- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Топогенез и секреция белков презентация
Содержание
- 1. Топогенез и секреция белков
- 2. План
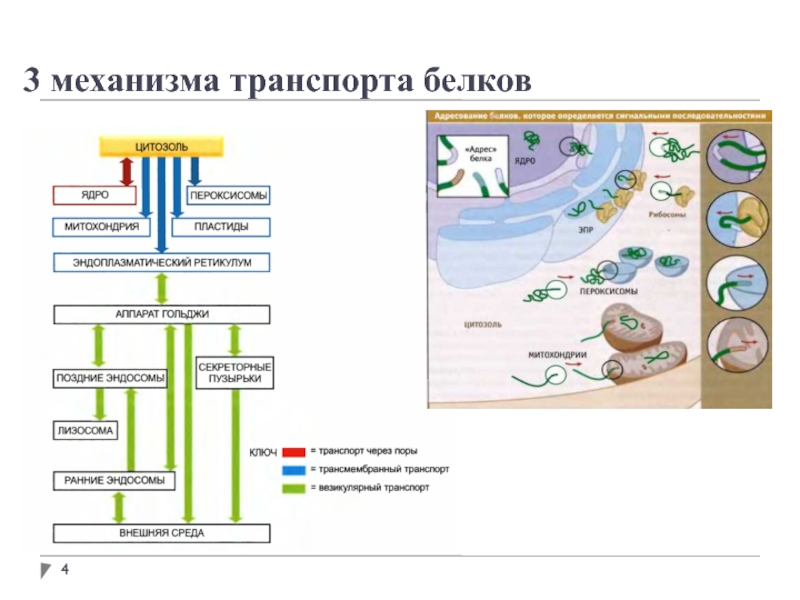
- 4. 3 механизма транспорта белков
- 5. Сигналы таргетинга в различные органеллы
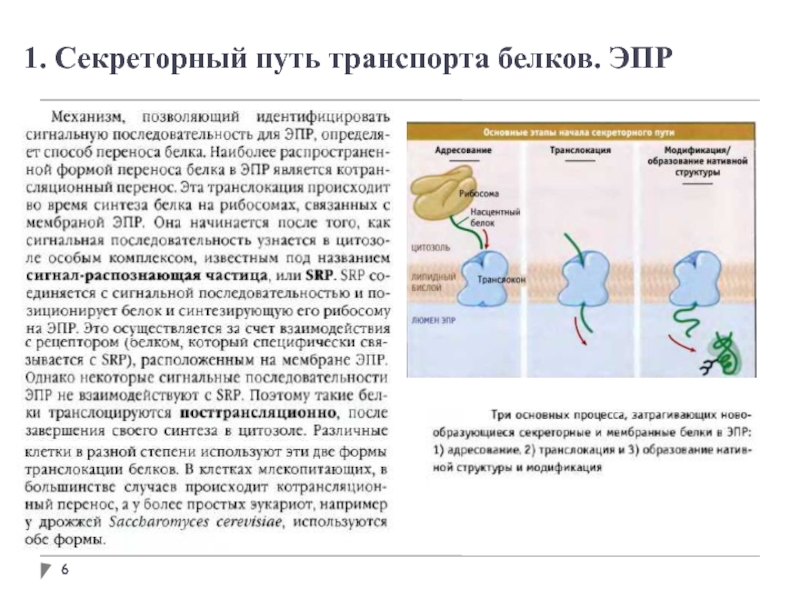
- 6. 1. Секреторный путь транспорта белков. ЭПР
- 29. 2. Везикулярный транспорт
- 30. 2. Везикулярный транспорт
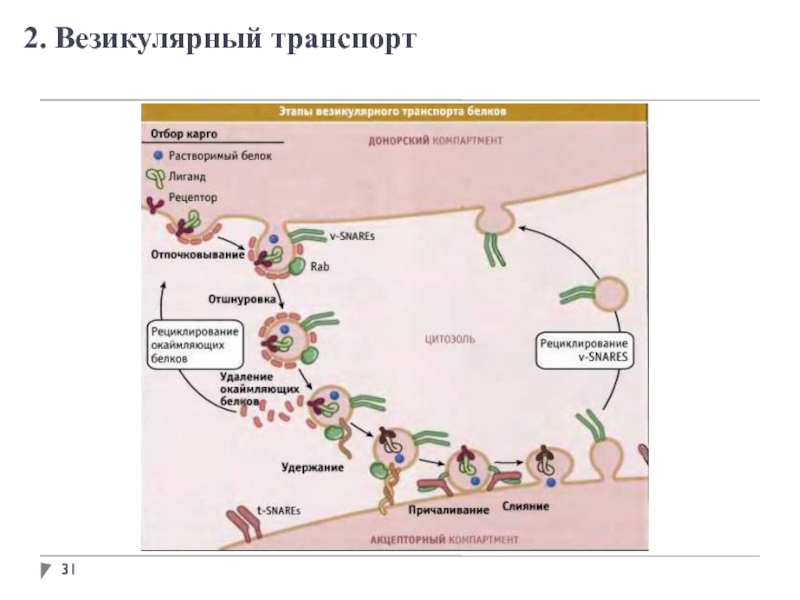
- 31. 2. Везикулярный транспорт
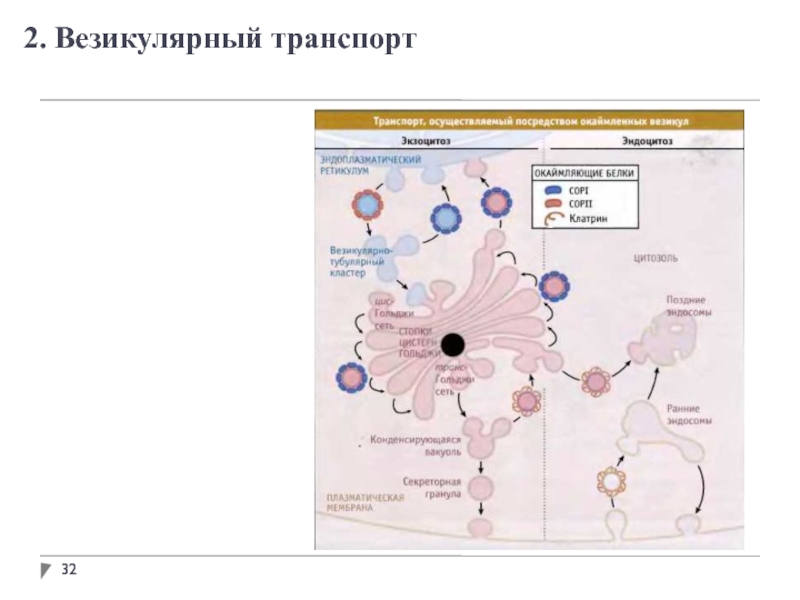
- 32. 2. Везикулярный транспорт
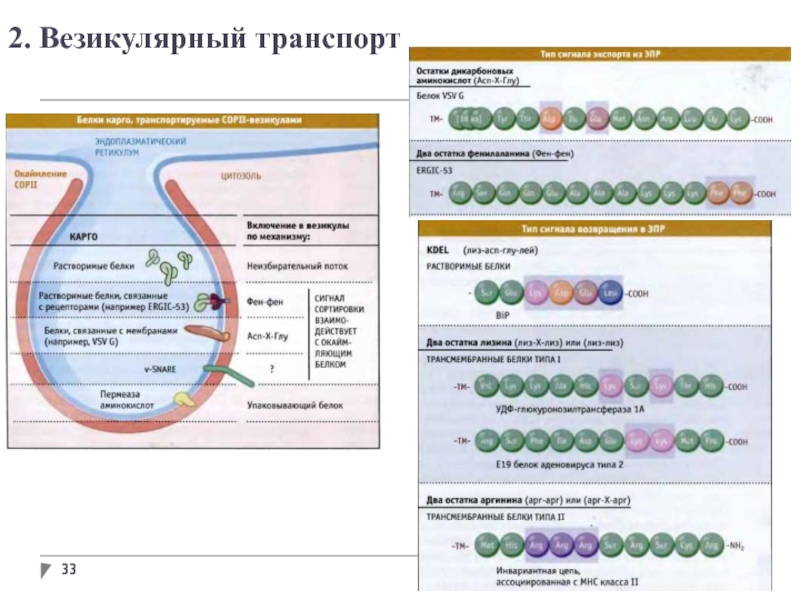
- 33. 2. Везикулярный транспорт
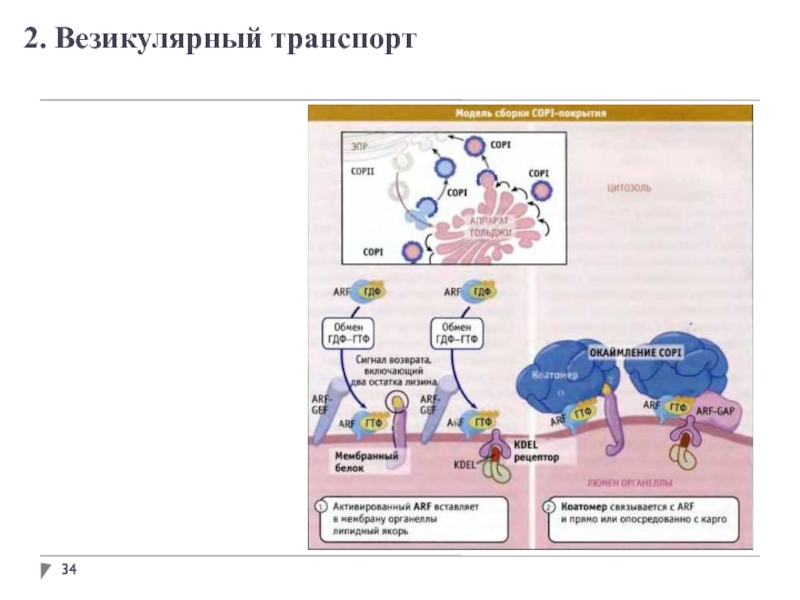
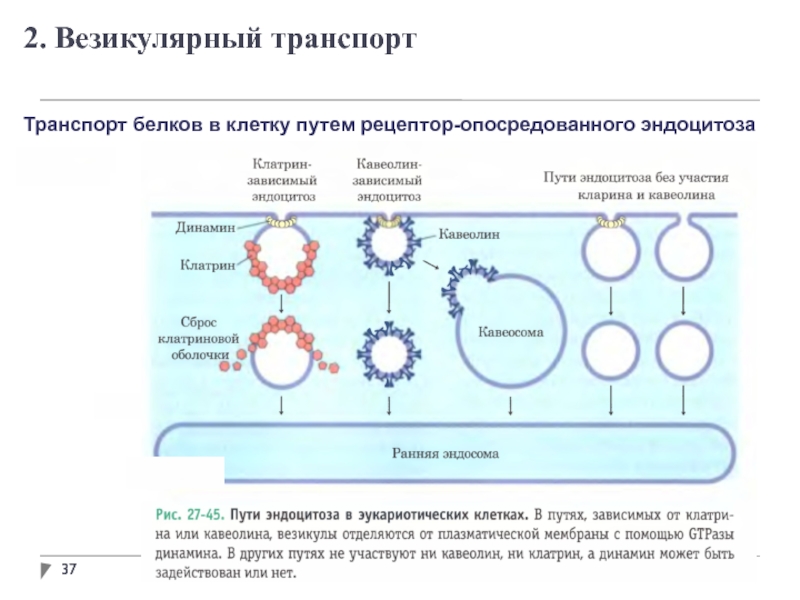
- 34. 2. Везикулярный транспорт
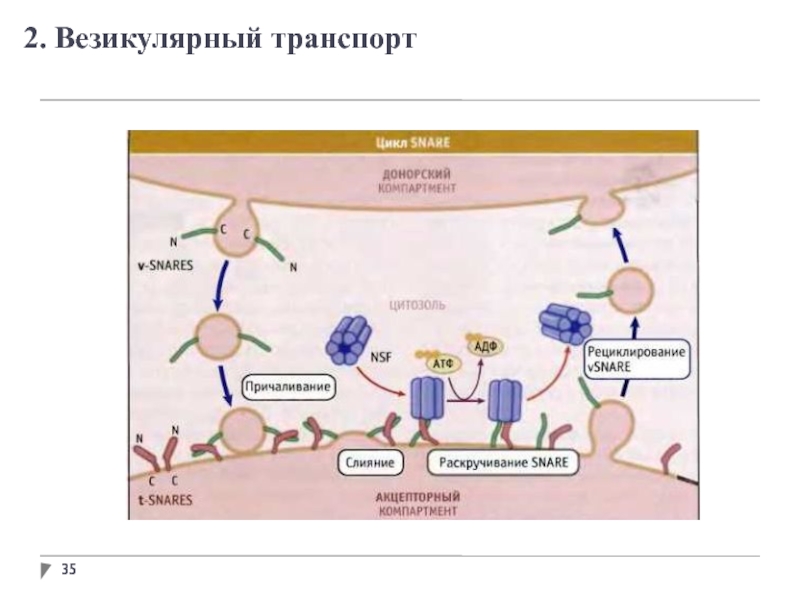
- 35. 2. Везикулярный транспорт
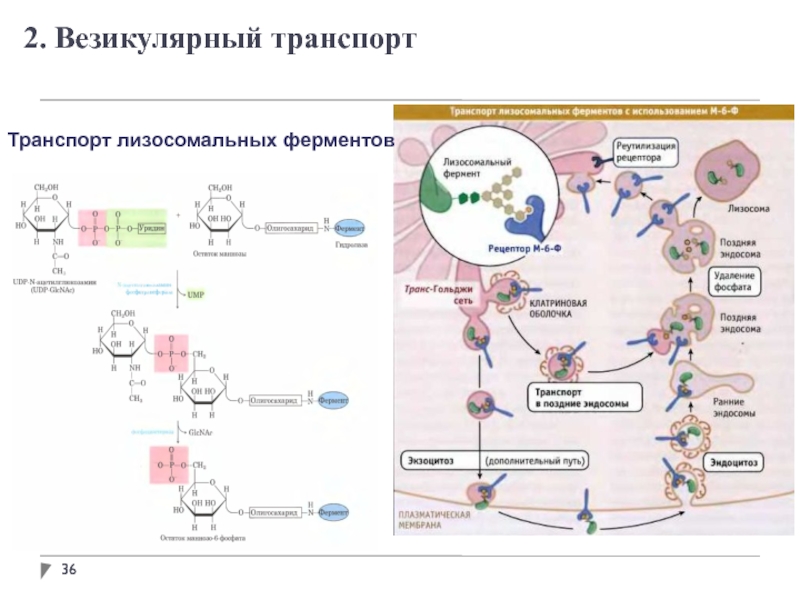
- 36. Транспорт лизосомальных ферментов 2. Везикулярный транспорт
Слайд 3
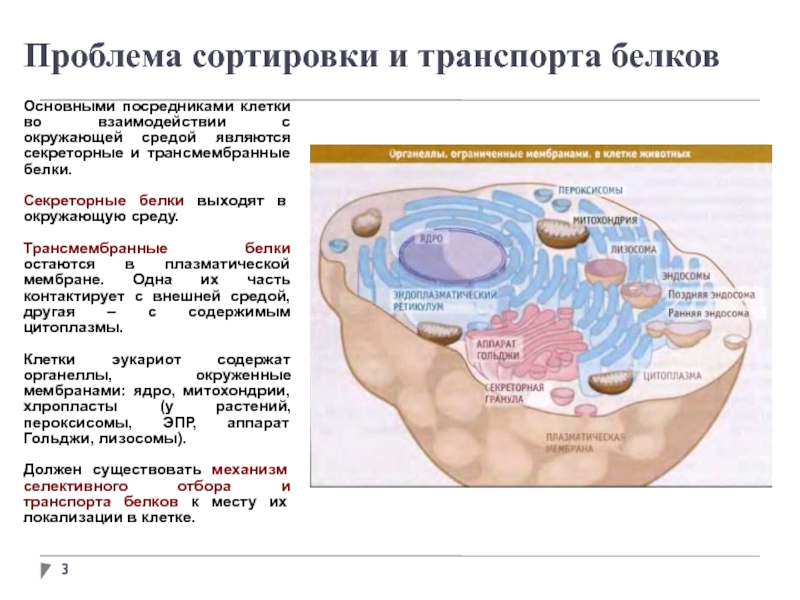
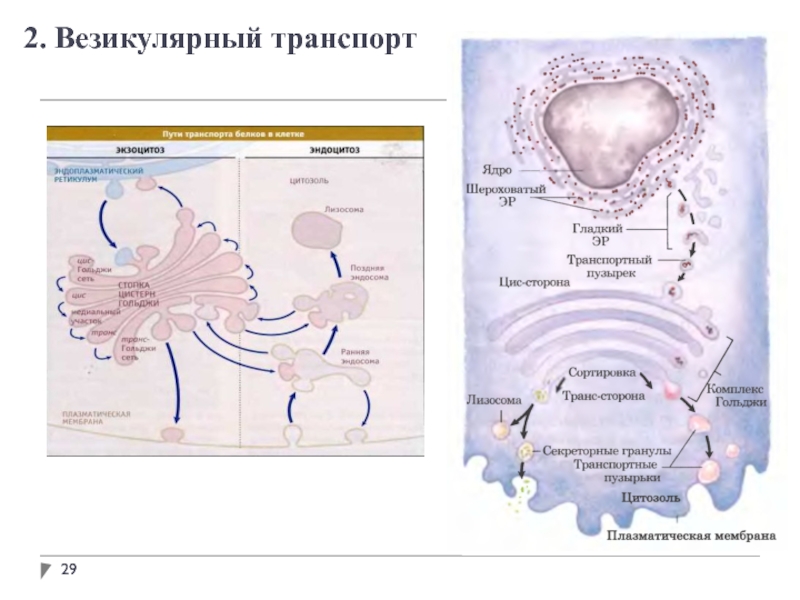
Проблема сортировки и транспорта белков
Основными посредниками клетки во взаимодействии с
окружающей средой являются секреторные и трансмембранные белки.
Секреторные белки выходят в окружающую среду.
Трансмембранные белки остаются в плазматической мембране. Одна их часть контактирует с внешней средой, другая – с содержимым цитоплазмы.
Клетки эукариот содержат органеллы, окруженные мембранами: ядро, митохондрии, хлропласты (у растений, пероксисомы, ЭПР, аппарат Гольджи, лизосомы).
Должен существовать механизм селективного отбора и транспорта белков к месту их локализации в клетке.
Секреторные белки выходят в окружающую среду.
Трансмембранные белки остаются в плазматической мембране. Одна их часть контактирует с внешней средой, другая – с содержимым цитоплазмы.
Клетки эукариот содержат органеллы, окруженные мембранами: ядро, митохондрии, хлропласты (у растений, пероксисомы, ЭПР, аппарат Гольджи, лизосомы).
Должен существовать механизм селективного отбора и транспорта белков к месту их локализации в клетке.
Слайд 8
лизосомные, мембранные и секретируемые белки
Длина 13-36 аминокислот
1. 10-15 гидрофобных аминокислот
2. один
или несколько положительно заряженных остатков, обычно между N-концом и гидрофобной последователностью
3. короткая сравнительно полярная последовательность на С-конце, содержащая аминокислоты с короткими боковыми цепями вблизи сайта расщепления
3. короткая сравнительно полярная последовательность на С-конце, содержащая аминокислоты с короткими боковыми цепями вблизи сайта расщепления
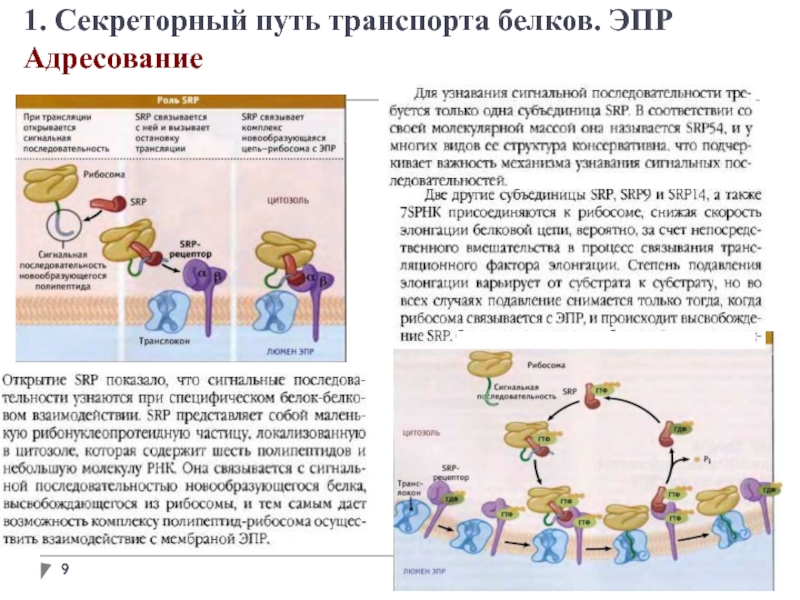
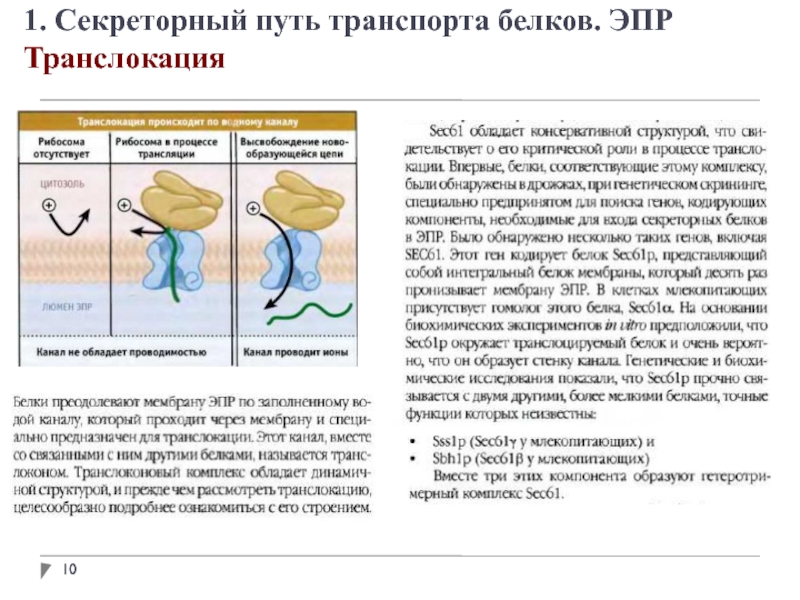
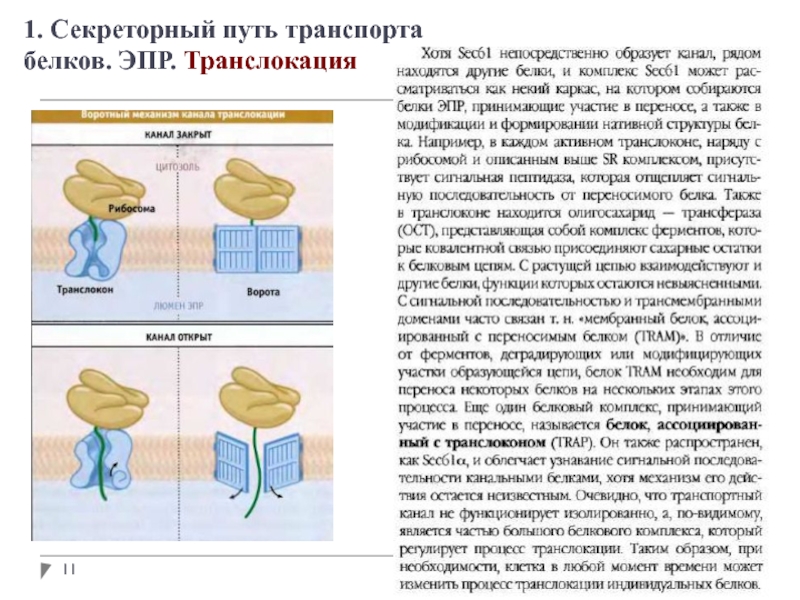
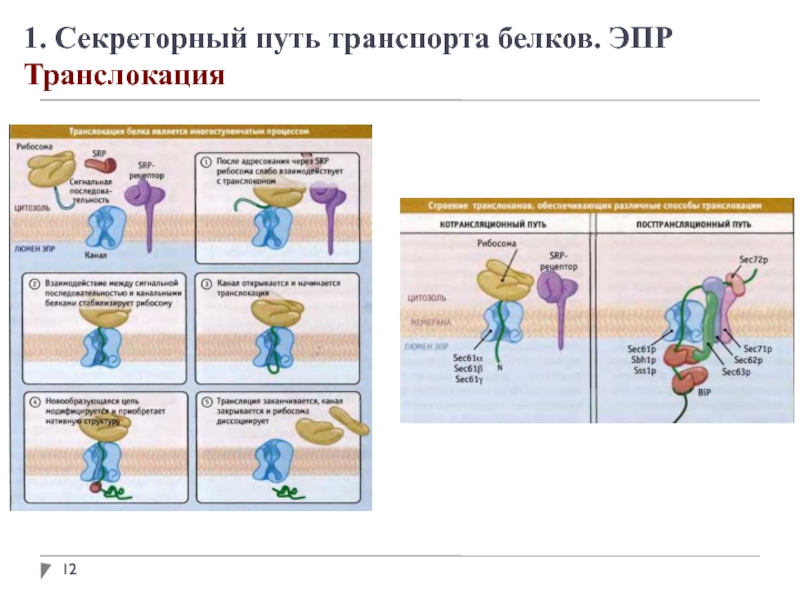
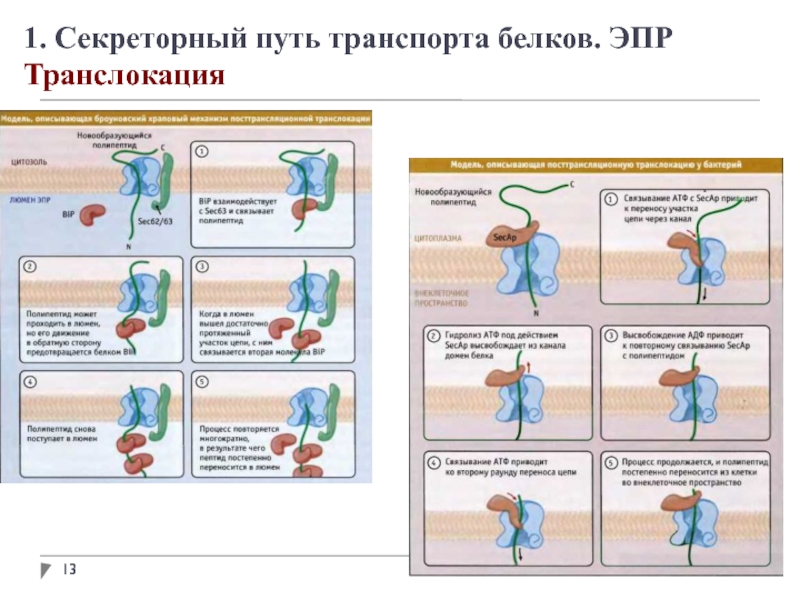
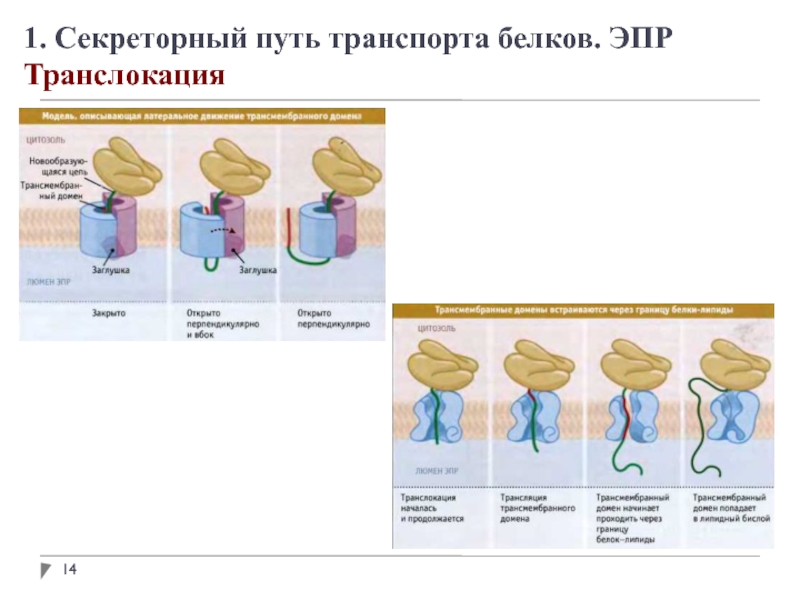
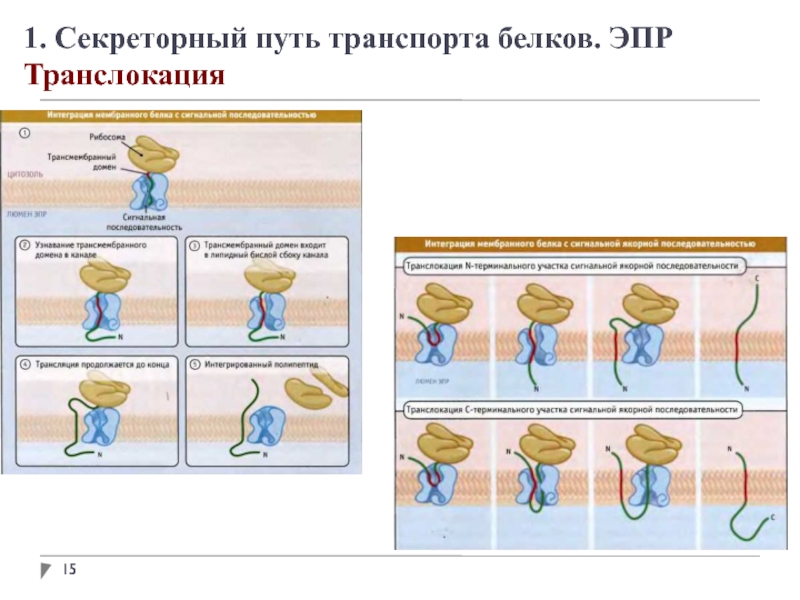
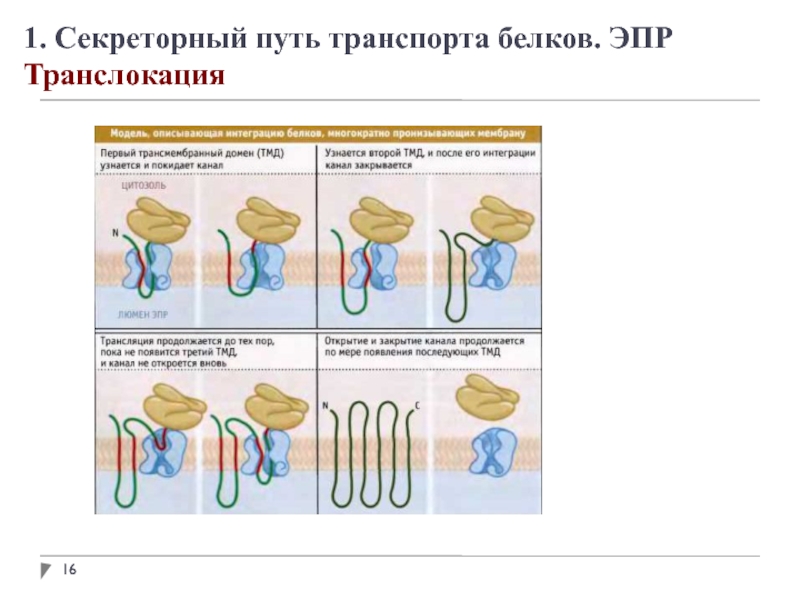
1. Секреторный путь транспорта белков. ЭПР
Адресование
Слайд 18
1. Секреторный путь транспорта белков. ЭПР
Модификация
Присоединение фосфолипида гликозилфосфатидилинозитола (ГФИ)
Слайд 19
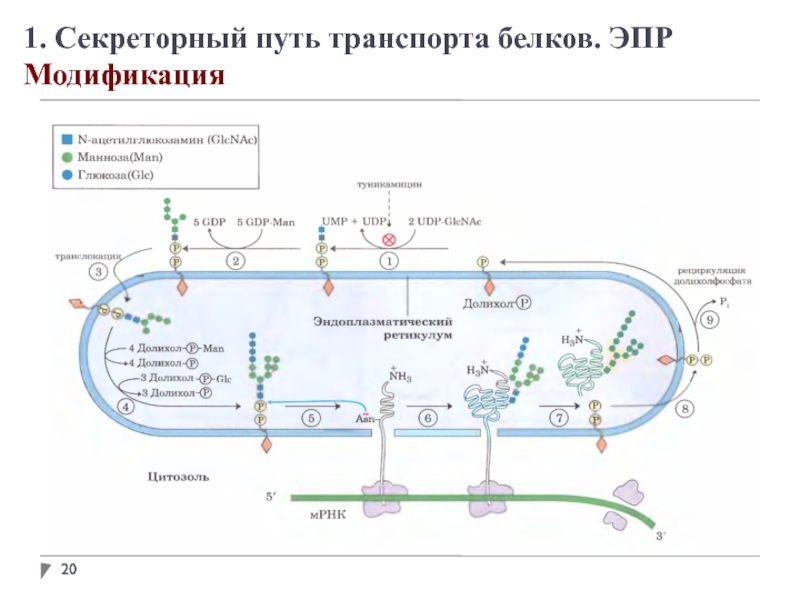
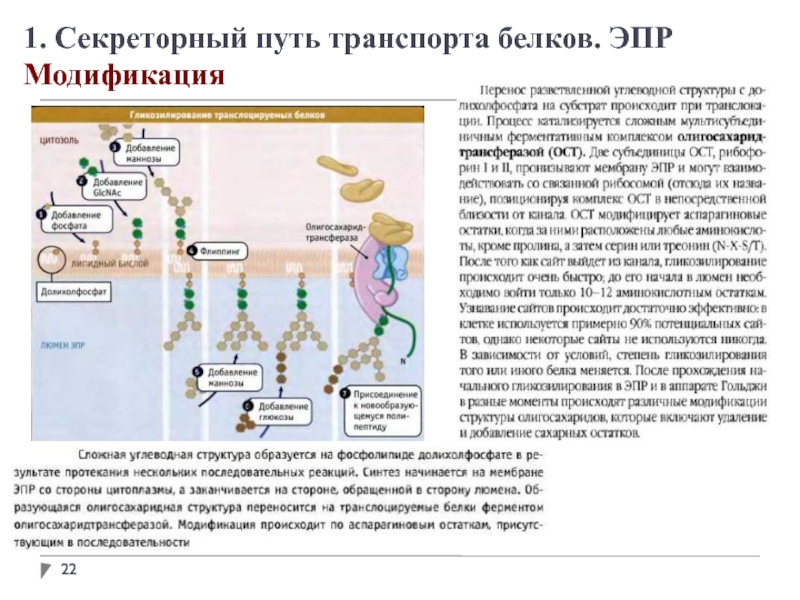
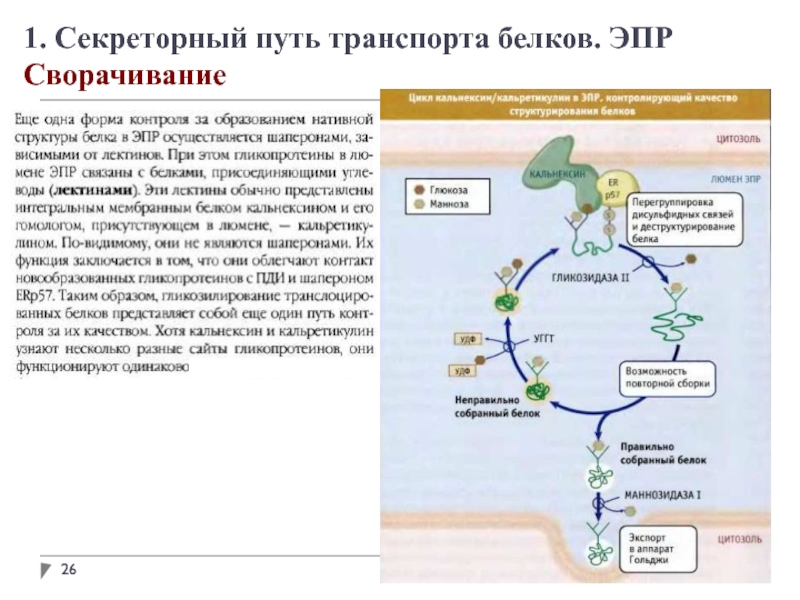
В просвете ЭПР вновь синтезированные белки модифицируются различным образом. После удаления
сигнальных последовательностей происходит укладка полипептидных цепей с возможным образованием дисульфидных связей. Многие белки гликозилируются с образованием гликопротеинов.
Во многих гликопротеинах связь с олигосахаридами осуществляется через остатки аспарагина. Такие N-связанные олигосахариды разнообразны.
Сначала синтезируется олигосахаридное ядро из 14 остатков, которое затем переносится от донорной молекулы долихолфосфата на остатки аспарагина в белке. Трансфераза находится на поверхности ЭПР, обращенной внутрь, поэтому не может катализировать гликозилирование белков в цитоплазме.
После переноса через мембрану олигосахариды в разных белках укорачиваются и модифицируются по-разному, но пентасахаридное ядро сохраняется во всех N-олигосахаридах.
Некоторые белки в ЭПР подвергаются О-гликозилированию, однако чаще О-гликозилирование осуществляется в комплексе Гольджи или в цитоплазме (для белков, не попадающих в ЭПР).
Во многих гликопротеинах связь с олигосахаридами осуществляется через остатки аспарагина. Такие N-связанные олигосахариды разнообразны.
Сначала синтезируется олигосахаридное ядро из 14 остатков, которое затем переносится от донорной молекулы долихолфосфата на остатки аспарагина в белке. Трансфераза находится на поверхности ЭПР, обращенной внутрь, поэтому не может катализировать гликозилирование белков в цитоплазме.
После переноса через мембрану олигосахариды в разных белках укорачиваются и модифицируются по-разному, но пентасахаридное ядро сохраняется во всех N-олигосахаридах.
Некоторые белки в ЭПР подвергаются О-гликозилированию, однако чаще О-гликозилирование осуществляется в комплексе Гольджи или в цитоплазме (для белков, не попадающих в ЭПР).
Гликозилирование белков в ЭПР
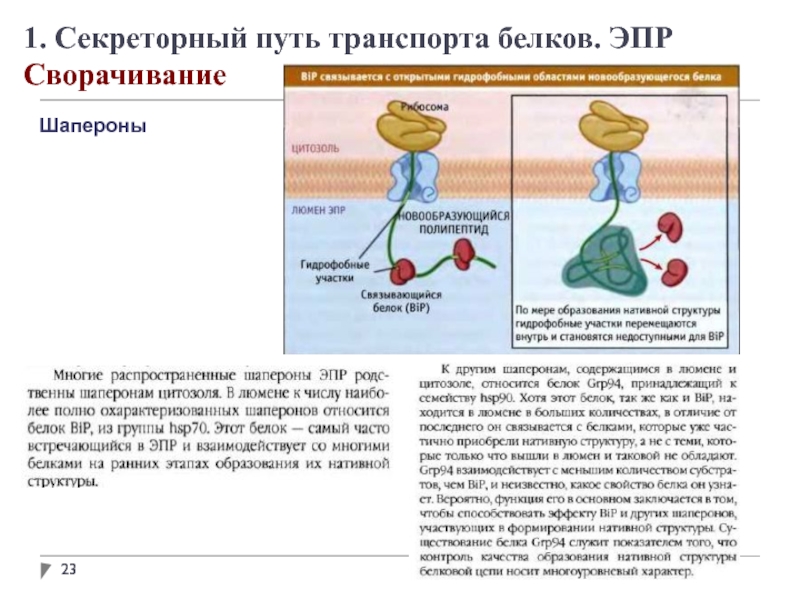
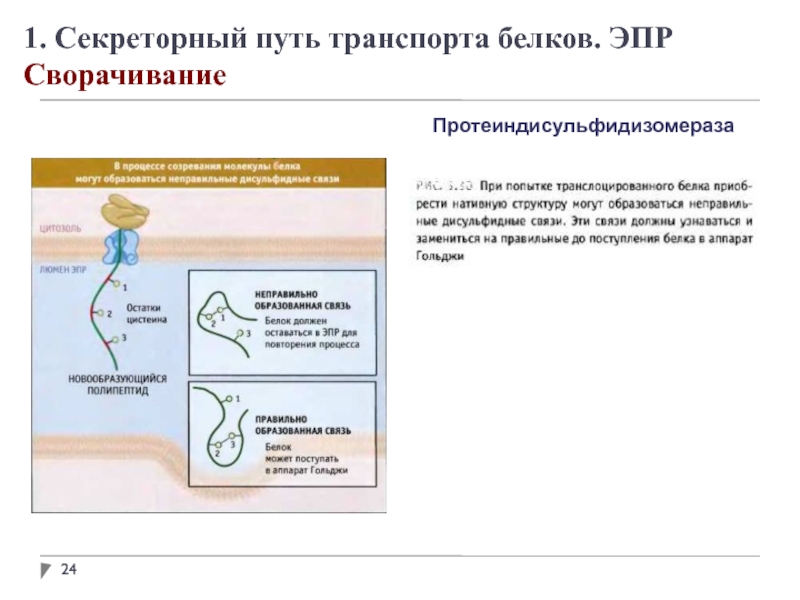
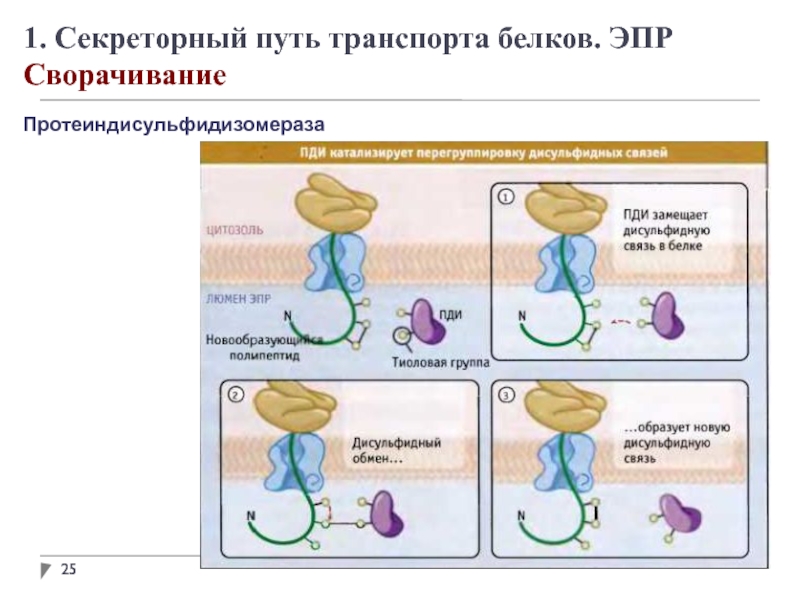
1. Секреторный путь транспорта белков. ЭПР
Модификация