- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Технология ферментационных процессов. Иммобилизованный ферменты. Иммобилизованные клетки в биотехнологии презентация
Содержание
- 1. Технология ферментационных процессов. Иммобилизованный ферменты. Иммобилизованные клетки в биотехнологии
- 2. Технология ферментационных процессов. Иммобилизованный ферменты. Иммобилизованные
- 3. Под иммобилизацией понимают такую процедуру, в результате
- 4. Первым иммобилизованным ферментом, примененным в промышленном масштабе,
- 5. Преимущества использования иммобилизованных ферментов: 1. Чистые препараты
- 6. Иммобилизованный (гетерогенный) катализатор легко отделить от реакционной
- 7. Иммобилизация фермента даёт возможность регулировать их каталитическую
- 8. Все существующие методы физической иммобилизации (т.е. иммобилизации,
- 9. 1) адсорбция на поверхности нерастворимого носителя; 2)
- 11. Основные требования, которым должны соответствовать носители: -
- 12. - Легкое перевода в реакционно-способную форму (активация):
- 13. В зависимости от природы носители делятся на:
- 14. К преимуществам природных носителей следует отнести:
- 15. Из природных аминосахаридов в качестве носителей для
- 16. Синтетические полимерные носители включают полимеры на основе
- 17. Носители неорганической природы представляют собой материалы изготовленные
- 18. При адсорбционной иммобилизации белковая молекула удерживается на
- 19. Эффективность адсорбции молекулы белка на носителе определяется
- 20. Иммобилизация ферментов путём включения в гель.
- 21. 1. Фермент вводят в водный раствор мономера,
- 22. Метод инкапсулирования разработан в 1974 г. и
- 23. Метод включения водных растворов ферментов в липосомы
- 24. Оставшуюся тонкую плёнку липидов выдерживают в водном
- 25. Химические методы иммобилизации ферментов. Представляют иммобилизацию
- 26. СПАСИБО ЗА ВНИМАНИЕ!
Слайд 2
Технология ферментационных процессов.
Иммобилизованный ферменты. Иммобилизованные клетки в биотехнологии.
Лекция № 9
Слайд 3Под иммобилизацией понимают такую процедуру, в результате которой молекула фермента тем
или иным способом прикрепляется к определенным объектам (носителей), нерастворимых в воде. Эти объекты вместе с ферментом легко отделяются от раствора после завершения реакции. Химическое «пришивание» фермента к носителю закрепляет конформацию фермента, и является причиной повышения устойчивости и снижения лабильности.
Слайд 4Первым иммобилизованным ферментом, примененным в промышленном масштабе, была аминоацилаза. Она была
использована в Японии в 1969 г. для производства аминокислот, добавляемых в корм животных. На мировом рынке эта продукция пользуется большим спросом.
Слайд 5Преимущества использования иммобилизованных ферментов: 1. Чистые препараты ферментов неустойчивы при длительном хранении. 2.
Многократное использование ферментов затруднено в промышленных условиях, т.к. их сложно отделить от реагентов.
Слайд 6Иммобилизованный (гетерогенный) катализатор легко отделить от реакционной среды. Это обусловливает: 1) возможность
остановки реакции в любой нужный момент:
2) повторное использование катализатора;
3) получение конечного продукта, не загрязнённого ферментом.
Слайд 7Иммобилизация фермента даёт возможность регулировать их каталитическую активность за счёт изменения
свойств носителя.
Иммобилизация представляет собой включение фермента в такую среду, в которой для него доступной оказывается лишь ограниченная часть общего объёма.
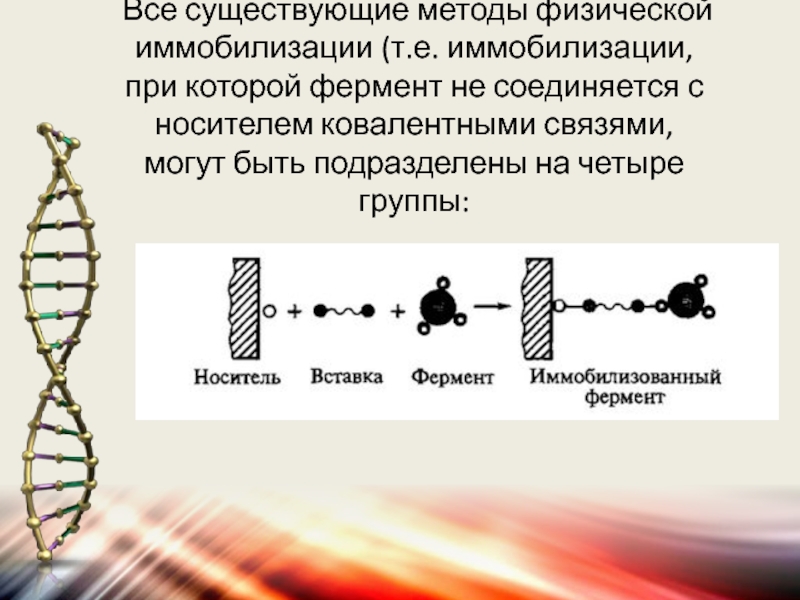
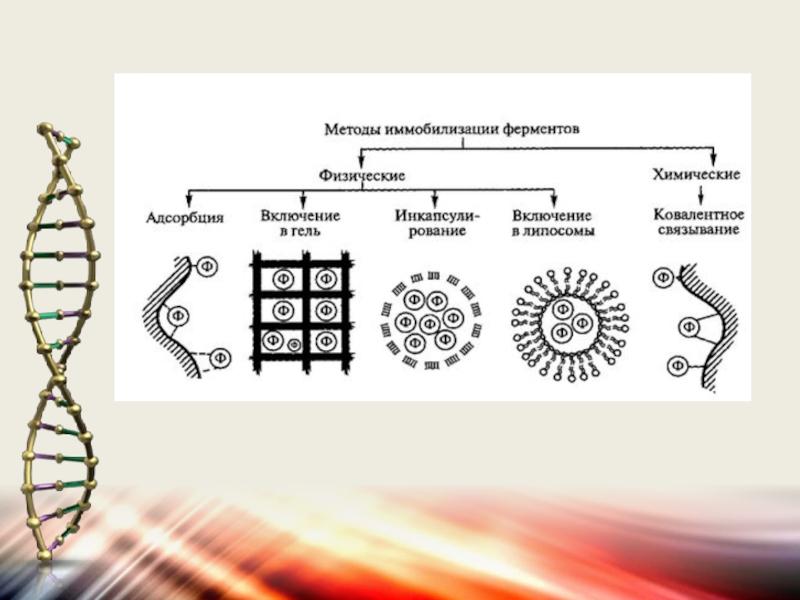
Слайд 8Все существующие методы физической иммобилизации (т.е. иммобилизации, при которой фермент не
соединяется с носителем ковалентными связями, могут быть подразделены на четыре группы:
Слайд 91) адсорбция на поверхности нерастворимого носителя; 2) включение в поры геля; 3) пространственное
разделение фермента от остальной части с помощью полупроницаемой мембраны;
4) введение фермента в двухфазную реакционную среду, в которой он растворим, но может находиться только в одной из фаз.
Слайд 11Основные требования, которым должны соответствовать носители:
- Высокая химическая и биологическая стойкость;
-
Высокая механическая прочность;
- Достаточная проницаемость для фермента и субстратов;
- Высокая пористость;
- Возможность получения в виде удобных в технологическом отношении форм (гранул, мембран, труб, листов и т.д.);
- Достаточная проницаемость для фермента и субстратов;
- Высокая пористость;
- Возможность получения в виде удобных в технологическом отношении форм (гранул, мембран, труб, листов и т.д.);
Слайд 12- Легкое перевода в реакционно-способную форму (активация):
- Высокая гидрофильность, которая обеспечивает
возможность проведения реакции связывания фермента с носителем в водной среде;
- Невысокая стоимость.
- Невысокая стоимость.
Слайд 13В зависимости от природы носители делятся на: 1. Органические материалы; 2. Неорганические материалы. Органические
полимерные носители можно разделить на 2 класса:
а) природные;
б) синтетические.
В свою очередь, каждый из классов органических полимерных носителей подразделяется на группы в зависимости от их строения. Среди природных полимеров выделяют: белковые; полисахаридные; липидные носители, а среди синтетических: полиметиленовые; полиамидные; полиэфирные носители.
а) природные;
б) синтетические.
В свою очередь, каждый из классов органических полимерных носителей подразделяется на группы в зависимости от их строения. Среди природных полимеров выделяют: белковые; полисахаридные; липидные носители, а среди синтетических: полиметиленовые; полиамидные; полиэфирные носители.
Слайд 14К преимуществам природных носителей следует отнести:
Доступность;
2. Полифункциональность;
3. Гидрофильность,
а к
недостаткам – высокую стоимость.
Из полисахаридов для иммобилизации наиболее часто используют: целлюлозу, декстран, агарозу и их производные. Для придания химической устойчивости их линейные цепи поперечно сшивают эпихлоргидрином. В полученные сетчатые структуры легко вводят различные ионогенные группировки.
Слайд 15Из природных аминосахаридов в качестве носителей для иммобилизации применяют хитин, который
в значительных количествах накапливается в виде отходов в процессе промышленной переработки крабов и креветок. Хитин химически стоек и имеет хорошо выраженную пористую структуру.
Среди белков практическое применение в качестве носителей нашли структурные протеины, такие как: кератин, фиброин, коллаген и продукт переработки коллагена – желатин.
Слайд 16Синтетические полимерные носители включают полимеры на основе стирола, акриловой кислоты, поливинилового
спирта, полиамидные и полиуретановые поли меры.
Их преимущество:
1. Механическая прочность;
2. Возможность варьирования в широких пределах величины пор и введения различных функциональных групп.
Синтетические полимеры воспроизведены в таких изделиях, как трубы, волокна, гранулы. Все эти свойства полезны для разных способов иммобилизации ферментов.
Их преимущество:
1. Механическая прочность;
2. Возможность варьирования в широких пределах величины пор и введения различных функциональных групп.
Синтетические полимеры воспроизведены в таких изделиях, как трубы, волокна, гранулы. Все эти свойства полезны для разных способов иммобилизации ферментов.
Слайд 17Носители неорганической природы представляют собой материалы изготовленные из стекла, глины, керамики,
графитовой сажи, а также оксиды металлов. Их можно подвергать химической модификации, для чего носители покрывают плёнкой оксидов алюминия, титана, циркония. Или обрабатывают органическими полимерами.
Преимущество неорганических носителей:
лёгкость регенерации.
Подобно синтетическим полимерам неорганическим носителям можно придать любую форму и получать их с любой степенью пористости.
лёгкость регенерации.
Подобно синтетическим полимерам неорганическим носителям можно придать любую форму и получать их с любой степенью пористости.
Слайд 18При адсорбционной иммобилизации белковая молекула удерживается на поверхности носителя за счёт
электростатических, гидрофобных, дисперсионных взаимодействий и водородных связей.
Слайд 19Эффективность адсорбции молекулы белка на носителе определяется пористостью носителя. Процесс адсорбции
ферментов на нерастворимых носителях отличается крайней простотой и достигается при контакте водного раствора фермента с носителем при перемешивании. С этой целью раствор фермента смешивают со свежим осадком, например, гидроксида титана, и высушивают в мягких условиях.
Слайд 20Иммобилизация ферментов путём включения в гель.
Способ иммобилизации ферментов путём включения
в трёхмерную структуру полимерного геля широко распространён благодаря своей простоте и уникальности. Метод применим для иммобилизации не только индивидуальных ферментов, но даже отдельных клеток. иммобилизацию ферментов в геле осуществляют двумя способами:
Слайд 211. Фермент вводят в водный раствор мономера, а затем проводят полимеризацию,
в результате которой возникает пространственная структура полимерного геля с включёнными в его ячейки молекулами фермента.
2. Фермент вносят в раствор уже готового полимера, который впоследствии переводят в гелеобразное состояние.
Для первого варианта используют гели: полиакриламида, поливинилового спирта, силикагеля. Для второго: гели крахмала, агар-агара, агарозы, фосфата кальция.
Слайд 22Метод инкапсулирования разработан в 1974 г. и состоит в том, что
водный раствор фермента включается внутрь замкнутой микрокапсулы, стенки которой образованы полупроницаемым полимером. Один из механизмов возникновения мембраны на поверхности водных микрокапсул фермента заключается в реакции межфазной поликонсистенции двух соединений, одно из которых растворено с водой, а другое – в органической фазе.
Размер получаемых капсул составляет сотни микрометров, а толщина мембраны - сотые доли микрометра.
Слайд 23Метод включения водных растворов ферментов в липосомы
Впервые данный метод был применён
для иммобилизации ферментов Дж. Вайсманом и Дж. Сессом в 1970 году. Для получения липосом из растворов липида (чаще всего лецитина) упаривают органический растворитель.
Слайд 24Оставшуюся тонкую плёнку липидов выдерживают в водном растворе, содержащем фермент. В
процессе выдержки происходит самосборка липидных структур липосомы, содержащих данный раствор фермента.
Ферменты, иммобилизованные путём включения в структуру липосом, используют преимущественно в медицинских и биотехнологических целях.
Слайд 25Химические методы иммобилизации ферментов.
Представляют иммобилизацию ферментов путём образования новых ковалентных
связей между ферментом и носителем – наиболее массовый способ получения промышленных биокатализаторов.
В отличие от физических вариантов, эти методы иммобилизации обеспечивают прочную и необратимую связь фермента с носителем и сопровождаются стабилизацией молекулы энзима.