- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Структурно-функциональные основы протеомики. Вторичная структура и другие презентация
Содержание
- 1. Структурно-функциональные основы протеомики. Вторичная структура и другие
- 2. План лекции Вторичная структура Третичная структура Четвертичная структура
- 3. Вторичная структура
- 4. Что можно увидеть на картах электронной плотности
- 5. Элементы пространственной организации белков α-спираль β-слой
- 6. α-спираль Л.К. Полинг, Р.Б. Кори 1951 г.
- 7. β-слои и другие типы вторичной структуры β-листы
- 8. Полипролиновые спирали коллаген Полипролиновые спирали не содержат
- 9. Коллаген Преобладают пролин, гидроксипролин, глицин. Тропоколлаген сод.
- 10. Распространенность вторичных структур в белках В типичном
- 11. Карты Рамачандрана Общая карта Рамачандрана не очень
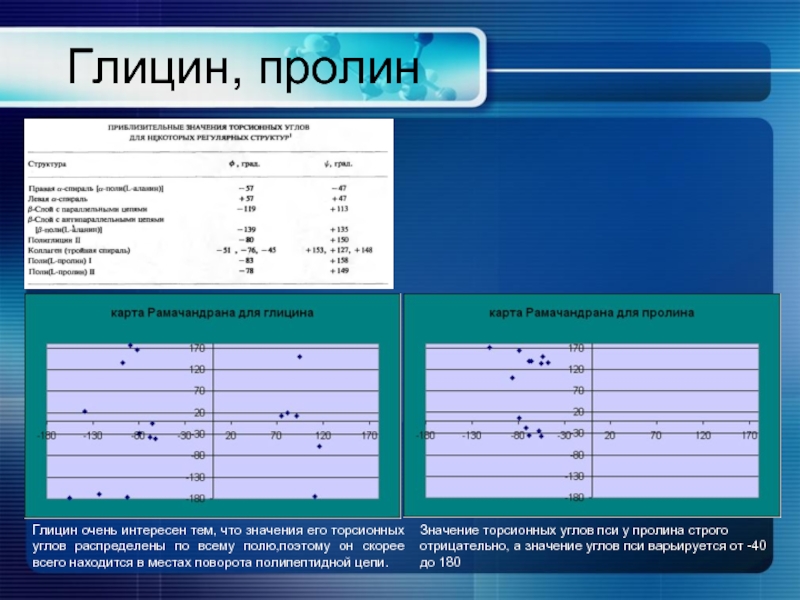
- 12. Глицин, пролин Глицин очень интересен тем, что
- 13. Третичная структура
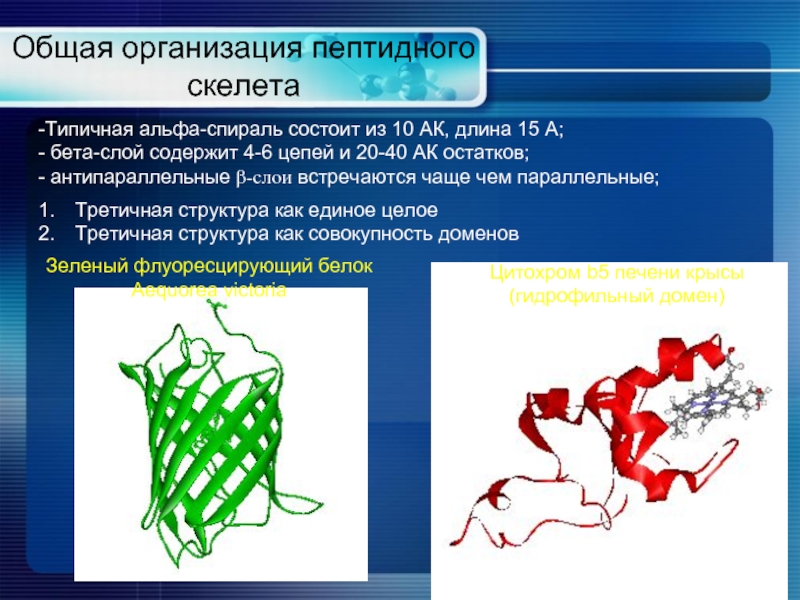
- 14. Общая организация пептидного скелета Типичная альфа-спираль состоит
- 15. Окружение отдельных остатков Конформации отдельных пептидных групп
- 16. Плотность упаковки АК остатков в свернутых молекулах
- 17. Объем и плотность белков Σ вандерваальсовых объемов
- 18. Динамичность третичной структуры Методы изучения динамики –
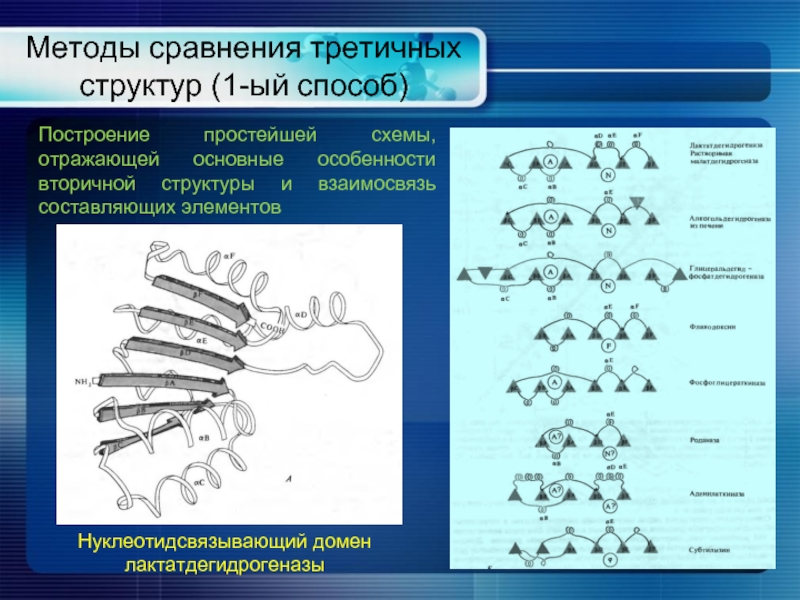
- 19. Методы сравнения третичных структур (1-ый способ) Нуклеотидсвязывающий
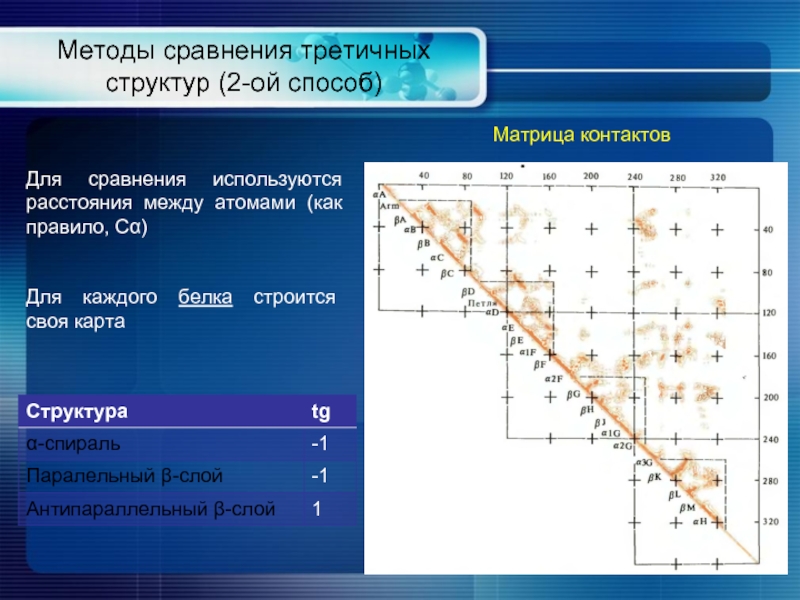
- 20. Методы сравнения третичных структур (2-ой способ) Матрица
- 21. Парадокс Левинталя 1968 г., Сайрус Левинталь «Промежуток
- 22. Четвертичная структура
- 23. Четвертичная структура Третичная структура Четвертичная структура
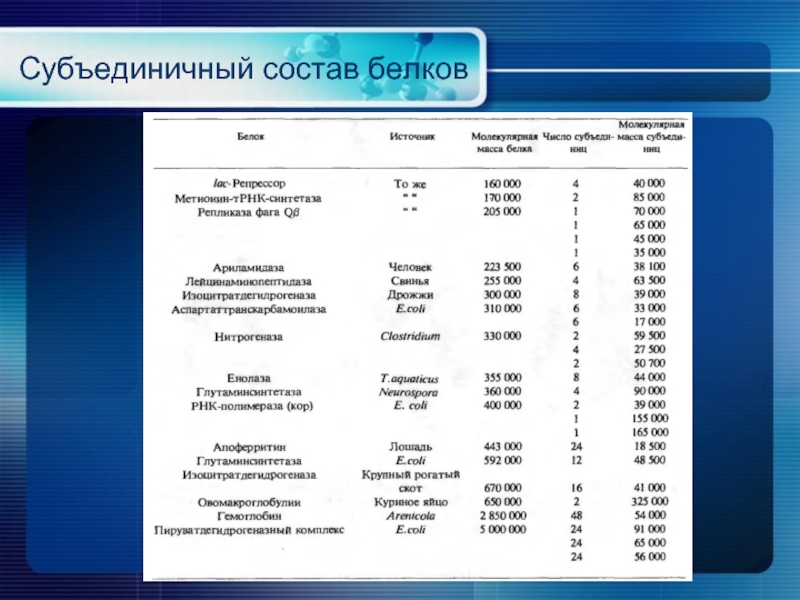
- 24. Субъединичный состав белков
- 25. Субъединичный состав белков
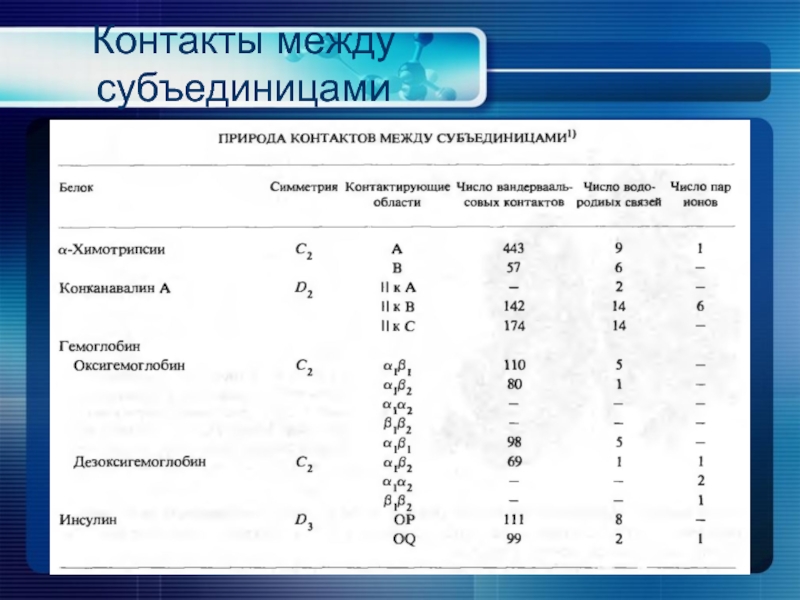
- 26. Контакты между субъединицами
- 27. Заключение Белки – АК, металлы, простетические группы,
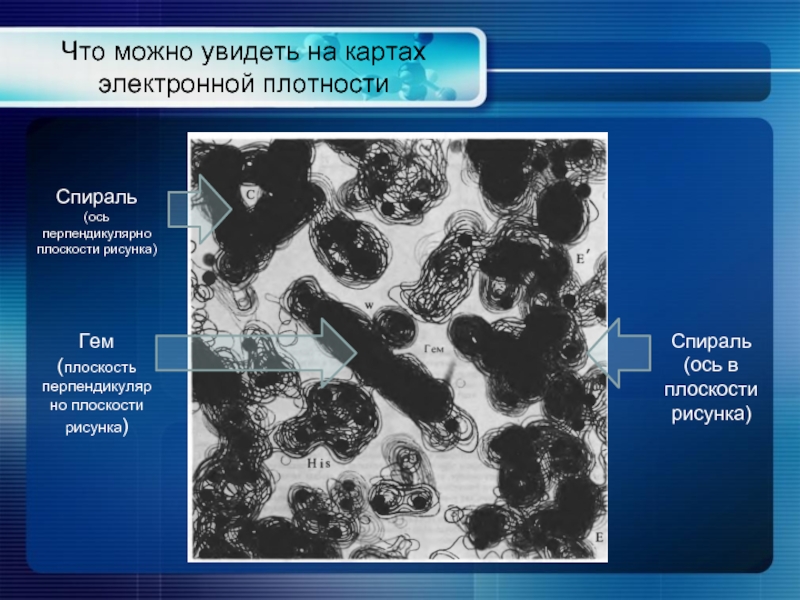
Слайд 4Что можно увидеть на картах электронной плотности
Спираль
(ось перпендикулярно плоскости рисунка)
Спираль
(ось в
Гем
(плоскость перпендикулярно плоскости рисунка)
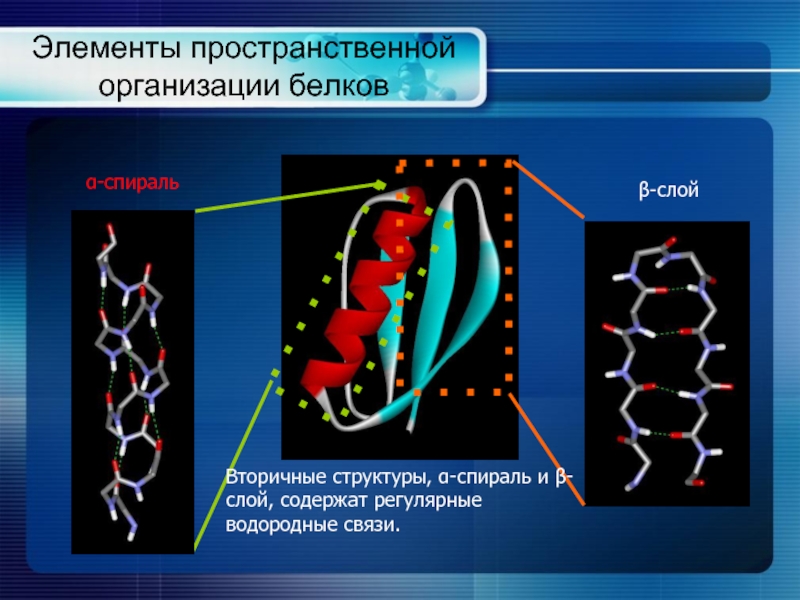
Слайд 5Элементы пространственной организации белков
α-спираль
β-слой
Вторичные структуры, α-спираль и β-слой, содержат регулярные водородные
Слайд 6α-спираль
Л.К. Полинг, Р.Б. Кори
1951 г.
Классическая альфа-спираль Полинга-Кори-Брэнсона
Альфа-спираль (α-спираль) — типичный элемент вторичной
Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушает α-спирали.
Роль АК в образовании спирали
Слайд 7β-слои и другие типы вторичной структуры
β-листы (складчатые слои) — несколько зигзагообразных полипептидных
π-спирали;
310-спирали;
неупорядоченные фрагменты.
Слайд 8Полипролиновые спирали
коллаген
Полипролиновые спирали не содержат водородных связей в цепи:
Полипролин I –
10 остатков на 3 витка
Полипролин II – левая спираль, пептидные связи в транс-положении
3 остатка на виток, смещение вдоль оси 3,12 А на остаток
Существует в водных растворах
Стабилизирована стерическими ограничениями
Вторичная структура встречается редко, в семействе коллагенов
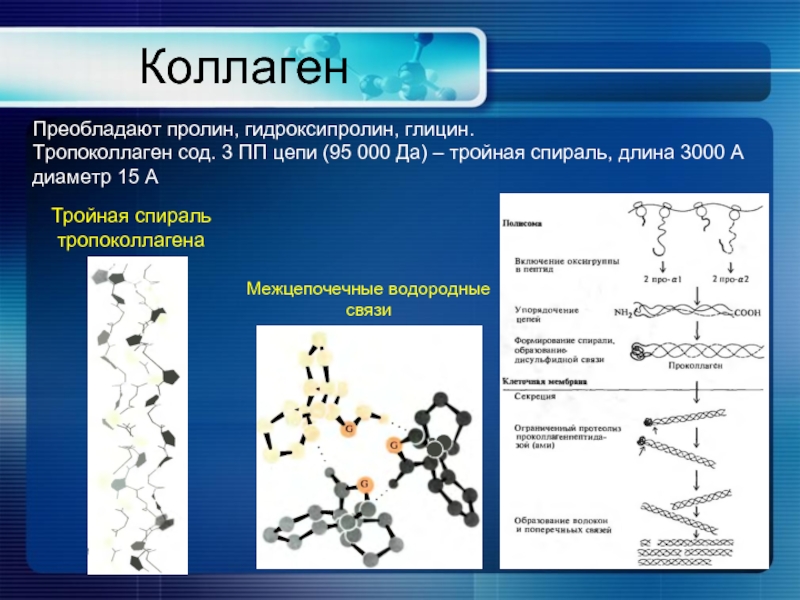
Слайд 9Коллаген
Преобладают пролин, гидроксипролин, глицин.
Тропоколлаген сод. 3 ПП цепи (95 000 Да)
Межцепочечные водородные связи
Тройная спираль тропоколлагена
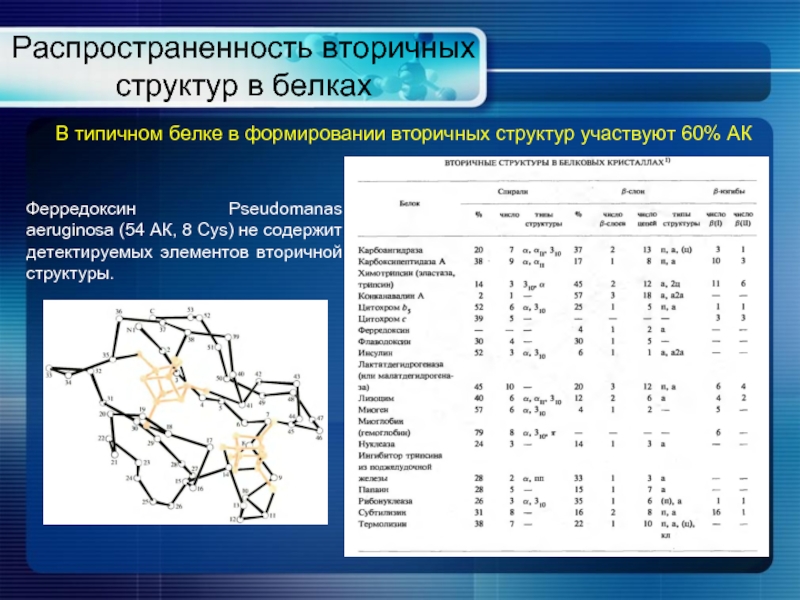
Слайд 10Распространенность вторичных структур в белках
В типичном белке в формировании вторичных структур
Ферредоксин Pseudomanas aeruginosa (54 АК, 8 Сys) не содержит детектируемых элементов вторичной структуры.
Слайд 11Карты Рамачандрана
Общая карта Рамачандрана не очень отличается от такой же, только
Карта Рамачандрана для бета-структур довольна мала, отчасти из-за небольших размеров исследуемых тяжей. Но она очень интересна тем, что значения расположенны предельно скученно во второй четверти координатной плоскости.Т.е. для бета тяжей характерно отрицательное значение углов пси и положительное значение углов фи.
Слайд 12Глицин, пролин
Глицин очень интересен тем, что значения его торсионных углов распределены
Значение торсионных углов пси у пролина строго отрицательно, а значение углов пси варьируется от -40 до 180
Слайд 14Общая организация пептидного скелета
Типичная альфа-спираль состоит из 10 АК, длина 15
бета-слой содержит 4-6 цепей и 20-40 АК остатков;
антипараллельные β-слои встречаются чаще чем параллельные;
Третичная структура как единое целое
Третичная структура как совокупность доменов
Цитохром b5 печени крысы
(гидрофильный домен)
Зеленый флуоресцирующий белок
Aequorea victoria
Слайд 15Окружение отдельных остатков
Конформации отдельных пептидных групп лежат в областях наибольшей стабильности;
Заряженные
Гидрофобные неполярные остатки располагаются внутри третичной структуры глобулярного водорастворимого белка;
Все доноры и акцепторы водородных связей находятся там, где они могут образовывать эти связи;
Полярные и неполярные боковые группы АК могут располагаться периодически если α-спираль располагается вблизи поверхности;
Остатки пролина ограничивают α-спираль.
Слайд 16Плотность упаковки АК остатков в свернутых молекулах белка
Большинство белков – плотные
Плотность упаковки белковой молекулы -
*Возможно «рыхлое» расположение атомов вблизи активного центра молекулы –
большая гибкость
Слайд 17Объем и плотность белков
Σ вандерваальсовых объемов всех атомов на 10% больше
Электрострикционный эффект (16 А3 на заряженную группу)
Внешние области белка имеют большую плотность чем внутренние
Внутри белка находится больше воды, чем детектируется по результатам рентгеноструктурного анализа.
Зависимость средней плотности сферического слоя от радиуса этого слоя для нескольких белков
Объем молекул белка рассчитанный как сумма вандерваальсовых объемов отдельных атомов
Слайд 18Динамичность третичной структуры
Методы изучения динамики – поляризованная флуоресценция, ЯМР С13, МД
Оценка
На поверхности
молекулы
Внутри молекулы
Недоступны
Малоподвижны
Доступны
Подвижны
В активном центре
молекулы
Ограниченно доступны
Ограниченно подвижны
Слайд 19Методы сравнения третичных структур (1-ый способ)
Нуклеотидсвязывающий домен
лактатдегидрогеназы
Построение простейшей схемы, отражающей основные
Слайд 20Методы сравнения третичных структур (2-ой способ)
Матрица контактов
Для сравнения используются расстояния между
Для каждого белка строится своя карта
Слайд 21Парадокс Левинталя
1968 г., Сайрус Левинталь
«Промежуток времени, за который полипептид приходит к
Причины парадокса:
теоретические модели, используемые для доказательства твердости не соответствуют тому, что природа старается оптимизировать;
в ходе эволюции были отобраны только те белки, которые легко сворачиваются;
белки могут сворачиваться разными путями, не обязательно следуя глобально оптимальному пути.
«Как белок выбирает свою нативную структуру среди бесчисленного множества возможных?». Для цепи из 100 остатков число возможных конформаций ~10100 , и их полный перебор занял бы ~1080 лет, если один переход осуществлять за ~10−13 секунды. Поэтому сложность проблемы заключается в том, что данный вопрос нельзя решить экспериментально, так как придется ждать ~1080 лет.
Слайд 27Заключение
Белки – АК, металлы, простетические группы, сахара.
Существует корреляция между составом, структурой
В белках с большим содержанием пролина формируются спирали полипролинового типа.
Третичные структуры организованы в плотно упакованные глобулы или несколько плотноупакованных доменов.
Четвертичные структуры делят на 2 типа – с глобулярныи и спиральным расположением субъединиц.