Розробка:
Бондарчук Тетяна
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Структура і функції білків. Ферменти. Вітаміни, гормони, фактори росту, їх роль у життєдіяльності організмів презентация
Содержание
- 1. Структура і функції білків. Ферменти. Вітаміни, гормони, фактори росту, їх роль у життєдіяльності організмів
- 2. МОЛЕКУЛЯРНА БІОЛОГІЯ – вивчає білки та
- 3. МОЛЕКУЛЯРНА БІОЛОГІЯ – вивчає білки та
- 4. МОЛЕКУЛЯРНА БІОЛОГІЯ – вивчає білки та
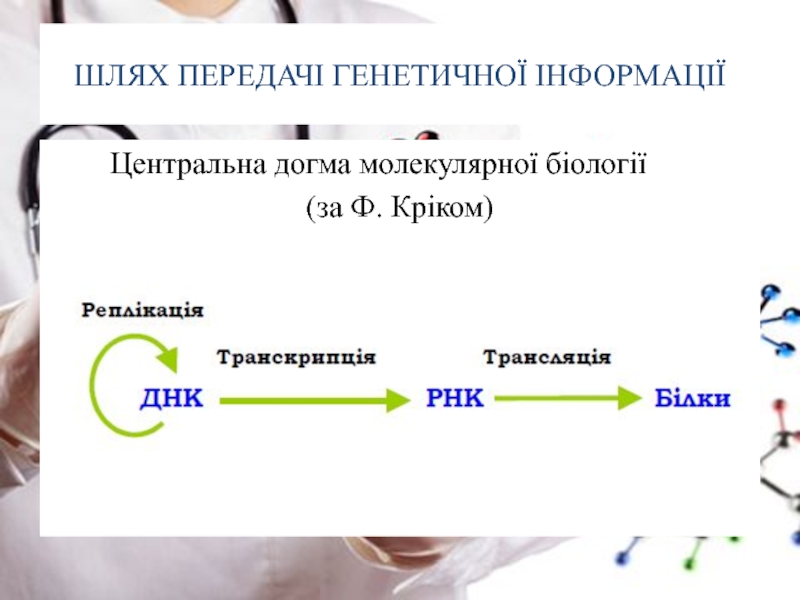
- 5. ШЛЯХ ПЕРЕДАЧІ ГЕНЕТИЧНОЇ ІНФОРМАЦІЇ
- 6. БІООРГАНІЧНІ МОЛЕКУЛИ Нуклеїнові кислоти (ДНК, різні типи РНК) Білки
- 7. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ
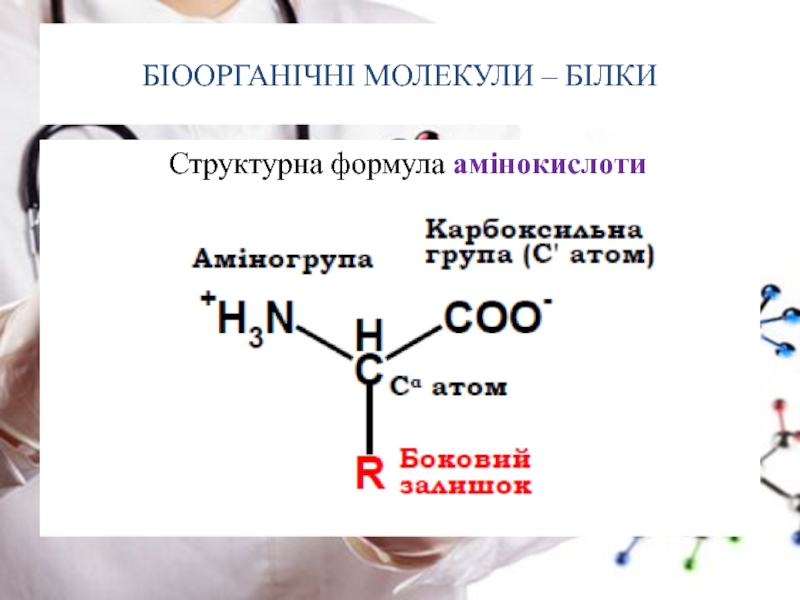
- 8. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ Структурна
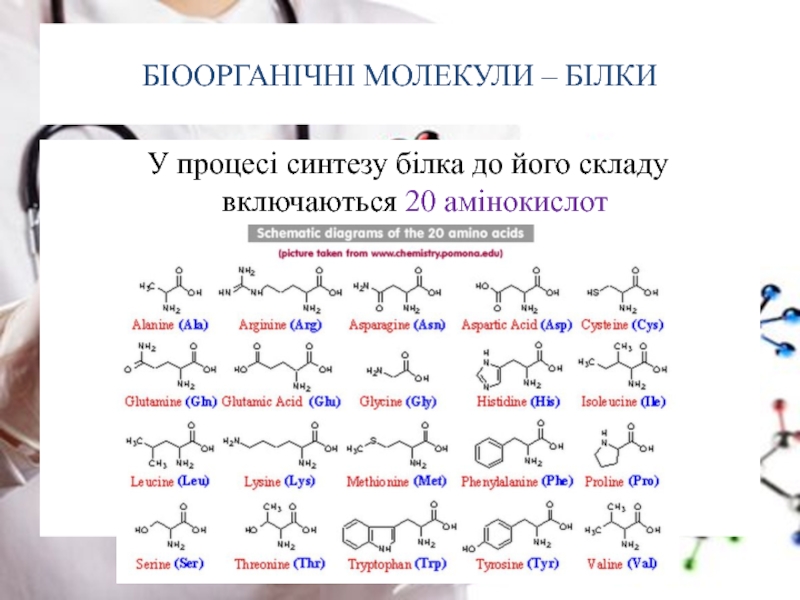
- 9. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ У
- 10. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ
- 11. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ
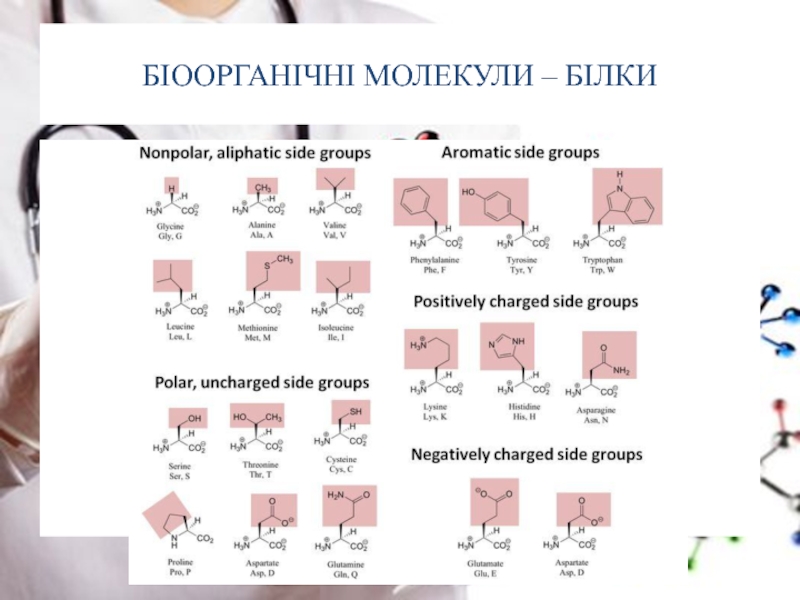
- 12. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ У
- 13. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ
- 14. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ
- 15. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ
- 16. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ Утворення
- 17. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ Утворення
- 18. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ Сполуки,
- 19. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ До
- 20. РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ Первинна структура
- 21. РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ Вторинна структура
- 22. РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ Вторинна структура
- 23. РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ Вторинна структура
- 24. РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ Вторинна структура
- 25. РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ Третинна структура
- 26. РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ Четвертинна структура
- 27. РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ
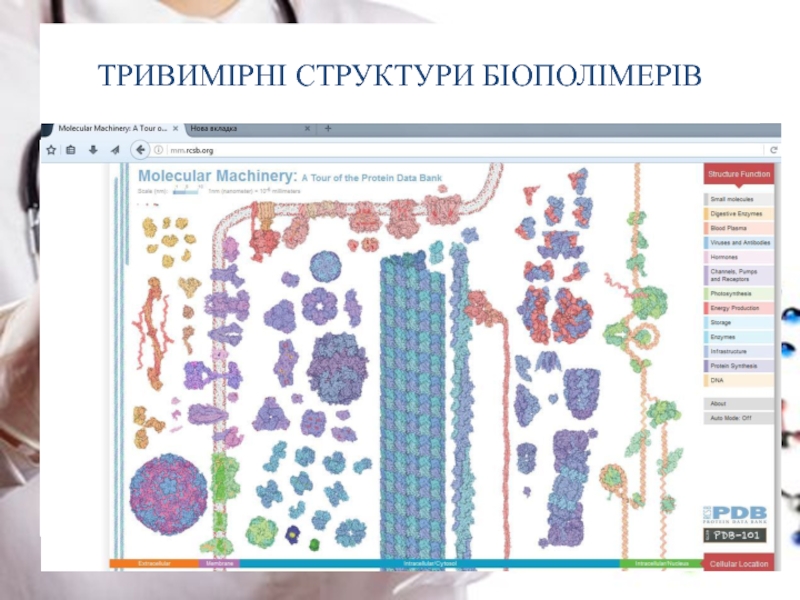
- 28. ТРИВИМІРНІ СТРУКТУРИ БІОПОЛІМЕРІВ
- 29. БІЛКИ Якщо поліпептидні ланцюги лежать у
- 30. ДЕНАТУРАЦІЯ ТА РЕНАТУРАЦІЯ БІЛКА Починаючи зі
- 31. БІОФУНКЦІЇ БІЛКІВ
- 32. БІОФУНКЦІЇ БІЛКІВ
- 33. БІОФУНКЦІЇ БІЛКІВ
- 34. ФЕРМЕНТИ – БІОКАТАЛІЗАТОРИ
- 35. ФЕРМЕНТИ – БІОКАТАЛІЗАТОРИ Ферментативні реакції
- 36. ФЕРМЕНТИ – БІОКАТАЛІЗАТОРИ
- 37. ФЕРМЕНТИ – БІОКАТАЛІЗАТОРИ
- 38. ФЕРМЕНТИ – БІОКАТАЛІЗАТОРИ
- 39. ФЕРМЕНТИ – БІОКАТАЛІЗАТОРИ
- 40. ВЛАСТИВОСТІ ФЕРМЕНТІВ
- 41. МЕХАНІЗМ ДІЇ ФЕРМЕНТІВ
- 42. МЕХАНІЗМ ДІЇ ФЕРМЕНТІВ
- 43. МЕХАНІЗМ ДІЇ ФЕРМЕНТІВ
- 44. МЕХАНІЗМ ДІЇ ФЕРМЕНТІВ
- 45. ВИКОРИСТАННЯ ФЕРМЕНТІВ
- 46. ВІТАМІНИ
- 47. ВІТАМІНИ
- 48. ВІТАМІНИ
- 49. ВІТАМІНИ
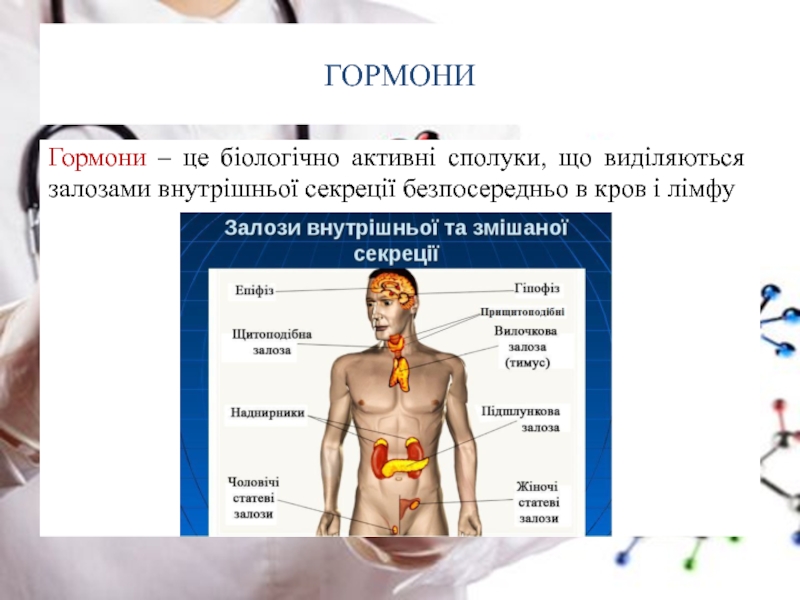
- 50. ГОРМОНИ
- 51. ГОРМОНИ
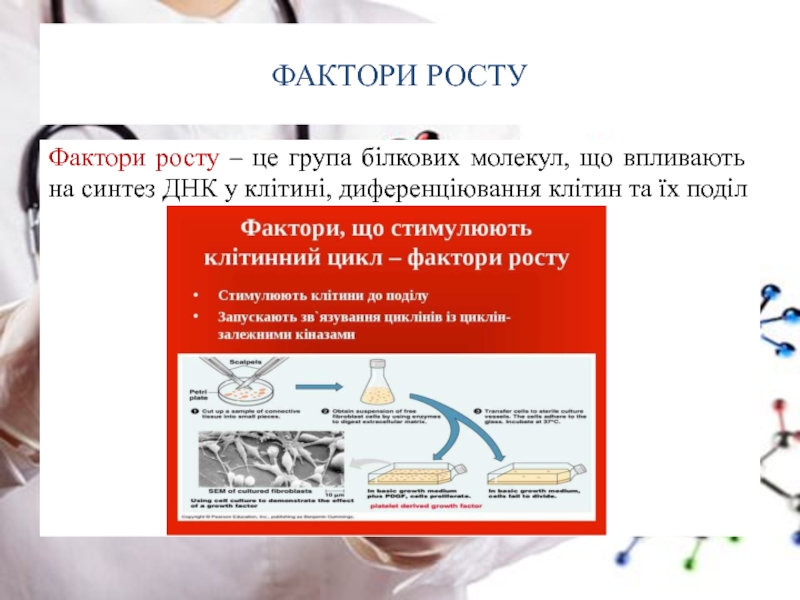
- 52. ФАКТОРИ РОСТУ
- 53. ДОМАШНЄ ЗАВДАННЯ
Слайд 1
Структура і функції білків. Ферменти. Вітаміни, гормони, фактори росту, їх роль
Слайд 2МОЛЕКУЛЯРНА БІОЛОГІЯ –
вивчає білки та нуклеїнові кислоти
Молекулярна біологія
Слайд 3МОЛЕКУЛЯРНА БІОЛОГІЯ –
вивчає білки та нуклеїнові кислоти
Ген визначає первинну структуру БІЛКА
Слайд 4МОЛЕКУЛЯРНА БІОЛОГІЯ –
вивчає білки та нуклеїнові кислоти
Білки-ферменти, каталізуючи певні реакції, забезпечують ВИЯВ ОЗНАКИ
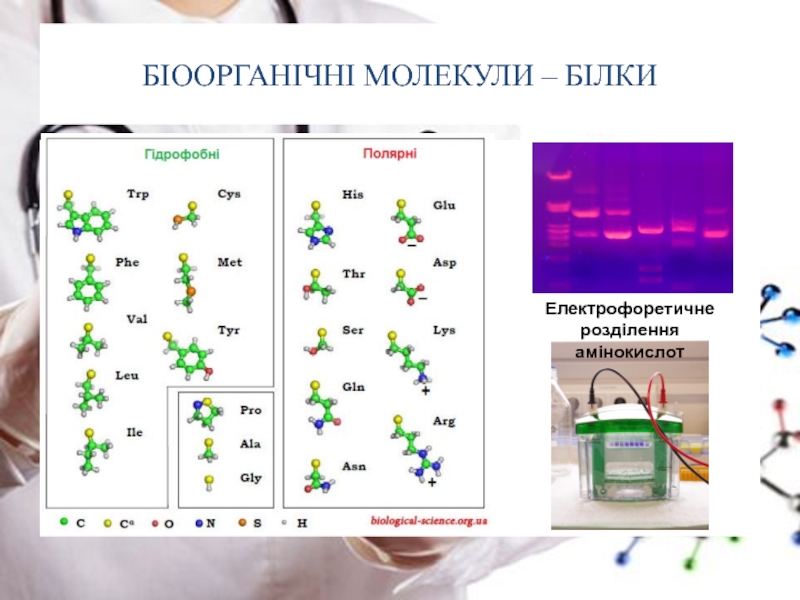
Слайд 7БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ
Білки – біополімери,
Амінокислоти – органічні сполуки, які у своєму складі містять аміногрупу (-NH2) та карбоксильну групу (-COOH) що приєднані до спільного атома карбону та радикал (боковий залишок)
Слайд 9БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ
У процесі синтезу білка до його
Слайд 12БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ
У процесі синтезу білка до його
Амінокислоти
Незамінні –
які не синтезуються в організмі людини і тварин та обов'язково мають надходити з їжею
Замінні –
синтезуються в організмі людини і тварин
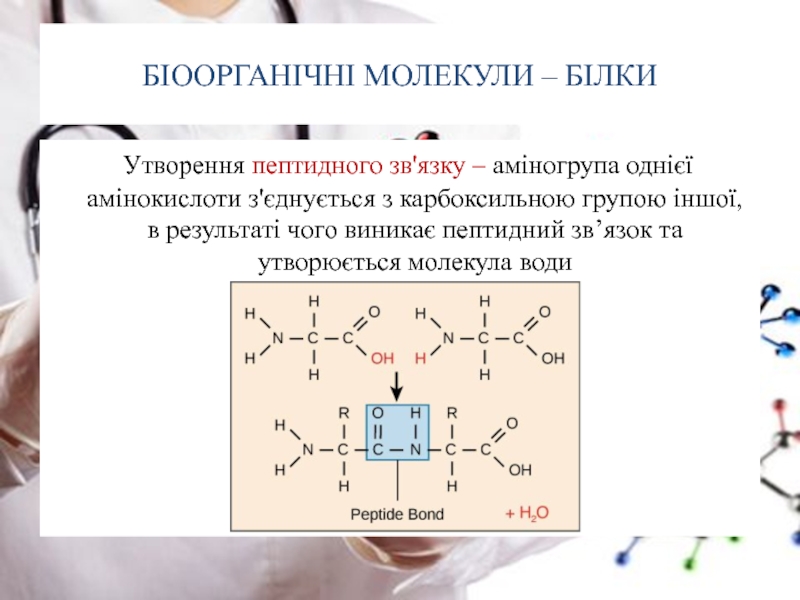
Слайд 16БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ
Утворення пептидного зв'язку – аміногрупа однієї
Слайд 18БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ
Сполуки, що містять декілька амінокислот звуться
Сполуку з великою кількістю амінокислот називають поліпептидом
Слайд 19БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ
До складу більшості білків входить 300-500
Білки відрізняються кількістю амінокислот і порядком чергування їх у поліпептидному ланцюзі
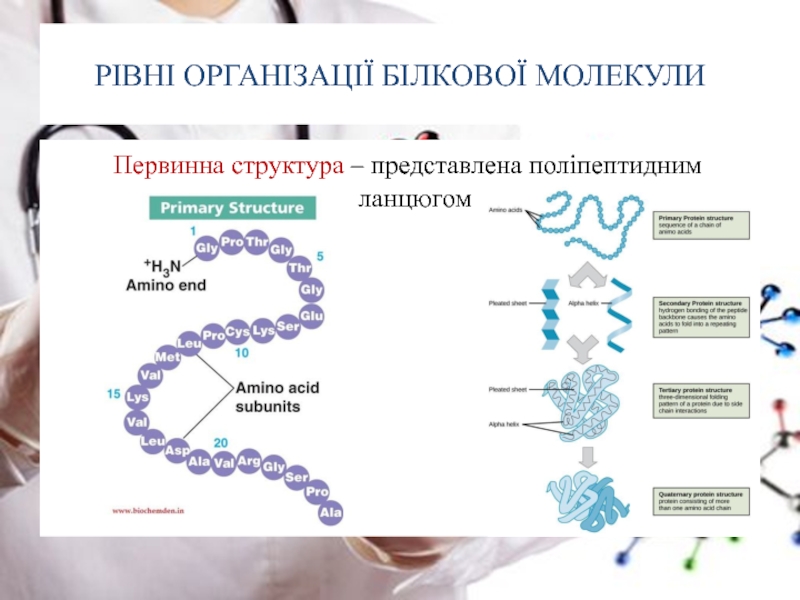
Слайд 20РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ
Первинна структура – представлена поліпептидним ланцюгом
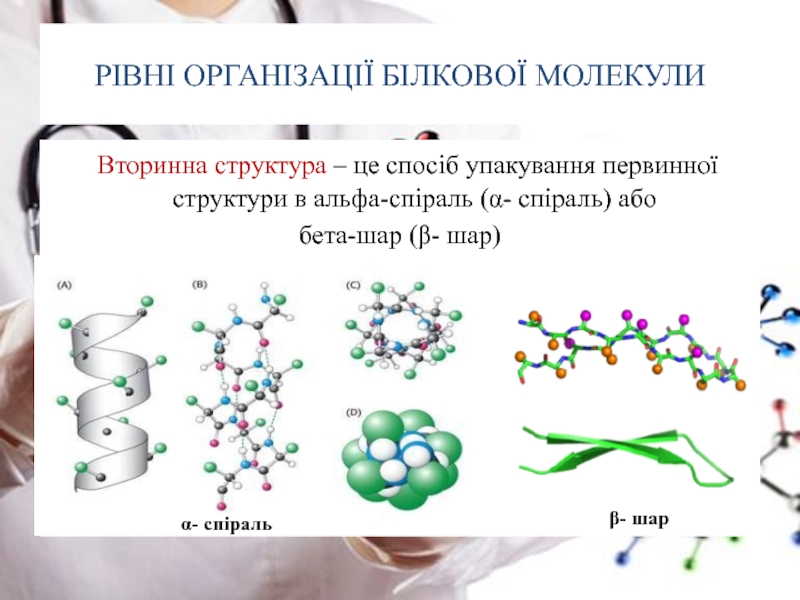
Слайд 21РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ
Вторинна структура – це спосіб упакування первинної
бета-шар (β- шар)
α- спіраль
β- шар
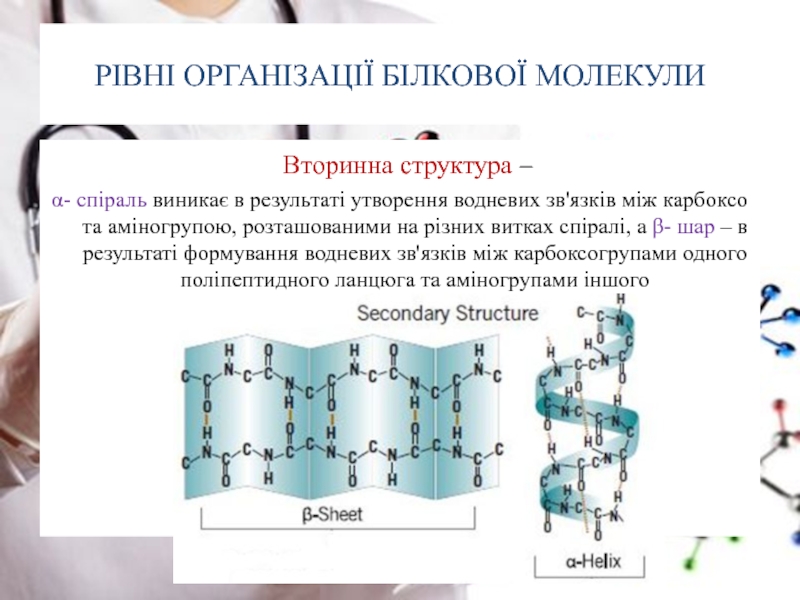
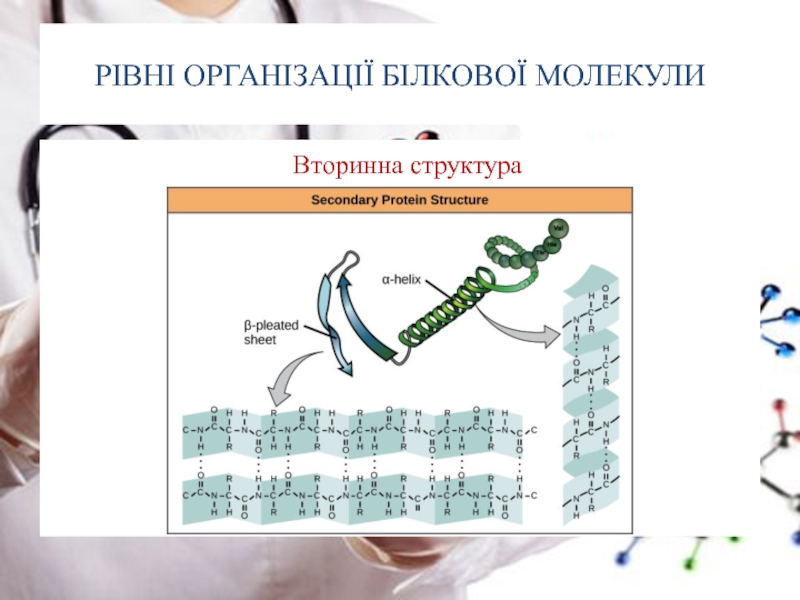
Слайд 22РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ
Вторинна структура –
α- спіраль виникає в
Слайд 23РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ
Вторинна структура –
α- спіраль виникає в
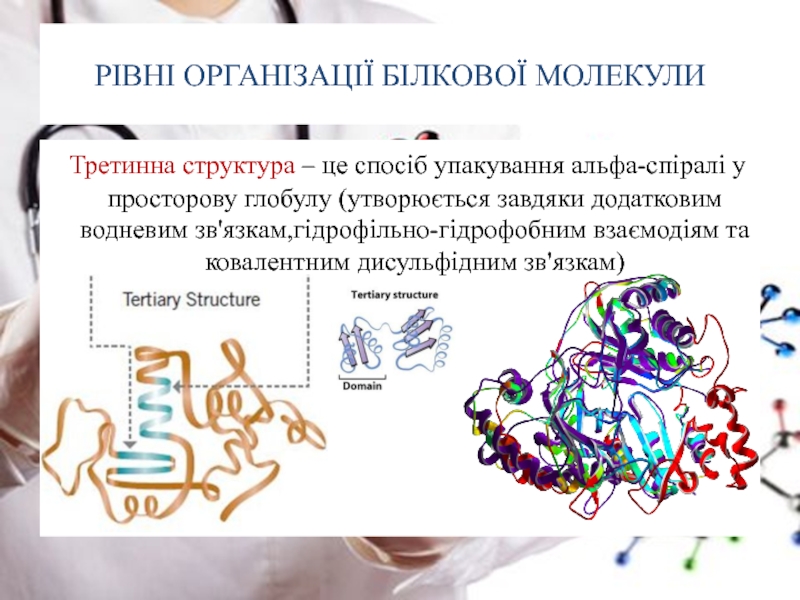
Слайд 25РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ
Третинна структура – це спосіб упакування альфа-спіралі
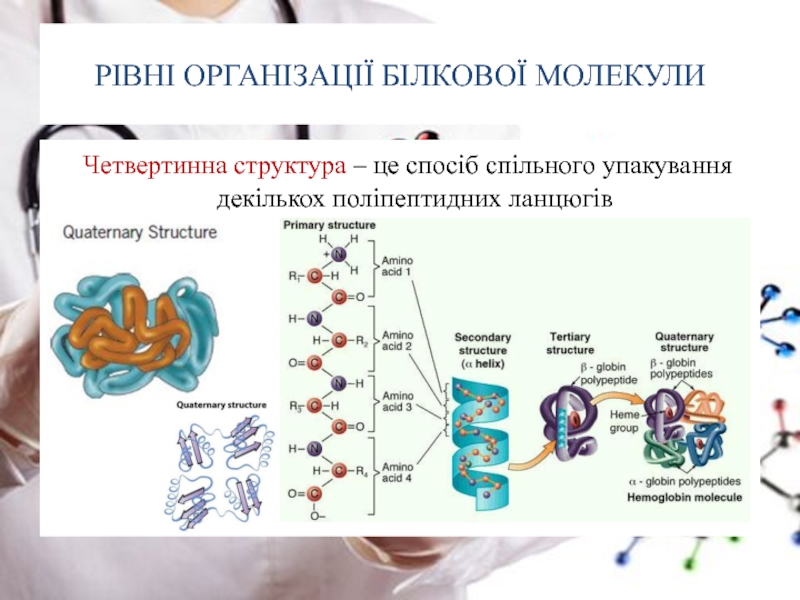
Слайд 26РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ
Четвертинна структура – це спосіб спільного упакування
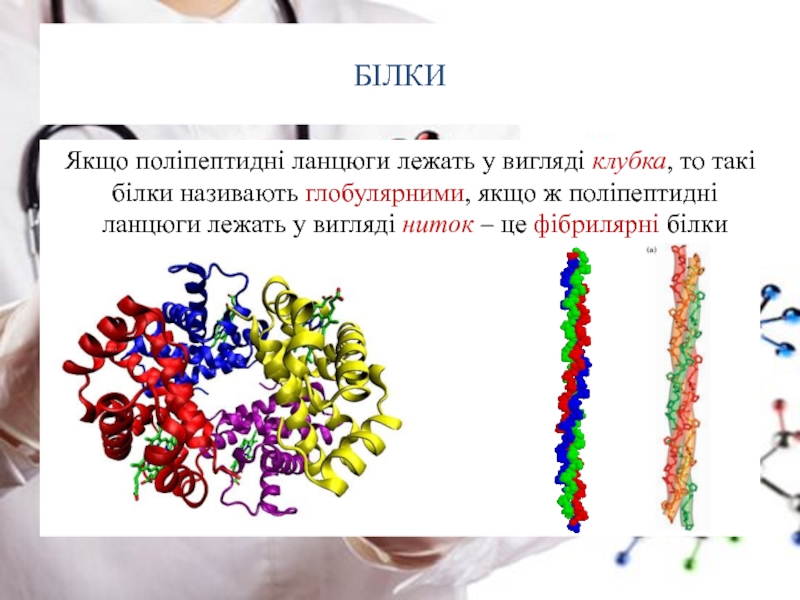
Слайд 29БІЛКИ
Якщо поліпептидні ланцюги лежать у вигляді клубка, то такі білки
Слайд 30ДЕНАТУРАЦІЯ ТА РЕНАТУРАЦІЯ БІЛКА
Починаючи зі вторинної структури, просторова конформація макромолекул
Денатурація, при якій руйнується первинна структура білка – необоротна, за умови збереження первинної структури і усунення чинника, що спричинив денатурацію, білок може відновити структуру – ренатурація
Слайд 34ФЕРМЕНТИ – БІОКАТАЛІЗАТОРИ
Ферменти – це білкові
Каталітична функція притаманна особливим білкам – ферментам, або ензимам, що впливають на перебіг біохімічних реакцій
Каталіз (від грец. каталіз – припинення) – зміна швидкості перебігу хімічних реакцій під дією певних хімічних сполук
Каталітичну функцію в живих організмах – біокаталіз – здійснюють ферменти
Слайд 35ФЕРМЕНТИ – БІОКАТАЛІЗАТОРИ
Ферментативні реакції в клітині є анаболічні (реакції
І. Фермент (1) тимчасово сполучається з речовиною (2) і забезпечує її розщеплення на простіші сполуки (3). ІІ. Фермент (1) вступає у тимчасовий комплекс із двома молекулами (3) і забезпечує їхню реакцію з утворенням складнішої речовини (4). Після реакції
структура ферменту не змінюється (5) і він готовий забезпечувати нові реакції
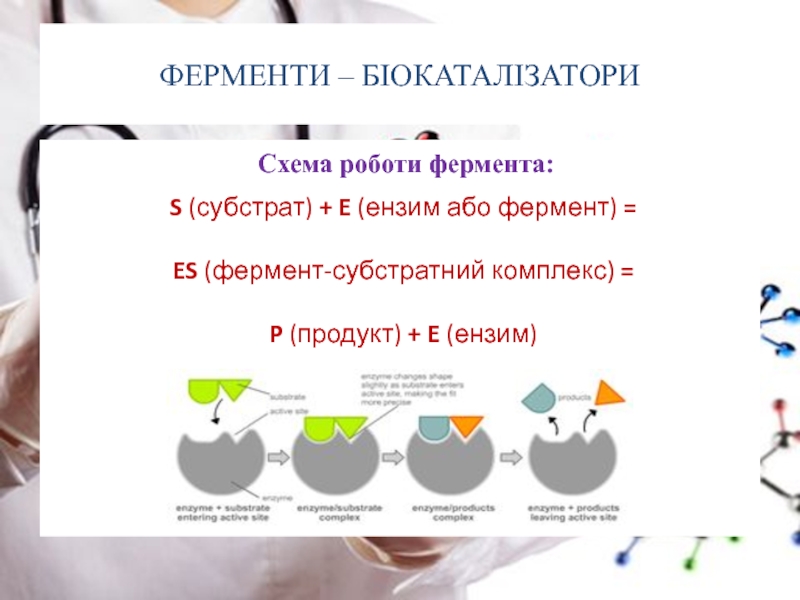
Слайд 36ФЕРМЕНТИ – БІОКАТАЛІЗАТОРИ
Схема роботи фермента:
S
ES (фермент-субстратний комплекс) =
P (продукт) + E (ензим)
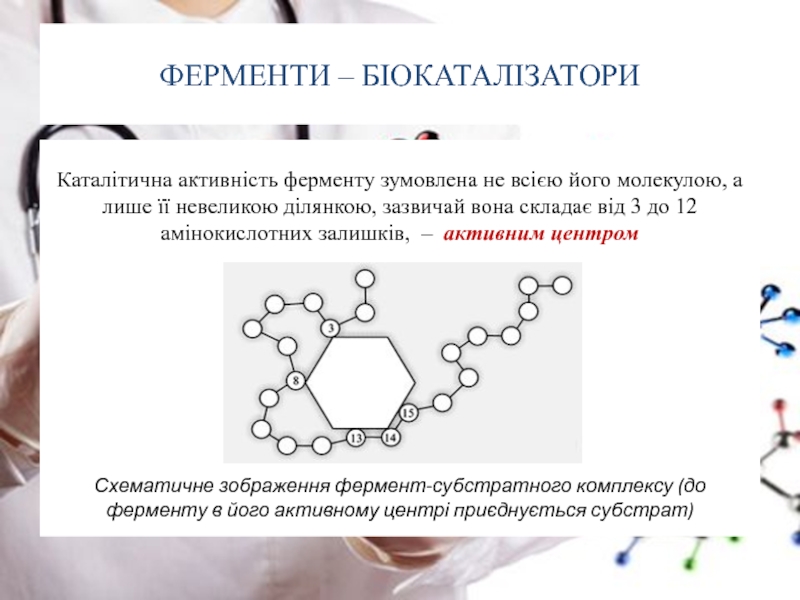
Слайд 37ФЕРМЕНТИ – БІОКАТАЛІЗАТОРИ
Каталітична активність ферменту
Схематичне зображення фермент-субстратного комплексу (до ферменту в його активному центрі приєднується субстрат)
Слайд 38ФЕРМЕНТИ – БІОКАТАЛІЗАТОРИ
Ферменти бувають простими
Прості ферменти – це білкові молекули (пепсин, трипсин тощо), які складаються лише з амінокислотних залишків
Складні ферменти, крім білкової частини, містять ще й небілкову, яку називають кофактором
Кофакторами можуть бути неорганічні катіони або аніони, а також органічні речовини (коферменти), наприклад похідні вітаміні.
Комплекс ферменту з кофактором зветься голофермент, а ферментна частина без кофактора – апофермент. Білковий компонент складних ферментів визначає, яку саме реакцію каталізує певний складний фермент. Але активність складних ферментів проявляється лише тоді, коли білкова частина ферменту сполучається з небілковою
Слайд 39ФЕРМЕНТИ – БІОКАТАЛІЗАТОРИ
Кожна молекула ферменту
Гліоксалаза людини. Фермент має два йони цинку, що забезпечують каталітичну функцію і позначені фіолетовим кольором та інгібітор фермента – S-гексилглютатіон, який заповнює два активні центри фермента
Слайд 40ВЛАСТИВОСТІ ФЕРМЕНТІВ
Ферменти мають наступні властивості:
1) всі
2) вони збільшують швидкість реакції при цьому самі залишаються в незміненому вигляді, тобто не використовуються в реакції;
3) їх наявність не впливає ні на природу, ні на властивості кінцевого продукту (продуктів) реакції;
4) дуже мала кількість ферменту сприяє перетворенню великої кількості субстрату;
5) активність ферментів змінюється в залежності від рН, температури, тиску і від концентрації як субстрату так і самого ферменту;
6) каталітична реакція оборотна;
7) ферменти мають специфічність, тобто, один фермент зазвичай каталізує лише одну реакцію
Слайд 41МЕХАНІЗМ ДІЇ ФЕРМЕНТІВ
Існує дві гіпотези, що
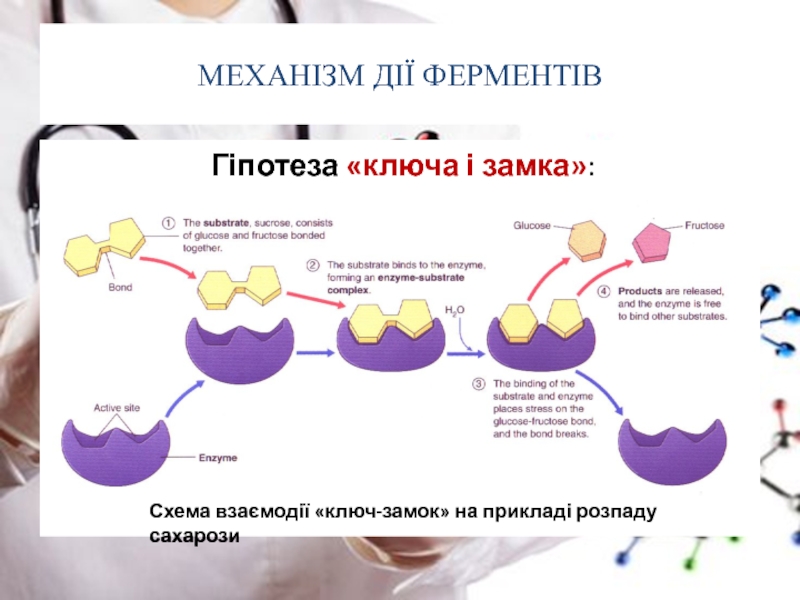
одна з них називається “ ключа та замка “,
а друга – гіпотеза “ рука та рукавичка “
Фішер в 1890 році висунув припущення, що специфічність обумовлена особливою формою молекули фермента, яка чітко відповідає формі молекули субстрату (субстратів). Цю гіпотезу називають гіпотезою «ключа і замка»: субстрат порівнюється із «ключем», котрий чітко відповідає по формі «замку», тобто ферменту
Слайд 42МЕХАНІЗМ ДІЇ ФЕРМЕНТІВ
Гіпотеза «ключа і замка»:
Схема
Слайд 43МЕХАНІЗМ ДІЇ ФЕРМЕНТІВ
Існує дві гіпотези, що
одна з них називається “ ключа та замка “,
а друга – гіпотеза “ рука та рукавичка “
В 1959 році нову інтерпретацію запропонував Кошланд. Ґрунтуючись на даних, що свідчать про надзвичайну фізичну гнучкість молекул ферментів та їхніх активних центрів, він запропонував ідею про динамічну взаємодію між ферментом і субстратом. Згідно з цим уявленням, субстрат, з’єднуючись з ферментом, викликає певні зміни в структурі останнього. Амінокислотні залишки активного центру ферменту набувають певної форми, котра дає йому змогу найефективніше виконувати свою функцію. Цю гіпотезу називають гіпотезою індукованої відповідності. Аналогом такої взаємодії може слугувати рукавичка, котра при одяганні на руку відповідно змінює свою форму («рука-рукавичка»). «Рука» – субстрат, «рукавичка» – фермент. Ця гіпотеза наразі активно розвивається та доповнюється новими даними
Слайд 44МЕХАНІЗМ ДІЇ ФЕРМЕНТІВ
Гіпотеза «рука і рукавичка»:
Схема
Схема ілюструє кошландівську гіпотезу індукованої відповідності «рука-рукавичка»
1 – з’єднуючись з ферментом, субстрат викликає в ньому зміни, внаслідок яких активні групи ферменту зближуються; 2 – дрібніші чи крупніші молекули не здатні взаємодіяти з ферментом і тому групи А і В або не зближуються або перекриваються