- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение и уровни организации белка презентация
Содержание
- 1. Строение и уровни организации белка
- 2. Белки полимерные молекулы, мономеры - аминокислоты.
- 3. Общие структурные особенности аминокислот, входящих в состав
- 4. Аминокислота
- 5. Классификация аминокислот По радикалу Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан Полярные незаряженные
- 6. Классификация аминокислот По функциональным группам (радикалам) Ароматические: фенилаланин, тирозин, триптофан Гетероциклические: гистидин, пролин Серосодержащие: цистеин, метионин Нециклические: все остальные
- 7. Классификация аминокислот Незаменимые валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан, аргинин, гистидин. Заменимые глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
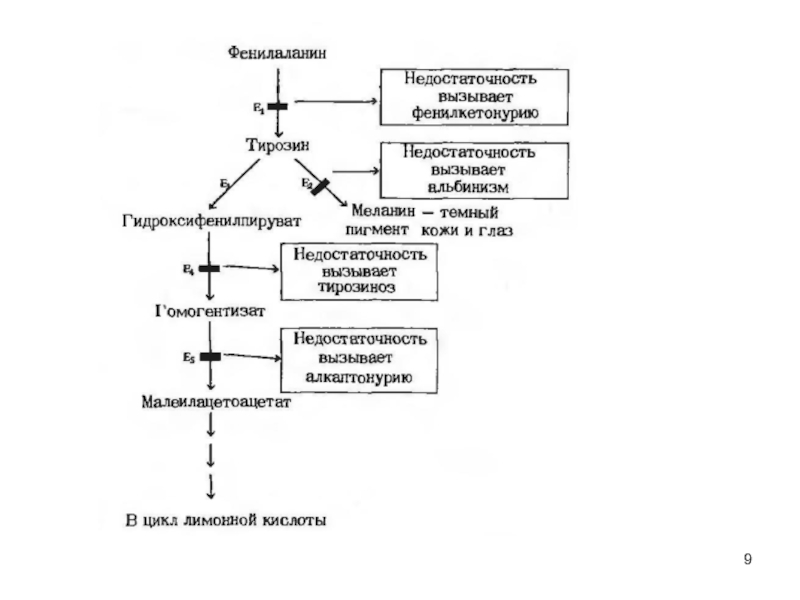
- 8. Схема 1 Особенности обмена аминокислот. Обмен фенилаланина
- 10. Пептидная связь α-Аминокислоты могут ковалентно связываться
- 12. СТРУКТУРА БЕЛКА Пептидные цепи содержат а/к
- 14. Первичная структура белка линейная последовательность а/к в
- 15. Вторичная структура белка
- 16. Вторичная структура белка регулярные структуры двух типов: α-спираль и β-структура.
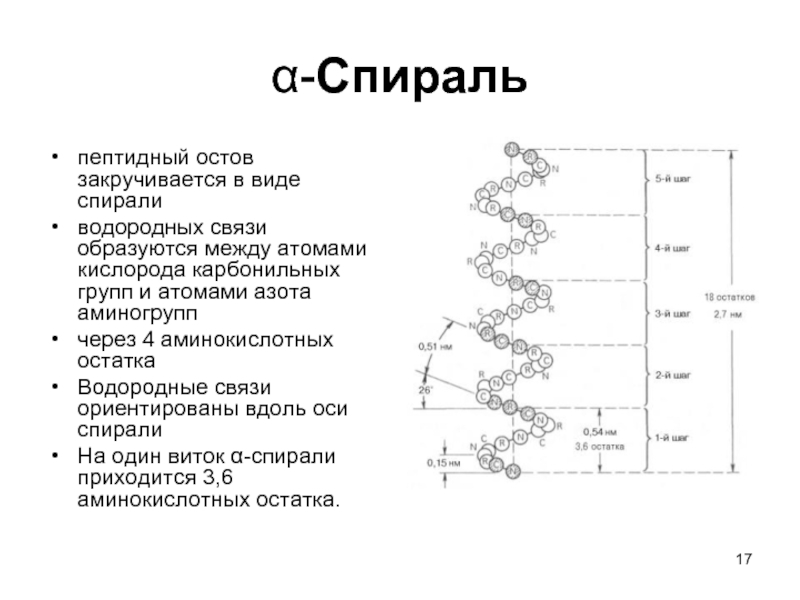
- 17. α-Спираль пептидный остов закручивается в виде
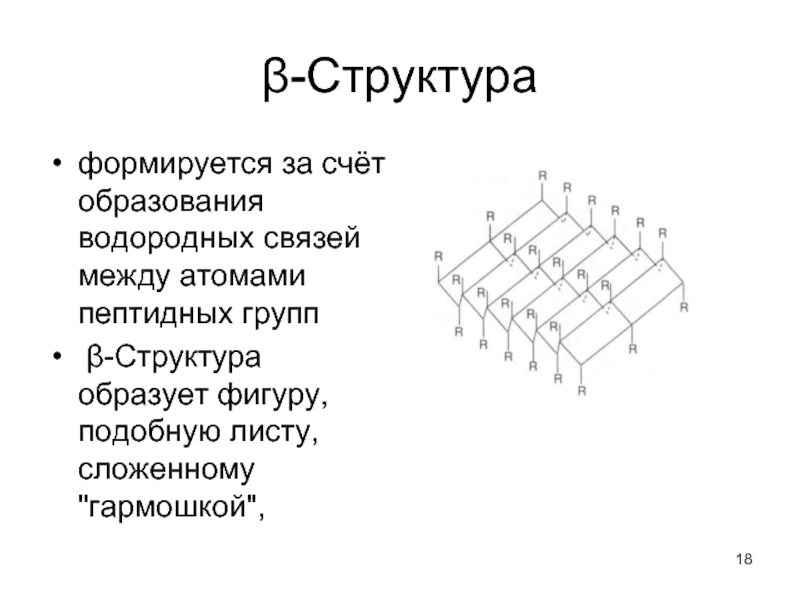
- 18. β-Структура формируется за счёт образования водородных связей
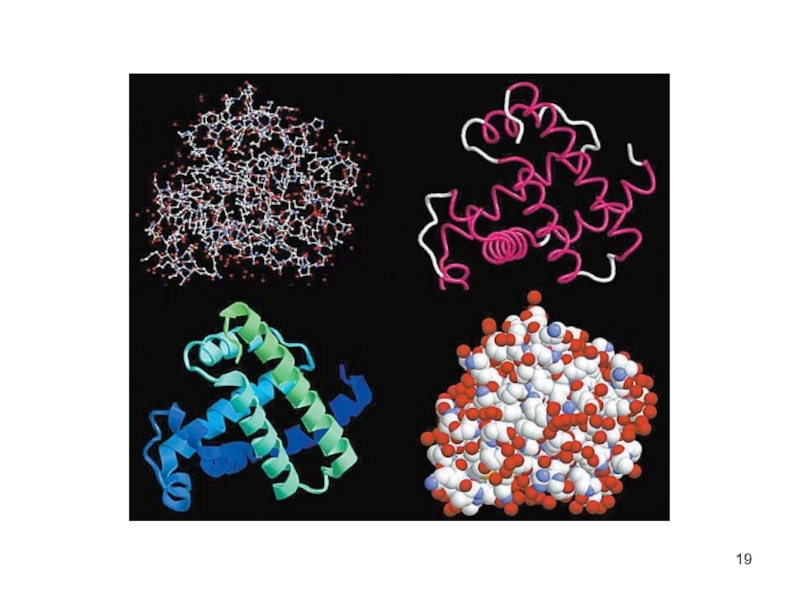
- 20. Третичная структура белков трёхмерная пространственная структура образуетсяза
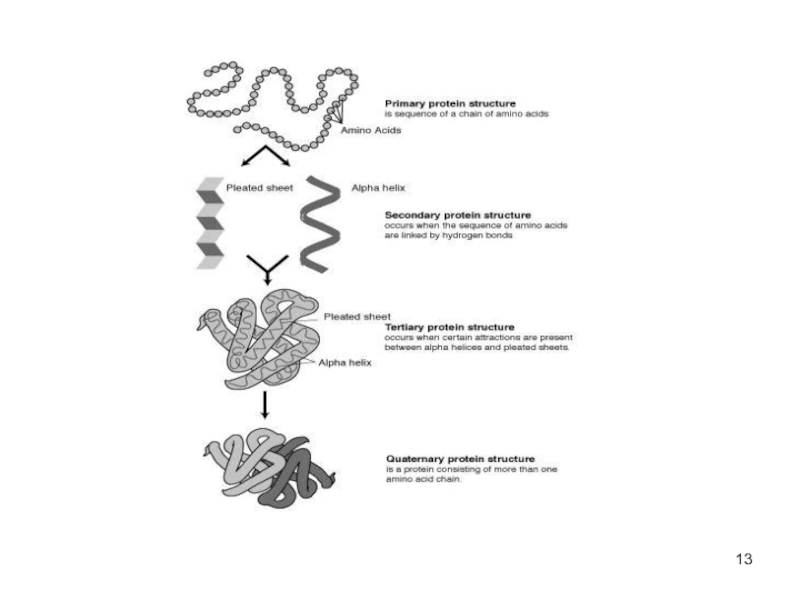
- 21. Четвертичная структура Несколько глобул Одна глобула + кофактор и/или кофермент
- 22. КОФАКТОРЫ И КОФЕРМЕНТЫ Большинство ферментов для
- 23. Функции белков в организме Каталитическая функция Структурная
- 24. Каталитическая функция Ферменты (энзимы) – белки -
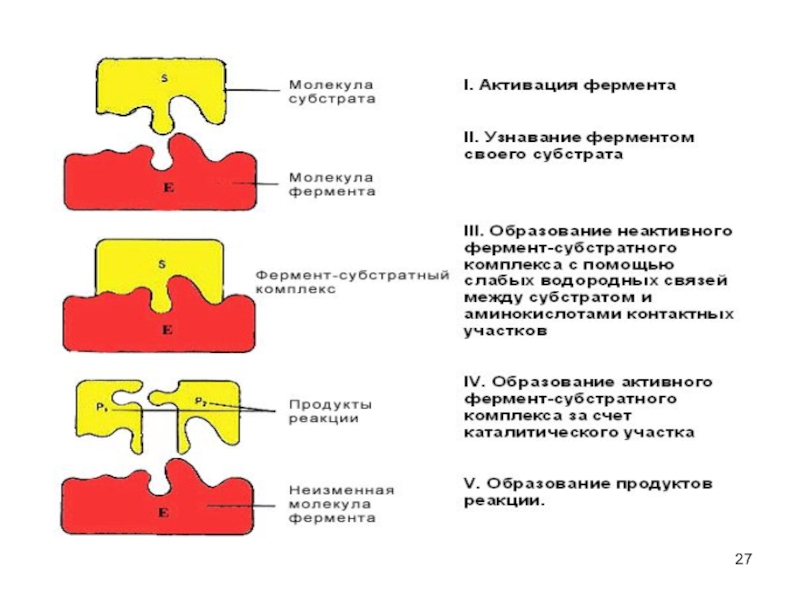
- 25. Фермент-субстратные реакции В участке связывания субстрат связывается
- 26. Катализ Схематично процесс катализа можно представить следующим
- 30. Специфичность наиболее важное свойство ферментов. субстратная
- 31. Специфичность Выделяют абсолютную субстратную специфичность (катализ 1
- 32. Каталитическая специфичность Фермент превращает субстрат по одному
- 33. Номенклатура и классификация ферментов В настоящее
- 34. Вещество, имеющее это окончание, принимают за
- 35. ферменты, катализирующие процессы гидролиза называют гидролазами,
- 36. КОФАКТОРЫ И КОФЕРМЕНТЫ Большинство ферментов для
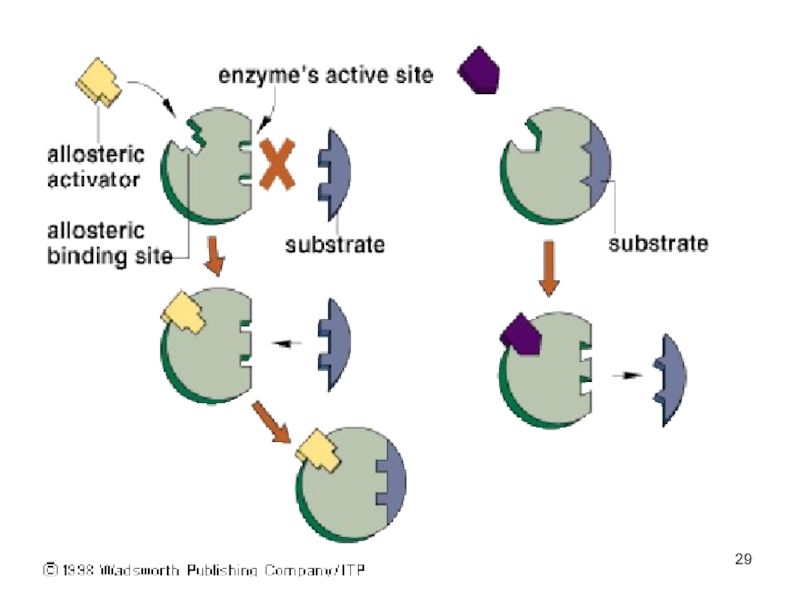
- 37. Регуляция работы ферментов Активность ферментов зависит от
- 38. Среди множества ферментов практически каждого метаболического
- 39. Ингибиторы ферментов Действие ферментов можно полностью
Слайд 2Белки
полимерные молекулы, мономеры - аминокислоты.
В составе белков в организме человека
встречают 20 α-аминокислот.
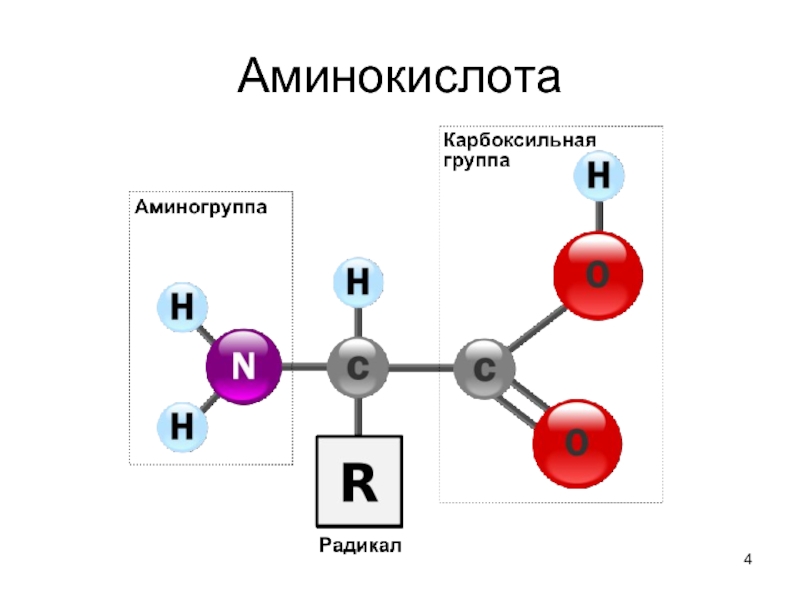
Слайд 3Общие структурные особенности
аминокислот, входящих в состав белков
наличие амино- и
карбоксильной групп, соединённых с одним и тем же α-углеродным атомом.
R - радикал аминокислот - в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение.
R - радикал аминокислот - в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение.
Слайд 5Классификация аминокислот
По радикалу
Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан
Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, аспарагин, глутамин, тирозин
Полярные заряженные отрицательно при
pH<7: аспарагиновая к-та, глутаминовая к-та
Полярные заряженные положительно при pH>7: лизин, аргинин, гистидин
Полярные заряженные положительно при pH>7: лизин, аргинин, гистидин
Слайд 6Классификация аминокислот
По функциональным группам (радикалам)
Ароматические: фенилаланин, тирозин, триптофан
Гетероциклические: гистидин, пролин
Серосодержащие: цистеин, метионин
Нециклические: все остальные
Слайд 7Классификация аминокислот
Незаменимые
валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан, аргинин, гистидин.
Заменимые
глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
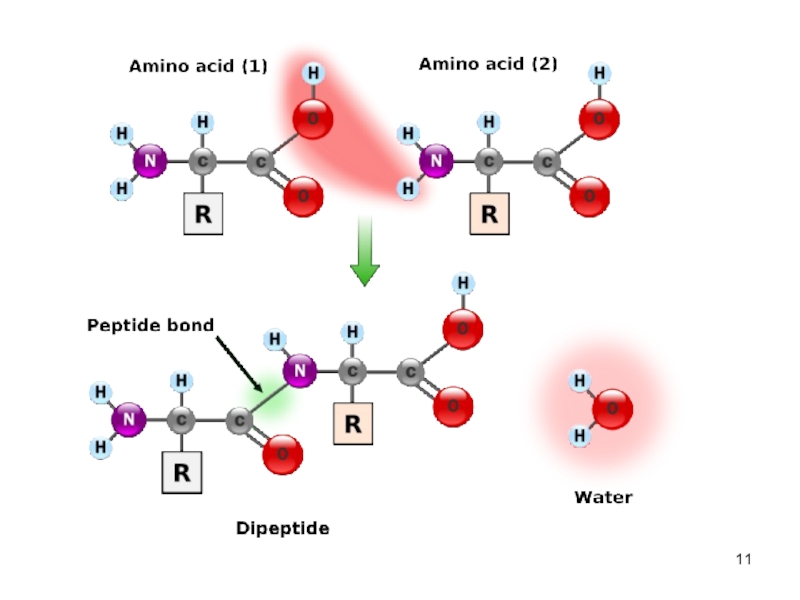
Слайд 10Пептидная связь
α-Аминокислоты могут ковалентно связываться друг с другом с помощью
пептидных связей.
Пептидная связь образуется между а-карбоксильной группой одной аминокислоты и α-аминогруппой другой, т.е. является амидной связью.
отщепление молекулы воды
Пептидная связь образуется между а-карбоксильной группой одной аминокислоты и α-аминогруппой другой, т.е. является амидной связью.
отщепление молекулы воды
Слайд 12СТРУКТУРА БЕЛКА
Пептидные цепи содержат а/к остатки, соединены пептидными связями. (прочные,
разрыв - фермент)
Белок имее определённую пространственную структуру, она определяет функции белка.
Различают 4 уровня структурной организации белков
Белок имее определённую пространственную структуру, она определяет функции белка.
Различают 4 уровня структурной организации белков
Слайд 14Первичная структура белка
линейная последовательность а/к в полипептидной цепи
первичная структура каждого белка
закодирована в одном гене
Слайд 17α-Спираль
пептидный остов закручивается в виде спирали
водородных связи образуются между
атомами кислорода карбонильных групп и атомами азота аминогрупп
через 4 аминокислотных остатка
Водородные связи ориентированы вдоль оси спирали
На один виток α-спирали приходится 3,6 аминокислотных остатка.
через 4 аминокислотных остатка
Водородные связи ориентированы вдоль оси спирали
На один виток α-спирали приходится 3,6 аминокислотных остатка.
Слайд 18β-Структура
формируется за счёт образования водородных связей между атомами пептидных групп
β-Структура образует фигуру, подобную листу, сложенному "гармошкой",
Слайд 20Третичная структура белков
трёхмерная пространственная структура
образуетсяза счёт взаимодействий между радикалами аминокислот, стоящих
на значительном расстоянии друг от друга в цепи
функционально активная конформация - "нативная структура".
функционально активная конформация - "нативная структура".
Слайд 22КОФАКТОРЫ И КОФЕРМЕНТЫ
Большинство ферментов для активности нуждается в:
низкомолекулярных органических
соединениях небелковой природы (коферментах)
и/или в ионах металлов (кофакторах) Zn2+, Mg2+, Mn2+, Fe2+, Cu2+, K+, Na+ .
и/или в ионах металлов (кофакторах) Zn2+, Mg2+, Mn2+, Fe2+, Cu2+, K+, Na+ .
Слайд 23Функции белков в организме
Каталитическая функция
Структурная функция
Защитная функция
Регуляторная функция
Сигнальная функция
Транспортная функция
Запасная (резервная)
функция белков
Рецепторная функция
Моторная (двигательная) функция
Рецепторная функция
Моторная (двигательная) функция
Слайд 24Каталитическая функция
Ферменты (энзимы) – белки - увеличивают скорость протекания химической реакции,
при этом не расходуются
биологическая функция фермента обусловлена наличием в его структуре активного центра (АЦ)
в АЦ фермента есть участки связывания субстрата, и участки химического превращения субстрата (каталитический участок).
биологическая функция фермента обусловлена наличием в его структуре активного центра (АЦ)
в АЦ фермента есть участки связывания субстрата, и участки химического превращения субстрата (каталитический участок).
Слайд 25Фермент-субстратные реакции
В участке связывания субстрат связывается с ферментом - фермент-субстратный комплекс.
В каталитическом участке субстрат превращается в продукт
продукт отщепляется от активного центра фермента.
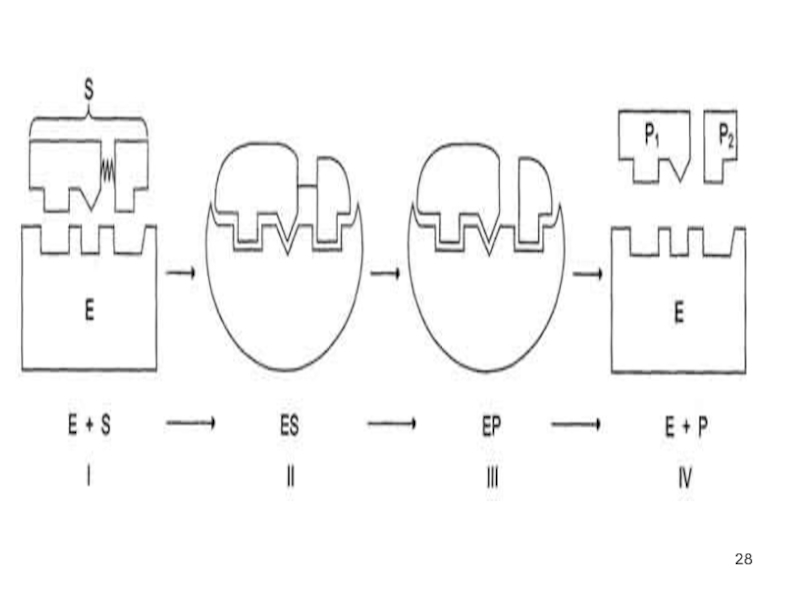
Слайд 26Катализ
Схематично процесс катализа можно представить следующим уравнением:
Е + S ↔
ES ↔ ЕР ↔ Е + Р,
где Е - фермент (энзим), S - субстрат, Р - продукт.
где Е - фермент (энзим), S - субстрат, Р - продукт.
Слайд 30Специфичность
наиболее важное свойство ферментов.
субстратная сп.- способность фермента взаимодействовать лишь с
одним или несколькими определёнными субстратами.
Слайд 31Специфичность
Выделяют
абсолютную субстратную специфичность (катализ 1 субстрата) - аргиназа;
групповую субстратную специфичность
однотипные реакции с группой структурно похожих субстратов - панкреатическая липаза ;
стереоспецифичность специфичность ферментов к стереоизомерам (L-аминокислотам )
стереоспецифичность специфичность ферментов к стереоизомерам (L-аминокислотам )
Слайд 32Каталитическая специфичность
Фермент превращает субстрат по одному из возможных путей его превращения
Зависит
от строения каталитического участка активного центра фермента
глюкозо-6-фосфат в клетках печени человека - субстрат 4 различных ферментов; фосфоглюкомутазы, глюкозо-6-фосфатфосфатазы, фосфоглюкоизомеразы и глюкозо-6-фосфатдегидрогеназы
глюкозо-6-фосфат в клетках печени человека - субстрат 4 различных ферментов; фосфоглюкомутазы, глюкозо-6-фосфатфосфатазы, фосфоглюкоизомеразы и глюкозо-6-фосфатдегидрогеназы
Слайд 33Номенклатура и классификация ферментов
В настоящее время известно более 2400 ферментов. Каждый
фермент, как правило, имеет две номенклатуры; одна из них рабочая (тривиальная), а другая - систематическая.
Рабочее наименоваие фермента составляют путем прибавления к корню слова латинского , греческого или химического названия субстрата, на который действует фермент, или к названию процесса, катализируемого данным ферментом окончания “-аза”.
Рабочее наименоваие фермента составляют путем прибавления к корню слова латинского , греческого или химического названия субстрата, на который действует фермент, или к названию процесса, катализируемого данным ферментом окончания “-аза”.
Слайд 34
Вещество, имеющее это окончание, принимают за фермент. Ферменты, действующие на крахмал
(amylum), сахарозу, мочевину (urea), пептиды получили соответственно названия : амилаза, сахараза, уреаза,пептидаза;
В названии ряда ферментов указывают как характер субстрата, так и тип катализируемой реакции. Фермент, катализирующий отнятие водорода от спирта, называют алкогольдегирогеназа.
Рабочим названием ферментов пользуются в повседневной практике.
В названии ряда ферментов указывают как характер субстрата, так и тип катализируемой реакции. Фермент, катализирующий отнятие водорода от спирта, называют алкогольдегирогеназа.
Рабочим названием ферментов пользуются в повседневной практике.
Слайд 35
ферменты, катализирующие процессы гидролиза называют гидролазами, процессы окисления - оксидазами, перенос
групп - трнсферазами и т.д. Для некоторых ферментов сохранены названия, неподчиняющиеся этому правилу: пепсин, трипсин, химотрипсин папин и др.
Слайд 36КОФАКТОРЫ И КОФЕРМЕНТЫ
Большинство ферментов для активности нуждается в:
низкомолекулярных органических
соединениях небелковой природы (коферментах)
и/или в ионах металлов (кофакторах) Zn2+, Mg2+, Mn2+, Fe2+, Cu2+, K+, Na+ .
и/или в ионах металлов (кофакторах) Zn2+, Mg2+, Mn2+, Fe2+, Cu2+, K+, Na+ .
Слайд 37Регуляция работы ферментов
Активность ферментов зависит от количества:
молекул субстрата
продукта
наличия кофакторов и коферментов.
Каскад : продукт одной ферментативной реакции является субстратом другой, образуя таким образом "метаболические пути".
Слайд 38
Среди множества ферментов практически каждого метаболического пути различают ключевые, или регуляторные,
ферменты, активность которых может изменяться в зависимости от потребности клетки в конечном продукте метаболического пути.
Слайд 39Ингибиторы ферментов
Действие ферментов можно полностью или частично подавить (ингибировать) химическими
веществами (ингибиторами).
По характеру действия ингибиторы могут быть обратимыми и необратимыми. - прочность соединения ингибитора с ферментом.
По характеру действия ингибиторы могут быть обратимыми и необратимыми. - прочность соединения ингибитора с ферментом.