- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Синтез белка в клетке презентация
Содержание
- 1. Синтез белка в клетке
- 3. Синтез белка в клетке состоит из
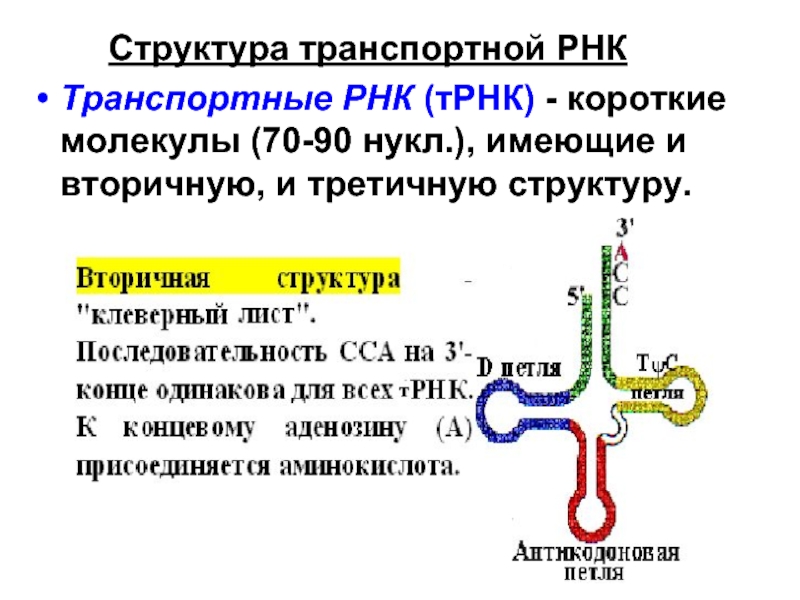
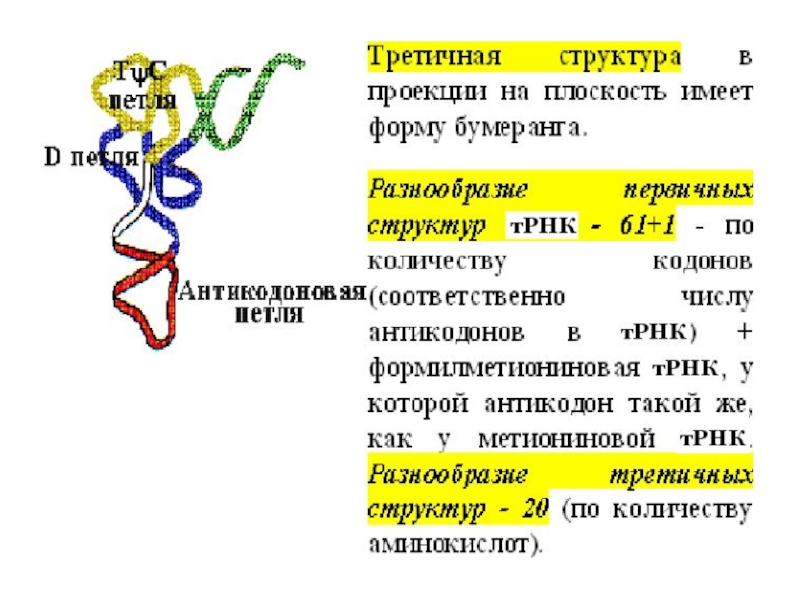
- 4. Структура транспортной РНК
- 7. Аминоацилирование - это образование связи между аминокислотой
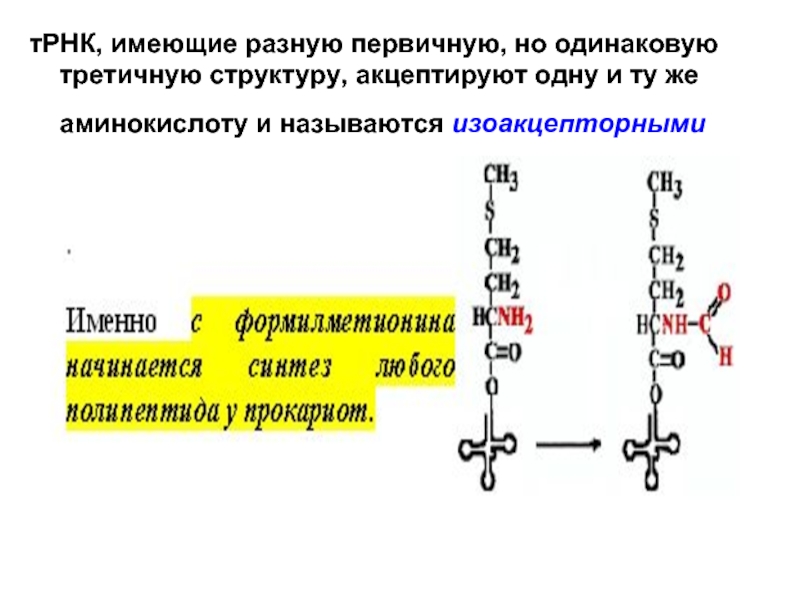
- 8. тРНК, имеющие разную первичную, но одинаковую третичную
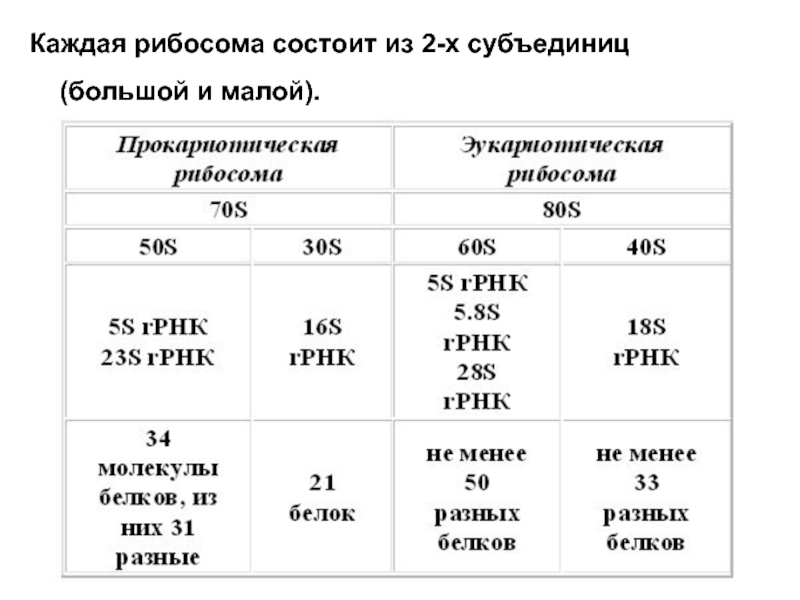
- 9. Структура рибосом Рибосомы
- 10. Каждая рибосома состоит из 2-х субъединиц (большой и малой).
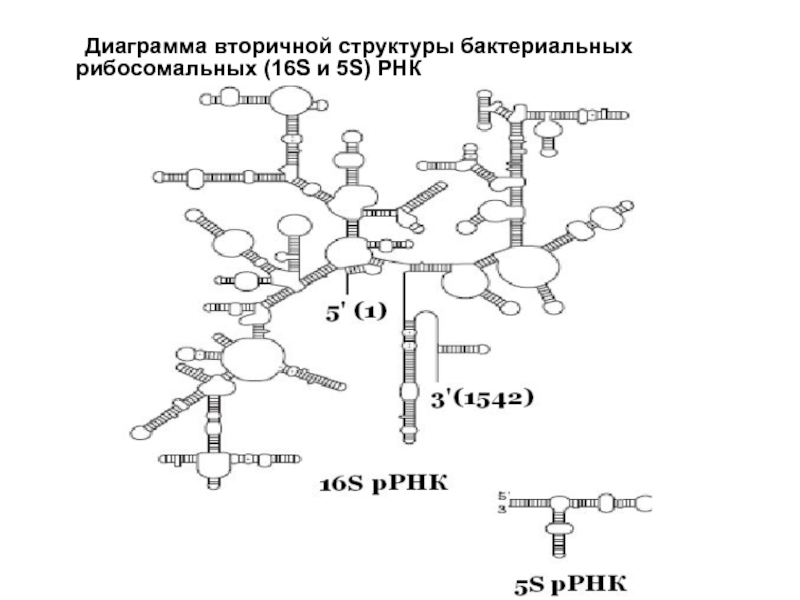
- 12. Диаграмма вторичной структуры бактериальных рибосомальных (16S и 5S) РНК
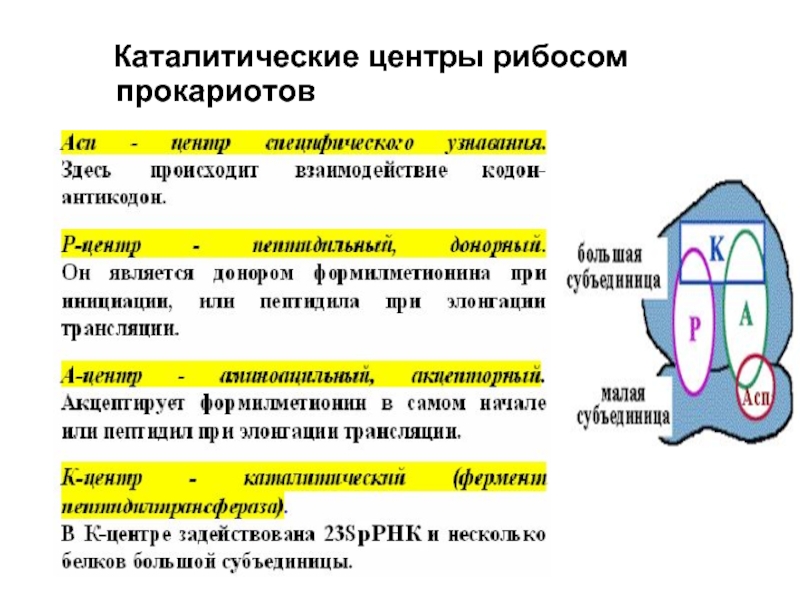
- 13. Каталитические центры рибосом прокариотов
- 14. Синтез полипептидов на рибосоме У прокариот перед
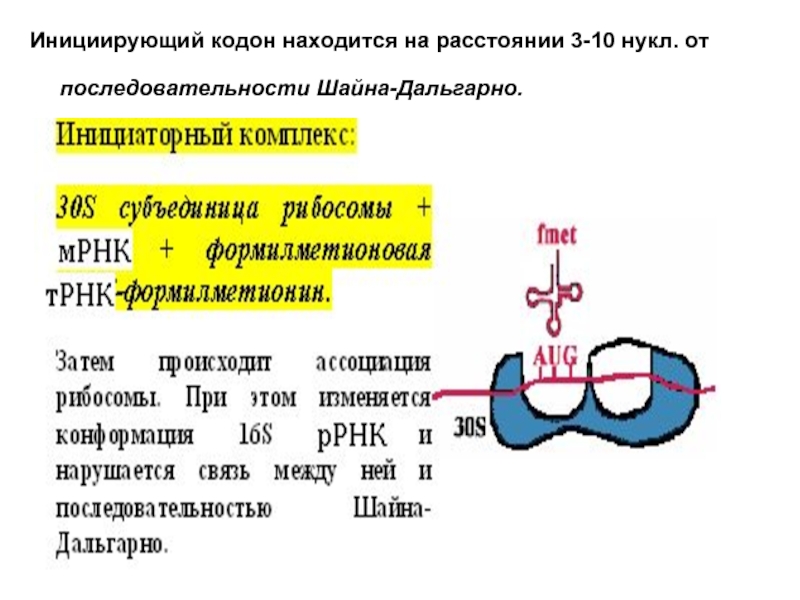
- 15. Инициирующий кодон находится на расстоянии 3-10 нукл. от последовательности Шайна-Дальгарно.
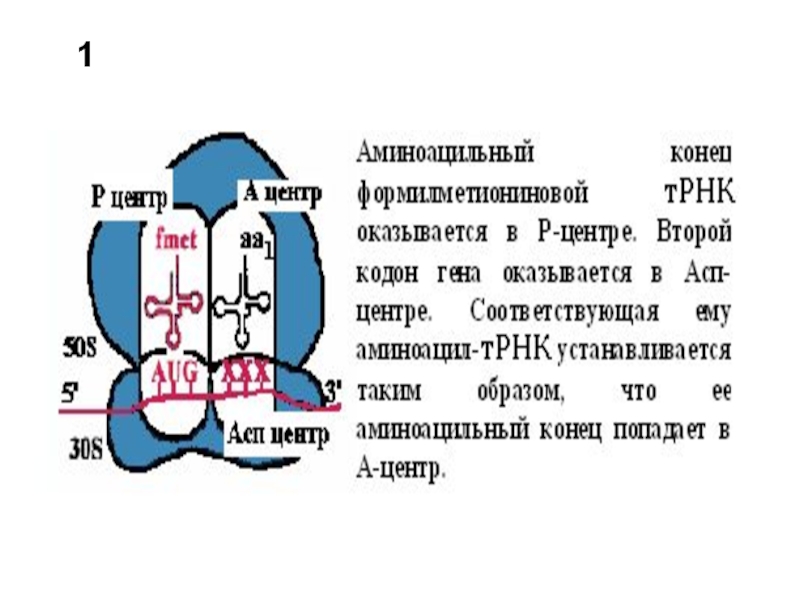
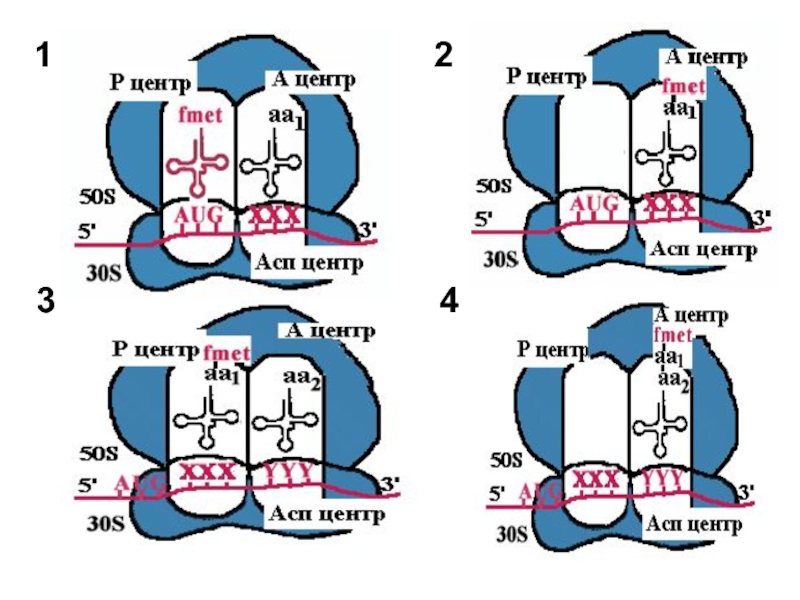
- 16. 1
- 17. 2. Пептидилтрансфераза отрывает формилметионин в Р-центре
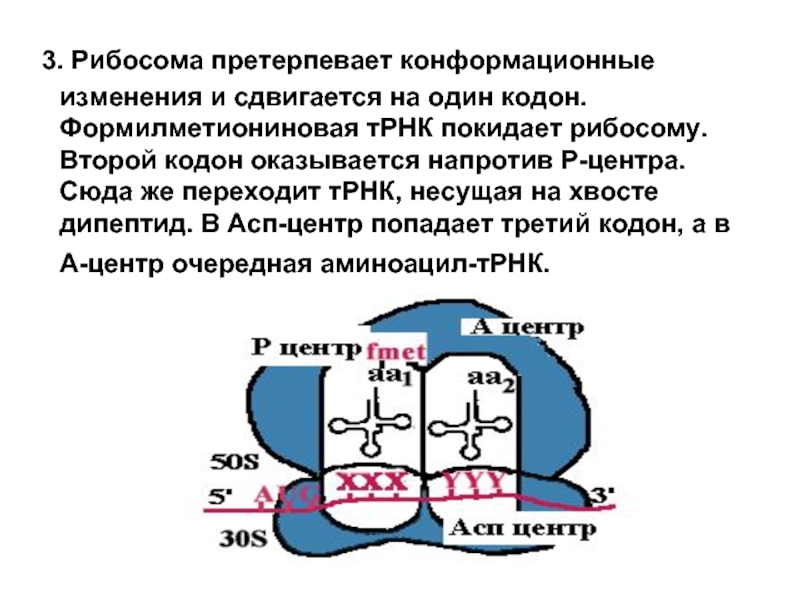
- 18. 3. Рибосома претерпевает конформационные изменения и
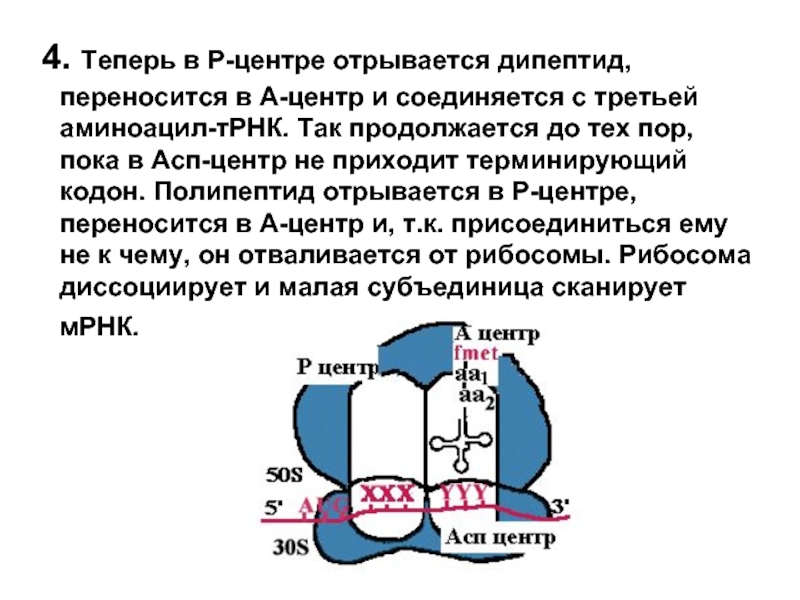
- 19. 4. Теперь в Р-центре отрывается дипептид,
- 21. In vivo
- 22. Компоненты, необходимые для пяти основных стадий синтеза белка у E.coli
- 24. ПОСТТРАНСЛЯЦИОННАЯ
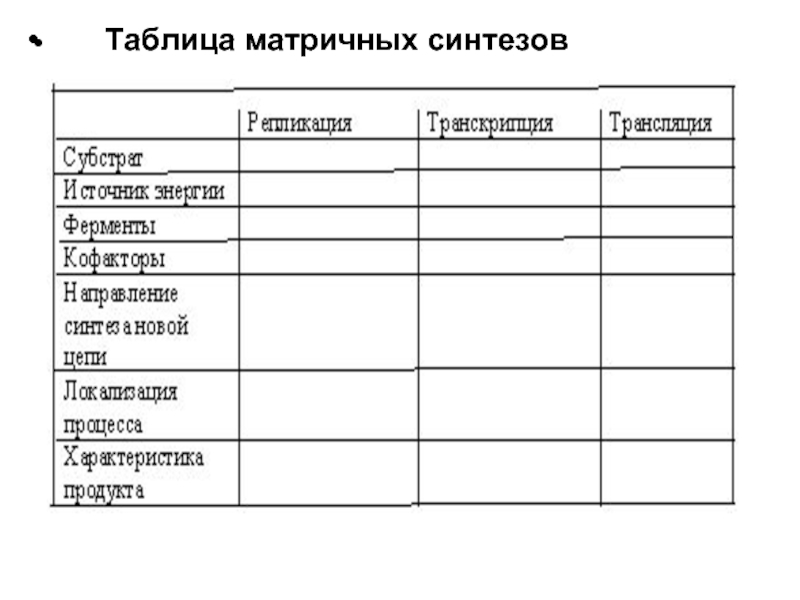
- 26. Таблица матричных синтезов
Слайд 1БИОТЕХНОЛОГИЯ
Курс лекций для студентов IV курса факультета биологии РГПУ им. А.И.
Направление 050100 Педагогическое образование
Профиль 01 Биологическое образование
Профессор кафедры Зоологии д.б.н., проф. Цымбаленко Надежда Васильевна
Слайд 3
Синтез белка в клетке состоит из трех этапов:
рекогниция,
трансляция -
посттрансляционная модификация
(процессинг и фолдинг).
Ключевым субстратом рекогниции является транспортная РНК.
Слайд 4 Структура транспортной РНК
Транспортные РНК (тРНК) - короткие
Слайд 6
Рекогниция - это подготовительный этап трансляции, суть которого в образовании ковалентной связи между тРНК и соответствующей аминокислотой.
1. Активирование аминокислоты.
2. Присоединение аминокислоты к тРНК - аминоацилирование.
Обе стадии рекогниции осуществляются ферментом аминоацил-тРНК-синтетазой (APC-азой, кодазой).
Существует 20 вариантов кодаз (по числу аминокислот). У каждой кодазы 3 центра опознавания. Каждая АРС-аза узнает третичную структуру tРНК.
Слайд 8тРНК, имеющие разную первичную, но одинаковую третичную структуру, акцептируют одну и
Слайд 9 Структура рибосом
Рибосомы - немембранные самые мелкие клеточные
1. Прокариотические 70S.
2. Эукариотические 80S.
3. Рибосомы митохондрий (55S - у животных, 75S - у грибов).
4. Рибосомы хлоропластов (70S у высших растений).
S - коэффициент седиментации или константа Сведберга. Отражает скорость осаждения молекул или их компонентов при центрифугировании, зависящую от конформации и молекулярного веса.
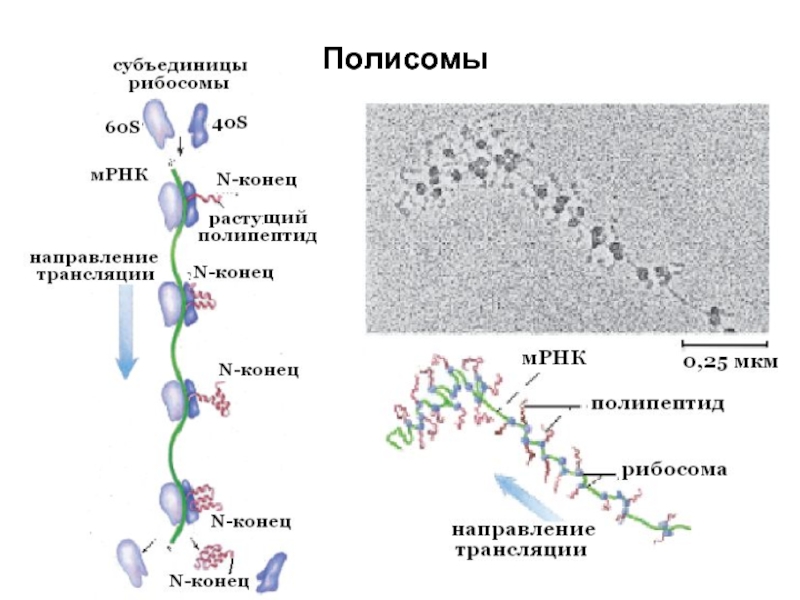
Слайд 14Синтез полипептидов на рибосоме
У прокариот перед каждым геном и соответственно в
Слайд 15Инициирующий кодон находится на расстоянии 3-10 нукл. от последовательности Шайна-Дальгарно.
Слайд 17 2. Пептидилтрансфераза отрывает формилметионин в Р-центре и переносит его в
Слайд 18 3. Рибосома претерпевает конформационные изменения и сдвигается на один кодон.
Слайд 19 4. Теперь в Р-центре отрывается дипептид, переносится в А-центр и
Слайд 21
In vivo на каждой стадии (образования инициаторного
На всех этапах принимают участие молекулы ГТФ, которые дефосфорилируются.
Смысл гидролиза ГТФ не в отдаче энергии, а в свидетельстве того, что данный этап трансляции пройден.
Слайд 24
ПОСТТРАНСЛЯЦИОННАЯ МОДИФИКАЦИЯ БЕЛКОВ
(фолдинг и процессинг)
1.Частичный протеолиз.
2.
3. Фолдинг – формирование пространственной структуры с помощью шаперонов для правильной укладки полипептидной цепи).
4. Образование дисульфидных связей.
5. Присоединение простетических групп
6. Образование олигомерных структур (четвертичная структура) с участием шаперонов.
Слайд 25 ИНГИБИТОРЫ СИНТЕЗА БЕЛКА
Пуромицин
Тетрациклин - блокирует А центр рибосомы, препятствует связыванию тРНК.
Хлорамфеникол – блокирует перенос пептидила (у бактерий, в митохондриях и хлоропластах).
Рицин (белок) – очень токсический белок деструктурирует эукариотические рибосомы путем депуринизации рРНК.