- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ретровирусы и ретровирусные векторы МГУ В.С. Прасолов презентация
Содержание
- 1. Ретровирусы и ретровирусные векторы МГУ В.С. Прасолов
- 2. Открытие вирусов 1892 год Д.И.Ивановский –
- 3. Ретровирусы
- 4. Классификация ретровирусов
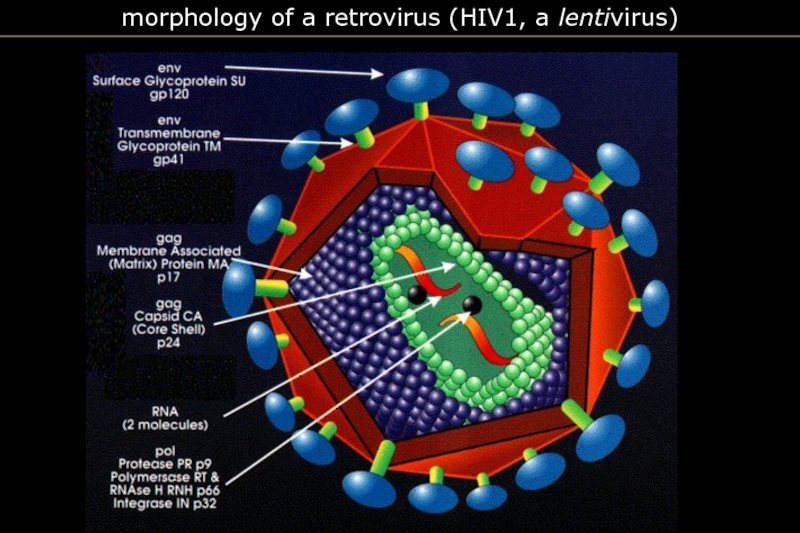
- 5. morphology of a retrovirus (HIV1, a lentivirus)
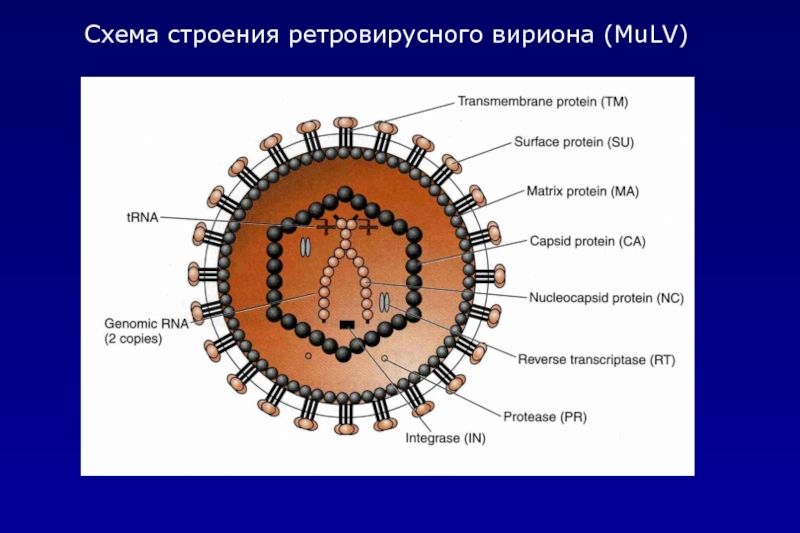
- 6. Схема строения ретровирусного вириона (MuLV)
- 7. Гены простых и сложных ретровирусов
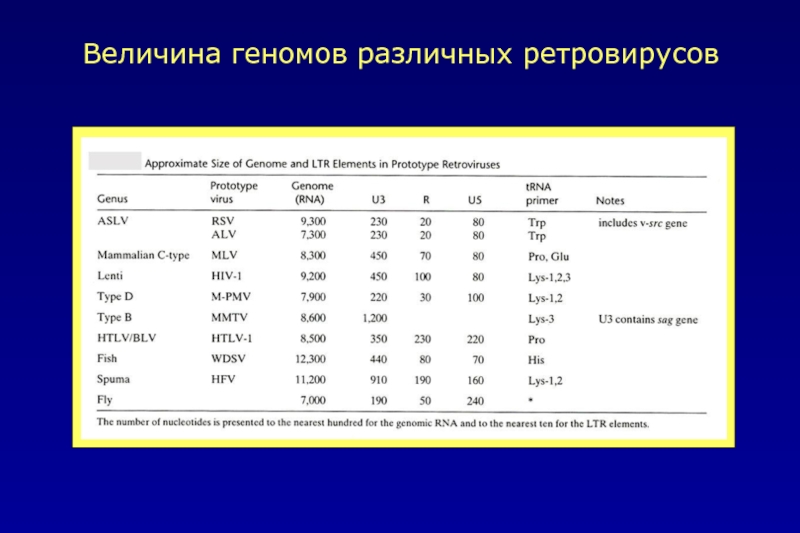
- 8. Величина геномов различных ретровирусов
- 9. Структура геномной РНК простого ретровируса
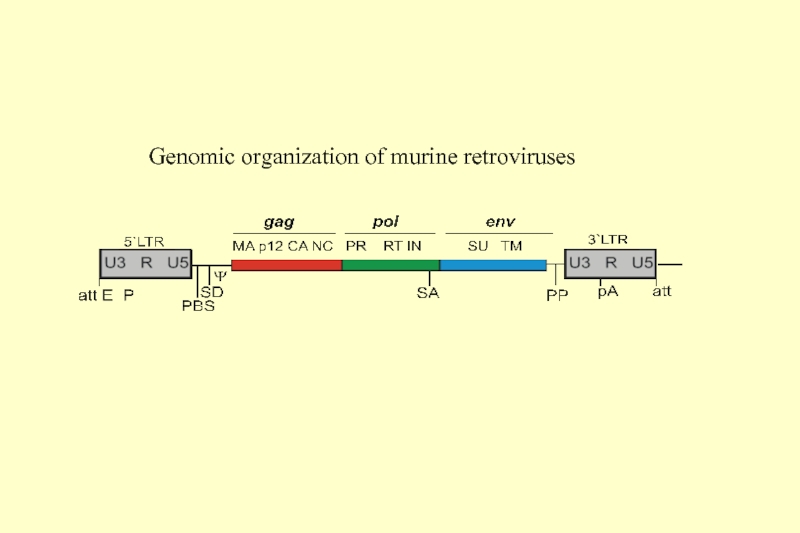
- 10. Геномная организация различных ретровирусов
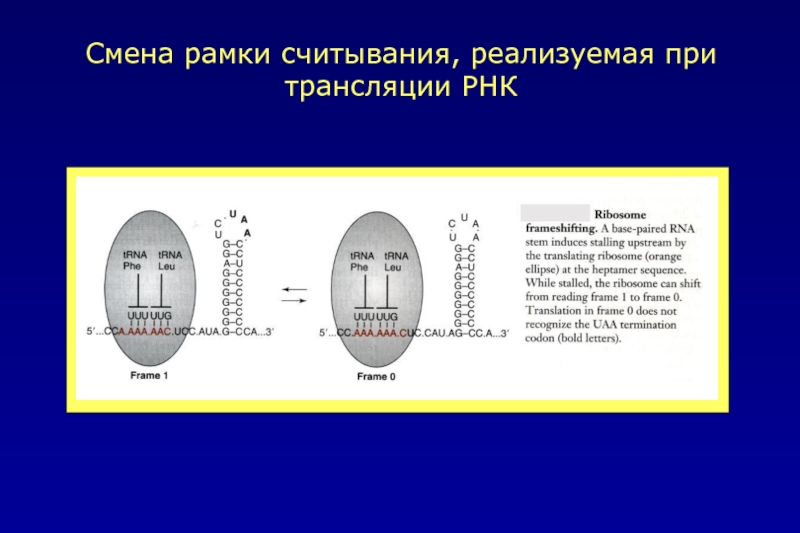
- 11. Смена рамки считывания, реализуемая при трансляции РНК
- 12. Образование двух форм ретровирусной РНК
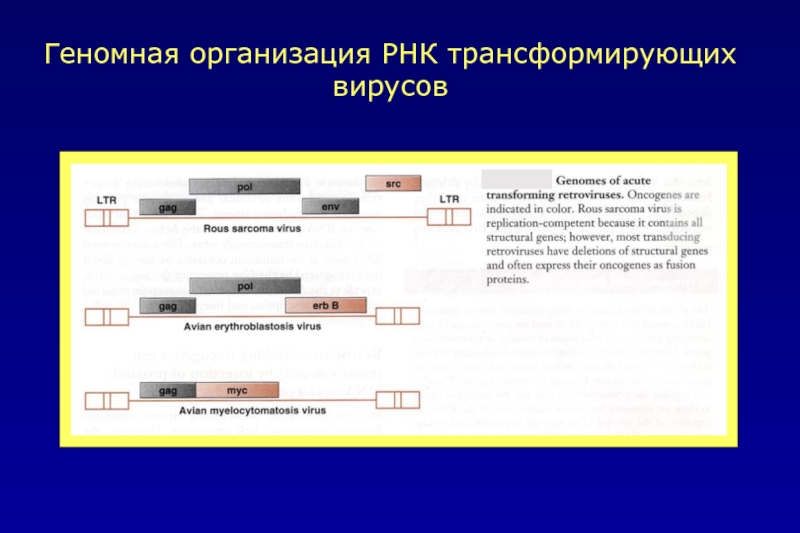
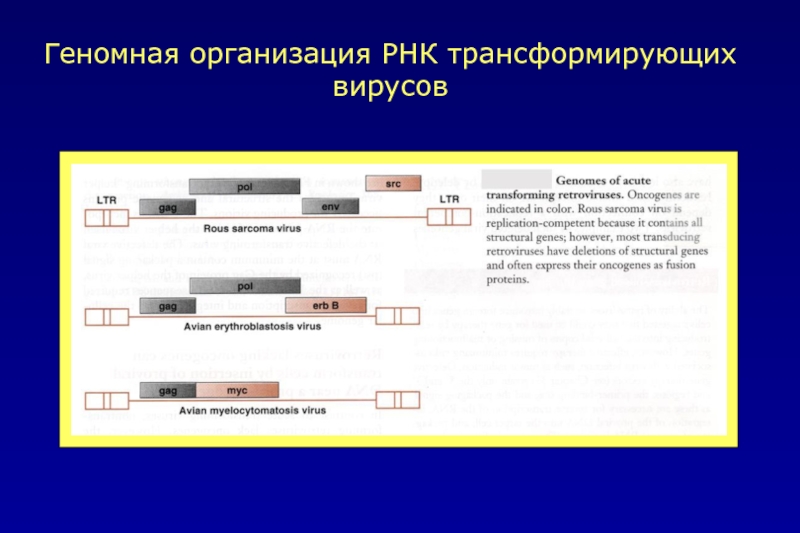
- 13. Геномная организация РНК трансформирующих вирусов
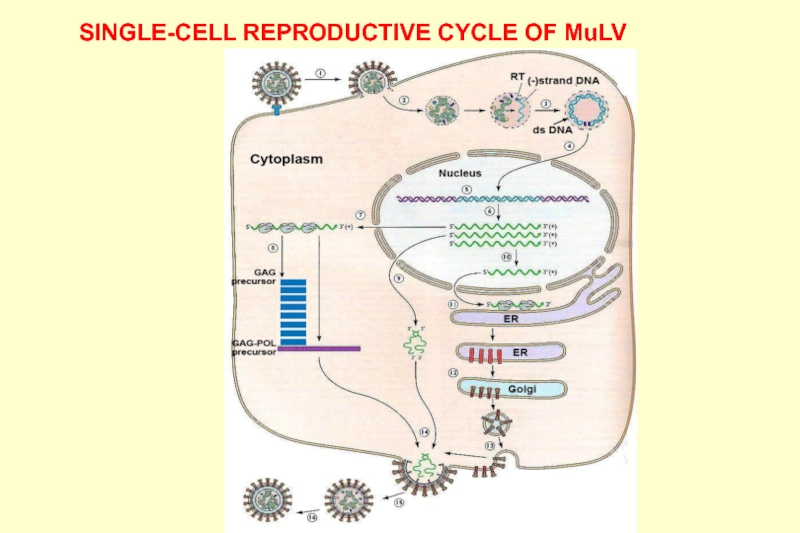
- 14. SINGLE-CELL REPRODUCTIVE CYCLE OF MuLV
- 15. Организация белков оболочки различных ретровирусов
- 16. RNA-genome of an infectious retrovirus
- 17.
- 18.
- 19.
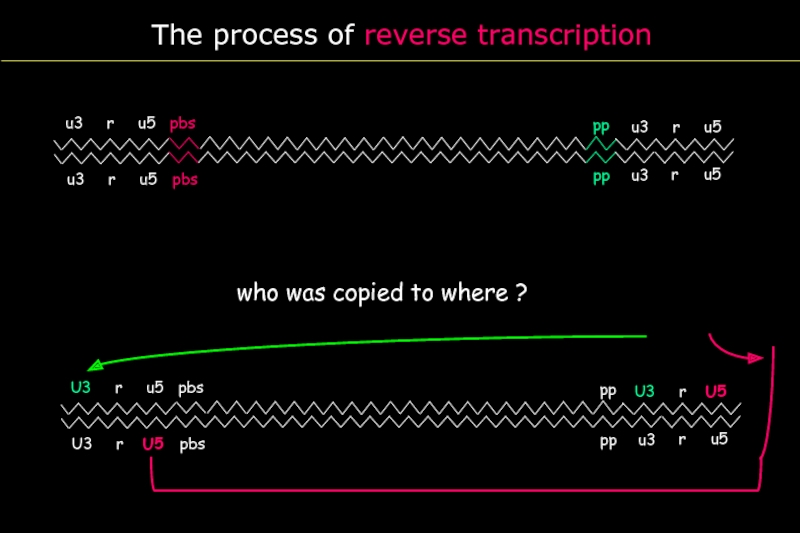
- 20. The process of reverse transcription u3
- 21. The process of reverse transcription who was copied to where ?
- 22. Схема обратной транскрипции
- 23. Genomic organization of murine retroviruses
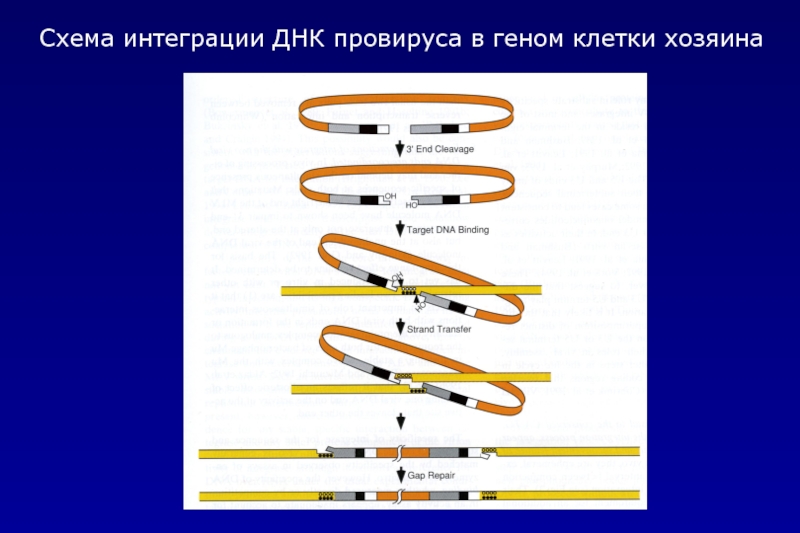
- 24. Схема интеграции ДНК провируса в геном клетки хозяина
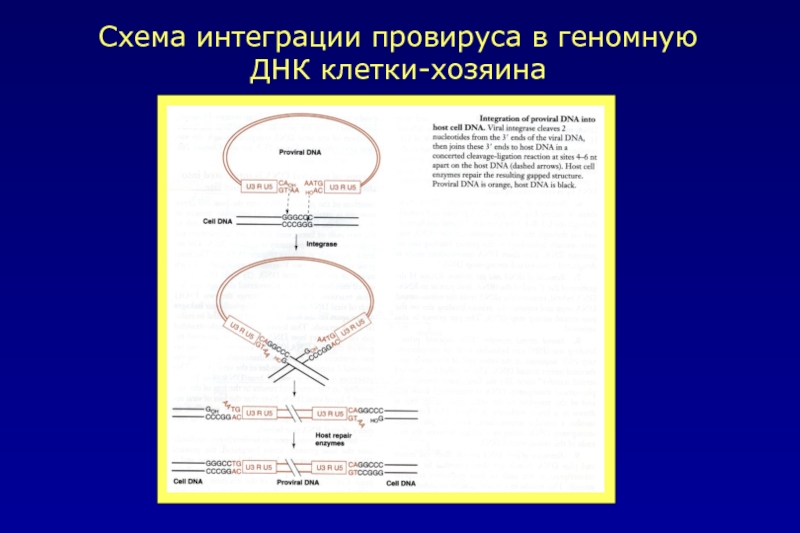
- 25. Схема интеграции провируса в геномную ДНК клетки-хозяина
- 26. Образование молекул РНК простого ретровируса
- 27. Transcriptional control of MoMLV integrated provirus (Moloney Murine Leukemia Virus, MoMLV)
- 28. Gene expression of simple retroviruses
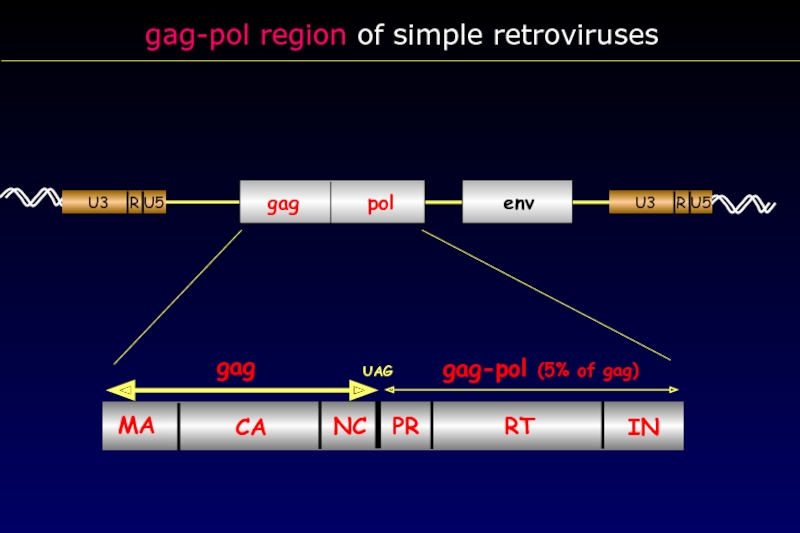
- 29. gag-pol region of simple retroviruses
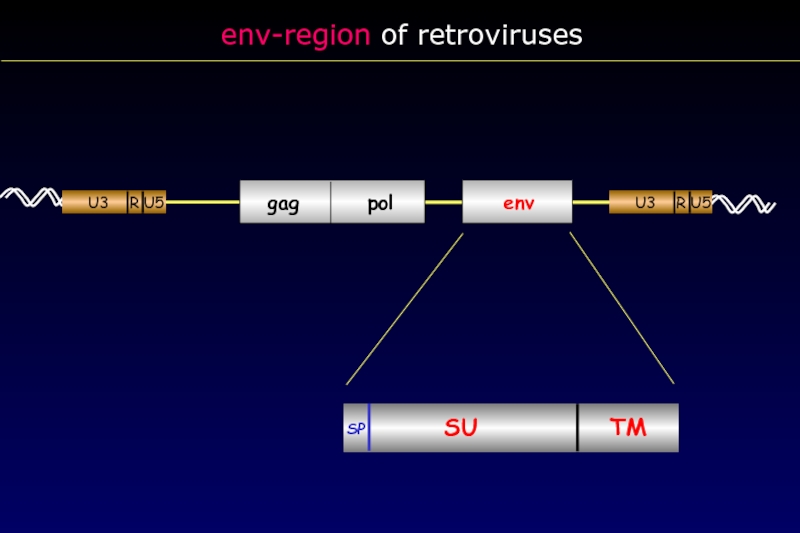
- 30. env-region of retroviruses
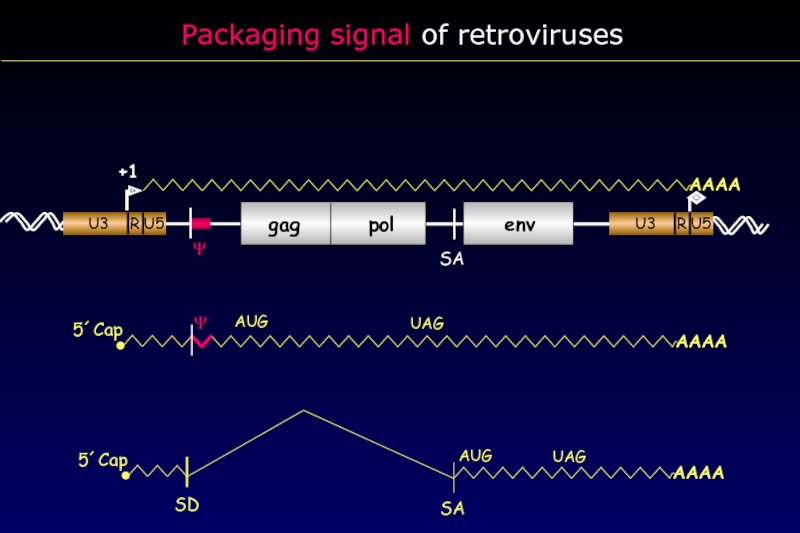
- 31. Packaging signal of retroviruses 5´Cap AUG
- 32. Смена рамки считывания, реализуемая при трансляции РНК
- 33. Геномная организация РНК трансформирующих вирусов
- 34. Лентивирусы – возбудители медленных инфекций
- 35. morphology of a retrovirus (HIV1, a lentivirus)
- 36. Схематическое изображение вирусной частицы HIV-1
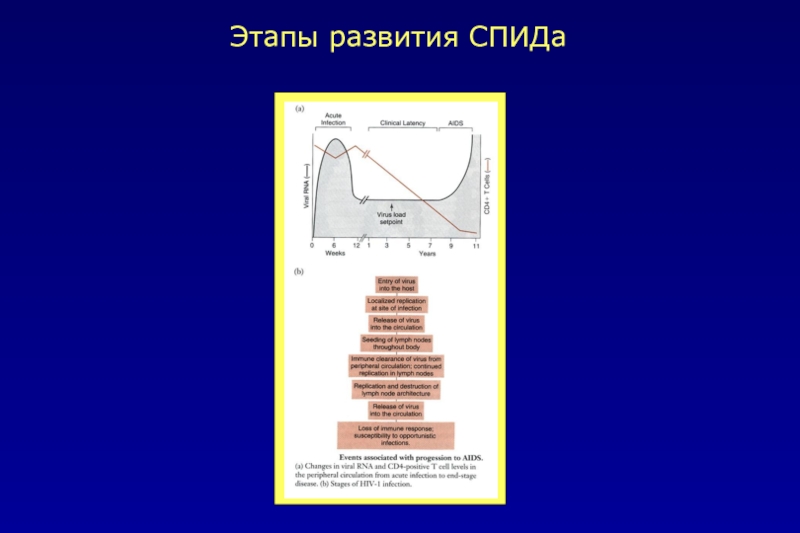
- 37. Этапы развития СПИДа
- 38. Лентивирусы млекопитающих
- 39. Структура генома и схема сплайсинга РНК HIV-1
- 40. Структурные белки HIV-1
- 41. Неструктурные белки HIV-1
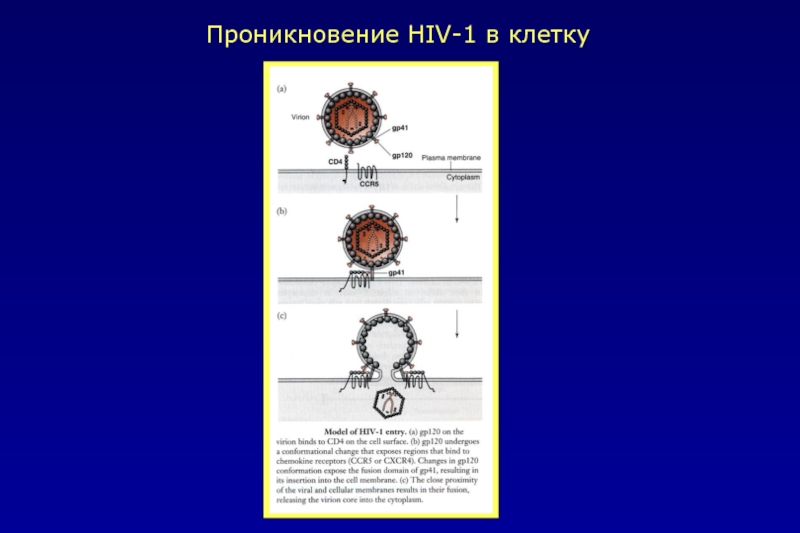
- 42. Проникновение HIV-1 в клетку
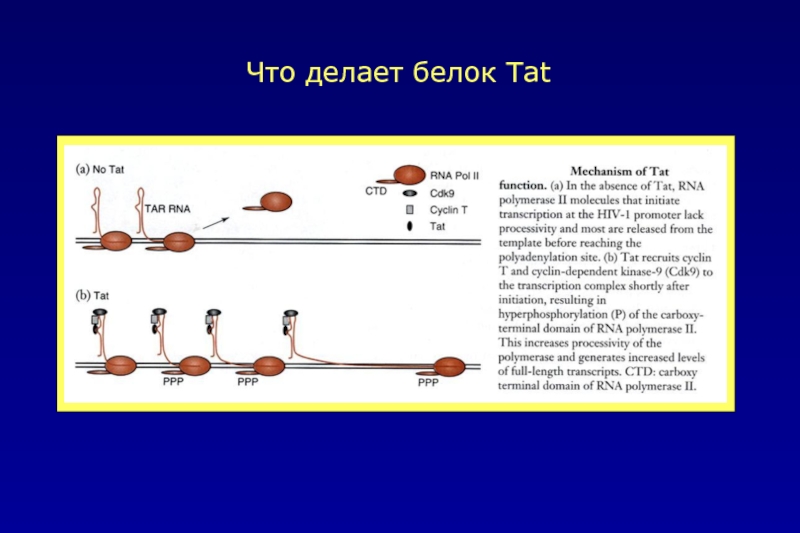
- 43. Что делает белок Tat
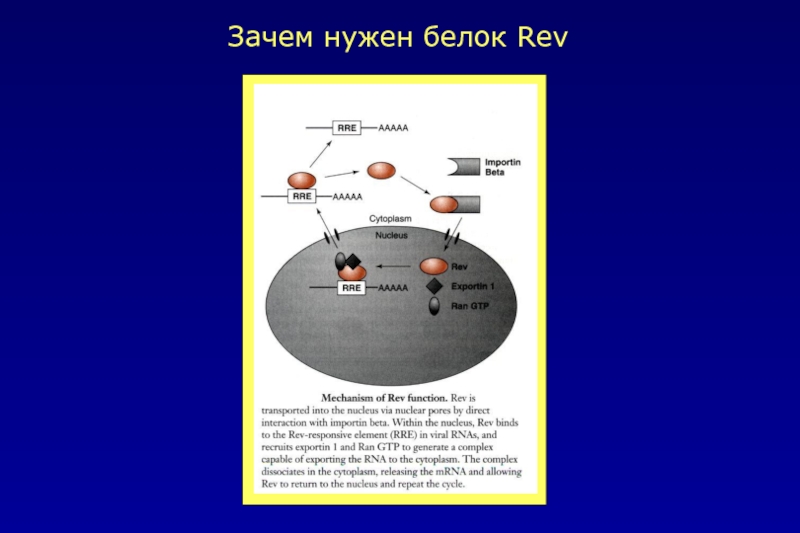
- 44. Зачем нужен белок Rev
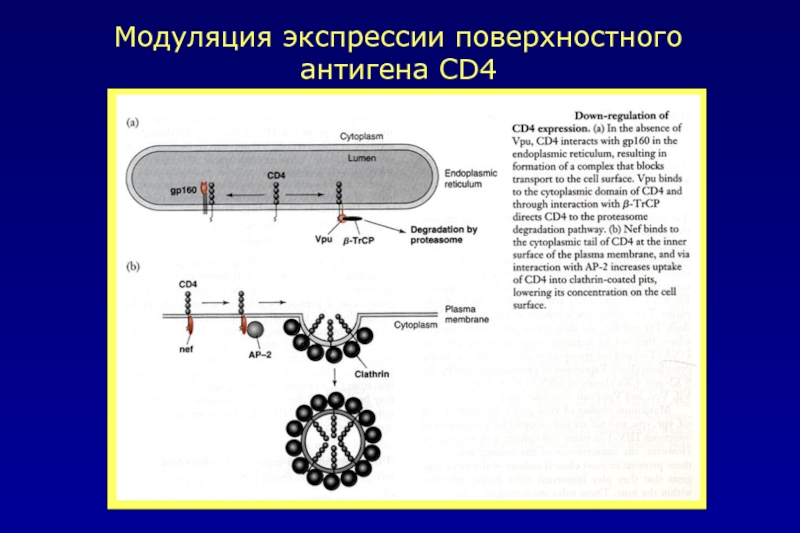
- 45. Модуляция экспрессии поверхностного антигена CD4
- 46. Функции вирусных белков 1.Белок Tat увеличивает транскрипцию
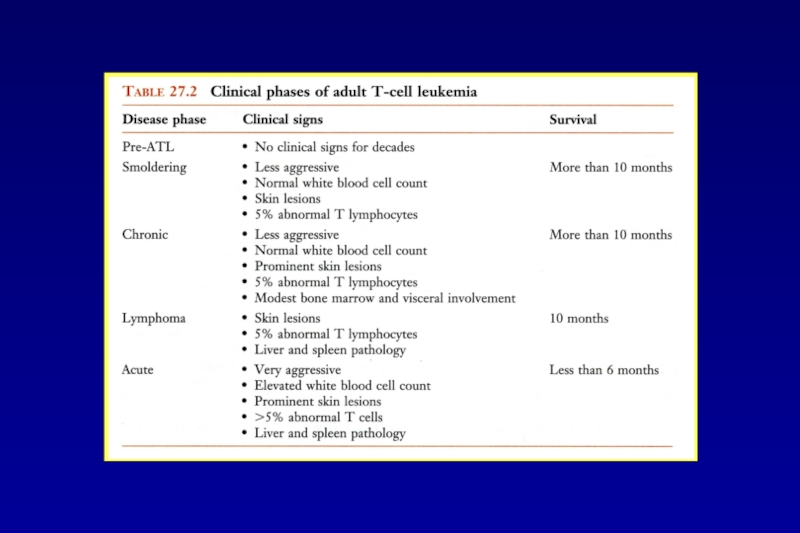
- 47. Вирус Т-клеточного лейкоза 1 типа человека
- 48. Синтез регуляторных белков HTLV-1 направляется дважды сплайсированными РНК
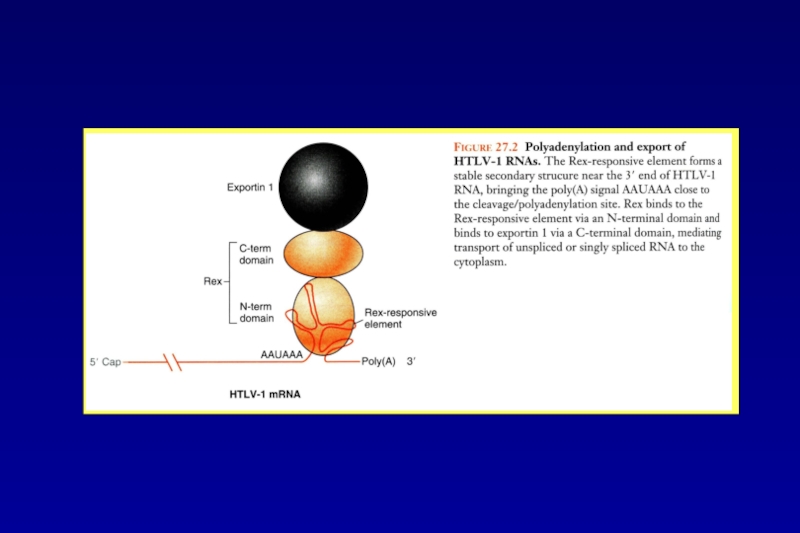
- 49. Полиаденилирование и экспорт РНК HTLV-1
- 50. Белок Tax активирует транскрипцию РНК HTLV-1
- 51. Клеточные гены, активируемые вирусным белком Tax
- 60. The concept of Gene Therapy
- 61. Необходимые свойства эффективной системы переноса и экспрессии
- 62. Выбор метода переноса и экспрессии целевых генов
- 63. Выбор метода переноса и экспрессии целевых генов (продолжение)
- 64.
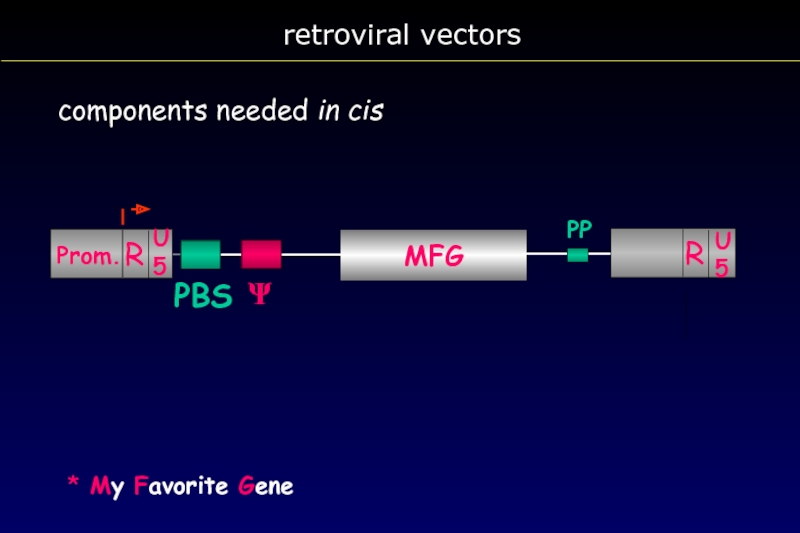
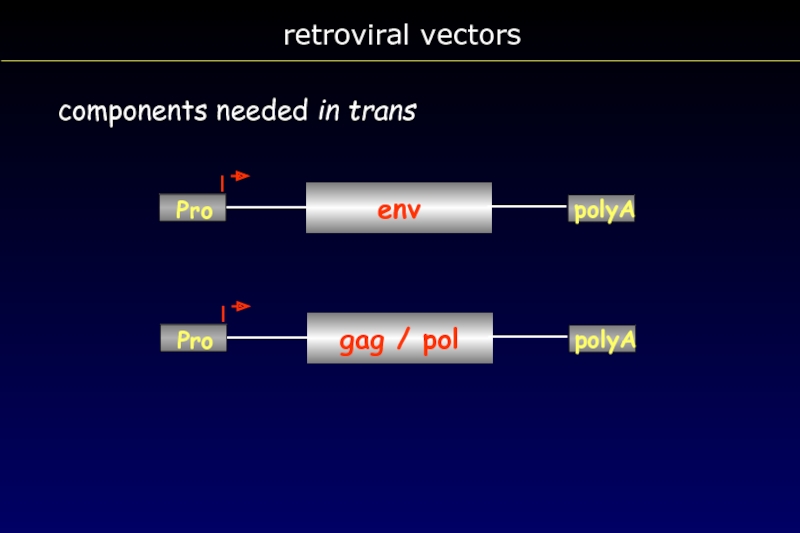
- 65. retroviral vectors components needed in trans
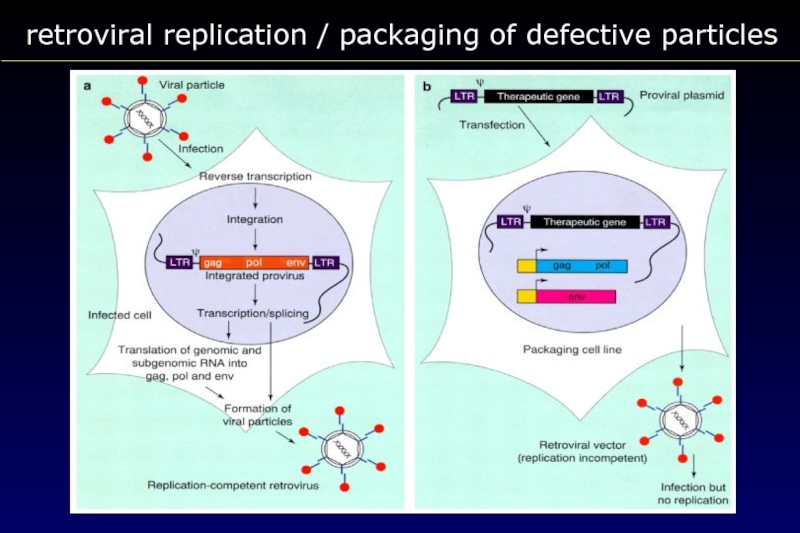
- 66. retroviral replication / packaging of defective particles
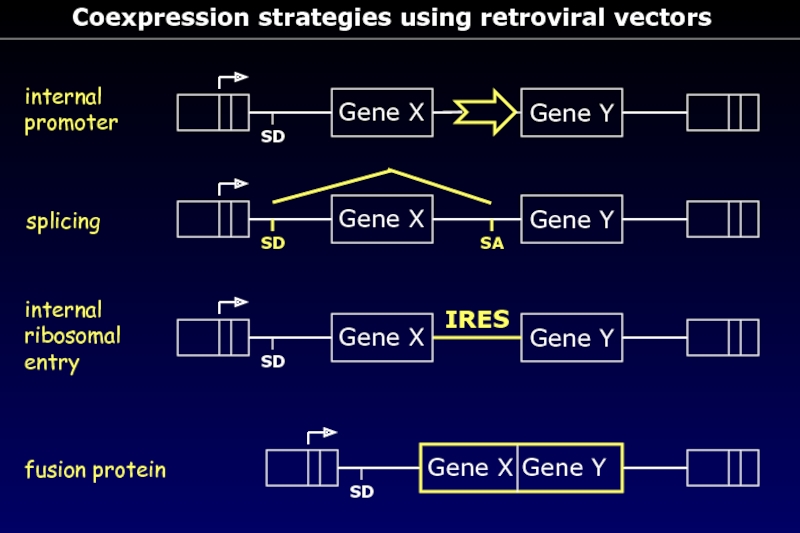
- 67. Coexpression strategies using retroviral vectors
- 68. Utilized coexpression strategies HoxB4
- 69. Calculation of retroviral titers („GFP-Transfer Units“) ->
- 70. Titers of retroviral expression vectors
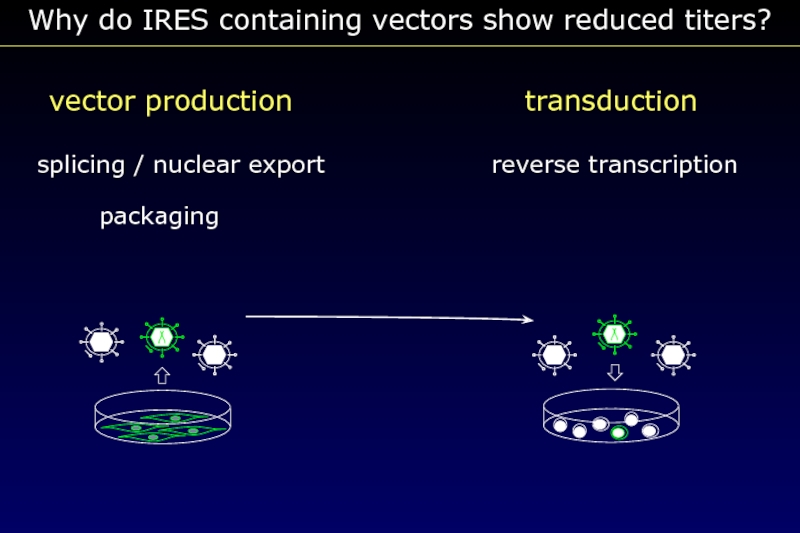
- 71. vector production transduction splicing /
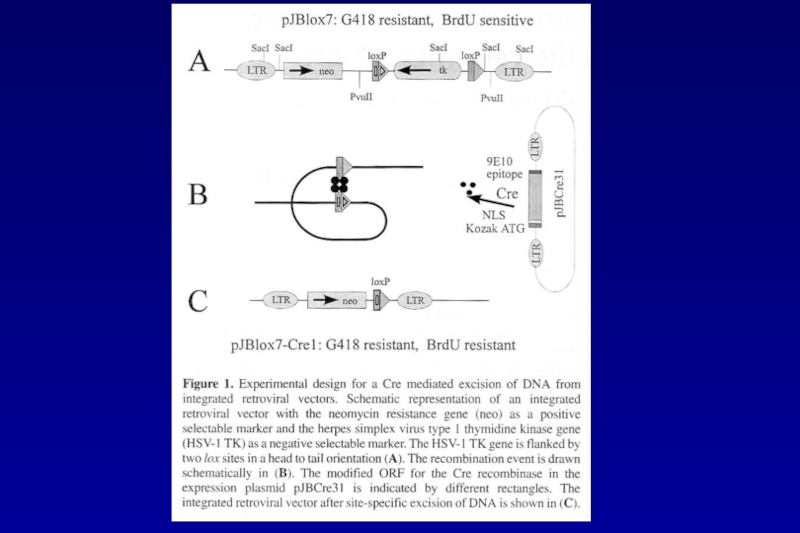
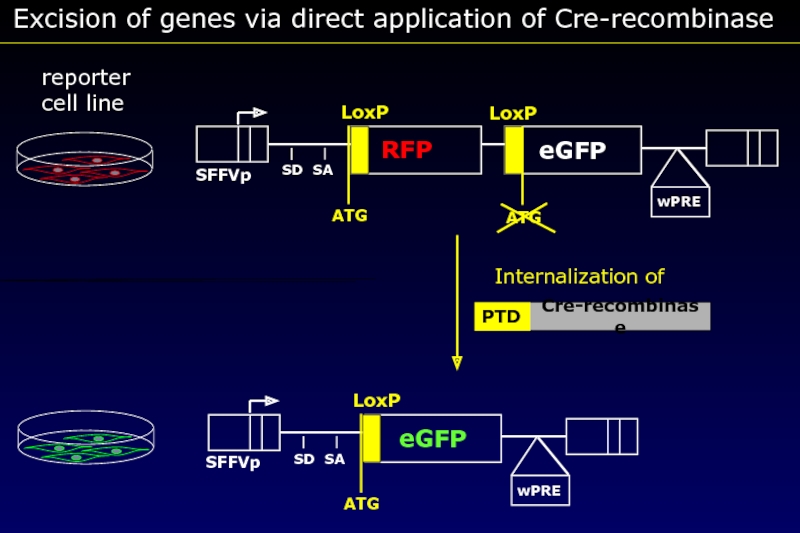
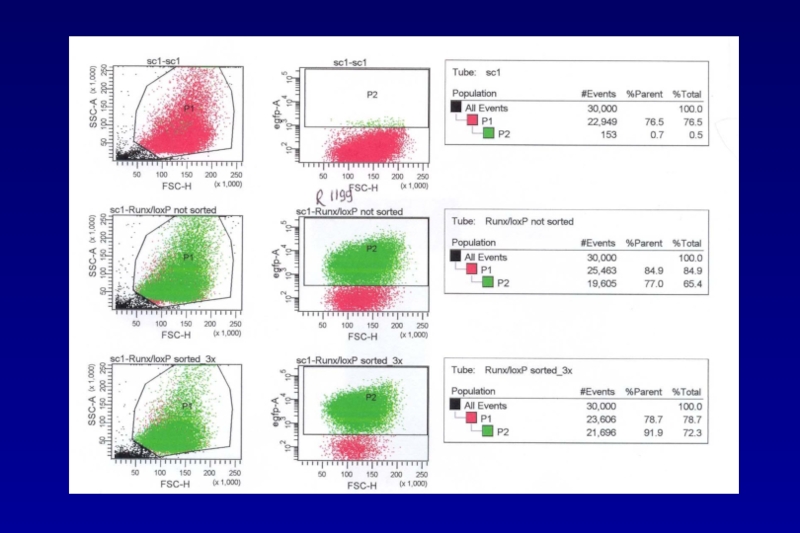
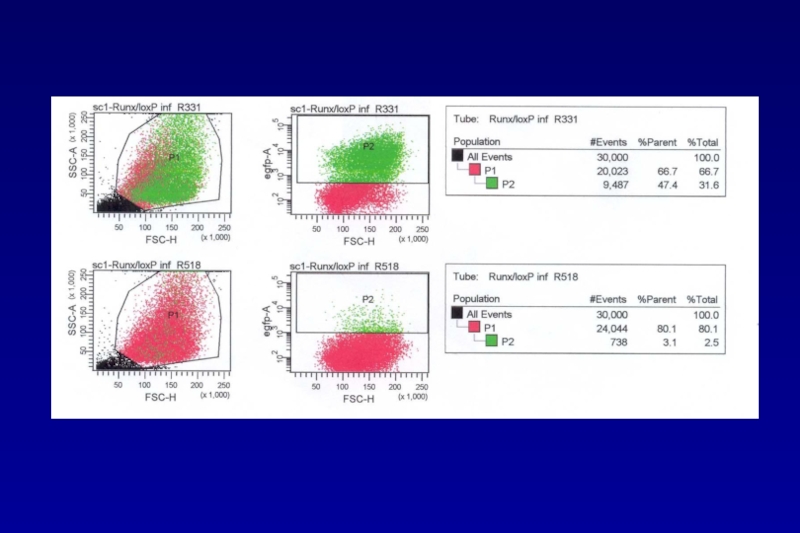
- 73. Excision of genes via direct application of Cre-recombinase reporter cell line
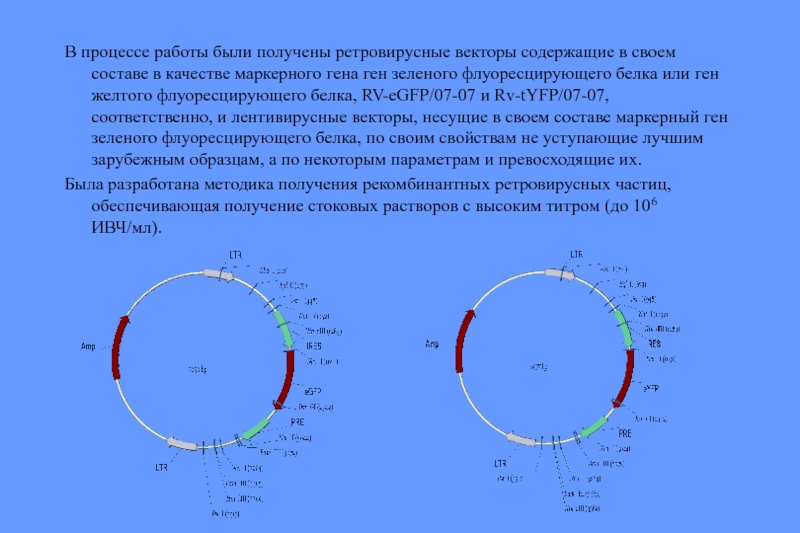
- 76. В процессе работы были получены ретровирусные векторы
- 77. (А) и трансфицированные (В) клетки 293
- 78. Кинетика продукции ретровирусного вектора RV-GFP/07-07 упаковывающими клетками
- 79. Кинетика продукции ретровирусного вектора RV-GFP/07-07 упаковывающими клетками
- 80. Создание клеток продуцентов (перевиваемых фибробластов мыши) секретируемого
- 81. Продукция гормона роста человека перевиваемыми клетками мыши
- 82. Физическая карта модульного лентивирусного вектора pLPL-mCMV-H4puro Индукция
- 83. Схема конструкции для экспрессии зеленого флуоресцентного белка
- 84. Испытание лентивирусного вектора pLCMV для стабильной экспрессии
- 85. Retroviral vectors most commonly used gene transfer
- 86. Possible mechanisms of (retroviral) insertional mutagenesis gene
- 87. ... theoretical risk assessment Starting cell
- 88. Схематическое изображение структурно-функциональных изменений ретровирусного вектора, приводящих
- 89. Env protein Transmembrane Domain TM Surface Protein
- 90. Neuropathology of DDD mice infected with Mo-AmphoV
- 94. M813 expression slightly interferences with ecotropic MuLV infection but not with other MuLVs
- 95. А) PA 317 cells incubated with M813
- 96. Selection with Geneticin Target Cells
- 97. Marker-rescue assay (A) Cell with integrated provirus
- 98. Marker-rescue assay (B)
- 99. M813 Does Not Use mCAT1
- 101. M813 SU Sequences Dictate Receptor Usage MoMuLV MoM813 M813
- 102. Hamster Cells Murine
- 103. promising candidate gene on Chr. 16:
- 104. Expression of mSMIT1 in Human Cells Imparts
- 105. M813 Induces Syncytia Formation in Cells Expressing
- 106. M813 belongs to a unique receptor
- 107. Acknowledgments Dmitry Ivanov, Pavel Spirin, Tamara
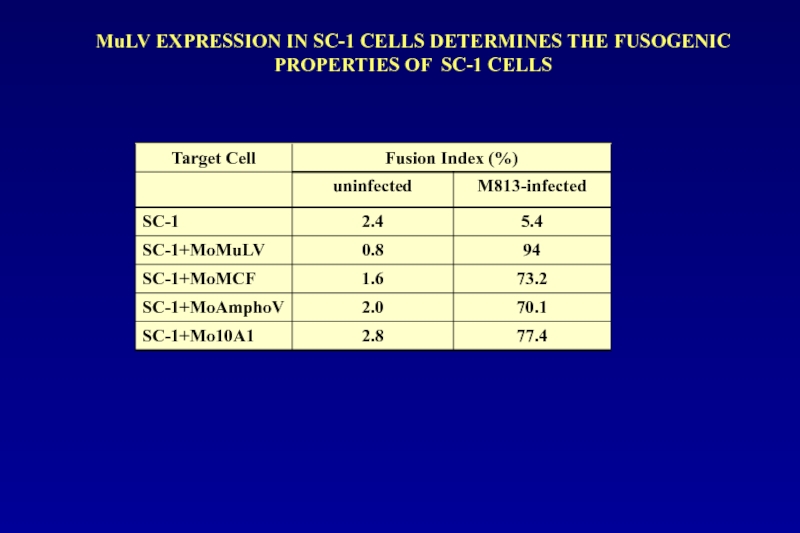
- 108. MuLV EXPRESSION IN SC-1 CELLS DETERMINES THE FUSOGENIC PROPERTIES OF SC-1 CELLS
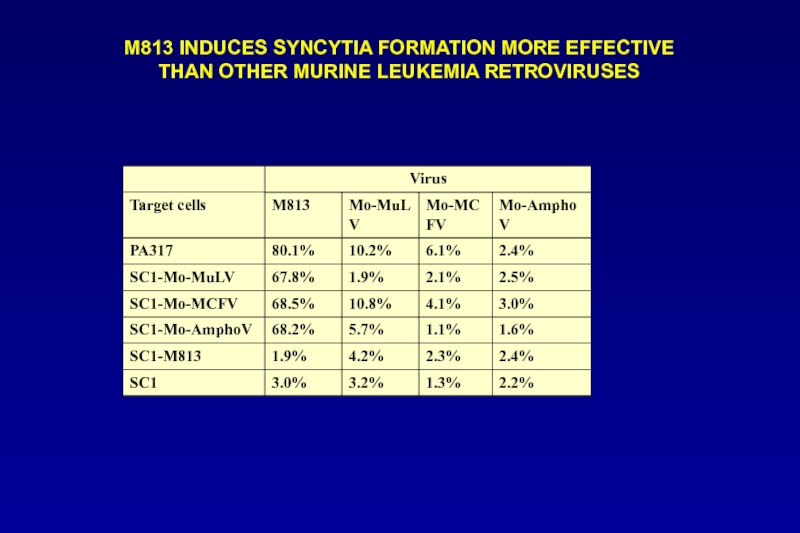
- 109. М813 INDUCES SYNCYTIA FORMATION MORE EFFECTIVE THAN OTHER MURINE LEUKEMIA RETROVIRUSES
- 110. Fusion index (FI) = (N - S)/T
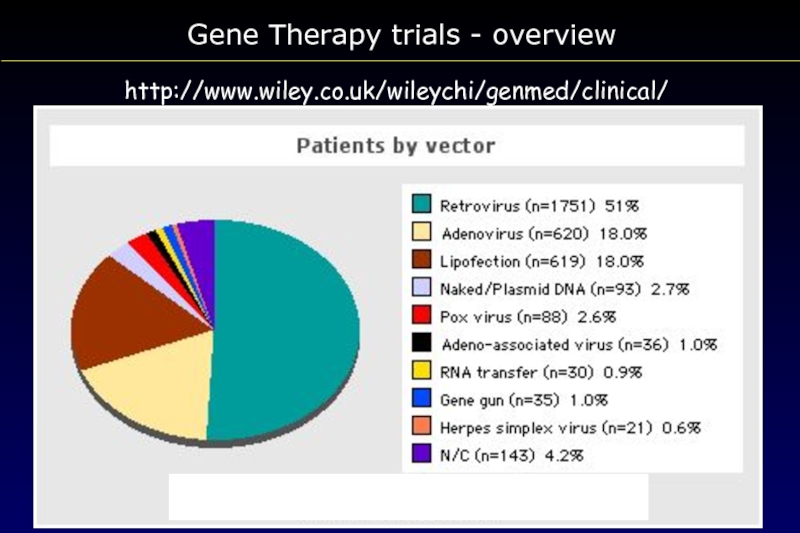
- 111. Gene Therapy trials - overview http://www.wiley.co.uk/wileychi/genmed/clinical/
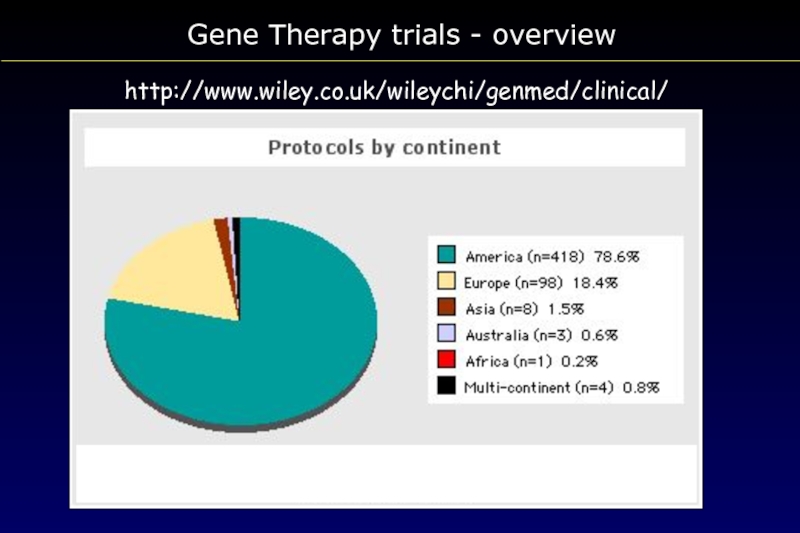
- 112. Gene Therapy trials - overview http://www.wiley.co.uk/wileychi/genmed/clinical/
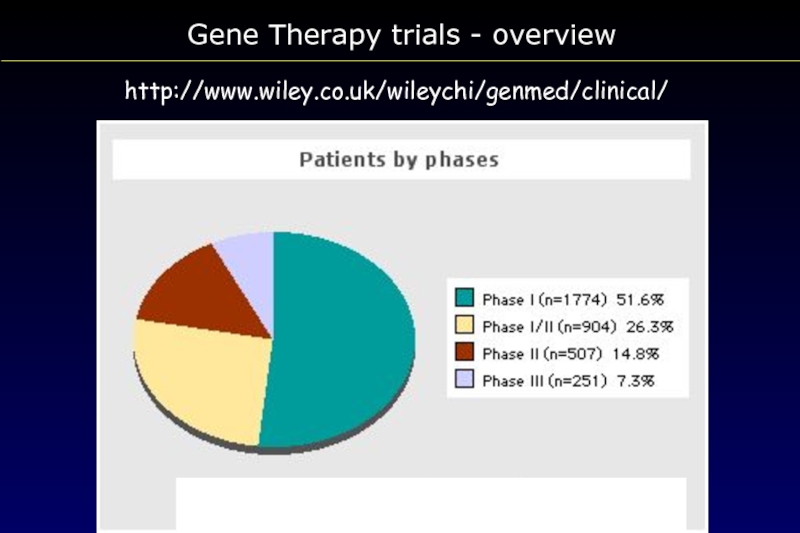
- 113. Gene Therapy trials - overview http://www.wiley.co.uk/wileychi/genmed/clinical/
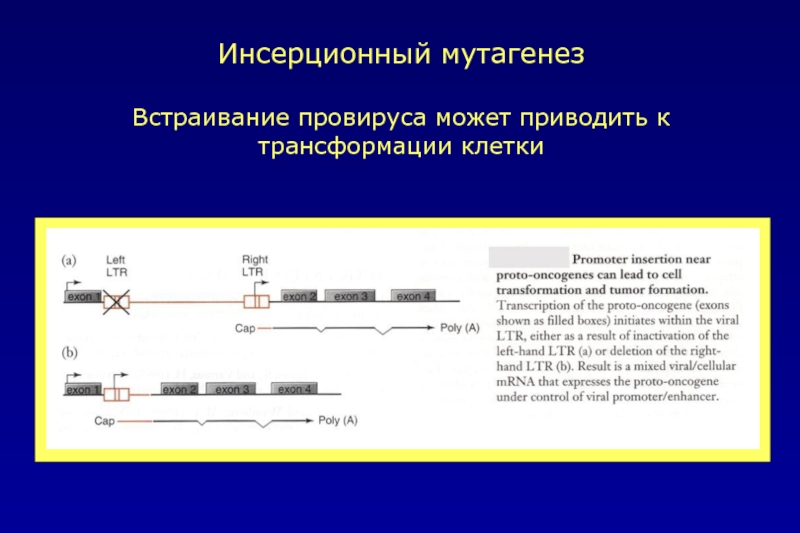
- 114. Инсерционный мутагенез Встраивание провируса может приводить к трансформации клетки
- 115. Открытие вирусов 1892 год Д.И.Ивановский –
Слайд 1Ретровирусы и ретровирусные векторы
МГУ
В.С. Прасолов
Институт молекулярной биологии им. В.А. Энгельгардта РАН
Лаборатория
Слайд 2Открытие вирусов
1892 год
Д.И.Ивановский – инфекционный фильтрующийся агент, вызывающий табачную мозаику.
1898
M.Beijerinck - “contagium vivum fluidum”.
Loeffler & Frosch – foot-and- mouth disease
1908 год
Ellerman & Bang – ALV
1911 год
P.Rous - RSV
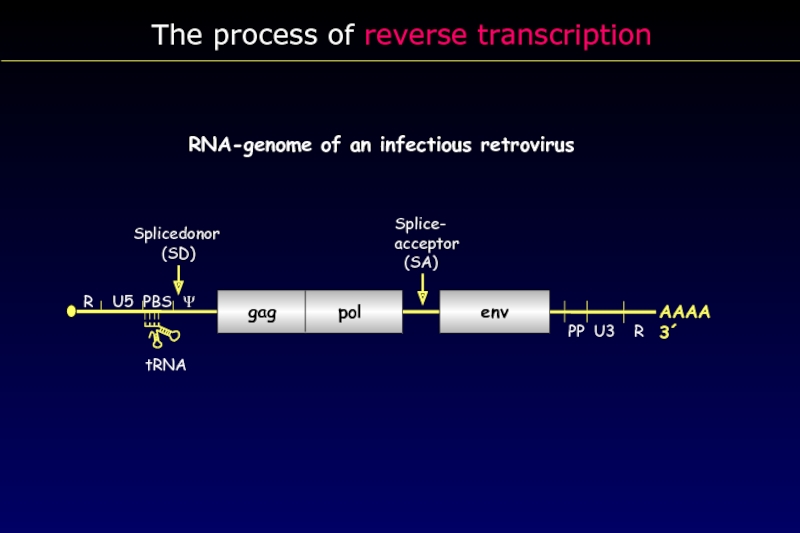
Слайд 16 RNA-genome of an infectious retrovirus
tRNA
gag
env
Splicedonor
(SD)
Splice-
acceptor
(SA)
Ψ
R U5 PBS
PP U3 R
AAAA 3´
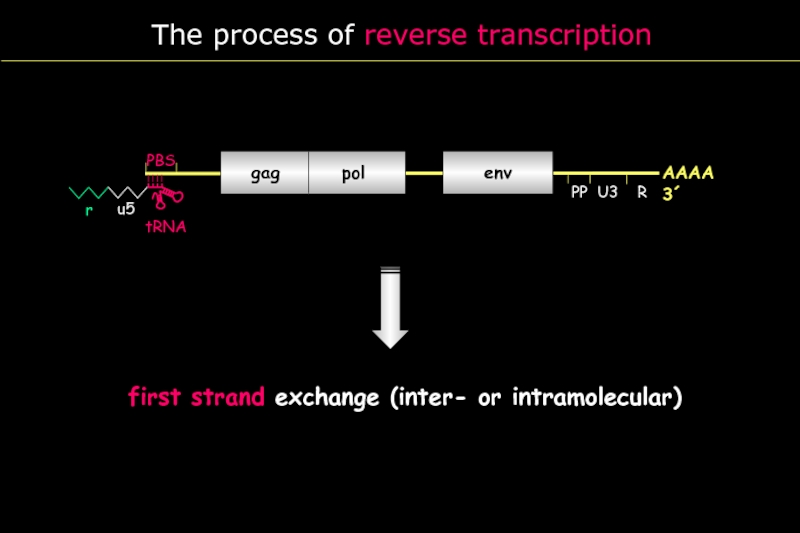
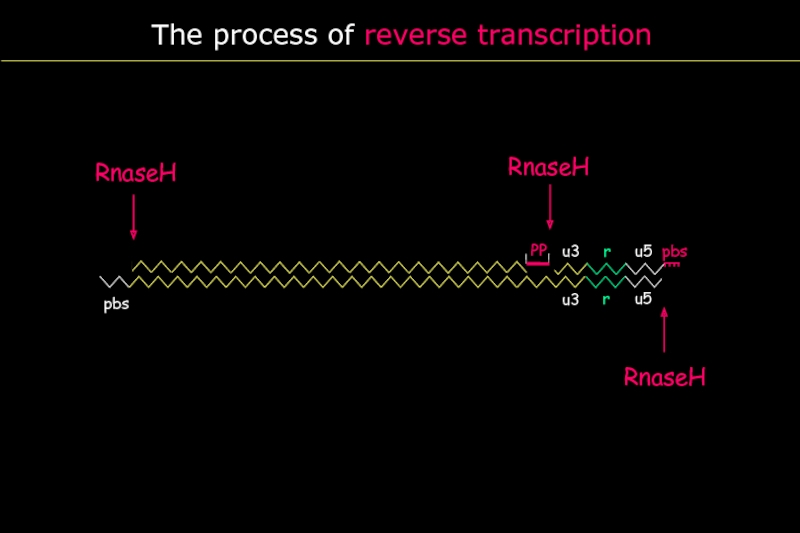
The process of reverse transcription
Слайд 46Функции вирусных белков
1.Белок Tat увеличивает транскрипцию провирусного генома HIV-1,
стимулируя элонгаторную активность
2.Белок Rev1 способствует транспорту в цитоплазму вирусных информационных РНК, кодирующих структурные белки HIV-1. Tat и Rev белки в значительной степени стимулируют синтез вирусных белков.
3.Белок Vif увеличивает инфекционность вируса HIV-1, взаимодействуя с клеточной дезоксицитидин дезаминазой. (Vif, присоединяясь к клеточной дезаминазе CEM15 индуцируя убиквитинизацию и последующую деградацию этого фермента протеосомами).
4. Белок Vpr важен для переноса преинтеграционного комплекса HIV-1 из цитоплазмы в ядро.
5. Белок Vpu усиливает выход вирусного потомства из заражённой клетки.
6. Белок Nef – важный медиатор патогенеза (Nef снижает уровень экспрессии белков CD4 и MHC на поверхности клетки. Влияет на инфекционность вируса и изменяет сигнальные пути: взаимодействие Nef c src-родственными киназами lyn и hck, приводит к их активации. А взаимодействие Nef с lyc и fyn приводит к их подавлению. Активация hck приводит к увеличению экспрессии в T клетках ряда цитокинов и хемокинов, что в свою очередь увеличивает репликацию HIV-1 и привлекает больше T-клеток к очагу заражения)
Слайд 61Необходимые свойства эффективной системы переноса и экспрессии гена
Высокая эффективность переноса выбранного
Простота и высокая воспроизводимость метода трансдукции
Стабильная экспрессия внесённого гена
Возможность направленной регуляции экспрессии
Регулируемый тропизм (способность избирательно вносить экспрессируемые гены в клетки определённых типов)
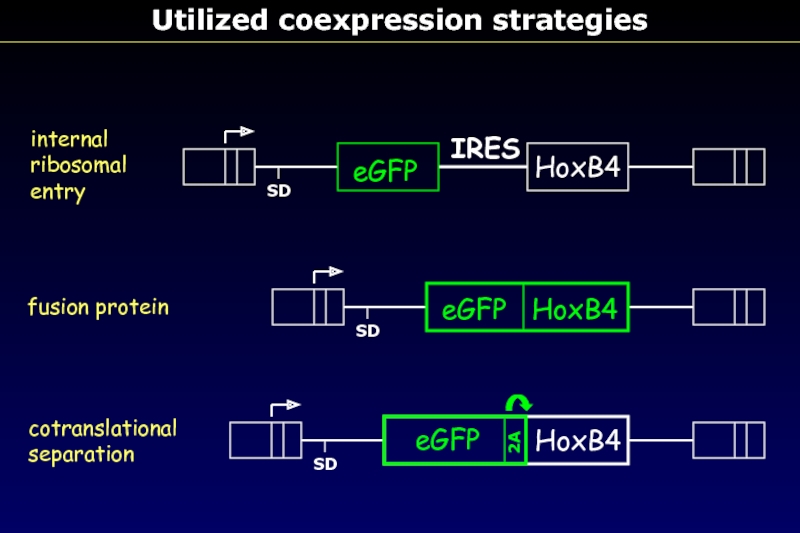
Слайд 68Utilized coexpression strategies
HoxB4
eGFP
SD
internal
ribosomal
entry
IRES
fusion protein
eGFP HoxB4
SD
eGFP
SD
HoxB4
2A
cotranslational
separation
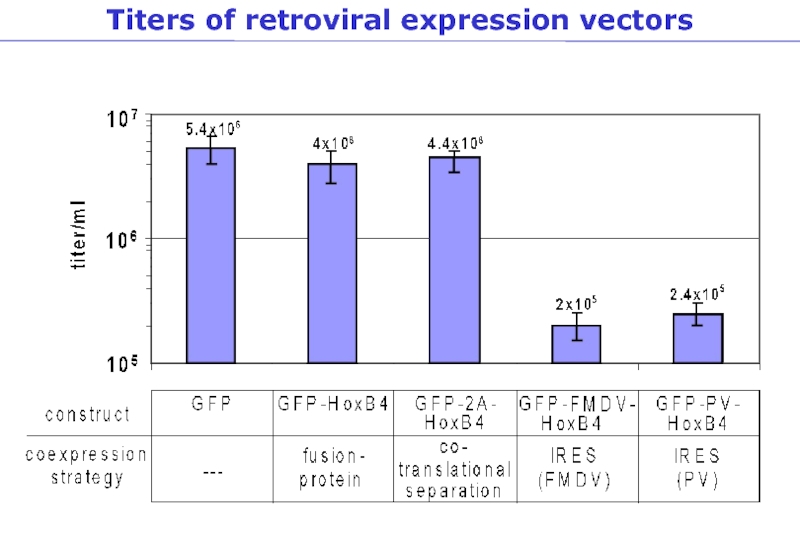
Слайд 69Calculation of retroviral titers („GFP-Transfer Units“)
-> % GFP positive cells x
Слайд 76В процессе работы были получены ретровирусные векторы содержащие в своем составе
Была разработана методика получения рекомбинантных ретровирусных частиц, обеспечивающая получение стоковых растворов с высоким титром (до 106 ИВЧ/мл).
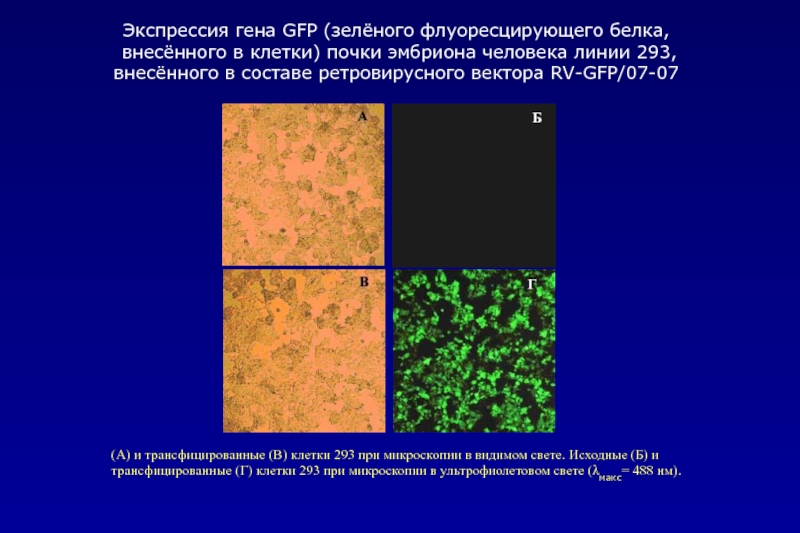
Слайд 77
(А) и трансфицированные (В) клетки 293 при микроскопии в видимом свете.
Экспрессия гена GFP (зелёного флуоресцирующего белка,
внесённого в клетки) почки эмбриона человека линии 293, внесённого в составе ретровирусного вектора RV-GFP/07-07
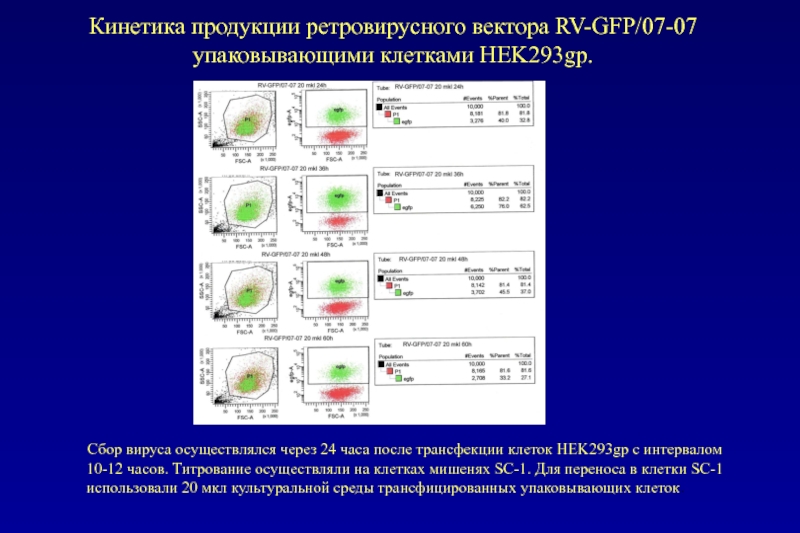
Слайд 78Кинетика продукции ретровирусного вектора RV-GFP/07-07 упаковывающими клетками HEK293gp.
Слайд 79Кинетика продукции ретровирусного вектора RV-GFP/07-07 упаковывающими клетками HEK293gp.
Для
Слайд 80Создание клеток продуцентов (перевиваемых фибробластов мыши) секретируемого гормона роста человека с
Карта ретровирусного вектора R-hGH-IRES-eGFP
Слайд 81Продукция гормона роста человека перевиваемыми клетками мыши линии SC1, трансдуцированных ретровирусным
Электрофоретической разделение в полиакриламидном геле в динатурирующих условиях зрелого гормона роста человека, полученного из культуральной среды трансгенных клеток, геном которых содержит интегрированный рекомбинантный вектор R-hGH-IRES-eGFP при помощи иммуносорбентной колонки (1) и зрелого гормона роста человека, полученного из клеток E.coli (3), (2)-маркёрные белки. Концентрация зрелого гормона роста человека, в кондиционированной среде трансгенных клеток SC1 составляла 5-8 мкг/мл.
Слайд 82Физическая карта модульного лентивирусного вектора pLPL-mCMV-H4puro
Индукция синтеза бета-галактозидазы в перевиваемых клетках
Перенос целевых генов в клетки человека с помощью лентивирусного вектора pLPL-mCMV-H4puro
Слайд 83Схема конструкции для экспрессии зеленого флуоресцентного белка с локализацией в эндоплазматическом
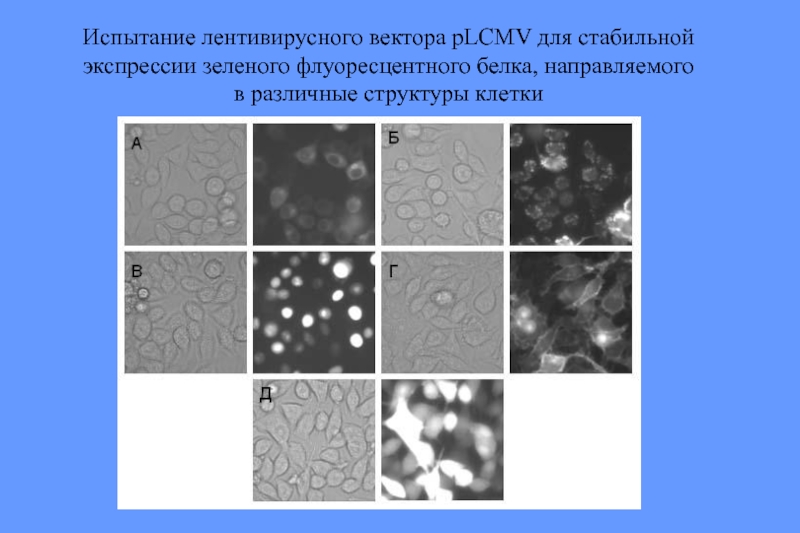
Дополнительно, для направления продуктов в определенные структуры клетки в область, примыкающую к промотору CMV и участку клонирования введены последовательности, кодирующие N-концевые пептиды – сигналы внутриклеточной локализации. Эти сигналы включают: пептид кальретикулина, отвечающий за локализацию в эндоплазматическом ретикулуме, пептид нейромодулина, направляющий белки в плазматическую мембрану, и пептид цитохром С оксидазы, направляющий белок в митохондрии.
Компартмент адрессованная экспрессия генов целевых белков, направляемая лентивирусным вектором.
Слайд 84Испытание лентивирусного вектора pLCMV для стабильной экспрессии зеленого флуоресцентного белка, направляемого
Слайд 85Retroviral vectors
most commonly used gene transfer system in gene therapy
genome integration
BUT
any genome integration may be associated with insertional mutagenesis
(... which may in the worst case lead to malignant transformation)
Слайд 86Possible mechanisms of (retroviral) insertional mutagenesis
gene X
5‘LTR
3‘LTR
1
2
3
4
5
7
LCR
Enhancer
Promotor
Terminator
Exons
Intron
Exons
MAR
Integration
6
4 & 5: Change of
1 & 7: Alteration
of gene control regions
2 & 3: Direct promotor, enhancer
or silencer activity
6: Influence
on RNA stability
... at least some of these mechanisms do occur !!!
Слайд 87... theoretical risk assessment
Starting cell number: 108
Target cell number: 1x109
Transduction efficiency: 25-30% ? 3 x 107 insertions
Genome size: 3 x 109 bp
Random integration would statistically result
in one insertion every 100 bp!!!
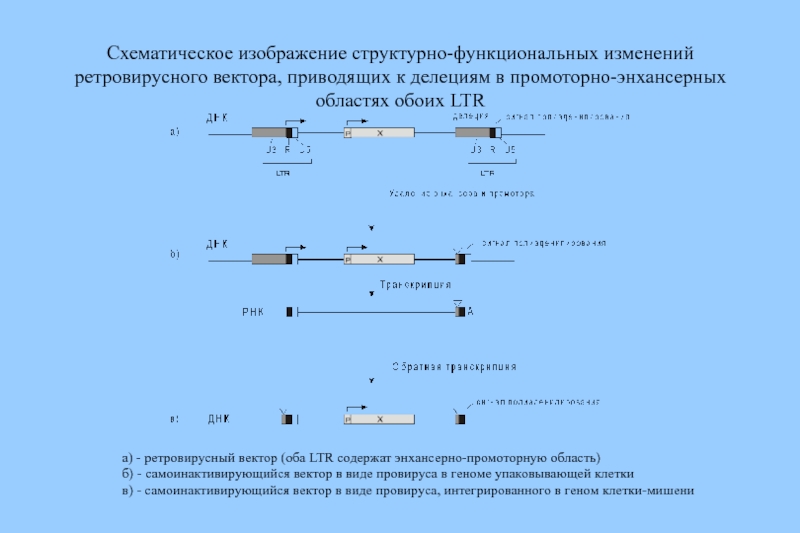
Слайд 88Схематическое изображение структурно-функциональных изменений ретровирусного вектора, приводящих к делециям в промоторно-энхансерных
а) - ретровирусный вектор (оба LTR содержат энхансерно-промоторную область)
б) - самоинактивирующийся вектор в виде провируса в геноме упаковывающей клетки
в) - самоинактивирующийся вектор в виде провируса, интегрированного в геном клетки-мишени
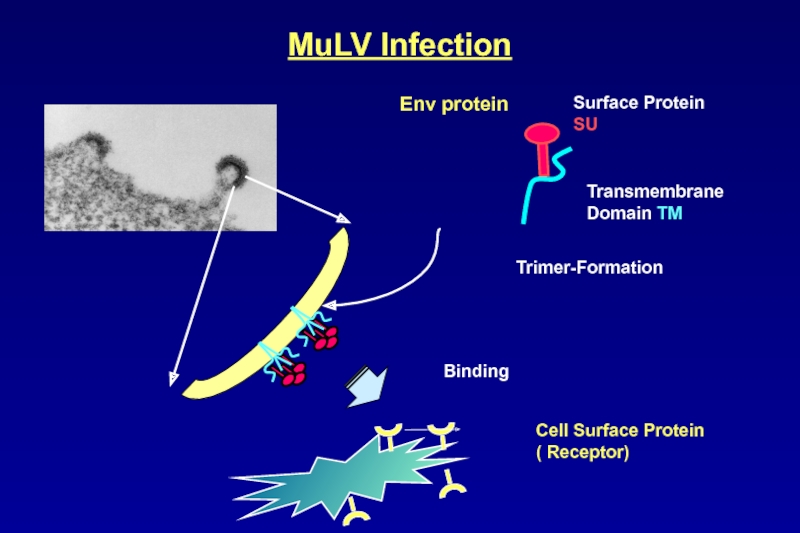
Слайд 89Env protein
Transmembrane Domain TM
Surface Protein
SU
Cell Surface Protein
( Receptor)
Binding
Trimer-Formation
MuLV Infection
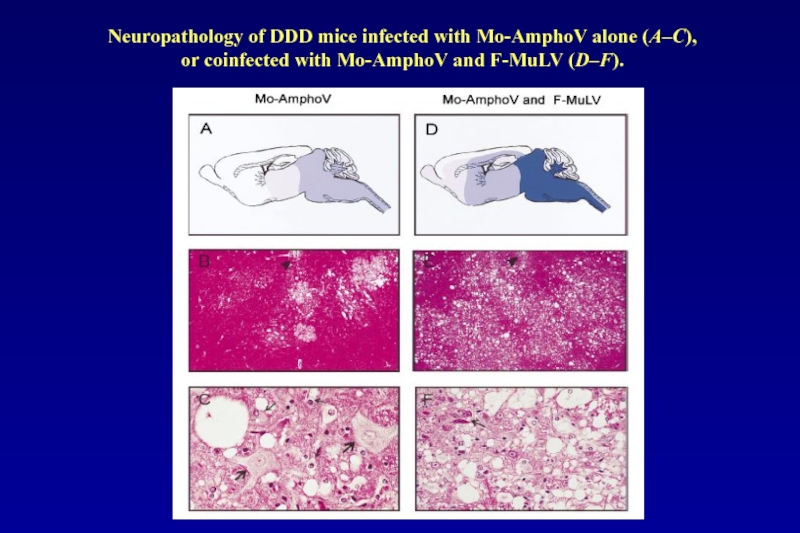
Слайд 90Neuropathology of DDD mice infected with Mo-AmphoV alone (A–C),
or coinfected
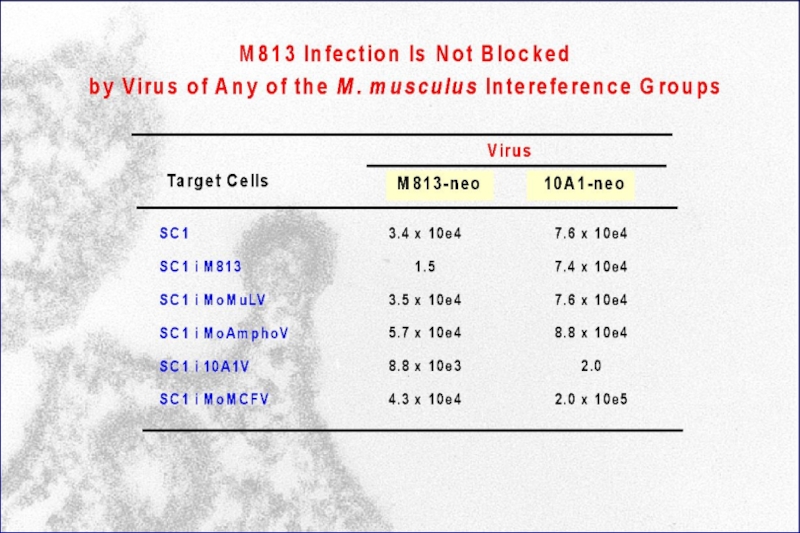
Слайд 94M813 expression slightly interferences with
ecotropic MuLV infection but not with
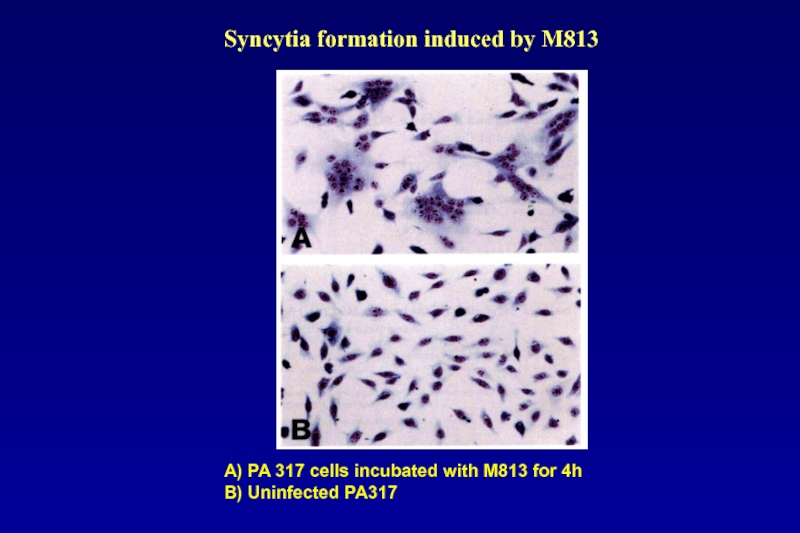
Слайд 95А) PA 317 cells incubated with M813 for 4h
B) Uninfected
Syncytia formation induced by M813
Слайд 96
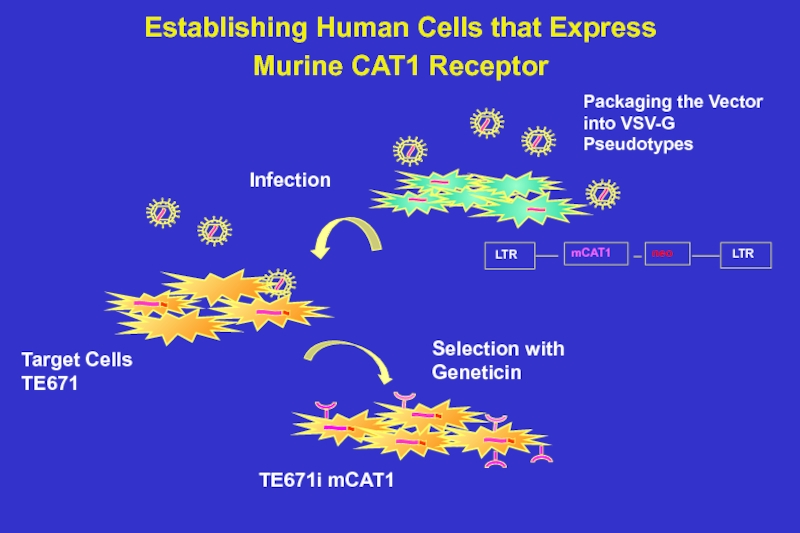
Selection with Geneticin
Target Cells
TE671
Infection
Packaging the Vector into VSV-G Pseudotypes
TE671i mCAT1
Establishing Human
Murine CAT1 Receptor
neo
LTR
LTR
mCAT1
Слайд 97Marker-rescue assay (A)
Cell with integrated provirus of replication
defective virus with marker
Infection by replication-competent
virus
Virus production
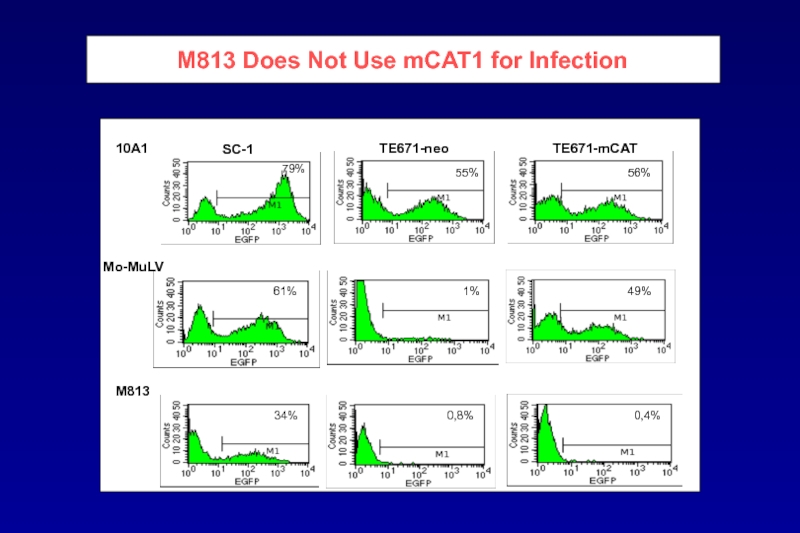
Слайд 99
M813 Does Not Use mCAT1 for Infection
SC-1
TE671-neo
TE671-mCAT
10A1
Mo-MuLV
M813
79%
55%
56%
49%
1%
61%
0,4%
0,8%
34%
Слайд 102
Hamster Cells
Murine Cells
Irradiation
Genome Fragmententation
Fusion + Selection
96 Hybrid Clones
Per clone: 31%
271 Markers
Infection M813eGFP
Positive ??
Mapping the common overlapping regions
Localisation of the M813 Receptor Gene
by Hybrid Cell Lines
16
16
16
16
16
Chromosome
Слайд 103
promising candidate gene on Chr. 16:
► Scl5A3 : multiple membrane spanning
Na+
myo-Inositol
Symporter
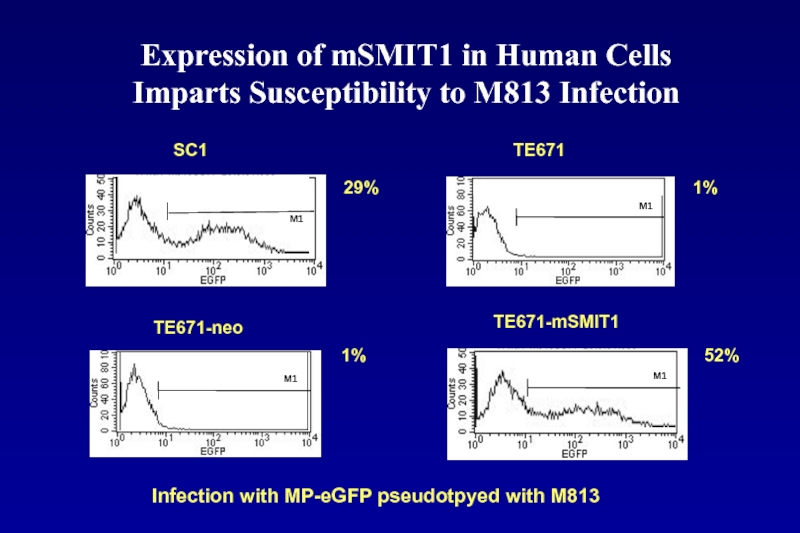
Слайд 104Expression of mSMIT1 in Human Cells
Imparts Susceptibility to M813 Infection
TE671-mSMIT1
52%
M1
SC1
M1
TE671-neo
1%
M1
TE671
1%
29%
M1
M1
Infection
Слайд 106 M813 belongs to a unique receptor interference group
M813
M813 uses the m SMIT1 protein as a receptor
M813 induces T-cell lymphoma associated with large
multinucleated cells
Summary
Слайд 107Acknowledgments
Dmitry Ivanov,
Pavel Spirin,
Tamara Semenova
Engelhardt Institute of Molecular Biology
Moscow, Russia
Sibyll Hein
Jürgen
Carol Stocking
Heinrich-Pette-Institute
Hamburg, Germany
This work was supported by grants from the Deustche
Forschungs-gemeinschaft (Sto 224) and Russian Foundation
of Basic Researches (02-04-49103 )
Слайд 110Fusion index (FI) = (N - S)/T
N – number of nuclei
S – number of syncytium
T – total number of nuclei
Over 500 nuclei were counted in each
experiment to obtain the FI value
Слайд 115Открытие вирусов
1892 год
Д.И.Ивановский – инфекционный фильтрующийся агент, вызывающий табачную мозаику.
1898
M.Beijerinck - “contagium vivum fluidum”.
Loeffler & Frosch – foot-and- mouth disease
1908 год
Ellerman & Bang – ALV
1911 год
P.Rous - RSV