- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Репродукция и дифференцировка клеток презентация
Содержание
- 1. Репродукция и дифференцировка клеток
- 3. Настоящее учебное пособие подготовлено в форме конспекта-презентации
- 4. ВВЕДЕНИЕ 1. Проблема репродукции и дифференциации клеток
- 5. Одним из постулатов в клеточной теории Т.
- 6. В то же время, уже в 1824
- 7. Однако Вирхов митоза не знал. Его видели,
- 8. 1879 – Вальтер Флемминг = первое верное
- 9. Лавина работ. «Ядро затмило цитоплазму». Особо отметим
- 10. Параллельно с морфологическими наблюдениями развиваются и биохимические.
- 11. 2. Актуальность новых исследований Кто и для
- 12. Частные гистофизиологические дисциплины. Особенно гематология и иммунология.
- 13. Аналитическая и препаративная химия, фармакология. Получение чистых
- 14. ТЕМА 1. КЛЕТОЧНЫЙ ЦИКЛ
- 15. Общая характеристика клеточного (митотического) цикла Опыты Говарда
- 16. Данные авторадиографии синтеза ДНК вскоре были подтверждены
- 17. 1960-е годы. Большая работа по определению пролиферативной
- 18. 2. Методы изучения клеточного цикла и пролиферативной
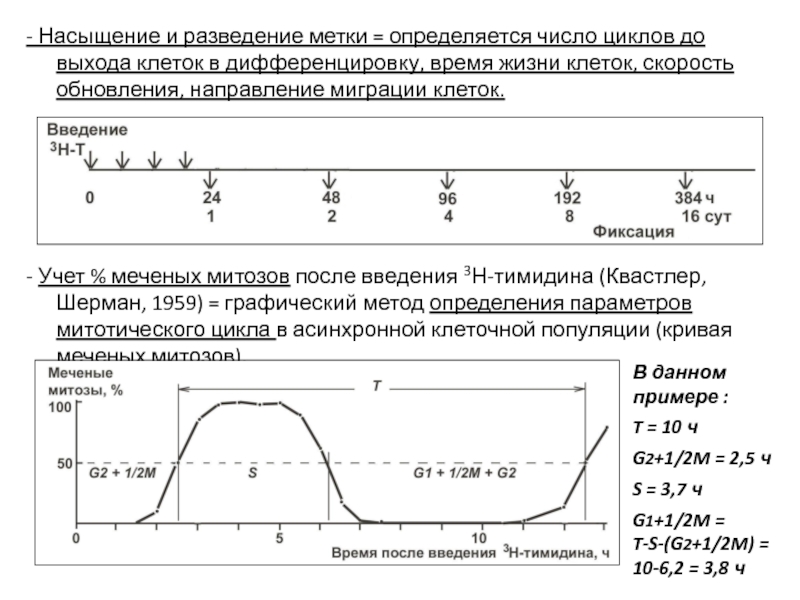
- 19. - Насыщение и разведение метки = определяется
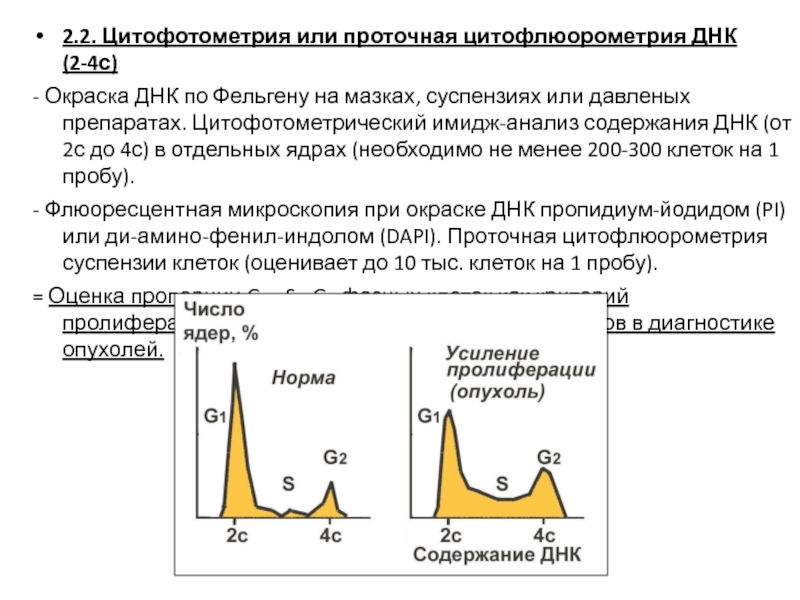
- 20. 2.2. Цитофотометрия или проточная цитофлюорометрия ДНК (2-4с)
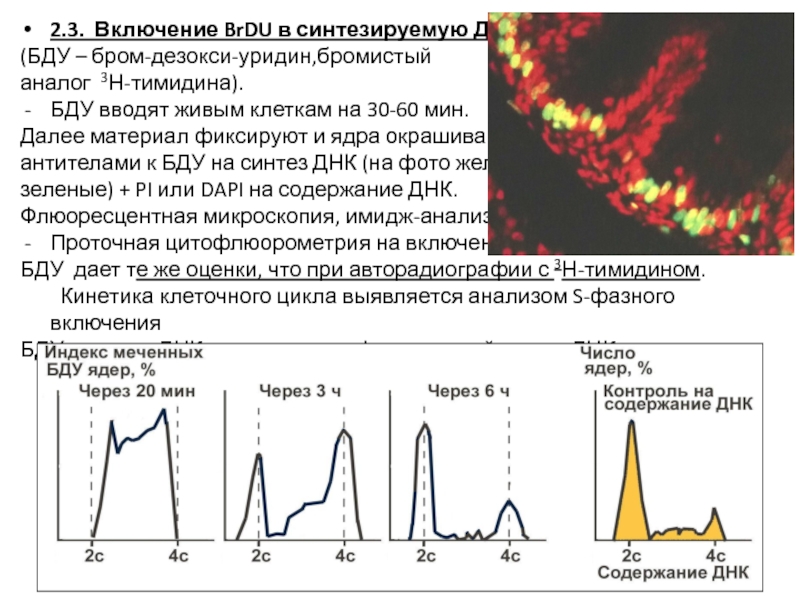
- 21. 2.3. Включение BrDU в синтезируемую ДНК
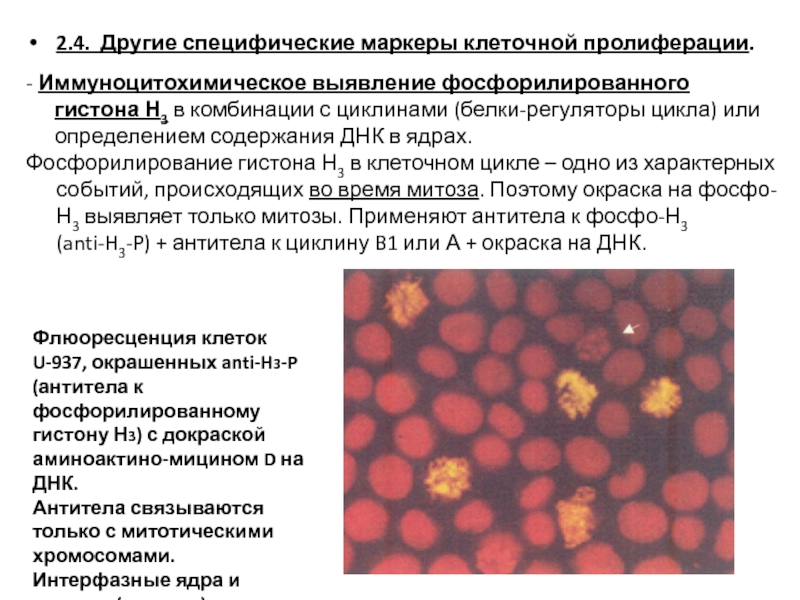
- 22. 2.4. Другие специфические маркеры клеточной пролиферации.
- 23. = Проточная цитофлюорометрия на фосфо-Н3 выявляет митотический
- 24. - Иммуноцитохимическое выявление белка Ki-67 в циклирующих
- 25. Иммуноцитохимическое выявление циклоспецифического антигена PCNA (Proliferating Cell
- 26. 3. Репликация ДНК 3.1. Подготовка к синтезу
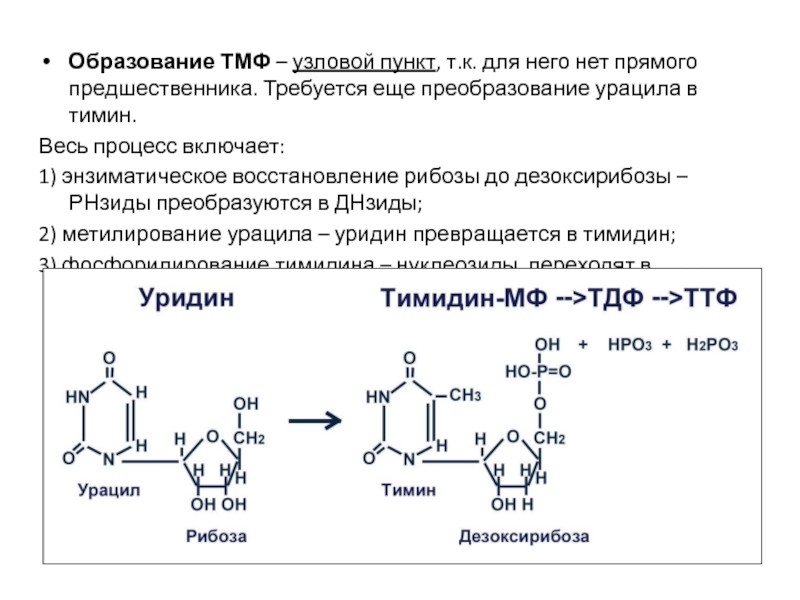
- 27. Образование ТМФ – узловой пункт, т.к. для
- 28. Фосфорилирование нуклеозидов происходит с помощью специфических киназ.
- 29. 3.2. Полуконсервативный механизм репликации ДНК. Молекула ДНК
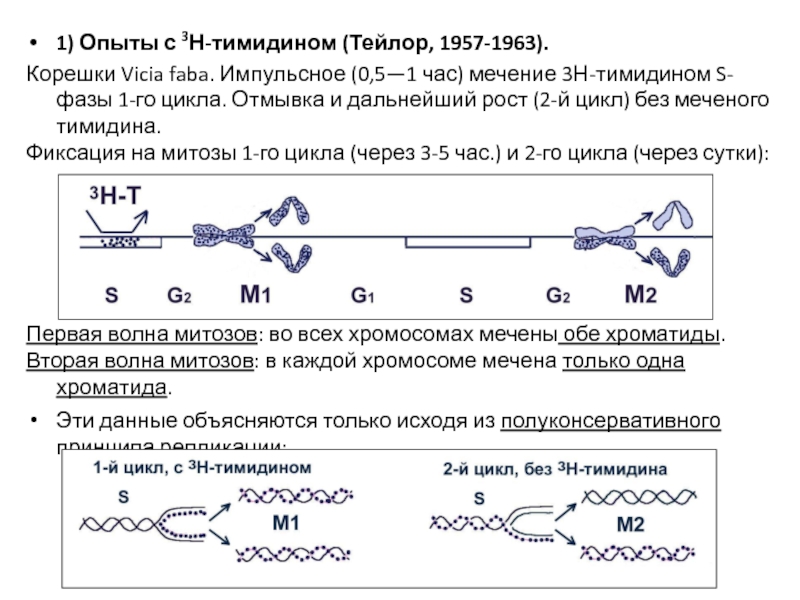
- 30. 1) Опыты с 3Н-тимидином (Тейлор, 1957-1963). Корешки
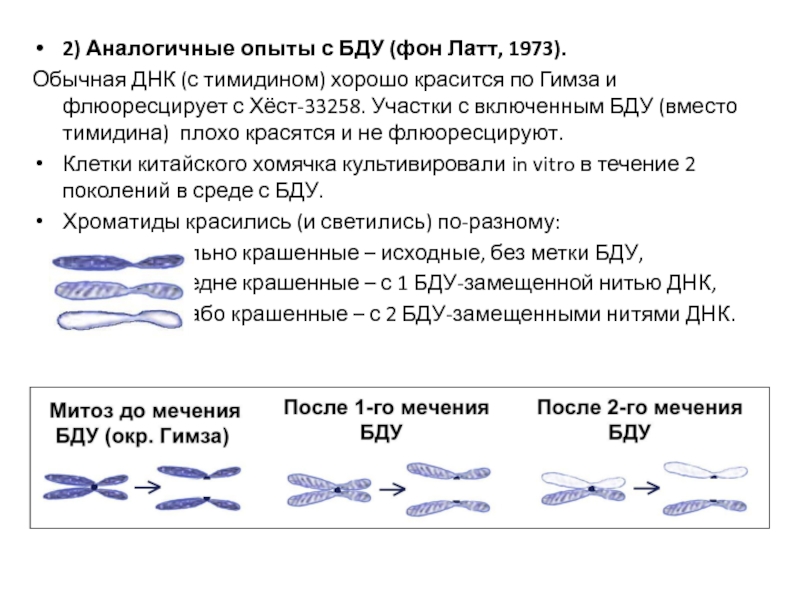
- 31. 2) Аналогичные опыты с БДУ (фон Латт,
- 32. 3) Опыты c 14N и 15N на
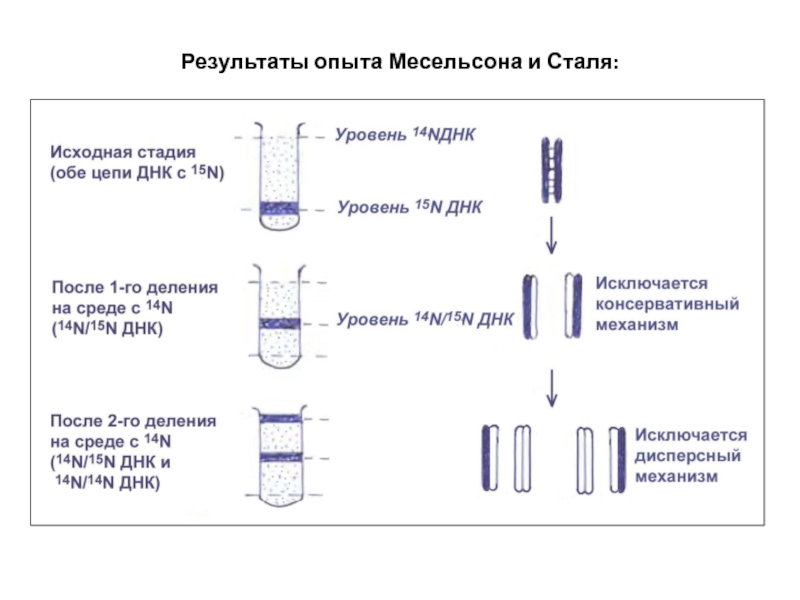
- 33. Результаты опыта Месельсона и Сталя:
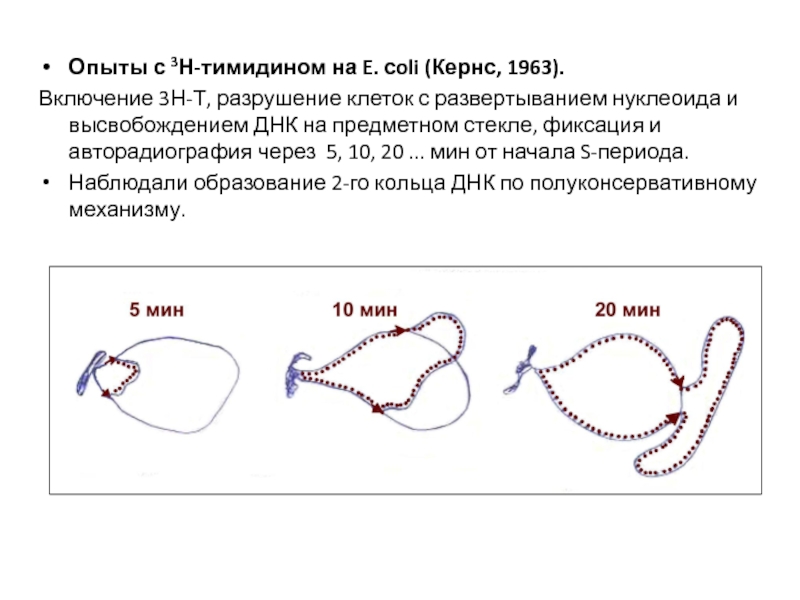
- 34. Опыты с 3Н-тимидином на E. сoli (Кернс,
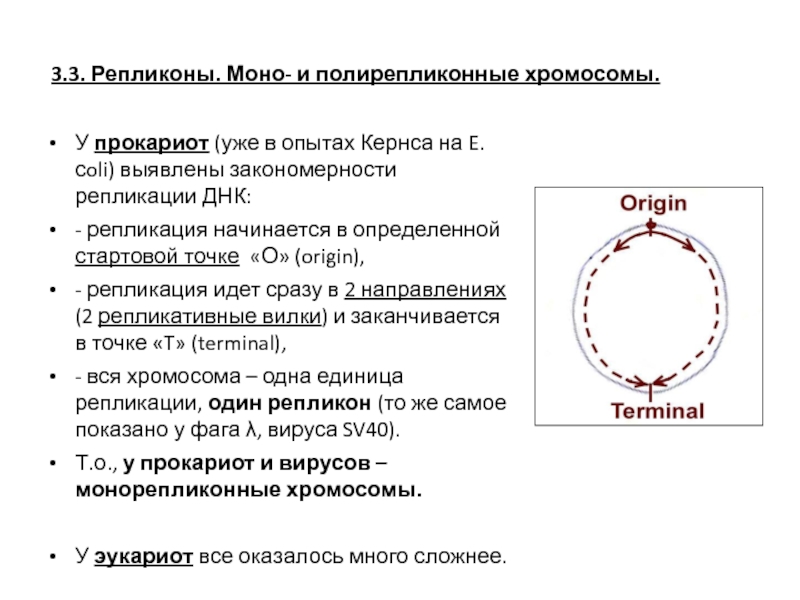
- 35. У прокариот (уже в опытах Кернса на
- 36. Информация к размышлению: - В 2n наборе
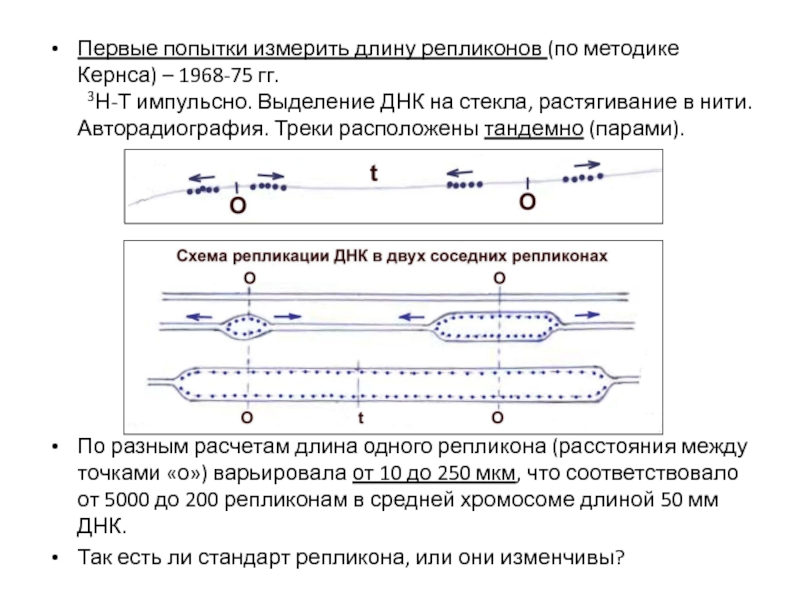
- 37. Первые попытки измерить длину репликонов (по методике
- 38. Дополнительная информация к размышлению. У одного и
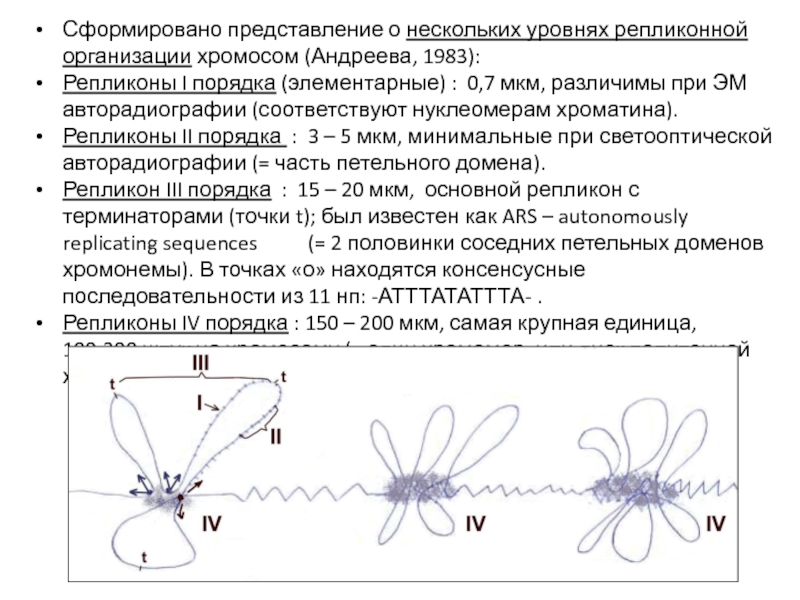
- 39. Сформировано представление о нескольких уровнях репликонной организации
- 40. Т.о., в онтогенезе большинство точек «о» постепенно
- 41. 3.4. Хронология синтеза ДНК. Рано и поздно
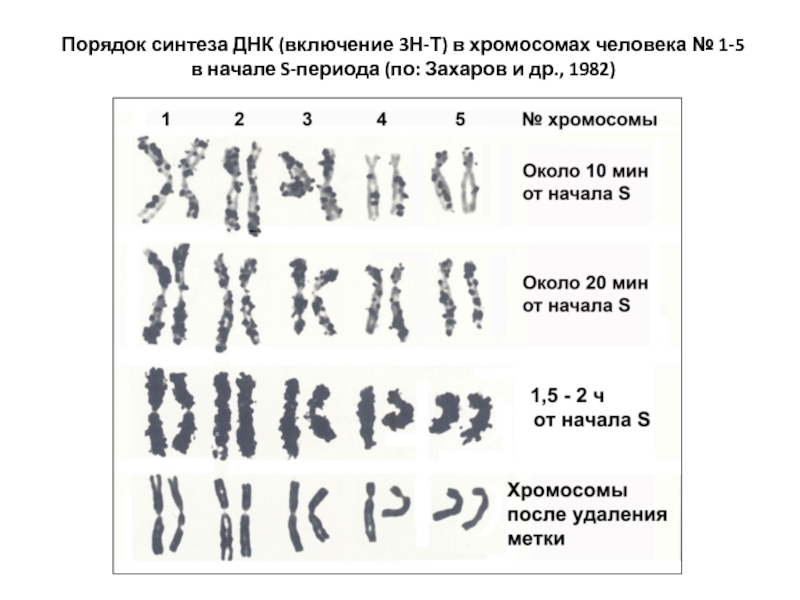
- 42. Порядок синтеза ДНК (включение 3Н-Т) в хромосомах
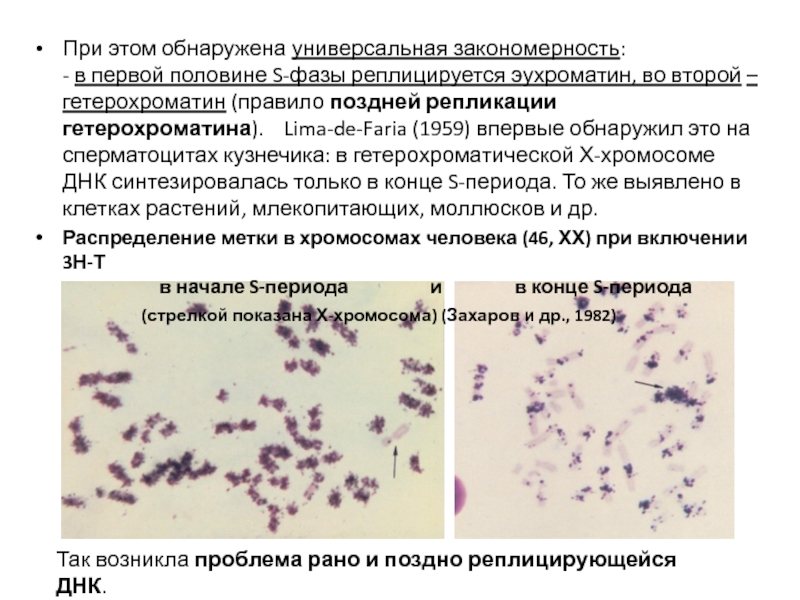
- 43. При этом обнаружена универсальная закономерность:
- 44. Справка. В интерфазе клеточного цикла, при переходе
- 45. (Босток, Самнер, 1981)
- 46. Выводы: по репликации гетерохроматиновой ДНК: -
- 47. Общая динамика и скорость синтеза суммарной ДНК
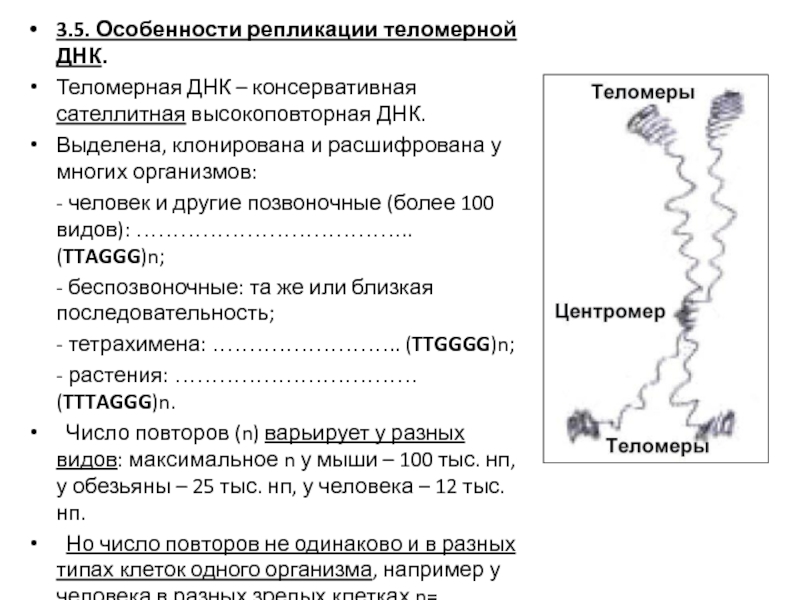
- 48. 3.5. Особенности репликации теломерной ДНК. Теломерная ДНК
- 49. Роль теломерной сатДНК : Обеспечивает индивидуальность и
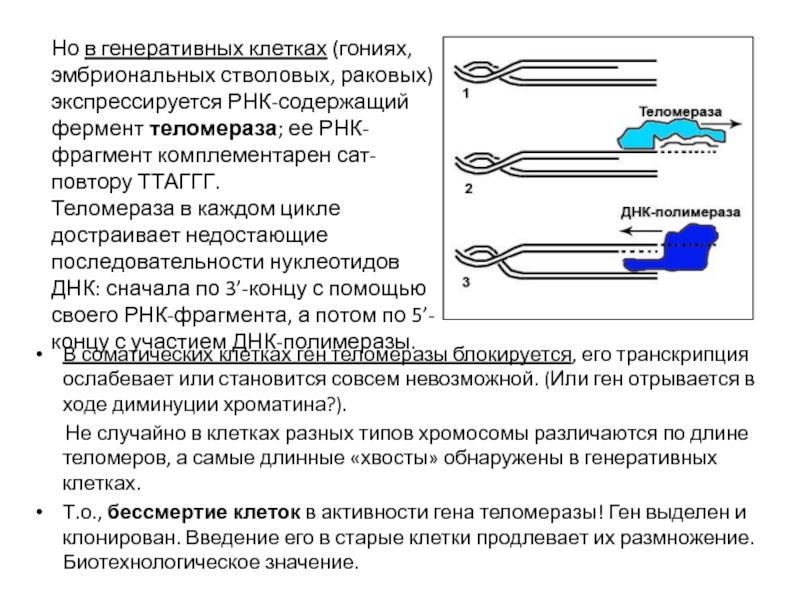
- 50. В соматических клетках ген теломеразы блокируется, его
- 51. 3.6. Репаративный синтез ДНК.
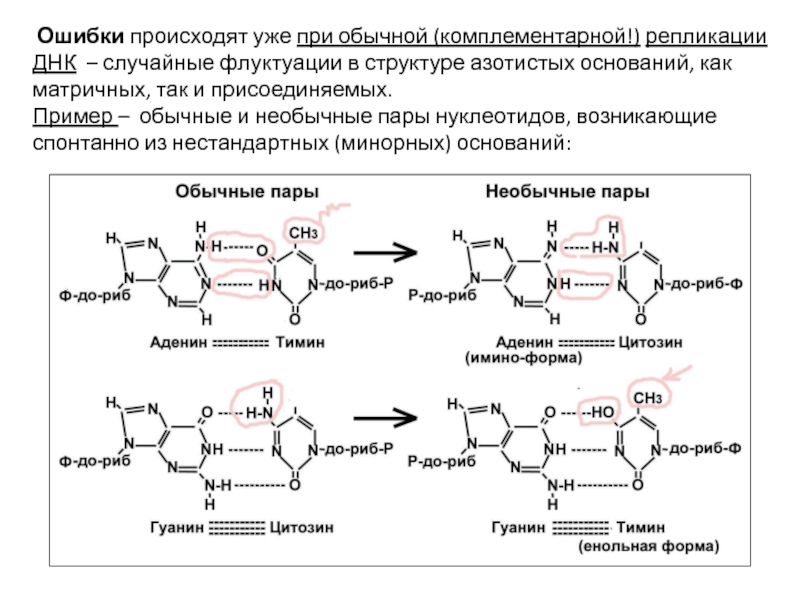
- 52. Ошибки происходят уже при обычной (комплементарной!)
- 53. В этих случаях рост цепи сразу останавливается,
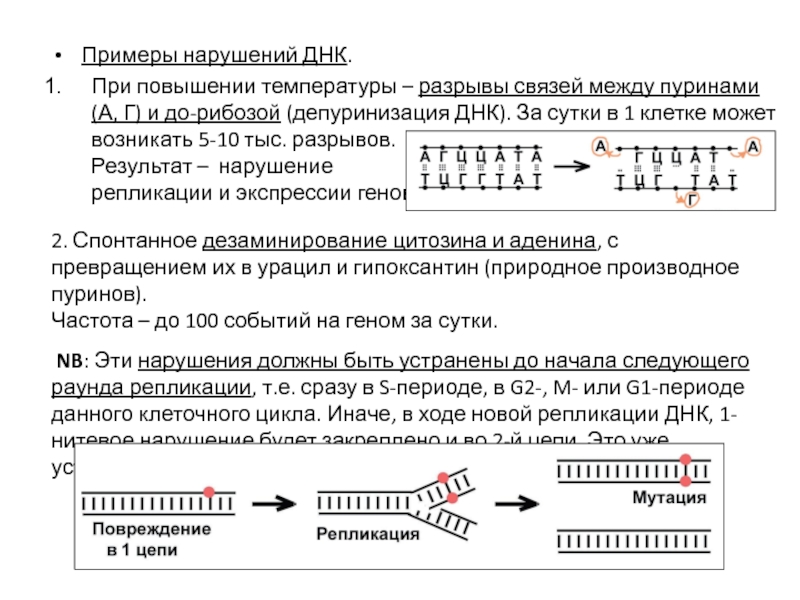
- 54. Примеры нарушений ДНК. При повышении температуры –
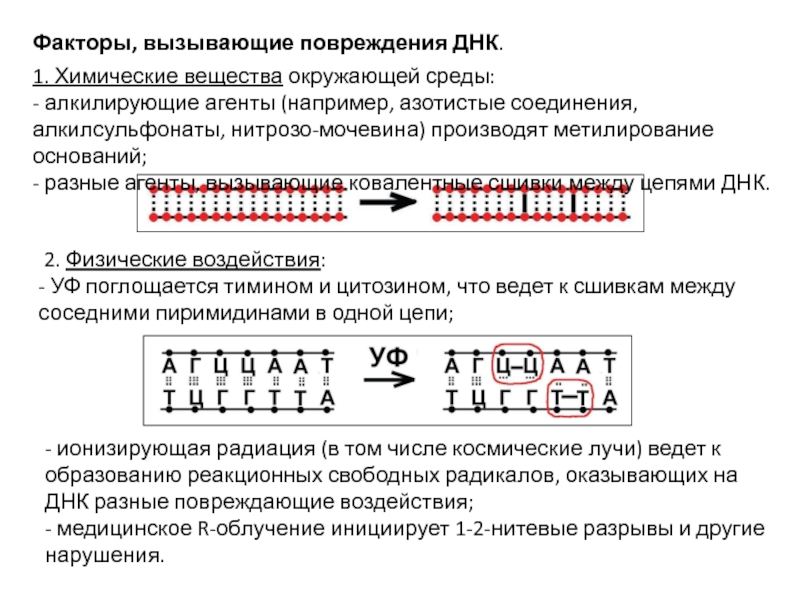
- 55. Факторы, вызывающие повреждения ДНК. 1. Химические вещества
- 56. Как это восстанавливается до начала следующей репликации?
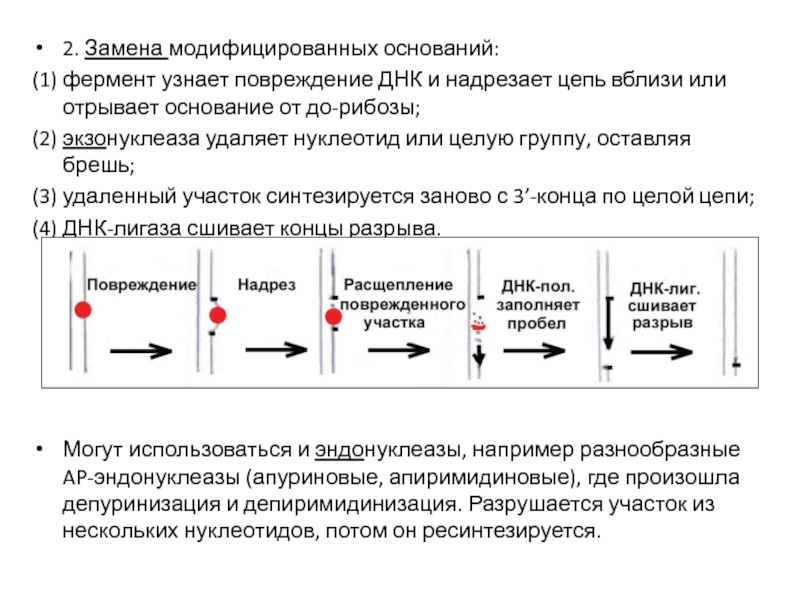
- 57. 2. Замена модифицированных оснований: (1) фермент узнает
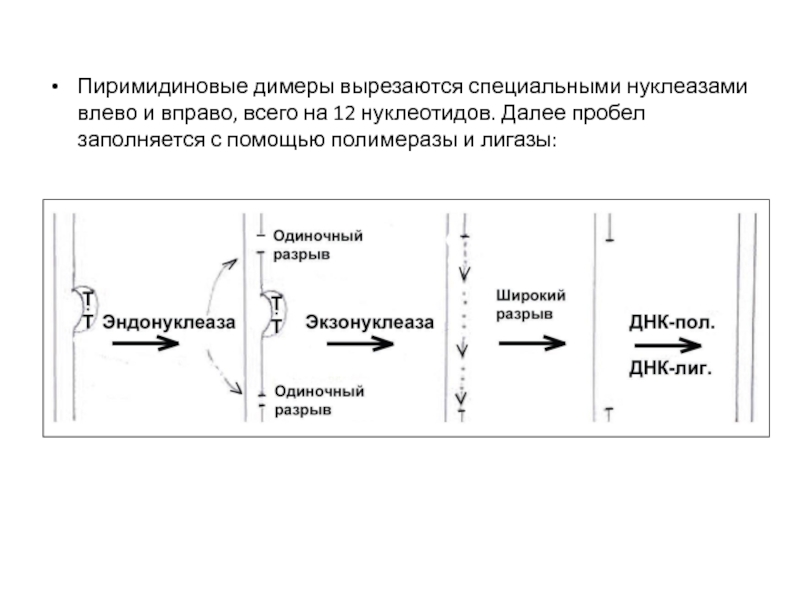
- 58. Пиримидиновые димеры вырезаются специальными нуклеазами влево и
- 59. Значение репарации ДНК. Повреждения ДНК
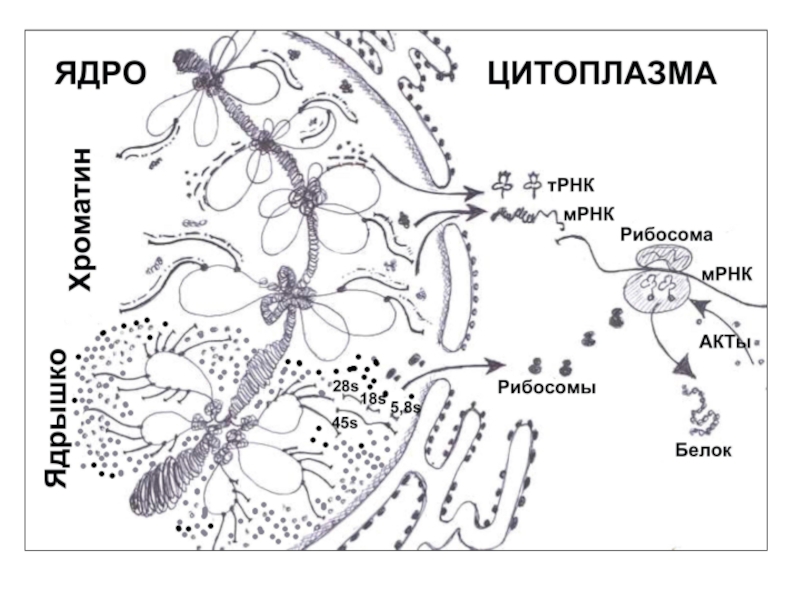
- 60. 4. Синтез РНК и белков в клеточном
- 61. 4.1. Синтез РНК. Необходим синтез и процессинг
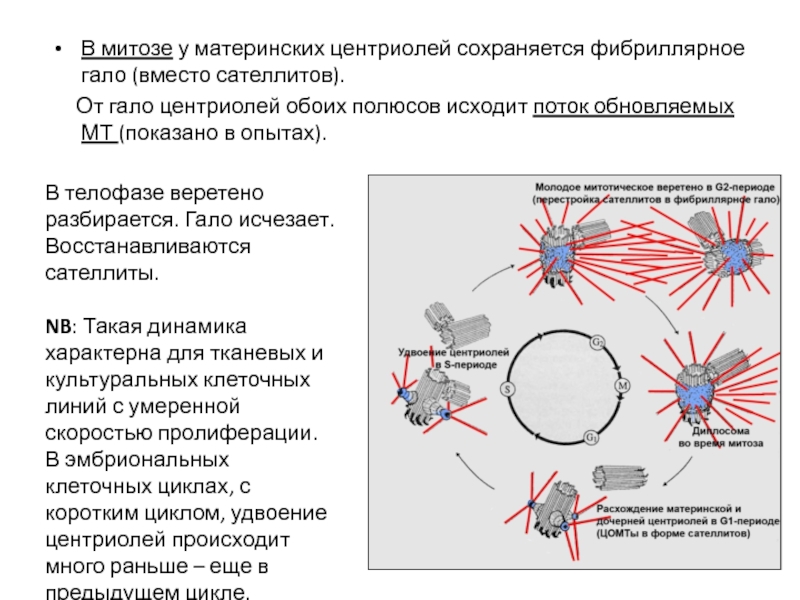
- 63. Количество РНК в клетке вне цикла остается
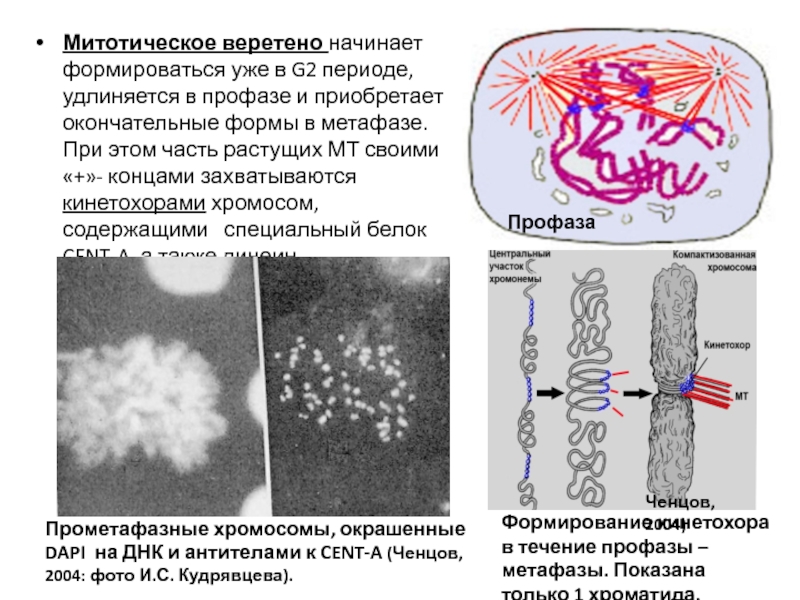
- 64. В 1960-е годы установлено:
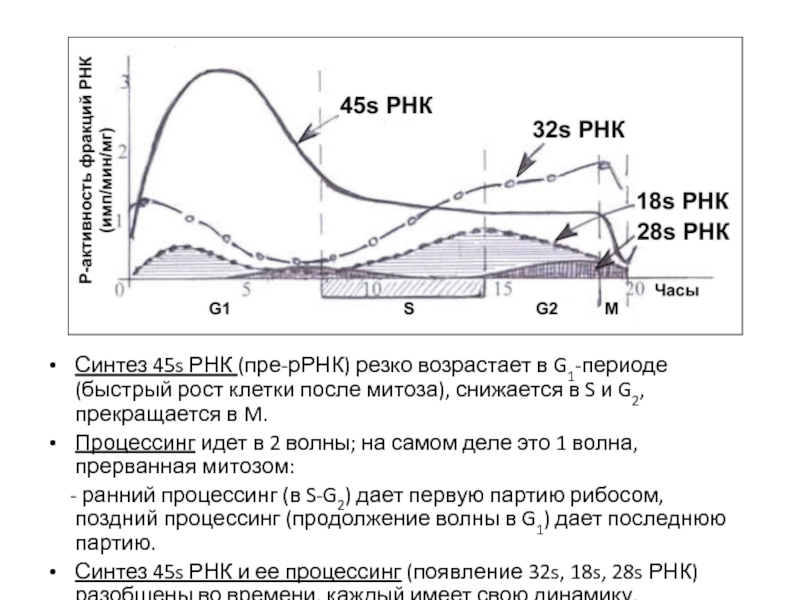
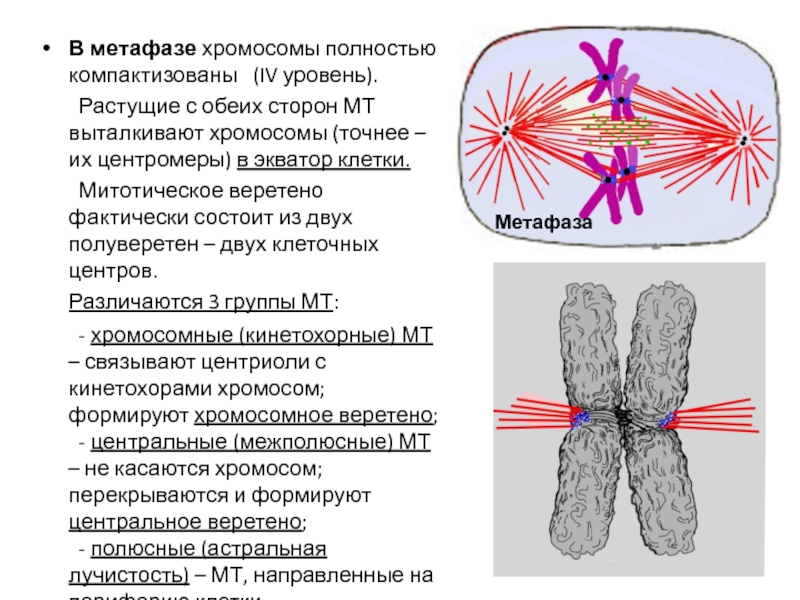
- 65. Синтез рРНК (ядрышковая, рибосомная) – показано разобщение
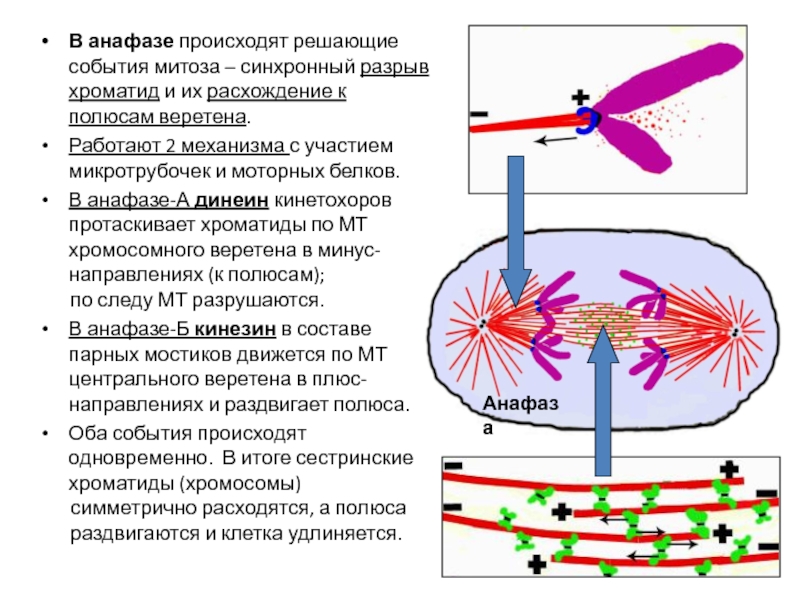
- 66. Синтез 45s РНК (пре-рРНК) резко возрастает в
- 67. Синтез иРНК – показан эффект дозы генов.
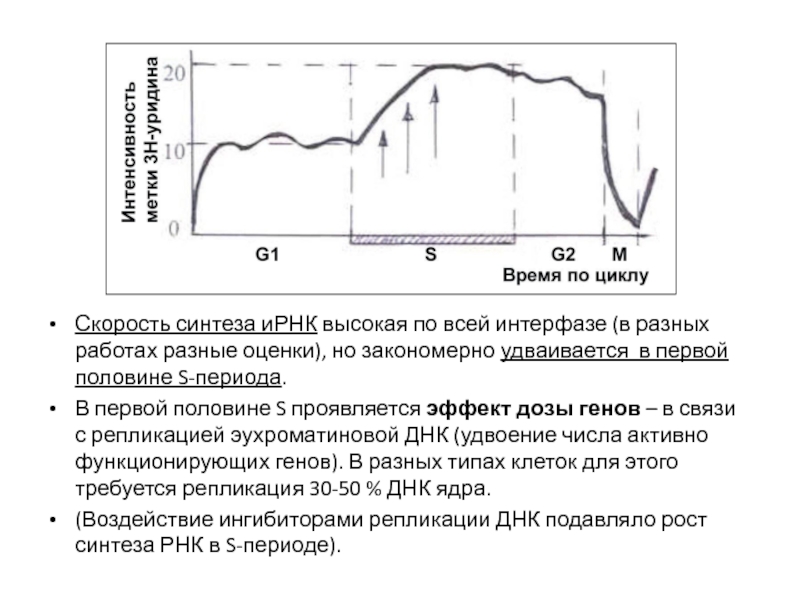
- 68. Скорость синтеза иРНК высокая по всей интерфазе
- 69. NB: Четкая зависимость синтеза РНК от дозы
- 70. 4.2. Синтез белков. Синтез белков выявляют по
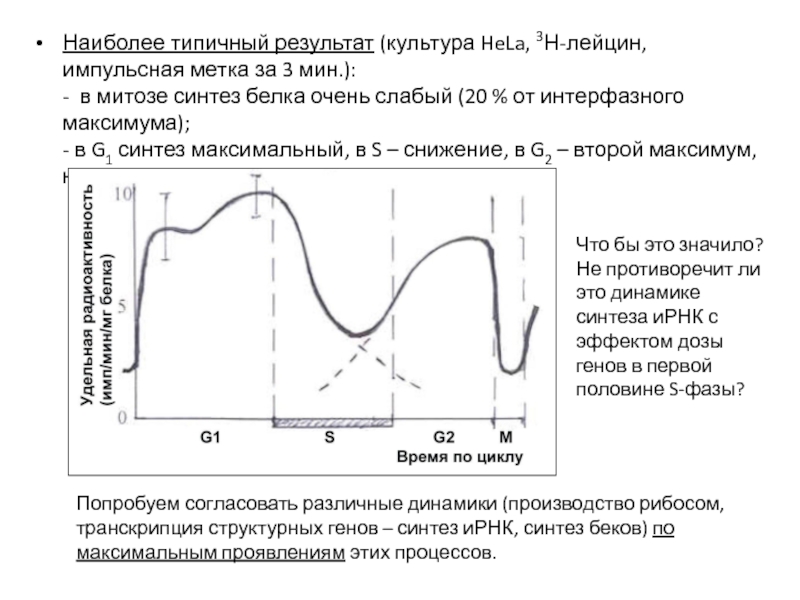
- 71. Наиболее типичный результат (культура HeLa, 3Н-лейцин, импульсная
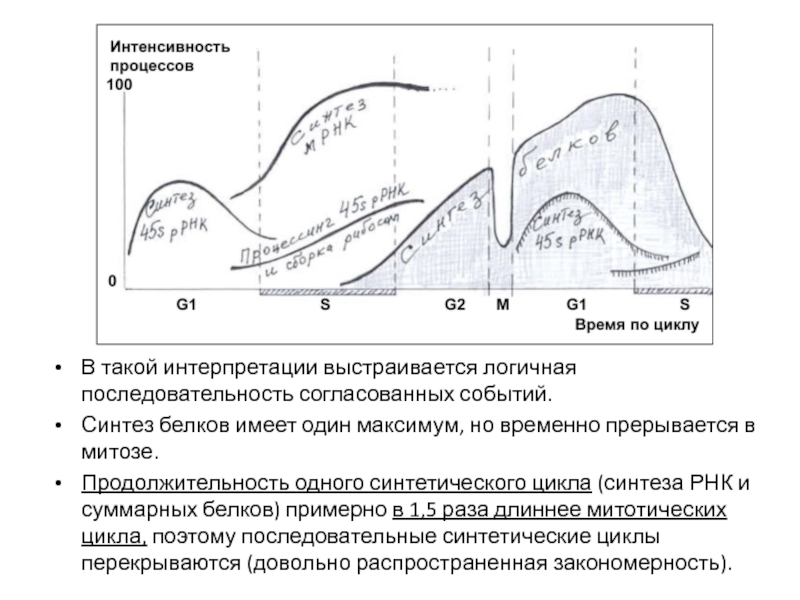
- 72. В такой интерпретации выстраивается логичная последовательность согласованных
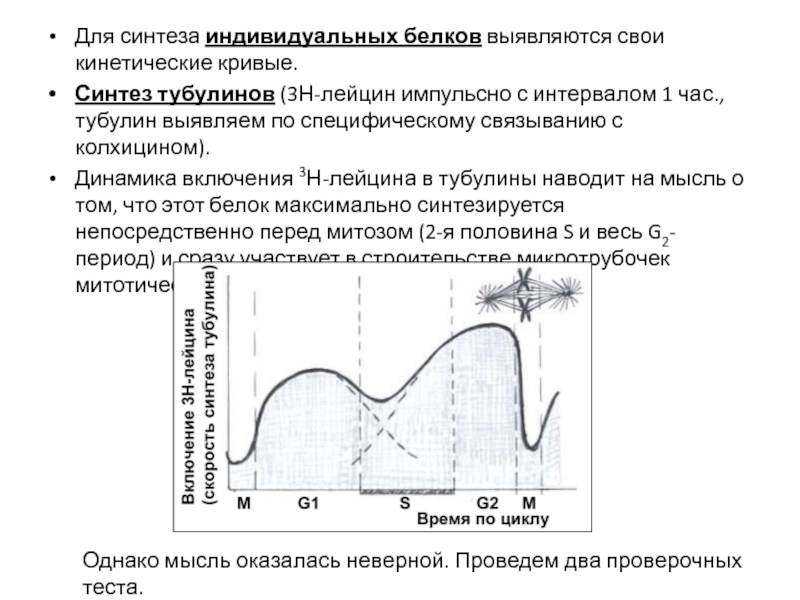
- 73. Для синтеза индивидуальных белков выявляются свои кинетические
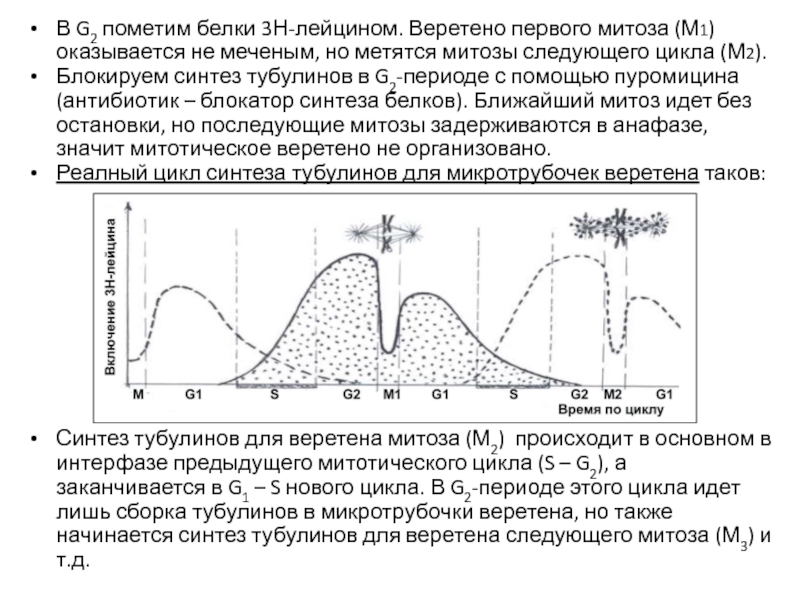
- 74. В G2 пометим белки 3Н-лейцином. Веретено первого
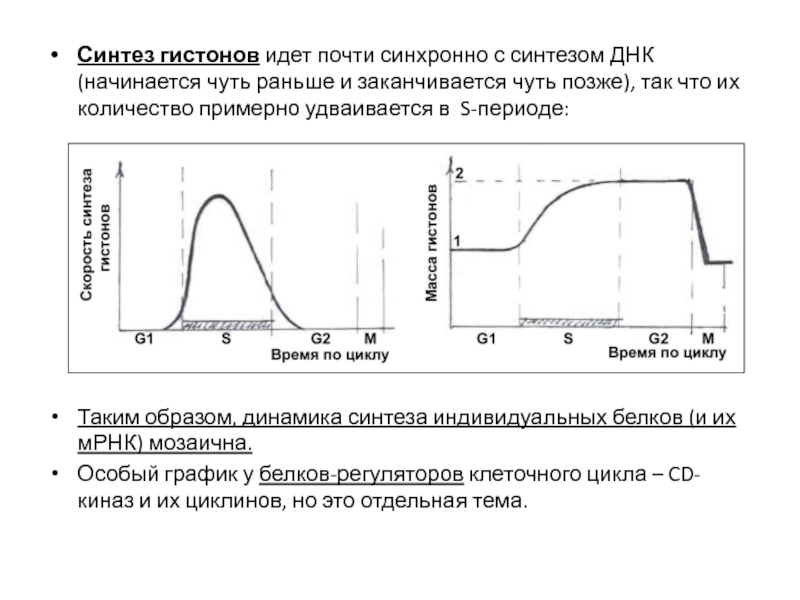
- 75. Синтез гистонов идет почти синхронно с синтезом
- 76. 5. Митоз. Хромосомный цикл В митозе связаны
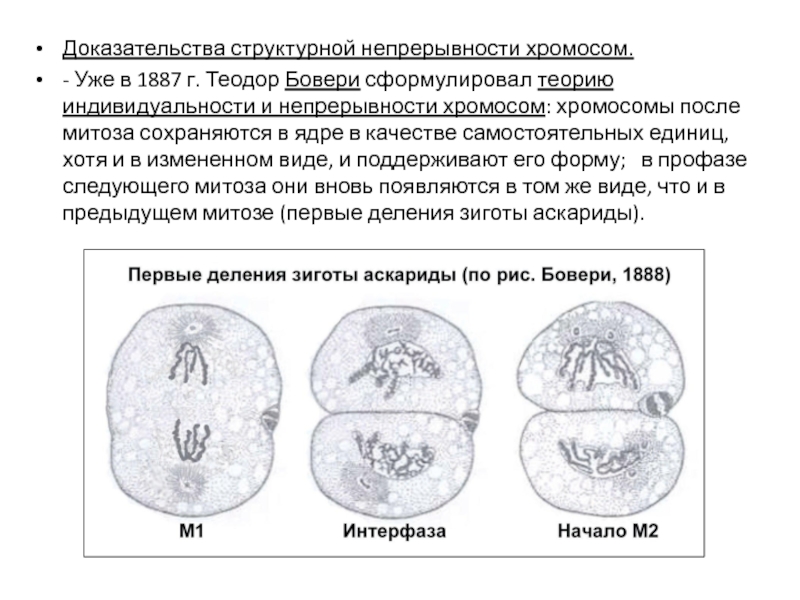
- 77. Доказательства структурной непрерывности хромосом. - Уже
- 78. - Аналогичные наблюдения на других объектах. В
- 79. - Современные картины. Гибридизация in situ (на
- 80. - Постоянство хромосомной территории для гетерохроматической Х-хромосомы
- 81. 5.2. Структурный цикл хромосом Структурные преобразования хромосом – основная характеристика митоза.
- 82. Интерфаза. Хромосомы не видны, они деконденсированы до
- 83. У разных видов животных и растений метафазная
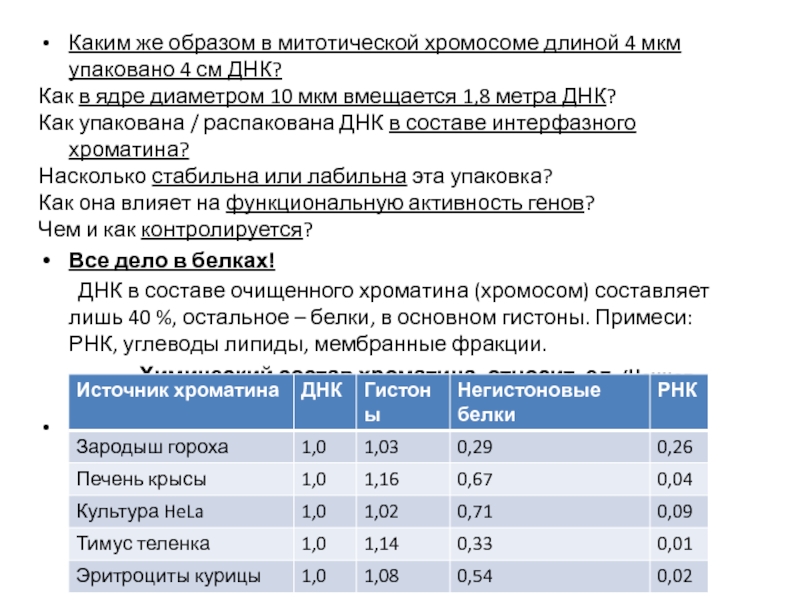
- 84. Каким же образом в митотической хромосоме длиной
- 85. Гистоны отвечают за низшие уровни компактизации. Это
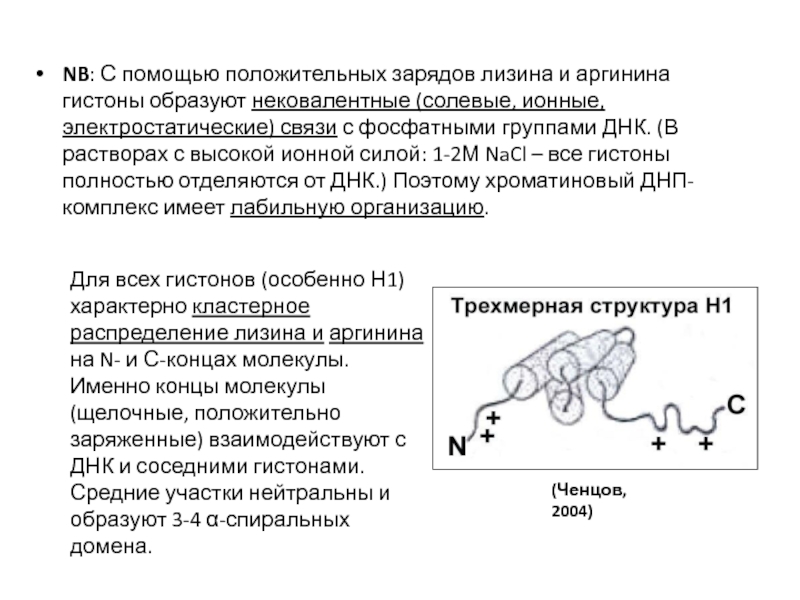
- 86. NB: С помощью положительных зарядов лизина и
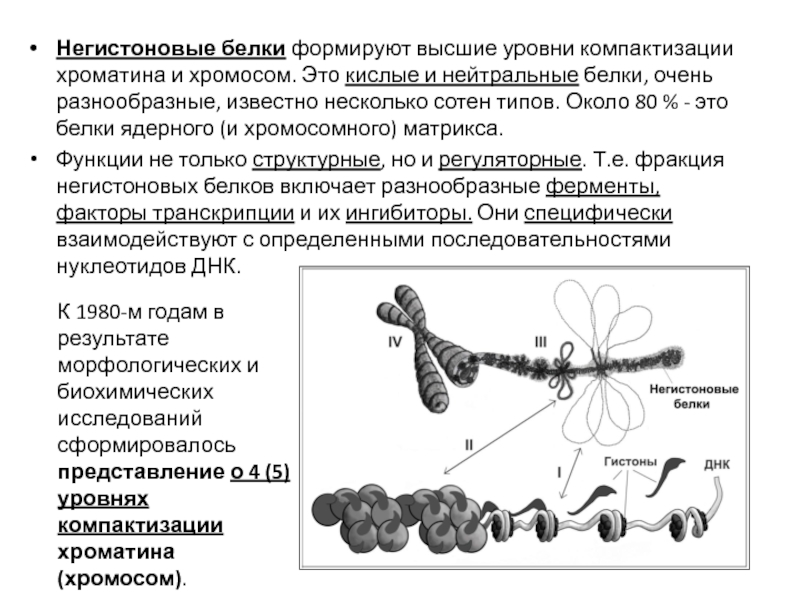
- 87. Негистоновые белки формируют высшие уровни компактизации хроматина
- 88. (I) Нуклеосомная фибрилла диаметром 10 нм.
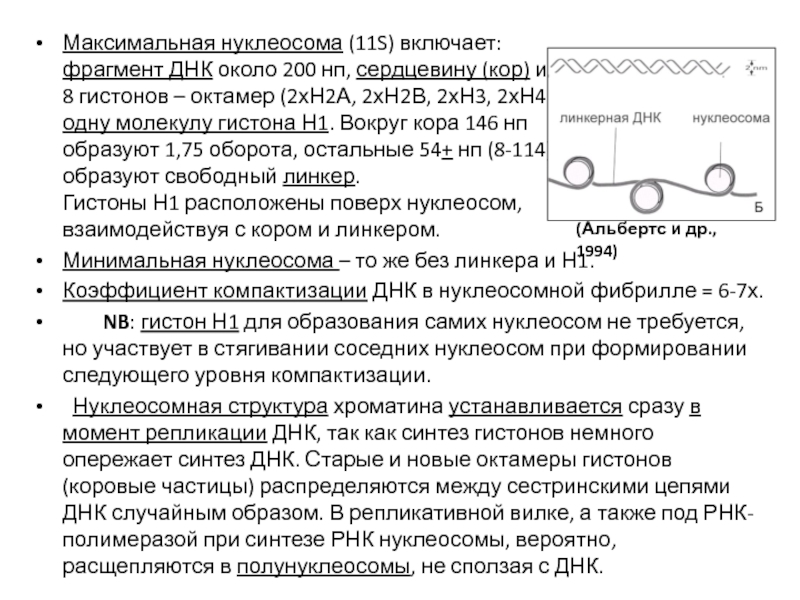
- 89. Максимальная нуклеосома (11S) включает:
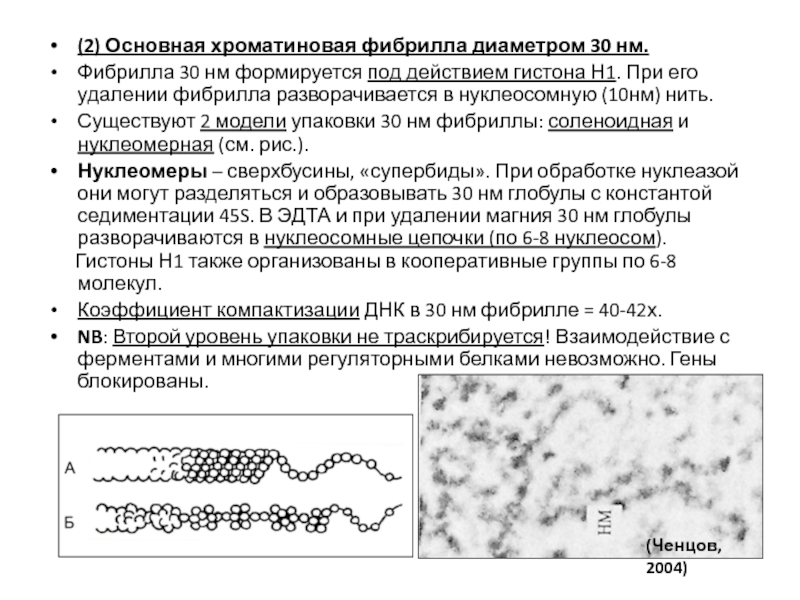
- 90. (2) Основная хроматиновая фибрилла диаметром 30 нм.
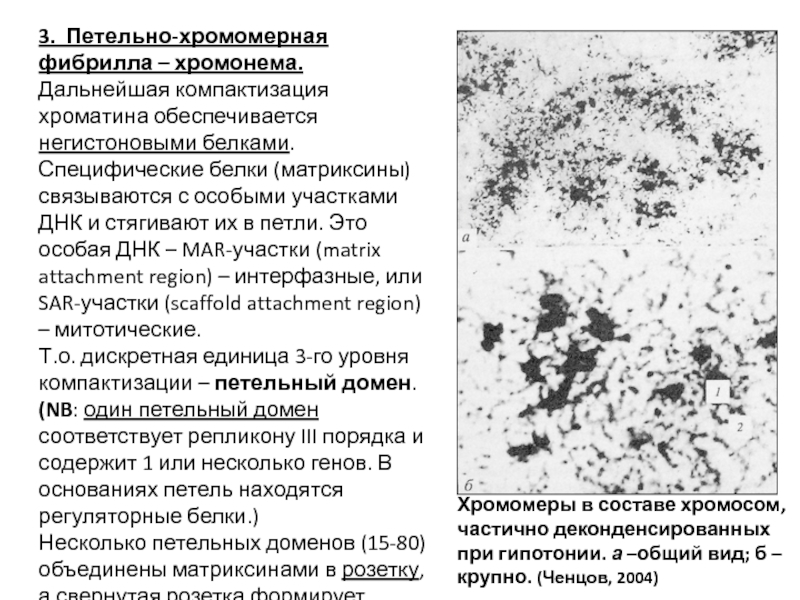
- 91. 3. Петельно-хромомерная фибрилла – хромонема. Дальнейшая компактизация
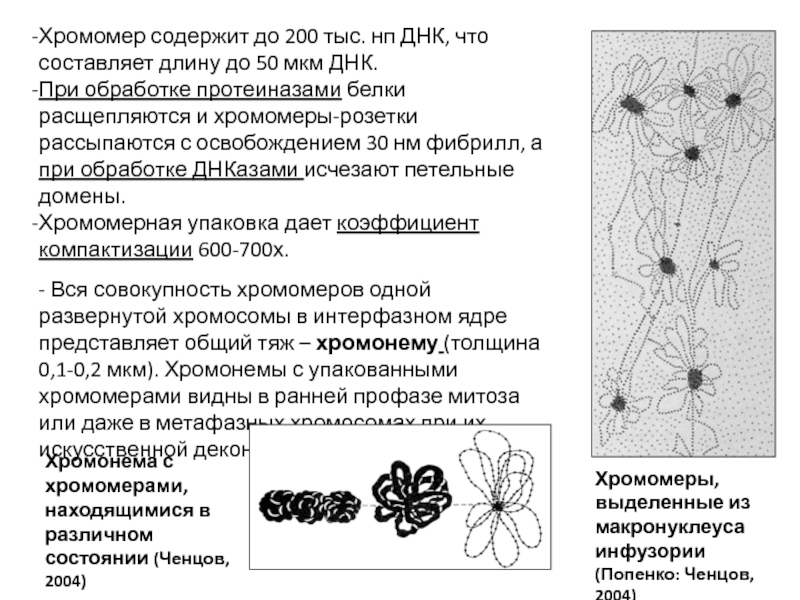
- 92. Хромомер содержит до 200 тыс. нп ДНК,
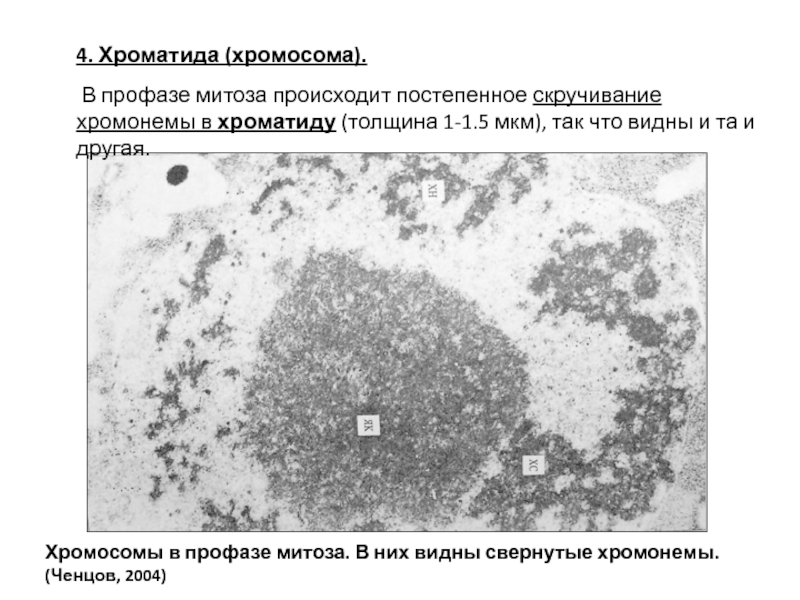
- 93. 4. Хроматида (хромосома). В профазе митоза происходит
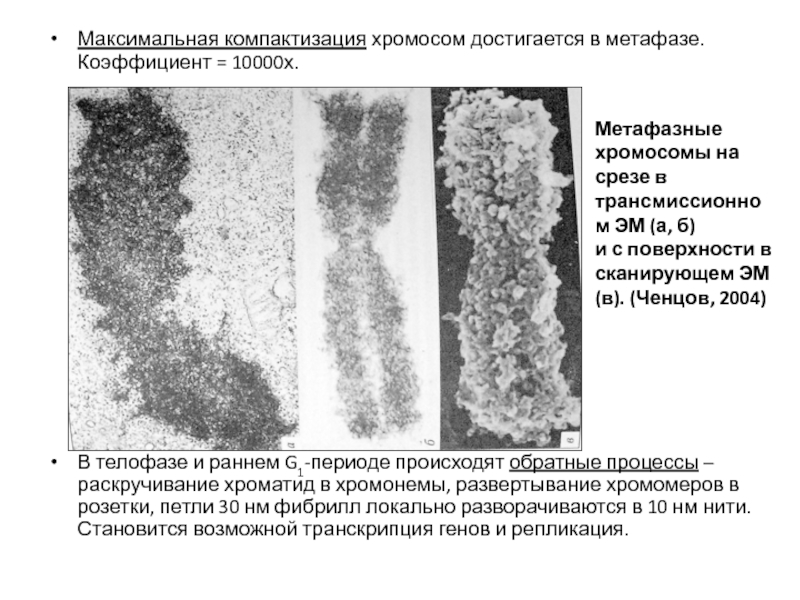
- 94. Максимальная компактизация хромосом достигается в метафазе. Коэффициент
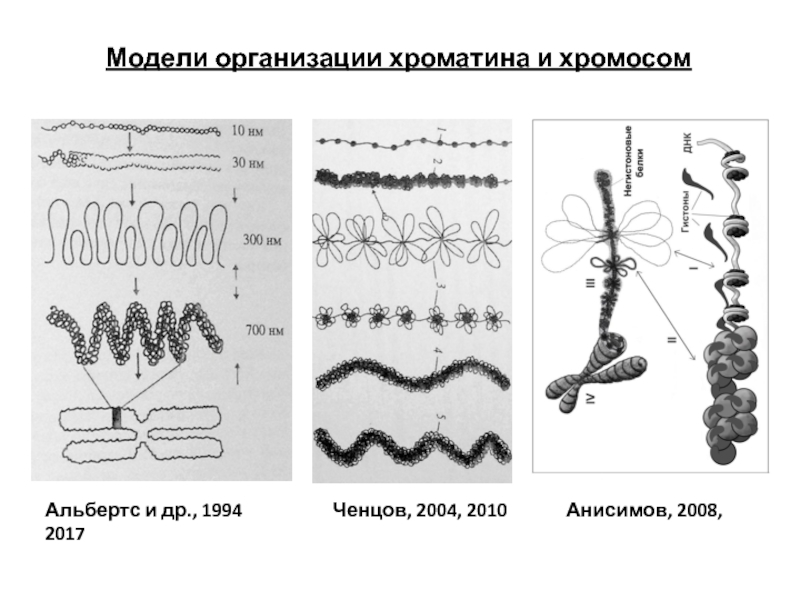
- 95. Модели организации хроматина и хромосом Альбертс
- 96. 6. Митоз. Цикл митотического веретена Веретено обеспечивает
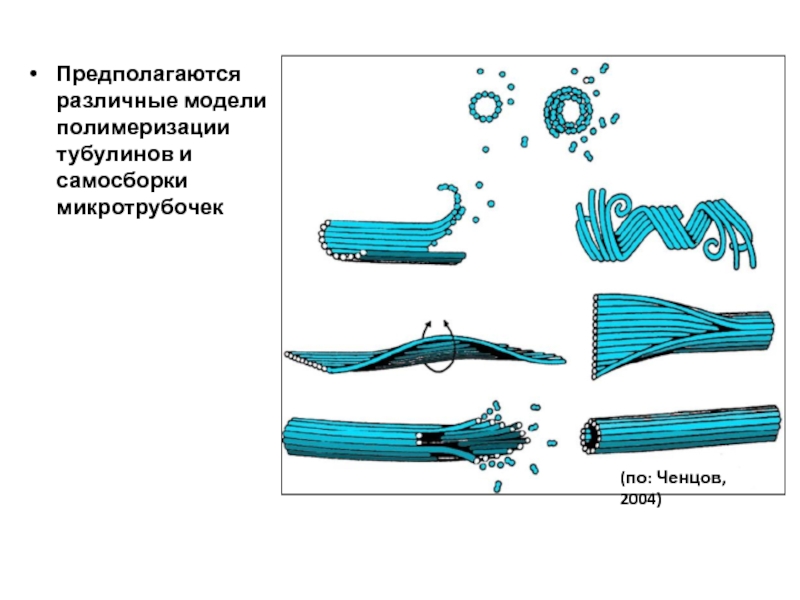
- 97. Предполагаются различные модели полимеризации тубулинов и самосборки микротрубочек (по: Ченцов, 2004)
- 98. NB: Рост на +конце преобладает
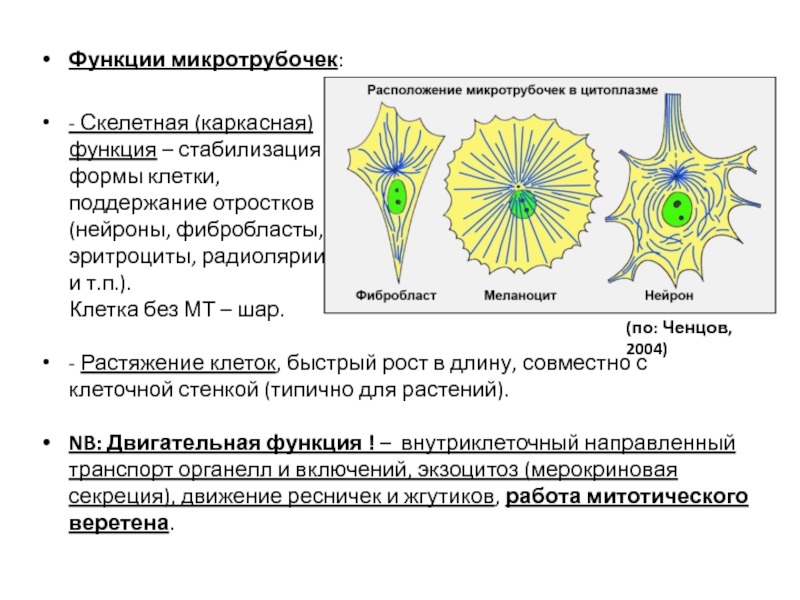
- 99. Функции микротрубочек: - Скелетная (каркасная)
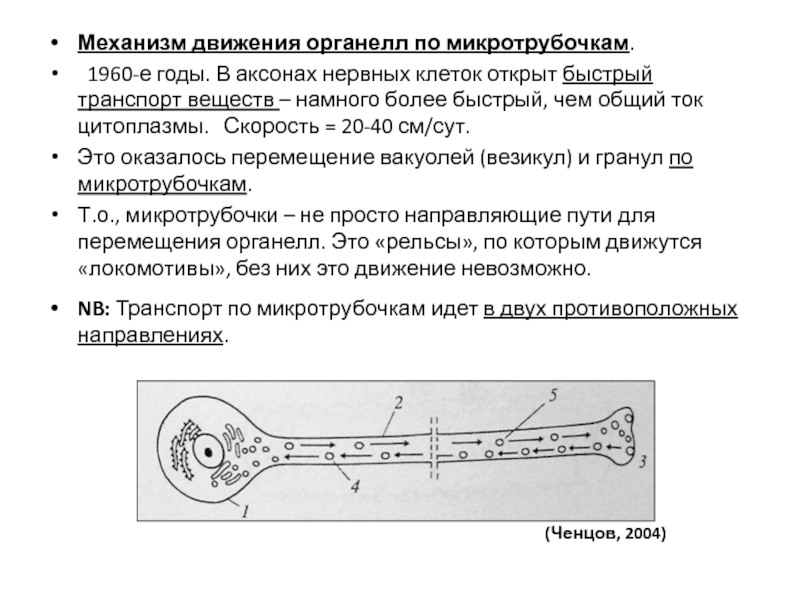
- 100. Механизм движения органелл по микротрубочкам. 1960-е
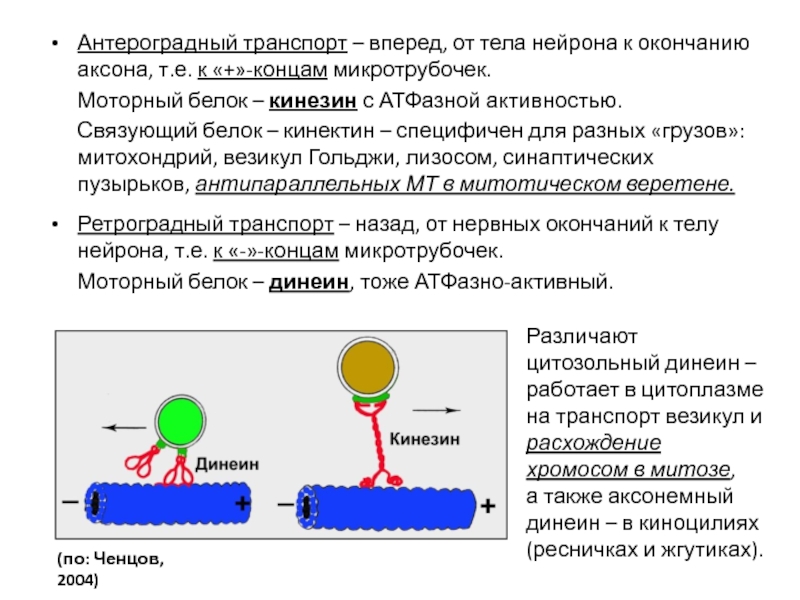
- 101. Антероградный транспорт – вперед, от тела нейрона
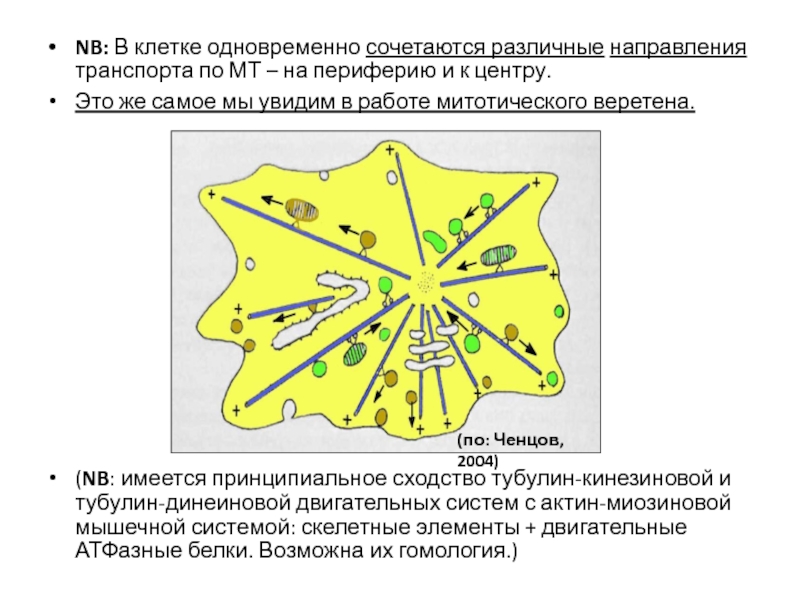
- 102. NB: В клетке одновременно сочетаются различные направления
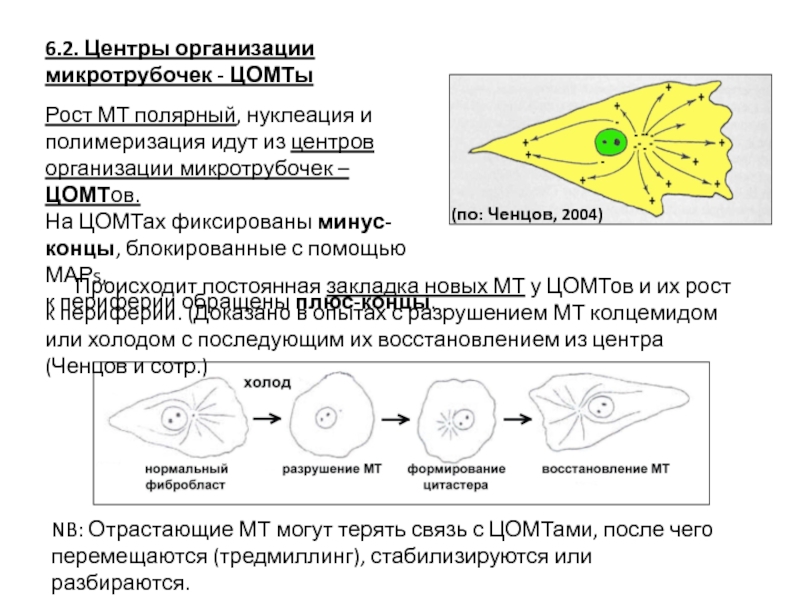
- 103. 6.2. Центры организации микротрубочек - ЦОМТы Рост
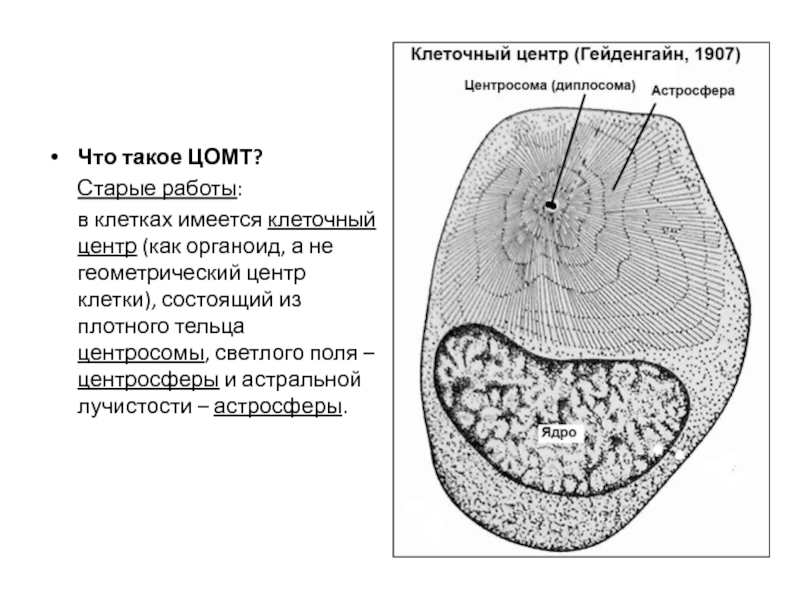
- 104. Что такое ЦОМТ? Старые
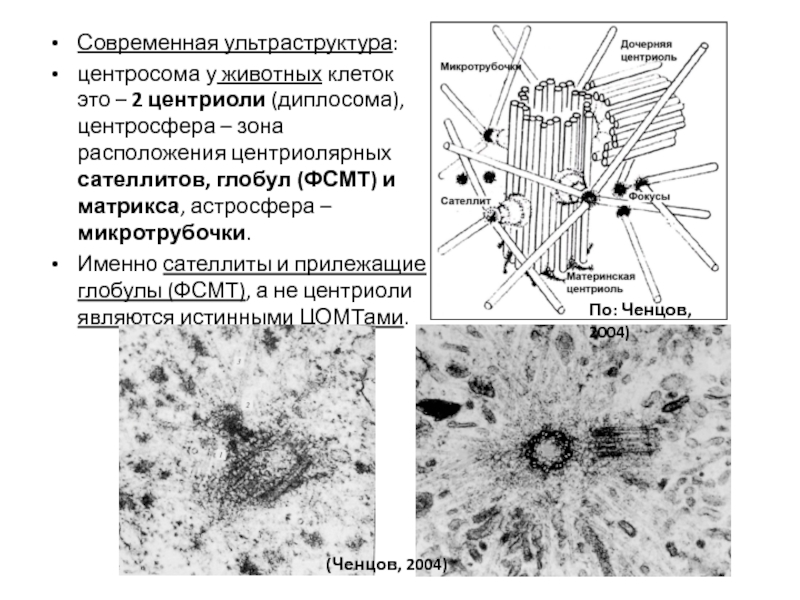
- 105. Современная ультраструктура: центросома у животных клеток
- 106. NB: Пара центриолей – материнская и дочерняя.
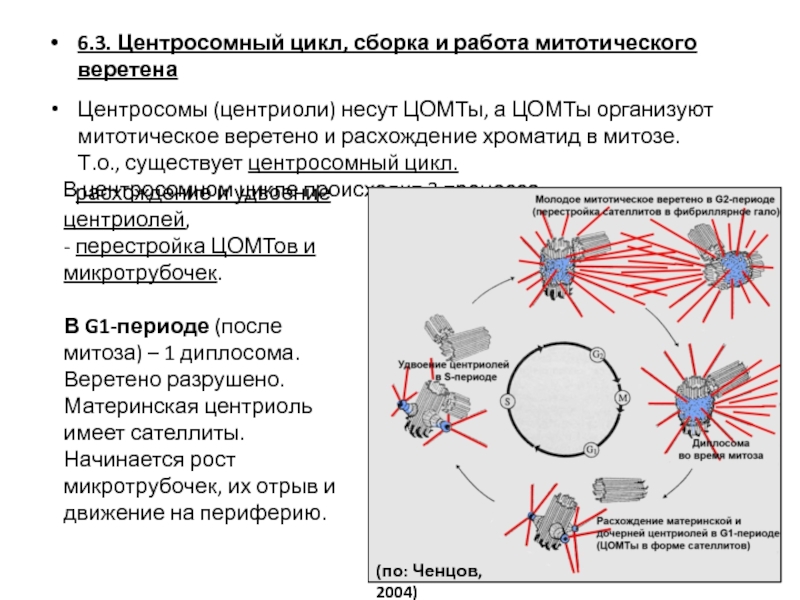
- 107. 6.3. Центросомный цикл, сборка и работа митотического
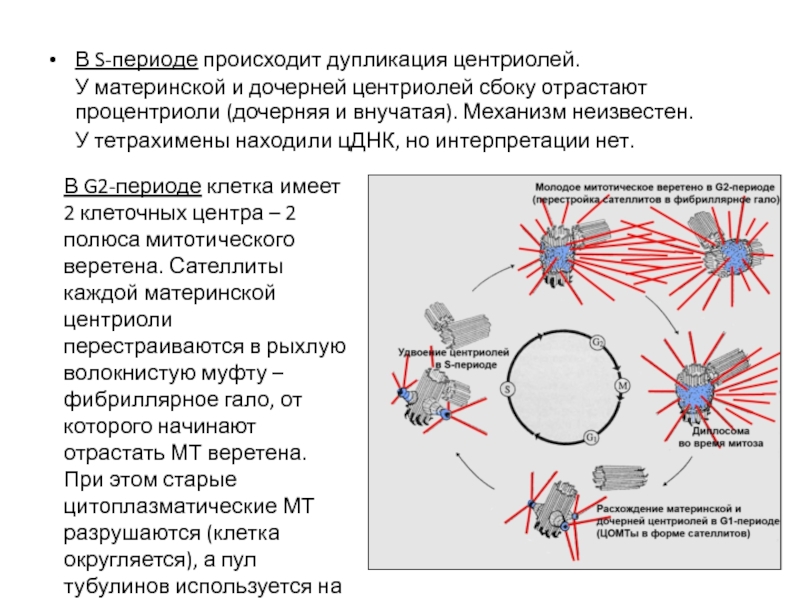
- 108. В S-периоде происходит дупликация центриолей.
- 109. В митозе у материнских центриолей сохраняется фибриллярное
- 110. Митотическое веретено начинает формироваться уже в G2
- 111. В метафазе хромосомы полностью компактизованы (IV
- 112. В анафазе происходят решающие события митоза –
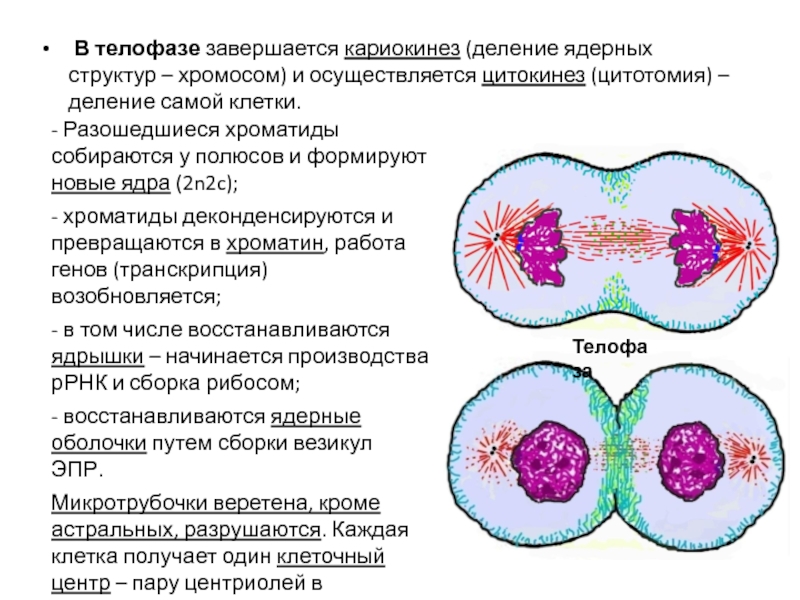
- 113. В телофазе завершается кариокинез (деление ядерных
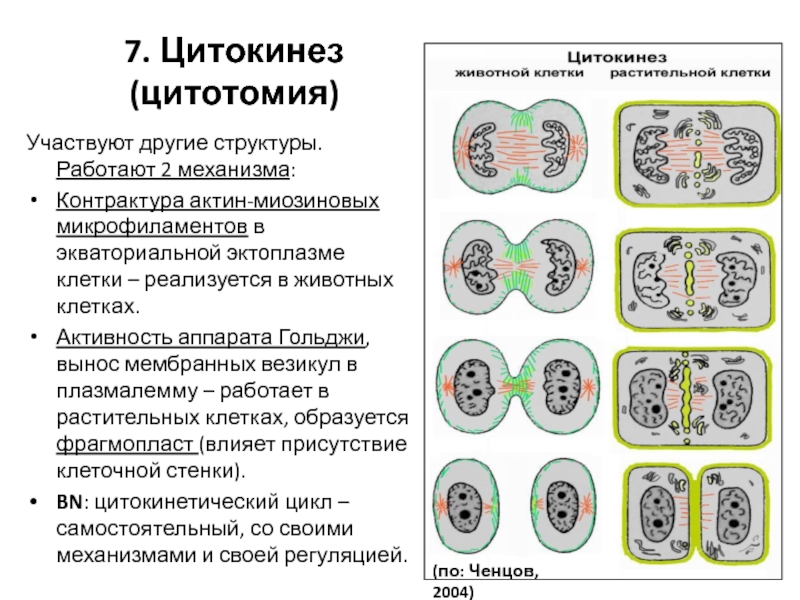
- 114. Участвуют другие структуры. Работают 2 механизма:
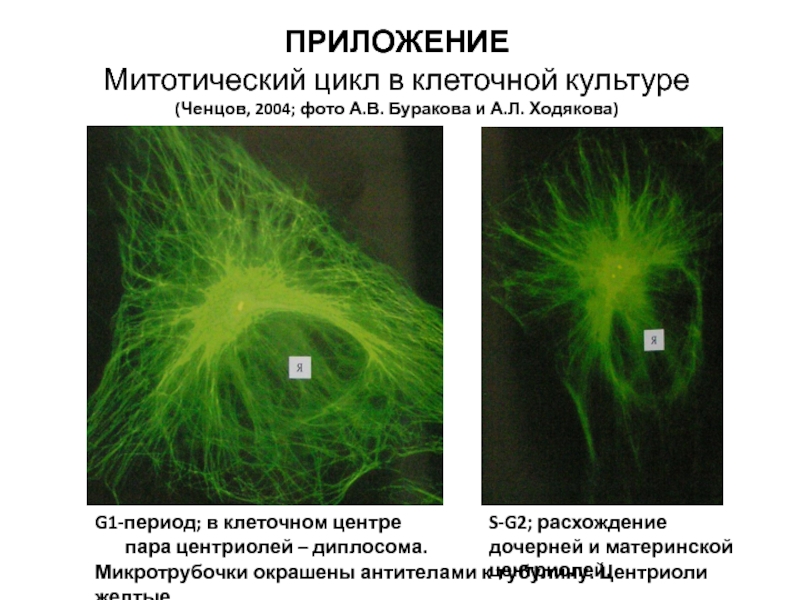
- 115. G1-период; в клеточном центре пара центриолей –
- 118. Т.о., митотический цикл – сочетание трех относительно
Слайд 1Министерство образования и науки Российской Федерации Дальневосточный федеральный университет Кафедра клеточной биологии и
Слайд 3 Настоящее учебное пособие подготовлено в форме конспекта-презентации лекционного спецкурса, читаемого автором
К настоящему времени по этим проблемам накоплен и продолжает расти огромный научный материал. Отразить его с достаточной полнотой в одном учебном (семестровом) пособии не представляется возможным, поэтому предлагаем настоящий спецкурс «Репродукция и дифференцировка клеток» лишь как «Часть I – Базовый уровень». Это означает, что без этих начальных знаний невозможно осваивать самые актуальные материалы по структуре и генетической мобильности хроматина, биологии и технологии стволовых клеток, регенерации тканей и органов, злокачественной трансформации клеток и другим проблемам, которые, как хотелось бы автору, должны быть отражены в Части II под условным названием «Актуальные проблемы». К сотрудничеству в этой сложной работе, а также к полезной критике данного пособия приглашаю специалистов.
В нашем пособии минимум текста, но достаточно иллюстраций, что обычно любят студенты, поскольку позволяет удовлетворительно усвоить на базовом уровне учебный материал. Учебное пособие могут использовать, кроме биологических цитологов, гистологов и эмбриологов, генетики, физиологи, биохимики, а также студенты биомедицинского профиля (лечебники, биофизики, биохимики) и другие специалисты, которым потребны современные знания в области клеточной биологии.
Слайд 4ВВЕДЕНИЕ 1. Проблема репродукции и дифференциации клеток в клеточной теории (История
17 в. 1665 г. – Роберт Гук = открытие клеток у растений.
1671 г. – Грю, 1675 г. – Мальпиги = у животных.
До 19 в. Новых принципиальных положений не высказано.
Начало 19 в. = формируется клеточная теория:
1802 – Бриссо-Мирбе, 1809 – Ламарк, 1824 – Дютроше
= все организмы состоят из клеток.
1830 – Ян Пуркинье = описание клеточного ядра (зародышевый пузырек яйца курицы).
1831 – итальянец Роберт Броун = обнаружил ядро в растительной клетке.
Ввел термин nucleus. Идея о постоянном наличии ядра во всех клетках.
Роль ядра – неизвестна. (=Комочек слизи, питательные вещества ...).
1838-39 – Теодор Шванн (немецкий зоолог) = окончательная и наиболее полная формулировка клеточной теории.
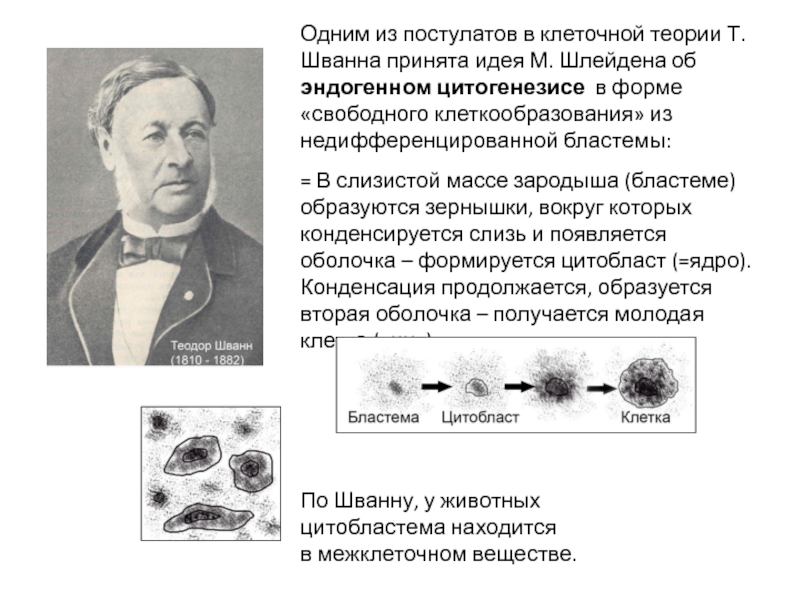
Слайд 5Одним из постулатов в клеточной теории Т. Шванна принята идея М.
= В слизистой массе зародыша (бластеме) образуются зернышки, вокруг которых конденсируется слизь и появляется оболочка – формируется цитобласт (=ядро).
Конденсация продолжается, образуется вторая оболочка – получается молодая клетка (=цит).
По Шванну, у животных
цитобластема находится
в межклеточном веществе.
Слайд 6В то же время, уже в 1824 г. наблюдали деление клеток
1832 – деление перегородками у нитчатых водорослей.
Но эти факты не принимались как универсальный способ клеткообразования. Поведение и роль ядра не понимали.
1847 – Горянинов (акад. Петербургской АН) допускал Шлейденовский цитогенезис для возникновения первых в эволюции клеток. Но в индивидуальном развитии признавал деление (перегородками, почкованием).
1841-1852 – Ремак. Его первые наблюдения –
деление клеток крови цыпленка.
Дал описание и обзор фактов по делению клеток и ядер перегородками и почкованием (позже Флемминг назвал такое деление амитозом). Утверждал, что это универсальное явление.
= Большой толчок к исследованию деления клеток.
1855-1859 – Рудольф Вирхов. «Целлюлярная патология».
Полностью развенчал теорию цитогенезиса Шлейдена, которая господствовала благодаря авторитету Шванна. Вирхов (1858): все клетки образуются путем деления! (Omnis cellula e cellulae!).
Слайд 7Однако Вирхов митоза не знал. Его видели, видели перестройки ядра, но
1867 – Гофмейстер = наблюдал митоз у растений.
1873 – Шнейдер (зоолог) = первое описание последовательных картин митоза на дробящихся яйцах плоского червя. Это наблюдение осталось неизвестным для биологов.
1874 – Бючли = редукционное деление у нематод и улиток. Но по его заключению, ядро выталкивается из клетки, а новообразование ядер и клеток происходит из вакуолек и зернышек цитоплазмы, все от Шлейдена).
1876 – Ван Бенеден = открыл клеточный центр.
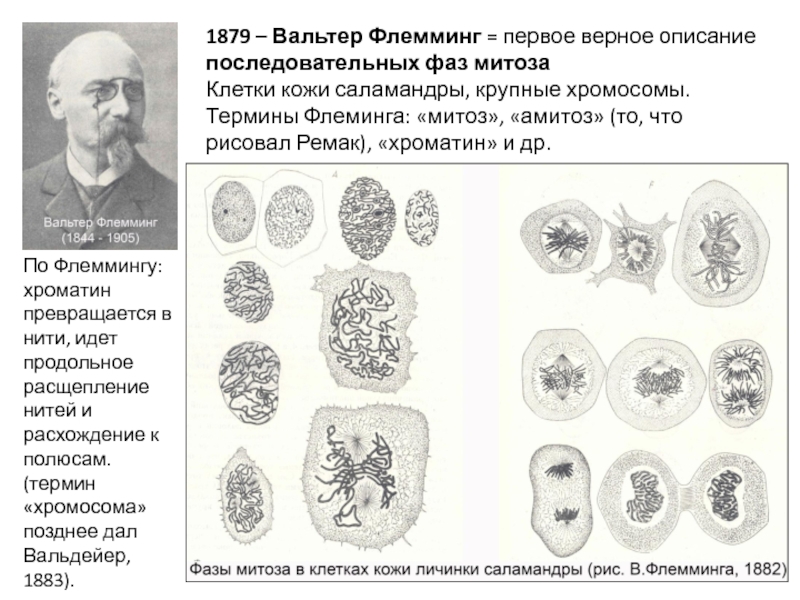
Слайд 81879 – Вальтер Флемминг = первое верное описание последовательных фаз митоза
Клетки кожи саламандры, крупные хромосомы. Термины Флеминга: «митоз», «амитоз» (то, что рисовал Ремак), «хроматин» и др.
По Флеммингу: хроматин превращается в нити, идет продольное расщепление нитей и расхождение к полюсам. (термин «хромосома» позднее дал Вальдейер, 1883).
Слайд 9Лавина работ. «Ядро затмило цитоплазму».
Особо отметим цикл работ Ван Бенедена –
Но объяснения смысла продольного расщепления хромосом не было.
1883 – Вильгельм Ру, крупнейший биолог-теоретик: зернышки ядра соединяются в нити, они (зернышки) разнокачественные. Только продольное расщепление нитей обеспечивает равноценное разделение содержимого ядра по двум клеткам.
Это величайшая догадка и, по сути, теория митоза.
1884-85 – О. Гертвиг, Страсбургер, Рабль. Сформулирована гипотеза: ядро – носитель наследственности.
Открыт закон постоянства числа хромосом в соматических клетках одного биологического вида.
Эта идея наиболее развита Августом Вейсманом в его учении о зародышевой и соматической плазме.
Дальнейшее развитие этой концепции – вся теория гена Томаса Моргана. Оформление цитогенетики с хромосомной теорией наследственности (Сеттон, нач. 20 в.).
1896 – Э. Вильсон (американский цитолог). Первая капитальная сводка по цитологии и цитогенетике: «Клетка и ее роль в развитии и наследственности» (русский перевод 1936, 1940).
Слайд 10Параллельно с морфологическими наблюдениями развиваются и биохимические.
1868 – Мишер =
1872 – в ядрах спермы лосося обнаружены протамины и НК.
1889 – получены чистые НК, свободные от белка.
Однако в начале 20 в. наследственный материал связывали с белками.
Н. Кольцов = идея самоудвоения белков хромосом.
Лишь в 40-х годах выявлены различия ДНК (ТНК) и РНК и установлена их локализация (Фельген, Розенбек, Белозерский, Девидсон).
Возникло предположение о связи ДНК с хромосомами и ее роли в хранении и передаче наследственной информации.
1953 – Уотсон и Крик = расшифровка структуры ДНК и механизма репликации. Позже Крик = расшифровка генетического кода (ЦДМБ).
1953 – Говард и Пелк = сформулированы понятие митотического цикла.
Сошлись биохимические и цитологические работы. Начало современного этапа в изучении механизмов репродукции и дифференцировки клеток.
1953 – умер Сталин = начало освобождение генетики и цитологии в СССР от засилия лысенковщины.
Слайд 112. Актуальность новых исследований
Кто и для чего изучает репродукцию и дифференцировку
Чьи же это проблемы?
Цитология (в узком смысле). Морфология митоза, цикл хромосом и др. клеточных структур, связь митоза и дифференцировки с клеточным метаболизмом.
Биология развития. Гаметогенез, в т.ч. специфический цикл мейоза. Репродукция и дифференцировка клеток как механизм эмбрионального морфогенеза (дробление, гаструляция, органогенез).
Гистология. Нормальный и репаративный гистогенез. Физиологическая регенерация (обновление) тканей и органов.
Слайд 12Частные гистофизиологические дисциплины. Особенно гематология и иммунология. Без знания динамики и
Онкология и радиобиология. Малигнизация (опухолевая трансформация) клеток. Именно задачи онкологии и радиобиологической защиты стали главным стимулом развития этих проблем в 50-60-е годы прошлого века и сохраняются по сей день. Задача: понять механизмы контроля, регуляции клеточного цикла, дифференцировки и смерти (апоптоза) клеток, чтобы ими управлять в патологических ситуациях.
Молекулярная биология и генетика. Регуляторы клеточного цикла и дифференцировки – молекулы, главным образом белки, кодируемые соответствующими генами (гены клеточного цикла и дифференцировки). Белковые регуляторы специфичны к тканевым клеткам-мишеням. Тут задействованы разнообразные гормоны, олигопептидные факторы роста, стимуляторы и ингибиторы, разнообразные молекулы-рецепторы, действующие в мембранах, цитоплазме и хромосомах на уровне сигналинга, активации транскрипции и трансляции. Ряд химических канцерогенов имеют сродство с регуляторами пролиферации (размножения) клеток. Открытие и изучение онкогенов и антионкогенов – молекулярно-генетическая проблема. Внутриклеточные сети молекулярного сигналинга – пути к управлению этими процессами.
Слайд 13Аналитическая и препаративная химия, фармакология. Получение чистых препаратов – стимуляторов и
Биотехнология. Клеточно-тканевая инженерия, заместительная терапия. Проблема стволовых клеток. Культивирование стволовых клеток, их искусственная детерминация и пересадка в организм, к больным органам. Выращивание тканей и органов in vitro.
Таким образом, проблемы репродукции и дифференцировки клеток – междисциплинарная область биологии, медицины, биотехнологии. Это область интересов синтетической науки – клеточной биологии.
Слайд 15Общая характеристика клеточного (митотического) цикла
Опыты Говарда и Пелка (1953). Открытие митотического
Корешки конского боба Vicia faba, меристема. Авторадиография с 35РО4.
РНК из препаратов экстрагировали, так что метка
получалась только от ДНК.
Показано, что синтез ДНК (редупликация хромосом)
происходит посреди интерфазы.
Рассчитаны параметры цикла: Т = 27 ч (реально 24 ч)
- время генерации, продолжительность цикла.
Выделены G1, S, G2, M – периоды (фазы) митотического цикла:
S – synthesis – синтетический; G1 – gap – пресинтетический, или постмитотический; G2 – постсинтетический, или премитотический; M – mitosis – митоз).
Определение митотического цикла:
Митотический цикл – циклическая последовательность взаимосвязанных и упорядоченных процессов, обеспечивающих подготовку к митотическому делению клетки и сам митоз.
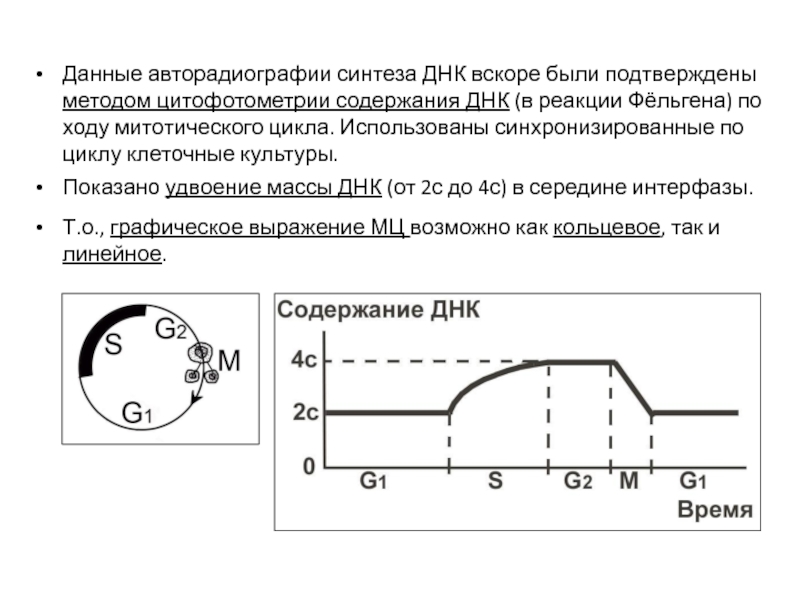
Слайд 16Данные авторадиографии синтеза ДНК вскоре были подтверждены методом цитофотометрии содержания ДНК
Показано удвоение массы ДНК (от 2с до 4с) в середине интерфазы.
Т.о., графическое выражение МЦ возможно как кольцевое, так и линейное.
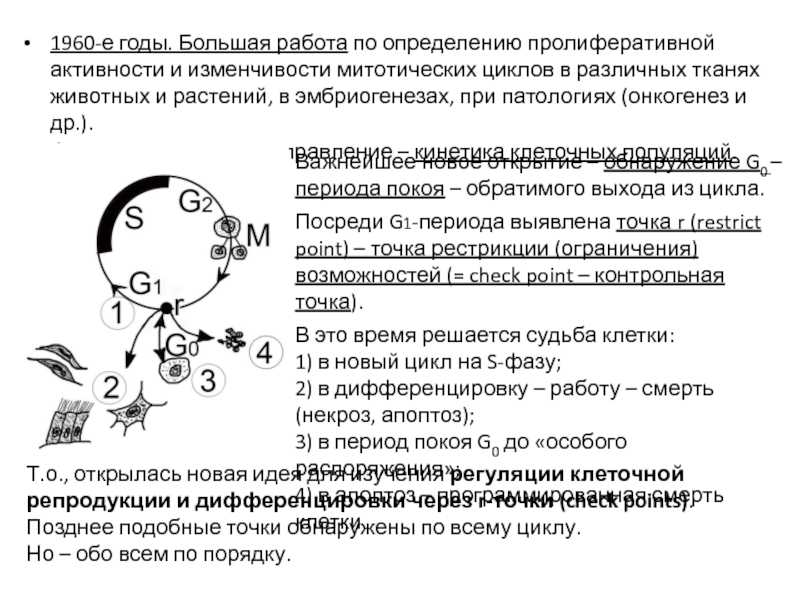
Слайд 171960-е годы. Большая работа по определению пролиферативной активности и изменчивости митотических
Формируется новое направление – кинетика клеточных популяций.
Важнейшее новое открытие – обнаружение G0 – периода покоя – обратимого выхода из цикла.
Посреди G1-периода выявлена точка r (restrict point) – точка рестрикции (ограничения) возможностей (= check point – контрольная точка).
В это время решается судьба клетки:
1) в новый цикл на S-фазу;
2) в дифференцировку – работу – смерть (некроз, апоптоз);
3) в период покоя G0 до «особого распоряжения»;
4) в апоптоз – программированная смерть клетки.
Т.о., открылась новая идея для изучения регуляции клеточной репродукции и дифференцировки через r-точки (check points). Позднее подобные точки обнаружены по всему циклу.
Но – обо всем по порядку.
Слайд 182. Методы изучения клеточного цикла и пролиферативной активности клеток
2.1. Авторадиография
Тейлор (1957) впервые применил 3Н-тимидин. Простота и безопасность в
работе, высокое разрешение, точность локализации метки
(мелкозернистые ядерные фотоэмульсии с Ag+).
- Импульсная метка = оценка индекса меченых
S-фазных ядер (ИМЯ), 0-10-20-...-50…%.
ИМЯ=30%
- Насыщение меткой = оценка пролиферативного пула (Р), 0-100%.
Слайд 19- Насыщение и разведение метки = определяется число циклов до выхода
- Учет % меченых митозов после введения 3Н-тимидина (Квастлер, Шерман, 1959) = графический метод определения параметров митотического цикла в асинхронной клеточной популяции (кривая меченых митозов).
В данном примере :
T = 10 ч
G2+1/2M = 2,5 ч
S = 3,7 ч
G1+1/2M =
T-S-(G2+1/2M) =
10-6,2 = 3,8 ч
Слайд 202.2. Цитофотометрия или проточная цитофлюорометрия ДНК (2-4с)
- Окраска ДНК по Фельгену
- Флюоресцентная микроскопия при окраске ДНК пропидиум-йодидом (PI) или ди-амино-фенил-индолом (DAPI). Проточная цитофлюорометрия суспензии клеток (оценивает до 10 тыс. клеток на 1 пробу).
= Оценка пропорции G1-, S-, G2-фазных клеток как критерий пролиферативной активности, быстрый анализ циклов в диагностике опухолей.
Слайд 212.3. Включение BrDU в синтезируемую ДНК
(БДУ – бром-дезокси-уридин,бромистый
аналог 3Н-тимидина).
БДУ вводят живым клеткам на 30-60 мин.
Далее материал фиксируют и ядра окрашивают
антителами к БДУ на синтез ДНК (на фото желто-
зеленые) + PI или DAPI на содержание ДНК.
Флюоресцентная микроскопия, имидж-анализ.
Проточная цитофлюорометрия на включение
БДУ дает те же оценки, что при авторадиографии с 3Н-тимидином.
Кинетика клеточного цикла выявляется анализом S-фазного включения
БДУ в синтез ДНК в сочетании с фотометрией массы ДНК в течение цикла.
Слайд 222.4. Другие специфические маркеры клеточной пролиферации.
- Иммуноцитохимическое выявление фосфорилированного гистона
Фосфорилирование гистона Н3 в клеточном цикле – одно из характерных событий, происходящих во время митоза. Поэтому окраска на фосфо-Н3 выявляет только митозы. Применяют антитела к фосфо-Н3 (anti-H3-P) + антитела к циклину B1 или А + окраска на ДНК.
Флюоресценция клеток U-937, окрашенных anti-H3-P (антитела к фосфорилированному гистону Н3) с докраской аминоактино-мицином D на ДНК.
Антитела связываются только с митотическими хромосомами. Интерфазные ядра и апоптоз (стрелка) не метятся.
Слайд 23= Проточная цитофлюорометрия на фосфо-Н3 выявляет митотический индекс – % клеток
Слайд 24- Иммуноцитохимическое выявление белка Ki-67 в циклирующих клетках.
Моноклональные антитела Ki-67 были
Сам белок Ki-67 – это антиген неясной локализации, связанный с пролиферацией; выявляется во всех активных фазах митотического цикла: G1, S, C2, M, но только не в G0.
= Проточная цитофлюорометрия оценивает общий пролиферативный пул и соотношение клеток в разных периодах цикла.
В нормальных (не опухолевых) клетках преобладает G0-период (по сути дифференцировка), хотя есть и циклирующие клетки. В опухоли G0-клетки практически отсутствуют, всё пролиферирует).
Слайд 25Иммуноцитохимическое выявление циклоспецифического антигена PCNA (Proliferating Cell Nuclear Antigen) с помощью
PCNA – одна из субъединиц ДНК-полимеразного комплекса, поэтому anti-PCNA связывается только в S-фазных ядрах. Это – филогенетически древние (консервативные) молекулы. Имеют значительную гомологию у животных, дрожжей, растений.
= Проточная цитофлюорометрия выявляет в ядрах уровень экспрессии PCNA в сочетании с оценкой содержания ДНК (для определения фаз цикла) – фактически это S-фазный индекс (ИМЯ в авторадиографии с 3Н-тимидином).
Слайд 263. Репликация ДНК
3.1. Подготовка к синтезу ДНК.
Подготовка к синтезу ДНК
Для синтеза ДНК необходимо наличие 4 видов дезоксирибонуклеотидов (ДНтидов): тимидиловый ТТФ, адениловый АТФ, гуаниловый ГТФ и цитидиловый ЦТФ.
Метаболический фонд нуклеотидов невелик. В основном он состоит из рибонуклеозидов, которые и являются источником образования дезоксирибонуклеотидов.
Для этого происходит:
энзиматическое восстановление рибозы до дезоксирибозы: РНзиды преобразуются в ДНзиды;
и далее фосфорилирование: нуклеозиды переходят в нуклеотиды.
Слайд 27Образование ТМФ – узловой пункт, т.к. для него нет прямого предшественника.
Весь процесс включает:
1) энзиматическое восстановление рибозы до дезоксирибозы – РНзиды преобразуются в ДНзиды;
2) метилирование урацила – уридин превращается в тимидин;
3) фосфорилирование тимидина – нуклеозиды переходят в нуклеотиды.
Слайд 28Фосфорилирование нуклеозидов происходит с помощью специфических киназ. Но не все киназы
С другой стороны, происходит катаболизм предшественников. Кислая фосфатаза способна дефосфорилировать ТМФ, выступая антагонистом киназы.
[Опыты с 3Н-тимидином. У земляной белки (низкая физиологическая активность) включение тимидина слабое, у золотистого хомячка (высокая активность) – сильное. Оказалось, что у белки резко увеличена активность ферментов катаболизма тимидина и др. нуклеотидов. Возможно, те же различия имеются у мидии и гребешка?].
Т.о., активность киназ тимидиловой системы и их антагонистов фосфатаз управляет пулом тимидинфосфатов и является лимитирующим фактором в подготовке к репликации ДНК. Синтез и распад нуклеотидов перед S-фазой – один из механизмов регуляции цикла (с помощью специальных киназ и циклинов, Глава 3).
Слайд 293.2. Полуконсервативный механизм репликации ДНК.
Молекула ДНК – двухцепочечная. Теоретически возможны 3
При разработке модели строения и удвоения ДНК Уотсон и Крик исходили гипотетически из полуконсервативного принципа: разрыв водородных связей, расхождение цепей, достройка на них комплементарных цепей (в соответствии с правилом Чаргафа: А-Т, Г-Ц).
В результате каждая новая молекула ДНК должна иметь одну нить от исходной молекулы, а вторую вновь синтезированную.
Но метода доказательства не было. А уже появились наблюдения фрагментации ДНК, сестринских хроматидных обменов (СХО). Позднее СХО были определены как мутации, но сначала это могло свидетельствовать в пользу дисперсного механизма репликации ДНК.
Первые исследования выполнены изотопными методами.
Слайд 301) Опыты с 3Н-тимидином (Тейлор, 1957-1963).
Корешки Vicia faba. Импульсное (0,5—1 час)
Фиксация на митозы 1-го цикла (через 3-5 час.) и 2-го цикла (через сутки):
Первая волна митозов: во всех хромосомах мечены обе хроматиды.
Вторая волна митозов: в каждой хромосоме мечена только одна хроматида.
Эти данные объясняются только исходя из полуконсервативного принципа репликации:
Слайд 312) Аналогичные опыты с БДУ (фон Латт, 1973).
Обычная ДНК (с тимидином)
Клетки китайского хомячка культивировали in vitro в течение 2 поколений в среде с БДУ.
Хроматиды красились (и светились) по-разному:
- сильно крашенные – исходные, без метки БДУ,
- средне крашенные – с 1 БДУ-замещенной нитью ДНК,
- слабо крашенные – с 2 БДУ-замещенными нитями ДНК.
Слайд 323) Опыты c 14N и 15N на E. coli (Месельсон, Сталь,
У бактерий одна кольцевая хромосома, упакованная в нуклеоид.
Удвоение ДНК происходит за 20-30 мин, и сразу наступает деление клетки.
Биохимический подход. Разработан метод равновесного центрифугирования в солевом растворе для разделения ДНК разной удельной плотности: легкая с 14N и тяжелая 15N.
E. coli выращивали 10 поколений на среде с 15NH4Cl. Практически весь азот заместился на тяжелый 15N.
Далее культура перенесена на среду с обычным 14NH4Cl. Начался синтез легкой ДНК.
В первом и втором циклах ДНК выделяли и центрифугировали.
Слайд 34Опыты с 3Н-тимидином на E. сoli (Кернс, 1963).
Включение 3Н-Т, разрушение клеток
Наблюдали образование 2-го кольца ДНК по полуконсервативному механизму.
Слайд 35У прокариот (уже в опытах Кернса на E. сoli) выявлены закономерности
- репликация начинается в определенной стартовой точке «О» (origin),
- репликация идет сразу в 2 направлениях (2 репликативные вилки) и заканчивается в точке «T» (terminal),
- вся хромосома – одна единица репликации, один репликон (то же самое показано у фага λ, вируса SV40).
Т.о., у прокариот и вирусов – монорепликонные хромосомы.
У эукариот все оказалось много сложнее.
3.3. Репликоны. Моно- и полирепликонные хромосомы.
Слайд 36Информация к размышлению:
- В 2n наборе хромосом человека содержится 6 пкг
то около 2 м, по 20-80 мм в отдельных хромосомах (сравни с 2 мм у E. сoli).
- Скорость репликации у эукариот (50 пн/сек) на порядок ниже, чем у прокариот (500 пн/сек). С такой скоростью при монорепликонной организации хромосом период синтеза ДНК длился бы сотни часов; на самом деле он занимает до 5-10 ч.
- Уже в ранних работах (Тейлор, 1960) показано, что импульсная метка 3Н-Т обнаруживается сразу во многих участках хромосомы. Особенно хорошо это видно на политенных хромосомах дрозофилы. Каждый диск (хромомер) – отдельный репликон?
Т.о., по длине хромосомы имеется множество точек инициации синтеза ДНК. Каждый автономно реплицирующийся участок– репликон. Хромосомы эукариот полирепликонные.
Слайд 37Первые попытки измерить длину репликонов (по методике Кернса) – 1968-75 гг.
3Н-Т
По разным расчетам длина одного репликона (расстояния между точками «о») варьировала от 10 до 250 мкм, что соответствовало от 5000 до 200 репликонам в средней хромосоме длиной 50 мм ДНК.
Так есть ли стандарт репликона, или они изменчивы?
Слайд 38Дополнительная информация к размышлению.
У одного и того же организма длительность S-фазы
У саламандры: эмбриональные клетки ранней бластулы - tS = 1 ч;
дифференцированные взрослые клетки - tS = 48 ч;
премейотический синтез в сперматоцитах - tS = 200 ч.
У морского ежа: первые деления дробления - Т = 1,5-2 ч, tS = 0,8 ч;
поздняя гаструла - Т = 50-60 ч, tS = 25-30 ч.
У дрозофилы: первые циклы дробления - Т = 10 мин, tS = 3,5 мин !
(расчетная длина репликона = 3-4 мкм).
клеточная культура от взрослых мух - все на порядок больше.
Т.о., время S-фазы удлиняется от нескольких минут до нескольких часов.
При этом во всех случаях скорость движения репликативных вилок примерно одинаковая!
Следовательно, в ходе развития уменьшается число точек инициации и, соответственно, увеличивается длина репликонов. Большинство точек, активных на ранних стадиях, не используются (отключаются) на более поздних стадиях.
Слайд 39Сформировано представление о нескольких уровнях репликонной организации хромосом (Андреева, 1983):
Репликоны I
Репликоны II порядка : 3 – 5 мкм, минимальные при светооптической авторадиографии (= часть петельного домена).
Репликон III порядка : 15 – 20 мкм, основной репликон с терминаторами (точки t); был известен как ARS – autonomously replicating sequences (= 2 половинки соседних петельных доменов хромонемы). В точках «о» находятся консенсусные последовательности из 11 нп: -АТТТАТАТТТА- .
Репликоны IV порядка : 150 – 200 мкм, самая крупная единица, 100-300 штук на хромосому (= один хромомер, или диск политенной хромосомы).
Слайд 40Т.о., в онтогенезе большинство точек «о» постепенно теряют инициирующую активность, длина
Сначала, в раннем эмбриогенезе, включены все элементарные репликоны, потом по 1 точке в репликонах II порядка, далее III, IV.
Имеем сложный многоуровневый (иерархичный) механизм регуляции репликации ДНК. Иерархические уровни репликации ДНК отражают дискретность структурной организации хроматина.
Слайд 413.4. Хронология синтеза ДНК. Рано и поздно реплицирующиеся участки
В первых циклах
Но репликоны III-IV порядков инициируются асинхронно. Т.о., по длине хромосомы и при сравнении разных хромосом наблюдается асинхронность репликации ДНК.
Однако это не означает беспорядочности репликации. Время начала и окончания репликации в тех или иных хромосомах (график репликации) сохраняется неизменным в ряду клеточных делений. Каждая хромосома характеризуется высокой стабильностью порядка репликации, имеет специфический рисунок репликации.
Слайд 42Порядок синтеза ДНК (включение 3Н-Т) в хромосомах человека № 1-5
в
Слайд 43При этом обнаружена универсальная закономерность:
- в первой половине
Распределение метки в хромосомах человека (46, ХХ) при включении 3Н-Т
в начале S-периода и в конце S-периода
(стрелкой показана Х-хромосома) (Захаров и др., 1982)
Так возникла проблема рано и поздно реплицирующейся ДНК.
Слайд 44Справка. В интерфазе клеточного цикла, при переходе хромосом в хроматин определенные
Факультативный гетерохроматин – не работающие конденсированные гены. Яркий пример – Х-хромосома (тельце Бара, половой хроматин) у млекопитающих и человека.
Структурный гетерохроматин – постоянно конденсированный в одних и тех же районах обеих гомологичных хромосом (теломерный, центромерный, интеркалярный, околоядрышковый). Образован разными видами сателлитной ДНК, многоповторными последовательностями нуклеотидов.
Оказалось, что правило Лима-де-Фария справедливо только для факультативного гетерохроматина, который действительно реплицируется в конце S-фазы.
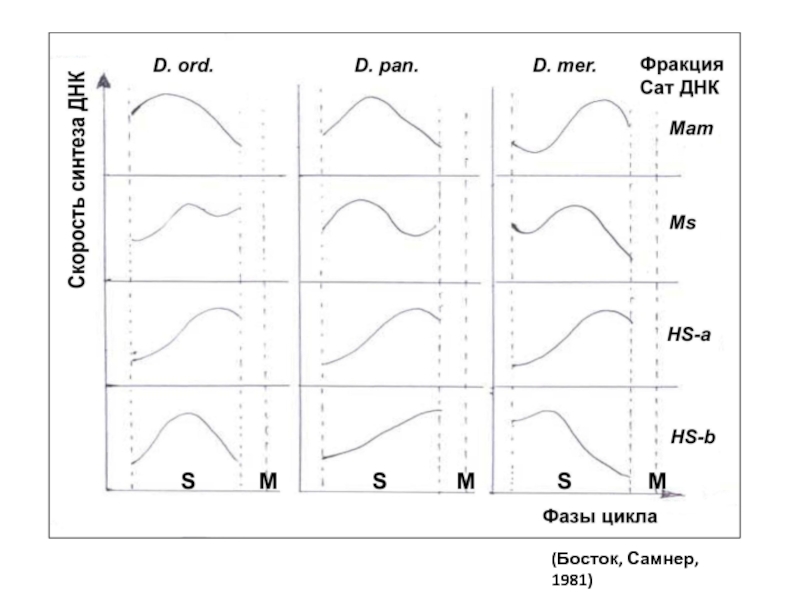
СатДНК реплицируется на протяжении всего S-периода, причем каждая фракция имеет свой пик синтеза в определенной части S.
Пример: на 3 видах кенгуровых крыс выявляли время репликации разных фракций сатДНК:
Слайд 46Выводы: по репликации гетерохроматиновой ДНК:
- Синтез разных фракций сатДНК может
- Хронология репликации видоспецифична;
- Распространенное представление о поздней репликации гетерохроматина справедливо только в отношении факультативного гетерохроматина.
- Эухроматиновая ДНК реплицируется преимущественно в первой половине S-фазы, но отдельные локусы реплицируются в середине и даже в конце S-фазы. Например, репликация ядрышковых организаторов:
NB: У хомячка и крысы гены рРНК (ЯОР) локализованы в 1 паре хромосом, у человека – в 5 парах. Каждая пара хромосом имеет свой график репликации.
(Босток, Самнер, 1981)
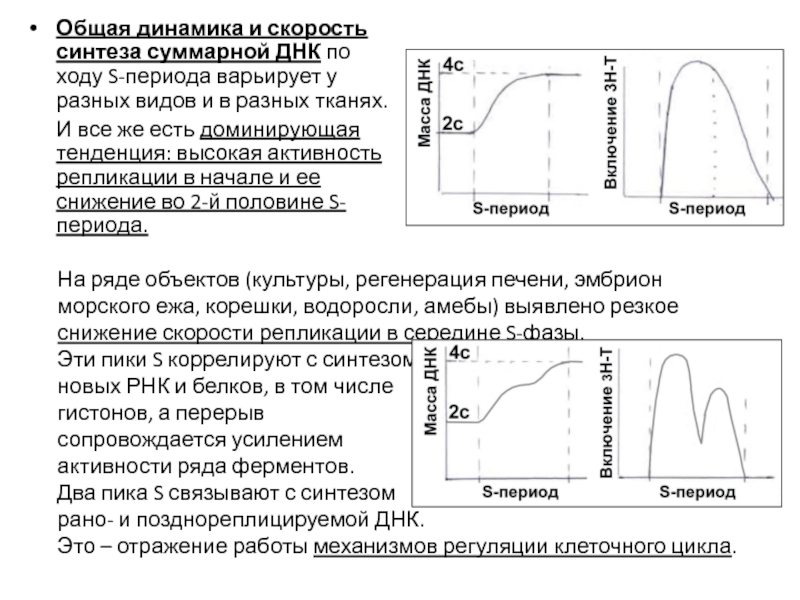
Слайд 47Общая динамика и скорость синтеза суммарной ДНК по ходу S-периода варьирует
И все же есть доминирующая тенденция: высокая активность репликации в начале и ее снижение во 2-й половине S-периода.
На ряде объектов (культуры, регенерация печени, эмбрион морского ежа, корешки, водоросли, амебы) выявлено резкое снижение скорости репликации в середине S-фазы.
Эти пики S коррелируют с синтезом
новых РНК и белков, в том числе
гистонов, а перерыв
сопровождается усилением
активности ряда ферментов.
Два пика S связывают с синтезом
рано- и позднореплицируемой ДНК.
Это – отражение работы механизмов регуляции клеточного цикла.
Слайд 483.5. Особенности репликации теломерной ДНК.
Теломерная ДНК – консервативная сателлитная высокоповторная ДНК.
Выделена,
- человек и другие позвоночные (более 100 видов): ……………………………….. (TTAGGG)n;
- беспозвоночные: та же или близкая последовательность;
- тетрахимена: …………………….. (TTGGGG)n;
- растения: …………………………… (TTTAGGG)n.
Число повторов (n) варьирует у разных видов: максимальное n у мыши – 100 тыс. нп, у обезьяны – 25 тыс. нп, у человека – 12 тыс. нп.
Но число повторов не одинаково и в разных типах клеток одного организма, например у человека в разных зрелых клетках n= 250-1500 нп.
Слайд 49Роль теломерной сатДНК :
Обеспечивает индивидуальность и интактность хромосом. При утрате теломеров
деградируют или связываются с
другими хромосомами
(в митозе образуются мосты).
Предотвращают разрушение эухроматической (=генетической) части хромосомы при множественной репликации. Концы хромосом сокращаются в каждом цикле из-за недорепликации по последнему РНК-праймеру (по модели Оказаки). Сокращается теломерная (сателлитная!) ДНК, а геномная ДНК до поры до времени защищена.
За теломером имеется субтеломерный участок (другая сатДНК, разная у разных видов). Это дополнительный буфер между теломером и генами.
На этом построена теломерная гипотеза старения клеток (основана А.М. Оловниковым, 1970-е годы):
Соматические клетки при каждом делении теряют часть теломерных повторов, которые изначально защищают генетическую зону от укорочения (разрушения). Когда теломеры и субтеломеры израсходуются, разрушаются концевые гены, разрушаются хромосомы. Клетка погибает.
Слайд 50В соматических клетках ген теломеразы блокируется, его транскрипция ослабевает или становится
Не случайно в клетках разных типов хромосомы различаются по длине теломеров, а самые длинные «хвосты» обнаружены в генеративных клетках.
Т.о., бессмертие клеток в активности гена теломеразы! Ген выделен и клонирован. Введение его в старые клетки продлевает их размножение. Биотехнологическое значение.
Но в генеративных клетках (гониях, эмбриональных стволовых, раковых) экспрессируется РНК-содержащий фермент теломераза; ее РНК-фрагмент комплементарен сат-повтору ТТАГГГ.
Теломераза в каждом цикле достраивает недостающие последовательности нуклеотидов ДНК: сначала по 3’-концу с помощью своего РНК-фрагмента, а потом по 5’-концу с участием ДНК-полимеразы.
Слайд 513.6. Репаративный синтез ДНК.
В ДНК постоянно возникают ошибки и
Ошибки – спонтанные (происходят при репликации или рекомбинации ДНК).
Нарушения – индуцированные (происходят под действием УФ света, R-лучей, химических веществ).
Но в клетке есть гены, обеспечивающие синтез не только реплицирующих, но и репарирующих ферментов. Обычно эти ферменты совмещены в ДНК-полимеразных комплексах.
Слайд 52 Ошибки происходят уже при обычной (комплементарной!) репликации ДНК – случайные
Пример – обычные и необычные пары нуклеотидов, возникающие спонтанно из нестандартных (минорных) оснований:
Слайд 53В этих случаях рост цепи сразу останавливается, и экзонуклеаза (домен в
В репарации и репликации участвуют также:
Pol II (заполняет пробелы между фрагментами Оказаки),
Pol III (ключевая полимераза по хромосомной ДНК E. coli),
ДНК-лигазы (соединяют цепи ДНК при репликации, репарации и рекомбинации),
топоизомеразы I и II (разрывы и сшивки на «острие» репликативной вилки – шарнир).
Нарушения (повреждения) – нарушения остова ДНК, модификации оснований или ошибочные спаривания оснований при рекомбинации (в ходе кроссинговера).
2-цепочечные повреждения в одном месте, в том числе 2-цепочечные разрывы, они всегда летальны. (Уникальное исключение – Т4-лигаза E. coli: при внедрении фага Т4 соединяет 2-цепочечные фрагменты на концах разрыва.)
Слайд 54Примеры нарушений ДНК.
При повышении температуры – разрывы связей между пуринами (А,
Результат – нарушение
репликации и экспрессии генов.
2. Спонтанное дезаминирование цитозина и аденина, с превращением их в урацил и гипоксантин (природное производное пуринов).
Частота – до 100 событий на геном за сутки.
NB: Эти нарушения должны быть устранены до начала следующего раунда репликации, т.е. сразу в S-периоде, в G2-, M- или G1-периоде данного клеточного цикла. Иначе, в ходе новой репликации ДНК, 1-нитевое нарушение будет закреплено и во 2-й цепи. Это уже устойчивая мутация.
Слайд 55Факторы, вызывающие повреждения ДНК.
1. Химические вещества окружающей среды:
- алкилирующие агенты (например,
- разные агенты, вызывающие ковалентные сшивки между цепями ДНК.
2. Физические воздействия:
- УФ поглощается тимином и цитозином, что ведет к сшивкам между соседними пиримидинами в одной цепи;
- ионизирующая радиация (в том числе космические лучи) ведет к образованию реакционных свободных радикалов, оказывающих на ДНК разные повреждающие воздействия;
- медицинское R-облучение инициирует 1-2-нитевые разрывы и другие нарушения.
Слайд 56Как это восстанавливается до начала следующей репликации?
1.
- специальные ферменты могут просто снимать метильные группы, полученные под действием алкилирующих агентов;
- ферменты фотолиазы (фотореактивирующие ферменты бактерий и низших эукариот) под действием видимого света превращают пиримидиновые димеры, полученные при УФ облучении, в нормальные мономеры.
Слайд 572. Замена модифицированных оснований:
(1) фермент узнает повреждение ДНК и надрезает цепь
(2) экзонуклеаза удаляет нуклеотид или целую группу, оставляя брешь;
(3) удаленный участок синтезируется заново с 3’-конца по целой цепи;
(4) ДНК-лигаза сшивает концы разрыва.
Могут использоваться и эндонуклеазы, например разнообразные AP-эндонуклеазы (апуриновые, апиримидиновые), где произошла депуринизация и депиримидинизация. Разрушается участок из нескольких нуклеотидов, потом он ресинтезируется.
Слайд 58Пиримидиновые димеры вырезаются специальными нуклеазами влево и вправо, всего на 12
Слайд 59
Значение репарации ДНК.
Повреждения ДНК блокируют репликацию (передачу информации в ряду поколений)
Поврежденная ДНК еще более уязвима. Поэтому повреждения надо устранять.
Мутации по генам ферментов репарации – прямой путь к мутациям структурных генов, т.е. к разнообразным генетическим заболеваниям, включая онкологические .
В частности, у людей с пигментной ксеродермой нарушена способность к выщеплению пиримидиновых димеров из УФ-облученной ДНК (мутация в 1 из 9 генов). Даже при слабом воздействии солнечного света развивается рак кожи.
Слайд 604. Синтез РНК и белков в клеточном цикле
Размножение клеток, как правило,
(Старое представление о «критической массе», необходимой для начала деления. Опыты с амебой: периодическое отрезание части цитоплазмы ведет к бесконечной задержке митоза.)
Исключения: дробление зиготы и некоторые специальные случаи.
В основе роста клетки лежат синтезы РНК и белков (транскрипция и трансляция генетической программы).
Слайд 614.1. Синтез РНК.
Необходим синтез и процессинг 3 форм РНК – иРНК,
Гены пре-иРНК (10-80s РНК) локализованы диффузно по эухроматину всех хромосом. Это уникальные или умеренно (10-20) повторенные последовательности; в геноме человека около 25 тыс. таких генов.
Пре-иРНК – подвергается процессингу и сплайсингу в перихроматиновых гранулах – информоферах (разрушается до 80-90 % интронной РНК). Готовая иРНК (сшитые экзонные фрагменты) выходит через ядерные поры в цитоплазму, связывается с новыми белками и образует информосомы.
Гены пре-тРНК (4s РНК) – локализованы так же диффузно; это умеренные повторы. В геноме 61 вид генов тРНК (по числу кодонов). Процессинг идет без сплайсинга.
Гены пре-рРНК (45s РНК) – локализованы в ядрышках (ЯОР, NOR), они присутствуют в фибриллярных центрах и фибриллярном компоненте ядрышка. Это 1 вид гена, он образует умеренные повторы. У человека до 500 повторов в 5 парах хромосом.
45s РНК процессирует без сплайсинга до 18s, 28s и 5,8s рРНК.
(5s рРНК синтезируется на других хромосомах).
Слайд 63Количество РНК в клетке вне цикла остается постоянным, т.к. синтез и
- Данные цитофотометрии: общая масса РНК или только рРНК в ходе интерфазы примерно удваивается.
- Морфологические данные: увеличение объема ядрышек в циклирующих клетках (регенерирующая печень, крипты кишечного эпителия и др.).
Динамика синтеза и процессинга РНК исследуется на синхронизированных клеточных культурах (или в асинхронных клеточных популяциях) при одновременном учете ДНК (фаза цикла) и РНК.
Оценивают включение в РНК 3Н-уридина или флуоресцентно меченного урацила (в форме УТФ), активность РНК-полимеразы I (ядрышковая), РНК-полимеразы-II (хроматиновая).
Слайд 64В 1960-е годы установлено:
- Все основные синтезы,
(NB: понятие «синтетический период» интерфазы (S) – относится только к синтезу ДНК; все другие синтезы идут на протяжении всей интерфазы, хотя скорости изменяются.)
- Митоз – инертная, не активная фаза; синтез РНК прерывается от поздней профазы до ранней телофазы вследствие компактизации эухроматина;
- В интерфазе транскрипция прерывается только в реплицируемых участках хроматина (синтезы РНК и ДНК взаимоисключены в 1 пуфе политенной хромосомы).
Позже выявлено, что разные формы РНК имеют свои максимумы синтеза.
Слайд 65Синтез рРНК (ядрышковая, рибосомная) – показано разобщение транскрипции и процессинга.
Volpe et
Импульсная метка 3Н-уридина, интервал проб – 1 час.
Суммарную РНК выделяли и фракционировали центрифугированием по скорости седиментации в градиенте сахарозы. Выделяли ядрышковые фракции РНК: 45s (первичный транскрипт), 32s (промежуточный процессинг), 28s и 18s (конечные рРНК формы).
Радиоактивность фракций РНК, отражающую скорость синтеза (45s) или процессинга (32s, 28s, 18s), оценивали сценциляционным счетчиком.
Результат:
Слайд 66Синтез 45s РНК (пре-рРНК) резко возрастает в G1-периоде (быстрый рост клетки
Процессинг идет в 2 волны; на самом деле это 1 волна, прерванная митозом:
- ранний процессинг (в S-G2) дает первую партию рибосом, поздний процессинг (продолжение волны в G1) дает последнюю партию.
Синтез 45s РНК и ее процессинг (появление 32s, 18s, 28s РНК) разобщены во времени, каждый имеет свою динамику.
Слайд 67Синтез иРНК – показан эффект дозы генов.
Многочисленные исследования по включению 3Н-уридина
Детальные исследования группы Pfeiffer (1968) на синхронизированной культуре HeLa, подтвержденные позже на других объектах (др. культуры, растения, инфузории, плесень).
Применяли 3Н-уридин импульсно (0,5-1 час) в разных точках цикла.
Результат:
Слайд 68Скорость синтеза иРНК высокая по всей интерфазе (в разных работах разные
В первой половине S проявляется эффект дозы генов – в связи с репликацией эухроматиновой ДНК (удвоение числа активно функционирующих генов). В разных типах клеток для этого требуется репликация 30-50 % ДНК ядра.
(Воздействие ингибиторами репликации ДНК подавляло рост синтеза РНК в S-периоде).
Слайд 69NB: Четкая зависимость синтеза РНК от дозы генов выявляется не всегда.
Надо учитывать:
Артефакты: несовершенство методик, плохая синхронизация цикла.
Различия клеток: степень их митотической потентности (стволовости), степень дифференцировки, т.е. разное соотношение ауто- и гетеросинтезов РНК.
Изменения активности РНК-полимераз или их поступления в ядро.
Колебания пула нуклеотидов – общих предшественников РНК и ДНК.
Возможность изменения проницаемости мембран и т.д. и т.п.
Слайд 704.2. Синтез белков.
Синтез белков выявляют по включению в живые клетки меченых
Радиоактивную метку регистрируют на микроскопических препаратах (авторадиография) или в выделенных белках (счетчиком).
Используют клеточные культуры, синхронизированные по фазам цикла.
Результаты по синтезу общих (суммарных) белков очень различаются в зависимости от типа клеток, их возраста, используемого предшественника и др. факторов.
Но есть и общие тенденции.
Слайд 71Наиболее типичный результат (культура HeLa, 3Н-лейцин, импульсная метка за 3 мин.):
- в G1 синтез максимальный, в S – снижение, в G2 – второй максимум, но меньше первого.
Что бы это значило? Не противоречит ли это динамике синтеза иРНК с эффектом дозы генов в первой половине S-фазы?
Попробуем согласовать различные динамики (производство рибосом, транскрипция структурных генов – синтез иРНК, синтез беков) по максимальным проявлениям этих процессов.
Слайд 72В такой интерпретации выстраивается логичная последовательность согласованных событий.
Синтез белков имеет
Продолжительность одного синтетического цикла (синтеза РНК и суммарных белков) примерно в 1,5 раза длиннее митотических цикла, поэтому последовательные синтетические циклы перекрываются (довольно распространенная закономерность).
Слайд 73Для синтеза индивидуальных белков выявляются свои кинетические кривые.
Синтез тубулинов (3Н-лейцин
Динамика включения 3Н-лейцина в тубулины наводит на мысль о том, что этот белок максимально синтезируется непосредственно перед митозом (2-я половина S и весь G2-период) и сразу участвует в строительстве микротрубочек митотического веретена:
Однако мысль оказалась неверной. Проведем два проверочных теста.
Слайд 74В G2 пометим белки 3Н-лейцином. Веретено первого митоза (М1) оказывается не
Блокируем синтез тубулинов в G2-периоде с помощью пуромицина (антибиотик – блокатор синтеза белков). Ближайший митоз идет без остановки, но последующие митозы задерживаются в анафазе, значит митотическое веретено не организовано.
Реалный цикл синтеза тубулинов для микротрубочек веретена таков:
Синтез тубулинов для веретена митоза (М2) происходит в основном в интерфазе предыдущего митотического цикла (S – G2), а заканчивается в G1 – S нового цикла. В G2-периоде этого цикла идет лишь сборка тубулинов в микротрубочки веретена, но также начинается синтез тубулинов для веретена следующего митоза (М3) и т.д.
Слайд 75Синтез гистонов идет почти синхронно с синтезом ДНК (начинается чуть раньше
Таким образом, динамика синтеза индивидуальных белков (и их мРНК) мозаична.
Особый график у белков-регуляторов клеточного цикла – CD-киназ и их циклинов, но это отдельная тема.
Слайд 765. Митоз. Хромосомный цикл
В митозе связаны воедино преобразования хромосом – хромосомный
5.1. Концепция структурной непрерывности хромосом
В интерфазе клеточного цикла морфологически обособленные хромосомы не видны. Однако они здесь присутствуют в форме хроматина – в деконденсированном (декомпактизованном, деспирализованном) состоянии.
- В конденсированном состоянии (метаболически не активном), в процессе митоза, выполняется функция разделения генетического материала.
- В деконденсированном состоянии, в интерфазе, - функции репликации и транскрипции.
При этом каждая хромосома в цикле остается цельной непрерывной нитью, деконденсация происходит без разборки, без разрывов, а пространственная организация хроматина обеспечена связями с ядерным матриксом и ламиной ядерной оболочки.
Слайд 77Доказательства структурной непрерывности хромосом.
- Уже в 1887 г. Теодор Бовери
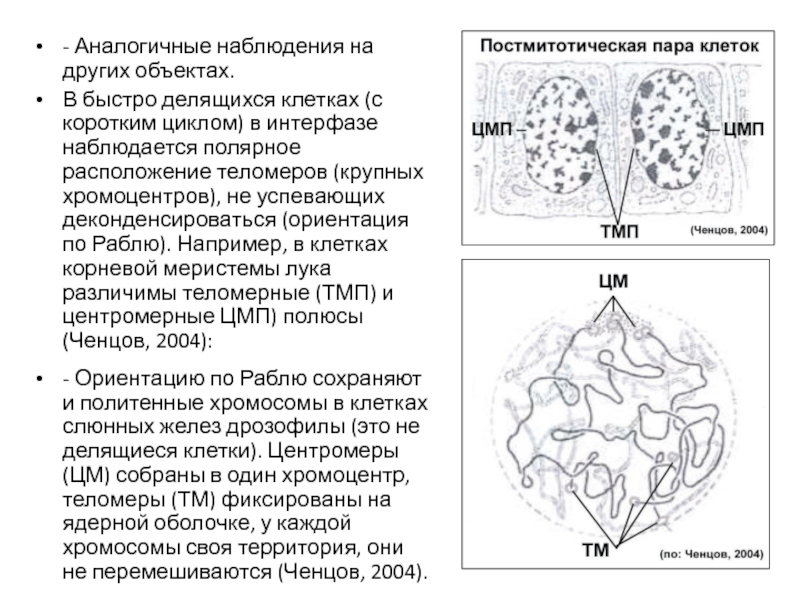
Слайд 78- Аналогичные наблюдения на других объектах.
В быстро делящихся клетках (с коротким
- Ориентацию по Раблю сохраняют и политенные хромосомы в клетках слюнных желез дрозофилы (это не делящиеся клетки). Центромеры (ЦМ) собраны в один хромоцентр, теломеры (ТМ) фиксированы на ядерной оболочке, у каждой хромосомы своя территория, они не перемешиваются (Ченцов, 2004).
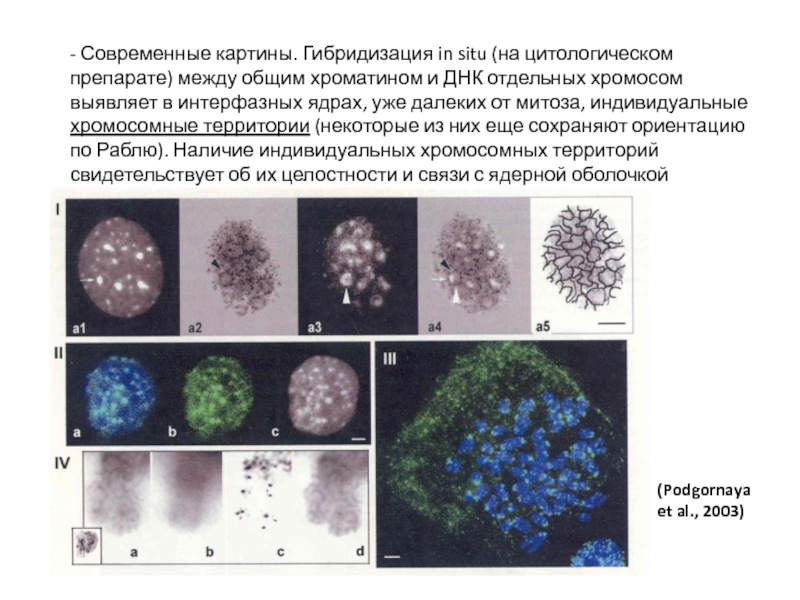
Слайд 79- Современные картины. Гибридизация in situ (на цитологическом препарате) между общим
(Podgornaya et al., 2003)
Слайд 80- Постоянство хромосомной территории для гетерохроматической Х-хромосомы в ядрах у особей
- Закономерное расположение определенных хромосом сохраняется и в метафазной пластинке. Это означает, что в интерфазном ядре они как-то фиксированы и сохраняют целостность, не рассыпаются на фрагменты.
- Работы по доказательству полуконсервативного механизма репликации ДНК. Во 2-м делении в хромосомах одна хроматида мечена, другая нет. Значит, ДНК хроматиды в интерфазе не распадается, сохраняет индивидуальную целостность.
- По данным формальной генетики, в процессах кроссинговера, скрещивания, при хромосомных разрывах функциональной единицей выступает хроматида. Сцепленное наследование признаков (Морган) – тоже следствие неизменного линейного расположения генов в хроматиде.
- У дрозофилы и др. объектов биохимическое определение молекулярной массы ДНК (центрифугирование, электрофорез) дало полное совпадение с расчетной молекулярной массой (исходя из размера митотических хромосом). Т.о., хромосома – одна гигантская молекула ДНК, ее длина не изменяется в клеточном цикле.
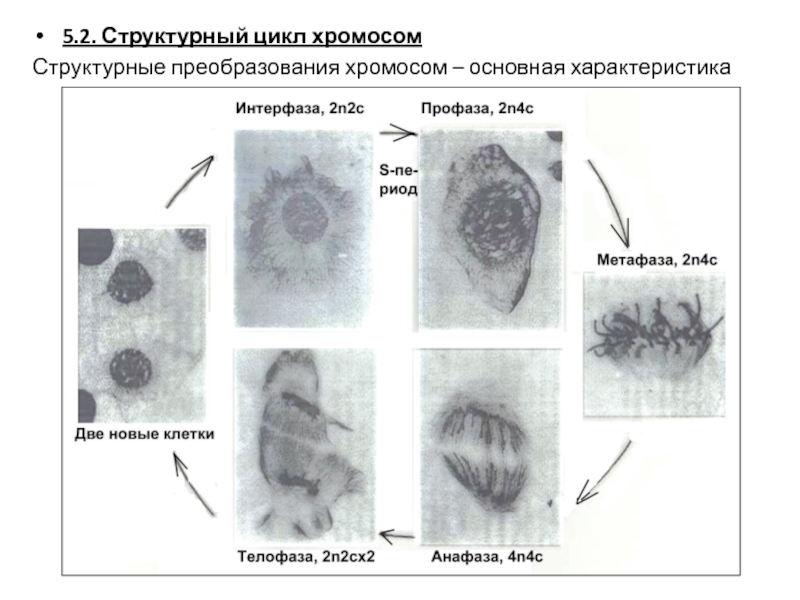
Слайд 815.2. Структурный цикл хромосом
Структурные преобразования хромосом – основная характеристика митоза.
Слайд 82Интерфаза. Хромосомы не видны, они деконденсированы до хроматина. Бывают различимы крупные
Профаза. Появляются нитевидные хромосомы (плотный клубок, рыхлый клубок – процесс компактизации). Они сначала длинные и тонкие. Иногда видно, что они уже двойные – это сестринские хроматиды. Начинает разрушаться ядерная оболочка. Генетическая формула клетки: 2n4c.
Прометафаза. Компактизация продолжается. Центромерные участки хромосом под действием нитей веретена выталкиваются к экватору клетки. Ядерная оболочка распалась. Генетическая формула клетки: 2n4c.
Метафаза. Максимальная компактизация хромосом. Все они бихроматидные. Плечи разделены, но центромеры пока еще связаны. Т.к. все центромеры собраны в экваторе (под действие веретена), хромосомы организованы в виде метафазной пластинки. Генетическая формула клетки: 2n4c.
Анафаза. Сохраняется максимальная компактизация. Хроматиды разделяются и под действием веретена расходятся к его полюсам. Генетическая формула клетки: 4n4c.
Телофаза. Формируются дочерние ядра. Начинается деконденсация хромосом, они представляют плотный клубок. Происходит цитокинез. Клетки входят в новую интерфазу. Генетическая формула клетки: 2n2c х 2.
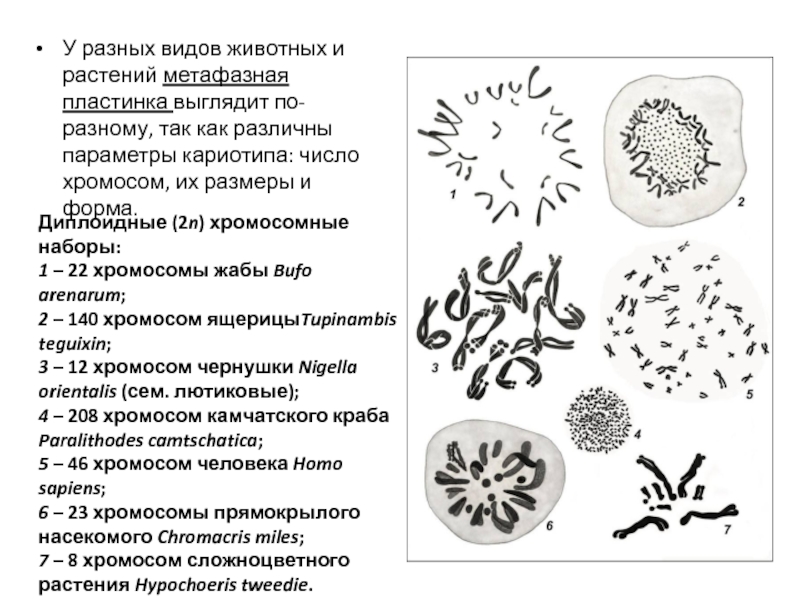
Слайд 83У разных видов животных и растений метафазная пластинка выглядит по-разному, так
Диплоидные (2n) хромосомные наборы:
1 – 22 хромосомы жабы Bufo arenarum;
2 – 140 хромосом ящерицыTupinambis teguixin;
3 – 12 хромосом чернушки Nigella orientalis (сем. лютиковые);
4 – 208 хромосом камчатского краба
Paralithodes camtschatica;
5 – 46 хромосом человека Homo sapiens;
6 – 23 хромосомы прямокрылого насекомого Chromacris miles;
7 – 8 хромосом сложноцветного растения Hypochoeris tweedie.
NB: Все рисунки выполнены при одном увеличении (Мюнтцинг, 1967).
Слайд 84Каким же образом в митотической хромосоме длиной 4 мкм упаковано 4
Как в ядре диаметром 10 мкм вмещается 1,8 метра ДНК?
Как упакована / распакована ДНК в составе интерфазного хроматина?
Насколько стабильна или лабильна эта упаковка?
Как она влияет на функциональную активность генов?
Чем и как контролируется?
Все дело в белках!
ДНК в составе очищенного хроматина (хромосом) составляет лишь 40 %, остальное – белки, в основном гистоны. Примеси: РНК, углеводы липиды, мембранные фракции.
Химический состав хроматина, относит. ед. (Ченцов, 2004)
Слайд 85Гистоны отвечают за низшие уровни компактизации. Это оснóвные (щелочные) белки, богатые
Н3 и Н4 – аргининбогатые гистоны, самые консервативные (у коровы и гороха различия всего по 2 аминокислотам).
Н2А и Н2В – умеренно лизинбогатые. Имеется межвидовая вариабельность.
Н1 – большое семейство лизинбогатых гистонов, самые щелочные (легко отделяются от хроматина в 0,5М солевых растворах). Наименее консервативные, имеются межвидовые и даже межтканевые вариации.
Н5 – содержит много аргинина и серина. Замещает гистон Н1 в эритроцитах низших позвоночных.
Слайд 86NB: С помощью положительных зарядов лизина и аргинина гистоны образуют нековалентные
Для всех гистонов (особенно Н1) характерно кластерное распределение лизина и аргинина на N- и С-концах молекулы. Именно концы молекулы (щелочные, положительно заряженные) взаимодействуют с ДНК и соседними гистонами. Средние участки нейтральны и образуют 3-4 α-спиральных домена.
(Ченцов, 2004)
Слайд 87Негистоновые белки формируют высшие уровни компактизации хроматина и хромосом. Это кислые
Функции не только структурные, но и регуляторные. Т.е. фракция негистоновых белков включает разнообразные ферменты, факторы транскрипции и их ингибиторы. Они специфически взаимодействуют с определенными последовательностями нуклеотидов ДНК.
К 1980-м годам в результате морфологических и биохимических исследований сформировалось представление о 4 (5) уровнях компактизации хроматина (хромосом).
Слайд 88(I) Нуклеосомная фибрилла диаметром 10 нм. (1нм = 0,001
Хроматин в щелочной среде с низкой ионной силой распадается на тонкие
фибриллы типа «бусы на нитке». «Бусы» – ДНК-гистоновые глобулы
диаметром 10-11 нм, скорость седиментации – 11S. «Нитка» – отрезки ДНК
(толщина 2нм) длиной около 20 нм (разрушается ДНКазой).
Микрококковая нуклеаза режет хроматин на отрезки, кратные 200 нп (200,
400, 600... нп) и 11S (11S, 22S, 33S…). Т.о., выявляются мономеры
(элементарные частицы хроматина), их димеры, тримеры ... Элементарные
частицы получили название нуклеосомы.
(Ченцов, 2004)
Слайд 89Максимальная нуклеосома (11S) включает:
фрагмент ДНК около 200
8 гистонов – октамер (2хН2А, 2хН2В, 2хН3, 2хН4) и
одну молекулу гистона Н1. Вокруг кора 146 нп
образуют 1,75 оборота, остальные 54+ нп (8-114)
образуют свободный линкер.
Гистоны Н1 расположены поверх нуклеосом,
взаимодействуя с кором и линкером.
Минимальная нуклеосома – то же без линкера и Н1.
Коэффициент компактизации ДНК в нуклеосомной фибрилле = 6-7х.
NB: гистон Н1 для образования самих нуклеосом не требуется, но участвует в стягивании соседних нуклеосом при формировании следующего уровня компактизации.
Нуклеосомная структура хроматина устанавливается сразу в момент репликации ДНК, так как синтез гистонов немного опережает синтез ДНК. Старые и новые октамеры гистонов (коровые частицы) распределяются между сестринскими цепями ДНК случайным образом. В репликативной вилке, а также под РНК-полимеразой при синтезе РНК нуклеосомы, вероятно, расщепляются в полунуклеосомы, не сползая с ДНК.
(Альбертс и др., 1994)
Слайд 90(2) Основная хроматиновая фибрилла диаметром 30 нм.
Фибрилла 30 нм формируется под
Существуют 2 модели упаковки 30 нм фибриллы: соленоидная и нуклеомерная (см. рис.).
Нуклеомеры – сверхбусины, «супербиды». При обработке нуклеазой они могут разделяться и образовывать 30 нм глобулы с константой седиментации 45S. В ЭДТА и при удалении магния 30 нм глобулы разворачиваются в нуклеосомные цепочки (по 6-8 нуклеосом).
Гистоны Н1 также организованы в кооперативные группы по 6-8 молекул.
Коэффициент компактизации ДНК в 30 нм фибрилле = 40-42х.
NB: Второй уровень упаковки не траскрибируется! Взаимодействие с ферментами и многими регуляторными белками невозможно. Гены блокированы.
(Ченцов, 2004)
Слайд 913. Петельно-хромомерная фибрилла – хромонема.
Дальнейшая компактизация хроматина обеспечивается негистоновыми белками. Специфические
Т.о. дискретная единица 3-го уровня компактизации – петельный домен.
(NB: один петельный домен соответствует репликону III порядка и содержит 1 или несколько генов. В основаниях петель находятся регуляторные белки.)
Несколько петельных доменов (15-80) объединены матриксинами в розетку, а свернутая розетка формирует хромомер (диаметр 100-150 нм).
Хромомеры в составе хромосом, частично деконденсированных при гипотонии. а –общий вид; б – крупно. (Ченцов, 2004)
Слайд 92Хромомер содержит до 200 тыс. нп ДНК, что составляет длину до
При обработке протеиназами белки расщепляются и хромомеры-розетки рассыпаются с освобождением 30 нм фибрилл, а при обработке ДНКазами исчезают петельные домены.
Хромомерная упаковка дает коэффициент компактизации 600-700х.
- Вся совокупность хромомеров одной развернутой хромосомы в интерфазном ядре представляет общий тяж – хромонему (толщина 0,1-0,2 мкм). Хромонемы с упакованными хромомерами видны в ранней профазе митоза или даже в метафазных хромосомах при их искусственной деконденсации.
Хромомеры, выделенные из макронуклеуса инфузории (Попенко: Ченцов, 2004)
Хромонема с хромомерами, находящимися в различном состоянии (Ченцов, 2004)
Слайд 934. Хроматида (хромосома).
В профазе митоза происходит постепенное скручивание хромонемы в хроматиду
Хромосомы в профазе митоза. В них видны свернутые хромонемы. (Ченцов, 2004)
Слайд 94Максимальная компактизация хромосом достигается в метафазе. Коэффициент = 10000х.
В телофазе и
Метафазные хромосомы на срезе в трансмиссионном ЭМ (а, б)
и с поверхности в сканирующем ЭМ (в). (Ченцов, 2004)
Слайд 95Модели организации хроматина и хромосом
Альбертс и др., 1994
Слайд 966. Митоз. Цикл митотического веретена
Веретено обеспечивает расхождение хромосом в митозе. Это
6.1. Микротрубочки (25 нм) – элементы цитоскелета, состоят из белков тубулинов и микротрубочко-ассоциированных протеинов (MAPs).
Локализация МТ различна : бывают одиночные МТ, рыхлые пучки, центриоли и базальные тельца (3х9), аксонема ресничек и жгутиков (2х9 + 2). Во время митоза большая часть МТ входит в состав митотического веретена.
Полимеризация МТ.
Субъединицы α- и β-тубулина (5 нм) образуют гетеродимеры,
потом кольца (нуклеация), потом трубочки в 13 продольных протофиламентов. Полимеризация сопровождается
гидролизом ГТФ до ГДФ.
Димеры изначально поляризованы, поэтому и каждая МТ
оказывается полярной. Быстро растущий плюс-конец и
медленно растущий или разбираемый минус-конец (разная
скорость гидролиза ГТФ, до его полной остановки).
(по:Campbell, 1996)
Слайд 97Предполагаются различные модели полимеризации тубулинов и самосборки микротрубочек
(по: Ченцов, 2004)
Слайд 98NB: Рост на +конце преобладает (быстрый гидролиз ГТФ) =
Колхицин (алкалоид) связывается с тубулином и препятствует полимеризации МТ = разборка цитоплазматических МТ (потеря формы клеток) и МТ митотического веретена. То же с колцемидом и нокодозолом, но после отмывки МТ восстанавливаются.
Таксол, напротив, способствует полимеризации тубулина, даже при низких концентрациях = избыточный рост МТ.
MAP-белки ускоряют полимеризацию = стабилизируют МТ в дифференцированных клетках.
ВЫВОД: МТ являются очень динамичными структурами, способны быстро возникать и разрушаться. Время полужизни МТ = около 5 мин! За 15 мин. обновляется около 80% МТ.
В дифференцированных клетках до 20 % МТ стабилизированы, «живут» несколько часов (дополнительные MAPs, ацетилирование по лизину, удаление терминального тирозина).
Слайд 99Функции микротрубочек:
- Скелетная (каркасная)
функция – стабилизация
формы клетки,
поддержание отростков
(нейроны, фибробласты,
эритроциты, радиолярии
и т.п.).
Клетка без МТ – шар.
- Растяжение клеток, быстрый рост в длину, совместно с клеточной стенкой (типично для растений).
NB: Двигательная функция ! – внутриклеточный направленный транспорт органелл и включений, экзоцитоз (мерокриновая секреция), движение ресничек и жгутиков, работа митотического веретена.
(по: Ченцов, 2004)
Слайд 100Механизм движения органелл по микротрубочкам.
1960-е годы. В аксонах нервных клеток
Это оказалось перемещение вакуолей (везикул) и гранул по микротрубочкам.
Т.о., микротрубочки – не просто направляющие пути для перемещения органелл. Это «рельсы», по которым движутся «локомотивы», без них это движение невозможно.
NB: Транспорт по микротрубочкам идет в двух противоположных направлениях.
(Ченцов, 2004)
Слайд 101Антероградный транспорт – вперед, от тела нейрона к окончанию аксона, т.е.
Моторный белок – кинезин с АТФазной активностью.
Связующий белок – кинектин – специфичен для разных «грузов»: митохондрий, везикул Гольджи, лизосом, синаптических пузырьков, антипараллельных МТ в митотическом веретене.
Ретроградный транспорт – назад, от нервных окончаний к телу нейрона, т.е. к «-»-концам микротрубочек.
Моторный белок – динеин, тоже АТФазно-активный.
Различают цитозольный динеин – работает в цитоплазме на транспорт везикул и расхождение хромосом в митозе,
а также аксонемный динеин – в киноцилиях (ресничках и жгутиках).
(по: Ченцов, 2004)
Слайд 102NB: В клетке одновременно сочетаются различные направления транспорта по МТ –
Это же самое мы увидим в работе митотического веретена.
(NB: имеется принципиальное сходство тубулин-кинезиновой и тубулин-динеиновой двигательных систем с актин-миозиновой мышечной системой: скелетные элементы + двигательные АТФазные белки. Возможна их гомология.)
(по: Ченцов, 2004)
Слайд 1036.2. Центры организации микротрубочек - ЦОМТы
Рост МТ полярный, нуклеация и полимеризация
На ЦОМТах фиксированы минус-концы, блокированные с помощью МАРs,
к периферии обращены плюс-концы.
Происходит постоянная закладка новых МТ у ЦОМТов и их рост к периферии. (Доказано в опытах с разрушением МТ колцемидом или холодом с последующим их восстановлением из центра (Ченцов и сотр.)
NB: Отрастающие МТ могут терять связь с ЦОМТами, после чего перемещаются (тредмиллинг), стабилизируются или разбираются.
(по: Ченцов, 2004)
Слайд 104Что такое ЦОМТ?
Старые работы:
в
Слайд 105Современная ультраструктура:
центросома у животных клеток это – 2 центриоли (диплосома),
Именно сателлиты и прилежащие глобулы (ФСМТ), а не центриоли являются истинными ЦОМТами.
По: Ченцов, 2004)
(Ченцов, 2004)
Слайд 106NB: Пара центриолей – материнская и дочерняя. Воспроизводятся в клеточном цикле
Сателлиты и ФСМТ имеются только на материнской центриоли.
NB: У высших растений, низших грибов, некоторых простейших ЦОМТы не имеют четкой локализации, так как в них нет центриолей. Диффузный ЦОМТ-материал локализован на периферии клеточного ядра (снаружи или внутри), откуда МТ расходятся радиально.
Это подтверждает, что истинные ЦОМТы – не центриоли, а прилежащий материал.
Сами центриоли – лишь «пассажиры», расходящиеся с гарантией в дочерние клетки во время митоза (аналогия Ю.С. Ченцова).
А функция центриолей – это потенциальные базальные тельца киноцилий (ресничек и жгутиков).
Слайд 1076.3. Центросомный цикл, сборка и работа митотического веретена
Центросомы (центриоли) несут ЦОМТы,
Т.о., существует центросомный цикл.
В центросомном цикле происходит 2 процесса:
- расхождение и удвоение центриолей,
- перестройка ЦОМТов и микротрубочек.
В G1-периоде (после митоза) – 1 диплосома. Веретено разрушено. Материнская центриоль имеет сателлиты. Начинается рост микротрубочек, их отрыв и движение на периферию.
(по: Ченцов, 2004)
Слайд 108В S-периоде происходит дупликация центриолей.
У тетрахимены находили цДНК, но интерпретации нет.
В G2-периоде клетка имеет 2 клеточных центра – 2 полюса митотического веретена. Сателлиты каждой материнской центриоли перестраиваются в рыхлую волокнистую муфту – фибриллярное гало, от которого начинают отрастать МТ веретена. При этом старые цитоплазматические МТ разрушаются (клетка округляется), а пул тубулинов используется на построение новых МТ веретена.
Слайд 109В митозе у материнских центриолей сохраняется фибриллярное гало (вместо сателлитов).
В телофазе веретено разбирается. Гало исчезает. Восстанавливаются сателлиты.
NB: Такая динамика характерна для тканевых и культуральных клеточных линий с умеренной скоростью пролиферации.
В эмбриональных клеточных циклах, с коротким циклом, удвоение центриолей происходит много раньше – еще в предыдущем цикле.
Слайд 110Митотическое веретено начинает формироваться уже в G2 периоде, удлиняется в профазе
При этом часть растущих МТ своими «+»- концами захватываются кинетохорами хромосом, содержащими специальный белок CENT-A, а также динеин.
Прометафазные хромосомы, окрашенные DAPI на ДНК и антителами к CENT-A (Ченцов, 2004: фото И.С. Кудрявцева).
Профаза
Формирование кинетохора в течение профазы – метафазы. Показана только 1 хроматида.
Ченцов, 2004)
Слайд 111В метафазе хромосомы полностью компактизованы (IV уровень).
Растущие с обеих сторон
Митотическое веретено фактически состоит из двух полуверетен – двух клеточных центров.
Различаются 3 группы МТ:
- хромосомные (кинетохорные) МТ – связывают центриоли с кинетохорами хромосом; формируют хромосомное веретено;
- центральные (межполюсные) МТ – не касаются хромосом; перекрываются и формируют центральное веретено;
- полюсные (астральная лучистость) – МТ, направленные на периферию клетки.
Метафаза
Слайд 112В анафазе происходят решающие события митоза – синхронный разрыв хроматид и
Работают 2 механизма с участием микротрубочек и моторных белков.
В анафазе-А динеин кинетохоров протаскивает хроматиды по МТ хромосомного веретена в минус-направлениях (к полюсам);
по следу МТ разрушаются.
В анафазе-Б кинезин в составе парных мостиков движется по МТ центрального веретена в плюс-направлениях и раздвигает полюса.
Оба события происходят одновременно. В итоге сестринские хроматиды (хромосомы)
симметрично расходятся, а полюса раздвигаются и клетка удлиняется.
Анафаза
Слайд 113 В телофазе завершается кариокинез (деление ядерных структур – хромосом) и
- Разошедшиеся хроматиды собираются у полюсов и формируют новые ядра (2n2c);
- хроматиды деконденсируются и превращаются в хроматин, работа генов (транскрипция) возобновляется;
- в том числе восстанавливаются ядрышки – начинается производства рРНК и сборка рибосом;
- восстанавливаются ядерные оболочки путем сборки везикул ЭПР.
Микротрубочки веретена, кроме астральных, разрушаются. Каждая клетка получает один клеточный центр – пару центриолей в окружении МТ.
Параллельно идет цитокинез.
Телофаза
Слайд 114Участвуют другие структуры. Работают 2 механизма:
Контрактура актин-миозиновых микрофиламентов в экваториальной
Активность аппарата Гольджи, вынос мембранных везикул в плазмалемму – работает в растительных клетках, образуется фрагмопласт (влияет присутствие клеточной стенки).
BN: цитокинетический цикл – самостоятельный, со своими механизмами и своей регуляцией.
7. Цитокинез (цитотомия)
(по: Ченцов, 2004)
Слайд 115G1-период; в клеточном центре пара центриолей – диплосома.
ПРИЛОЖЕНИЕ
Митотический цикл в клеточной культуре
(Ченцов, 2004; фото А.В. Буракова и А.Л. Ходякова)
S-G2; расхождение дочерней и материнской центриолей.
Микротрубочки окрашены антителами к тубулину. Центриоли желтые.
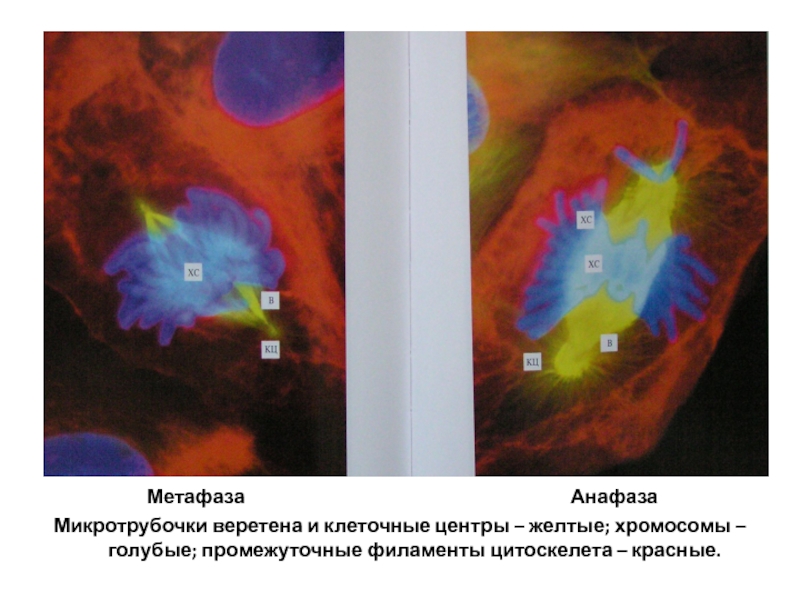
Слайд 116
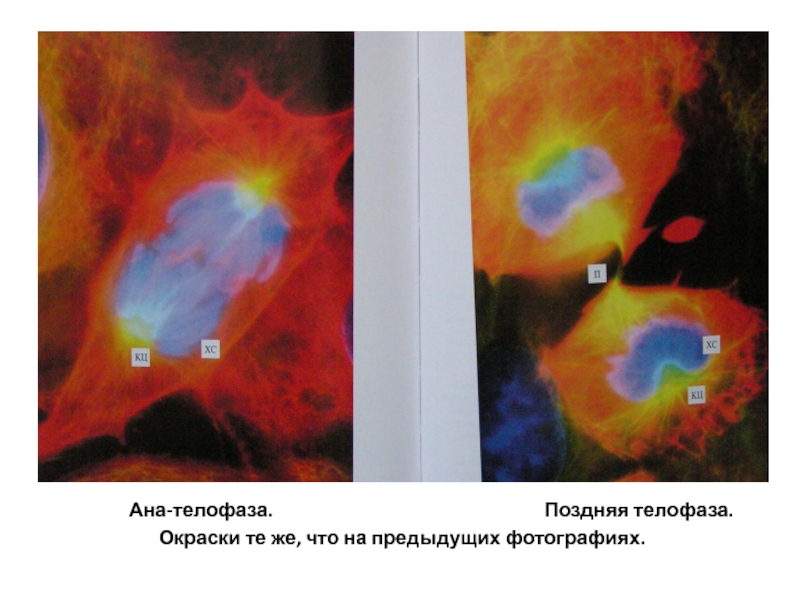
Микротрубочки веретена и клеточные центры – желтые; хромосомы –голубые; промежуточные филаменты цитоскелета – красные.
Слайд 118Т.о., митотический цикл – сочетание трех относительно независимых циклов:
- хромосомный цикл;
-
- цитокинетический цикл.
Каждый цикл имеет свою регуляцию. В норме эти циклы согласованы, но возможны рассогласования, приводящие к нарушениям митоза с различными последствиями.