- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Регуляция ионных токов в протопластах из пыльцевых зерен лилии пероксидом водорода презентация
Содержание
- 1. Регуляция ионных токов в протопластах из пыльцевых зерен лилии пероксидом водорода
- 2. H2O2 – один из регуляторов прогамной фазы
- 3. H2O2 – один из регуляторов прогамной фазы
- 4. Процесс выделения протопластов из пыльцевых зёрен лилии
- 5. Метод исследования: пэтч-кламп в конфигурации «whole cell»
- 6. H2O2 активирует Ca2+ ток в протопластах лилии
- 7. H2O2 активирует Ca2+ ток в протопластах лилии
- 8. H2O2 активирует K+ ток в протопластах лилии
- 9. H2O2 активирует K+ ток в протопластах лилии
- 10. H2O2 не оказывает действия на мембранный потенциал
- 11. Спасибо за внимание!
Слайд 1Регуляция ионных токов в протопластах из пыльцевых зерен лилии пероксидом водорода
Максимов
МГУ им. Ломоносова,
Биологический факультет,
Кафедра физиологии растений
Москва, 2015
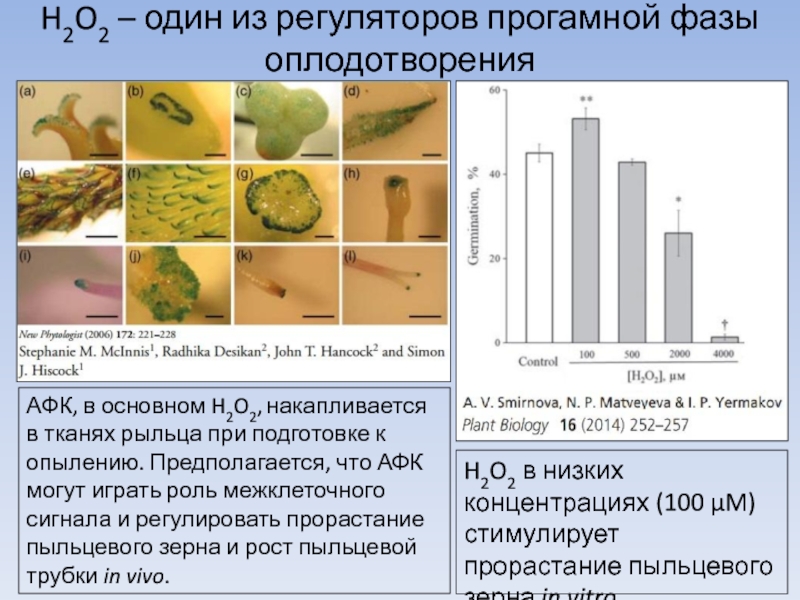
Слайд 2H2O2 – один из регуляторов прогамной фазы оплодотворения
H2O2 в низких концентрациях
АФК, в основном H2O2, накапливается в тканях рыльца при подготовке к опылению. Предполагается, что АФК могут играть роль межклеточного сигнала и регулировать прорастание пыльцевого зерна и рост пыльцевой трубки in vivo.
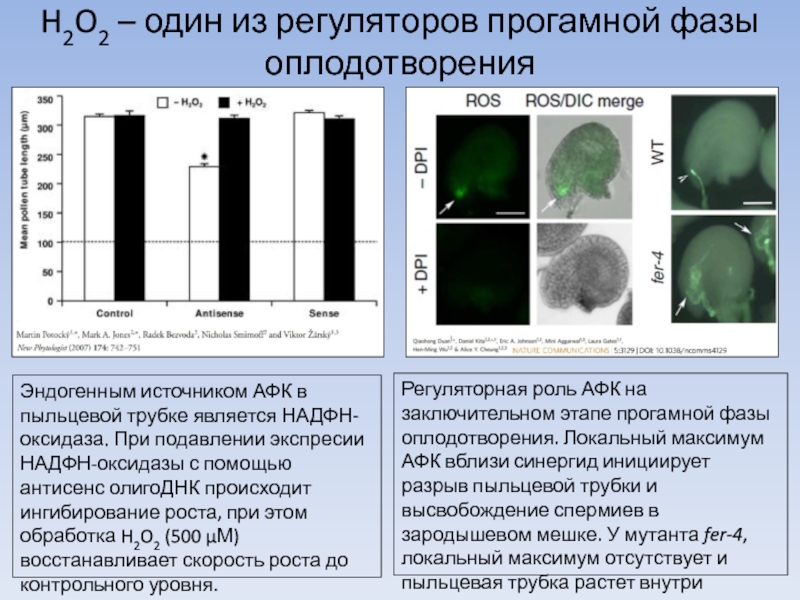
Слайд 3H2O2 – один из регуляторов прогамной фазы оплодотворения
Эндогенным источником АФК в
Регуляторная роль АФК на заключительном этапе прогамной фазы оплодотворения. Локальный максимум АФК вблизи синергид инициирует разрыв пыльцевой трубки и высвобождение спермиев в зародышевом мешке. У мутанта fer-4, локальный максимум отсутствует и пыльцевая трубка растет внутри зародышевого мешка.
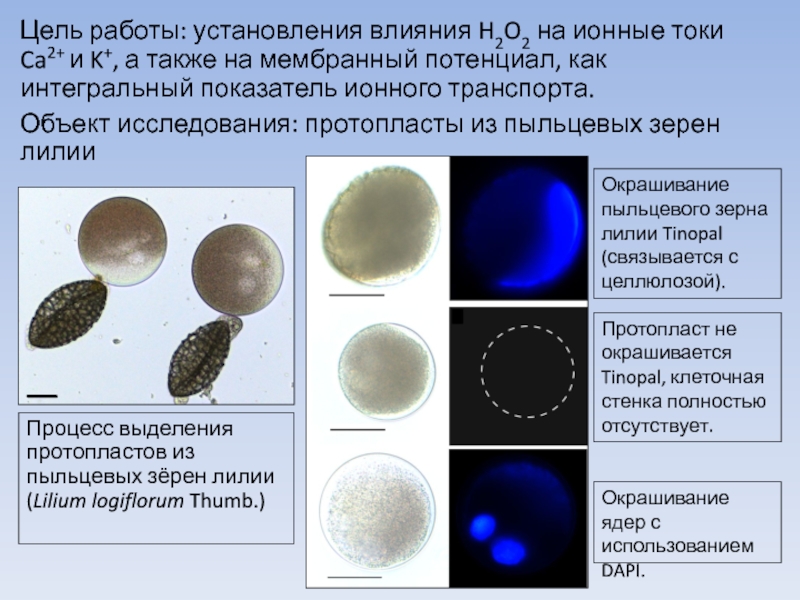
Слайд 4Процесс выделения протопластов из пыльцевых зёрен лилии (Lilium logiflorum Thumb.)
Окрашивание пыльцевого
Протопласт не окрашивается Tinopal, клеточная стенка полностью отсутствует.
Окрашивание ядер с использованием DAPI.
Цель работы: установления влияния H2O2 на ионные токи Ca2+ и K+, а также на мембранный потенциал, как интегральный показатель ионного транспорта.
Объект исследования: протопласты из пыльцевых зерен лилии
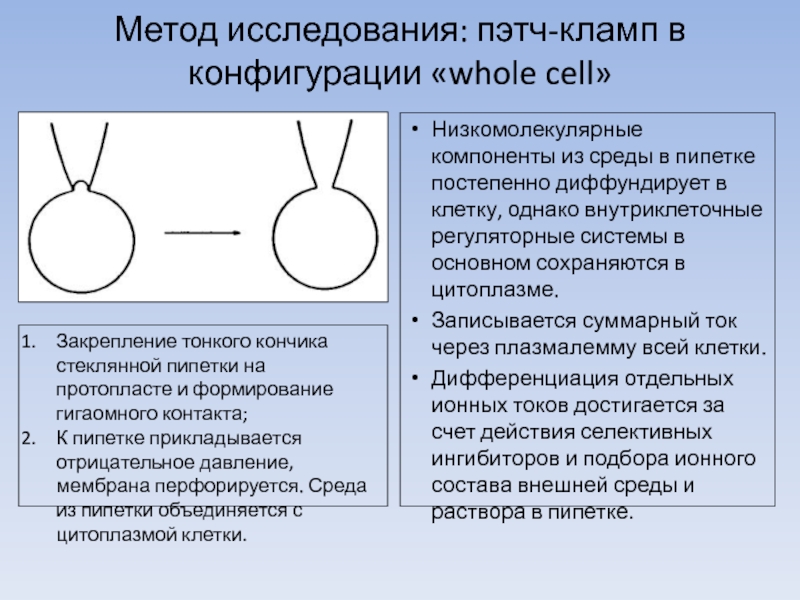
Слайд 5Метод исследования: пэтч-кламп в конфигурации «whole cell»
Низкомолекулярные компоненты из среды в
Записывается суммарный ток через плазмалемму всей клетки.
Дифференциация отдельных ионных токов достигается за счет действия селективных ингибиторов и подбора ионного состава внешней среды и раствора в пипетке.
Закрепление тонкого кончика стеклянной пипетки на протопласте и формирование гигаомного контакта;
К пипетке прикладывается отрицательное давление, мембрана перфорируется. Среда из пипетки объединяется с цитоплазмой клетки.
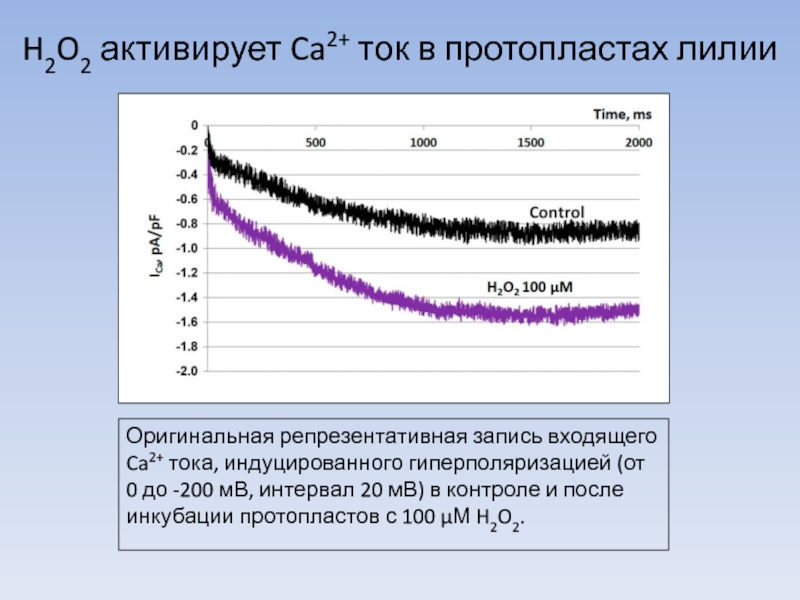
Слайд 6H2O2 активирует Ca2+ ток в протопластах лилии
Оригинальная репрезентативная запись входящего Ca2+
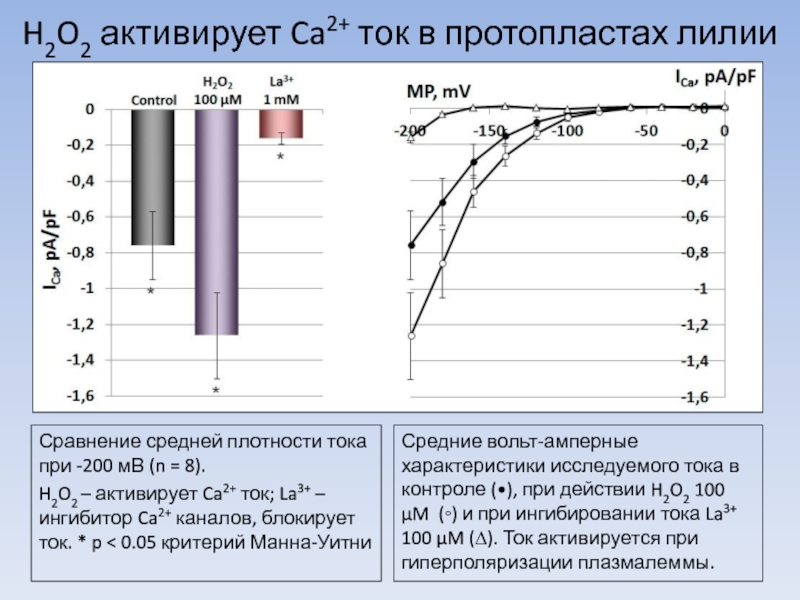
Слайд 7H2O2 активирует Ca2+ ток в протопластах лилии
Сравнение средней плотности тока при
H2O2 – активирует Ca2+ ток; La3+ – ингибитор Ca2+ каналов, блокирует ток. * p < 0.05 критерий Манна-Уитни
Средние вольт-амперные характеристики исследуемого тока в контроле (•), при действии H2O2 100 µM (◦) и при ингибировании тока La3+ 100 µM (∆). Ток активируется при гиперполяризации плазмалеммы.
Слайд 8H2O2 активирует K+ ток в протопластах лилии
Оригинальные репрезентативные записи K+ тока
Запись K+ тока в контроле и при действии ингибитора K+-каналов тетраэтиламмония (TEA) (Б). TEA эффективно блокирует K+ ток.
A
Б
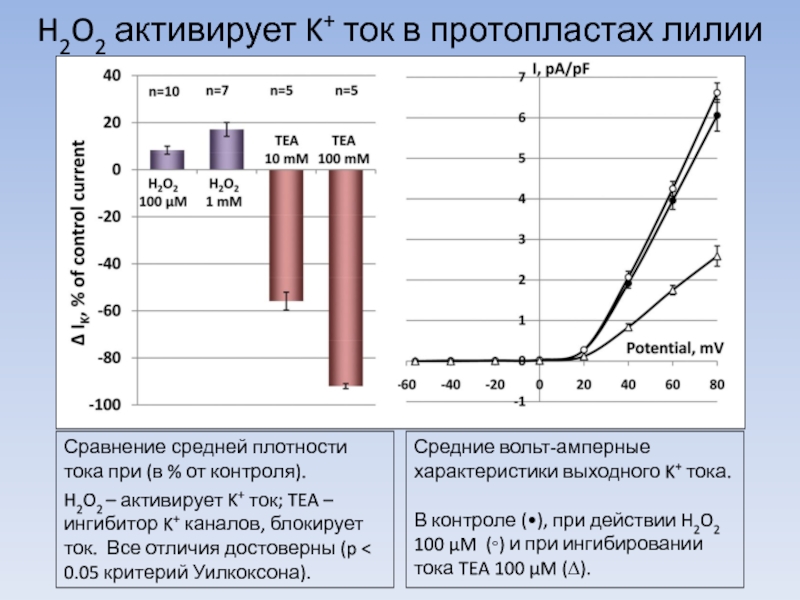
Слайд 9H2O2 активирует K+ ток в протопластах лилии
Сравнение средней плотности тока при
H2O2 – активирует K+ ток; TEA – ингибитор K+ каналов, блокирует ток. Все отличия достоверны (p < 0.05 критерий Уилкоксона).
Средние вольт-амперные характеристики выходного K+ тока.
В контроле (•), при действии H2O2 100 µM (◦) и при ингибировании тока TEA 100 µM (∆).
Слайд 10H2O2 не оказывает действия на мембранный потенциал протопластов лилии
Для измерения потенциала
Отношение флуоресценции Di-4-ANNEPS в двух каналах – параметр пропорциональный величине мембранного потенциала после добавления H2O2 (среднее ± стандартная ошибка).