- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Реакции окисления и восстановления биоорганических соединений. (Лекция 5) презентация
Содержание
- 1. Реакции окисления и восстановления биоорганических соединений. (Лекция 5)
- 2. Кислород в атмосфере
- 3. Окислительно-восстановительными называются реакции, которые сопровождаются
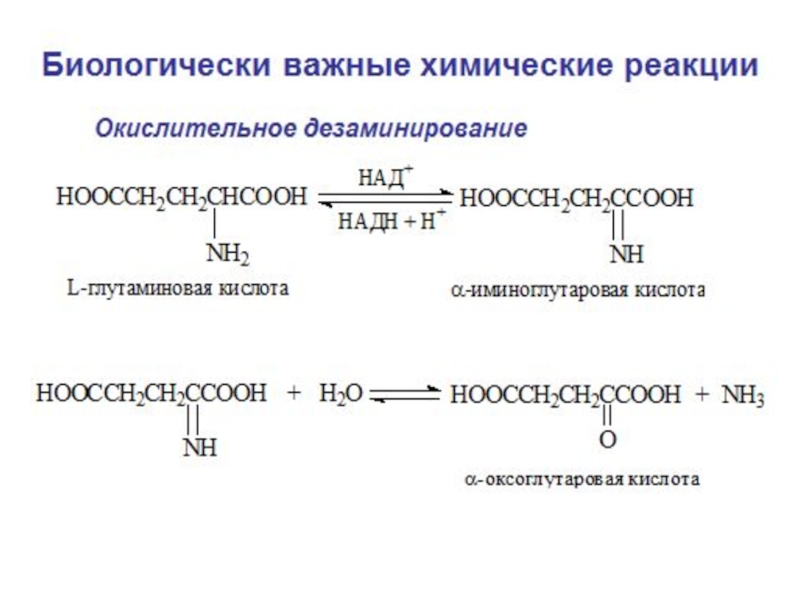
- 4. Значение реакций окисления-восстановления в организме 1.
- 5. В органической химии под окислением в
- 6. Механизмы окисления
- 7. Примеры реакций окисления в организме Окисление этилового спирта с участием алкогольдегидрогеназы
- 8. Окисление молочной кислоты до пировиноградной кислоты
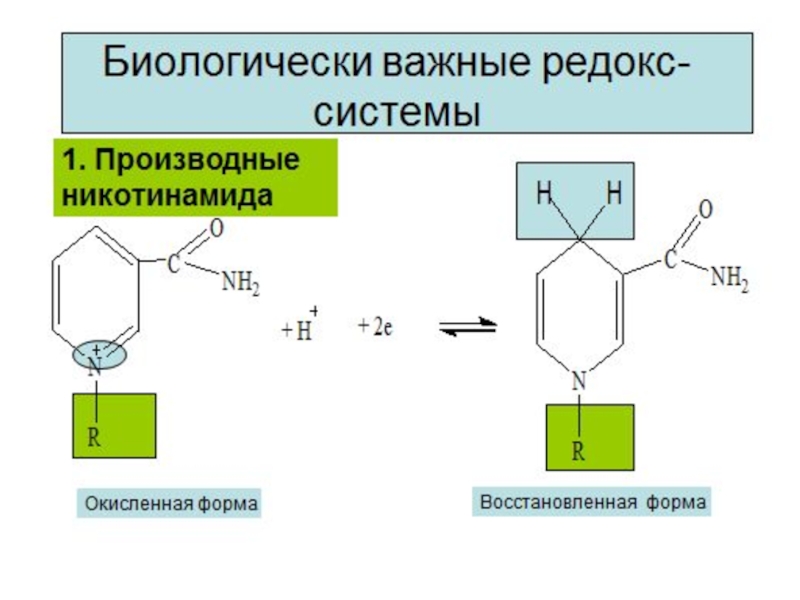
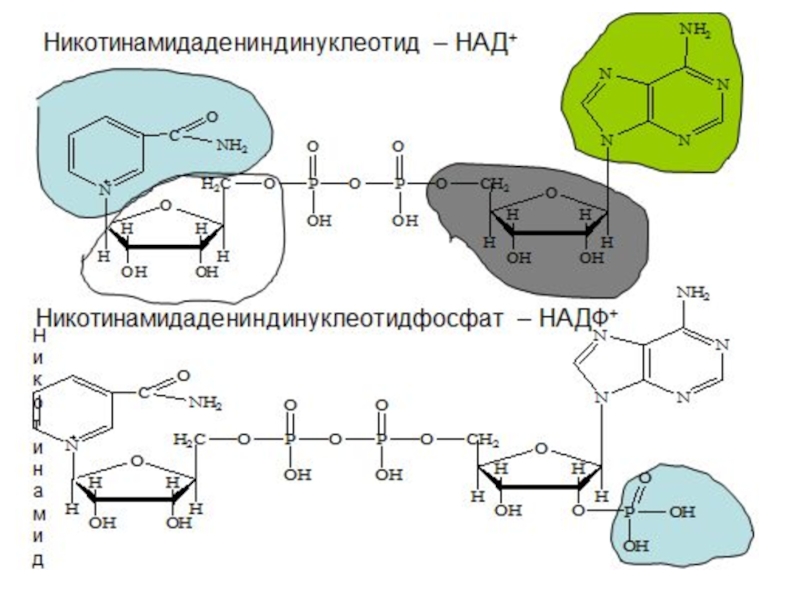
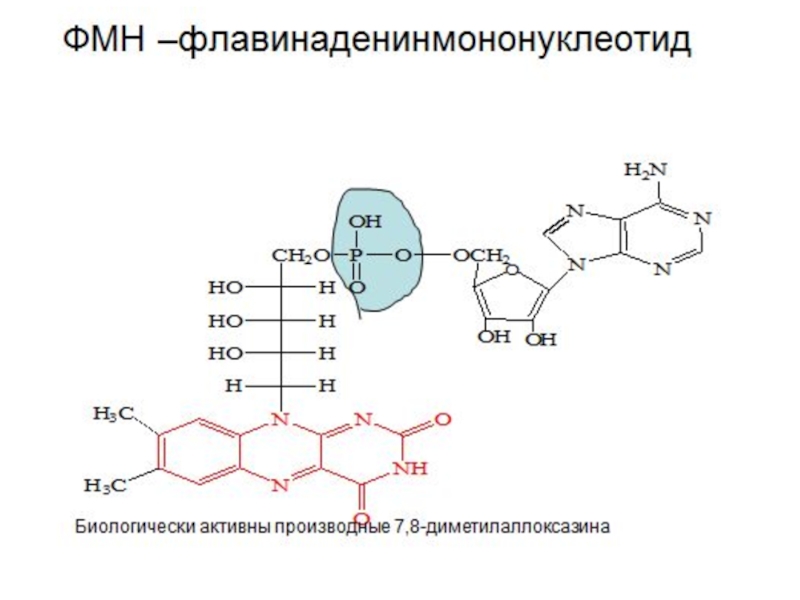
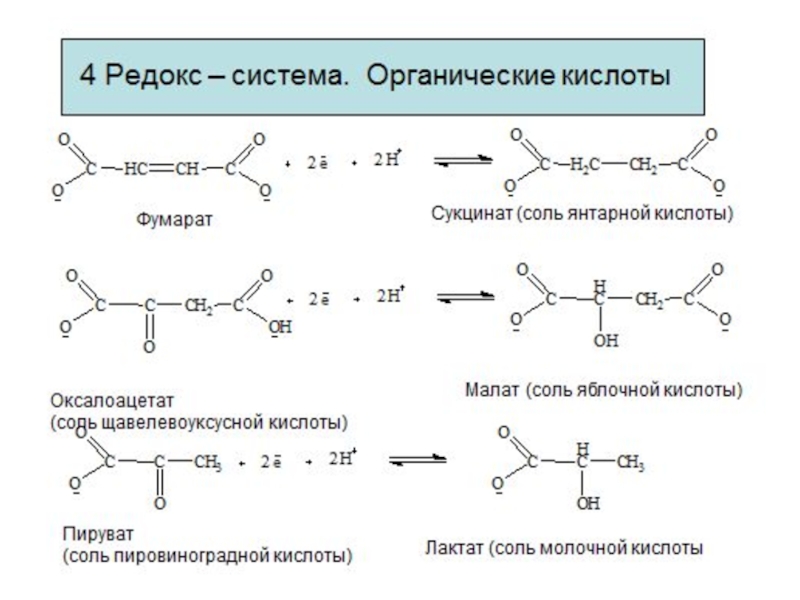
- 9. Редокс – системы Взаимопревращения
- 11. Окисление
- 12. Окисление ароматических соединений Реакция гидроксилирования Механизм реакции гидроксилирования
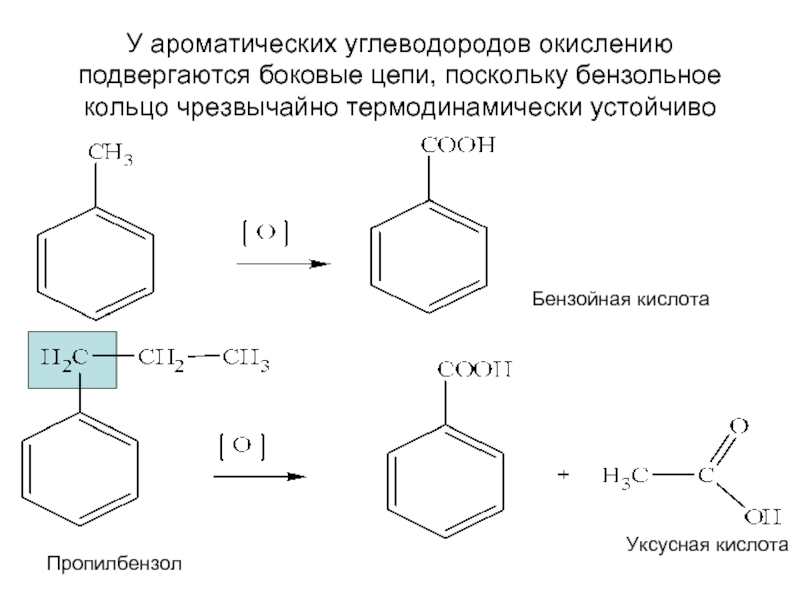
- 13. У ароматических углеводородов окислению подвергаются боковые
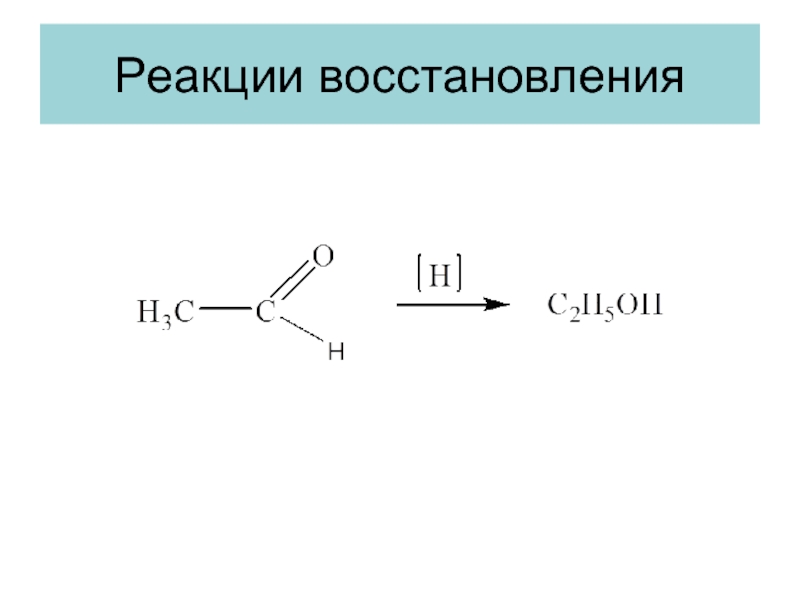
- 14. Реакции восстановления
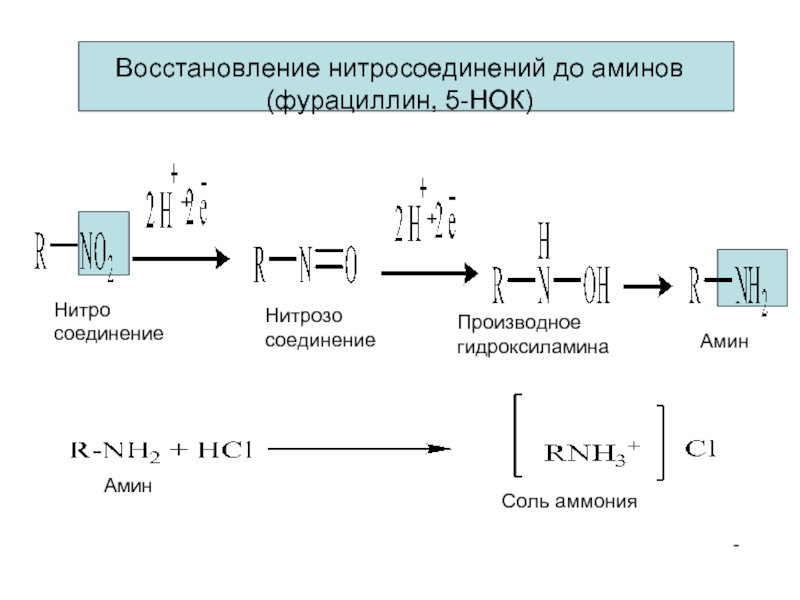
- 15. Нитро соединение Нитрозо соединение
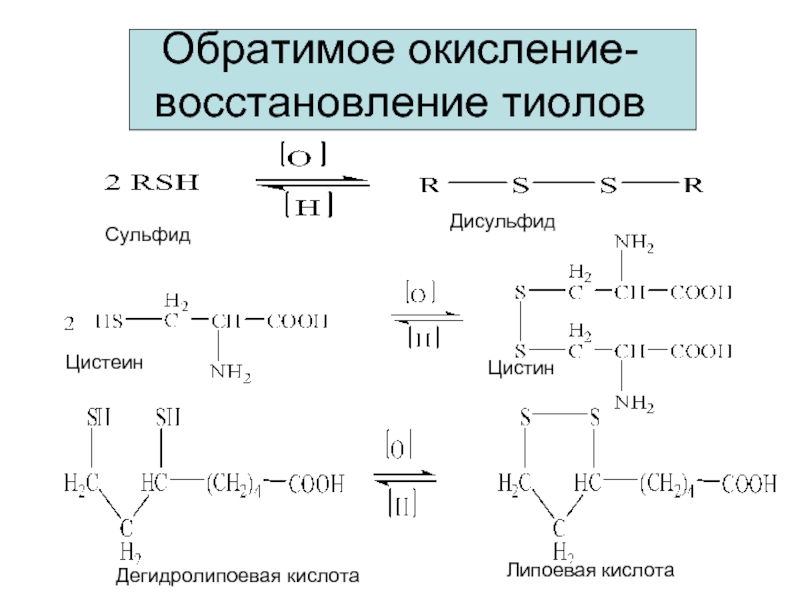
- 16. Обратимое окисление-восстановление тиолов Сульфид Дисульфид Цистеин Цистин Дегидролипоевая кислота Липоевая кислота
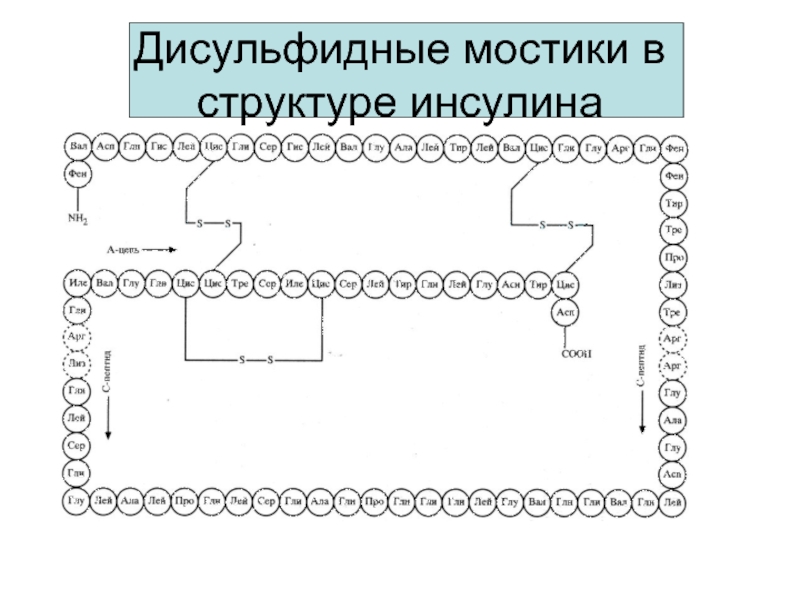
- 17. Дисульфидные мостики в структуре инсулина
Слайд 2
Кислород в атмосфере Земли появился около 600 млн. лет назад, что
Н-субстрат-Н + ½ О2 Н2О + дегидрированный (окисленный) субстрат
2Н - 2 е 2Н+
О + 2 е О2-
Н2О
∆G0 = - 100 кДж/моль протонов - экзергонический процесс
Окисление органических субстратов – процесс аналогичный горению
Слайд 3
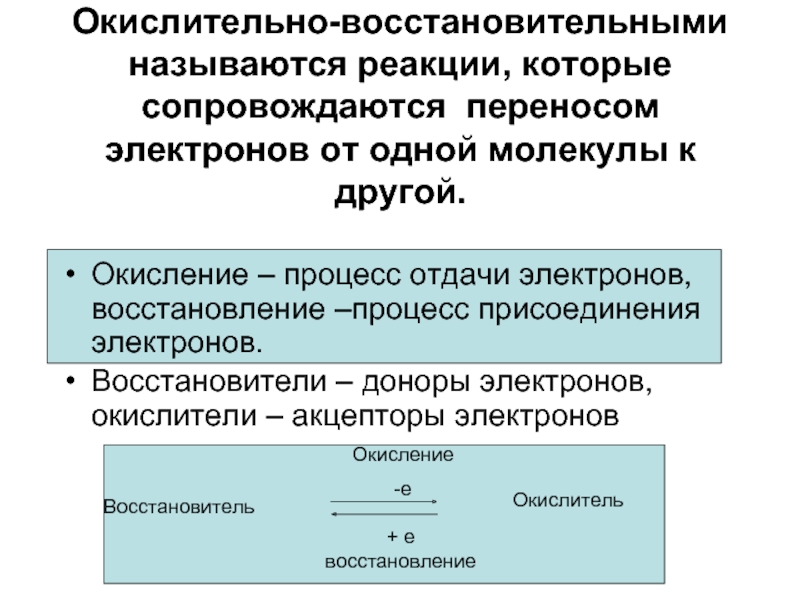
Окислительно-восстановительными называются реакции, которые сопровождаются переносом электронов от одной молекулы к
Окисление – процесс отдачи электронов, восстановление –процесс присоединения электронов.
Восстановители – доноры электронов, окислители – акцепторы электронов
Восстановитель
Окислитель
Окисление
-е
+ е
восстановление
Слайд 4
Значение реакций окисления-восстановления в организме
1. Окисление питательных веществ
(процессы катаболизма), при которых
2. Основа клеточного дыхания (окислительное фосфорилирование)
3. Процессы свободнорадикального окисления липидов биологических мембран, белков, нуклеиновых кислот
4. Процессы детоксикации ксенобиотиков
Слайд 5
В органической химии под окислением в широком смысле понимают реакции, связанные
О
Слайд 6
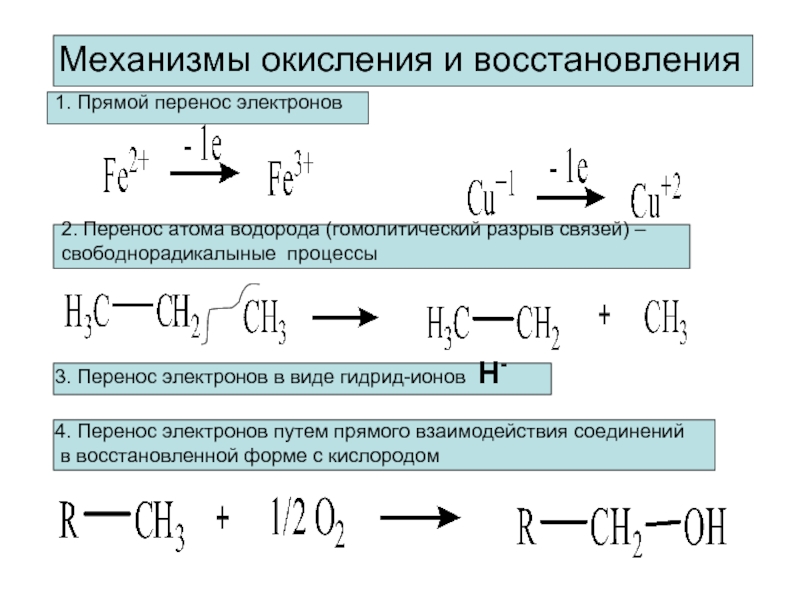
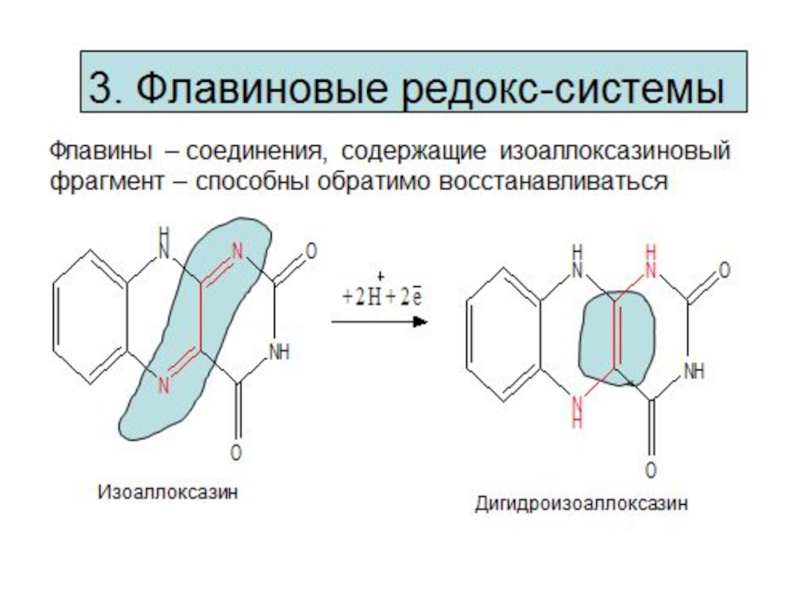
Механизмы окисления и восстановления
1. Прямой перенос электронов
2. Перенос атома водорода (гомолитический
свободнорадикалыные процессы
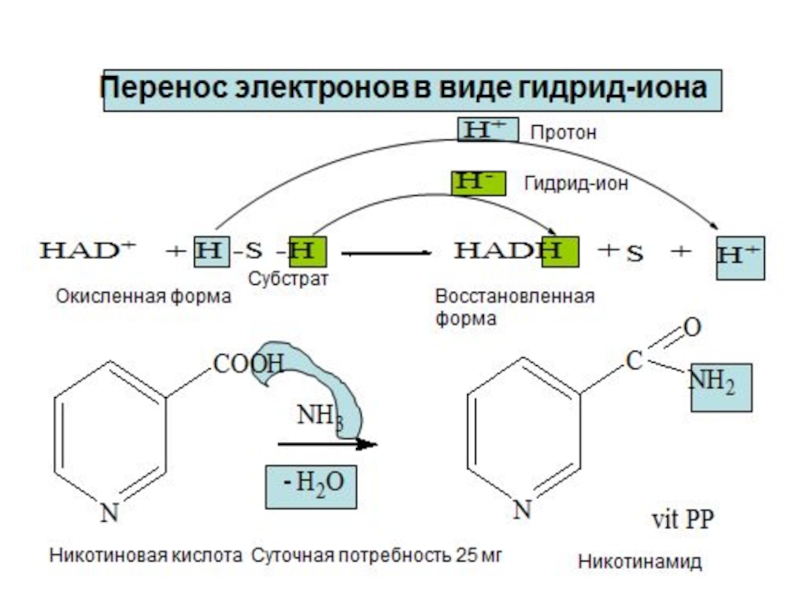
3. Перенос электронов в виде гидрид-ионов Н-
4. Перенос электронов путем прямого взаимодействия соединений
в восстановленной форме с кислородом
Слайд 7
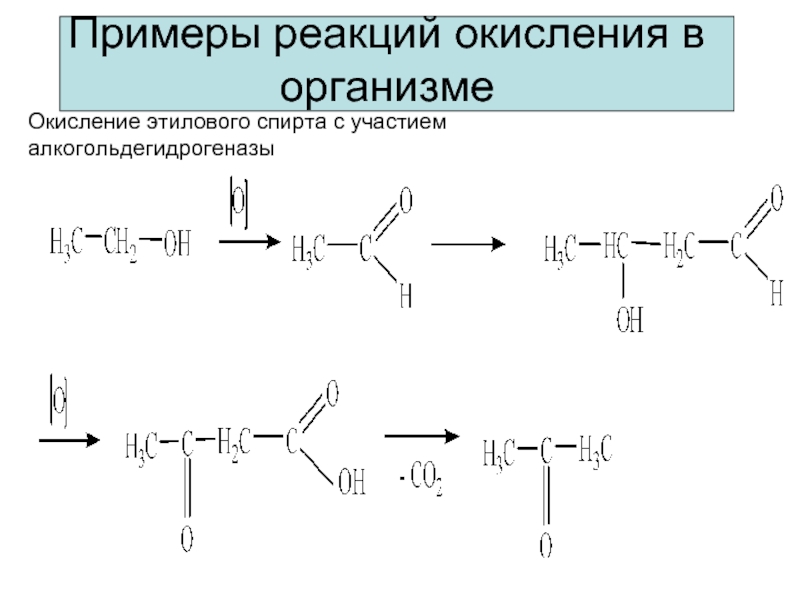
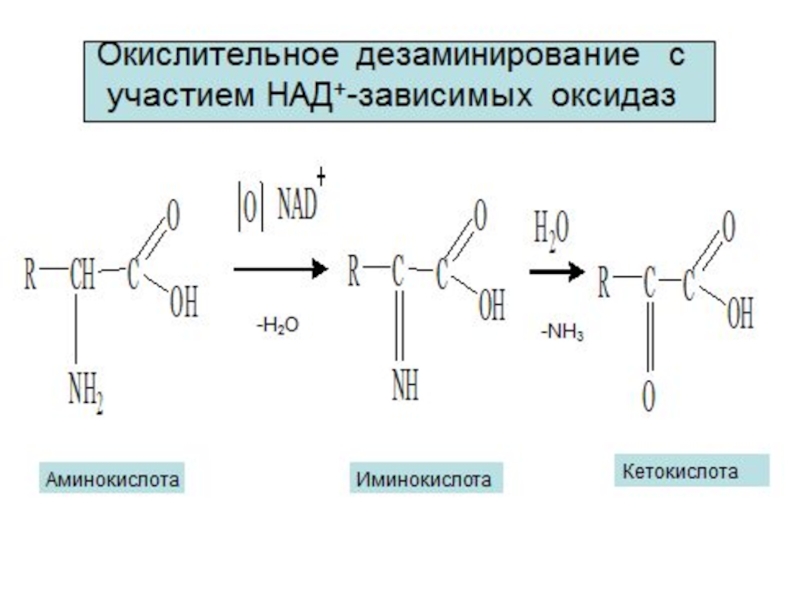
Примеры реакций окисления в организме
Окисление этилового спирта с участием алкогольдегидрогеназы
Слайд 8
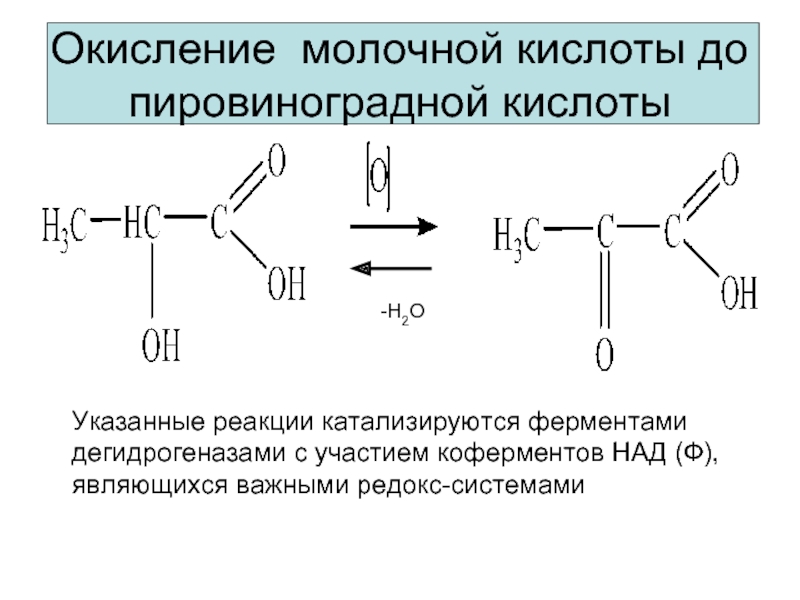
Окисление молочной кислоты до пировиноградной кислоты
Указанные реакции катализируются ферментами дегидрогеназами с
являющихся важными редокс-системами
-H2O
Слайд 9
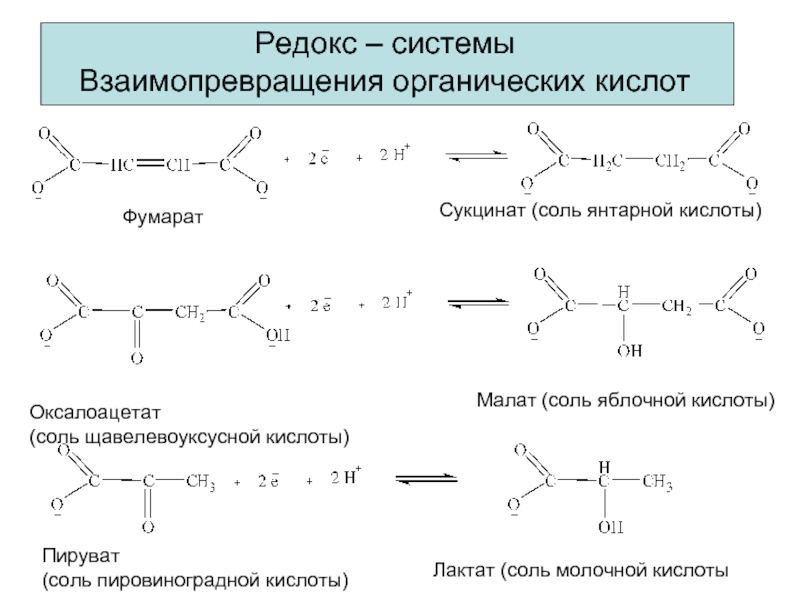
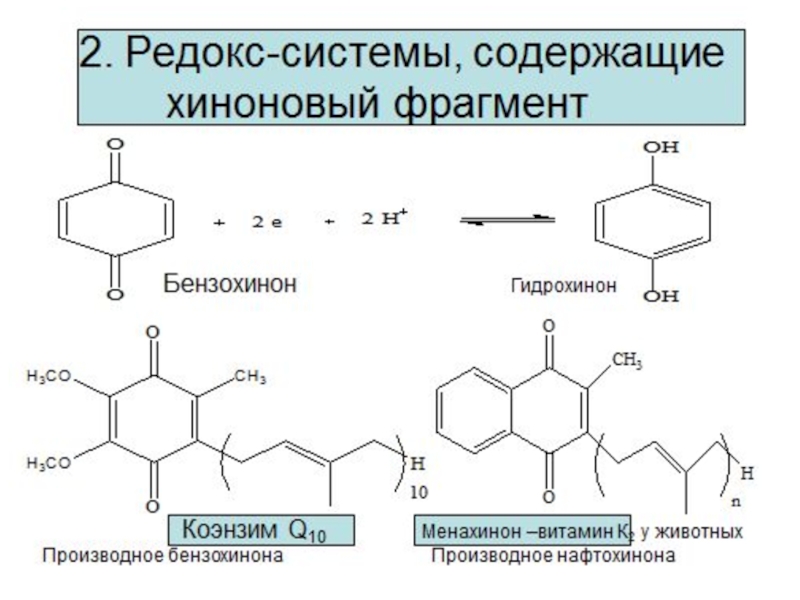
Редокс – системы
Взаимопревращения органических кислот
Фумарат
Сукцинат (соль янтарной кислоты)
Оксалоацетат
(соль
Малат (соль яблочной кислоты)
Пируват
(соль пировиноградной кислоты)
Лактат (соль молочной кислоты
Слайд 12
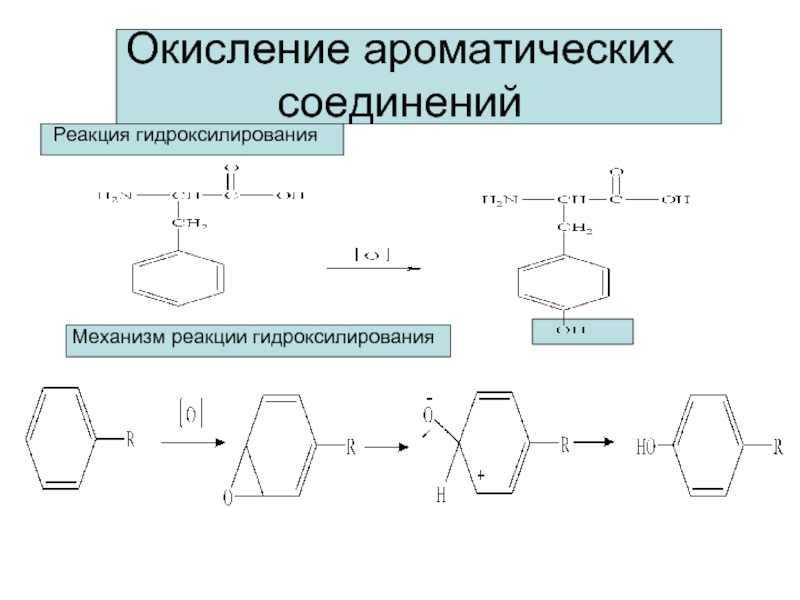
Окисление ароматических соединений
Реакция гидроксилирования
Механизм реакции гидроксилирования
Слайд 13
У ароматических углеводородов окислению подвергаются боковые цепи, поскольку бензольное кольцо чрезвычайно
Бензойная кислота
Пропилбензол
Уксусная кислота