- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы. Качественный и количественный состав растворов презентация
Содержание
- 1. Растворы. Качественный и количественный состав растворов
- 2. Качественный и количественный состав
- 3. идеальные разбавленные концентрированные Растворы в зависимости
- 4. Давление насыщенного пара над раствором. Закон
- 5. Рассмотрим бинарный идеальный раствор, состоящий из летучих
- 6. Общее давление насыщенного пара над раствором
- 7. Зависимости парциальных и общего давления от
- 8. Для неидеальных летучих смесей закон Рауля выполняется
- 9. PB=PB0 NB; PB0 = КГ; В идеальном
- 10. Испарение неидеальных летучих смесей Положительные (а) и
- 11. Отклонения от закона Рауля
- 12. Состав жидкости обычно отличается от состава равновесного с ней пара
- 13. Соотношение между составом пара и составом жидкости
- 14. Новый тип диаграмм Пар по сравнению с
- 15. Перегонка смесей, компоненты которой не образуют азеотроп Смесь разделяется на исходные компоненты
- 16. Системы с отклонениями от закона Рауля Точки
- 17. Перегонка смесей, компоненты которой образуют азеотроп Смесь разделяется на азеотроп и один из чистых компонентов
- 18. Перегонка – разделение смесей (или их обогащение)
- 19. Схема фракционной перегонки жидких летучих смесей с азеотропом
- 20. Второй Закон Рауля
- 21. Понижение температуры замерзания растворов. Криоскопия.
- 22. Для разбавленных растворов
- 23. Криометрия – метод исследования, основанный на измерении
- 24. Условие кипения Жидкость закипит, если давление пара в пузырьке станет равным внешнему давлению
- 25. Зависимости давления насыщенного пара от температуры для
- 26. где М2 – молекулярная
- 27. Эбулиоскопия – метод исследования, основанный на измерениях температур кипения растворов
- 28. Растворы в биологии и биотехнологии Растворами являются
- 29. Законы для растворов Закон Генри Описывает
- 30. Экстракция В различных пищевых технологиях, производстве БАВ,
Слайд 1
Раствор – это термодинамически устойчивая гомогенная система переменного состава, состоящая из
Слайд 2
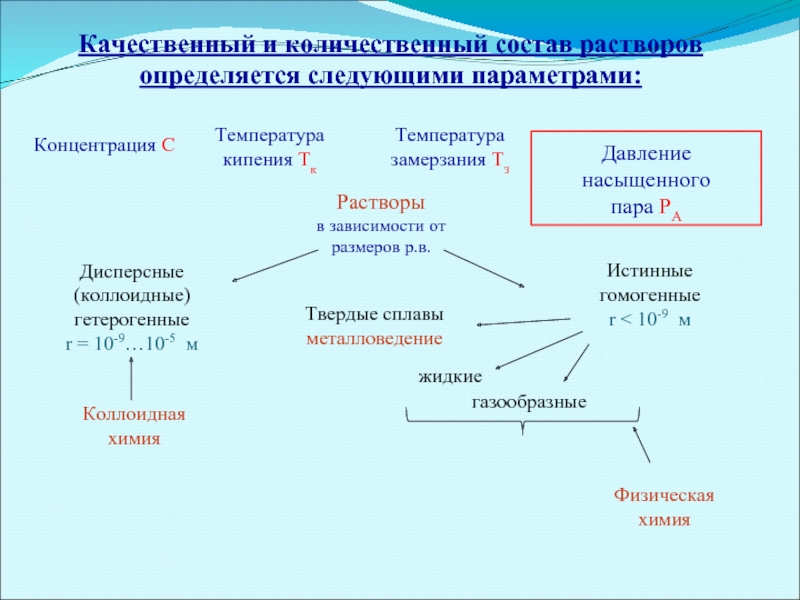
Качественный и количественный состав растворов определяется следующими параметрами:
Температура кипения Тк
Концентрация С
Давление
пара РА
Температура замерзания Тз
Растворы
в зависимости от размеров р.в.
Дисперсные (коллоидные)
гетерогенные
r = 10-9…10-5 м
Коллоидная химия
Истинные
гомогенные
r < 10-9 м
Физическая химия
Твердые сплавы
металловедение
жидкие
газообразные
Слайд 3
идеальные
разбавленные
концентрированные
Растворы
в зависимости от свойств р.в.
неэлектролиты
Растворы высокомолекулярных соединений
электролиты
Процесс образования растворов происходит самопроизвольно
энергии Гиббса (dG<0).
(из-за гидратации – идет с выделением энергии)
Слайд 4Давление насыщенного пара над раствором.
Закон Рауля.
РА0 ≠ PА
РА0 - давление
РА – давление насыщенного пара над раствором
парциальное давление насыщенного пара компонента раствора Pio пропорционально его мольной доле в растворе Ni :
(1) – Закон Рауля (1887 г.)
где Pio - давление насыщенного пара над чистым компонентом i при Niж =1.
Слайд 5Рассмотрим бинарный идеальный раствор, состоящий из летучих компонентов А и В
где NАж , NBж - мольные доли компонентов А и В в растворе;
PАo, PBo - давление насыщенного пара над чистыми веществами
А и В (при NАж = 1 и NBж = 1).
PВ = PВо ⋅ NВж
(3)
PА = PАо⋅ NАж ,
(2)
(4)
Подставив (4) в (2), получим (5)
(5) – Закон Рауля
Слайд 6 Общее давление насыщенного пара над раствором равно:
Р = РАо NАж
P = PАо (1 - NВо) + PВо NВж; (6)
P = PАо + (PВо - PАо) NВж .
Растворы, для которых закон Рауля выполняется при всех концентрациях и температурах, называются идеальными. Они образуются веществами, близкими по свойствам. Примерами растворов, близких к идеальным, могут служить смеси: бензол - толуол, гексан - гептан, хлорбензол - бромбензол и др.
Большинство растворов отклоняется от закона Рауля, т.е. они являются неидеальными. Очень многие растворы подчиняются закону Рауля лишь при малых концентрациях.
Слайд 7
Зависимости парциальных и общего давления от состава раствора (подчинение закону Рауля)
1 - PА ; 2 - PВ ; 3 - P = PА + PВ .
Рис 1.
Уравнения (4-6) показывают, что давление каждого компонента и общее давление пара над идеальным раствором линейно зависят от состава раствора.
Графически закон Рауля представляют в виде диаграмм давление - состав, которые удобны при рассмотрении свойств растворов (рис.1). Положение прямых на диаграмме определяется по граничным точкам:
Из (2) и (3) ⇒
Из (6) ⇒
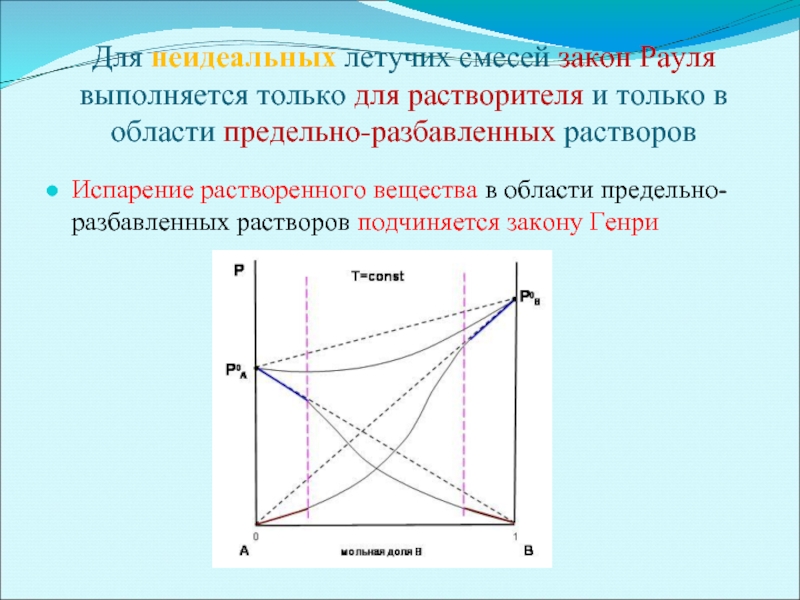
Слайд 8Для неидеальных летучих смесей закон Рауля выполняется только для растворителя и
Испарение растворенного вещества в области предельно-разбавленных растворов подчиняется закону Генри
Слайд 9PB=PB0 NB;
PB0 = КГ;
В идеальном растворе Закон Генри совладает с Законом
Закон Генри
(7)
(7’)
Для газов: при небольших Р растворимость газов пропорциональна Р (Т↑, NB↓; P↑, NB↑)
Примеры:
Н2 – 0,0016 г/100г H2O
N2 – 0,002 г/100г H2O
O2 – 0,0045 г/100г H2O
NH3 – 55,4
HCl – 73,4
SO2 – 12,13
Больше из-за химического взаимодействия
(8)
Слайд 10Испарение неидеальных летучих смесей
Положительные (а) и отрицательные (б) отклонения от закона
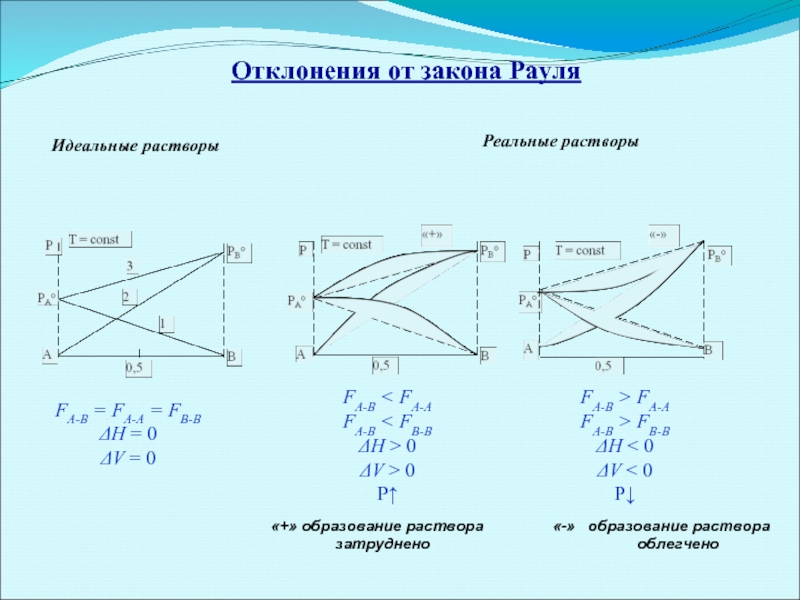
Слайд 11Отклонения от закона Рауля
FА-В = FА-А = FВ-В
ΔH = 0
ΔV = 0
FА-В < FА-А
FА-В < FВ-В
ΔH > 0
ΔV > 0
Р↑
FА-В > FА-А
FА-В > FВ-В
ΔH < 0
ΔV < 0
Р↓
Идеальные растворы
Реальные растворы
«+» образование раствора «-» образование раствора
затруднено облегчено
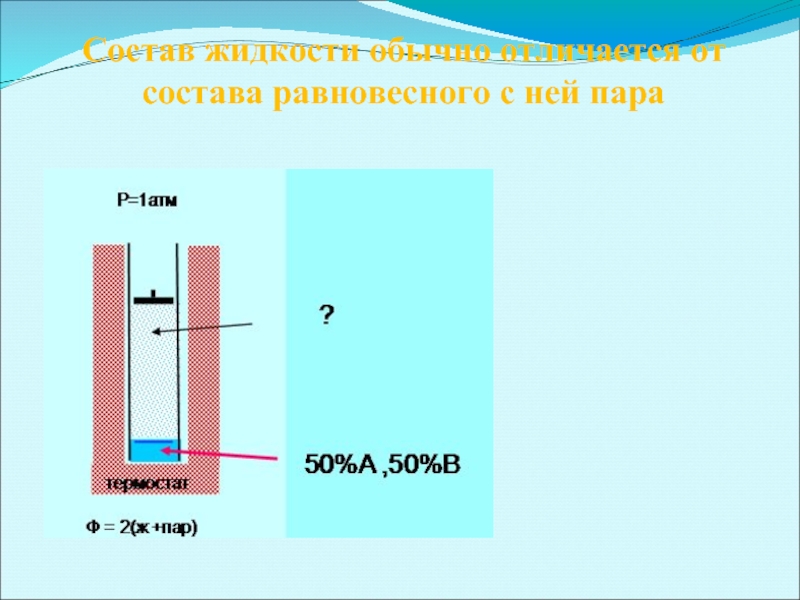
Слайд 13Соотношение между составом пара и составом жидкости
В общем случае состав пара
Для нахождения взаимосвязи между ними воспользуемся уравнениями Дальтона и Рауля.
тогда мольная доля компонента В в паре:
(8)
(9)
(10)
(11)
Если РВо > Рао т.е. В-более летучий и обозначить РАо/РВо=α , имеем
(12)
Для случая α< 1, следовательно, знаменатель уравнения (12) меньше 1, тогда:
т.е. пар содержит больше более летучего компонента.
(13)
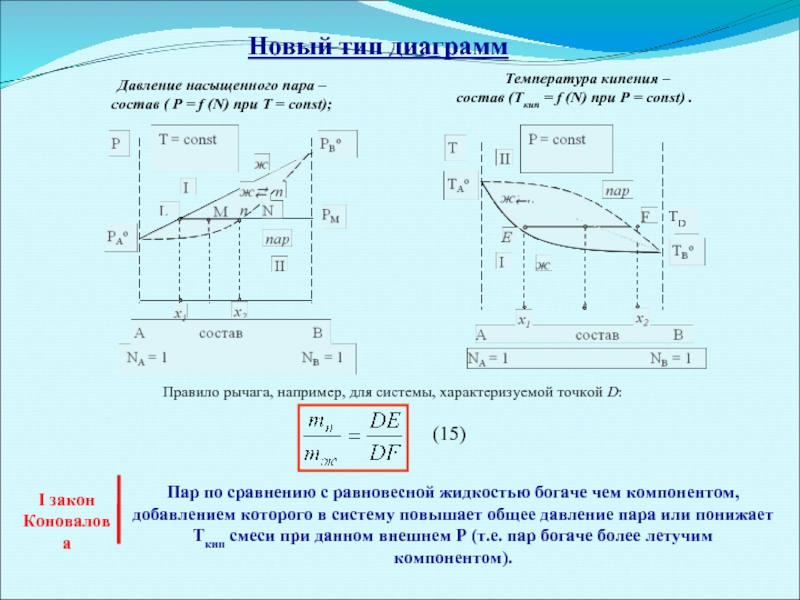
Слайд 14Новый тип диаграмм
Пар по сравнению с равновесной жидкостью богаче чем компонентом,
Давление насыщенного пара –
состав ( Р = f (N) при Т = const);
Температура кипения –
состав (Ткип = f (N) при P = const) .
Правило рычага, например, для системы, характеризуемой точкой D:
(15)
I закон
Коновалова
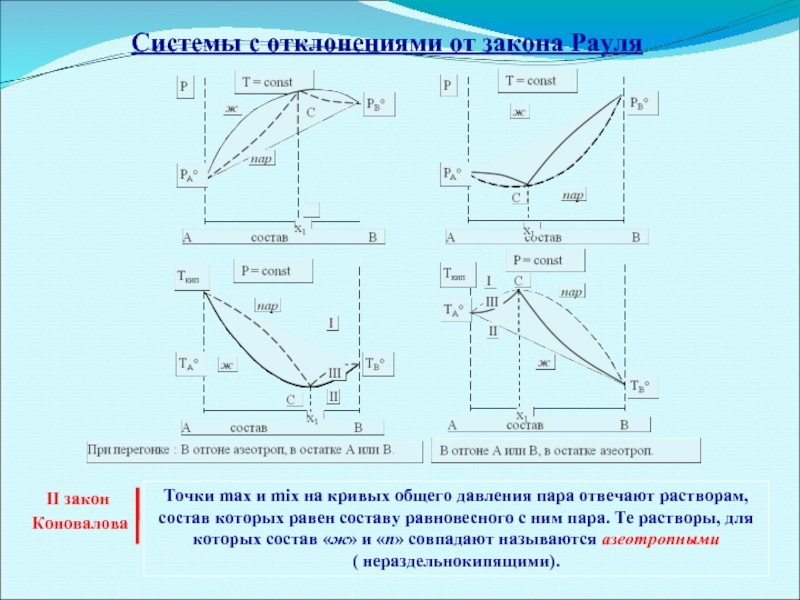
Слайд 15Перегонка смесей, компоненты которой не образуют азеотроп
Смесь разделяется на исходные компоненты
Слайд 16Системы с отклонениями от закона Рауля
Точки max и mix на кривых
II закон
Коновалова
Слайд 17Перегонка смесей, компоненты которой образуют азеотроп
Смесь разделяется на азеотроп и один
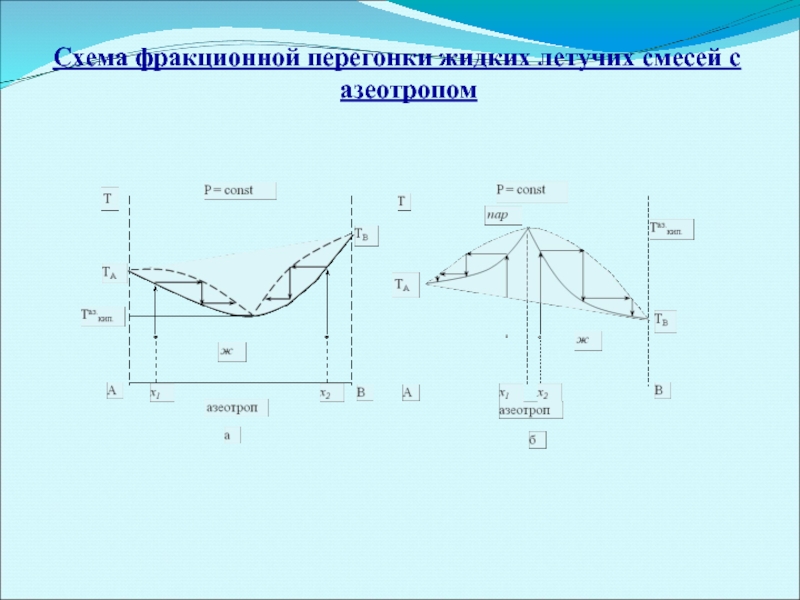
Слайд 18Перегонка – разделение смесей (или их обогащение)
1) Перегонка в равновесии (простая)
2) Фракционная перегонка (ректификация), пар отбирается немедленно, а конденсат отвечает некоторому интервалу концентрации исходной смеси и называется фракцией. Собирание фракций и вновь их нагревание и охлаждение лежит в основе разделения смесей на компоненты путем фракционной перегонки.
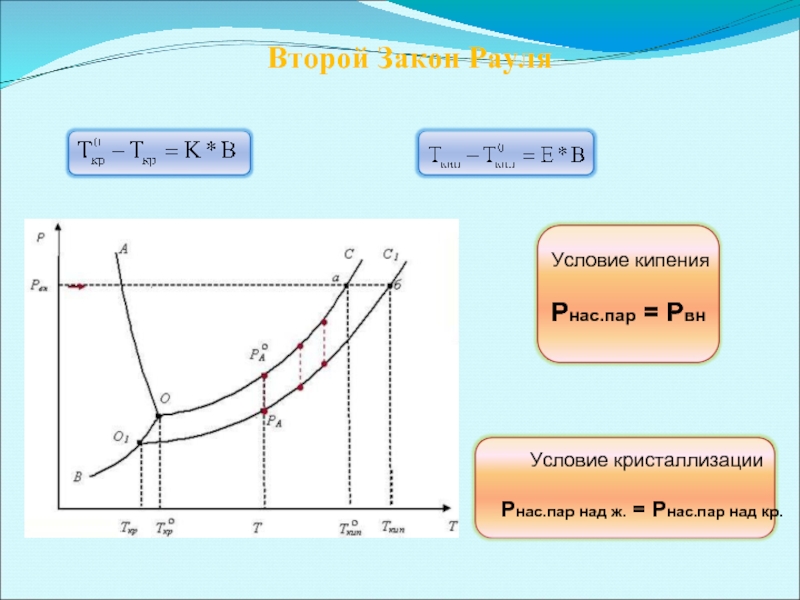
Слайд 21Понижение температуры замерзания растворов. Криоскопия.
Зависимости давления насыщенного пара от температуры над
ВС – над твердым растворителем;
О′А' – над раствором меньшей концентрации; О"А" – над раствором большей концентрации.
где m – моляльность раствора;
K – криоскопическая константа, постоянная для данного растворителя.
Слайд 22 Для разбавленных растворов электролитов в уравнение криоскопии
который определяется по уравнению:
где α – степень диссоциации растворенного вещества;
ν – число ионов, образующихся из одной молекулы.
Физико-химический метод изучения свойств разбавленных растворов, основанный на измерении понижения температур замерзания раствора по сравнению с температурой замерзания чистого растворителя, называется криоскопическим или криоскопией, а уравнение (2) называют уравнением криоскопии.
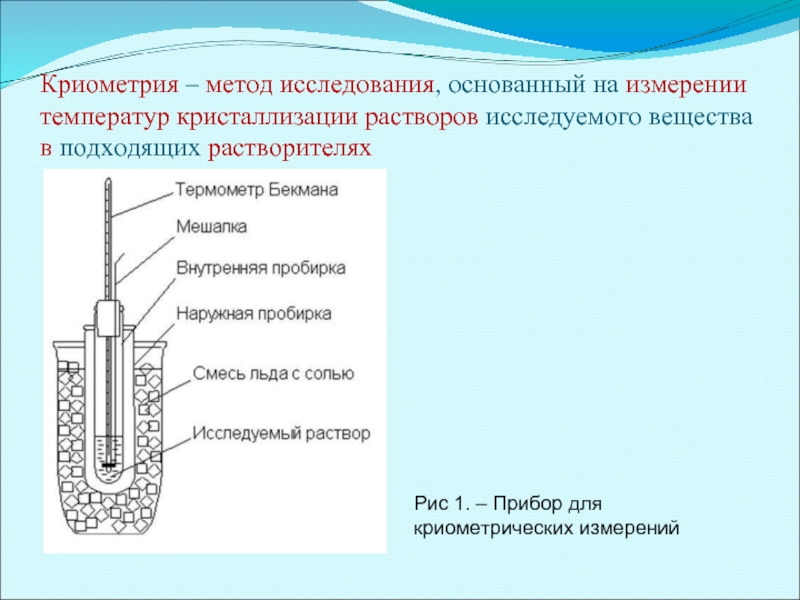
Слайд 23Криометрия – метод исследования, основанный на измерении температур кристаллизации растворов исследуемого
Рис 1. – Прибор для криометрических измерений
Слайд 24Условие кипения
Жидкость закипит, если давление пара в пузырьке станет равным внешнему
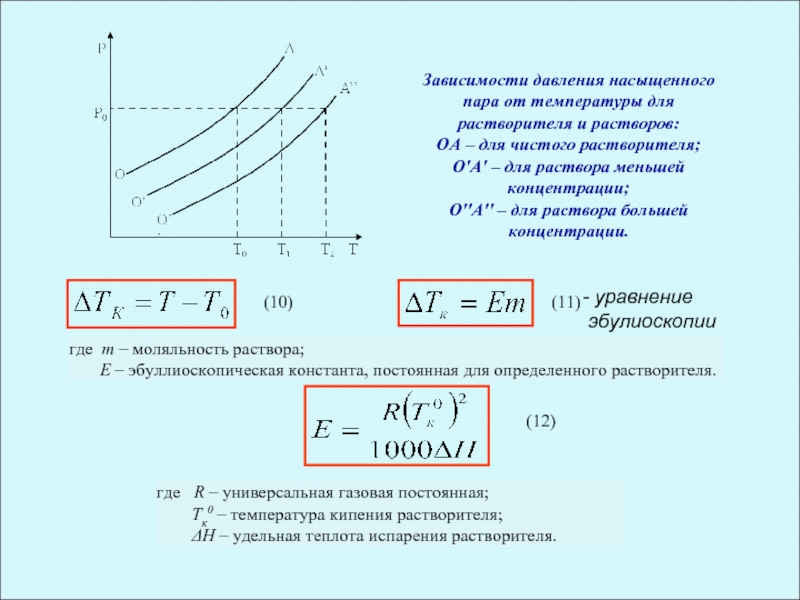
Слайд 25Зависимости давления насыщенного пара от температуры для растворителя и растворов:
ОА
О'А' – для раствора меньшей концентрации;
О''А'' – для раствора большей концентрации.
где m – моляльность раствора;
Е – эбуллиоскопическая константа, постоянная для определенного растворителя.
где R – универсальная газовая постоянная;
Тк0 – температура кипения растворителя;
ΔН – удельная теплота испарения растворителя.
Слайд 26
где М2 – молекулярная масса растворенного вещества.
где i – изотонический коэффициент Вант - Гоффа.
Физико-химический метод исследования свойств жидких растворов, основанный на измерении повышения температур кипения раствора, по сравнению с температурой кипения чистого растворителя, называется эбулиоскопическим или эбулиоскопией, а уравнение (11) – уравнением эбулиоскопии.
Слайд 28Растворы в биологии и биотехнологии
Растворами являются все биожидкости организма (кровь, лимфа,
Биожидкости – это растворы солей, белков, углеводов, липидов.
Вода – это всеобщий растворитель, необходимый для жизнедеятельности всех биосистем.
Концентрационный гомеостаз – постоянный состав биожидкости в организме, участвующей в транспорте кислорода и питательный веществ.
В пищевых технологиях при консервировании используют большое количество сахара и соли. В этих условиях идет плазмолиз и микроорганизмы становятся нежизнеспособными.
Изотонический раствор – 0,9% раствор NaCl.
Это заменитель крови, т..к. осмотические давления у них одинаковые. Если π > πизот., то это гипертонический раствор (2%), если π < πизот., то это гипотонический раствор (1%)
Слайд 29Законы для растворов
Закон Генри
Описывает влияние внешнего давления на растворимость газа (при
Закон Нернста – Шилова
Позволяет прогнозировать доступность лекарственных препаратов к клеткам в живых организмах
Диффузия и осмос
Скорость диффузии определяет упругость и эластичность клеток (в воде клетки набухают (гемолиз), а в крепких растворах солей сморщиваются (плазмолиз)).
Слайд 30Экстракция
В различных пищевых технологиях, производстве БАВ, эфирных масел, ароматизаторов часто возникает
Экстракцию из растворов применяют для разделения близкокипящих жидкостей с малой летучестью и высокой температурой кипения или для тех веществ, которые имеют температуру разложения меньше, чем температуру кипения.
Пример:
Антибиотики (пенициллин и др.) нельзя концентрировать выпариванием. Их экстрагируют бутил- (или этил-) ацетатом, которые потом отгоняют.
Уксусную, бензойную и др. кислоты выделяют из водных растворов экстракцией.
Выделяют из водных растворов металлы (уран, торий, цирконий, галлий и др.)