- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Предмет и задачи биохимии. Ферменты. Регуляция активности ферментов. (Лекция 3) презентация
Содержание
- 1. Предмет и задачи биохимии. Ферменты. Регуляция активности ферментов. (Лекция 3)
- 2. Влияние эффекторов на активность (скорость реакции) ферментов
- 3. Ингибиторы. Типы. По степени прочности связывания с
- 4. Ингибиторы. Типы. Необратимые ингибиторы – ковалентно связываются
- 5. Типы обратимых ингибиторов. Конкурентные ингибиторы Обратимые ингибиторы
- 6. Результат действия конкурентного ингибирования на графике
- 7. Конкурентные ингибиторы Тип ингибирования распространен в организме:
- 8. Неконкурентные ингибиторы Неконкурентные ингибиторы. Тип ингибирования –
- 9. Результат действия неконкурентного ингибитора на графике зависимости
- 10. Уровни регуляции скорости ферментативных реакций Для сохранения
- 11. 1. Регуляция количества молекул фермента в клетке
- 12. 2. Наличие и концентрация субстрата фермента Наличие
- 13. 3. Регуляция каталитической активности ключевого (регуляторного) фермента
- 14. Аллостерическая регуляция Характерна для олигомерных ферментов (четвертичная
- 15. Аллостерические эффекторы Отличаются по химической природе от
- 16. Аллостерическая регуляция Повышение сродства актив.центра к
- 17. Регуляция активности путем ассоциация/диссоциация Ферменты- олигомерные белки;
- 18. Регуляция путем ассоциации/диссоциации молекулы фермента активатор
- 19. Регуляция активности путем ассоциации/диссоциации Ассоциация – ковалентная
- 20. РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТА ПУТЕМ ФОСФОРИЛИРОВАНИЯ/ДЕФОСФОРИЛИРОВАНИЯ МОЛЕКУЛЫ ФЕРМЕНТА
- 21. Регуляция путем ассоциации/диссоциации молекулы фермента(протеинкиназа) с последующей
- 22. Регуляция активности путем ограниченного протеолиза Химическая модификация
- 23. Изоферменты Изоферменты – множественные формы ферментов, которые
Слайд 1Регуляция активности ферментов
(регуляция скорости ферментативных реакций)
1. Эффекторы. Типы. Механизмы действия.
2.Уровни регуляции
3.Механизмы регуляции активности регуляторных ферментов.
4. Изоферменты
Слайд 2Влияние эффекторов на активность (скорость реакции) ферментов
Эффекторы – вещества, которые связываясь
Эффекторы:
а. метаболиты, гормоны, образующиеся в организме, регулируют метаболизм, направляя его в нужное русло.
б. лекарственные препараты
В. яды.
Слайд 3Ингибиторы. Типы.
По степени прочности связывания с ферментом делят на необратимые и
Обратимые ингибиторы – нековалентно связываются с ферментами, образуя комплекс
E I , который способен диссоциировать при определенных условиях. Активность фермента восстанавливается
EI E + I
Слайд 4Ингибиторы. Типы.
Необратимые ингибиторы – ковалентно связываются c ферментом, образуя прочный комплекс
EI – практически не диссоциирует.
Примеры: яды !!( ДФФ- диизопропилфторфосфат) – нервнопаралитический яд. Ингибируют фермент ацетилхолинэстеразу, которая участвует в передаче нервных импульсов от нейрона к нейрону. (На его основе – синтезированы многие инсектициды)
Лекарственные препараты:
Аспирин – противовоспалительный нестероидный препарат.
Ингибирует фермент циклооксигеназу, который катализирует образование простагландинов из арахидоновой кислоты.
Ингибированные молекулы фермента разрушаются.
Простагландины – медиаторы воспаления. Их синтез восстанавливается только после синтеза новых молекул фермента.
Слайд 5Типы обратимых ингибиторов. Конкурентные ингибиторы
Обратимые ингибиторы делят на конкурентные и неконкурентные.
К
E+S → ES→E+P; E+I→EI
Слайд 6Результат действия конкурентного ингибирования
на графике зависимости V от [S]
контроль
С
Км –повышается; V max – const. При достаточно высокой [S] субстрат вытесняет ингибитор из активного центра
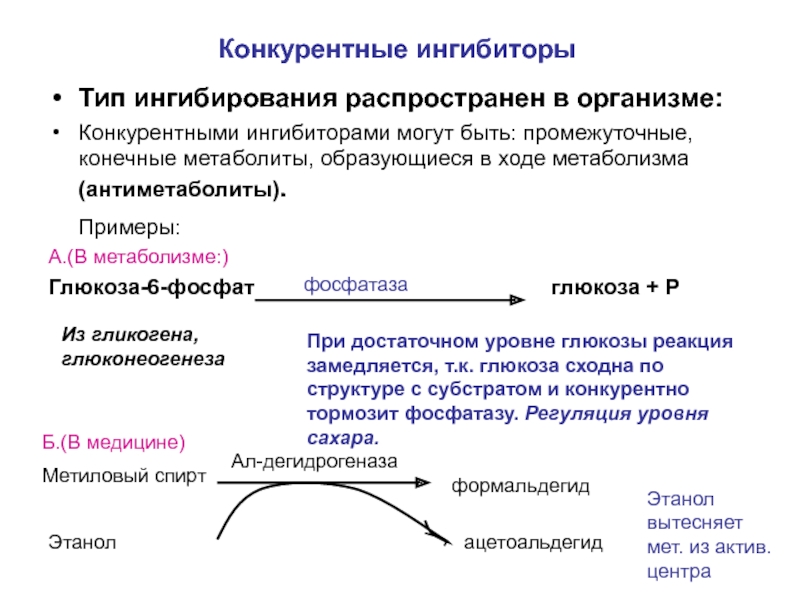
Слайд 7Конкурентные ингибиторы
Тип ингибирования распространен в организме:
Конкурентными ингибиторами могут быть: промежуточные, конечные
Примеры:
А.(В метаболизме:)
Глюкоза-6-фосфат глюкоза + Р
фосфатаза
Из гликогена, глюконеогенеза
При достаточном уровне глюкозы реакция замедляется, т.к. глюкоза сходна по структуре с субстратом и конкурентно тормозит фосфатазу. Регуляция уровня сахара.
Б.(В медицине)
Метиловый спирт
формальдегид
Ал-дегидрогеназа
Этанол
ацетоальдегид
Этанол вытесняет мет. из актив.центра
Слайд 8Неконкурентные ингибиторы
Неконкурентные ингибиторы. Тип ингибирования – неконкурентный.
Неконкурентный ингибитор не обладает сходством
Образуется тройной неактивный комплекс:
E + S + I ESI
Сродство фермента к субстрата не изменяется, т.е.
Км – не меняется
Слайд 9Результат действия неконкурентного ингибитора на графике зависимости [S]
1/2Vмах
1/2Vмах
Км
V
[S]
Км
контроль
с ингибитором
Слайд 10Уровни регуляции скорости ферментативных реакций
Для сохранения клеточного гомеостаза в клетках
Регуляция скорости реакции в клетке осуществляется на 3-х независимых уровнях:
Регуляция количества фермента в клетке;
Наличие и концентрация субстрата в клетке;
Изменение активности фермента
Слайд 111. Регуляция количества молекул фермента в клетке
Количество ферментов определяется соотношением скоростей
Аминокислоты фермент (белок)
синтез
распад
Синтез и фолдинг регулируются на разных этапах . Наиболее изучен механизм на уровне транскрипции- (индукция – активация; репрессия – угнетение). Регуляция осуществляется метаболитами, гормонами и др.
Регуляция распада ( протеолиз) менее изучена, но также, вероятно, на генетическом уровне.
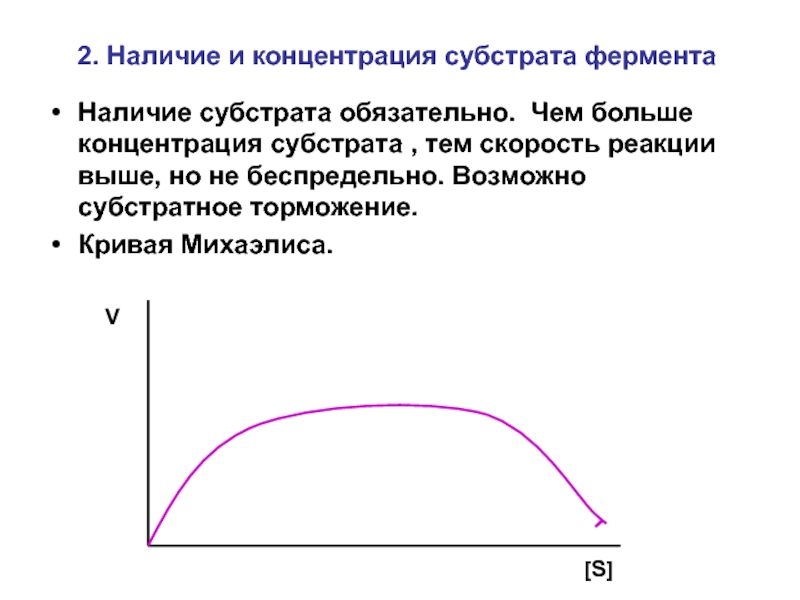
Слайд 122. Наличие и концентрация субстрата фермента
Наличие субстрата обязательно. Чем больше концентрация
Кривая Михаэлиса.
V
[S]
Слайд 133. Регуляция каталитической активности ключевого (регуляторного) фермента метаболического пути
Высокоэффективный способ регуляции
Основные механизмы регуляции каталитической активности регуляторного ферментов:
Аллостерическая регуляция;
Регуляция путем ассоциации/диссоциации протомеров молекул ферментов;
Регуляция путем фосфорилирования/ дефосфорилирования молекулы фермента;
4. Регуляция путем частичного протеолиза
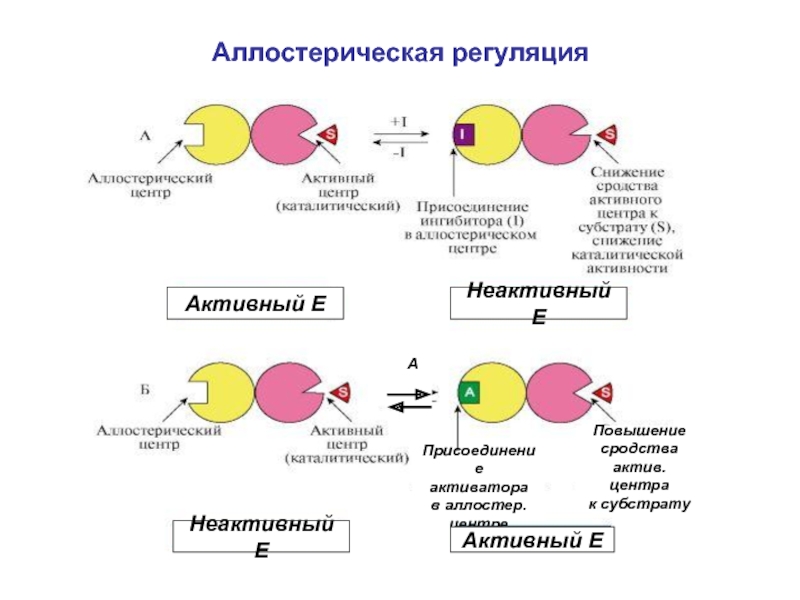
Слайд 14Аллостерическая регуляция
Характерна для олигомерных ферментов (четвертичная структура). В структуре имеются каталитические
Аллостерические ферменты меняют активность не только от концентрации субстрата , но и под действием эффекторов (результат- изменение конфигурации молекулы и активного центра).
Аллостерические ферменты- регуляторные ферменты метаболических путей, катализируют 1-ю необратимую (самую медленную) реакцию метаболического пути.
Активность остальных ферментов этого пути от [S]
S P 1 P2 P3→ P
E1
E2
E3
E4
Слайд 15Аллостерические эффекторы
Отличаются по химической природе от субстрата.
Активаторы и ингибиторы.
Аллостерические ингибиторы- конечный
Аллостерическое ингибирование часто называют – механизм отрицательной обратной связи
S P1 P2 P3 P
E1
E2
E3
E4
Слайд 16Аллостерическая регуляция
Повышение
сродства
актив.центра
к субстрату
Присоединение
активатора
в аллостер.
центре
Активный E
Неактивный E
Неактивный E
Активный E
А
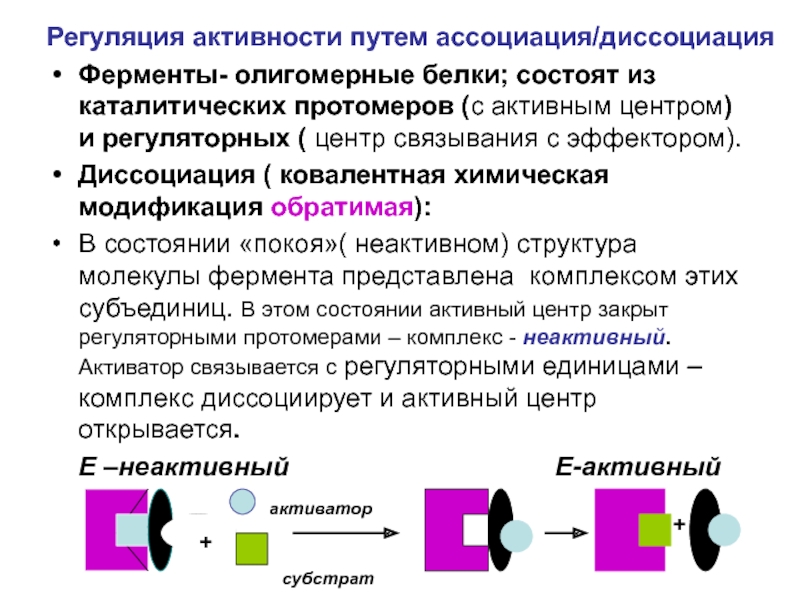
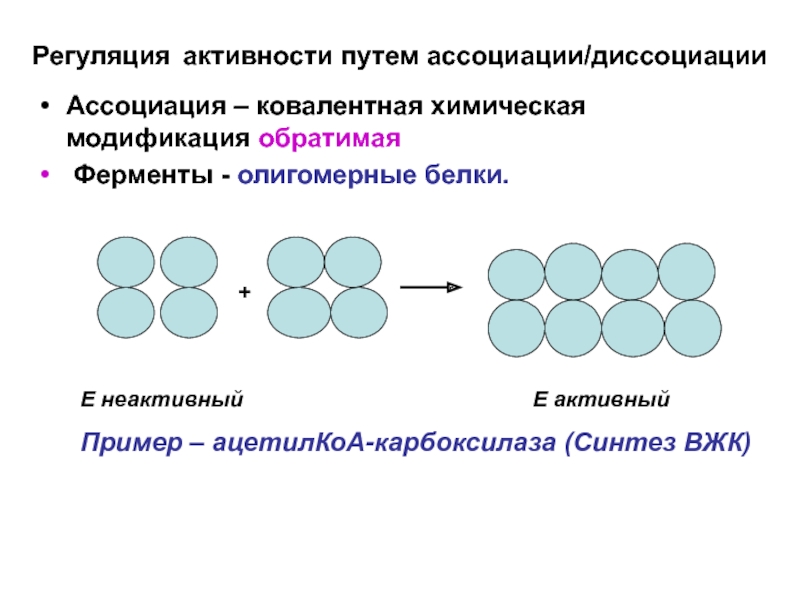
Слайд 17Регуляция активности путем ассоциация/диссоциация
Ферменты- олигомерные белки; состоят из каталитических протомеров (с
Диссоциация ( ковалентная химическая модификация обратимая):
В состоянии «покоя»( неактивном) структура молекулы фермента представлена комплексом этих субъединиц. В этом состоянии активный центр закрыт регуляторными протомерами – комплекс - неактивный. Активатор связывается с регуляторными единицами – комплекс диссоциирует и активный центр открывается.
E –неактивный E-активный
+
+
активатор
субстрат
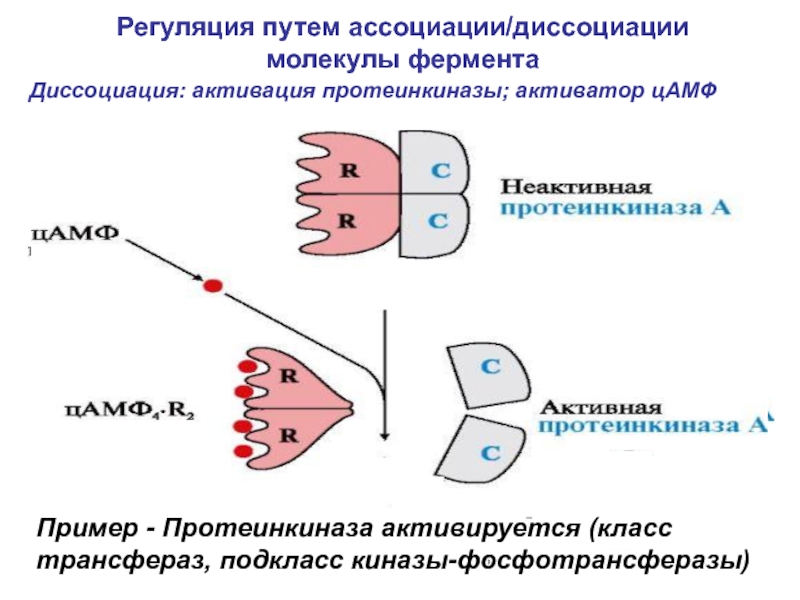
Слайд 18Регуляция путем ассоциации/диссоциации молекулы фермента
активатор
Диссоциация: активация протеинкиназы; активатор цАМФ
Пример - Протеинкиназа
Слайд 19Регуляция активности путем ассоциации/диссоциации
Ассоциация – ковалентная химическая модификация обратимая
Ферменты -
+
E неактивный E активный
Пример – ацетилКоА-карбоксилаза (Синтез ВЖК)
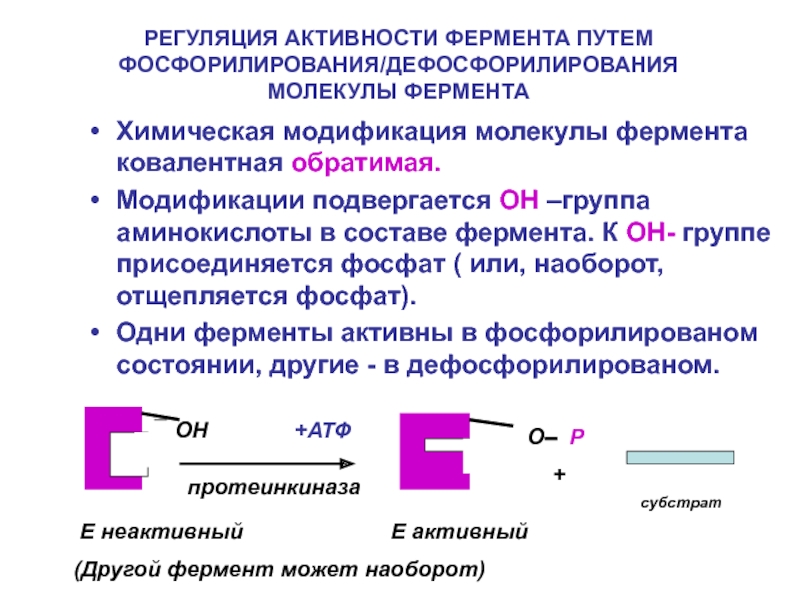
Слайд 20РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТА ПУТЕМ ФОСФОРИЛИРОВАНИЯ/ДЕФОСФОРИЛИРОВАНИЯ
МОЛЕКУЛЫ ФЕРМЕНТА
Химическая модификация молекулы фермента ковалентная обратимая.
Модификации
Одни ферменты активны в фосфорилированом состоянии, другие - в дефосфорилированом.
ОН
+АТФ
О Р
E неактивный E активный
(Другой фермент может наоборот)
протеинкиназа
субстрат
+
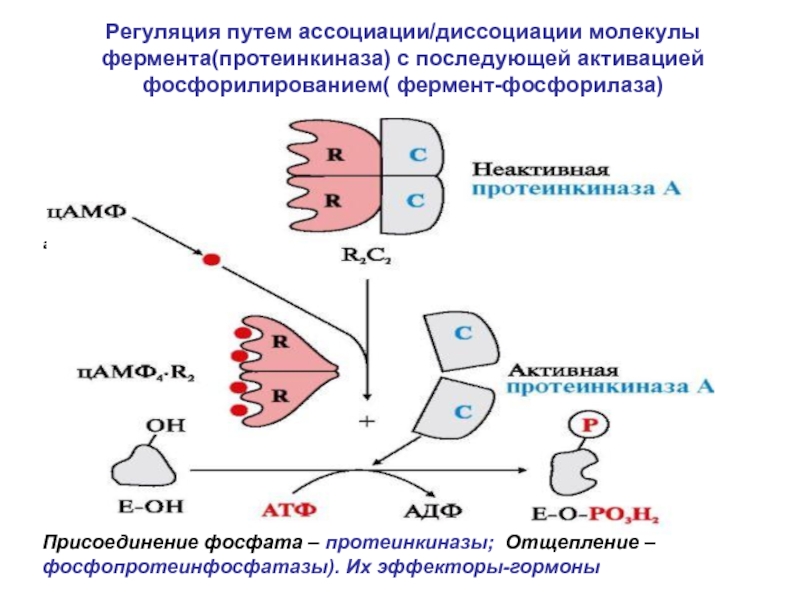
Слайд 21Регуляция путем ассоциации/диссоциации молекулы фермента(протеинкиназа) с последующей активацией фосфорилированием( фермент-фосфорилаза)
активатор
Присоединение фосфата
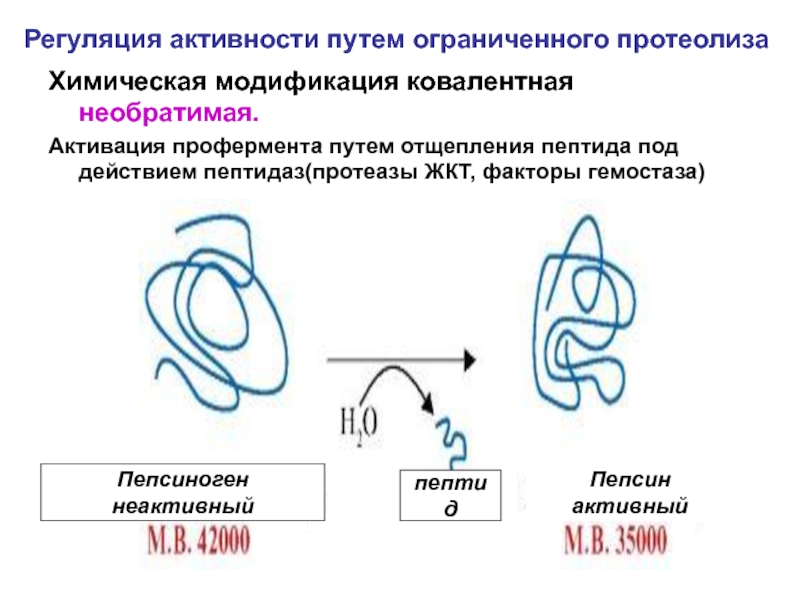
Слайд 22Регуляция активности путем ограниченного протеолиза
Химическая модификация ковалентная необратимая.
Активация профермента путем отщепления
Пепсиноген неактивный
Пепсин активный
пептид
Слайд 23Изоферменты
Изоферменты – множественные формы ферментов, которые катализируют один тип реакции в
Это олигомерные белки.
например: лактатдегидрогеназа:
Лактат +НАД
это тетрамер состоит из двух типов протомеров (субъединиц), Н – сердце ( heart) и М –мышцы( muscle) – Существует 5 изомеров. Строго распределены по органам.
ЛДГ1(Н4); ЛДГ2 (Н3М1); ЛДГ3 (Н2М2); ЛДГ4 (Н1М3); ЛДГ5 (М4)
Определяются с помощью электрофореза. Принцип метода- разная скорость движения в электрическом поле всвязи с разным зарядом и ММ.
Пировиноградная кислота +НАДН





![Результат действия конкурентного ингибирования на графике зависимости V от [S]контрольС ингибиторомКм –повышается; V max –](/img/tmb/6/507732/d095cd7ae874f9218da7d1c24eaa47f9-800x.jpg)

![Результат действия неконкурентного ингибитора на графике зависимости [S] 1/2Vмах 1/2VмахКмV[S]Км – не изменяется; Vмах –](/img/tmb/6/507732/94cb825a323627177ef9cccd25fcd31b-800x.jpg)