- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Предмет и задачи биохимии. Белки. (Лекция 1) презентация
Содержание
- 1. Предмет и задачи биохимии. Белки. (Лекция 1)
- 2. Цели и задачи биохимии Биохимия –
- 3. Применение знаний биохимии в медицине: 1. Решение
- 4. Белки. Строение, свойства, функции Белки (синоним:протеины; от
- 5. 1. Белки. Функции. В организме человека содержится
- 6. Белки. Химический состав. Мономер природного
- 7. Альфа-аминокислота- мономер природных белков
- 8. Пространственная структура (конформация) Все индивидуальные белки
- 9. Пространственная структура (продолжение) Четвертичная (олигомерные белки) -
- 10. Структура белка. Домены Для высокомолекулярных белков в
- 11. Шапероны. Фолдинг Фолдинг – процесс формирования трехмерной
- 12. УЧАСТИЕ ШАПЕРОНОВ В ФОЛДИНГЕ БЕЛКОВ
- 13. Центр связывания (активный центр). Взаимодействие
- 14. Физико-химические свойства белков. Высокая молекулярная масса –
- 15. Растворимость Факторы влияющие на растворимость: а.
- 16. Факторы, влияющие на растворимость б. ионная сила
- 17. Классификация. Существуют классификации по молекулярной массе,
- 18. Классификация (продолжение) Принцип классификации: Наличие простетической (
- 19. Простые белки На основании условно выработанных критериев
- 20. Простые белки ( продолжение) Проламины и глютелины
- 21. Сложные белки (протеиды) Сложные белки в зависимости
- 22. Сложные белки (продолжение) Нуклеопротеиды. Небелковый
- 23. Основные методы разделения и очистки белка. Подготовить самостоятельно
Слайд 1Введение. Предмет и задачи биохимии.
Белки.
Цели и задачи биологической химии.
Белки. Биологические функции.
Химический
Конформация белков. Фолдинг. Шапероны.
Физико-химические свойства.
Классификация.
Методы разделения белков.
Слайд 2Цели и задачи биохимии
Биохимия – дословно «химия жизни»
Цель: изучение химических (
Термин «биохимия» введен Карлом Нейбергом в 1903 г.
Задачи:
Изучение структуры биомолекул и биоактивных веществ во взаимосвязи с функциями.
Изучение механизмов поступления веществ в клетки.
3. Изучение механизмов превращения биомолекул в клетках, механизмов высвобождения и использования энергии, регуляция этих превращений, т.е. метаболизм
Слайд 3Применение знаний биохимии в медицине:
1. Решение проблем сохранения здоровья, в том
2. Выяснение причин различных заболеваний и изыскание путей их эффективного лечения.
(Диагностика и контроль за лечением)
При этом стоматолог всегда должен учитывать взаимосвязь химических (метаболических) процессов , происходящих в организме, и состоянием тканей и секретов ротовой полости.
Слайд 4Белки. Строение, свойства, функции
Белки (синоним:протеины; от греч.protos-первый)
Белки-высокомолекулярные азотсодержащие биополимеры или сополимеры,
Слайд 51. Белки. Функции.
В организме человека содержится свыше 50000 индивидуальных белков, выполняющих
Функции:
Специфические ( характерны только белкам, благодаря их уникальной пространственной конфигурации) - каталитическая, транспортная, рецепторная, иммунной защиты, механо-химическая, защита от кровопотери.
Неспецифические – пластическая, энергетическая, регуляторная
Белки выполняют специфические функции благодаря их уникальной пространственной (трехмерной) конфигурации
Слайд 6Белки. Химический состав.
Мономер природного белка – альфа- аминокислоты.
Классификация аминокислот:
- по полярности радикала;
- способности синтезироваться в организме –заменимые и незаменимые;
незаменимые: валин, лейцин, изолейцин, лизин, метионин, треонин, триптофан, фенилаланин.
частично заменимые- гистидин, аргинин.
условно заменимые – синтезируются из незаменимых- цистеин, тирозин.
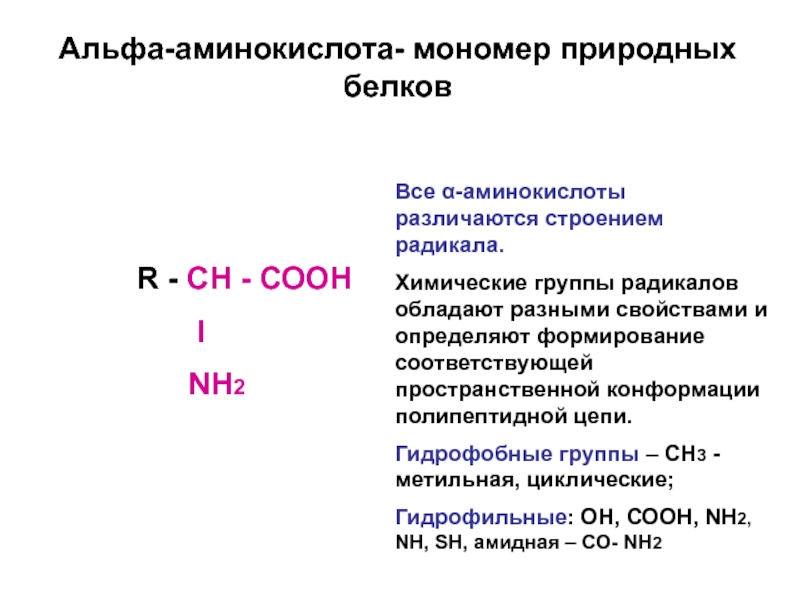
Слайд 7Альфа-аминокислота- мономер природных белков
R - CН - СООН
NН2
Все α-аминокислоты различаются строением радикала.
Химические группы радикалов обладают разными свойствами и определяют формирование соответствующей пространственной конформации полипептидной цепи.
Гидрофобные группы – СН3 -метильная, циклические;
Гидрофильные: ОН, СООН, NН2, NН, SH, амидная – СО- NН2
Слайд 8 Пространственная структура (конформация)
Все индивидуальные белки отличаются первичной структурой, конформацией, строением
Молекулы белка - трехмерны. Имеют три уровня организации:
первичная - полипептидная цепь, состоящая из аминокислот, последовательно связанных ковалентными пептидными связями
-СО-NН- ; аминокислотный состав и их последовательность обусловлена генетическим кодом. Каждый из индивидуальных белков имеет уникальную первичную структуру.
Первичная структура обусловливает пространственную конформацию.
вторичная - ( пространственно упорядоченная спираль, обусловленная водородными связями между водородом и кислородом групп, обеспечивающих пептидные связи); Два вида структуры – альфа-спираль и бета-спираль.
третичная – (энергетически выгодная упорядоченная структура, обусловленная нековалентными связями между химическими группа радикалов- водородные, ионные, дисульфидные, гидрофобные взаимодействия.).
Третичная структура- обязательная для всех белков – энергетически выгодная глобула. По геометрической форме глобулы белки разделяют на глобулярные и фибриллярные. Большинство белков – глобулярные. Они имеют компактную структуру,в которой гидрофобные радикалы расположены внутри молекулы.
Слайд 9Пространственная структура (продолжение)
Четвертичная (олигомерные белки) - ассоциация нескольких (четное кол-во) протомеров
Слайд 10Структура белка. Домены
Для высокомолекулярных белков в структуре характерно наличие доменов.
Домены- это
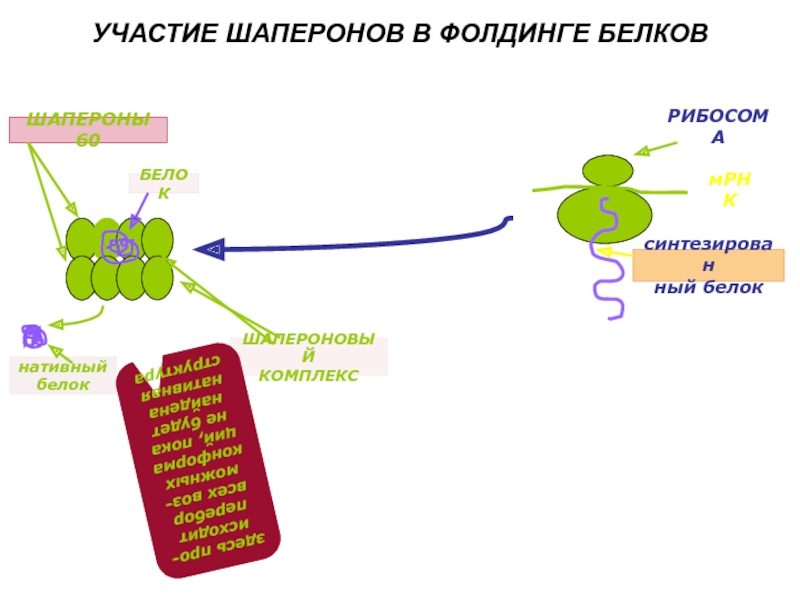
Слайд 11Шапероны. Фолдинг
Фолдинг – процесс формирования трехмерной структуры при участии белков шаперонов
Шапероны (shaperon - с французского- няня)– специализированные внутриклеточные белки, ответственные за быстрое формирования правильной пространственной структуры белка.
Шапероны также участвуют в защите клеточных белков от денатурирующих воздействий (температуры, гипоксии, инфекции, рН, тяжелых металлов). Их количество возрастает при повышении температуры, поэтому их также называют белками теплового шока.
Болезни связанные с нарушением фолдинга –амилоидозы (например, амилоидоз- нервной ткани- болезнь Альцгеймера).
Амилоиды- нерастворимые субстанции белка в клетке ( в связи с их несформированой нативной пространственной структурой) .
Слайд 12УЧАСТИЕ ШАПЕРОНОВ В ФОЛДИНГЕ БЕЛКОВ
РИБОСОМА
мРНК
синтезирован
ный белок
ШАПЕРОНЫ 60
БЕЛОК
ШАПЕРОНОВЫЙ
КОМПЛЕКС
нативный
белок
здесь про-исходит перебор всех воз-можных
Слайд 13
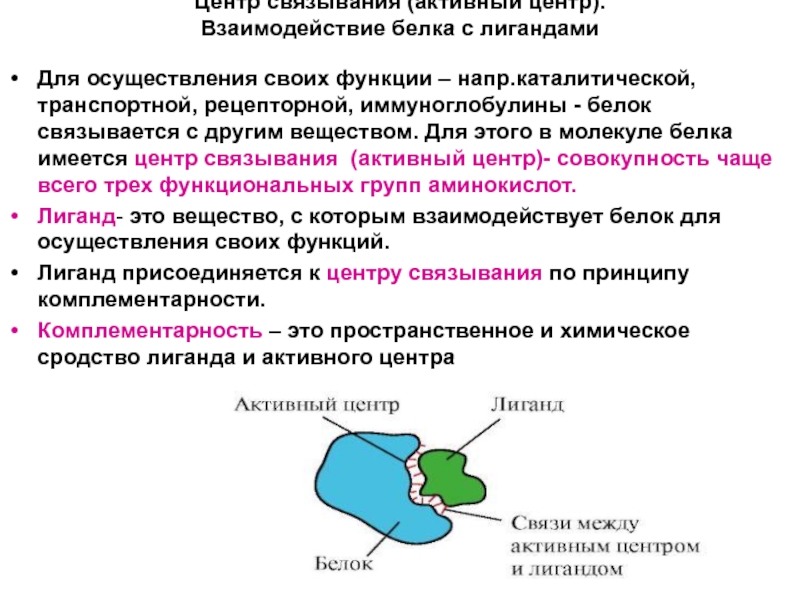
Центр связывания (активный центр).
Взаимодействие белка с лигандами
Для осуществления своих функции
Лиганд- это вещество, с которым взаимодействует белок для осуществления своих функций.
Лиганд присоединяется к центру связывания по принципу комплементарности.
Комплементарность – это пространственное и химическое сродство лиганда и активного центра
Слайд 14Физико-химические свойства белков.
Высокая молекулярная масса – варьирует в широких пределах, т.к.
Растворы белка обладают свойствами коллоидных растворов - осмотические свойства, высокая вязкость, малая скорость диффузии
2. Термостабильность и термолабильность. В основном белки термолабильные ( денатурируют)- однако, есть очень малая группа термостабильных белков ( напр. белок слюны муцин)
Растворимость и заряд белков. Способность белка
к растворению (гидратации) обусловлена наличием на поверхности белка гидрофильных –заряженных функциональных групп, способных удерживать диполи воды.Зависит и от М.М.
Факторы устойчивости раствора белка- заряд и гидратная облочка.
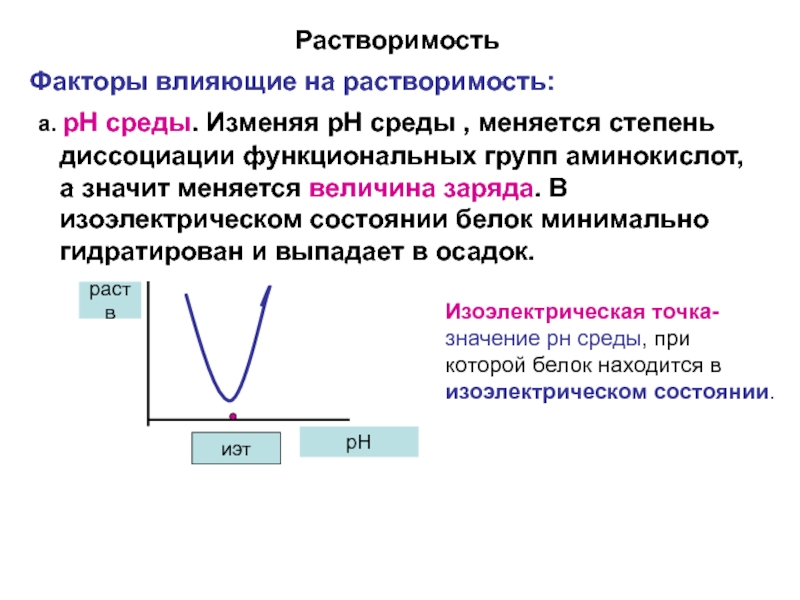
Слайд 15Растворимость
Факторы влияющие на растворимость:
а. рН среды. Изменяя рН среды ,
раств
рН
иэт
Изоэлектрическая точка- значение рн среды, при которой белок находится в изоэлектрическом состоянии.
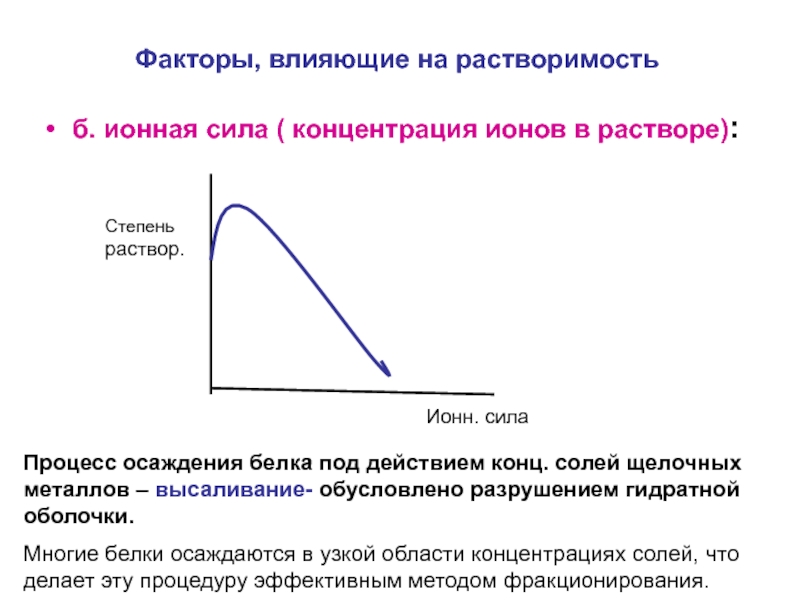
Слайд 16Факторы, влияющие на растворимость
б. ионная сила ( концентрация ионов в растворе):
Степень
Ионн. сила
Процесс осаждения белка под действием конц. солей щелочных металлов – высаливание- обусловлено разрушением гидратной оболочки.
Многие белки осаждаются в узкой области концентрациях солей, что делает эту процедуру эффективным методом фракционирования.
Слайд 17Классификация.
Существуют классификации по молекулярной массе, по выполняемым функциям, по локализации
Геометрическая форма белковой молекулы:
глобулярные; Фибриллярные
Глобулярные – белки, соотношение продольной и поперечной осей глобулы не превышает 1:10; а чаще 1:3; 1:4. Большинство инд. белков глобулярные Имеют компактную структуру и хорошо растворимы в воде в зависимости от величины заряда; М.М. и ионной силы растворителя.(см. выше).Функции разнообразны. К ним относятся ферменты, транспортные белки крови, иммуноглобулины, факторы свертывания крови и др.
Фибриллярные – белки имеют вытянутую нитевидную структуру, в которой соотношение осей более 1:10 Нерастворимы.
Коллаген, эластин, кератин структурные белки
Слайд 18Классификация (продолжение)
Принцип классификации:
Наличие простетической ( небелковой группы):
простые белки –
сложные белки – в состав молекулы входит небелковый компонент (простетическая группа). Присоединение небелкового компонента происходит или во время трансляции (котрансляционная модификация) или после завершения синтеза белка на рибосомах (посттрансляционная модификация).
Белковая часть – апобелок (апопротеин)
Слайд 19Простые белки
На основании условно выработанных критериев – м. м; ам.состав, растворимость,
Альбумины - локализованы в тканях и плазме крови, состоят из одной полипептидной цепи (3 уровень организации);
небольшая м. м. (15-70 тыс Да), кислые, сильно гидратированные – хорошо растворимы и осаждаются при насыщенных концентациях водоотнимающих веществ.
Обуславливают осмотическое давление крови, универсальные транспортные белки. Синтезируются преимущественно в печени
Глобулины – молекулярная масса в пределах 150 кДа, слабокислые или нейтральные, специфические транспортные белки. Осаждаются при полунасыщении водоотнимающих средств.
Среди них достаточно много сложных – (гликопротеионов).
Гистоны- тканевые белки, небольшая молекулярная масса 11-24 кДа, щелочного характера (аргинин,лизин) Связаны с ДНК. Функции- структурная – связаны с ДНК и участвуют в стабилизации пространственной структуры ДНК, регуляторная –способны блокировать передачу генетической информации от ДНК на РНК.
Протамины – низкомолекулярные м.м.-4-12 кДа,щелочные свойства (аргинин). Функция структурная- связываются с ДНК, делая ее молекулу компактной.
Слайд 20Простые белки ( продолжение)
Проламины и глютелины – растительные белки. Особенность –
Прионы - особый класс белков, обладающих инфекционными свойствами, Попадая в организм или спонтанно образуясь в организме, изменяют конформацию гомологичного ему нормального клеточного белка, превращая его в себе подобный. прионы- единственные инфекционные агенты, размножение которых идет без участия нуклеиновых кислот. Сопровождается разрушением головного мозга –губчатые энцефалопатии - прионовые болезни.
Источник – мясо, костная мука животных.
Слайд 21Сложные белки (протеиды)
Сложные белки в зависимости от химической природы небелкового компонента
Гликопротеины- простетическая группа -углеводы, связанные чаще всего с белком гликозидной связью. Белки плазмы крови - фибриноген, иммуноглобулины, муцины-белки слюны, некоторые ферменты и гормоны, коллаген, рецепторы клеток.
Хромопротеины- простетическая группа разнонобразные окрашенные продукты, прежде всего гем и флавин ( производное витамина В2). Гемоглобин, миоглобин, цитохромы; ферменты дегидрогеназы с коферментом ФАД.
Слайд 22Сложные белки (продолжение)
Нуклеопротеиды. Небелковый компонент – ДНК, РНК.
Липопротеины – небелковый компонент - липиды. Наибольшее значение липопротеины – транспортные формы липидов в крови. ЛПНП, ЛПВП, ЛПОНП, ХМ.
Фосфопротеиды – небелковый компонент фосфорная кислота. Фосфорилирование ( связь чаще с треонином и серином апобелка) белка внутриклеточных белков процесс обратимый. Процесс играет важную роль в регуляции биологической активности белков