- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Питание и дыхание бактерий презентация
Содержание
- 1. Питание и дыхание бактерий
- 2. Классификация бактерий по типам питания и способам
- 3. В зависимости от способа получения энергии, донора
- 4. Ауксотрофы — организмы, которые не способны синтезировать
- 5. Требования, предъявляемые к питательным средам Наличие необходимых
- 6. Оптимальная кислотность (рН). Поддержание определенного рН имеет
- 7. Влажность. Каждая питательная среда должна содержать воду,
- 8. Классификация питательных сред: По исходным компонентам: натуральные
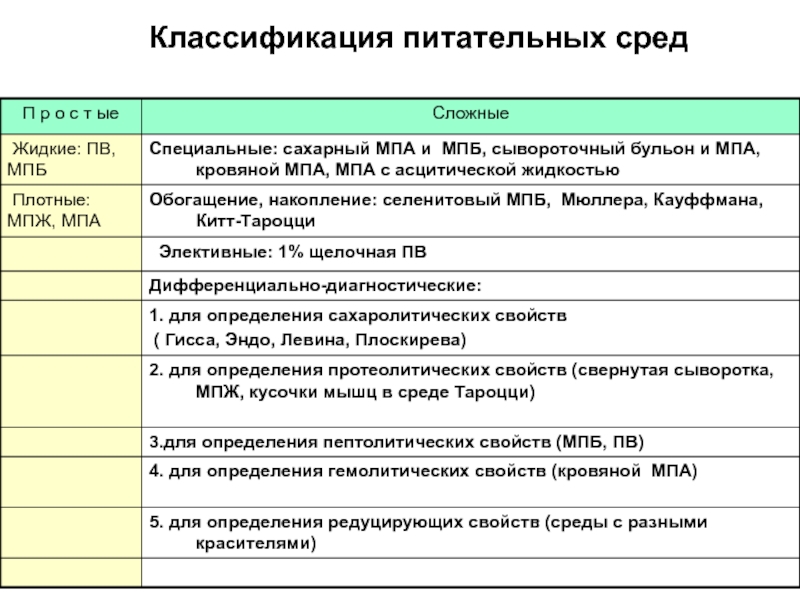
- 9. Классификация питательных сред
- 10. Среда Эндо дифференциально-диагностическая питательная среда, предназначенная для
- 11. Рост на среде Эндо Сальмонеллы и шигеллы
- 12. Элективный солевой агар (для культивирования стафилококков)
- 13. Агар Плоскирева — селективная среда для выделения шигелл
- 15. Желточно-солевой агар (ЖСА) - элективная для стафилококков
- 16. Селенитовый накопительный бульон (среда обогащения) Среда предложена
- 17. Среда М9 (Синтетическая, элективная)
- 18. По типу дыхания все микроорганизмы разделяются:
- 19. Дыхательные цепи У всех дышащих бактерий имеется
- 20. Дыхательные цепи бактерий в анаэробных и аэробных
- 21. Молоко по Тукаеву Состав: к 1-процентной пептонной
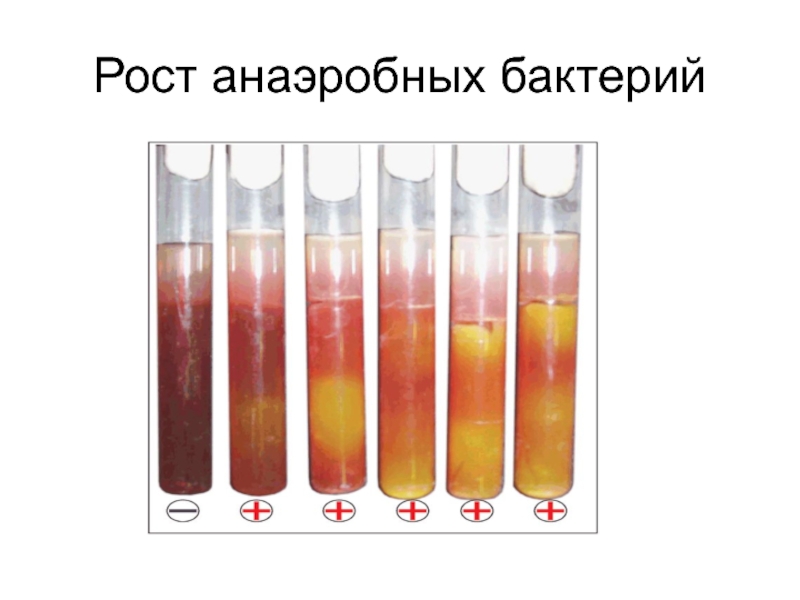
- 22. Рост анаэробных бактерий
- 23. Среда Вильсона Блера железосульфитный агар для выделения
- 24. Среда Вейнберга – разные варианты. 1)
- 25. Методы создания анаэробных условий Физические методы. Для
Слайд 2Классификация бактерий по типам питания и способам получения энергии
В зависимости
аутотрофы - используют неорганический углерод, в виде СО2;
гетеротрофы - используют органический углерод – напр., гексозы, многоатомные спирты, аминокислоты.
В зависимости от источника энергии (запасается в форме молекул АТФ):
фототрофы - источник энергии – свет;
хемотрофы - источник энергии – окислительно-восстановительные реакции
Среди хемотрофов выделяют литотрофы (используют неорганические доноры электронов (Н2, NH3, H2S, Fe2+ и др.) и органотрофы, которые используют в качестве доноров электронов органические соединения.
Слайд 3В зависимости от способа получения энергии, донора электронов и источника углерода
фотолитоавтотрофы
фотолитогетеротрофы
фотоорганоавтотрофы
фотоорганогетеротрофы
хемолитоавтотрофы
хемолитогетеротрофы
хемоорганоавтотрофы
хемоорганогетеротрофы.
Бактерии, изучаемые медицинской микробиологией, являются гетерохемоорганотрофами.
Слайд 4Ауксотрофы — организмы, которые не способны синтезировать определенные органические соединения, необходимые
Прототрофы - не требуют (в отличие от ауксотрофов) для своего развития готовых витаминов, аминокислот или др. факторов роста, а синтезируют их из минеральных или органических соединений.
Один и тот же микроорганизм может быть прототрофным по одному фактору роста, но ауксотрофным по другому.
Слайд 5Требования, предъявляемые к питательным средам
Наличие необходимых питательных веществ в достаточном количестве
Азот, углерод и водород для построения собственных белков: водород и кислород для клеток поставляет вода; источник азота - вещества животного происхождения (мясо говяжье, рыба, мясокостная мука, казеин), а также белковые гидролизаты, пептиды, пептоны.
Ростовые факторы (витамины, ферменты). Источник - экстракты из белков животного и растительного происхождения, белковые гидролизаты; нативные субстраты - кровь, сыворотка, асцитическая жидкость, яичный желток, кусочки печенки, почек, мозговой ткани и др.
Микроэлементы - среды должны содержать ионы железа, меди, марганца, цинка, кальция, натрия, калия и др. Их добавляют в питательную среду в виде солей, чаще всего фосфатов.
Слайд 6Оптимальная кислотность (рН).
Поддержание определенного рН имеет значение для предотвращения гибели микроорганизмов
Оптимальный редокс-потенциал (rH2).
Окислительно-восстановительный потенциал (редокс-потенциал) — мера способности химического вещества присоединять электроны (восстанавливаться).
Изотоничность.
Среда должна обладать определенным осмотическим давлением. Большинство бактерий способны расти на изотоничных средах, изотоничность которых достигается добавлением NaCl в концентрации 0,87 %. Некоторые бактерии не способны расти на средах при концентрации соли в них ниже 1 %. Такие бактерии называются галофильными.
Слайд 7Влажность.
Каждая питательная среда должна содержать воду, так как все процессы жизнедеятельности
Нетоксичность для исследуемых микробов.
Допустимым является употребление веществ, которые устраняют действие ингибиторов роста и токсинообразования микробов (отдельные аминокислоты, твин, активированный уголь и т.п.).
Определённая вязкость.
Плотность (вязкость) среды достигается добавлением агара - полисахарида, получаемого из водорослей. Он плавится при температуре 100 °С, но при охлаждении остывает при 45-50 °С. Агар добавляют в концентрации 0,5 % — для полужидких сред и 1,5—2 % — для создания плотных сред.
Стерильность. Прозрачность.
Слайд 8Классификация питательных сред:
По исходным компонентам:
натуральные среды — готовят из продуктов животного и
синтетические среды — готовят из определённых химически чистых органических и неорганических соединений, взятых в точно указанных концентрациях и растворённых в дважды дистиллированной воде.
По консистенции(степени плотности):
жидкие
полужидкие
плотные
Плотные и полужидкие среды готовят из жидких, к которым прибавляют агар-агар или желатин. Кроме того, в качестве плотных сред применяют свёрнутую сыворотку крови, свёрнутые яйца, картофель, среды с силикагелем. Некоторые микроорганизмы используют желатин как питательное вещество — при их росте среда разжижается.
По составу:
простые: мясопептонный бульон(МПБ), мясопептонный агар(МПА), , питательный желатин,
сложные — готовят прибавляя к простым средам кровь, сыворотку, углеводы и другие вещества.
По назначению:
основные — служат для культивирования большинства патогенных микробов. МПБ, МПА, бульон и агар Хоттингера, пептонная вода.
специальные — служат для выделения и выращивания микроорганизмов, не растущих на простых средах.
элективные(избирательные) — служат для выделения определённого вида микробов, росту которых они благоприятствуют, задерживая или подавляя рост сопутствующих микроорганизмов. Среды становятся элективными при добавлении к ним определённых антибиотиков, солей, изменения pH.Жидкие элективные среды называют средами накопления.
дифференциально-диагностические — позволяют отличить один вид микробов от другого по ферментативной активности.
консервирующие — предназначены для первичного посева и транспортировки исследуемого материала.
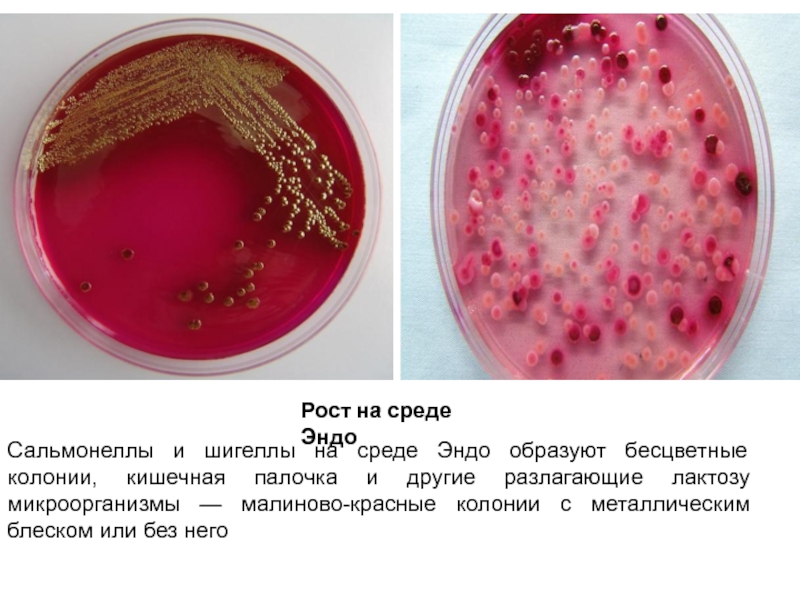
Слайд 10Среда Эндо
дифференциально-диагностическая питательная среда, предназначенная для выделения патогенных бактерий кишечной группы.
Состав среды: мясопептонный агар, лактоза, фуксин, сульфит натрия (Na2SO3).
Фуксин обесцвечивается сульфитом натрия (образуется бесцветная фуксинсернистая кислота — реактив Шиффа). Энтеробактерии, сбраживающие лактозу, в процессе брожения выделяют муравьиную кислоту, которая даёт цветную реакцию с фуксинсернистой кислотой с образованием свободного фуксина, в результате чего их колонии окрашиваются в малиново-красный цвет с металлическим блеском или без него. Колонии бактерий, не сбраживающих лактозу, имеют белый или слабо-розовый цвет (цвет питательной среды).
Слайд 11Рост на среде Эндо
Сальмонеллы и шигеллы на среде Эндо образуют бесцветные
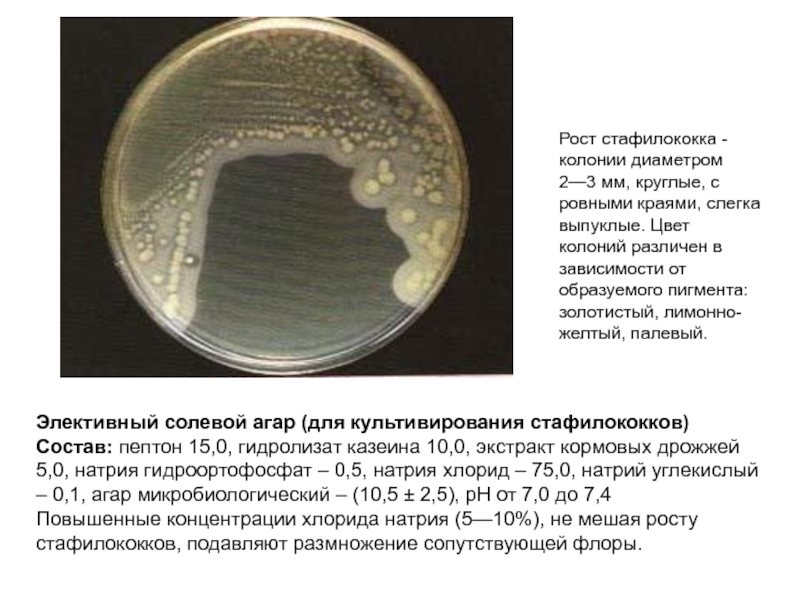
Слайд 12Элективный солевой агар (для культивирования стафилококков)
Состав: пептон 15,0, гидролизат казеина
Повышенные концентрации хлорида натрия (5—10%), не мешая росту стафилококков, подавляют размножение сопутствующей флоры.
Рост стафилококка - колонии диаметром 2—3 мм, круглые, с ровными краями, слегка выпуклые. Цвет колоний различен в зависимости от образуемого пигмента: золотистый, лимонно-желтый, палевый.
Слайд 13Агар Плоскирева — селективная среда для выделения шигелл и сальмонелл.
Состав: гидролизат
Принцип действия:
Ингибирующие вещества (желчные соли, бриллиантовый зеленый, йод), входящие в состав среды, полностью подавляют рост грамположительной микрофлоры и в 2-3 раза рост кишечной палочки, не препятствуя росту шигелл и сальмонелл.
Дифференцирующие свойства среды основаны на изменении рН в кислую сторону при росте лактозоферментирующих бактерий, которые образуют на среде колонии малинового цвета (индикатор нейтральный красный).
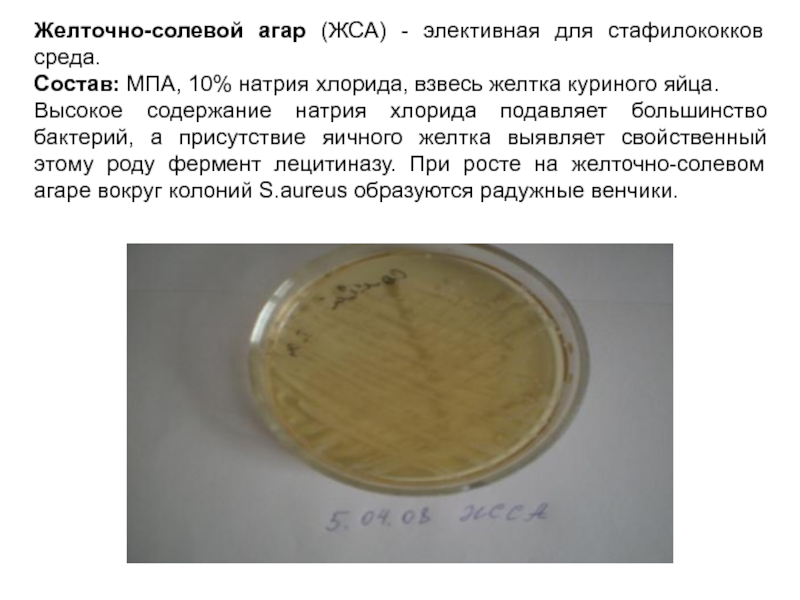
Слайд 15Желточно-солевой агар (ЖСА) - элективная для стафилококков среда.
Состав: МПА, 10%
Высокое содержание натрия хлорида подавляет большинство бактерий, а присутствие яичного желтка выявляет свойственный этому роду фермент лецитиназу. При росте на желточно-солевом агаре вокруг колоний S.aureus образуются радужные венчики.
Слайд 16Селенитовый накопительный бульон (среда обогащения)
Среда предложена Лейфсоном (1930) для селективного накопления
Принцип действия
Селенит подавляет рост кишечных колиформных бактерий и энтерококков преимущественно в течение первых 6-12 часов инкубации. Рост Salmonella, Proteus и Pseudomonas не тормозится. Рост: равномерное помутнение или осадок на дне.
Состав (г/л)
Пептон мясной 5,0; лактоза 4,0; селенит натрия 4,0; калий фосфорнокислый двузамещенный 3,5; калий фосфорнокислый однозамещенный 6,5. Готовая среда прозрачная, желтоватого цвета.
Слайд 17
Среда М9 (Синтетическая, элективная)
Состав (г/л): Na2HPO3 – 6,0; KH2PO4 –
Готовая среда – прозрачный раствор, рН – 7,0–7,2.
Способны расти только прототрофы (помутнение среды). Для ауксотрофов требуется добавление необходимых питательных веществ, например, для кишечной палочки – глюкозы.
Слайд 18По типу дыхания все микроорганизмы разделяются:
Облигатные аэробы (микобактерии туберкулеза и др.)
Микроаэрофилы - нуждаются в малых количествах кислорода (некоторые лептоспиры, бруцеллы), могут расти, если содержание О2 в окружающей среде будет значительно ниже атмосферного (порядка 2%)
Облигатные анаэробы (клостридии столбняка, ботулизма и др.) способны жить и размножаться только в отсутствие свободного кислорода воздуха. Дыхание у анаэробов происходит путем ферментации субстрата с образованием небольшого количества энергии.
Факультативные анаэробы — организмы, энергетические циклы которых проходят по анаэробному пути, но способные существовать при доступе кислорода, в отличие от облигатных анаэробов, для которых кислород губителен.
Капнофилы — микроорганизмы, которым для своей жизнедеятельности требуется углекислый газ в концентрации 10—15 % (кампилобактерии)
Слайд 19Дыхательные цепи
У всех дышащих бактерий имеется система транспорта электронов (дыхательная цепь).
Перенос
При аэробном дыхании в качестве конечного акцептора электронов используется молекулярный кислород.
При анаэробном дыхании конечным акцептором электронов служит не кислород, а другие неорганические или органические вещества. В зависимости от природы конечного акцептора различают нитратное, сульфатное, карбонатное, фумаратное типы дыхания и др.
Многие факультативные анаэробы при отсутствии кислорода используют в качестве конечного акцептора электронов нитраты (нитратное дыхание). При этом образуются нитриты и другие восстановленные формы азота, что используется на практике для идентификации бактерий.
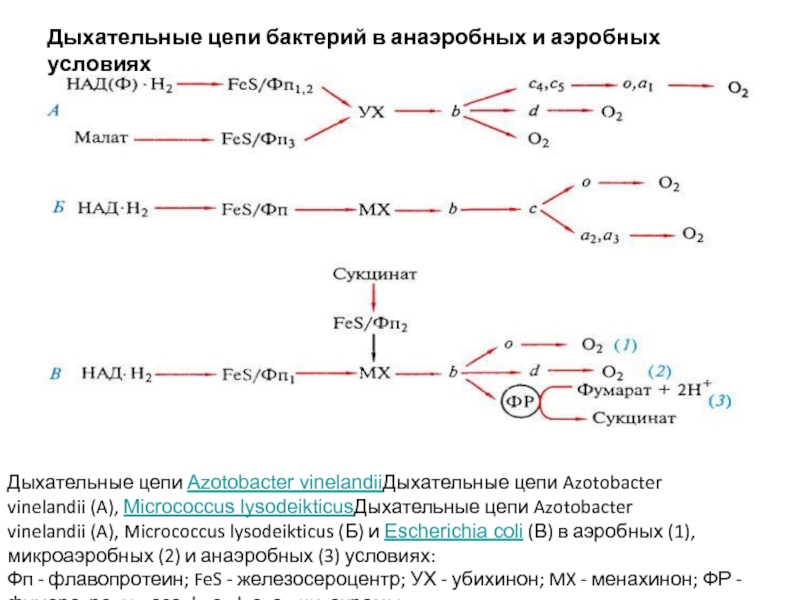
Слайд 20Дыхательные цепи бактерий в анаэробных и аэробных условиях
Дыхательные цепи Azotobacter vinelandiiДыхательные цепи Azotobacter
Фп - флавопротеин; FeS - железосероцентр; УХ - убихинон; MX - менахинон; ФР - фумаратредуктаза; b, с, d, о, а - цитохромы.
Слайд 21Молоко по Тукаеву
Состав: к 1-процентной пептонной воде прибавляют 5-6% обезжиренного молока,
Рост анаэробов – створаживание молока с образованием сгустка с пузырьками газа, просветление сыворотки.
Среда Китта – Тароцци
Жидкая питательная среда. Состав: мясопептонный бульон, обогащенный экстрактивными продуктами печени животных, кусочки вываренной печени в качестве поглотителя свободного кислорода.
Питательная основа – мясопептонный бульон, дыхательный субстрат – органические вещества (углеводы, липиды и аминокислоты) экстрактивных продуктов печени. Редуцирующее вещество - кусочки вываренной печени.
Рост анаэробов – помутнение с бурным газообразованием, ближе ко дну пробирки.
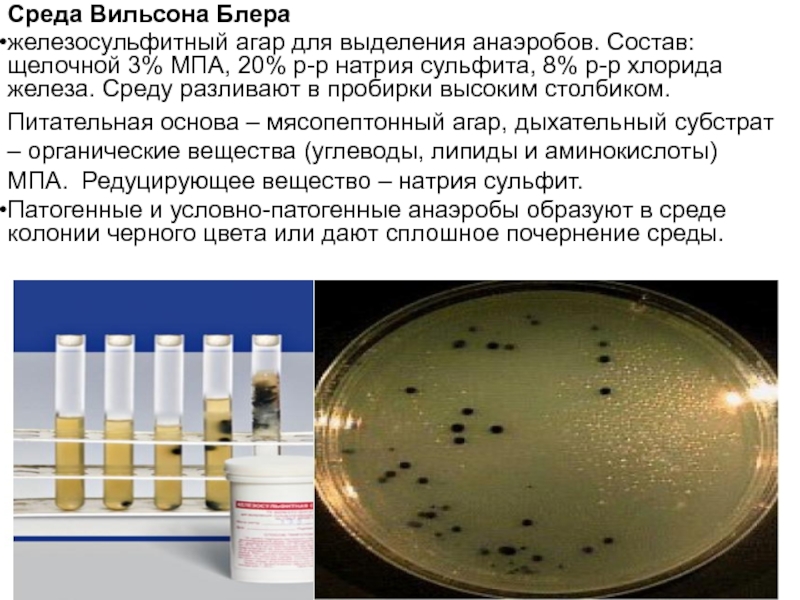
Слайд 23Среда Вильсона Блера
железосульфитный агар для выделения анаэробов. Состав: щелочной 3% МПА,
Питательная основа – мясопептонный агар, дыхательный субстрат – органические вещества (углеводы, липиды и аминокислоты) МПА. Редуцирующее вещество – натрия сульфит.
Патогенные и условно-патогенные анаэробы образуют в среде колонии черного цвета или дают сплошное почернение среды.
Слайд 24Среда Вейнберга – разные варианты.
1) полужидкая среда, состав: мясопептонный бульон,
2) жидкая среда, смесь водного экстракта сердечной мышцы быка и пептона из желудка и печени свиньи.
Питательная основа – мясопептонный бульон, дыхательный субстрат – органические вещества (углеводы, липиды и аминокислоты) экстрактивных продуктов. Редуцирующее вещество – глюкоза или кусочки вываренной печени.
Рост анаэробов – помутнение с газообразованием.
Среда Цейсслера.
Состав: МПА, 2% глюкозы, 10—15 мл стерильно взятой человеческой, лошадиной или бараньей крови.
Рост анаэробов - серо-желтые колонии с зоной гемолиза
Слайд 25Методы создания анаэробных условий
Физические методы. Для удаления растворенного в питательных средах
Применение анаэростатов и анаэробных боксов.
Химические методы. Для поглощения кислорода из замкнутого пространства можно использовать гидросульфит натрия. Для связывания кислорода в 1л объема используют 100мл свежеприготовленного 20% Na2S2O4 и 16мл 50% КОН.
Для связывания остатков кислорода используют вещества-редуценты, к которым относится тиогликолевая кислота или тиогликолат натрия, аскорбиновая кислота, различные сахара, цистин и цистеин, муравьинокислый натрий и т.д.
3.Биологические методы Совместное выращивание анаэробов и аэробов (метод Фортнера). На одну половину чашки засевают исследуемый материал, а на другую – культуру аэробного или факультативно-анаэробного микроба, способного энергично поглощать кислород.