- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Пероксисомы/Микротельца презентация
Содержание
- 1. Пероксисомы/Микротельца
- 2. Пероксисомы или микротельца – органеллы, окруженные
- 3. Пероксисомы содержат ферменты, ответственные за множество биохимических
- 4. Кроме окислительных ферментов, пероксисома обязательно содержит
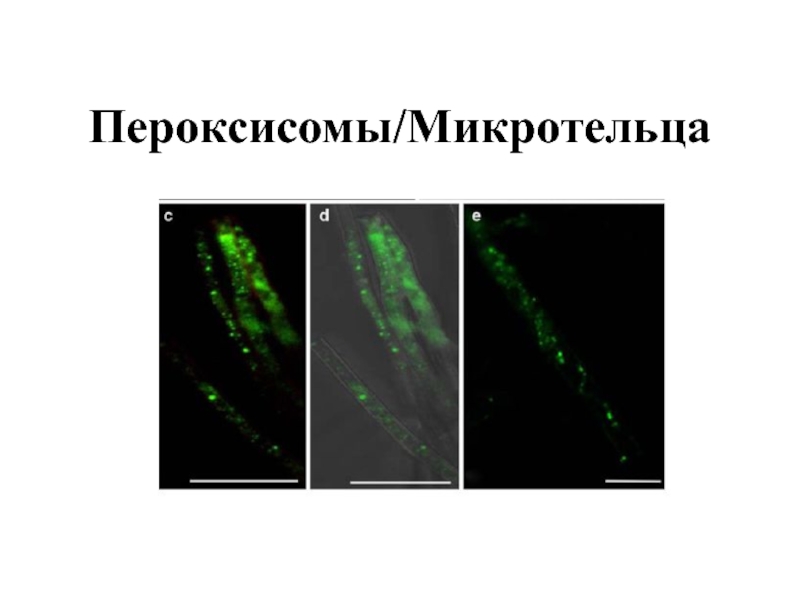
- 5. Последние данные продемонстрировали, что пероксисомы почкующихся
- 6. Функции пероксисом у эукариот Пероксисомы участвуют в
- 7. Общие функции Общие функции включают пероксисомальный
- 8. Специфические функции Последняя стадия биосинтеза пенициллина
- 9. Распространение Пероксисомы присутствуют у большинства групп грибов.
- 10. Пероксисомы формируются при росте клеток дрожжей (Candida,
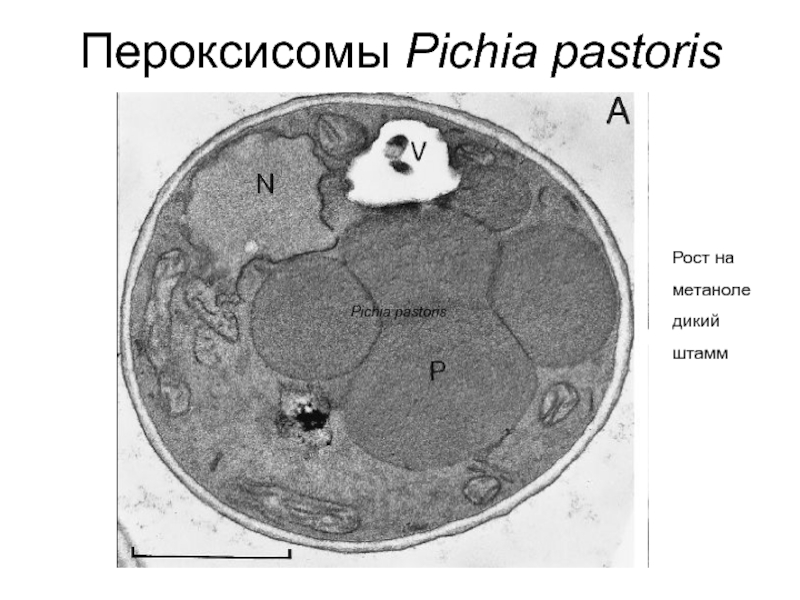
- 11. Пероксисомы Pichia pastoris Pichia pastoris Рост на метаноле дикий штамм
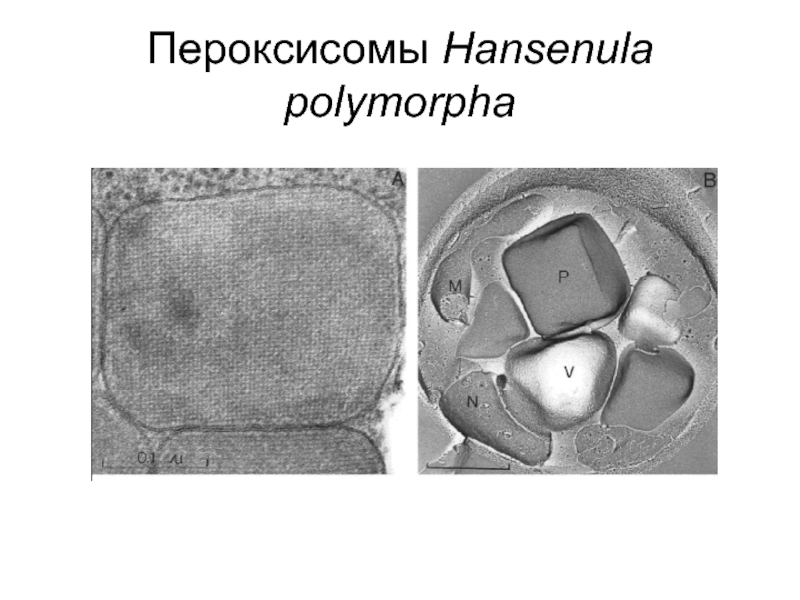
- 12. Пероксисомы Hansenula polymorpha
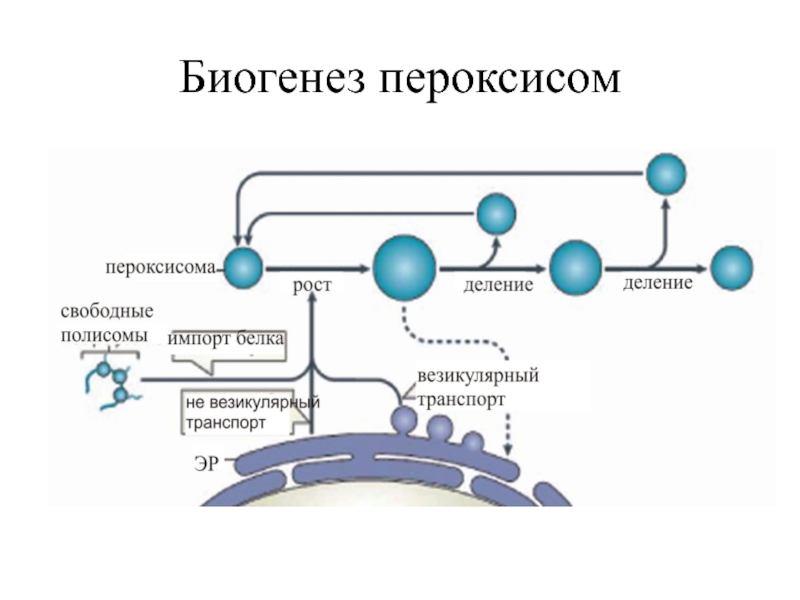
- 13. Биогенез Новые пероксисомы всегда возникают из
- 14. Молекулярные основы биогенеза пероксисом достаточно хорошо изучены.
- 15. В настоящее время общепринято, что практически
- 16. Для мембранных белков ситуация более сложная;
- 17. В биогенезе и включении в мембрану
- 18. В импорте пероксисомальных матриксных белков используется
- 19. Биогенез пероксисом
- 20. Пероксиновые гены имеют эукариотическое происхождение. Имеется
- 21. белок наследования пероксисом 2 = Inheritance of
- 22. Пексофагия Для регуляции функций пероксисом и ограничения
- 23. Макро- и микропексофагия (аналогичные макро- и микроавтофагии)
- 24. Пексофагия у Pichia pastoris Мембрана вакуоли пексофагосома макропексофагия микропексофагия
- 25. Макропексофагия у Hansenula polymorpha
- 26. Индуцированная глюкозой микропексофагия у Pichia pastoris
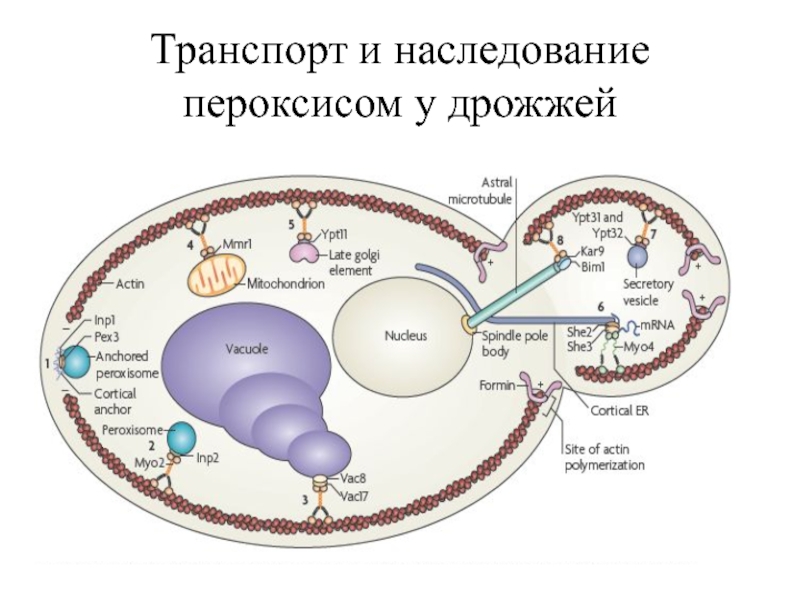
- 27. Транспорт и наследование пероксисом у дрожжей
- 28. Пероксисомы занимают строго фиксированное положение в
- 29. Пока большинство пероксисом остаются неподвижными у кортекса
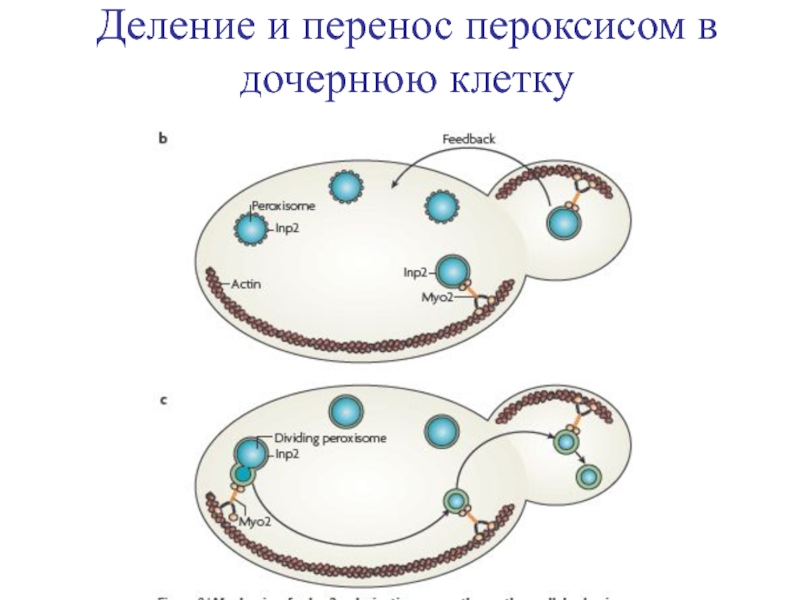
- 30. Деление и перенос пероксисом в дочернюю клетку
- 31. Тельца Воронина Тельца Воронина названы в честь
- 32. Функция телец Воронина – встраивание в поровый
- 33. Филогенетическое древо грибов дополненное некоторыми характеристиками (рабочая
- 34. Тельца Воронина были впервые изолированы из
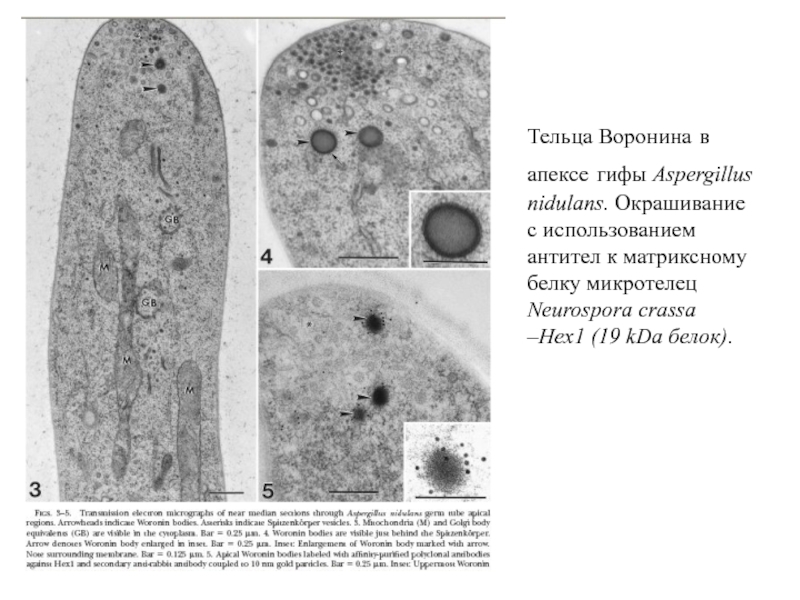
- 35. Тельца Воронина в апексе гифы Aspergillus nidulans.
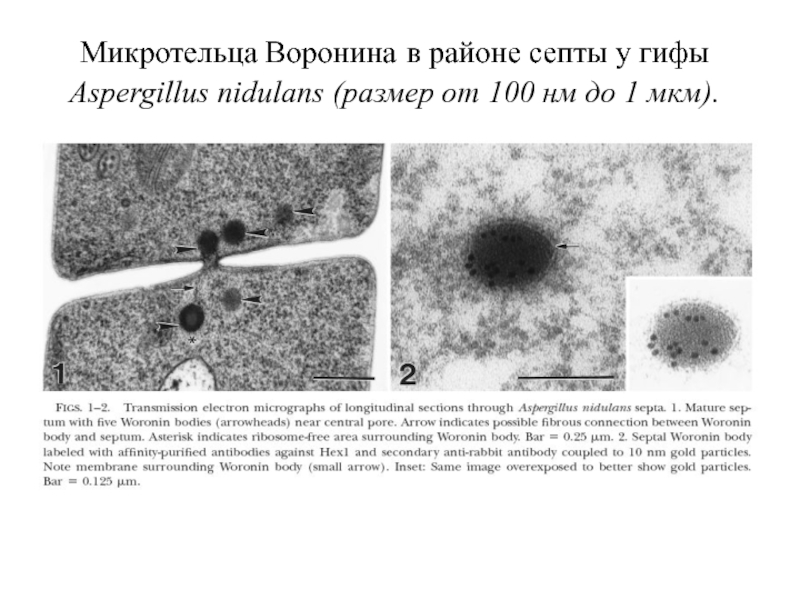
- 36. Микротельца Воронина в районе септы у гифы
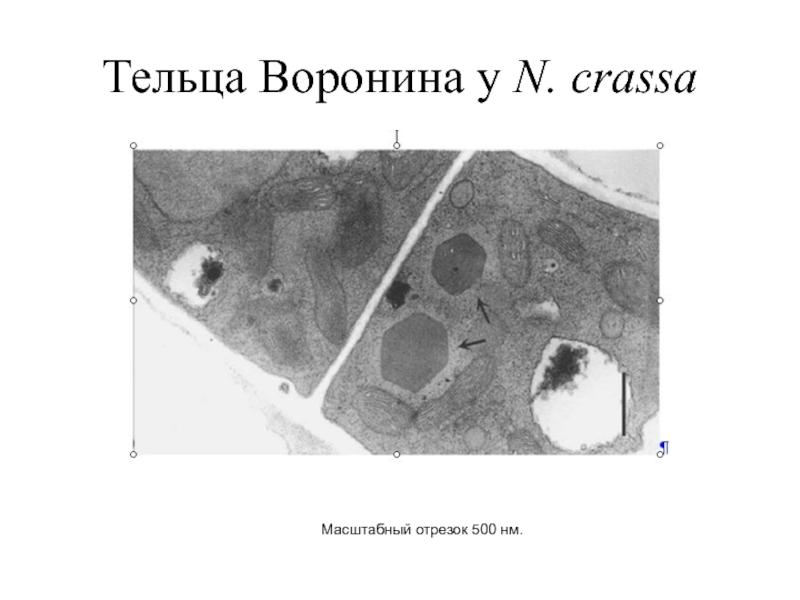
- 37. Тельца Воронина у N. crassa Масштабный отрезок 500 нм.
- 38. Структура кристаллической решетки HEX-1 Очищенный рекомбинантный
- 39. Биогенез телец Воронина Тельца Воронина обнаружены
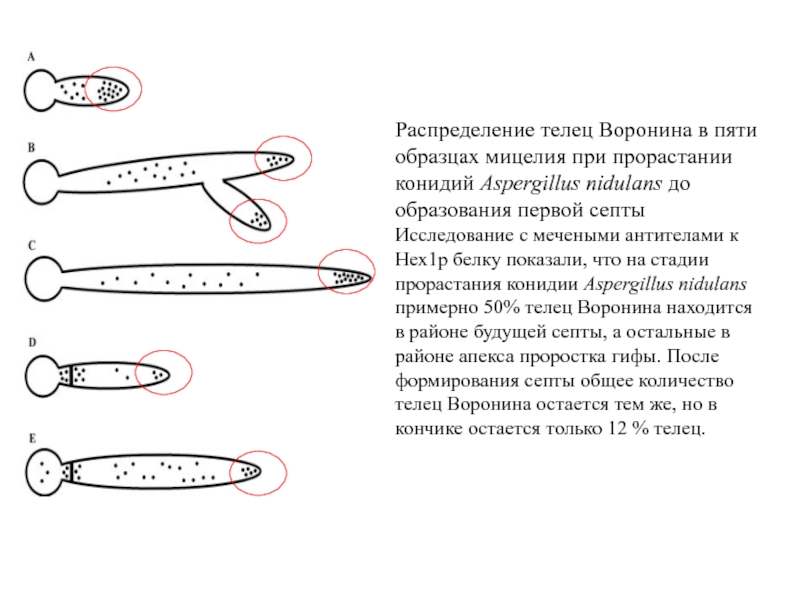
- 40. Распределение телец Воронина в пяти образцах мицелия
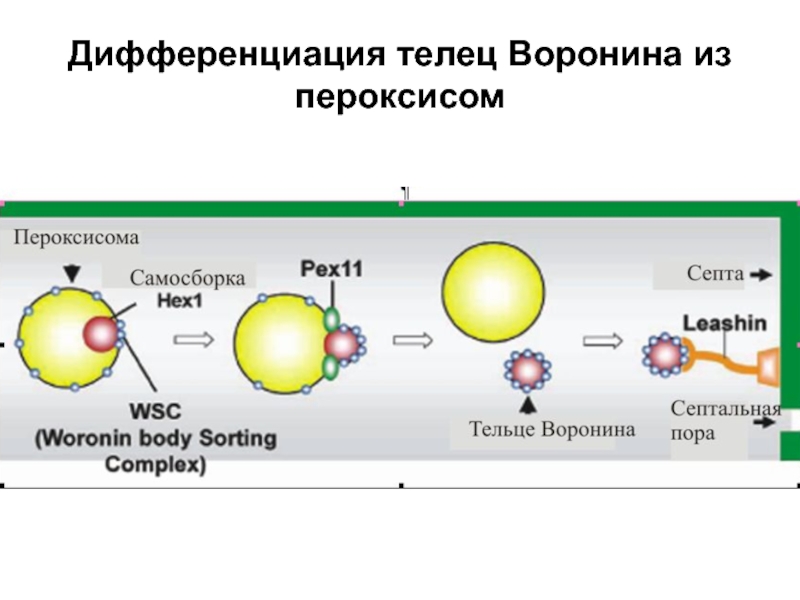
- 41. Дифференциация телец Воронина из пероксисом
- 42. Figure 3. Depiction of a Neurospora crassa
Слайд 2
Пероксисомы или микротельца – органеллы, окруженные однослойной мембраной. Пероксисомы присутствуют у
Слайд 3Пероксисомы содержат ферменты, ответственные за множество биохимических путей, в частности, β-окисление
Слайд 4
Кроме окислительных ферментов, пероксисома обязательно содержит каталазу. Каталаза разлагает образовавшуюся перекись
Н2О2 + R'H2 → R' + 2Н2О
Слайд 5
Последние данные продемонстрировали, что пероксисомы почкующихся дрожжей, мицелиального гриба Рodospora anserina
Слайд 6Функции пероксисом у эукариот
Пероксисомы участвуют в регуляции разнообразных процессов развития, таких
У грибов пероксисомы необходимы для утилизации необычных источников углерода и азота, биосинтеза вторичных метаболитов, созревания и прорастания спор, важны для хищных и патогенных грибов (Kiel et al., 2005).
Слайд 7Общие функции
Общие функции включают пероксисомальный путь β-окисления жирных кислот. Этот путь
Пероксисомальный путь превращает жирные кислоты в ацетил коэнзим-А, важный интермедиат в клеточном метаболизме, участвующий в нескольких путях биосинтеза.
Анализ мутантов у разных видов грибов показал, что пероксисомальный путь β-окисления жирных кислот является источником ацетил-CoA в синтезе меланина.
Пероксисомальный путь β-окисления некоторых жирных кислот приводит к формированию пимелиновой кислоты, предшественника биотина (витамин H или B7).
Помимо участия пероксисом в β-окислении жирных кислот, пероксисомы мицелиальных грибов участвуют в нескольких метаболических путях, таких как метаболизм пурина и аминокислот.
Слайд 8Специфические функции
Последняя стадия биосинтеза пенициллина у грибов (проводимая ацилтрансферазой, IAT)
Метилотрофность дрожжей. У растущих на метаноле клеток дрожжей пероксисомы содержат три ключевых фермента метаболизма метанола: алкогольоксидазу (AO), дигидроксиацетон-синтазу (DHAS) и каталазу (CAT). У этих дрожжей алкогольоксидаза, локализованная в пероксисомах, катализирует первую ступень потребления метанола с образованием формальдегида, цитотоксичного компонента, который в дальнейшем окисляется до углекислого газа.
Получены доказательства участия пероксисом в синтезе сидерофоров (вещества переводящие железо в растворимую форму) у Aspergillus nidulans и A. fumigatus.
Слайд 9Распространение
Пероксисомы присутствуют у большинства групп грибов. Исключение составляет группа анаэробных грибов,
Слайд 10Пероксисомы формируются при росте клеток дрожжей (Candida, Hansenula, Pichia) на метаноле
Высокая концентрация AO внутри органеллы приводит к кристаллизации этого белка, что отражается в типичной кубоидной форме органелл
Метилотрофные* и неметилотрофные (Trichosporon cutaneum) виды дрожжей способны утилизировать несколько органических источников азота. При этом активизируются следующие ферменты пероксисом: амино оксидаза (для утилизации первичных аминов подобных метиламину или этиламину), урат оксидаза и D-амино кислая оксидаза (для утилизации, например, D-alanine). Вместе с этими оксидазами также индуцируется пероксисомальная каталаза параллельно с увеличением размера и числа пероксисом.
* метилотрофные дрожжи – дрожжи, способные использовать С1–соединения (метан, метанол, формиат и др.) в качестве источника энергии и углерода, в некоторых случаях С2- соединения.
Условия формирования
Слайд 13Биогенез
Новые пероксисомы всегда возникают из предсуществующих и формируются путем роста и
Слайд 14Молекулярные основы биогенеза пероксисом достаточно хорошо изучены. Формирование пероксисом у разных
(1) биогенез пероксисомальных мембран,
(2) импорт пероксисомальных матриксных белков,
(3) пролиферация или деление пероксисом.
Сборка функционирующей пероксисомы требует импорта примерно 100 разных кодируемых ядром белков. Эти белки могут включаться в пероксисомальную мембрану или матрикс органеллы.
Слайд 15
В настоящее время общепринято, что практически все пероксисомальные матриксные белки (ПМБ)
Слайд 16
Для мембранных белков ситуация более сложная; в зависимости от белка и
Слайд 17
В биогенезе и включении в мембрану пероксисомальных мембранных белков аскомицета Podospora
Слайд 18
В импорте пероксисомальных матриксных белков используется большой набор пероксинов: PEX1, PEX2,
Слайд 20
Пероксиновые гены имеют эукариотическое происхождение. Имеется множество высоко консервативных пероксинов, которые,
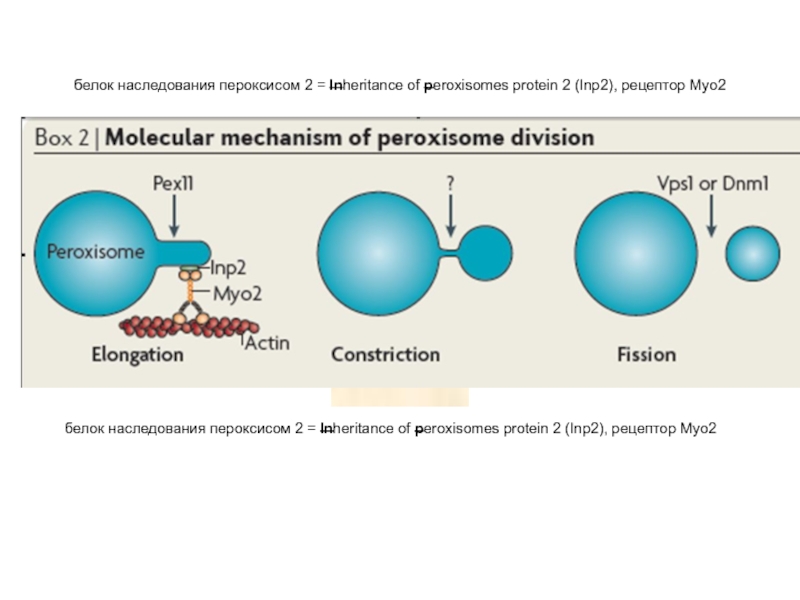
Слайд 21белок наследования пероксисом 2 = Inheritance of peroxisomes protein 2 (Inp2),
белок наследования пероксисом 2 = Inheritance of peroxisomes protein 2 (Inp2), рецептор Myo2
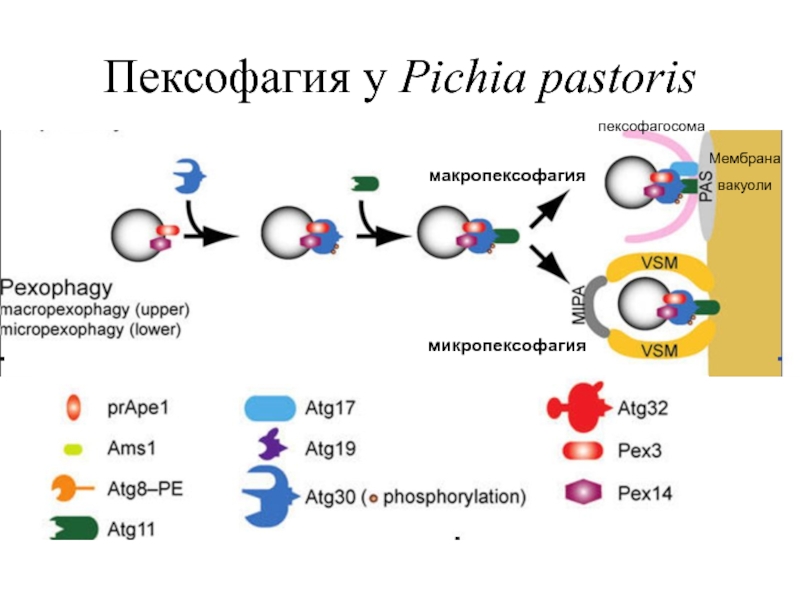
Слайд 22Пексофагия
Для регуляции функций пероксисом и ограничения процесса клеточного старения, лишние и
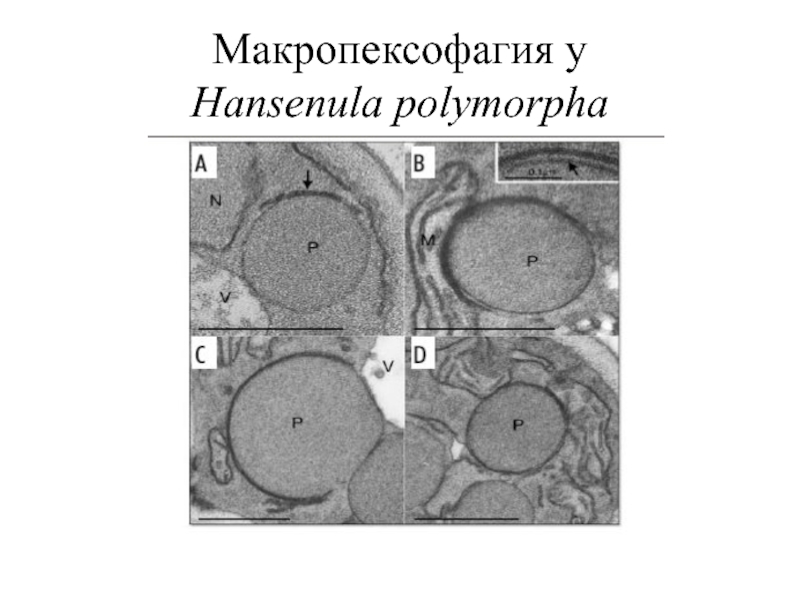
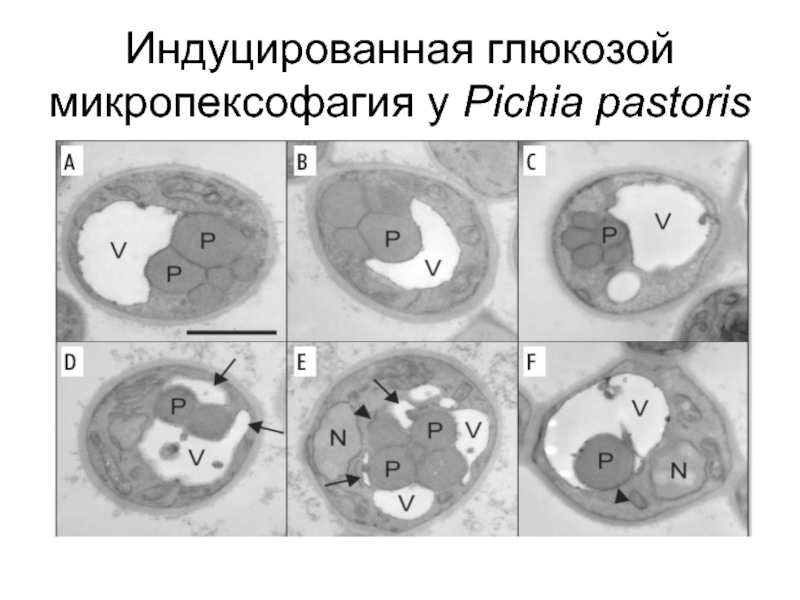
Слайд 23Макро- и микропексофагия (аналогичные макро- и микроавтофагии) два морфологически четких типа
(i) в процессе макропексофагии индивидуальные пероксисомы селективно поглощаются вновь образованной двумембранной везикулой - эта структура, называемая пексофагосомой (аналогично автофагосомам), в дальнейшем сливается с вакуолярной/лизосомальной мембраной;
(ii) в течение микропексофагии кластер пероксисом постепенно окружается вакуолярными/лизосомальными выступающими мембранами, которые затем замыкаются с формированием чашеобразной двумембранной структуры - микропексофагия-специфичный мембранный аппарат (MIPA).
Оба типа пексофагии подвергают включенные в лизосому пероксисомы действию гидролаз.
Слайд 28
Пероксисомы занимают строго фиксированное положение в процессе роста почки, что связано
Слайд 29Пока большинство пероксисом остаются неподвижными у кортекса материнской клетки во время
Наследование пероксисом
Слайд 31Тельца Воронина
Тельца Воронина названы в честь русского миколога Михаил Степановича Воронина
На ультратонких срезах тельца Воронина выглядят как плотные осмиофильные сердцевины, окруженные одинарной мембраной.
Размер телец Воронина варьирует от 100 нм до 1 мкм; этот разброс видоспецифичен и всегда незначительно превышает внутренний диаметр септальной поры.
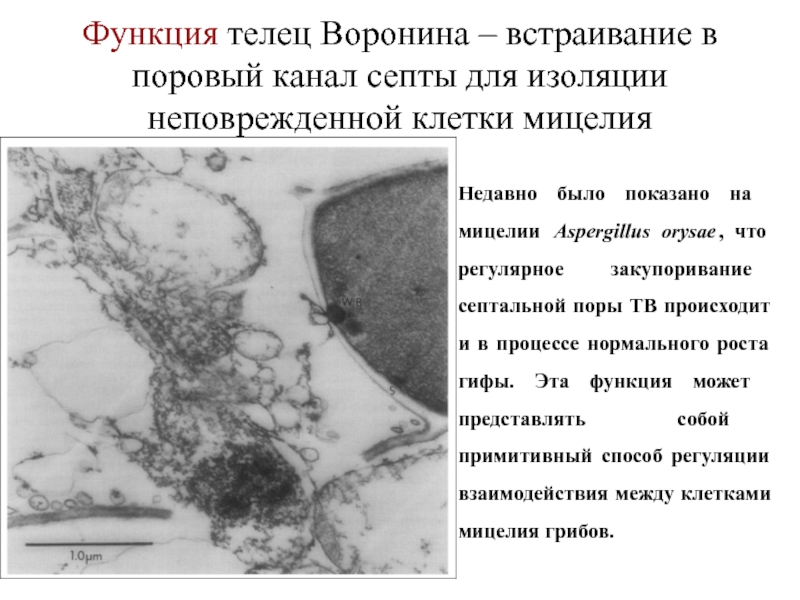
Слайд 32Функция телец Воронина – встраивание в поровый канал септы для изоляции
Недавно было показано на мицелии Aspergillus orysae, что регулярное закупоривание септальной поры ТВ происходит и в процессе нормального роста гифы. Эта функция может представлять собой примитивный способ регуляции взаимодействия между клетками мицелия грибов.
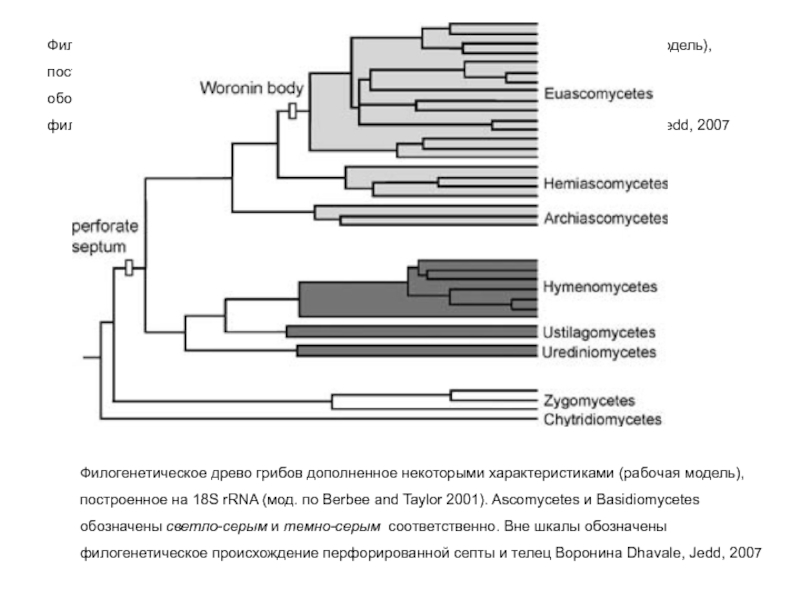
Слайд 33Филогенетическое древо грибов дополненное некоторыми характеристиками (рабочая модель), построенное на 18S
Филогенетическое древо грибов дополненное некоторыми характеристиками (рабочая модель), построенное на 18S rRNA (мод. по Berbee and Taylor 2001). Ascomycetes и Basidiomycetes обозначены светло-серым и темно-серым соответственно. Вне шкалы обозначены филогенетическое происхождение перфорированной септы и телец Воронина Dhavale, Jedd, 2007
Слайд 34
Тельца Воронина были впервые изолированы из N. crassa при использовании центрифугирования
Слайд 35Тельца Воронина в апексе гифы Aspergillus nidulans. Окрашивание с использованием антител
Слайд 36Микротельца Воронина в районе септы у гифы Aspergillus nidulans (размер от
Слайд 38Структура кристаллической решетки HEX-1
Очищенный рекомбинантный HEX-1 N. crassa спонтанно самособирается
Слайд 39Биогенез телец Воронина
Тельца Воронина обнаружены во всех вегетативных гифах и
Слайд 40Распределение телец Воронина в пяти образцах мицелия при прорастании конидий Aspergillus
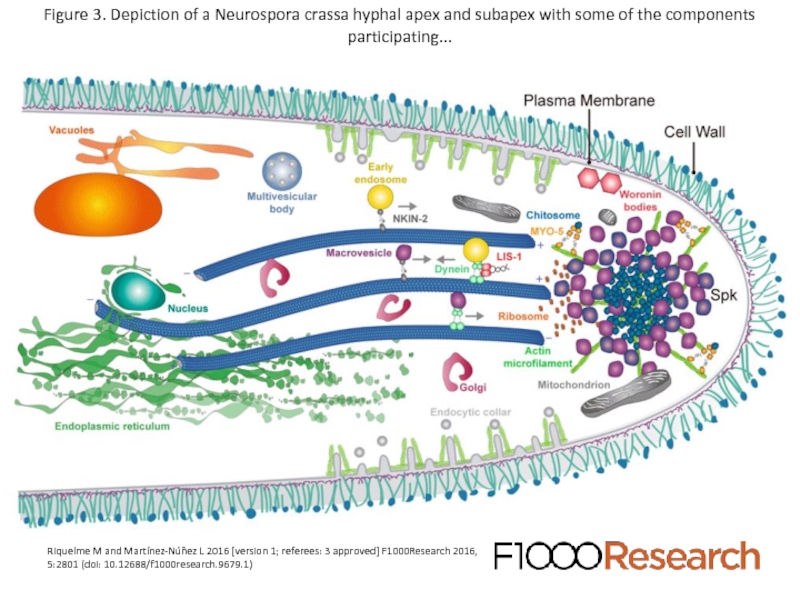
Слайд 42Figure 3. Depiction of a Neurospora crassa hyphal apex and subapex
Riquelme M and Martínez-Núñez L 2016 [version 1; referees: 3 approved] F1000Research 2016, 5:2801 (doi: 10.12688/f1000research.9679.1)