- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Перепрограммирование геномов дифференцированных клеток с использованием экзогенной экспрессии транскрипционных факторов презентация
Содержание
- 1. Перепрограммирование геномов дифференцированных клеток с использованием экзогенной экспрессии транскрипционных факторов
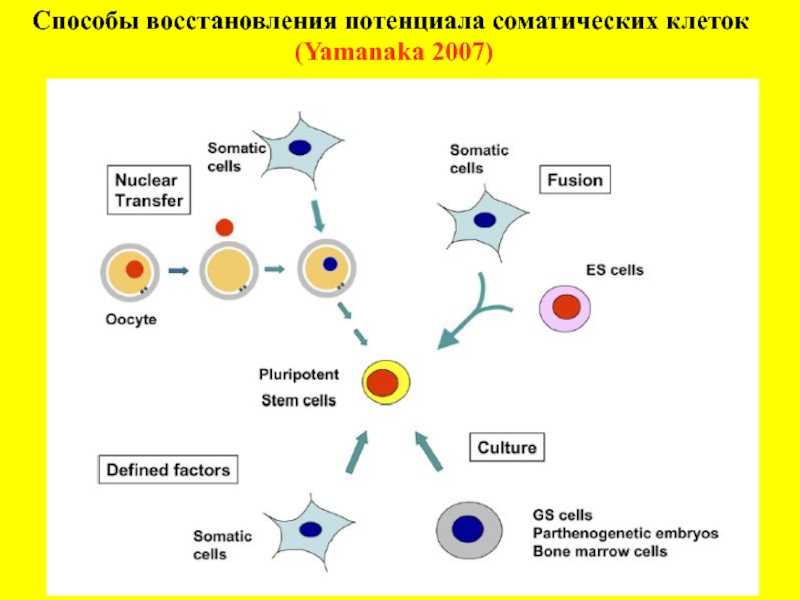
- 2. Способы восстановления потенциала соматических клеток (Yamanaka 2007)
- 3. Экспериментальные подходы восстановления потенций в клетках
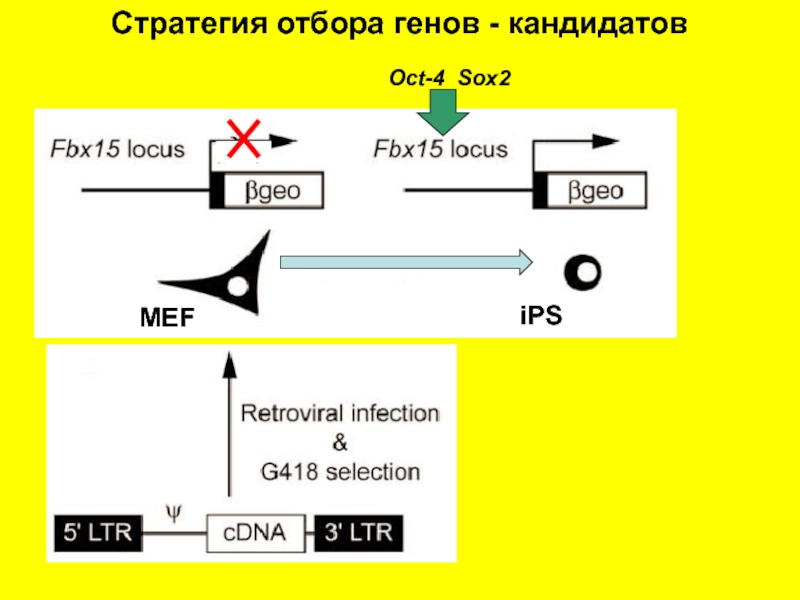
- 4. MEF iPS Oct-4 Sox2 Стратегия отбора генов - кандидатов
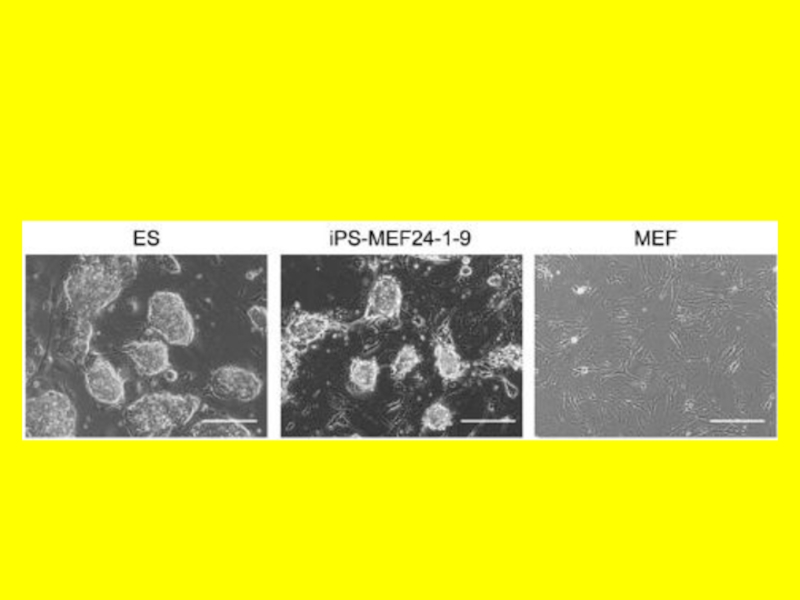
- 5. Визуализация клеточных колоний позитивных по экспрессии Oct4
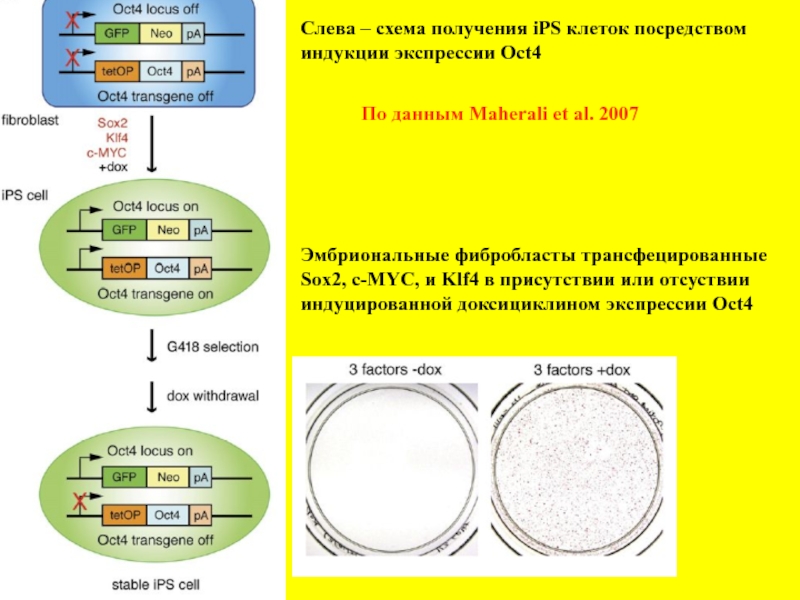
- 6. Слева – схема получения iPS клеток посредством
- 8. Динамика реактивации неактивной Х-хромосомы в iPS клетках
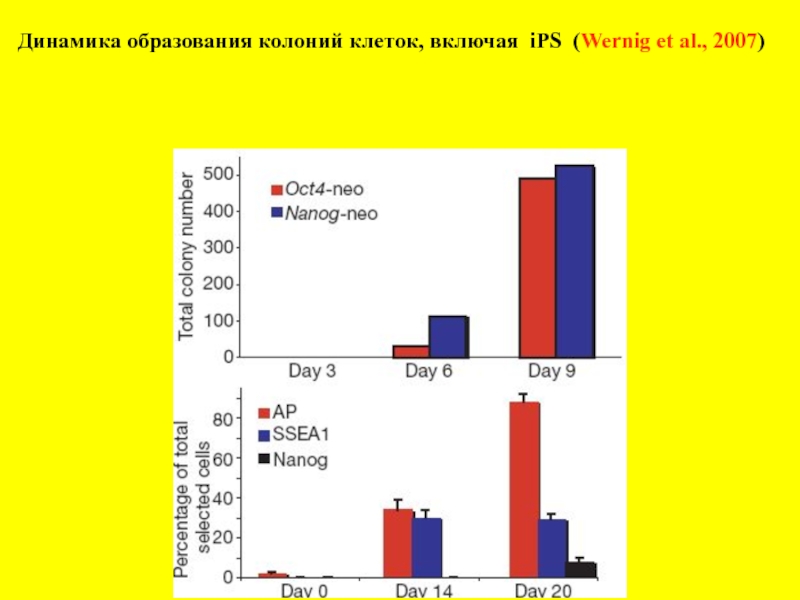
- 9. Динамика образования колоний клеток, включая iPS (Wernig et al., 2007)
- 10. Потенциал репрограммированных фибробластов (Werning et al. 2007)
- 11. Идентификация генотипов iPS среди потомков F1 в
- 12. Роль 4-х факторов в превращении фибробластов в
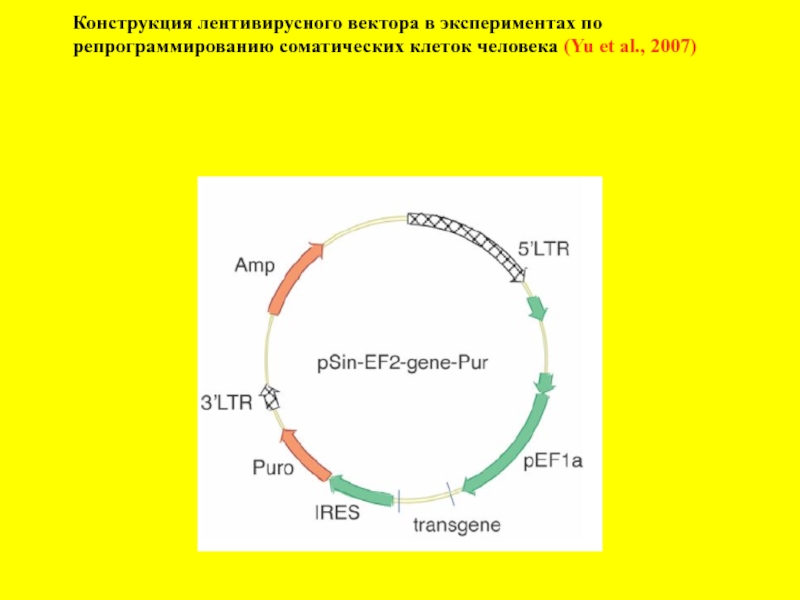
- 13. Конструкция лентивирусного вектора в экспериментах по
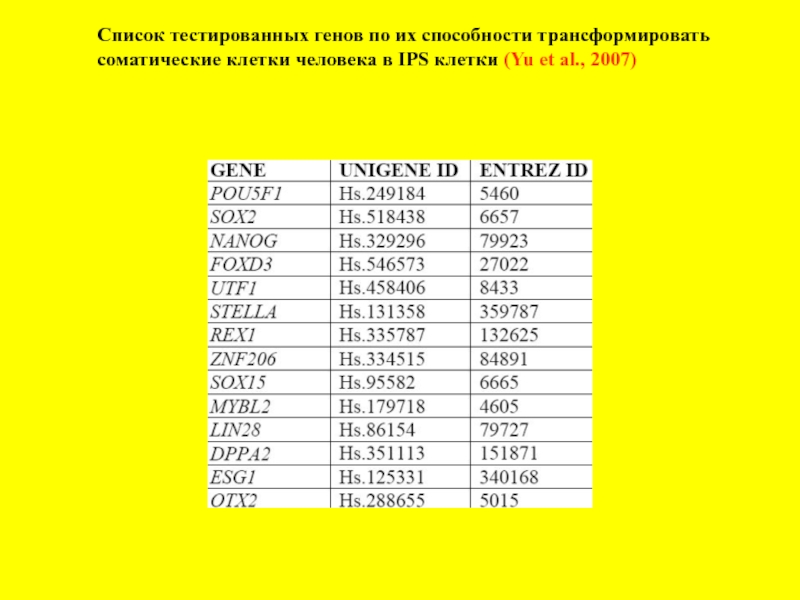
- 14. Список тестированных генов по их способности трансформировать
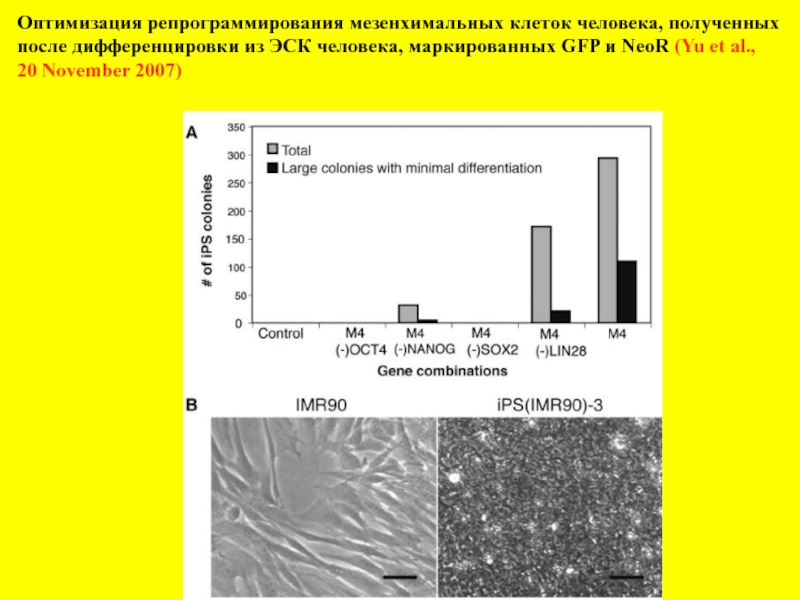
- 15. Оптимизация репрограммирования мезенхимальных клеток человека, полученных
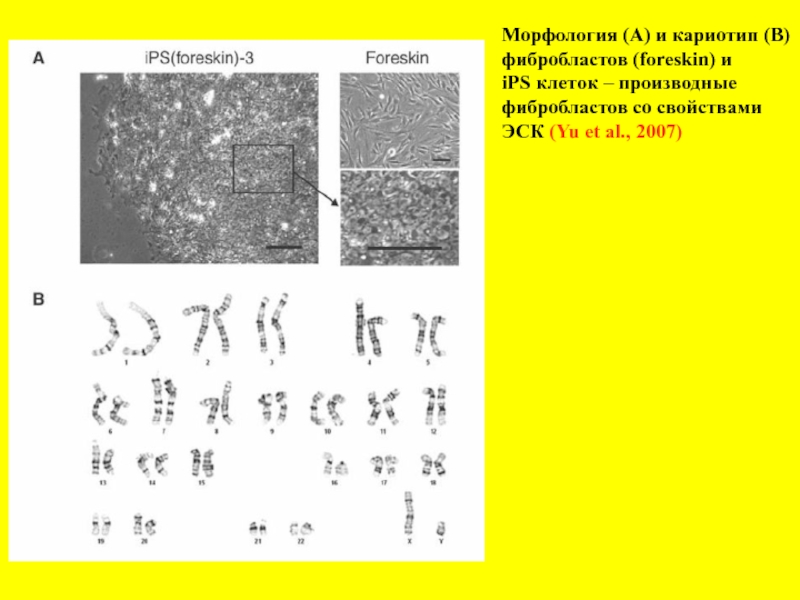
- 16. Морфология (А) и кариотип (В) фибробластов (foreskin)
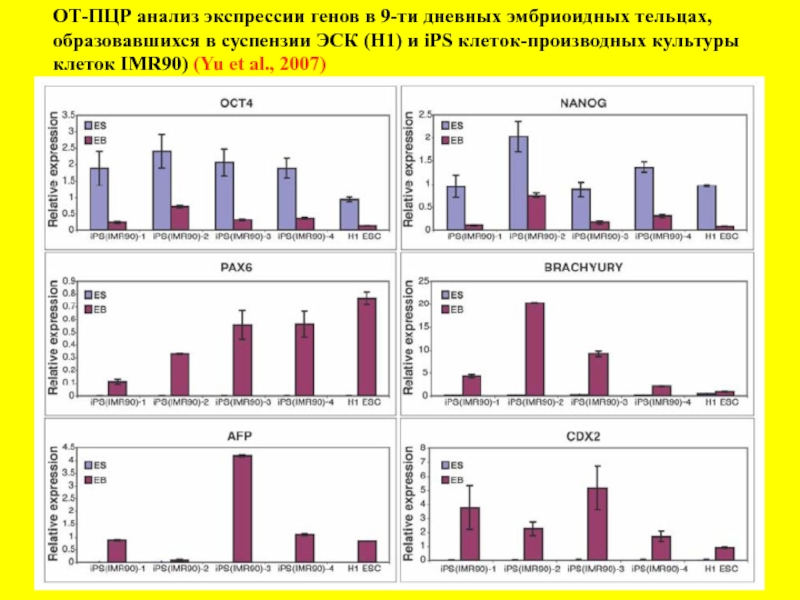
- 17. ОТ-ПЦР анализ экспрессии генов в 9-ти дневных
- 18. Профили метилирования промотора гена Oct4 в клетках
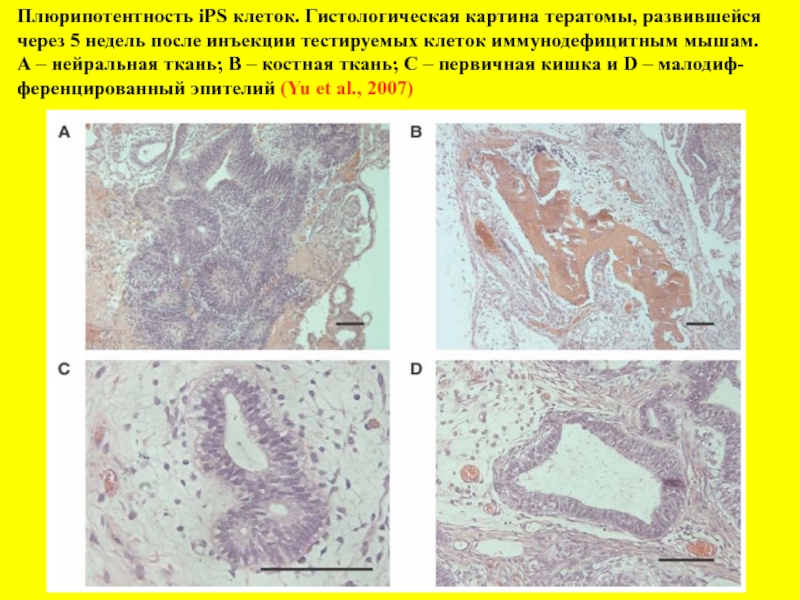
- 19. Плюрипотентность iPS клеток. Гистологическая картина тератомы, развившейся
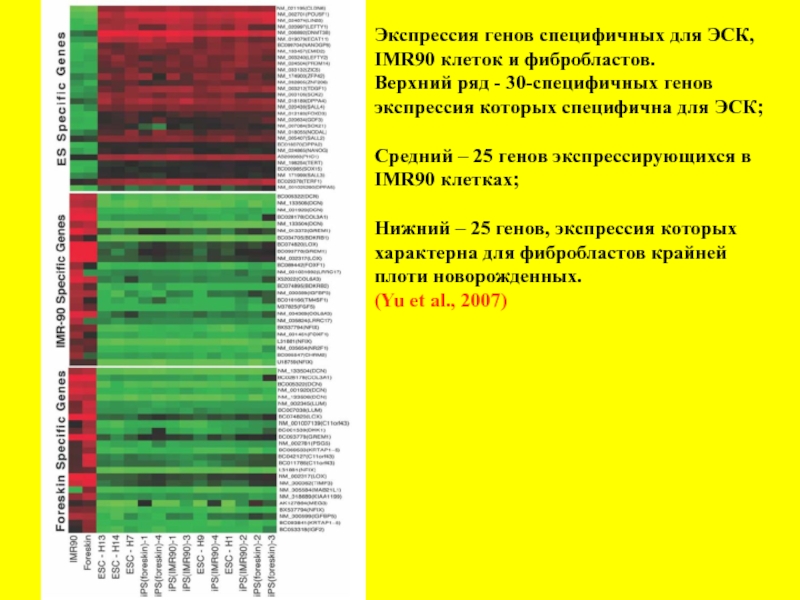
- 20. Экспрессия генов специфичных для ЭСК, IMR90 клеток
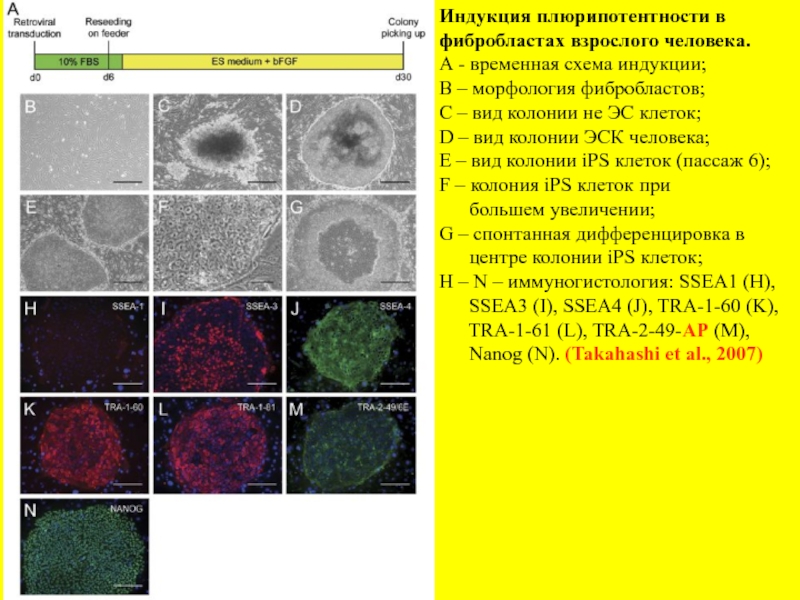
- 21. Индукция плюрипотентности в фибробластах взрослого человека.
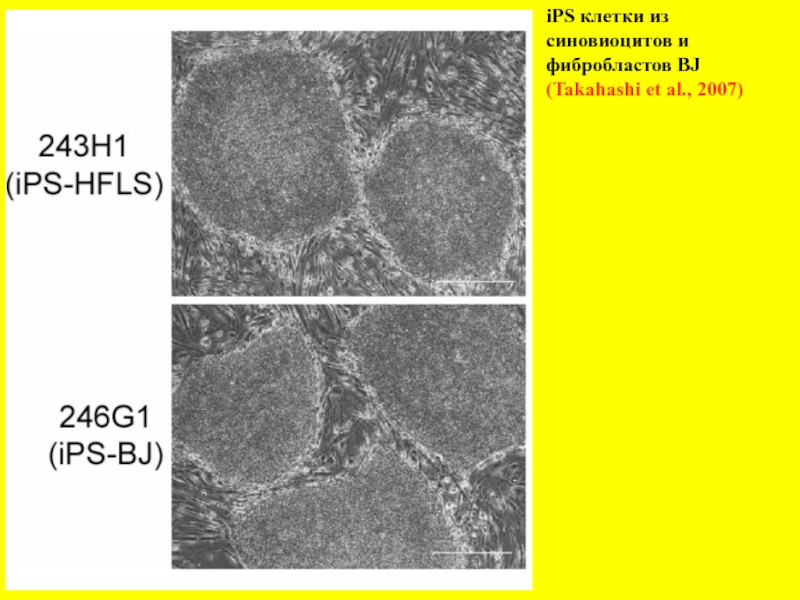
- 22. iPS клетки из синовиоцитов и фибробластов BJ (Takahashi et al., 2007)
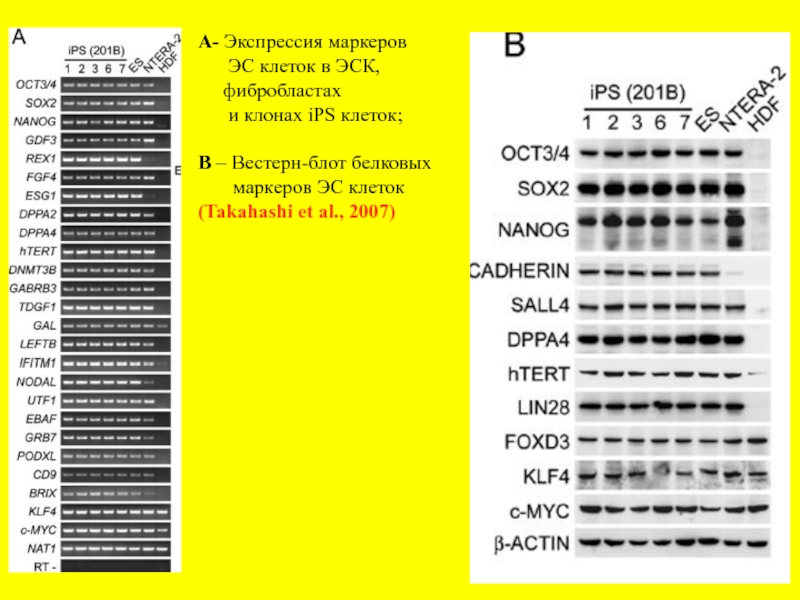
- 23. A- Экспрессия маркеров ЭС
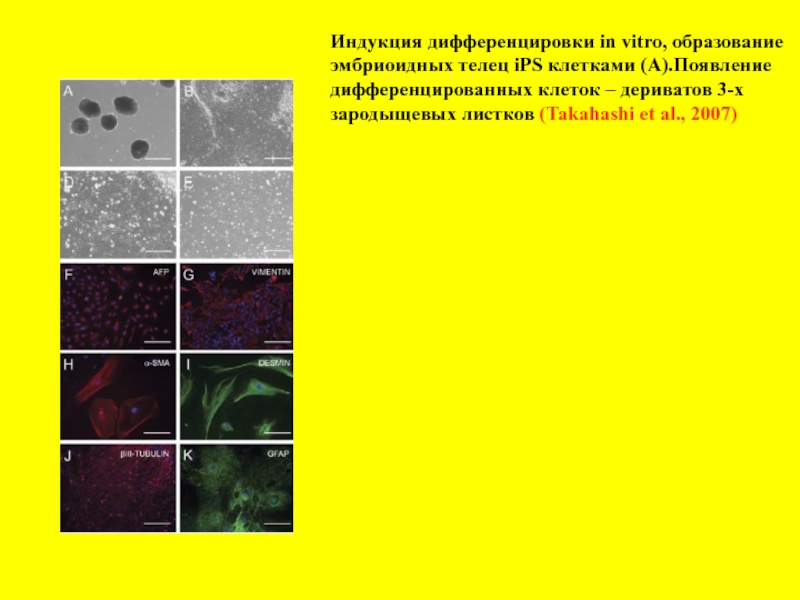
- 24. Индукция дифференцировки in vitro, образование эмбриоидных телец
- 25. Экспрессия генов-маркеров кардиомиоцитов в эмбриоидных тельцах трех клонов iPS клеток (Takahashi et al., 2007)
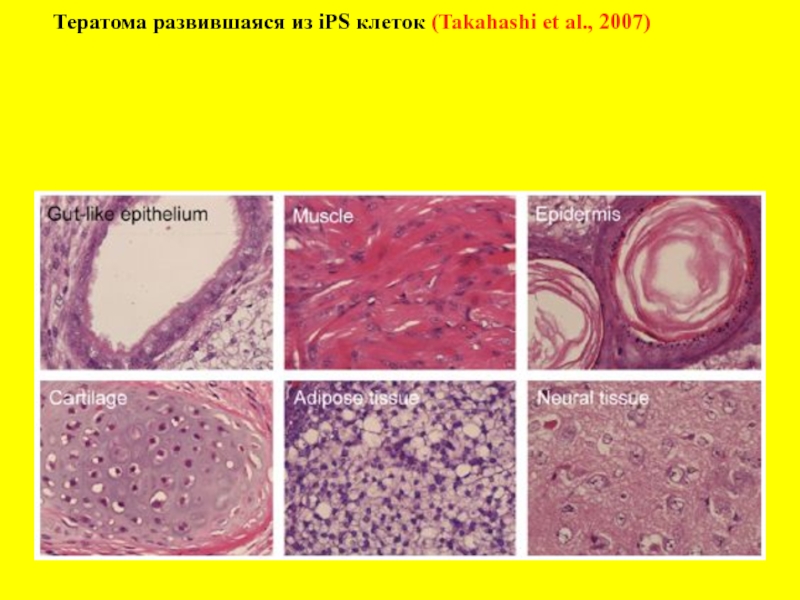
- 26. Тератома развившаяся из iPS клеток (Takahashi et al., 2007)
- 27. Характеристика экспрессии 32266 генов в фибробластах (HDF),
- 29. «Лабиринт к плюрипотентности» представляет транскрипционные и
Слайд 1Перепрограммирование геномов дифференцированных клеток
с использованием экзогенной экспрессии транскрипционных факторов
Слайд 3 Экспериментальные подходы восстановления потенций в клетках утративших их в процессе
Перенос ядер в энуклеированный ооцит или яйцеклетку – технология клонирования животных.
1952 – Briggs and King; 1997 - Wilmut et al., 1997;
Слияние эмбриональных стволовых клеток с дифференцированными – технология гибридных клеток.
1996 – Матвеева и др.
Трансфекция дифференцированных клеток векторами экспрессирующие транскрипционные факторы и факторы регулирующие пролиферацию.
2006 – Takahashi and Yamanaka
Слайд 6Слева – схема получения iPS клеток посредством
индукции экспрессии Oct4
Эмбриональные фибробласты трансфецированные
Sox2,
индуцированной доксициклином экспрессии Oct4
По данным Maherali et al. 2007
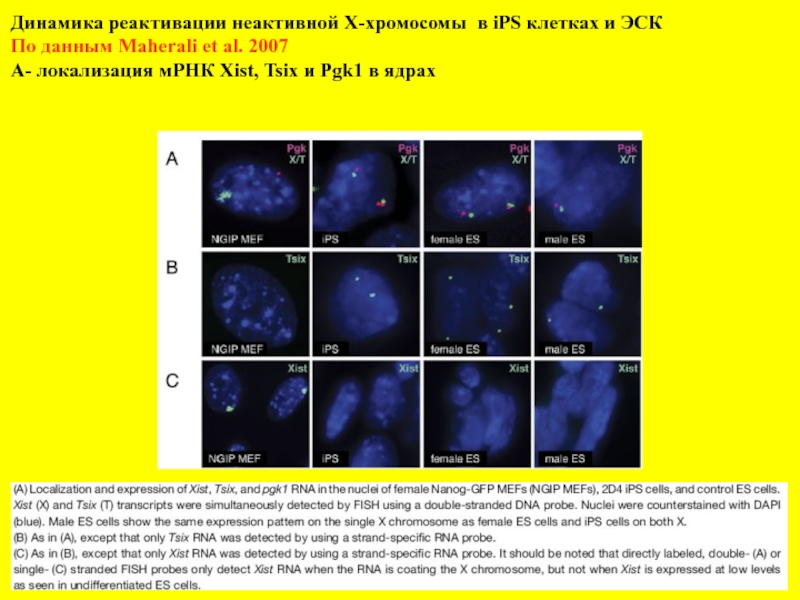
Слайд 8Динамика реактивации неактивной Х-хромосомы в iPS клетках и ЭСК
По данным
А- локализация мРНК Xist, Tsix и Pgk1 в ядрах
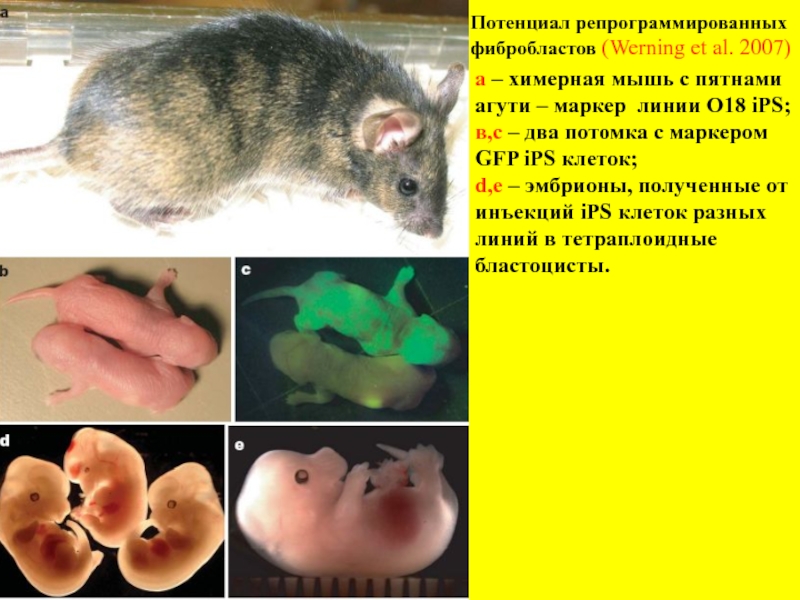
Слайд 10Потенциал репрограммированных
фибробластов (Werning et al. 2007)
а – химерная мышь с пятнами
агути – маркер линии O18 iPS;
в,с – два потомка с маркером
GFP iPS клеток;
d,e – эмбрионы, полученные от
инъекций iPS клеток разных
линий в тетраплоидные
бластоцисты.
Слайд 11Идентификация генотипов iPS среди потомков F1 в скрещиваниях
между химерными самцами
мышами C57BL.
Окраска потомков F2 в скрещивании iPS мышей с C57BL
(Okita et al., 2007)
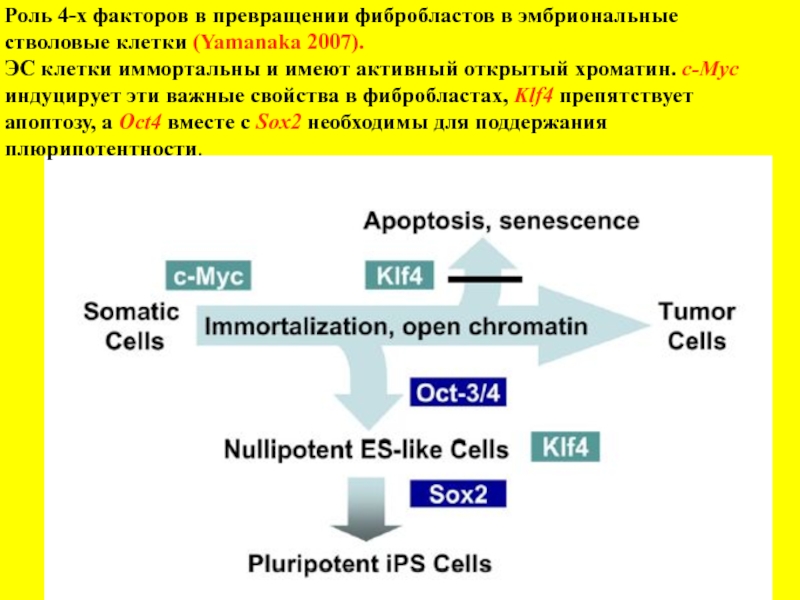
Слайд 12Роль 4-х факторов в превращении фибробластов в эмбриональные стволовые клетки (Yamanaka
ЭС клетки иммортальны и имеют активный открытый хроматин. с-Myc
индуцирует эти важные свойства в фибробластах, Klf4 препятствует апоптозу, а Oct4 вместе с Sox2 необходимы для поддержания плюрипотентности.
Слайд 13
Конструкция лентивирусного вектора в экспериментах по
репрограммированию соматических клеток человека (Yu
Слайд 14Список тестированных генов по их способности трансформировать
соматические клетки человека в
Слайд 15Оптимизация репрограммирования мезенхимальных клеток человека, полученных
после дифференцировки из ЭСК человека,
20 November 2007)
Слайд 16Морфология (А) и кариотип (В)
фибробластов (foreskin) и
iPS клеток – производные
фибробластов со свойствами
ЭСК (Yu et al., 2007)
Слайд 17ОТ-ПЦР анализ экспрессии генов в 9-ти дневных эмбриоидных тельцах,
образовавшихся в
клеток IMR90) (Yu et al., 2007)
Слайд 18Профили метилирования промотора гена Oct4 в клетках IMR90 (фетальные
фибробласты) ,
метилированные CpG-сайты, светлые неметилированные (Yu et al., 2007)
Слайд 19Плюрипотентность iPS клеток. Гистологическая картина тератомы, развившейся
через 5 недель после
А – нейральная ткань; В – костная ткань; С – первичная кишка и D – малодиф-
ференцированный эпителий (Yu et al., 2007)
Слайд 20Экспрессия генов специфичных для ЭСК,
IMR90 клеток и фибробластов.
Верхний ряд -
экспрессия которых специфична для ЭСК;
Средний – 25 генов экспрессирующихся в
IMR90 клетках;
Нижний – 25 генов, экспрессия которых
характерна для фибробластов крайней
плоти новорожденных.
(Yu et al., 2007)
Слайд 21Индукция плюрипотентности в
фибробластах взрослого человека.
А - временная схема индукции;
В –
С – вид колонии не ЭС клеток;
D – вид колонии ЭСК человека;
Е – вид колонии iPS клеток (пассаж 6);
F – колония iPS клеток при
большем увеличении;
G – спонтанная дифференцировка в
центре колонии iPS клеток;
Н – N – иммуногистология: SSEA1 (H),
SSEA3 (I), SSEA4 (J), TRA-1-60 (K),
TRA-1-61 (L), TRA-2-49-AP (M),
Nanog (N). (Takahashi et al., 2007)
Слайд 23A- Экспрессия маркеров
ЭС клеток в ЭСК,
и клонах iPS клеток;
В – Вестерн-блот белковых
маркеров ЭС клеток
(Takahashi et al., 2007)
Слайд 24Индукция дифференцировки in vitro, образование
эмбриоидных телец iPS клетками (А).Появление
дифференцированных клеток –
зародыщевых листков (Takahashi et al., 2007)
Слайд 25Экспрессия генов-маркеров
кардиомиоцитов в эмбриоидных
тельцах трех клонов iPS клеток
(Takahashi et al.,
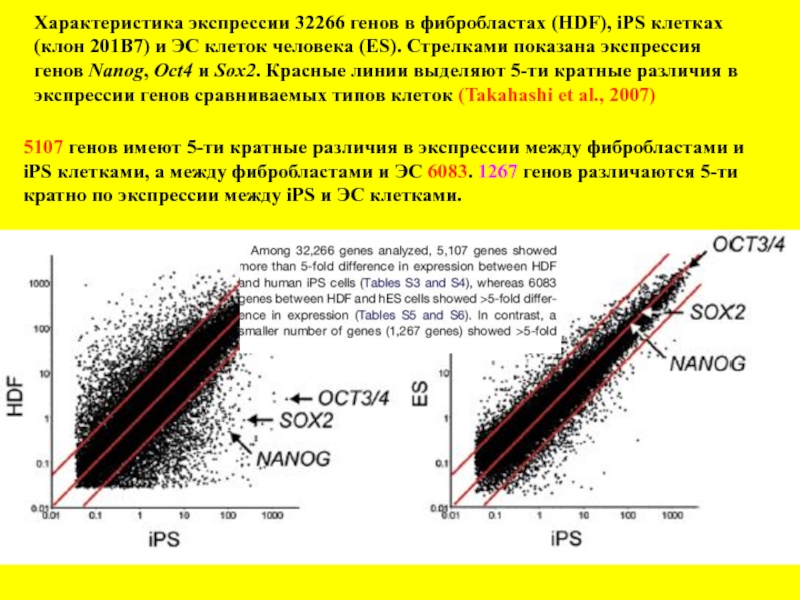
Слайд 27Характеристика экспрессии 32266 генов в фибробластах (HDF), iPS клетках
(клон 201В7)
генов Nanog, Oct4 и Sox2. Красные линии выделяют 5-ти кратные различия в
экспрессии генов сравниваемых типов клеток (Takahashi et al., 2007)
5107 генов имеют 5-ти кратные различия в экспрессии между фибробластами и
iPS клетками, а между фибробластами и ЭС 6083. 1267 генов различаются 5-ти
кратно по экспрессии между iPS и ЭС клетками.
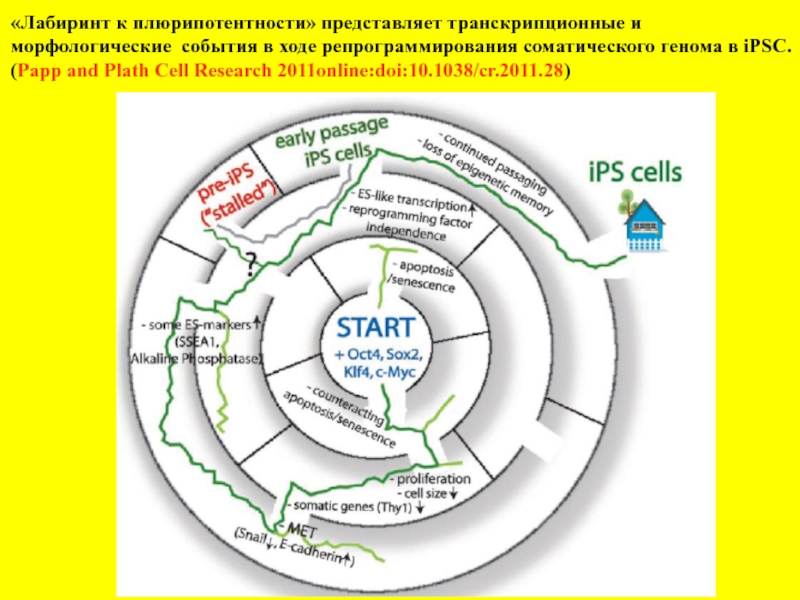
Слайд 29«Лабиринт к плюрипотентности» представляет транскрипционные и
морфологические события в ходе репрограммирования
(Papp and Plath Cell Research 2011online:doi:10.1038/cr.2011.28)