- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Оценка кислотно-щелочного равновесия и газов крови в практике интенсивной терапии презентация
Содержание
- 1. Оценка кислотно-щелочного равновесия и газов крови в практике интенсивной терапии
- 2. Артур К. Гайтон, Джон Э. Холл 2008
- 3. Артур К. Гайтон, Джон Э. Холл 2008
- 4. Артур К. Гайтон, Джон Э. Холл 2008
- 5. Артур К. Гайтон, Джон Э. Холл 2008
- 6. Артур К. Гайтон, Джон Э. Холл 2008
- 7. Артур К. Гайтон, Джон Э. Холл 2008
- 8. Артур К. Гайтон, Джон Э. Холл 2008
- 9. Артур К. Гайтон, Джон Э. Холл 2008
- 10. Артур К. Гайтон, Джон Э. Холл 2008
- 11. Артур К. Гайтон, Джон Э. Холл 2008
- 12. Артур К. Гайтон, Джон Э. Холл 2008
- 13. Артур К. Гайтон, Джон Э. Холл 2008
- 14. Артур К. Гайтон, Джон Э. Холл 2008
- 15. Артур К. Гайтон, Джон Э. Холл 2008
- 16. Артур К. Гайтон, Джон Э. Холл 2008
- 17. Артур К. Гайтон, Джон Э. Холл 2008
- 18. Артур К. Гайтон, Джон Э. Холл 2008
- 19. Артур К. Гайтон, Джон Э. Холл 2008
- 20. Артур К. Гайтон, Джон Э. Холл 2008
- 21. Артур К. Гайтон, Джон Э. Холл 2008
Слайд 1Оценка кислотно-щелочного равновесия и газов крови в практике интенсивной терапии
Кафедра онкологии
Электив «Значение исследований крови в клинической практике»
д.м.н., профессор Е.А.Спиридонова
д.м.н., профессор С.А.Румянцев
Слайд 2Артур К. Гайтон, Джон Э. Холл 2008 г
Концентрация ионов водорода и
в различных биологических жидкостях
Слайд 3Артур К. Гайтон, Джон Э. Холл 2008 г
Механизмы, препятствующие изменению
концентрации
Роль буферных систем, легких и почек.
Существуют три основных системы, деятельность которых направлена на регуляцию содержания ионов H⁺ в жидких средах, препятствующих возникновению ацидоза или алкалоза: ( 1 ) буферные системы жидких сред организма, которые немедленно вступают в химическую реакцию с кислотой или щелочью, предотвращая изменения содержания ионов H⁺; ( 2 ) системы дыхания, дыхательный центр которой регулирует выведение CO2 легкими ( следовательно, H2CO3 ) из внеклеточной
жидкости; ( 3 ) почки, которые способны выделять
кислую или щелочную мочу, компенсируя таким образом состояние развившегося ацидоза или алкалоза.
Слайд 4Артур К. Гайтон, Джон Э. Холл 2008 г
Буферизация ионов водорода в
средах организма
Буфер + H⁺
H Буфер
Слайд 5Артур К. Гайтон, Джон Э. Холл 2008 г
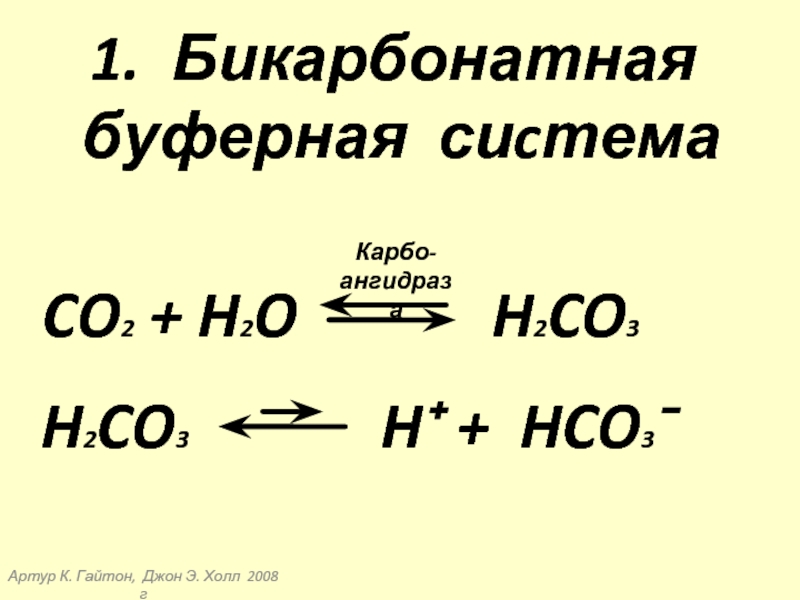
1. Бикарбонатная
буферная сиcтема
CO2
Карбо-
ангидраза
H2CO3
H2CO3
H⁺ + HCO3⁻
Слайд 6Артур К. Гайтон, Джон Э. Холл 2008 г
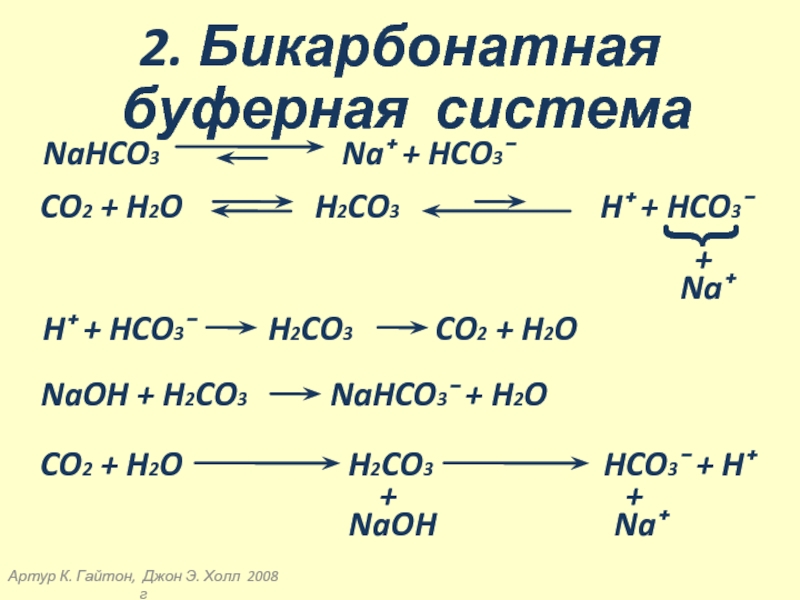
2. Бикарбонатная
буферная система
NaHCO3
Na⁺ + HCO3⁻
CO2 + H2O
H2CO3
H⁺ + HCO3⁻
}
+
Na⁺
H⁺ + HCO3⁻
H2CO3
CO2 + H2O
NaOH + H2CO3
NaHCO3⁻ + H2O
CO2 + H2O
H2CO3
HCO3⁻ + H⁺
+
+
NaOH
Na⁺
Слайд 7Артур К. Гайтон, Джон Э. Холл 2008 г
Количественная оценка свойств
бикарбонатной
Н2СO3
H⁺ + HCO3⁻
K̒ =
H⁺ X HCO3⁻
Н2СO3
(1)
H⁺ = K̒X
H2CO3
HCO3⁻
(2)
H⁺ = K X
CO2
HCO3⁻
(3)
H⁺ = K X
HCO3⁻
( 0,03 X Pco2)
(4)
Слайд 8Артур К. Гайтон, Джон Э. Холл 2008 г
Уравнение Гендерсона - Хассельбаха
pK = – logK
– logH⁺ = – logpK – log
( 0,03 x Pco2 )
HCO3⁻
pH = pK – log
( 0,03 x Pco2 )
HCO3⁻
pH = pK + log
( 0,03 x Pco2 )
HCO3⁻
pH = 6,1 + log
0,03 x Pco2
HCO3⁻
Слайд 9Артур К. Гайтон, Джон Э. Холл 2008 г
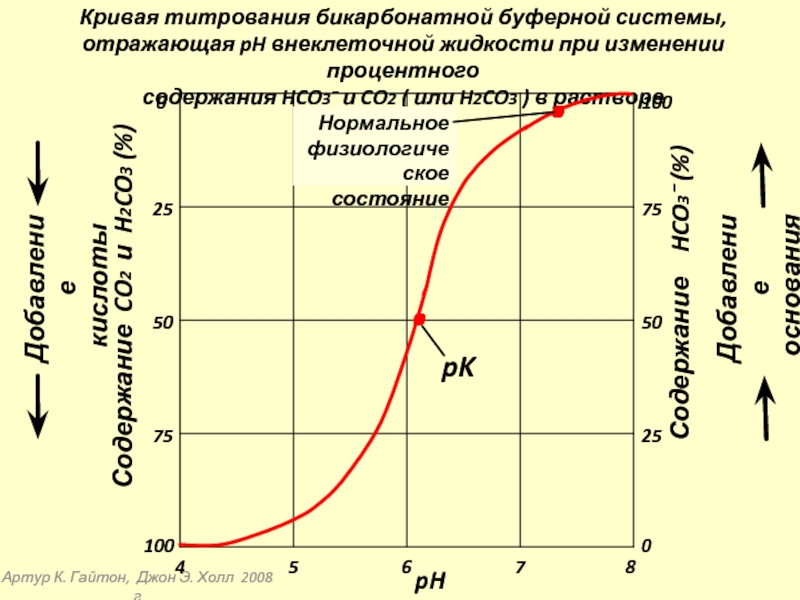
Кривая титрования бикарбонатной буферной
отражающая pH внеклеточной жидкости при изменении процентного
содержания HCO3⁻ и CO2 ( или H2CO3 ) в растворе
4
5
6
7
8
Добавление
кислоты
Добавление
основания
Содержание CO2 и H2CO3 (%)
Содержание HCO3⁻ (%)
75
50
25
0
100
pH
.
.
Нормальное
физиологическое
состояние
pK
100
75
50
25
0
Слайд 10Артур К. Гайтон, Джон Э. Холл 2008 г
Фосфатная буферная
система
HCl + Na2HPO4
NaH2PO4 + NaCl
NaOH + NaH2PO4
Na2HPO4 + H2O
Слайд 11Артур К. Гайтон, Джон Э. Холл 2008 г
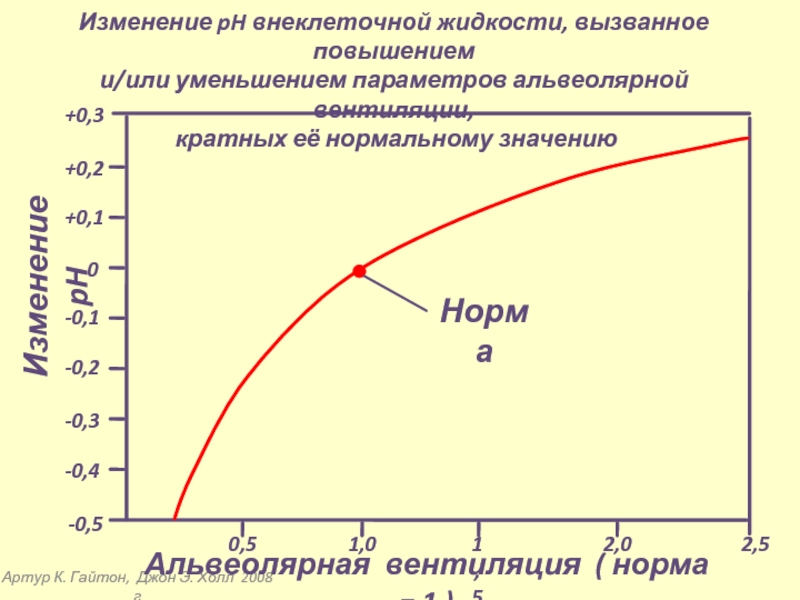
Изменение pH внеклеточной жидкости,
и/или уменьшением параметров альвеолярной вентиляции,
кратных её нормальному значению
0,5
1,0
1,5
2,0
2,5
Альвеолярная вентиляция ( норма = 1 )
-0,5
-0,4
-0,3
-0,2
-0,1
0
+0,1
+0,2
+0,3
Норма
Изменение pH
Слайд 12Артур К. Гайтон, Джон Э. Холл 2008 г
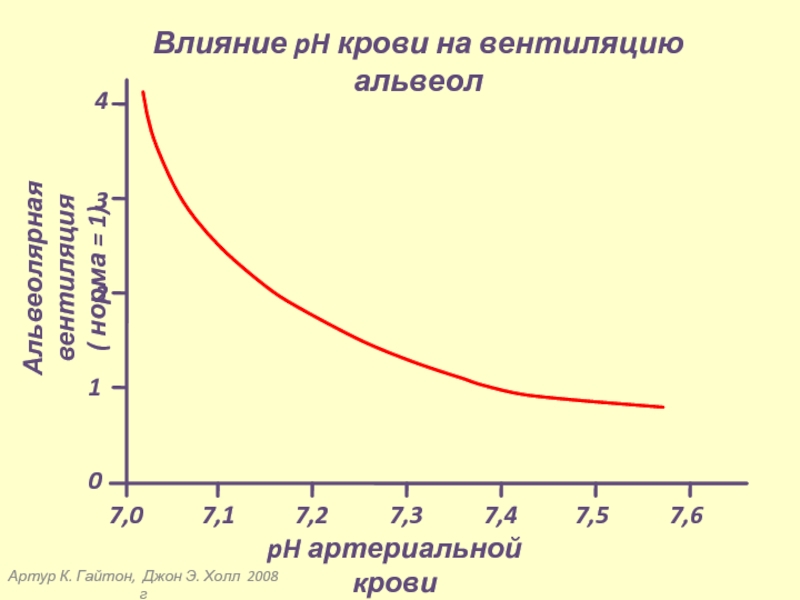
Влияние pH крови на
Альвеолярная вентиляция
( норма = 1)
pH артериальной крови
7,0
7,1
7,2
7,3
7,4
7,5
7,6
0
1
2
3
4
Слайд 13Артур К. Гайтон, Джон Э. Холл 2008 г
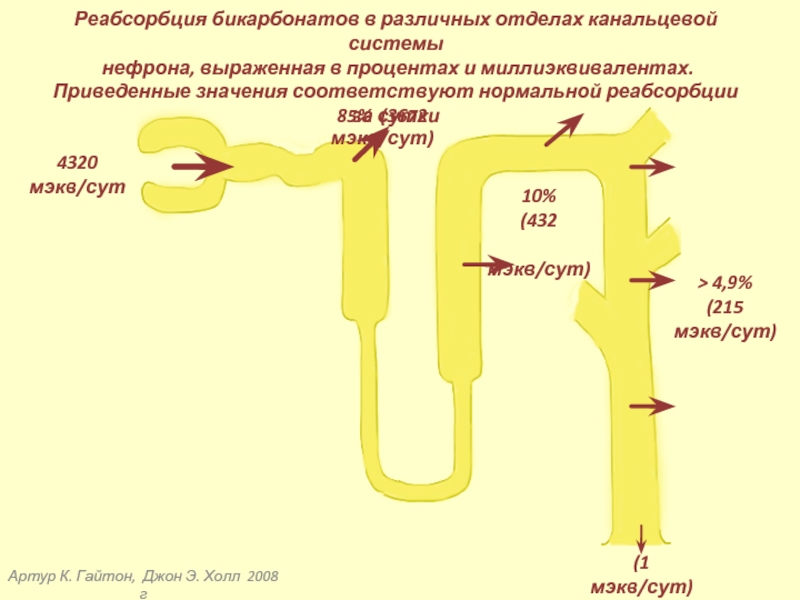
Реабсорбция бикарбонатов в различных
нефрона, выраженная в процентах и миллиэквивалентах.
Приведенные значения соответствуют нормальной реабсорбции за сутки
4320 мэкв/сут
85% (3672 мэкв/сут)
10%
(432
мэкв/сут)
> 4,9%
(215 мэкв/сут)
(1 мэкв/сут)
Слайд 14Артур К. Гайтон, Джон Э. Холл 2008 г
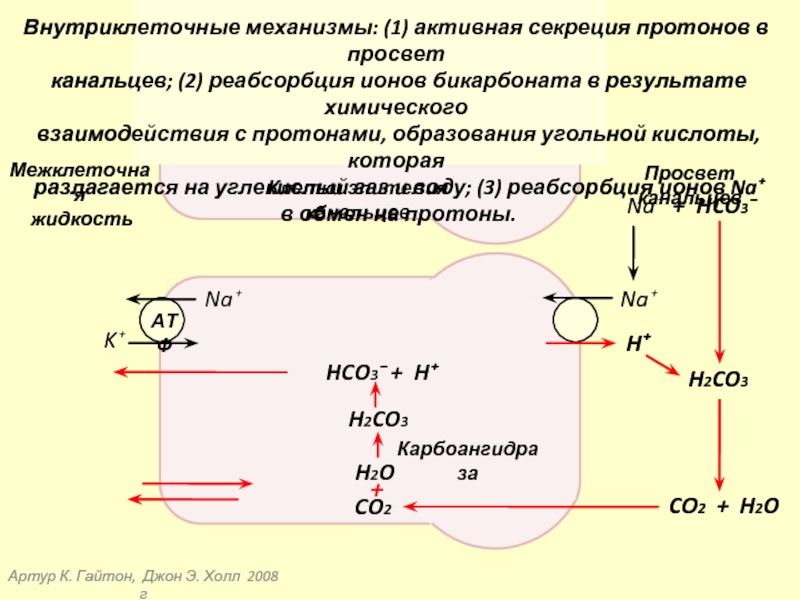
Клетки эпителия канальцев
Межклеточная
жидкость
Просвет
АТФ
Na⁺
K⁺
HCO3⁻ + H⁺
H2CO3
H2O
CO2
+
Карбоангидраза
Na⁺ + HCO3⁻
Na⁺
H⁺
H2CO3
CO2 + H2O
Внутриклеточные механизмы: (1) активная секреция протонов в просвет
канальцев; (2) реабсорбция ионов бикарбоната в результате химического
взаимодействия с протонами, образования угольной кислоты, которая
разлагается на углекислый газ и воду; (3) реабсорбция ионов Na⁺
в обмен на протоны.
Слайд 15Артур К. Гайтон, Джон Э. Холл 2008 г
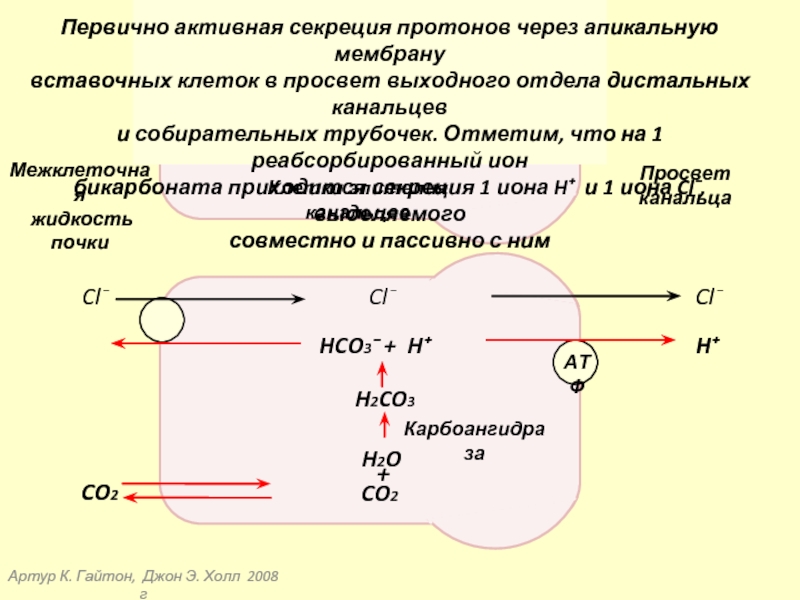
Клетки эпителия канальцев
Межклеточная
жидкость
почки
Просвет
Cl⁻
HCO3⁻ + H⁺
H2CO3
H2O
CO2
+
Карбоангидраза
H⁺
Первично активная секреция протонов через апикальную мембрану
вставочных клеток в просвет выходного отдела дистальных канальцев
и собирательных трубочек. Отметим, что на 1 реабсорбированный ион
бикарбоната приходится секреция 1 иона H⁺ и 1 иона Cl⁻, выделяемого
совместно и пассивно с ним
CO2
Cl⁻
Cl⁻
АТФ
Слайд 16Артур К. Гайтон, Джон Э. Холл 2008 г
Клетки эпителия канальцев
Межклеточная
жидкость
почки
Просвет
АТФ
Na⁺
K⁺
HCO3⁻ + H⁺
H2CO3
H2O
CO2
+
Карбоангидраза
Na⁺ + NaHPO4⁻
Na⁺
H⁺ + NaHPO4⁻
NaH2PO4
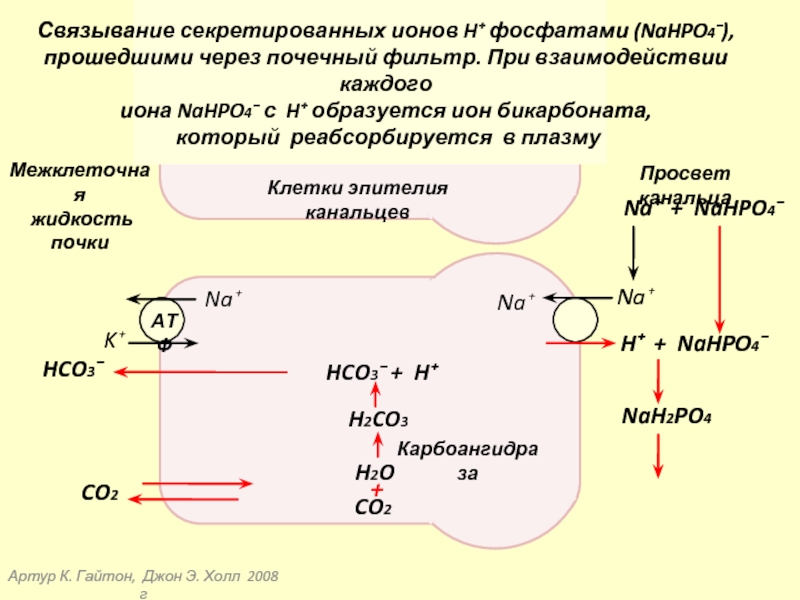
Связывание секретированных ионов H⁺ фосфатами (NaHPO4⁻),
прошедшими через почечный фильтр. При взаимодействии каждого
иона NaHPO4⁻ с H⁺ образуется ион бикарбоната,
который реабсорбируется в плазму
HCO3⁻
CO2
Na⁺
Слайд 17Артур К. Гайтон, Джон Э. Холл 2008 г
Клетки проксимального канальца
Межклеточная
жидкость
почки
Просвет
Na⁺
Na⁺
NH4⁺ + Cl⁻
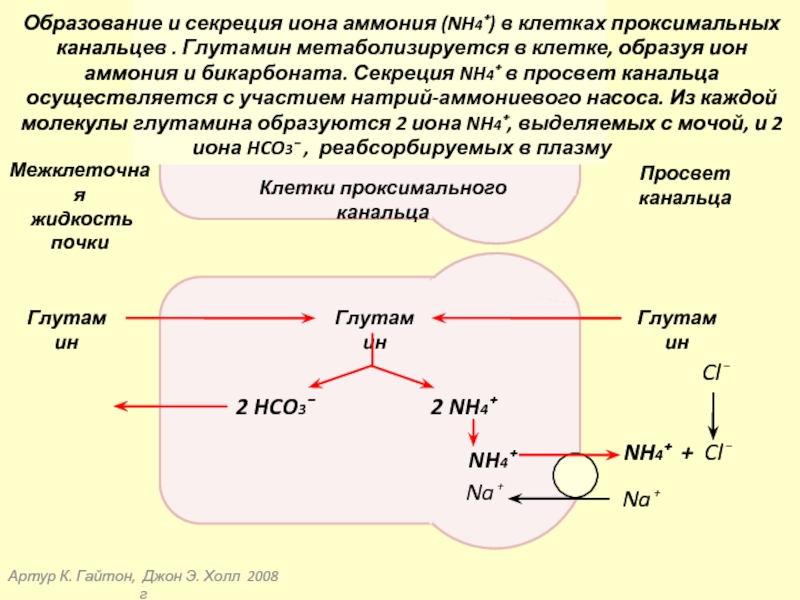
Образование и секреция иона аммония (NH4⁺) в клетках проксимальных канальцев . Глутамин метаболизируется в клетке, образуя ион аммония и бикарбоната. Секреция NH4⁺ в просвет канальца осуществляется с участием натрий-аммониевого насоса. Из каждой молекулы глутамина образуются 2 иона NH4⁺, выделяемых с мочой, и 2 иона HCO3⁻ , реабсорбируемых в плазму
Cl⁻
Глутамин
Глутамин
Глутамин
2 NH4⁺
2 HCO3⁻
NH4⁺
Слайд 18Артур К. Гайтон, Джон Э. Холл 2008 г
Клетки собирательной трубочки
Межклеточная
жидкость
почки
Просвет
АТФ
Na⁺
K⁺
HCO3⁻ + H⁺
H2CO3
H2O
CO2
+
Карбоангидраза
NH3
H⁺
NH4⁺ + Cl⁻
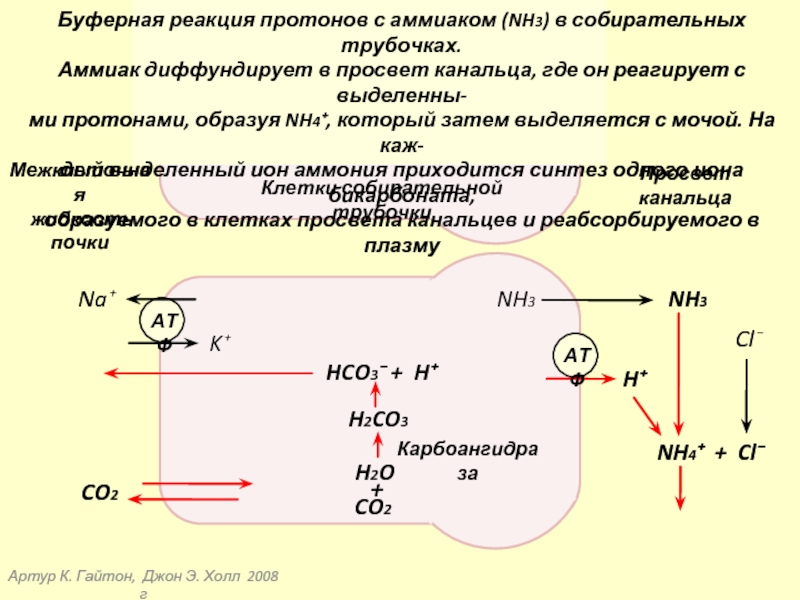
Буферная реакция протонов с аммиаком (NH3) в собирательных трубочках.
Аммиак диффундирует в просвет канальца, где он реагирует с выделенны-
ми протонами, образуя NH4⁺, который затем выделяется с мочой. На каж-
дый выделенный ион аммония приходится синтез одного иона бикарбоната,
образуемого в клетках просвета канальцев и реабсорбируемого в плазму
CO2
NH3
АТФ
Cl⁻
Слайд 19Артур К. Гайтон, Джон Э. Холл 2008 г
Факторы, влияющие на секрецию
и реабсорбцию бикарбонатов в почечных канальцах
Слайд 20Артур К. Гайтон, Джон Э. Холл 2008 г
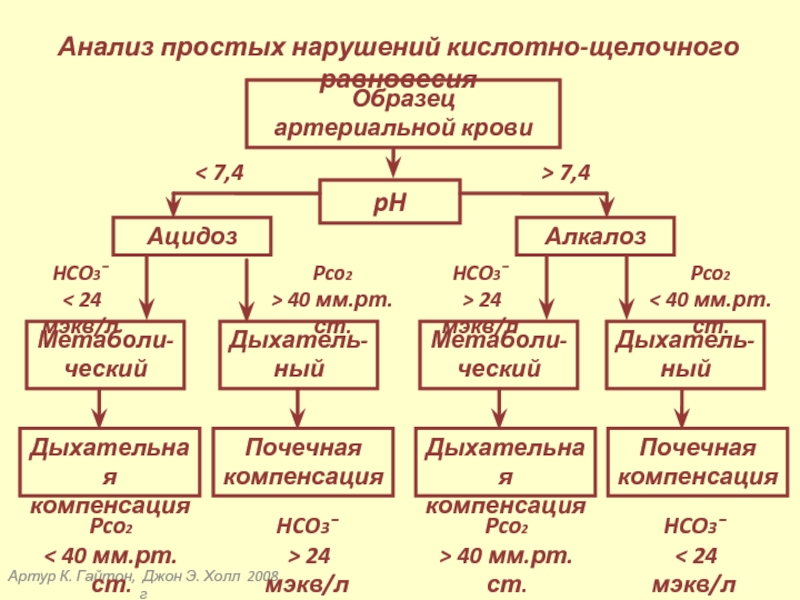
pH
Образец
артериальной крови
Ацидоз
Алкалоз
Метаболи-ческий
Дыхатель-ный
Дыхательная
компенсация
Почечная
компенсация
Анализ
< 7,4
> 7,4
Метаболи-ческий
Дыхатель-ный
HCO3⁻
< 24 мэкв/л
HCO3⁻
> 24 мэкв/л
Pco2
> 40 мм.рт.ст.
Pco2
< 40 мм.рт.ст.
Дыхательная
компенсация
Почечная
компенсация
Pco2
< 40 мм.рт.ст.
HCO3⁻
> 24 мэкв/л
Pco2
> 40 мм.рт.ст.
HCO3⁻
< 24 мэкв/л
Слайд 21Артур К. Гайтон, Джон Э. Холл 2008 г
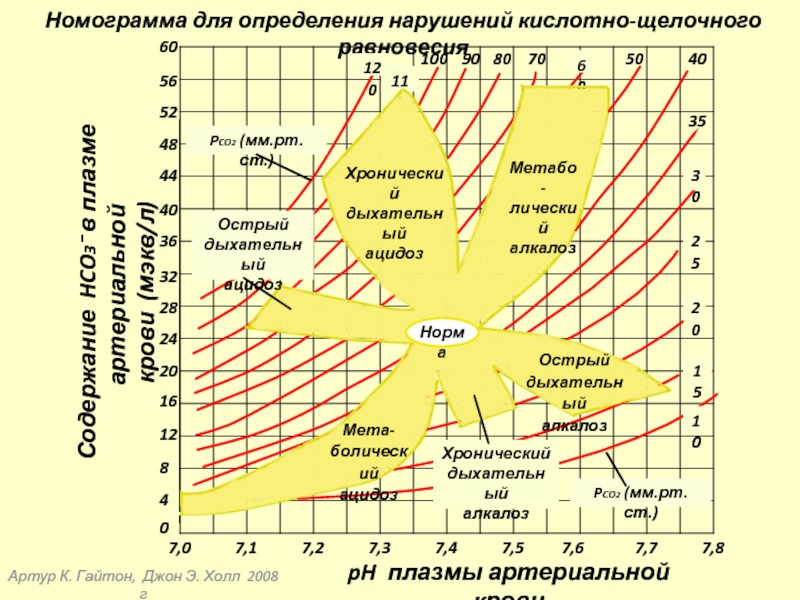
Номограмма для определения нарушений
7,0
0
7,2
7,3
7,4
7,5
7,6
7,7
7,8
7,1
4
8
12
16
20
24
28
32
36
40
44
48
52
56
60
35
40
50
70
80
90
100
10
15
20
25
30
110
120
60
Хронический
дыхательный
ацидоз
Метабо-
лический
алкалоз
Мета-
болический
ацидоз
Острый
дыхательный
алкалоз
Хронический
дыхательный
алкалоз
Острый
дыхательный
ацидоз
Норма
PCO2 (мм.рт.ст.)
PCO2 (мм.рт.ст.)
pH плазмы артериальной крови
Содержание HCO3⁻ в плазме артериальной
крови (мэкв/л)