- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Обмен белков. Использование аминокислот в организме человека презентация
Содержание
- 1. Обмен белков. Использование аминокислот в организме человека
- 3. Судьба всосавшихся аминокислот 1) используются на биосинтез
- 4. Синтез креатина Состоит из 2 стадий, используются
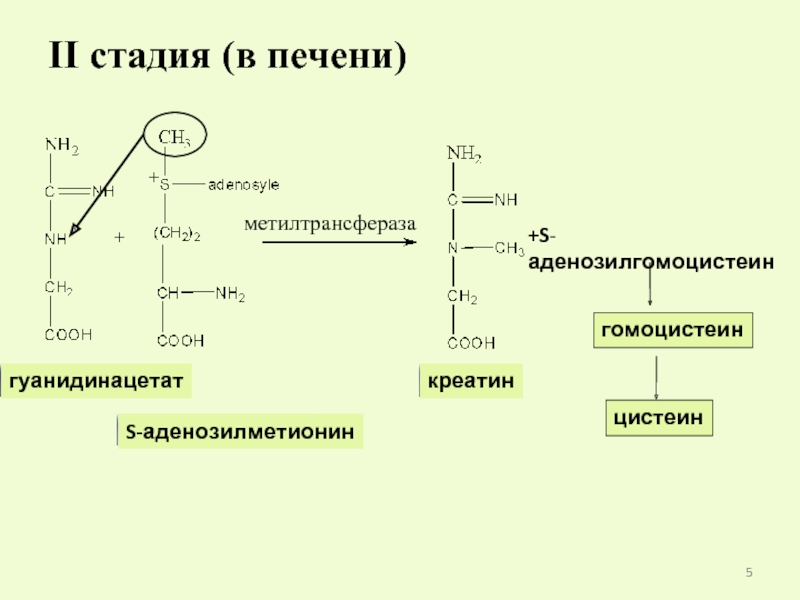
- 5. II стадия (в печени) метилтрансфераза +S- аденозилгомоцистеин гомоцистеин цистеин
- 6. SАМ- S-аденозилметионин
- 7. SАМ - S-аденозилметионин Это
- 8. Синтез креатина Миоциты скелетных мышц получают АТФ
- 9. Биологическая роль креатина В мышечной ткани, серд.
- 10. фосфокреатин Относится к группе фосфагенов – соединений,
- 11. фосфокреатин Рн КФК Выводится с
- 12. Содержание креатина В плазме крови 15,25 –
- 13. Повышение креатина наблюдается при параличах, мышечных
- 14. В норме креатин выделяется с мочой у
- 15. Креатинин является беспороговым веществом, т.е. он
- 16. ГОМОЦИСТЕИН В процессе синтеза
- 17. ГОМОЦИСТЕИН Повышение ГЦ вызывает повреждение стенки
- 18. ГОМОЦИСТЕИН
- 21. Повышение гомоцистеина
- 22. Превращения аминокислот в тканях 1) Дезаминирование 2)
- 23. Окислительное дезаминирование В тканях при физиологическом рН
- 24. Это прямое окислительное дезаминирование глутамата При рН
- 25. Непрямое дезаминирование 1) Трансаминирование 2) Окислительное дезаминирование глутамата Трансаминирование аминотранс- фераза B6
- 26. АМИНОТРАНСФЕРАЗЫ ОБЛАДАЮТ СУБСТРАТНОЙ СПЕЦИФИЧНОСТЬЮ глутамат
- 27. Активность АЛТ – 0,1 – 0,68 мкмоль/мл.ч
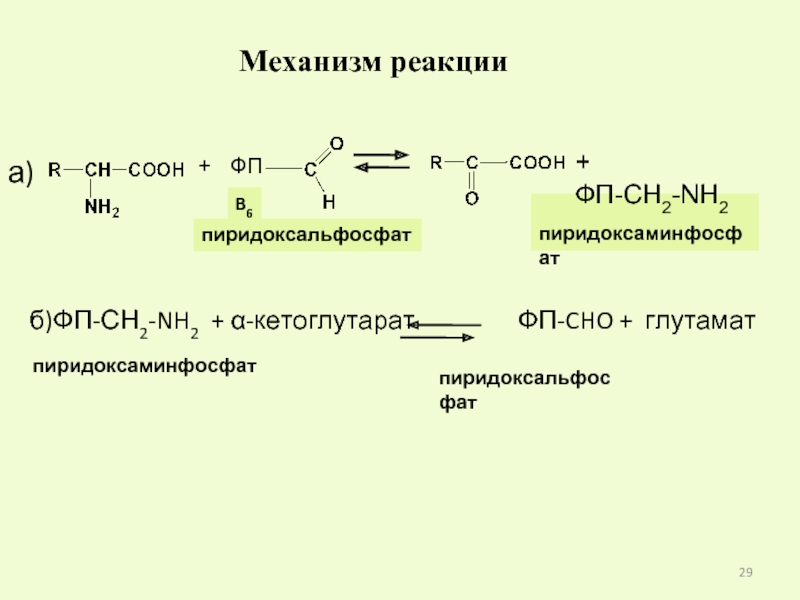
- 29. б)ФП-СН2-NH2 + α-кетоглутарат
- 30. Диагностическое значение аминотрансфераз Повышение активности АЛТ наблюдается
- 31. Биологическая роль трансаминирования 1) Синтез заменимых аминокислот
- 32. Источники аммиака 1)Дезаминирование аминокислот (в тканях и
- 34. 3. Накопление иона
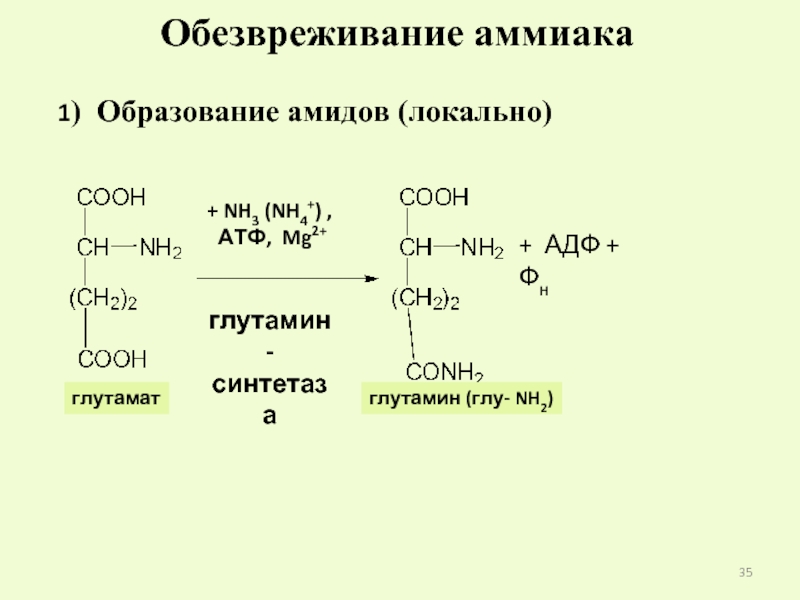
- 35. Обезвреживание аммиака 1) Образование амидов (локально) +
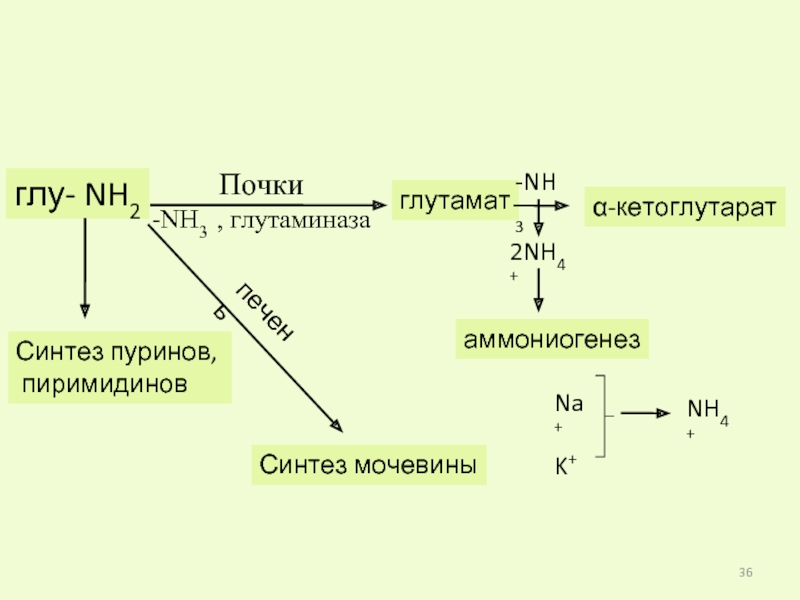
- 36. глу- NH2 Синтез пуринов, пиримидинов
- 37. 2) восстановительное аминирование 3) образование аммонийных
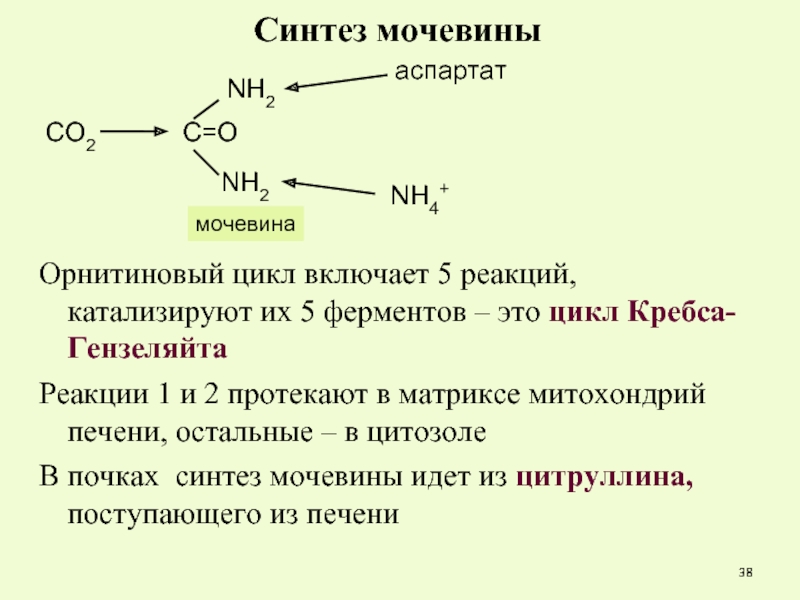
- 38. Синтез мочевины Орнитиновый цикл включает 5
- 39. NH4+ + CO2 + 2АТФ + Н2О
- 40. цитруллин аспартат -Н2О, АТФ
- 41. фумарат ЦТК аргининосукцинат-лиаза аргинин аргининсукцинат + Н2О аргиназа 4 5 мочевина орнитин аргинин
- 42. Связь синтеза мочевины с ЦТК Источником СО2
- 43. Суммарное уравнение синтеза мочевины На синтез 1
- 44. Нарушения цикла мочевины Известно 5 наследственных заболеваний,
- 45. Декарбоксилирование аминокислот В тканях преобладает α-декарбоксилирование, катализируют
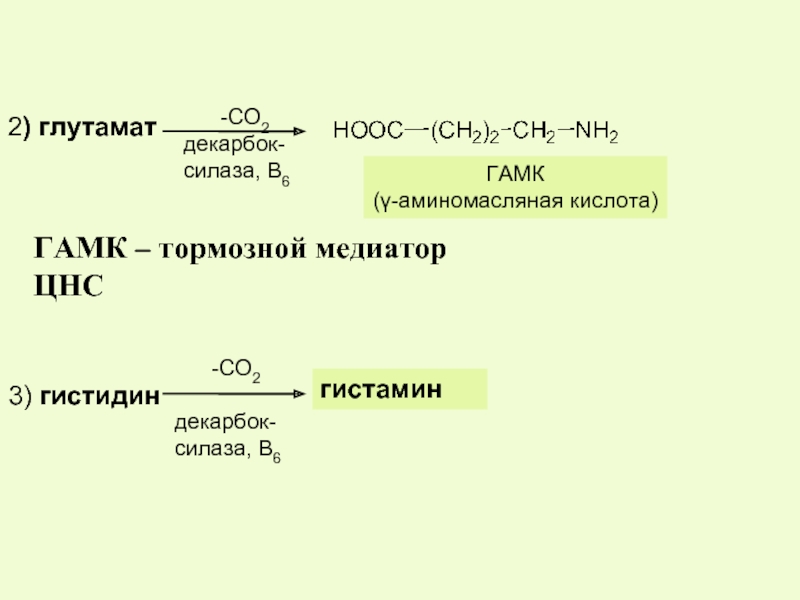
- 46. -СО2 декарбок- силаза, В6
- 48. Обезвреживание биогенных аминов I ст. Окислительное дезаминирование
- 49. Обезвреживание биогенных аминов Реакции декарбоксилирования протекают в
- 50. Особенности обмена белков у детей 1.У детей
- 51. ВЫБОРЫ
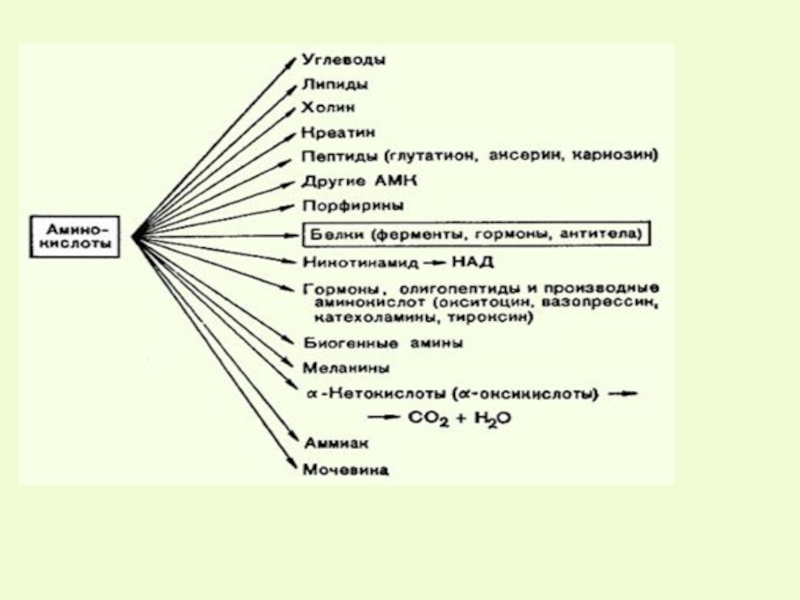
Слайд 3Судьба всосавшихся аминокислот
1) используются на биосинтез белков
2) превращаются в липиды, углеводы
3) окисляются до конечных продуктов
4) используются на синтез N-содержащих небелковых соединений:
-азотистых оснований (пуриновых, пиримидиновых)
-гормонов (катехоламины, йодтиронины)
-пептидов -глутатион (γ-глутамилцистенилглицин,
незамеченный в организме герой)
-креатина
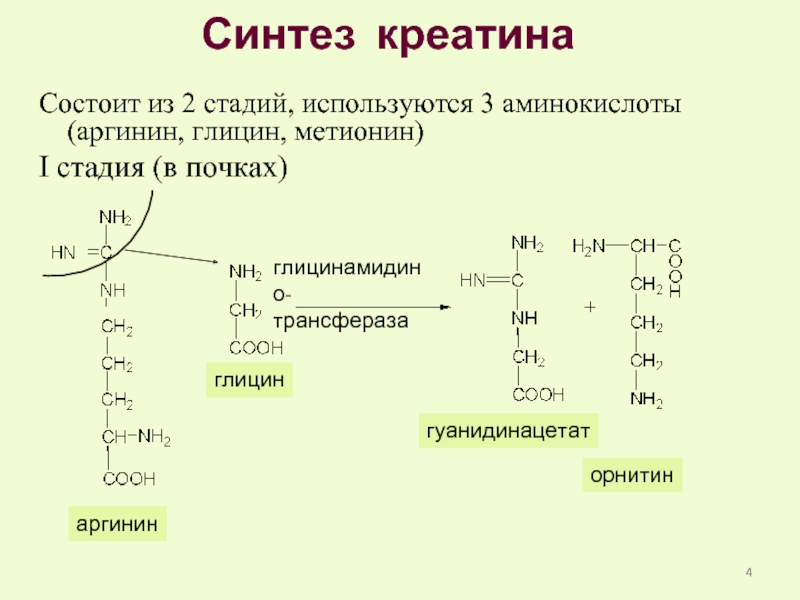
Слайд 4Синтез креатина
Состоит из 2 стадий, используются 3 аминокислоты (аргинин, глицин, метионин)
I
глицинамидино-
трансфераза
глицин
гуанидинацетат
орнитин
аргинин
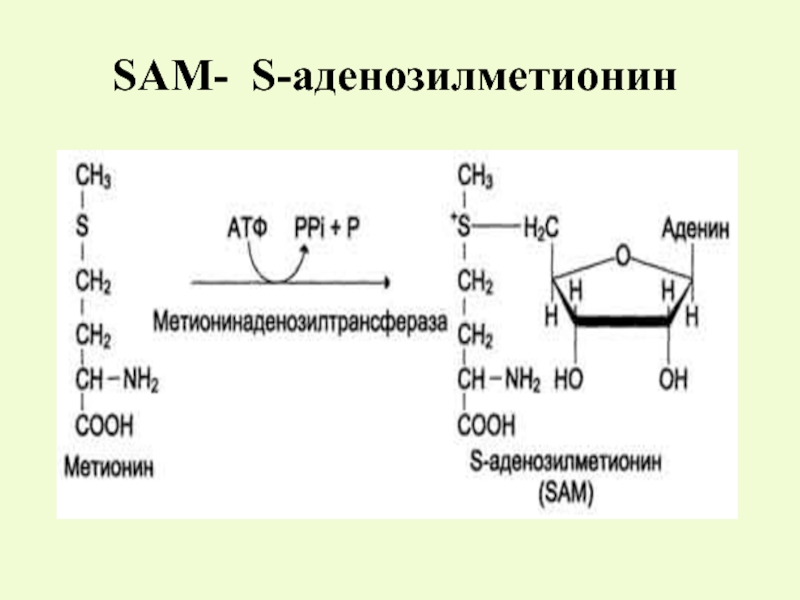
Слайд 7SАМ - S-аденозилметионин
Это активный метионин, который является донором
положительно заряженной серы и легко транспортируется на гуанидинацетат, образуя в данном случае креатин.
Слайд 8Синтез креатина
Миоциты скелетных мышц получают АТФ для мышечного сокращения аэробным путем
При большой нагрузке используется мышечный гликоген с образованием лактата, фосфокреатин. При малой нагрузке или отдыхе –жирные кислоты и кетоновые тела.
Сердечная мышца, находящаяся в цикле
сокращения-расслабления использует свободные жирные кислоты, глюкозу, кетоновые тела и фосфокреатин.
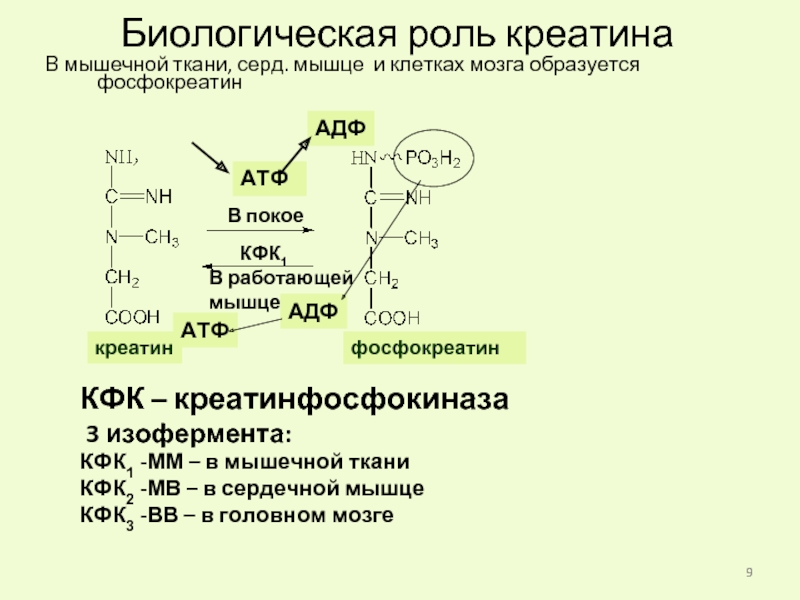
Слайд 9Биологическая роль креатина
В мышечной ткани, серд. мышце и клетках мозга образуется
креатин
АТФ
АДФ
В покое
КФК1
В работающей
мышце
фосфокреатин
КФК – креатинфосфокиназа
3 изофермента:
КФК1 -ММ – в мышечной ткани
КФК2 -МВ – в сердечной мышце
КФК3 -ВВ – в головном мозге
АТФ
АДФ
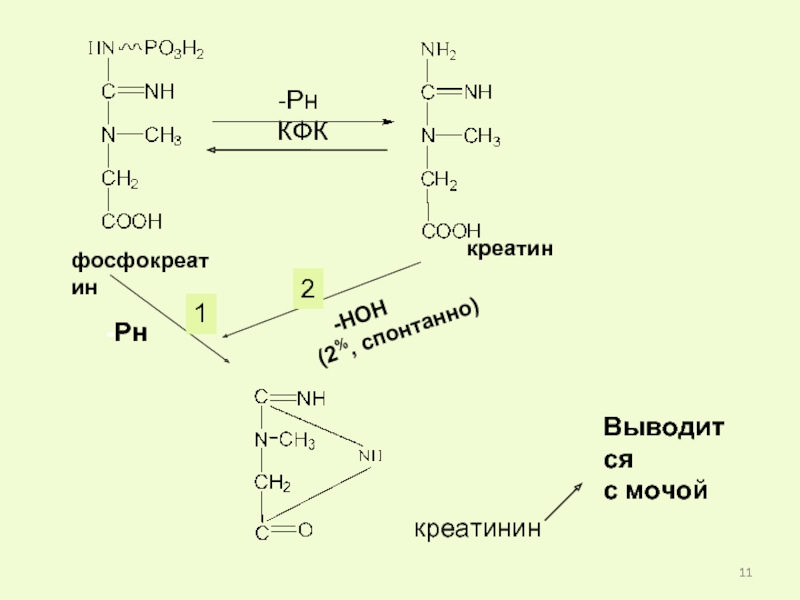
Слайд 10фосфокреатин
Относится к группе фосфагенов – соединений, резервирующих высокоэнергетические фосфаты. Они поддерживают
Слайд 12Содержание креатина
В плазме крови
15,25 – 76,25 мкмоль/л (0,15 – 0,76 мМ)
При повышении более 122 мкмоль/л креатин
выделяется с мочой
Креатинин в плазме крови
60 – 132 мкмоль/л (0,06 – 0,13 мМ)
Креатинин в моче
4,4 – 17,7 ммоль/сут (0,5 – 2,0 г/сут)
Слайд 13Повышение креатина наблюдается при
параличах, мышечных дистрофиях,
миопатиях.
При этом наблюдается нарушение
образования фосфокреатина,
что ведет к повышению креатина,
избыток которого выводится
с мочой - кретинурия.
При этом происходит уменьшение
образования креатинина.
Слайд 14В норме креатин выделяется с мочой у
беременных женщин, а также
Выделение креатинина с мочой для каждого человека поддерживается на постоянном уровне
и зависит от мышечной массы.
Диагностическое значение имеет измерение почечного клиренса креатинина, т.к.оно соответствует скорости клубочковой фильтрации
Слайд 15
Креатинин является беспороговым веществом, т.е. он не подвергается реабсорбции.
При заболеваниях почек
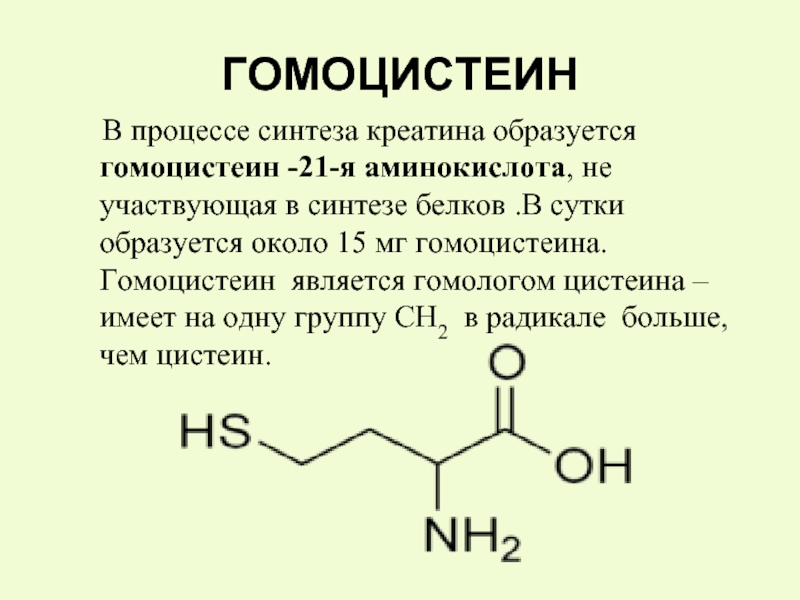
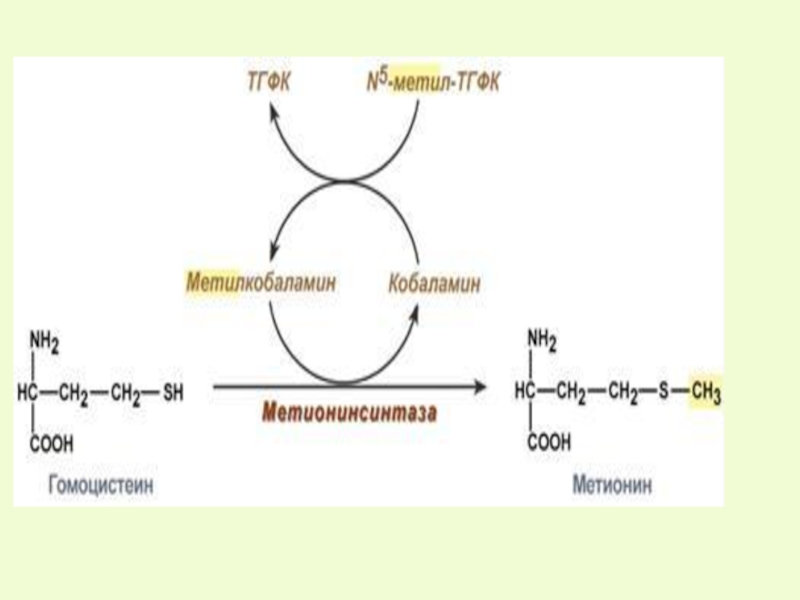
Слайд 16ГОМОЦИСТЕИН
В процессе синтеза креатина образуется гомоцистеин -21-я аминокислота,
Слайд 17ГОМОЦИСТЕИН
Повышение ГЦ вызывает повреждение стенки сосудов – «царапание» (не ХС!). Организм
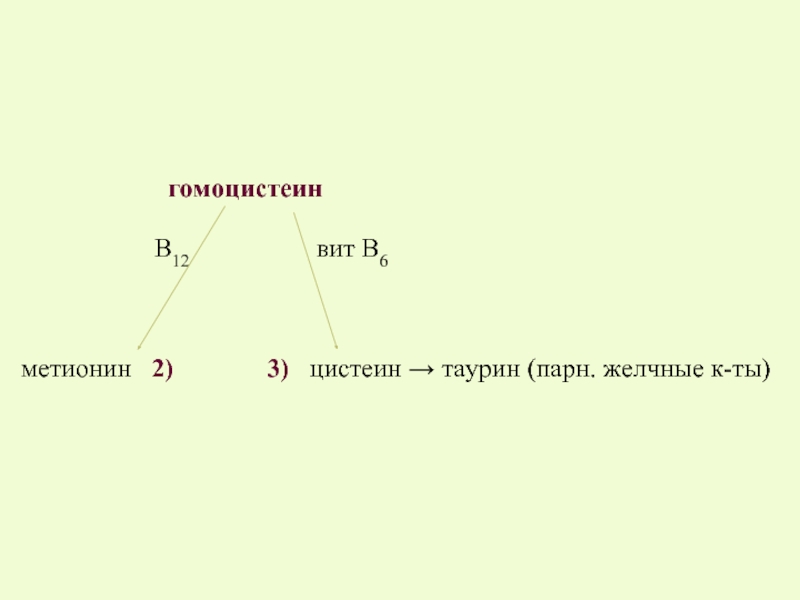
Снижение ГЦ возможно тремя путями:
1). Путем применения бетаина (триметилглцина), который отдает одну метильную группу на ГЦ с превращением его в полезный метионин.
Слайд 18 ГОМОЦИСТЕИН
Бетаин –триметилглицин ( в переводе
Слайд 21 Повышение гомоцистеина отмечается:
группы В, вит. В12, заболеваниях почек
При повышении гомоцистеина наблюдаютя :
тромбозы, слабоумие ( б-нь Альцгеймера),
атеросклероз, ИБС, повышение уровня холестерина
Содержание гомоцистеина в крови в норме — 9,7мг%, при атеросклерозе - 11,7 мг%
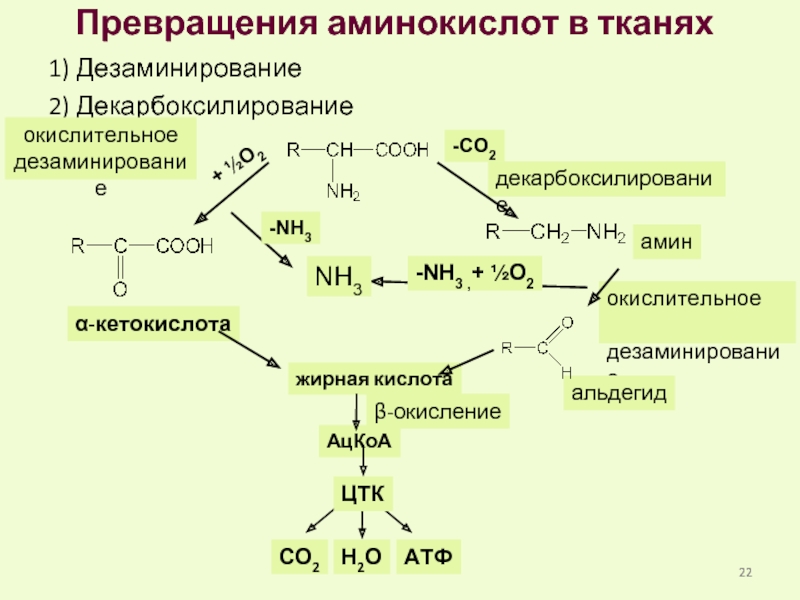
Слайд 22Превращения аминокислот в тканях
1) Дезаминирование
2) Декарбоксилирование
декарбоксилирование
окислительное
дезаминирование
амин
окислительное
дезаминирование
альдегид
жирная кислота
β-окисление
АцКоА
ЦТК
АТФ
Н2О
СО2
α-кетокислота
-NH3
-NH3 ,+
NH3
+ ½О2
-СО2
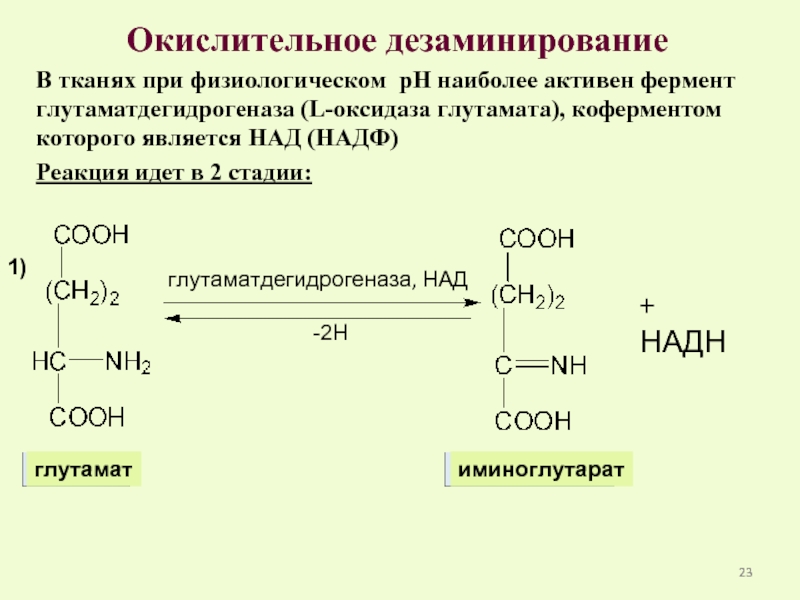
Слайд 23Окислительное дезаминирование
В тканях при физиологическом рН наиболее активен фермент глутаматдегидрогеназа (L-оксидаза
Реакция идет в 2 стадии:
глутаматдегидрогеназа, НАД
-2Н
+ НАДН
1)
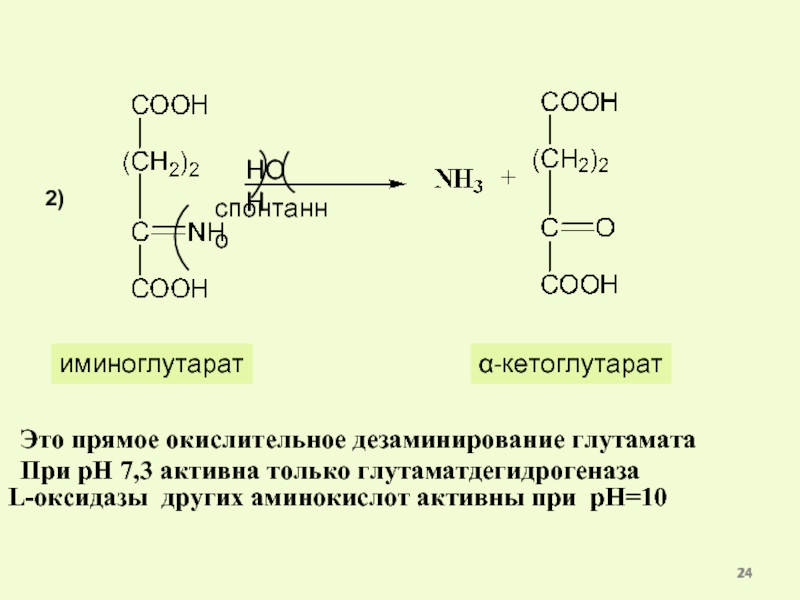
Слайд 24Это прямое окислительное дезаминирование глутамата
При рН 7,3 активна только глутаматдегидрогеназа
спонтанно
НОН
иминоглутарат
α-кетоглутарат
L-оксидазы
2)
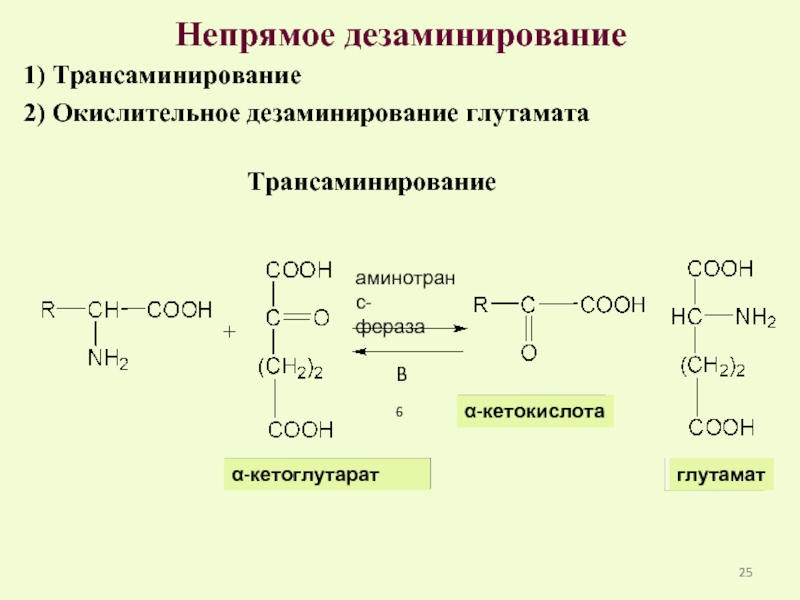
Слайд 25Непрямое дезаминирование
1) Трансаминирование
2) Окислительное дезаминирование глутамата
Трансаминирование
аминотранс-
фераза
B6
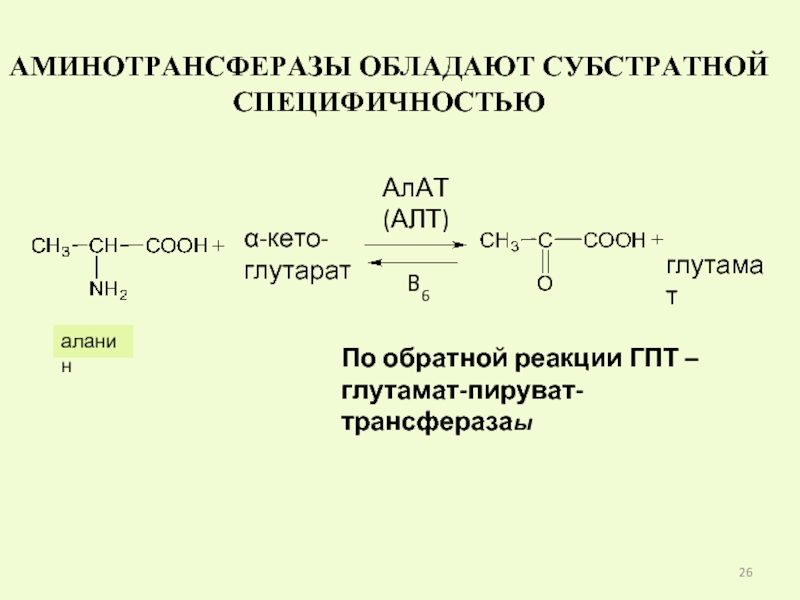
Слайд 26АМИНОТРАНСФЕРАЗЫ ОБЛАДАЮТ СУБСТРАТНОЙ
СПЕЦИФИЧНОСТЬЮ
глутамат
аланин
α-кето-
глутарат
АлАТ
(АЛТ)
B6
По обратной реакции ГПТ –
глутамат-пируват-трансферазаы
Слайд 27Активность АЛТ – 0,1 – 0,68 мкмоль/мл.ч
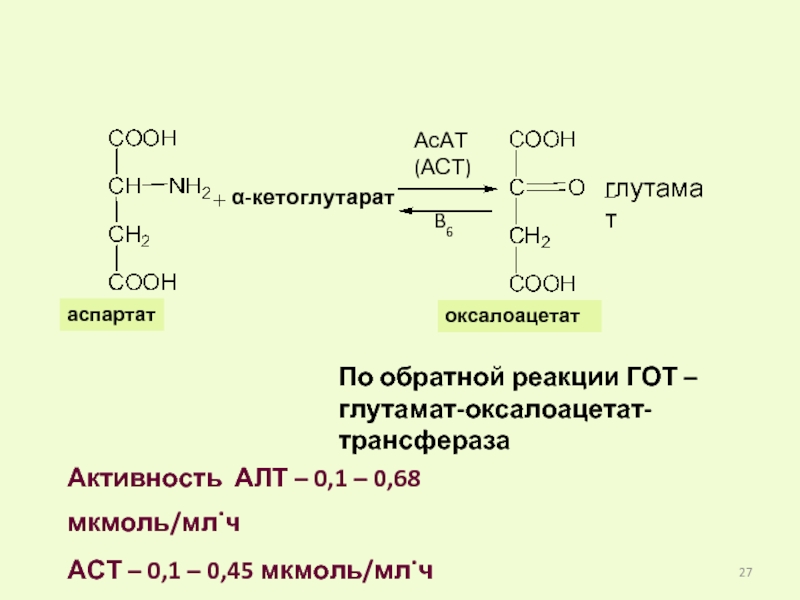
АСТ – 0,1 – 0,45
аспартат
α-кетоглутарат
глутамат
АсАТ
(АСТ)
B6
оксалоацетат
По обратной реакции ГОТ –
глутамат-оксалоацетат-трансфераза
Слайд 29
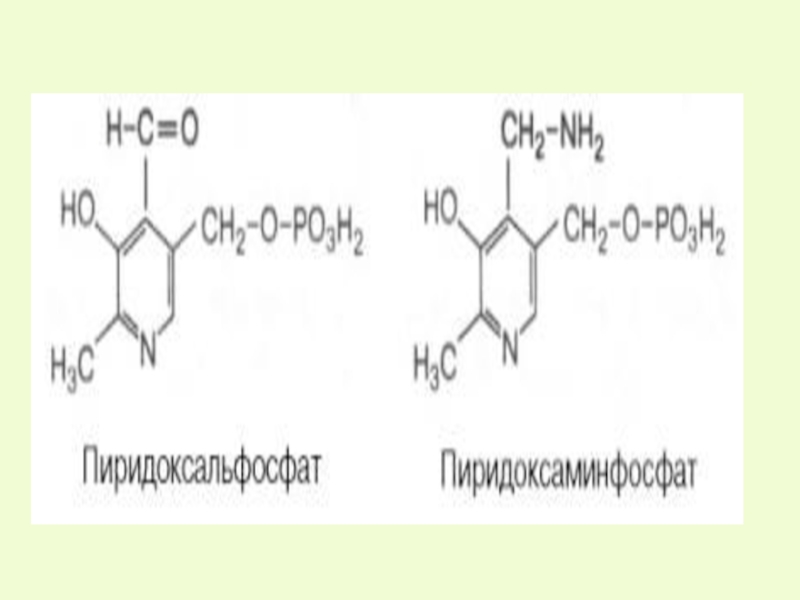
б)ФП-СН2-NH2 + α-кетоглутарат
B6
пиридоксальфосфат
пиридоксаминфосфат
+
ФП
+ ФП-CH2-NH2
Механизм реакции
а)
пиридоксаминфосфат
пиридоксальфосфат
Слайд 30Диагностическое значение аминотрансфераз
Повышение активности АЛТ наблюдается при гепатите ( не изменяется
Повышение активности АСТ характерно для инфаркта миокарда ( через 4 -6 ч) и снижается на 3-7 день.
Коэфициент де Ритиса (соотношение АСТ/АЛТ), при гепатите меньше 1, т.е. АСТ при этом повышается меньше.
Слайд 31Биологическая роль трансаминирования
1) Синтез заменимых аминокислот
2) Трансаминирование - I стадия непрямого
3) Реакции трансаминирования обратимы, их можно рассматривать как реакции катаболизма, так и анаболизма
Слайд 32Источники аммиака
1)Дезаминирование аминокислот (в тканях и толстом кишечнике)
2) Дезаминирование аминов
3) Дезаминирование
АММИАК: в крови - 12 – 65 мкмоль/л (10 – 110 мкг%)
в моче - 35,7 – 71,4 ммоль/сут (0,5 – 1,0 г)
Слайд 33 ПРИЧИНЫ ТОКСИЧНОСТИ АММИАКА
1.Аммиак
2. Аммиак усиливает синтез глутамина, что ведет к повышению осмотического давления в нервной ткани и может явиться причиной отека мозга
Слайд 34
3. Накопление иона аммония нарушает трансмембранный транспорт
4. Повышение аммиака изменяет рН крови в
щелочную сторону (алкалоз)
ПРИЧИНЫ ТОКСИЧНОСТИ АММИАКА
Слайд 35Обезвреживание аммиака
1) Образование амидов (локально)
+ NH3 (NH4+) ,
АТФ, Mg2+
глутамин-
синтетаза
+
глутамат
глутамин (глу- NH2)
Слайд 36глу- NH2
Синтез пуринов,
пиримидинов
печень
Синтез мочевины
Почки
-NH3 , глутаминаза
глутамат
-NH3
α-кетоглутарат
2NH4+
аммониогенез
Na+
K+
NH4+
Слайд 37
2) восстановительное аминирование
3) образование аммонийных солей
4) синтез мочевины
а) α-кетоглутарат
NH4+, 2H+,НАДФ
глутаматдегидрогеназа
(режим синтеза)
глутамат + Н2О+НАДФН
б) глутамат + ПВК
α-кетоглутарат + аланин
трансаминирование
Слайд 38
Синтез мочевины
Орнитиновый цикл включает 5 реакций, катализируют их 5 ферментов –
Реакции 1 и 2 протекают в матриксе митохондрий печени, остальные – в цитозоле
В почках синтез мочевины идет из цитруллина, поступающего из печени
СО2
NH4+
аспартат
мочевина
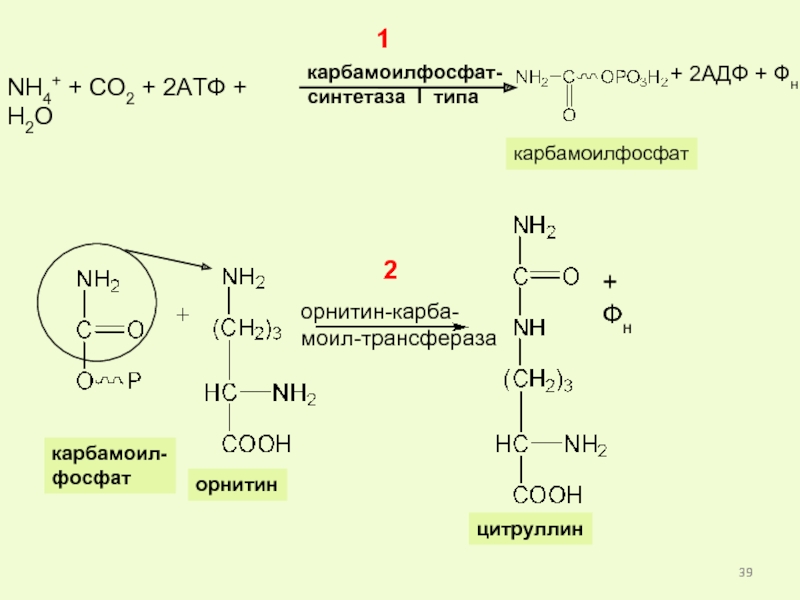
Слайд 39NH4+ + CO2 + 2АТФ + Н2О
карбамоилфосфат-
синтетаза I типа
карбамоилфосфат
+ 2АДФ +
1
орнитин-карба-
моил-трансфераза
2
+ Фн
карбамоил-
фосфат
орнитин
цитруллин
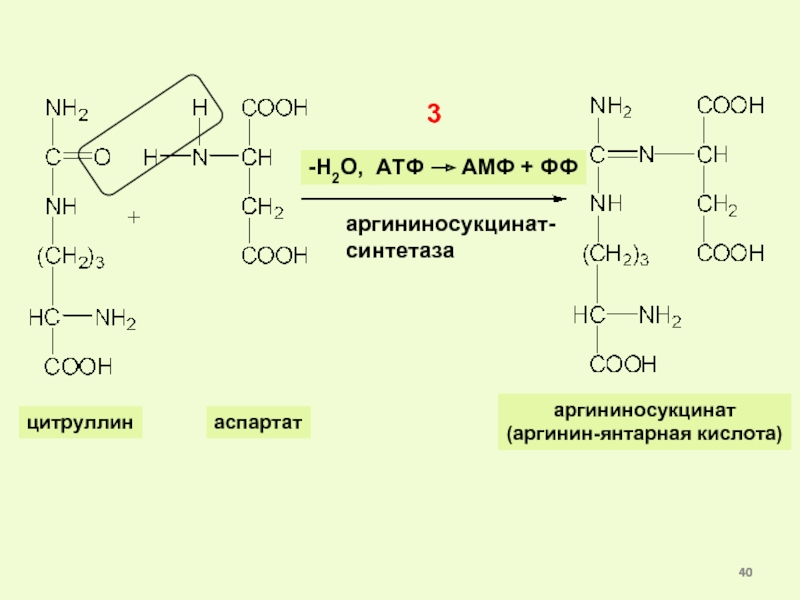
Слайд 40цитруллин
аспартат
-Н2О,
АТФ АМФ + ФФ
3
аргининосукцинат-
синтетаза
аргининосукцинат
(аргинин-янтарная кислота)
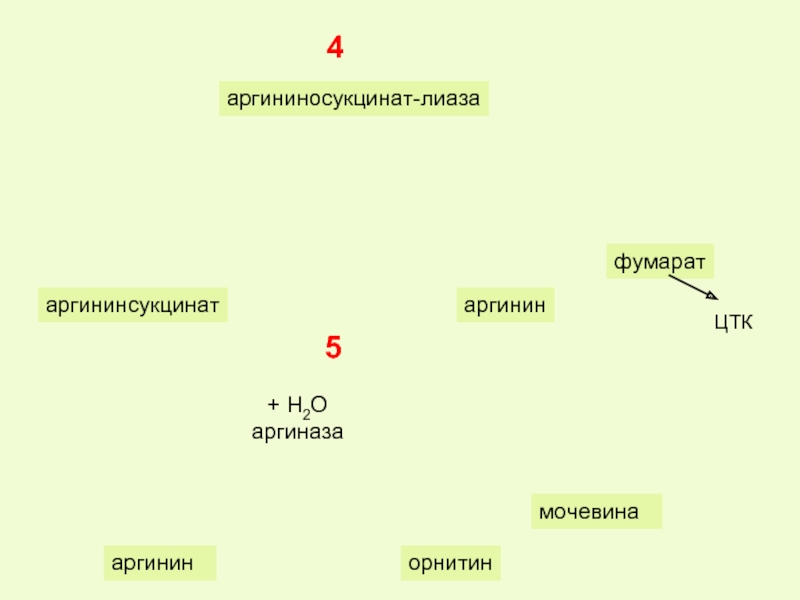
Слайд 42Связь синтеза мочевины с ЦТК
Источником СО2 являются реакции декарбоксилирования
Общим продуктом является фумарат
Источником АТФ также является ЦТК
Образование аспартата, используемого в цикле синтеза мочевины, происходит путем аминирования оксалоацетата, являющегося субстратом ЦТК
Слайд 43Суммарное уравнение синтеза мочевины
На синтез 1 молекулы мочевины затрачивается 3 АТФ
Мочевина в сыворотке – 2,5 – 8,3 ммоль/л (при употреблении 100-120 г белка)
Мочевина в моче - 20 – 35 г/сут
CO2 + NH4+ + 3АТФ + аспартат + 2Н2О
мочевина + 2АДФ + 2Фн + АМФ + ФФ + фумарат
Слайд 44Нарушения цикла мочевины
Известно 5 наследственных заболеваний, обусловленных дефектом 5 ферментов
1)Гипераммониемия I
карбамоилфосфат синтетазы
2) Гипераммониемия II типа – дефект
орнитинкарбамоилтрансферазы
3) Цитруллинемия – дефект аргинино-сукцинат синтетазы
4) Аргининсукцинатемия – дефект аргинино-сукцинат лиазы
5) Гипераргининемия – дефект аргиназы
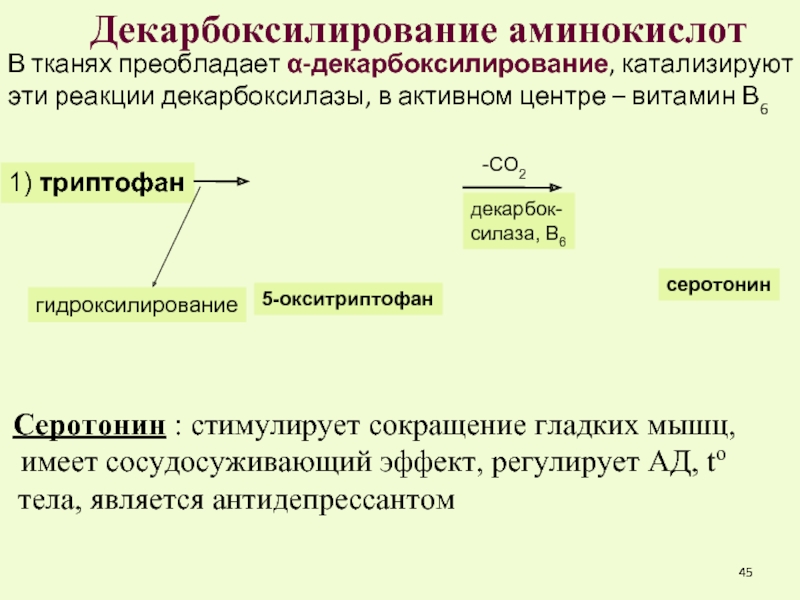
Слайд 45Декарбоксилирование аминокислот
В тканях преобладает α-декарбоксилирование, катализируют эти реакции декарбоксилазы, в активном
Серотонин : стимулирует сокращение гладких мышц,
имеет сосудосуживающий эффект, регулирует АД, tо
тела, является антидепрессантом
1) триптофан
декарбок-
силаза, В6
серотонин
5-окситриптофан
гидроксилирование
-СО2
Слайд 46 -СО2
декарбок-
силаза, В6
ГАМК
(γ-аминомасляная кислота)
ГАМК – тормозной медиатор ЦНС
декарбок-
силаза, В6
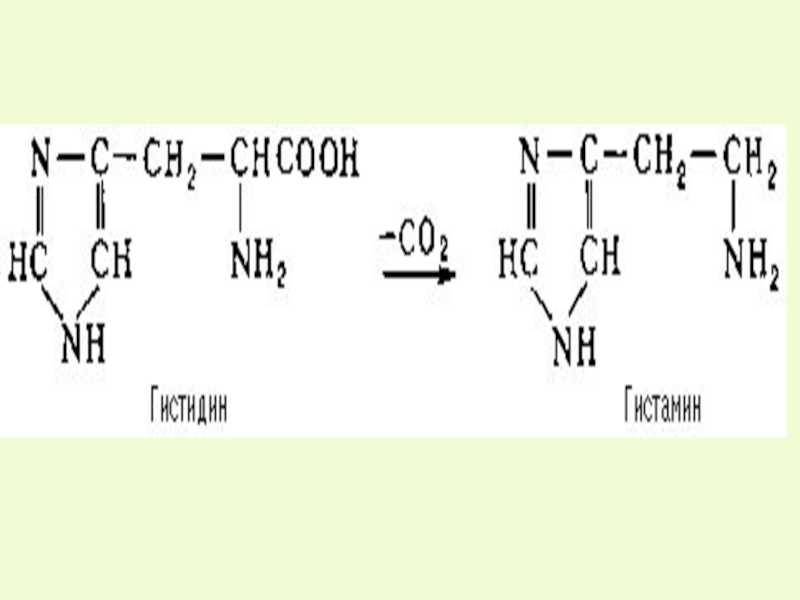
гистамин
2) глутамат
3) гистидин
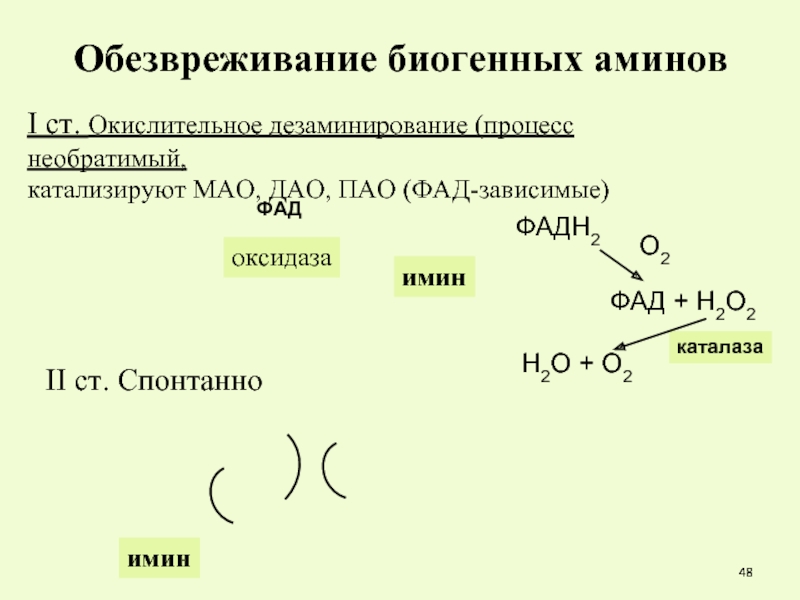
Слайд 48Обезвреживание биогенных аминов
I ст. Окислительное дезаминирование (процесс необратимый,
катализируют МАО, ДАО, ПАО
II ст. Спонтанно
оксидаза
ФАДН2
ФАД + Н2О2
каталаза
Н2О + О2
имин
имин
О2
ФАД
Слайд 49Обезвреживание биогенных аминов
Реакции декарбоксилирования протекают в цитоплазме, а окисление аминов на
Оксидазы аминов менее активны, чем оксидазы аминокислот, поэтому в клетках сохраняется большое количество аминокислот.
Значение реакций декарбоксилирования:
1.Источник СО2
2. Источник биогенных аминов
Слайд 50Особенности обмена белков у детей
1.У детей снижена активность ферментов синтеза мочевины
поэтому доля азота мочевины у детей составляет 70%, в то время как у взрослых – 90%.
2. Больше образуется амидов, аммонийных солей.
3. Высокая активность ксантиноксидазы приводит к повышенному образованию мочевой кислоты (мочекислый инфаркт новорожденных)
4.Снижена активность аминотрансфераз, декарбоксилаз, дезаминаз, глюкуронилтрансферазы.