- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Обмен белков презентация
Содержание
- 1. Обмен белков
- 2. Азотистый баланс Количество азотсодержащих веществ в организме
- 3. Азотистый баланс Отрицательный азотистый баланс –
- 4. Азотистый баланс Положительный азотистый баланс –
- 5. Нормы потребления белка Россия Взрослые 100-120 г,
- 6. Качество белка Идеальный белок: соотношение
- 7. Квашиоркор Квашиоркор – последствия нехватки
- 8. Квашиоркор
- 9. Внешний обмен аминокислот и белков
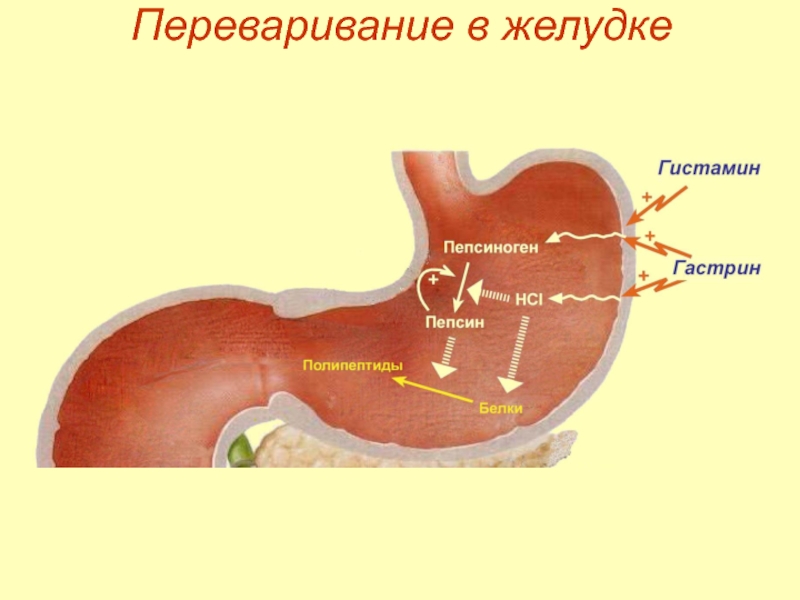
- 10. Переваривание в желудке
- 11. Соляная кислота Функции соляной кислоты денатурация белков
- 12. Соляная кислота Синтез соляной кислоты осуществляют париетальные клетки желудка
- 13. Пепсин эндопептидаза, синтезируется в главных клетках
- 14. Пепсин В результате образуется активный пепсин, активирующий
- 15. Пепсин
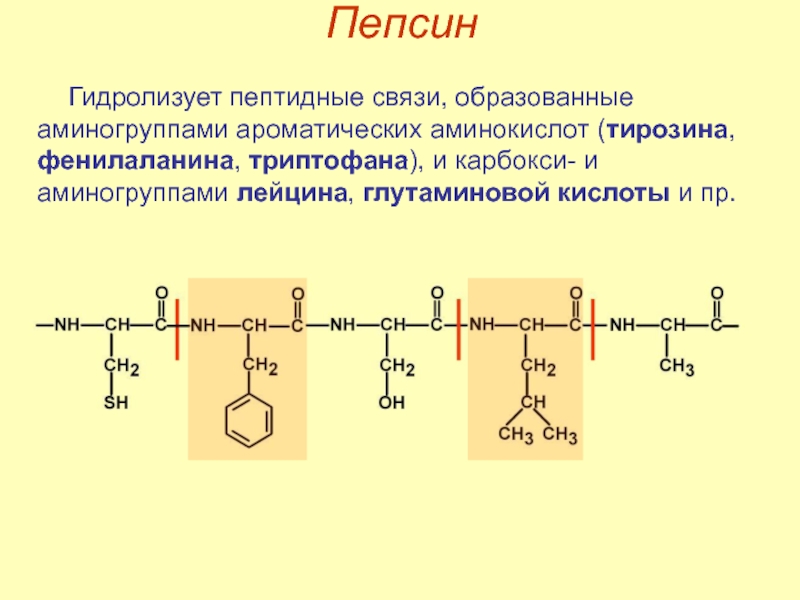
- 16. Пепсин Гидролизует пептидные связи, образованные аминогруппами ароматических
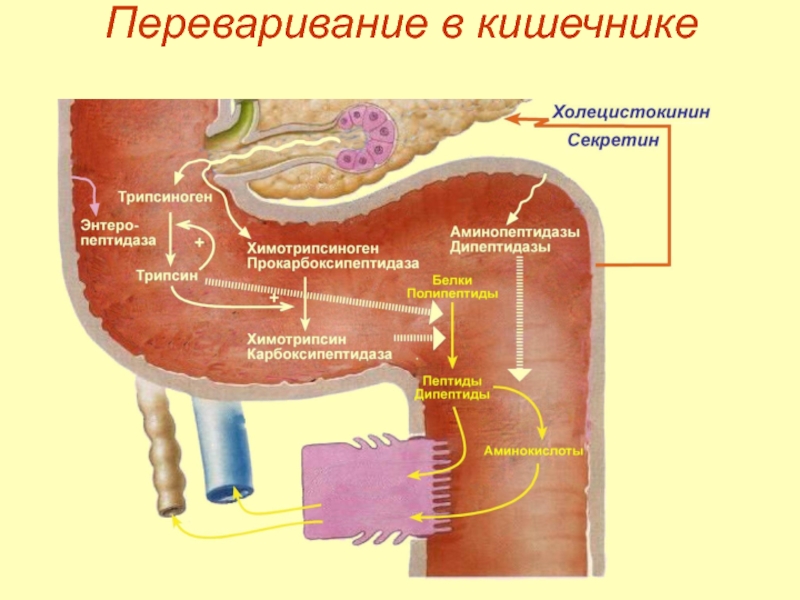
- 17. Переваривание в кишечнике
- 18. Переваривание в кишечнике Активация ферментов кишечника
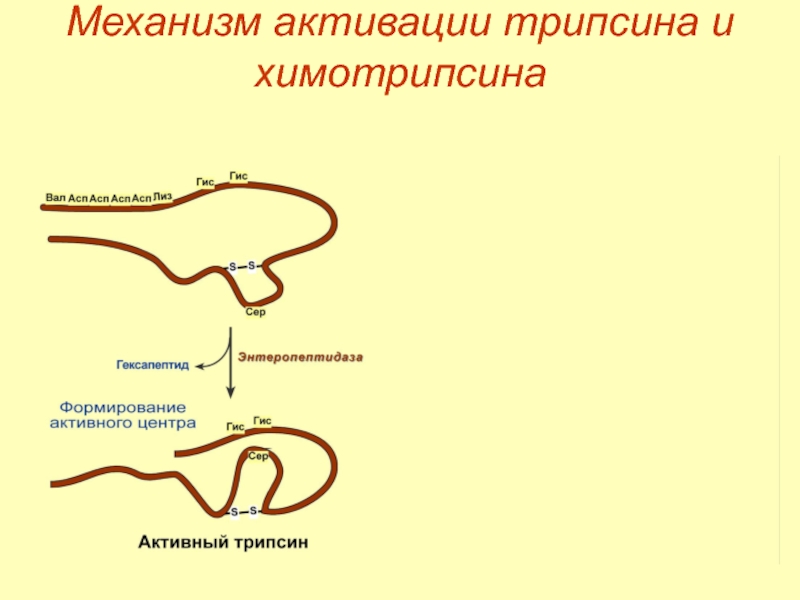
- 19. Механизм активации трипсина и химотрипсина
- 20. Специфичность ферментов Трипсин специфичен к пептидным связям,
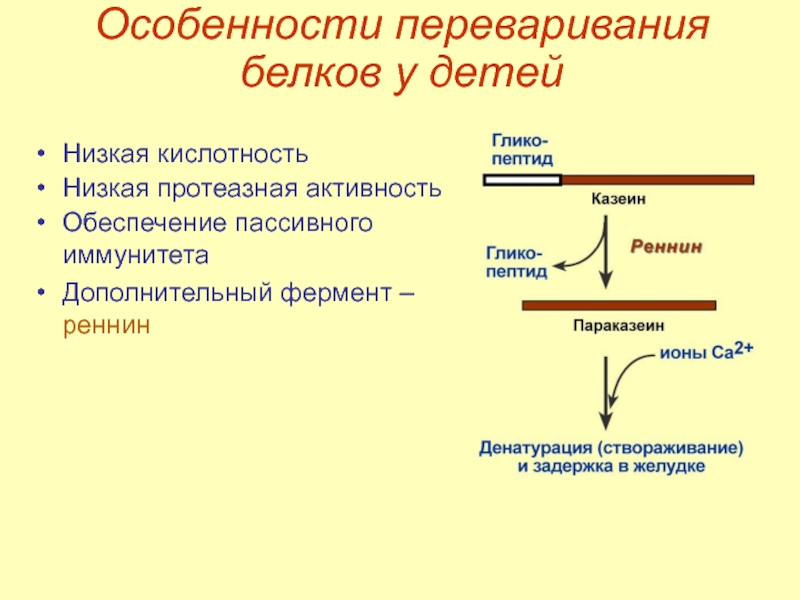
- 21. Особенности переваривания белков у детей Низкая кислотность
- 22. Нарушение процессов переваривания белков
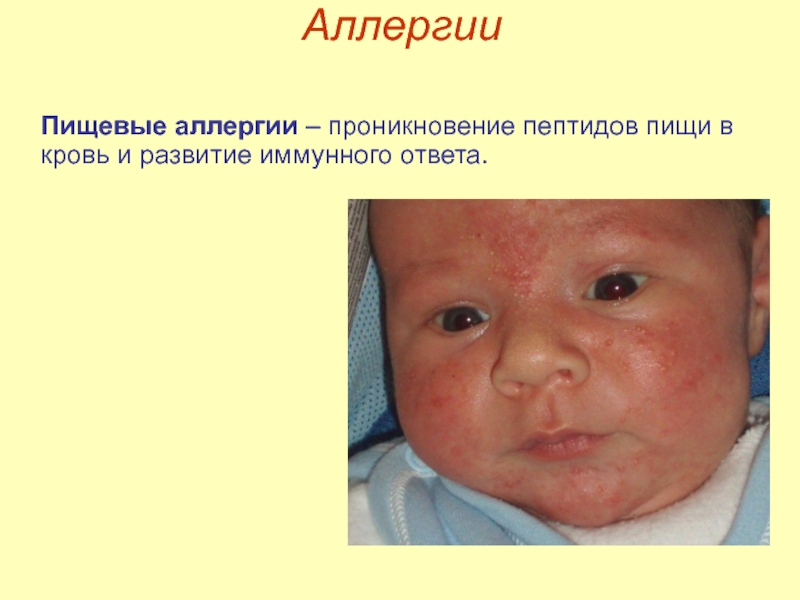
- 23. Аллергии Пищевые аллергии – проникновение пептидов пищи в кровь и развитие иммунного ответа.
- 24. Целиакия Целиакия – врожденная непереносимость белка клейковины
- 25. Гниение белков Гниение белков в кишечнике –
- 26. Нарушение переваривания
- 27. Нарушение переваривания
- 28. Детоксикационные системы печени
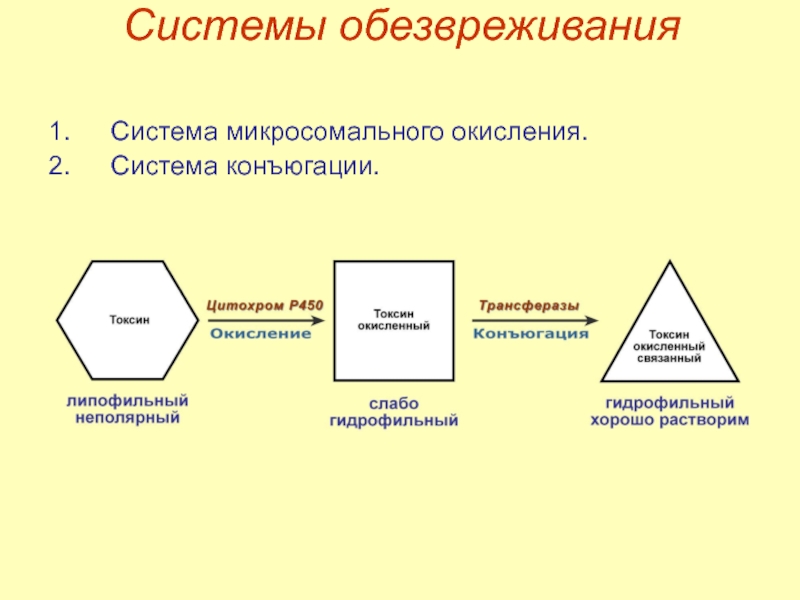
- 29. Системы обезвреживания Система микросомального окисления. Система конъюгации.
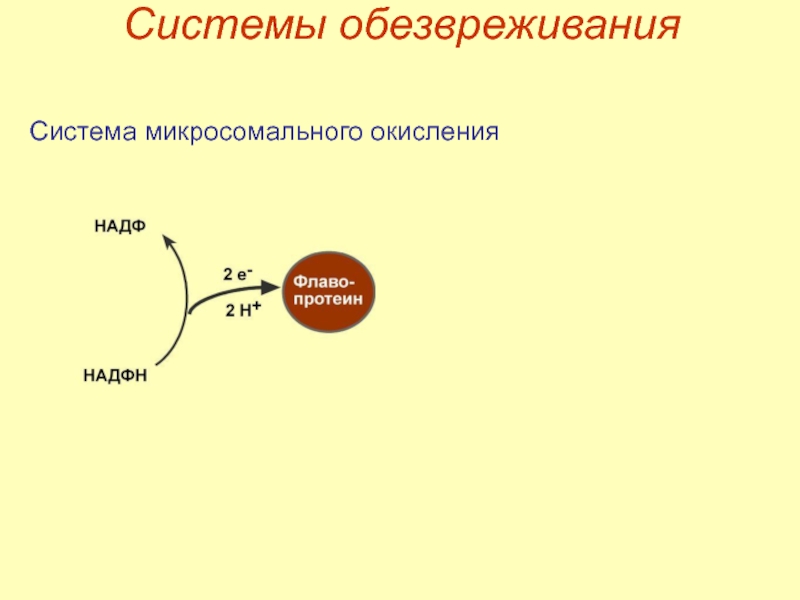
- 30. Системы обезвреживания Система микросомального окисления
- 31. Системы обезвреживания Система конъюгации – связывание с
- 32. Образование животного индикана
- 33. Внутриклеточный обмен аминокислот
- 34. Судьба аминокислот в клетке
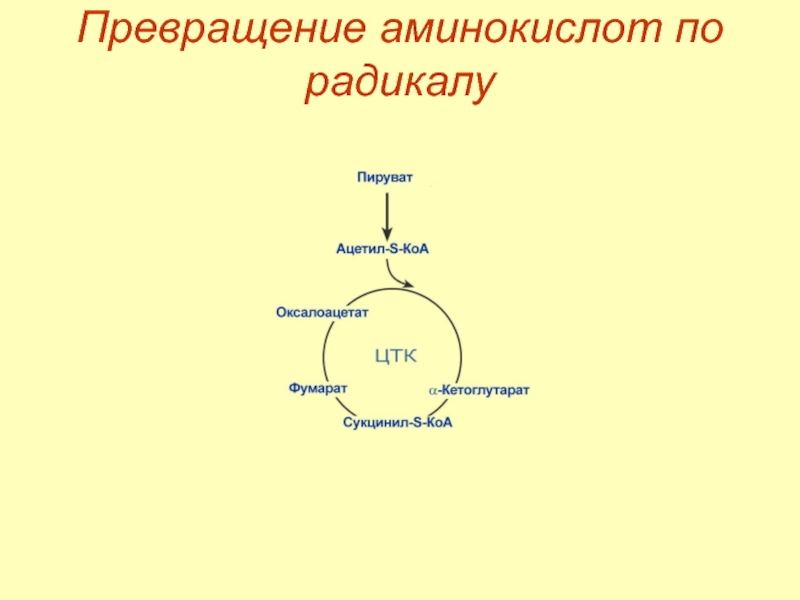
- 35. Превращение аминокислот по радикалу
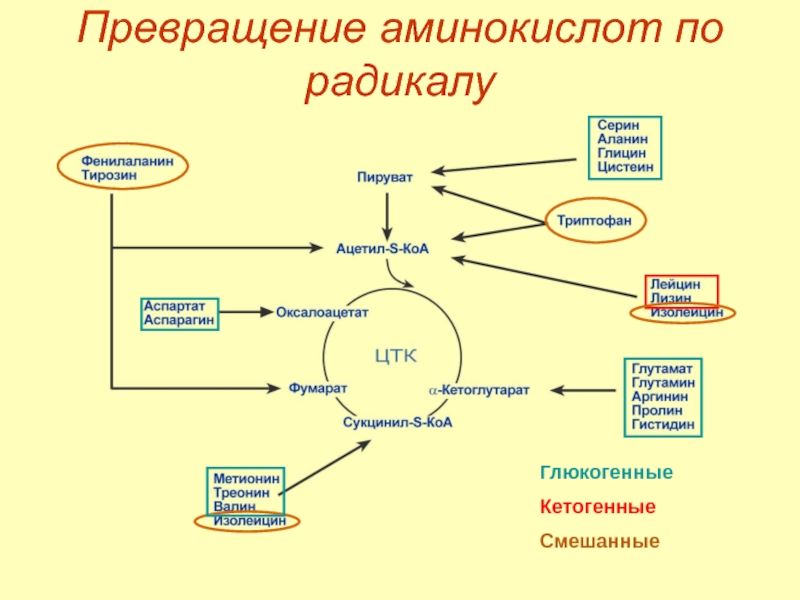
- 36. Превращение аминокислот по радикалу
- 37. Превращение аминокислот по карбоксильной группе
- 38. Превращение аминокислот с участием аминогруппы Превращение
- 39. Типы дезаминирования внутримолекулярное – с образованием ненасыщенной
- 40. гидролитическое – с образованием карбоновой гидроксикислоты, окислительное – с образованием кетокислот.
- 41. Окислительное дезаминирование
- 42. Окислительное дезаминирование Прямое Непрямое Аэробное Анаэробное (трансдез- аминирование)
- 43. Прямое окислительное дезаминирование 1. Аэробное 2. Анаэробное
- 44. Непрямое окислительное дезаминирование Первый этап – обратимый
- 45. Непрямое окислительное дезаминирование
- 46. Непрямое окислительное дезаминирование
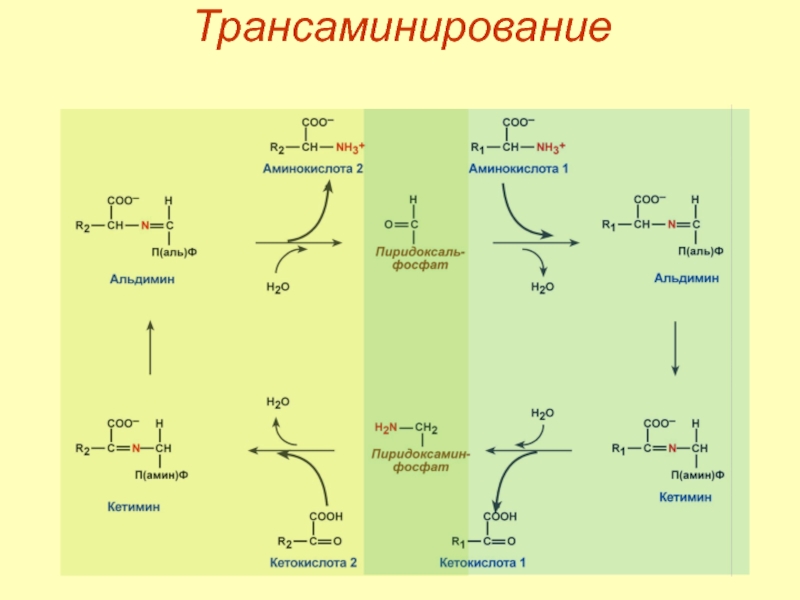
- 47. Механизм трансаминирования
- 48. Трансаминирование
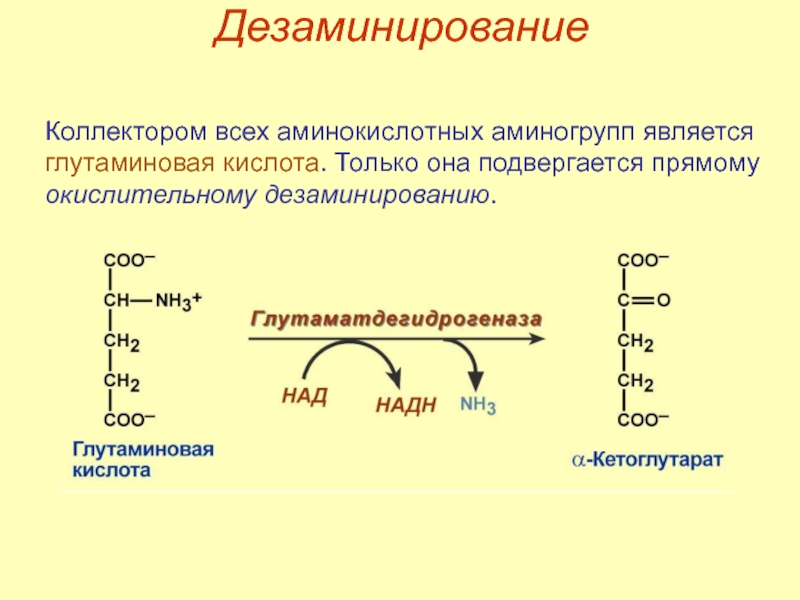
- 49. Дезаминирование Коллектором всех аминокислотных аминогрупп является глутаминовая кислота. Только она подвергается прямому окислительному дезаминированию.
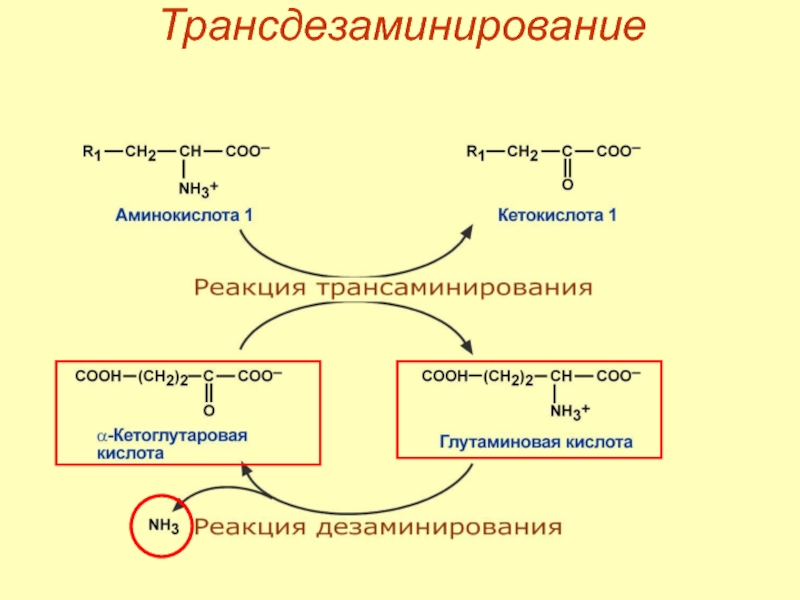
- 50. Трансдезаминирование
- 51. Роль трансаминирования Реакции трансаминирования: оптимизация соотношения аминокислот
- 52. Роль трансдезаминирования Процесс трансдезаминирования идет в организме
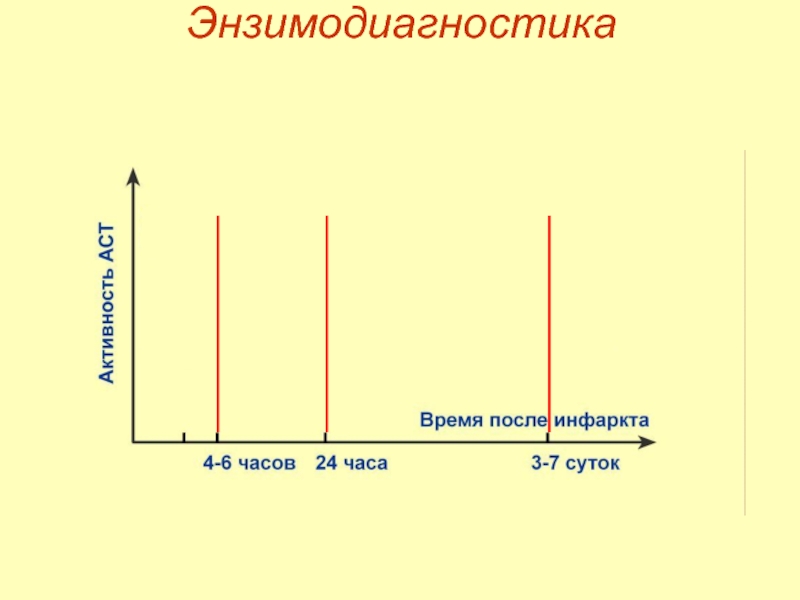
- 53. Энзимодиагностика
- 54. Энзимодиагностика
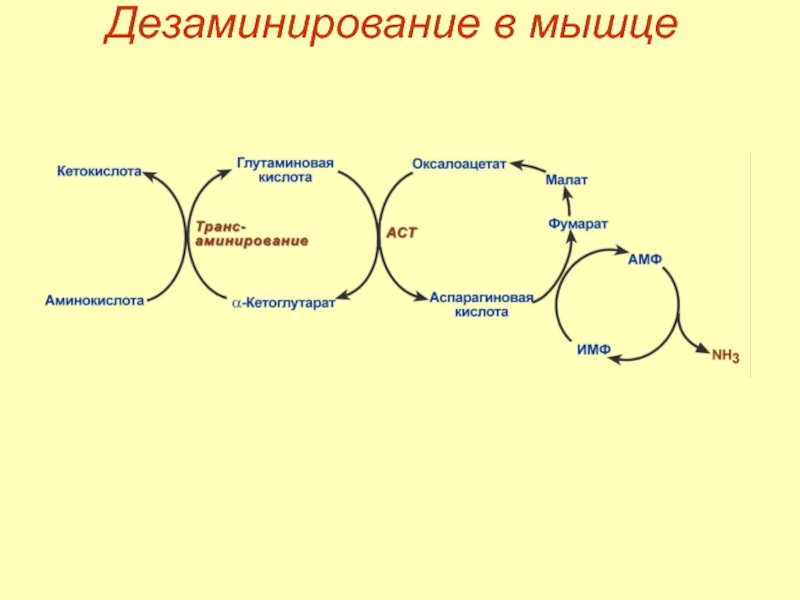
- 55. Дезаминирование в мышце
- 56. Спасибо за внимание
Слайд 1Обмен белков
Тимин Олег Алексеевич
Доцент кафедры биохимии и молекулярной и биологии ЛФ
www.biokhimija.ru
Слайд 2Азотистый баланс
Количество азотсодержащих веществ в организме определяется балансом между поступающим азотом
Поступающий азот = Белки + Аминокислоты +
+ Нуклеотиды – Азот экскрементов
Выводимый азот (30-400 мг/сут)
= Аммиак + Аммонийные соли + Мочевина (моча, пот) + Мочевая кислота
Азотистый баланс
– это состояние, когда количество выводимого азота равно количеству получаемого
(Vпоступления = Vвыведения) .
Слайд 3Азотистый баланс
Отрицательный азотистый баланс
– это состояние, когда количество выводимого азота
Голодание
Травмы
Воспаления
Ожоги
Опухоли
Слайд 4Азотистый баланс
Положительный азотистый баланс
– это состояние, когда количество поступающего азота
Беременность
Регенерация тканей
Здоровые дети
Выздоровление
Спортсмены
Слайд 5Нормы потребления белка
Россия
Взрослые 100-120 г,
Дети 1 год жизни 2-3 г/кг веса,
старшие 1,5-2 г/кг веса.
Животных белков должно быть не менее 60% от общего количества.
ВОЗ не менее 42 г/сутки полноценного белка
Слайд 6Качество белка
Идеальный белок:
соотношение заменимых и незаменимых аминокислот – в белке должно
близость аминокислотного состава белка к аминокислотному составу усредненного белка тела человека,
легкость переваривания в ЖКТ.
Растительные белки считаются неполноценными:
в их составе мало незаменимых аминокислот,
доля тех или иных аминокислот в растительном белке резко отличается от таковой животного белка.
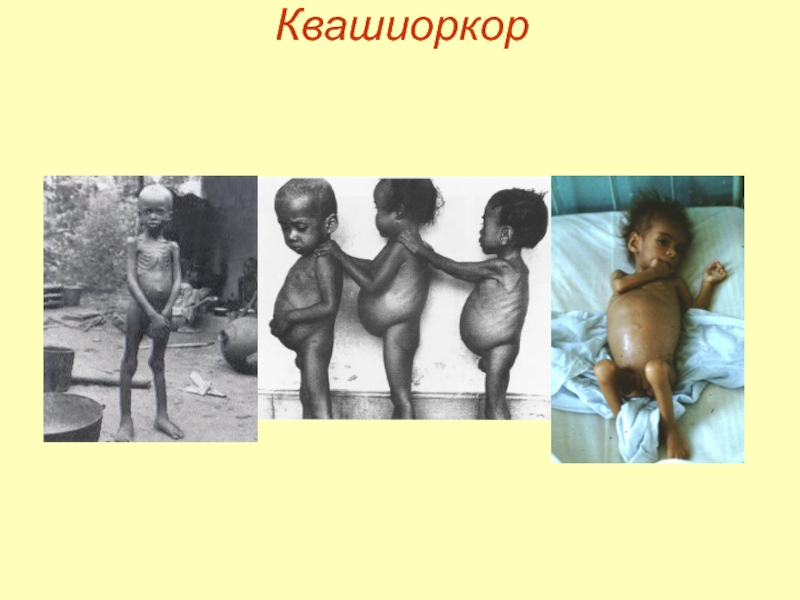
Слайд 7Квашиоркор
Квашиоркор – последствия нехватки в пище белков, особенно животных.
Симптомы:
задержка роста, истощение
отставание
изменение состава костной ткани,
иммунодефициты,
снижение активности эндокринных желез,
изменение цвета и качества кожи,
сонливость, апатия
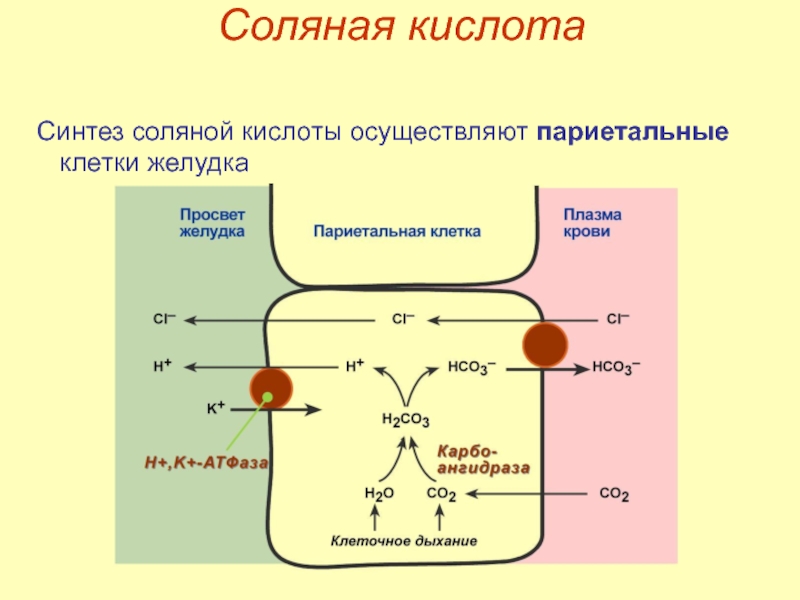
Слайд 11Соляная кислота
Функции соляной кислоты
денатурация белков пищи,
бактерицидное действие,
высвобождение Fe3+ из комплекса с
превращение неактивного пепсиногена в активный пепсин,
снижение рН желудочного содержимого до 1,5‑2,5 и создание оптимума рН для работы пепсина,
стимуляция секреции панкреатического сока.
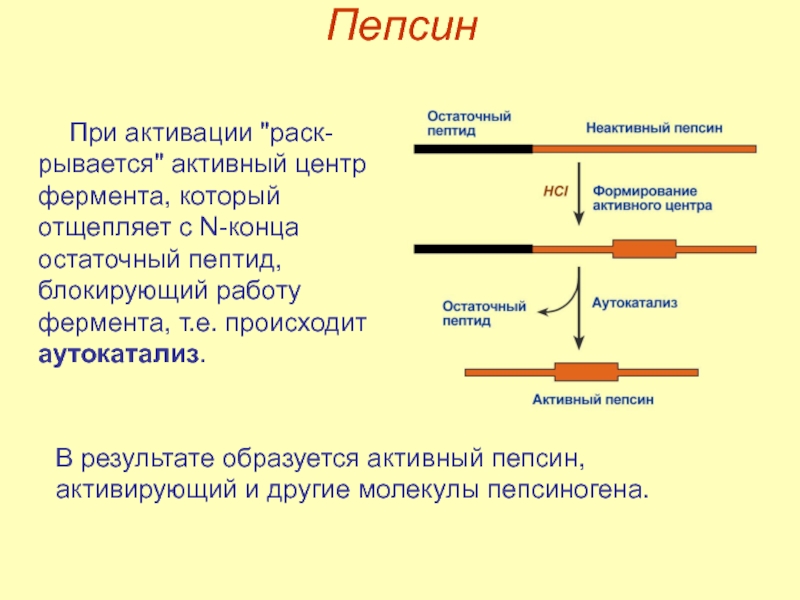
Слайд 13Пепсин
эндопептидаза,
синтезируется в главных клетках желудка в виде пепсиногена,
стимулятором секреции
активируется «частичным протеолизом»,
оптимум рН для пепсина 1,5‑2,0.
Слайд 14Пепсин
В результате образуется активный пепсин, активирующий и другие молекулы пепсиногена.
При
Слайд 16Пепсин
Гидролизует пептидные связи, образованные аминогруппами ароматических аминокислот (тирозина, фенилаланина, триптофана), и
Слайд 20Специфичность ферментов
Трипсин специфичен к пептидным связям, образованным с участием карбоксильных групп
Химотрипсин специфичен к пептидным связям, образованным с участием карбоксильных групп фенилаланина, тирозина и триптофана.
Слайд 21Особенности переваривания белков у детей
Низкая кислотность
Низкая протеазная активность
Обеспечение пассивного иммунитета
Дополнительный фермент
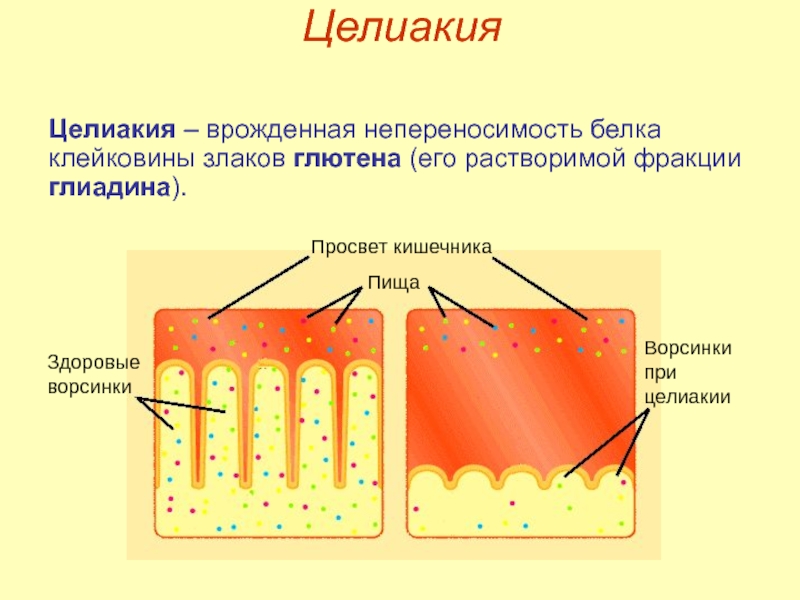
Слайд 24Целиакия
Целиакия – врожденная непереносимость белка клейковины злаков глютена (его растворимой фракции
Просвет кишечника
Пища
Здоровые
ворсинки
Ворсинки
при
целиакии
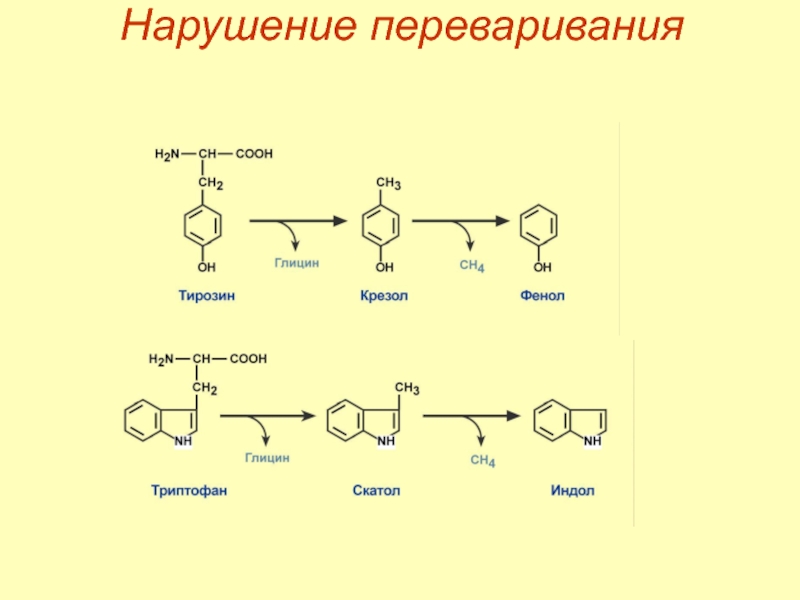
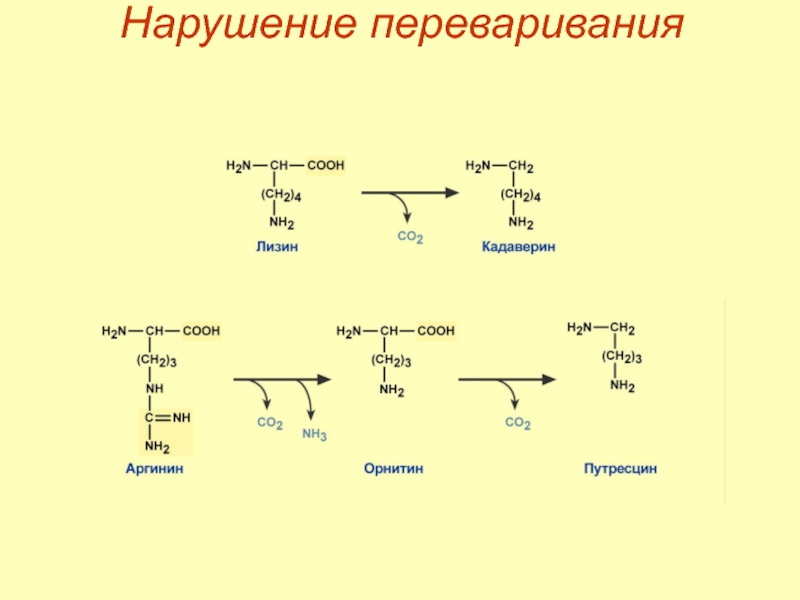
Слайд 25Гниение белков
Гниение белков в кишечнике – превращение аминокислот под влиянием микрофлоры.
Причины:
избыток белка в пище,
нарушение пищеварительных желез,
поражение слизистых (токсины, гельминтозы, гиповитаминозы).
Образуются:
токсины – кадаверин, путресцин, крезол, фенол, скатол, индол, пиперидин, пирролидин, сероводород (H2S) и метилмеркаптан (СН3SН),
нейромедиаторы – серотонин, гистамин, октопамин, тирамин.
Слайд 31Системы обезвреживания
Система конъюгации – связывание с очень полярным соединением (глутатион, серная,
Слайд 37Превращение аминокислот
по карбоксильной группе
Это удаление карбоксильной группы от аминокислоты
гистамин
серотонин
дофамин
γ-аминомасляная кислота
Самостоятельно
Слайд 38Превращение аминокислот с участием аминогруппы
Превращение аминокислот с участием NH2‑группы сводится
Типы дезаминирования
внутримолекулярное,
восстановительное,
гидролитическое,
окислительное.
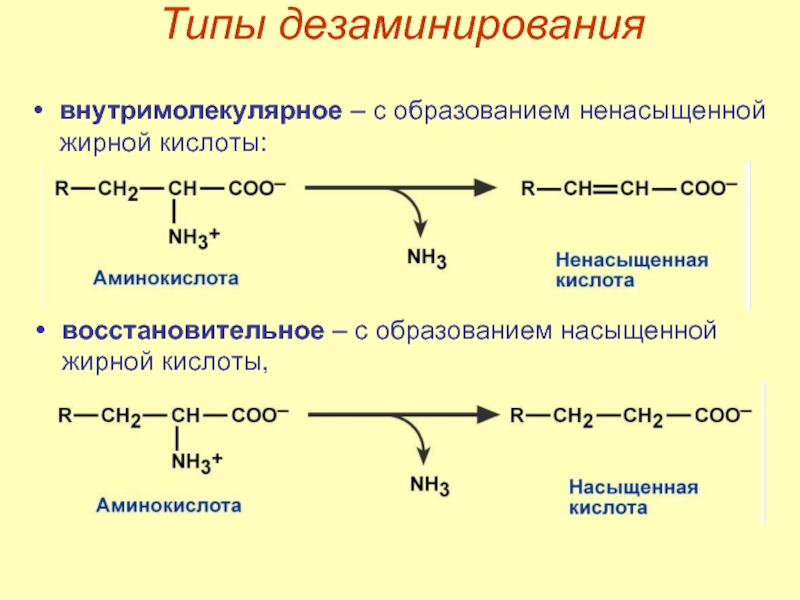
Слайд 39Типы дезаминирования
внутримолекулярное – с образованием ненасыщенной жирной кислоты:
восстановительное – с образованием
Слайд 40гидролитическое – с образованием карбоновой гидроксикислоты,
окислительное – с образованием кетокислот.
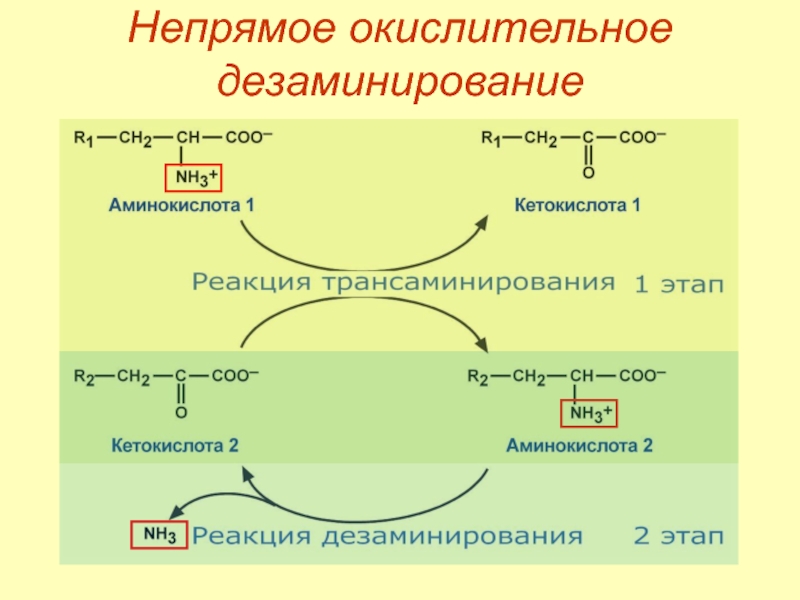
Слайд 44Непрямое окислительное дезаминирование
Первый этап – обратимый перенос NH2‑группы с аминокислоты на
Второй этап – отщепление аминогруппы от новообразованной аминокислоты – дезаминирование.
Слайд 49Дезаминирование
Коллектором всех аминокислотных аминогрупп является глутаминовая кислота. Только она подвергается прямому
Слайд 51Роль трансаминирования
Реакции трансаминирования:
оптимизация соотношения аминокислот в клетке,
синтез заменимых аминокислот в клетке
переводят аминокислоты на путь катаболизма,
использование безазотистого остатка аминокислот для кетогенеза и глюконеогенеза.
Глутаминовая кислота:
является одной из транспортных форм аминного азота в гепатоциты,
способна реагировать со свободным аммиаком, обезвреживая его.