- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Молекулярные механизмы регуляции поведения. Интерфейс между нейронами презентация
Содержание
- 1. Молекулярные механизмы регуляции поведения. Интерфейс между нейронами
- 2. Нейроны и поведение Поведение – продукт взаимодействия
- 3. Синаптическая и объемная коммуникации Синаптическая коммуникация осуществляется
- 4. Молекулярная структура интерфейса: В организме клетки являются
- 5. Рецепторы цитокинов и факторов роста Включают рецепторный,
- 6. Трансдукция сигнала с рецепторов IL-6, LIF, CNTF
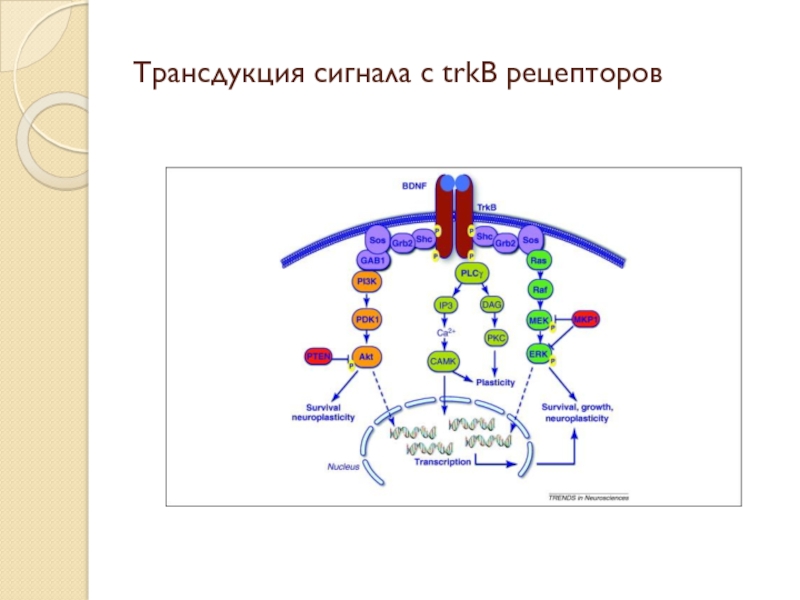
- 7. Трансдукция сигнала с trkB рецепторов
- 8. Рецепторы – ионные каналы P2X рецепторы состоят
- 9. Рецепторы, сопряженные с G-белками Более 1000 рецепторов
- 10. G-белки Связывают GTP и GDP. G-белки состоят
- 11. Регуляция аденилатциклазы αs-субъединица активирует, а αi-субъединица ингибирует
- 12. Активация фосфолипазы С Активация рецепторов, сопряженных с
- 13. Протеинкиназы Протеинкиназы – ферменты переносящие γ-фосфатный остаток
- 14. Протеинкиназа А Тетрамер, состоящий из двух регуляторных
- 15. Протеинкиназы С Мономеры, включающие каталитический (на С-конце)
- 16. Протеинкиназа II Состоит из 10-12 субъединиц, кодируемых
- 17. Фосфатазы Ферменты, отщепляющие остатки фосфата (присоединенные киназами)
- 18. Свойства фосфатазы-1 и кальценеврина Фосфатаза-1 имеет натуральный
- 19. DARPP-32 и молекулярный механизм интеграции DARPP-32 фосфопротеин
- 20. Роль вторичных посредников Вторичные посредники cAMP и
- 21. Интерфейс между цитоплазмой и ядром Длительное сохранение
- 22. CREB CREB – ядерный белок, регулируемый цАМФ.
- 23. CREB и AP-1 интегрируют сигналы с cAMP
- 24. Факторы быстрого ответа Белки быстрого ответа способны
- 25. Природа классических медиаторов Медиаторы – сигнальные молекулы.
- 26. КРИТЕРИИ МЕДИАТОРА Чтобы субстанция выполняла функцию медиатора
- 27. КЛАССИФИКАЦИЯ МЕДИАТОРОВ Аминокислоты (ГАМК, аспартат, глутамат, глицин,
- 28. МЕТАБОЛИЧЕСКАЯ ПРИРОДА МЕДИАТОРОВ
- 29. КОНЦЕНТРАЦИИ (ПОРЯДКИ) РАЗЛИЧНЫХ МЕДИАТОРОВ В МОЗГЕ
- 30. ПРИНЦИП ДЕЙЛА Согласно Дейлу химическая природа медиатора,
- 31. Обратные медиаторы Осуществляют обратную связь в синапсе
- 32. Окись азота Отличается от классических медиаторов тем,
- 33. Синтез окиси азота Газ, который синтезируется из
- 34. Функции NO в мозге В мозге nNOS
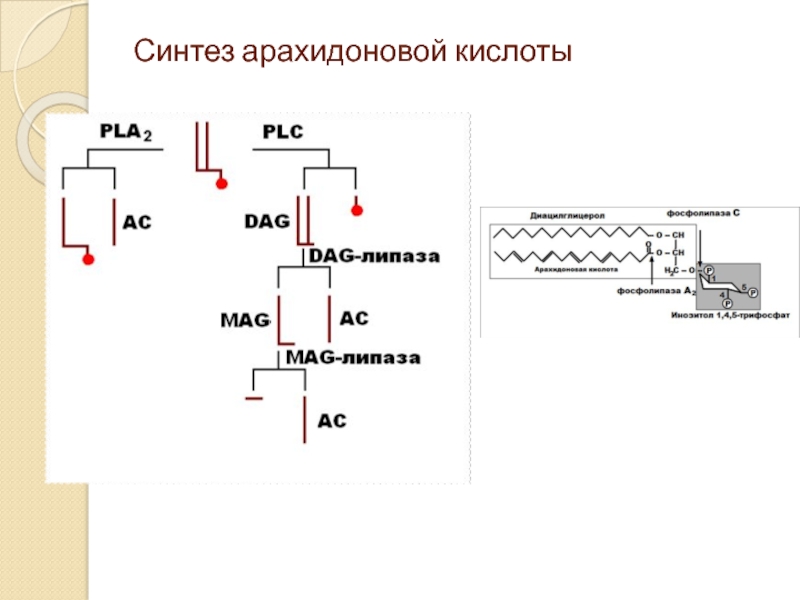
- 35. Синтез арахидоновой кислоты
- 36. Эндогенные канабиноиды Производные арахидоновой к-ты, анандамид и
- 37. Заключение Интерфейс нейрона перекодирует информацию, содержащуюся в
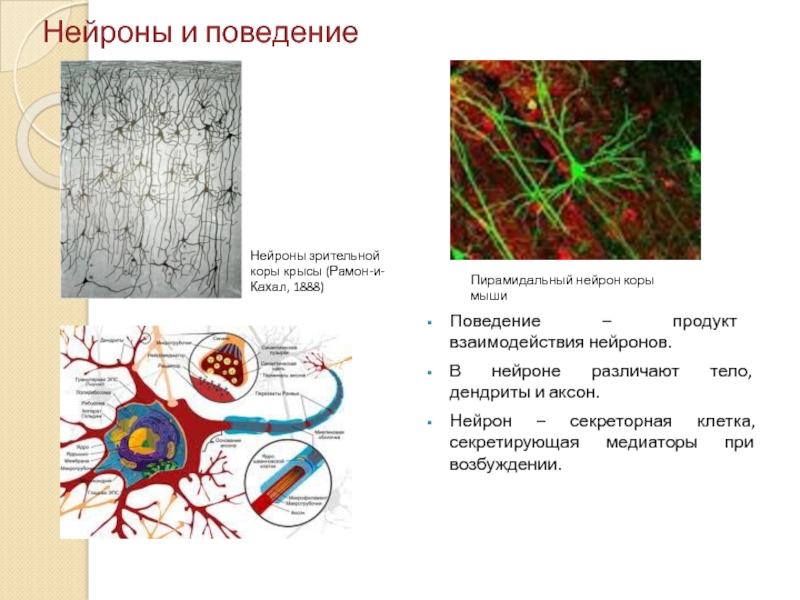
Слайд 2Нейроны и поведение
Поведение – продукт взаимодействия нейронов.
В нейроне различают тело, дендриты
Нейрон – секреторная клетка, секретирующая медиаторы при возбуждении.
Нейроны зрительной
коры крысы (Рамон-и-
Кахал, 1888)
Пирамидальный нейрон коры мыши
Слайд 3Синаптическая и объемная коммуникации
Синаптическая коммуникация осуществляется с помощью специализированной структуры –
При объемной коммуникации медиатор секретируется в межклеточное пространство и взаимодействует с множеством нейронов. Это обеспечивает параллельное управление.
Слайд 4Молекулярная структура интерфейса:
В организме клетки являются изолированными объектами, которые взаимодействуют через
Молекулярный интерфейс включает сигнальные молекулы, их рецепторы и сопряженные с ними ферменты.
Рецепторы сигнальных молекул являются основным компонентом интерфейса, обеспечивающим декодирование информации, содержащейся в пакете сигнальных молекул.
Различают следующие типы мембранных рецепторов :
Рецепторы трофических факторов и цитокинов (один трансмембранный домен).
Управляемые лигандом ионные каналы (2 или 4 трансмембранных домена).
Сопряженные с G-белками (7 трансмембранных домена).
Слайд 5Рецепторы цитокинов и факторов роста
Включают рецепторный, трансмембранный и внутриклеточный домены. Различают:
Присоединение лиганда сопровождается димеризацией с последующей активацией за счет автофосфорилирования.
Слайд 8Рецепторы – ионные каналы
P2X рецепторы состоят из 3 субъединиц, включающих 2
Рецепторы глутамата, ГАМК, ацетилхолина и серотонина состоят из 4 (глутамат) или 5 (остальные) субъединиц, включающих 4 трансмембранных домена. Субъединицы образуют ионный канал в норме закрытый. При активации ионный канал открывается и пропускает ионы Na+ (ацетилхолин, серотонин), Cl- (ГАМК-А) или Ca2+ / Na+ (NMDA, AMPA).
Вызывают быструю де- или гиперполяризацию мембраны.
Входящий ток Na+ открывает каналы Ca2+, который является внутриклеточным посредником в трансдукции сигнала.
Слайд 9Рецепторы, сопряженные с G-белками
Более 1000 рецепторов медиаторов, гормонов, света, вкуса, запаха.
Семь
Третья цитоплазматическая петля и COOH конец сопряжены с G-белком.
Механизм трансдукции сигнала определяется природой G-белка.
Отмечена конститутивная активность рецепторов в отсутствии лиганда. Лиганд только усиливает гидролиз G-белка.
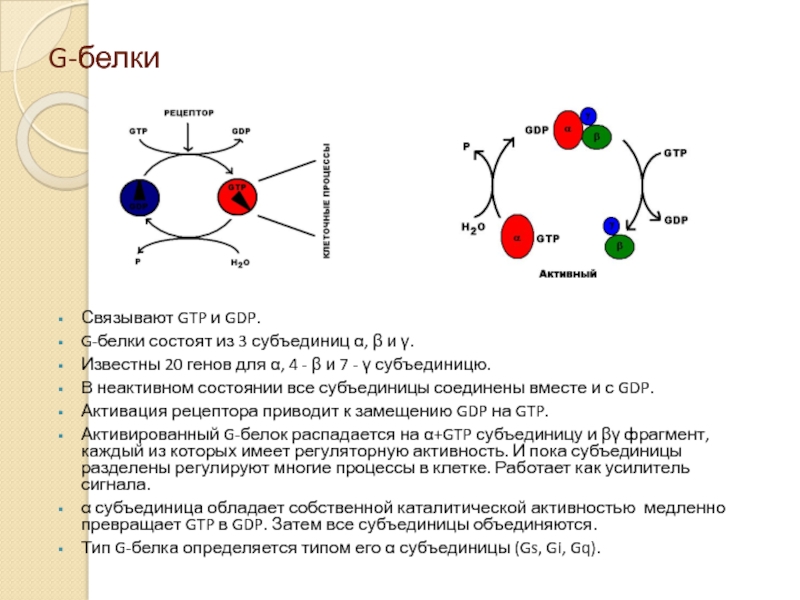
Слайд 10G-белки
Связывают GTP и GDP.
G-белки состоят из 3 субъединиц α, β и
Известны 20 генов для α, 4 - β и 7 - γ субъединицю.
В неактивном состоянии все субъединицы соединены вместе и с GDP.
Активация рецептора приводит к замещению GDP на GTP.
Активированный G-белок распадается на α+GTP субъединицу и βγ фрагмент, каждый из которых имеет регуляторную активность. И пока субъединицы разделены регулируют многие процессы в клетке. Работает как усилитель сигнала.
α субъединица обладает собственной каталитической активностью медленно превращает GTP в GDP. Затем все субъединицы объединяются.
Тип G-белка определяется типом его α субъединицы (Gs, Gi, Gq).
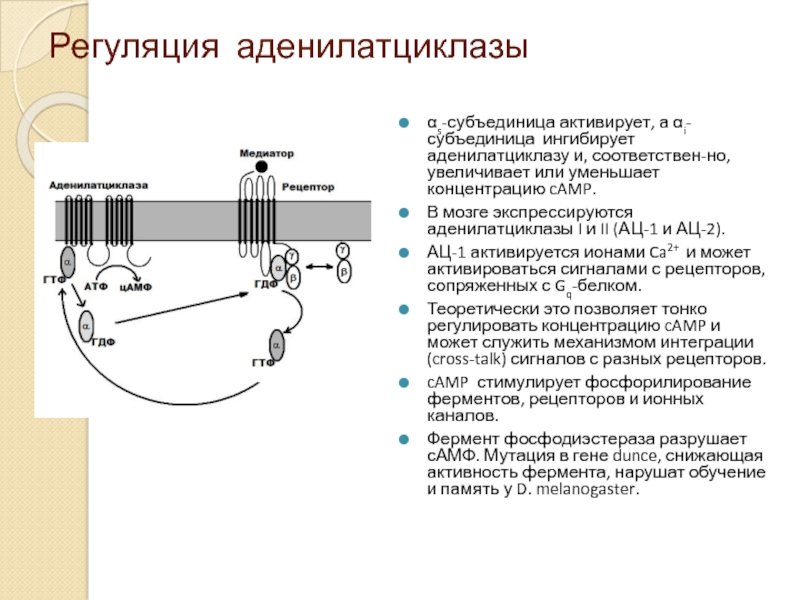
Слайд 11Регуляция аденилатциклазы
αs-субъединица активирует, а αi-субъединица ингибирует аденилатциклазу и, соответствен-но, увеличивает или
В мозге экспрессируются аденилатциклазы I и II (АЦ-1 и АЦ-2).
АЦ-1 активируется ионами Ca2+ и может активироваться сигналами с рецепторов, сопряженных с Gq-белком.
Теоретически это позволяет тонко регулировать концентрацию cAMP и может служить механизмом интеграции (cross-talk) сигналов с разных рецепторов.
cAMP стимулирует фосфорилирование ферментов, рецепторов и ионных каналов.
Фермент фосфодиэстераза разрушает сАМФ. Мутация в гене dunce, снижающая активность фермента, нарушат обучение и память у D. melanogaster.
Слайд 12Активация фосфолипазы С
Активация рецепторов, сопряженных с Gq-белком, вызывает активацию фосфолипазы С.
Это
IP3 активирует внутриклеточ-ные рецепторы и вызывает освобождение Ca2+.
Вызывает стимуляцию нейрона.
Слайд 13Протеинкиназы
Протеинкиназы – ферменты переносящие γ-фосфатный остаток от ATP на гидроксильные остатки
Обычно фосфорилирование активирует белки.
Основные сериновые протеинкиназы:
Протеинкиназа А, регулируемая cAMP.
Протеинкиназа С, регулируемая Ca2+.
Кальций, кальмодулин зависимая протеинкиназа II.
Слайд 14Протеинкиназа А
Тетрамер, состоящий из двух регуляторных и двух каталитических субъединиц.
Регуляторные субъединицы
Присоединение четырех молекул cAMP приводит к диссоциации каталитических субъединиц и их активации.
Активированные каталитические субъединицы фосфорилируют белки-мишени.
Снижение концентрации cAMP в результате ее гидролиза фосфодиэстеразами приводит к воссоединению субъединиц и деактивации фермента.
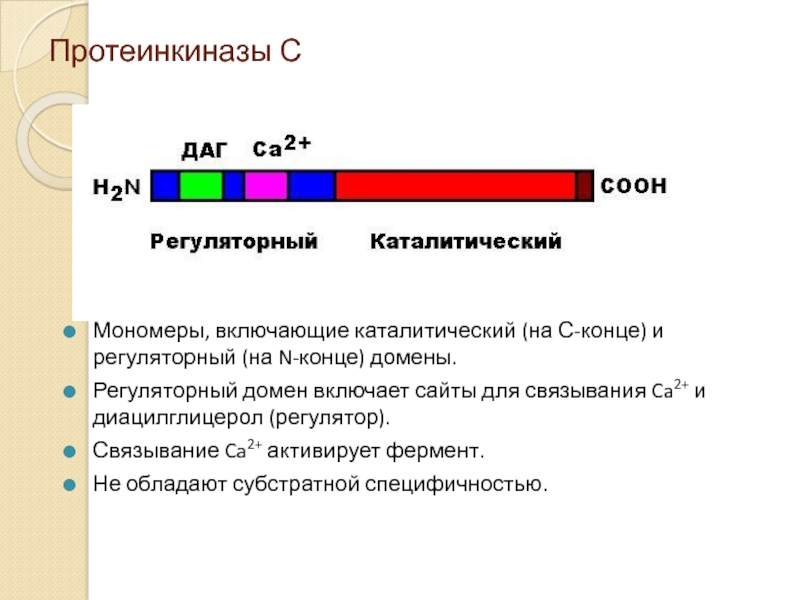
Слайд 15Протеинкиназы С
Мономеры, включающие каталитический (на С-конце) и регуляторный (на N-конце) домены.
Регуляторный
Связывание Ca2+ активирует фермент.
Не обладают субстратной специфичностью.
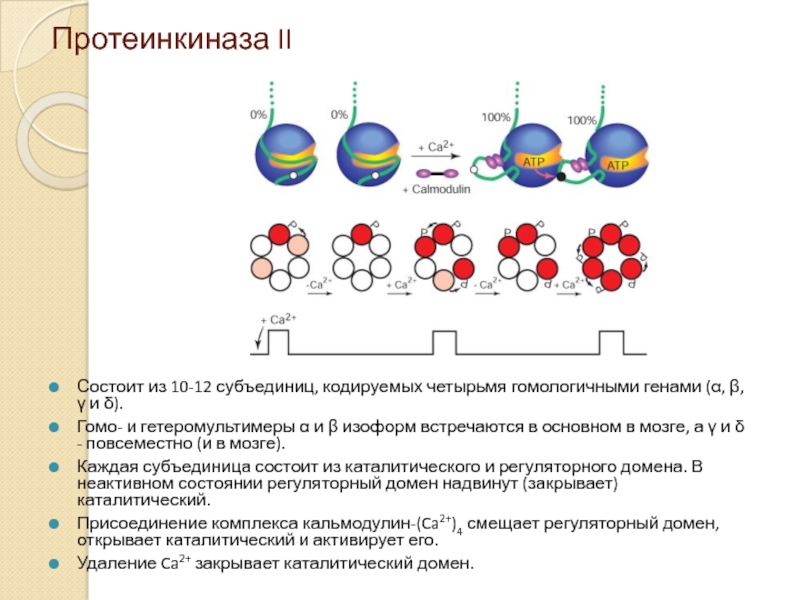
Слайд 16Протеинкиназа II
Состоит из 10-12 субъединиц, кодируемых четырьмя гомологичными генами (α, β,
Гомо- и гетеромультимеры α и β изоформ встречаются в основном в мозге, а γ и δ - повсеместно (и в мозге).
Каждая субъединица состоит из каталитического и регуляторного домена. В неактивном состоянии регуляторный домен надвинут (закрывает) каталитический.
Присоединение комплекса кальмодулин-(Ca2+)4 смещает регуляторный домен, открывает каталитический и активирует его.
Удаление Ca2+ закрывает каталитический домен.
Слайд 17Фосфатазы
Ферменты, отщепляющие остатки фосфата (присоединенные киназами) от молекул. Осуществляют функцию противоположную
В клетке прикреплены к белковым регуляторам.
Основные фосфатазы в нейроне:
Фосфатаза 1.
Фосфатаза 2А.
Фосфатаза 2B или кальценеврин.
Слайд 18Свойства фосфатазы-1 и кальценеврина
Фосфатаза-1 имеет натуральный белок-ингибитор: DARPP-32 (дофамин и цАМФ
Кальценеврин – тетрамер (2А и 2B субъединицы).
Имеет центр связывания Ca2+-КМ комплекса. Частичная активация при присоединении Ca2+, а сильная – при связывании комплекса Ca2+-КМ.
Слабая и низкочастотная стимуляция активирует преимущественно кальценеврин, а сильная и высокочастотная – кальценеврин и ПК-II.
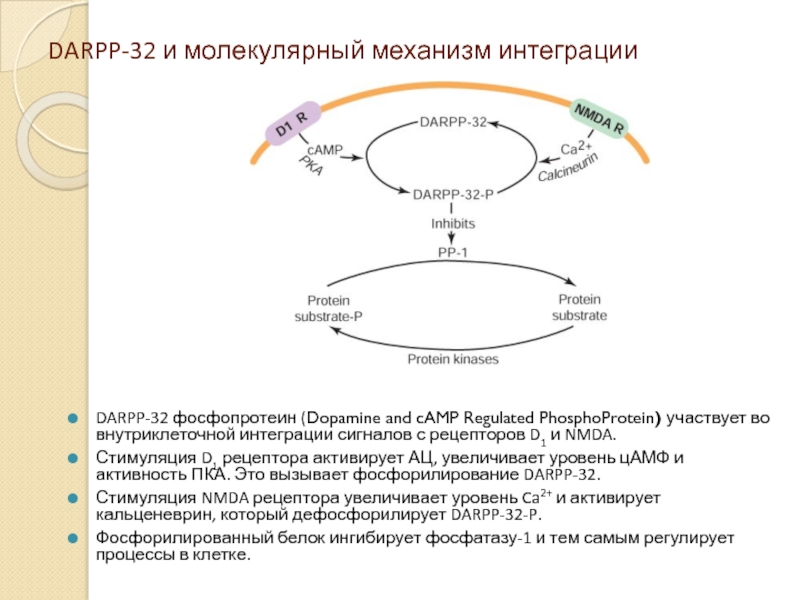
Слайд 19DARPP-32 и молекулярный механизм интеграции
DARPP-32 фосфопротеин (Dopamine and cAMP Regulated PhosphoProtein)
Стимуляция D1 рецептора активирует АЦ, увеличивает уровень цАМФ и активность ПКА. Это вызывает фосфорилирование DARPP-32.
Стимуляция NMDA рецептора увеличивает уровень Ca2+ и активирует кальценеврин, который дефосфорилирует DARPP-32-P.
Фосфорилированный белок ингибирует фосфатазу-1 и тем самым регулирует процессы в клетке.
Слайд 20Роль вторичных посредников
Вторичные посредники cAMP и Ca2+ осуществляют связь между мембранными
Любой сигнал с рецептора перекодируется в концентрации этих соединений.
Регуляторную функцию вторичные посредники осуществляют через активацию протеинкиназ и протеинфосфатаз.
Активированные киназы и фосфатазы изменяют функциональные свойства и активность ферментов, рецепторов и ионных каналов.
Протеинкиназы и фосфатазы участвуют в клеточных механизмах кратковременной памяти и интеграции.
Слайд 21Интерфейс между цитоплазмой и ядром
Длительное сохранение изменений, необходимое для физиологических последствий,
Вторичные посредники, изменяя функцию клетки, не могут непосредственно влиять на экспрессию генов.
Имеется интерфейс, передающий изменения в цитоплазме ядру.
Он включает третичные посредники – белковые транскрипционные факторы.
Эти белки связываются специфическими участками ДНК и взаимодействуя с РНК полимеразой II инициируют транскрипцию.
Наиболее известны транскрипционные факторы CREB и AP-1. Белки быстрого ответа Fos, Fra, Jun.
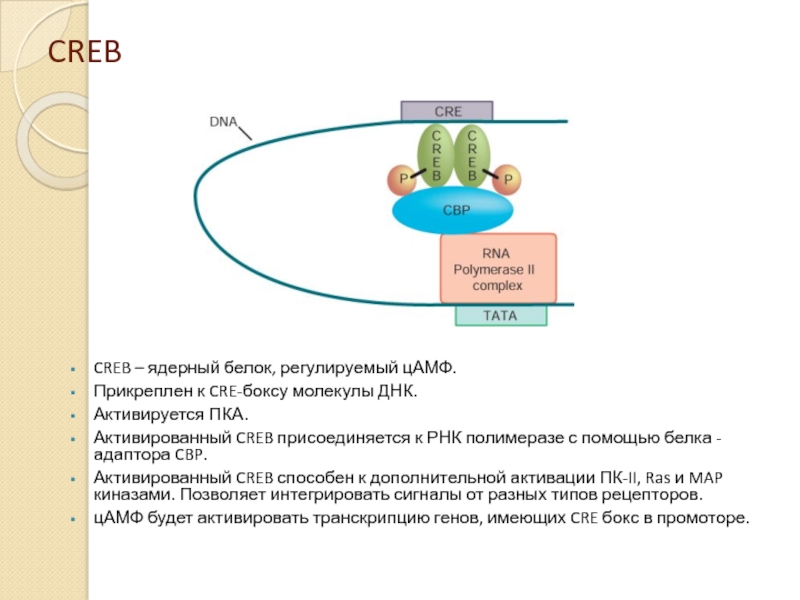
Слайд 22CREB
CREB – ядерный белок, регулируемый цАМФ.
Прикреплен к CRE-боксу молекулы ДНК.
Активируется ПКА.
Активированный
Активированный CREB способен к дополнительной активации ПК-II, Ras и MAP киназами. Позволяет интегрировать сигналы от разных типов рецепторов.
цАМФ будет активировать транскрипцию генов, имеющих CRE бокс в промоторе.
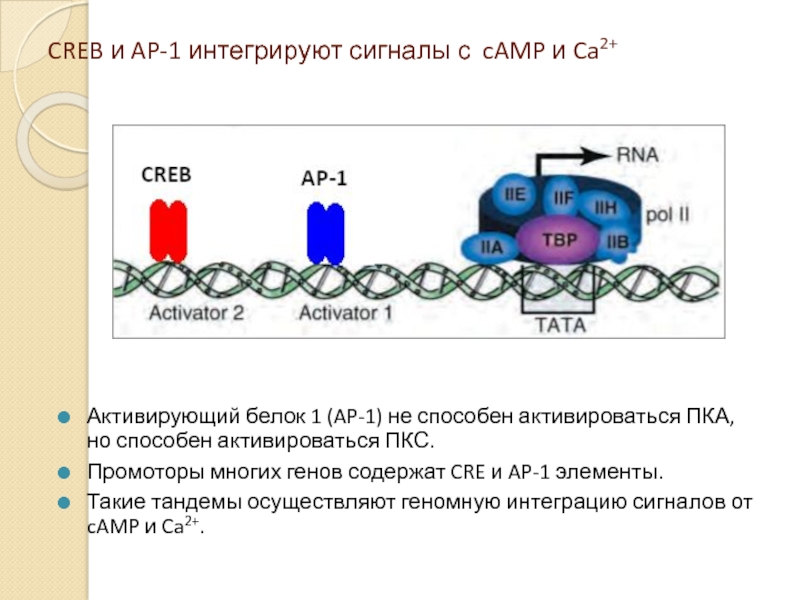
Слайд 23CREB и AP-1 интегрируют сигналы с cAMP и Ca2+
Активирующий белок 1
Промоторы многих генов содержат CRE и AP-1 элементы.
Такие тандемы осуществляют геномную интеграцию сигналов от cAMP и Ca2+.
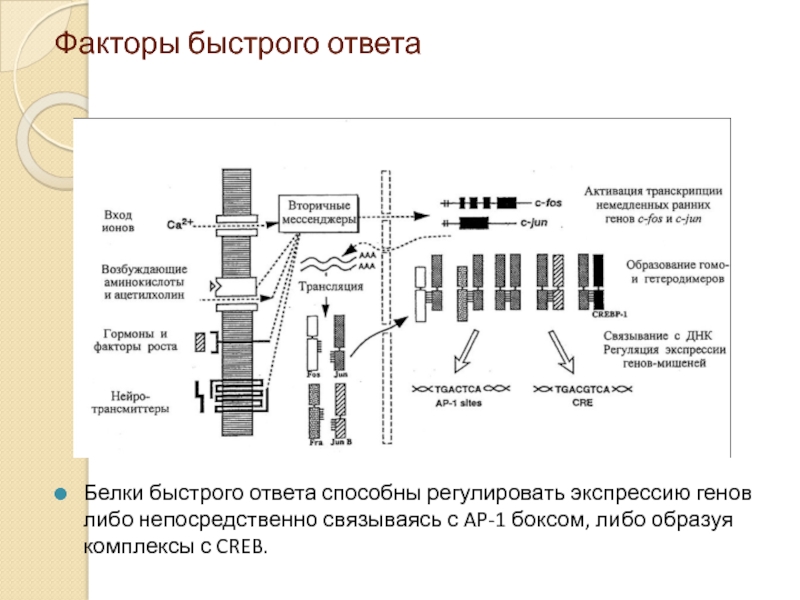
Слайд 24Факторы быстрого ответа
Белки быстрого ответа способны регулировать экспрессию генов либо непосредственно
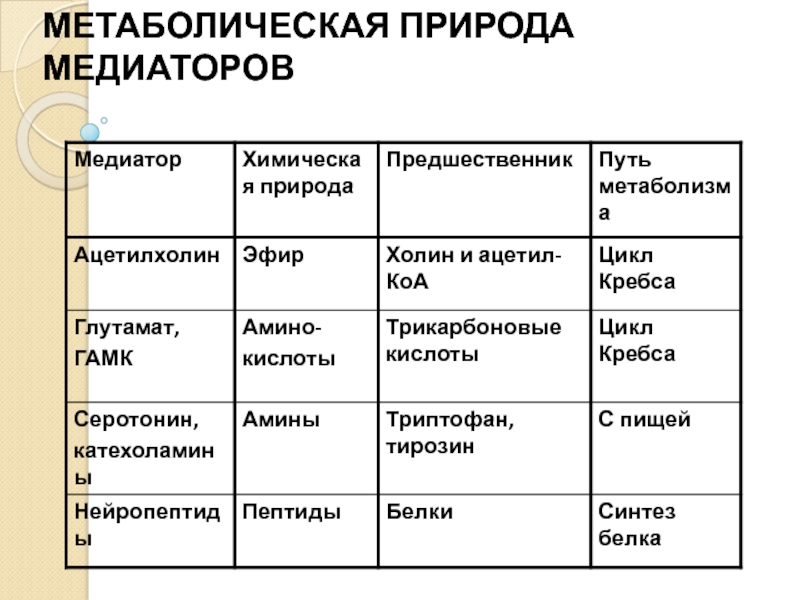
Слайд 25Природа классических медиаторов
Медиаторы – сигнальные молекулы.
Сигнальная связь между молекулой и функцией
Сигнальное значение молекулы определяется в ходе эволюции и онтогенеза.
Медиатором может быть любая молекула, для которой в ходе эволюции созданы механизмы синтеза, рецепции и трансдукции, то есть интерфейс.
Функция медиатора определяется стадией онтогенеза и тканью.
Слайд 26КРИТЕРИИ МЕДИАТОРА
Чтобы субстанция выполняла функцию медиатора необходимо:
1. Существование в мозге системы
2. Депонирование субстанции в везикулы и транспортировка везикул в места секреции.
3. Секреция субстанции Ca+2 -зависимым экзоцитозом при деполяризации окончания.
4. Воздействие на постсинаптические рецепторы и уровень вторичных посредников (отличает медиатор от модулятора).
5. Удаление субстанции из синаптической щели.
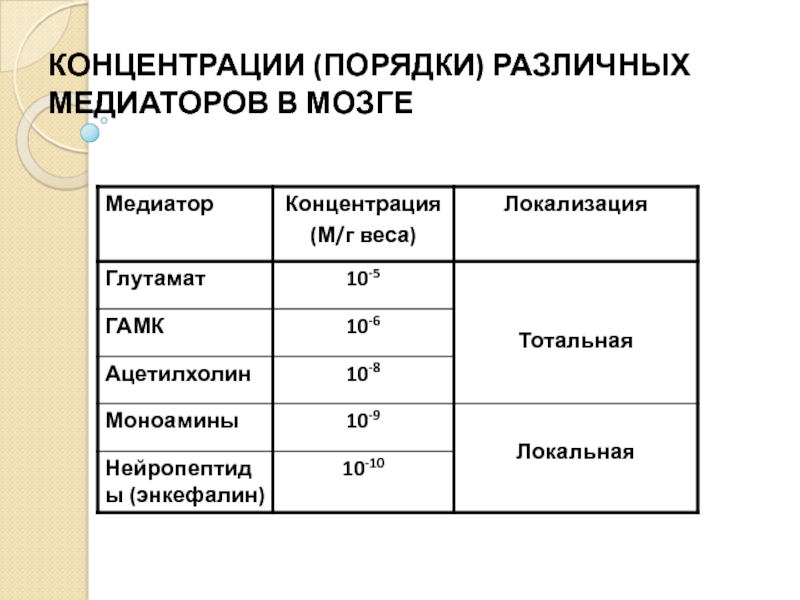
Слайд 27КЛАССИФИКАЦИЯ МЕДИАТОРОВ
Аминокислоты (ГАМК, аспартат, глутамат, глицин, гистамин, таурин).
Ацетилхолин.
Моноамины (адреналин, норадреналин, дофамин,
Пептиды (>2000).
Пурины (аденозин, АМФ, АДФ, АТФ и др.).
Слайд 30ПРИНЦИП ДЕЙЛА
Согласно Дейлу химическая природа медиатора, секретируемого из различных окончаний одного
Большинство нейронов секретируют несколько медиаторов, обычно небелковый и белковый. Основная субстанция называется медиатором, а сопутствующая – комедиатором.
Процентный состав смеси медиаторов может варьировать от физиологического состояния нейрона.
Может ли состав смеси медиаторов быть индивидуальным маркером нейрона, выделять конкретный нейрон из множества ему подобных?
Слайд 31Обратные медиаторы
Осуществляют обратную связь в синапсе когда постсинаптический нейрон информирует пресинаптический
Несмотря на то, что обратные медиаторы нарушают большинство из критериев, предъявляемых к медиаторам. Однако эти соединения участвуют в межнейрональной коммуникации и выполняют медиаторную функцию – позволяют одному нейрону управлять процессами в другом.
Наиболее известными и важными обратными медиаторами являются окись азота и производные арахидоновой кислоты.
Слайд 32Окись азота
Отличается от классических медиаторов тем, что:
Будучи газом она не депонируется
Не выделяется экзоцитозом, а диффундирует в другие нейроны-мишени.
4. Не действует на постсинаптические рецепторы и не изменяет концентрации вторичных посредников. Вместо этого она необратимо связывается со многими белками и модифицирует их активность).
5. Не имеется механизма инактивации окиси азота.
Слайд 33Синтез окиси азота
Газ, который синтезируется из L-аргинина. Синтез NO катализируется ферментами
NOS – самые регулируемые ферменты. Используют 3 различных доноров электронов: NADPH, FMN и FAD. Имеют сайт связывания Ca+2-кальмодулина.
Кальмодулин активирует NOS. Фосфорилирование ПКА, ПКС или ПК-II ингибирует NOS.
iNOS (NOS2) индуцибельная NOS резка увеличивает экспрессию при воспалении и стимуляции неспецифического иммунитета.
Слайд 34Функции NO в мозге
В мозге nNOS обнаружена исключительно в нейронах.
Около 2%
В гиппокампе NOS не содержится в пирамидальных нейронах, но в гранулярных.
Многие ГАМК нейроны коры содержат NOS.
NO является активатором растворимой гуанилатциклазы (аналога аденилатциклазы) и вызывает увеличение концентрации вторичного посредника цГМФ (аналогичного цАМФ).
Кроме того NO активирует транскрипционный фактор NF-kB.
Формирование долговременной потенциации в гипокампе. Нитроаргинин блокирует потенциацию.
Нейротоксичность, связанная с глутаматом.
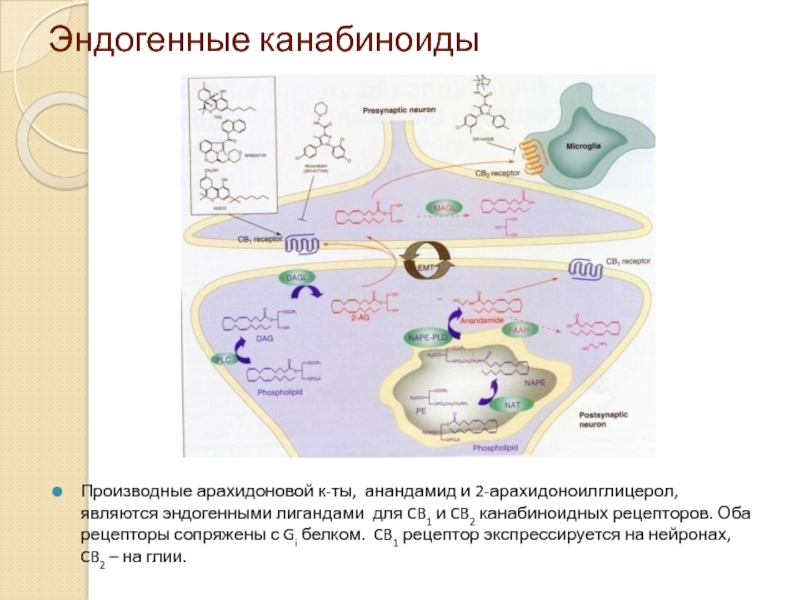
Слайд 36Эндогенные канабиноиды
Производные арахидоновой к-ты, анандамид и 2-арахидоноилглицерол, являются эндогенными лигандами для
Слайд 37Заключение
Интерфейс нейрона перекодирует информацию, содержащуюся в пакетах медиаторов, в активность различных
Комплексы мембранных рецепторов с одним трансмембранным доменом активируют факторы транскрипции.
Рецепторы с двумя, четырьмя и семью трансмембранными доменами изменяют концентрацию вторичных посредников и, через активацию протеинкиназ, активируют факторы транскрипции.
Ряд генов быстрого ответа являются транскрипционными факторами.
Взаимодействие регуляторных белков осуществляет интеграцию сигналов на уровне клетки.