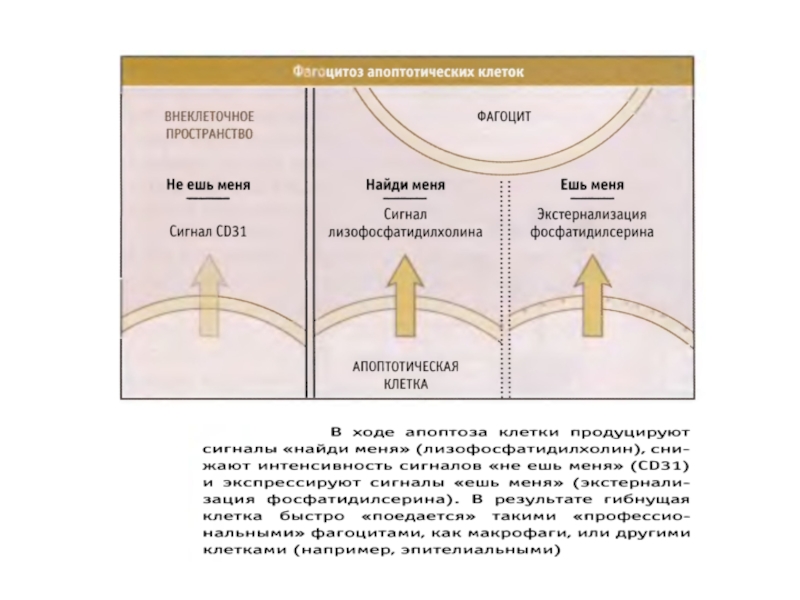
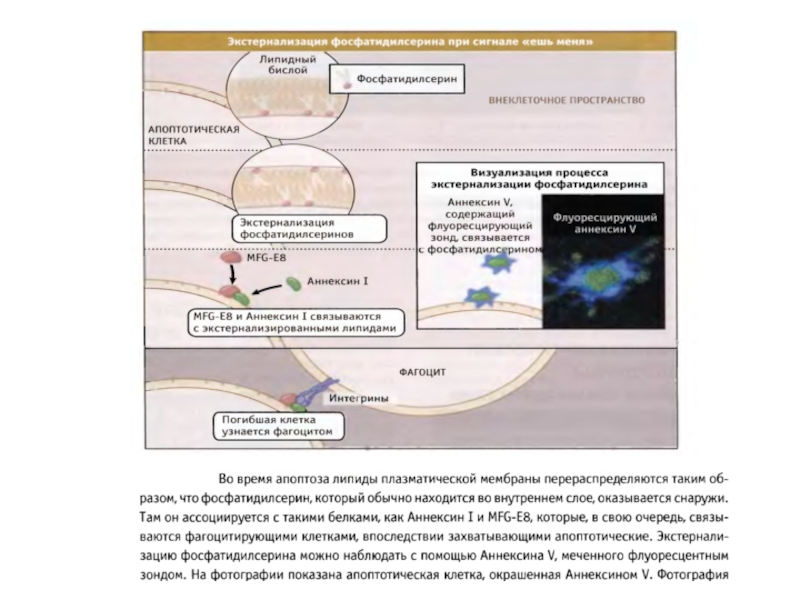
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Молекулярные механизмы апоптоза презентация
Содержание
- 1. Молекулярные механизмы апоптоза
- 2. «Апоптоз– это запрограммированный процесс уничтожения клетки,
- 3. Термин «апоптоз» впервые введен в 1972 г.
- 6. Морфологические изменения клеток в процессе апоптоза
- 7. Сидней Бреннер Джон Салстон Роберт Хорвиц Нобелевская
- 8. Представляя работы Бреннера,
- 9. В знак заслуг Бреннера и его пионерской
- 10. «Когда мы разгадаем червя - мы поймем
- 11. Р. Хорвиц открыл генетическую основу регуляции апоптоза
- 12. Выделяют 4 вида программированной гибели клеток (ПГК),
- 13. Аутофагия
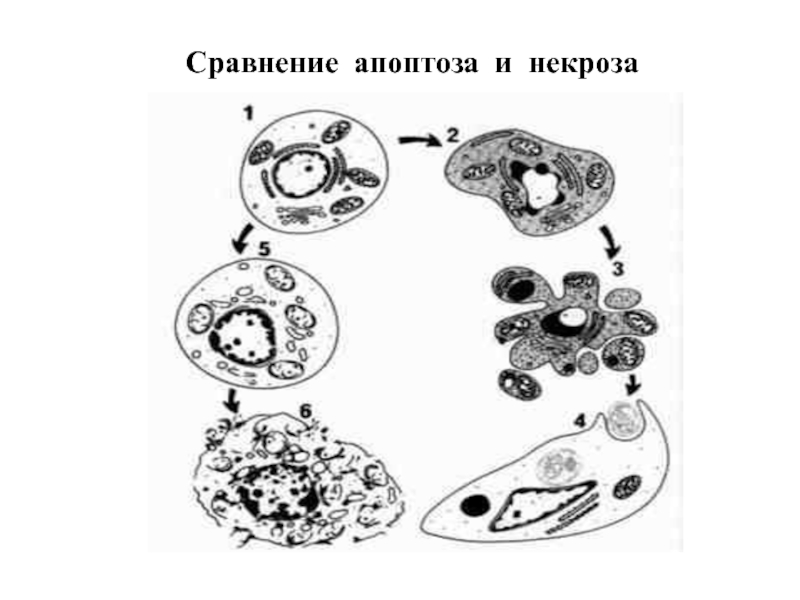
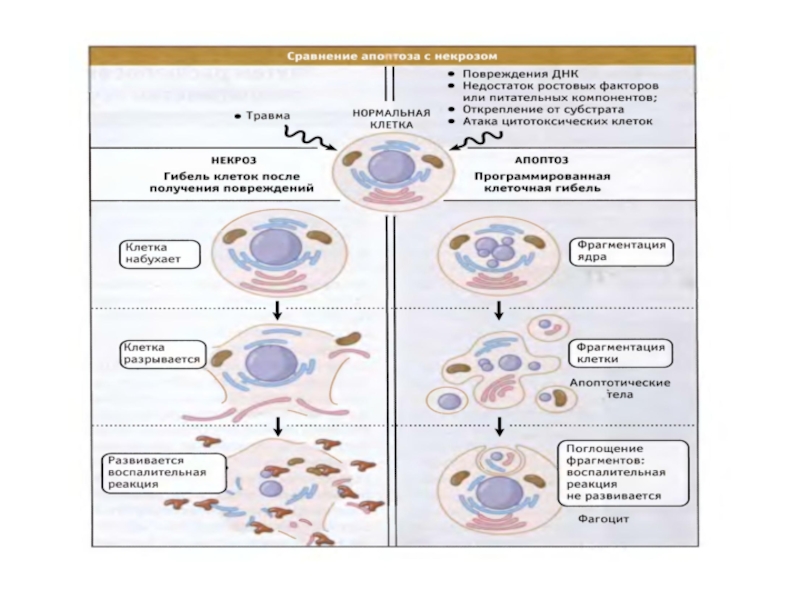
- 14. Сравнение апоптоза и некроза
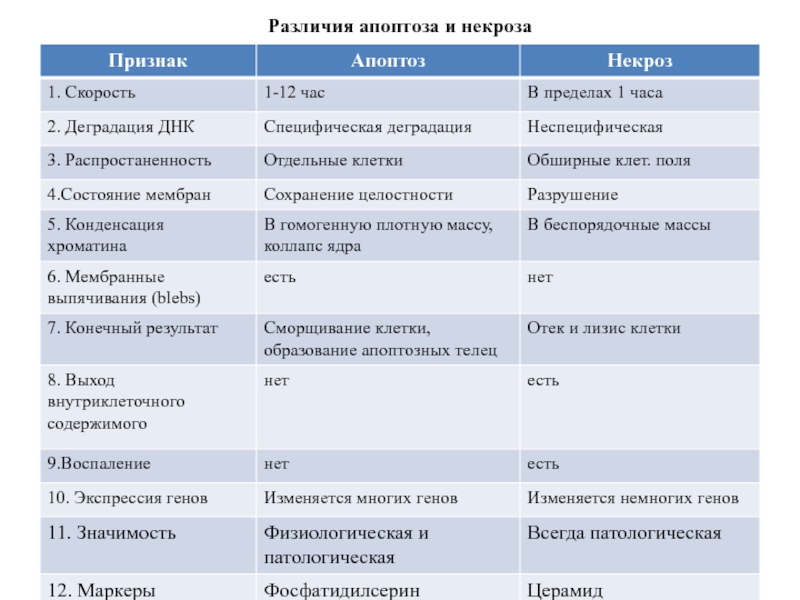
- 15. Различия апоптоза и некроза
- 18. Апоптоз эпителиальных клеток и кардиомицита: «пузырение», образование
- 19. Блеббинг плазматической мембраны лимфоцита: на снимке зафиксированы
- 20. Апоптоз лейкоцитов
- 21. Программированная гибель
- 22. 1. Апоптоз - фундаментальный процесс физиологического
- 23. Роль апоптоза
- 25. В организме среднестатистического взрослого человека в результате
- 26. При описании каких процессов
- 27. Индукция апоптоза
- 29. Апоптоз – эволюционно консервативный процесс Апоптоз
- 32. Стадии апоптоза 1.Индукция апоптоза: рецепция сигнала и
- 33. Индукция апоптоза : Главные пути: 1.Митохондриальный (
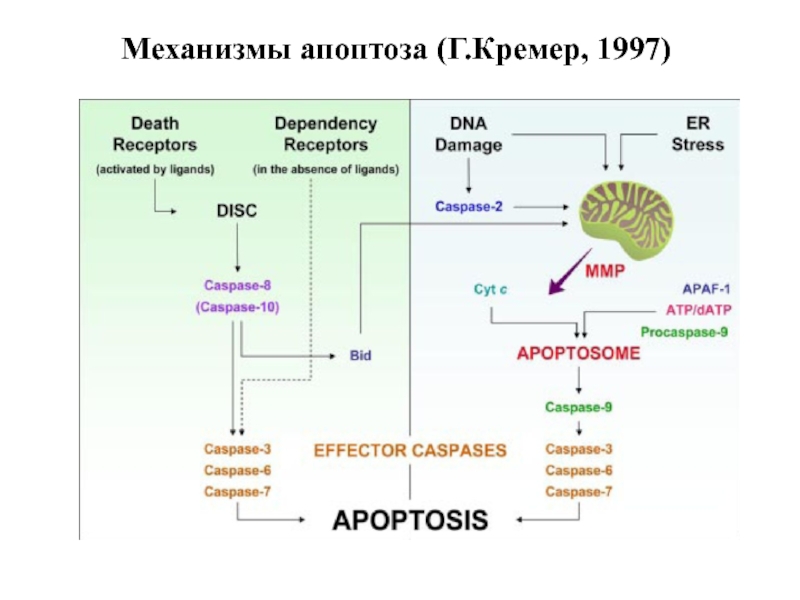
- 34. Механизмы апоптоза (Г.Кремер, 1997)
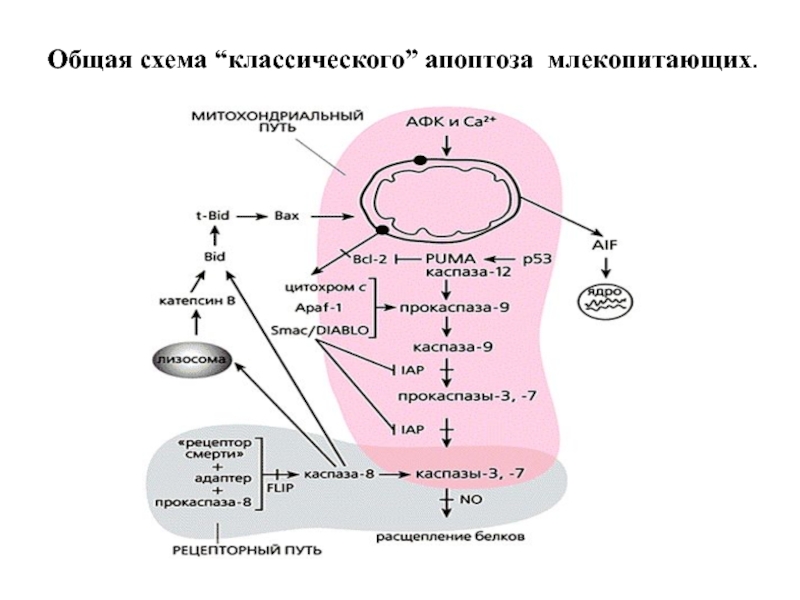
- 35. Общая схема “классического” апоптоза млекопитающих.
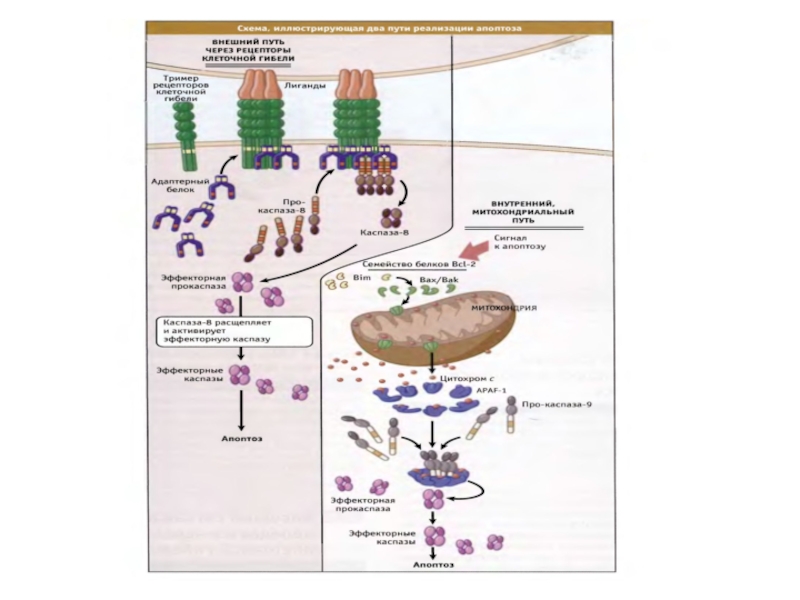
- 37. Две сигнальные платформы для активации каскадов каспаз
- 38. APOPTOSIS APOPTOSIS PYROPTOSIS & INFLAMMATION Cytochrome C
- 39. Общая характеристика каспаз: Каспазы – цистеин содержащие
- 40. Каспазы (caspase-cysteine-dependent aspartat specific protease) : 1.Каспазы
- 41. Структура каспаз Прокаспазы представлены мономерами, которые содержат
- 44. Активация инициаторных каспаз происходит по механизму индуцированного
- 46. Активация инициаторных каспаз (8, 9 и 2) Stefan J. Riedl and Guy S. Salvesen; 2007
- 47. Активация эффекторных каспаз 1.Эффекторные каспазы (-7,-3,-6) присутствуют
- 49. Активация эффекторных каспаз (3, 6 и 7) Stefan J. Riedl and Guy S. Salvesen; 2007
- 50. Структура каспаз. Каспазы – цистеиновые аспартат-специфичные протеазы
- 51. Классификация, строение и процесс активации каспаз двух типов: инициаторной и эффекторной.
- 52. В 1990—2000-е годы
- 55. Белки
- 56. Белковые ингибиторы апоптоза (IAPs) блокируют действие каспаз
- 57. Подобные SMAC вещества (пептиды или низкомолекулярные органические
- 58. Митохондрии выполняют роль «контрольно-пропускного пункта» апоптотического сигнала
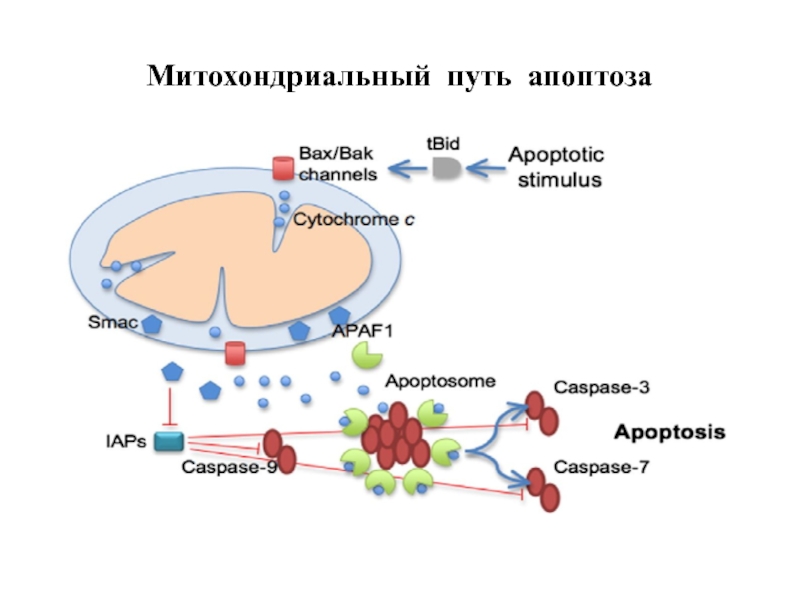
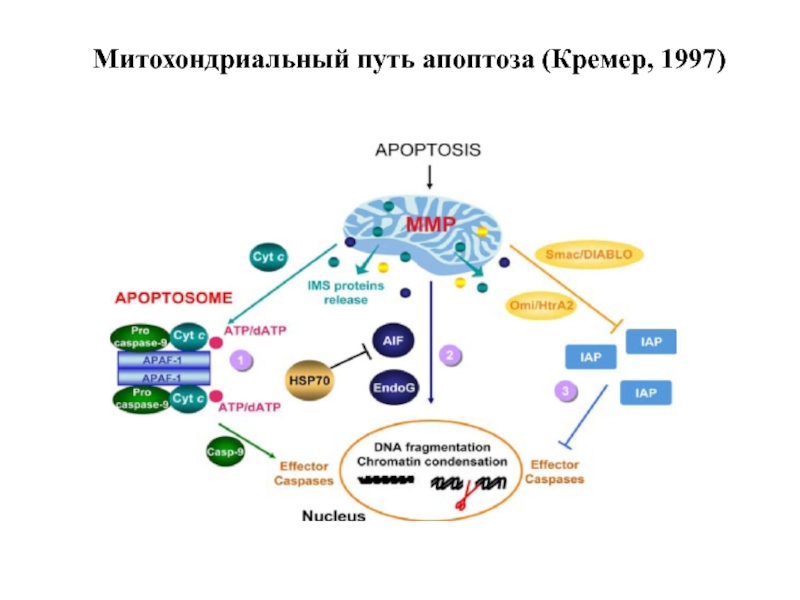
- 61. Митохондриальный путь апоптоза
- 62. Митохондриальный путь апоптоза (Кремер, 1997)
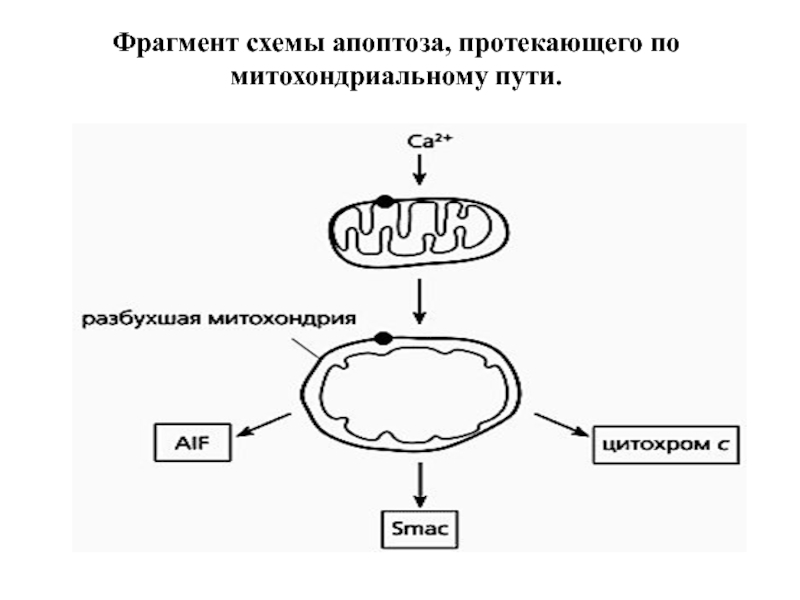
- 64. Фрагмент схемы апоптоза, протекающего по митохондриальному пути.
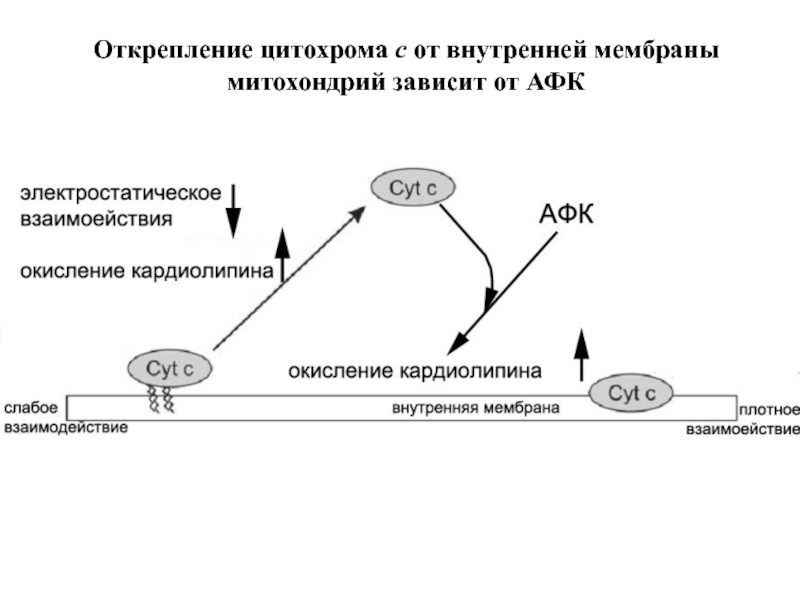
- 65. Открепление цитохрома с от внутренней мембраны митохондрий зависит от АФК
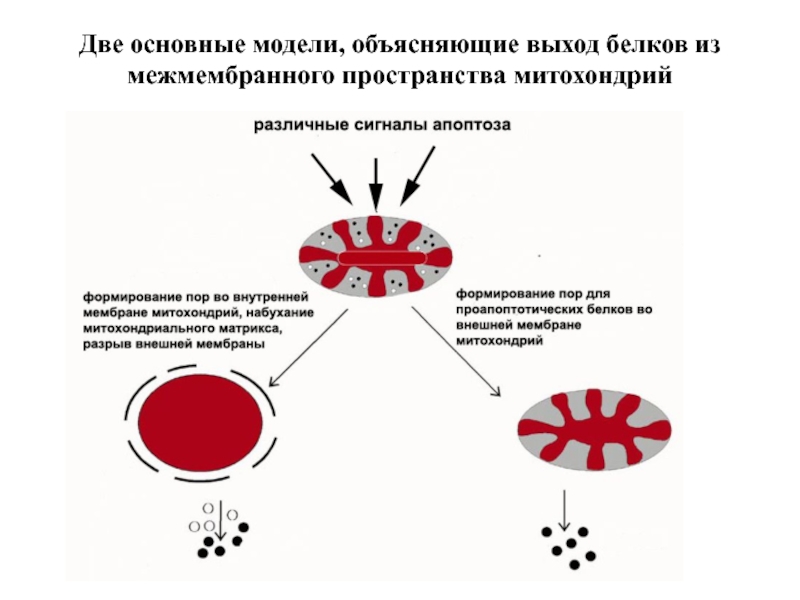
- 66. Две основные модели, объясняющие выход белков из межмембранного пространства митохондрий
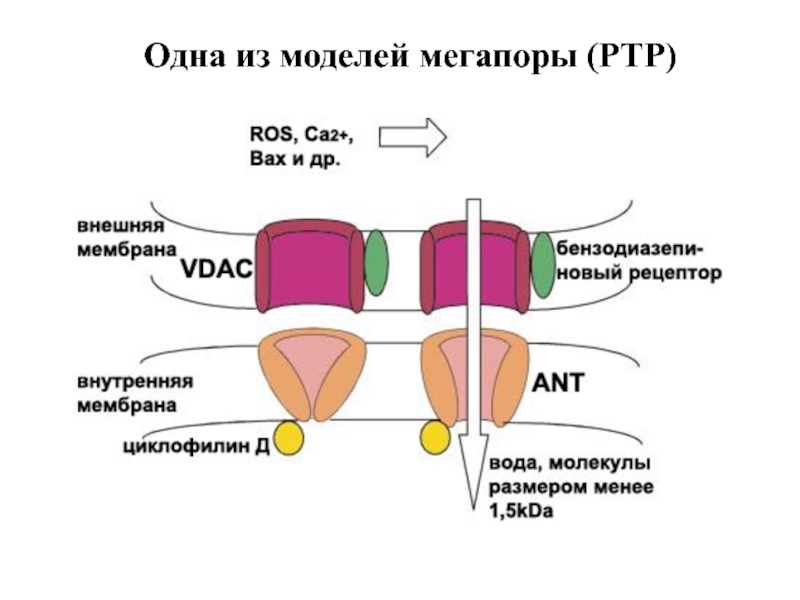
- 67. Одна из моделей мегапоры (PTP)
- 68. Возможные механизмы обеспечения проницаемости внешней мембраны Bax/Bak и Bax/tBid
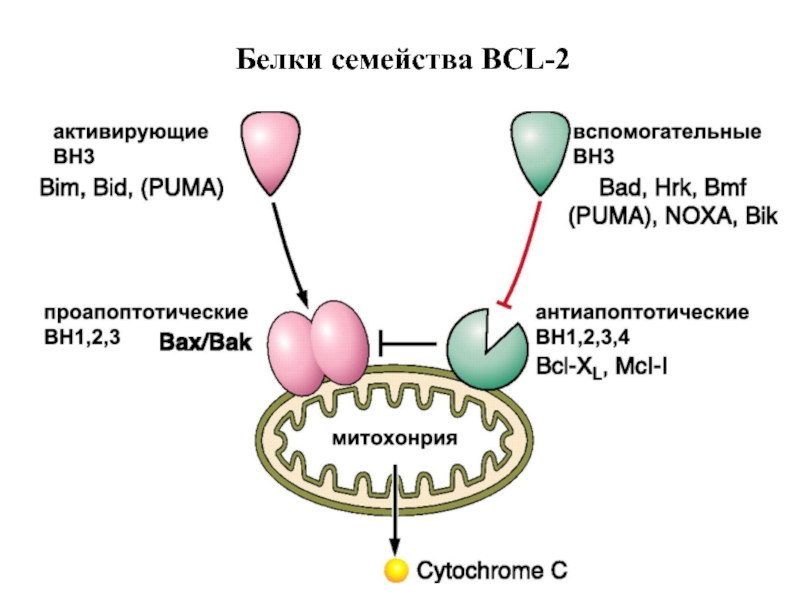
- 70. Белки сем Bcl-2 участвуют в апоптозе Белки
- 71. Bcl-2. Перенос его
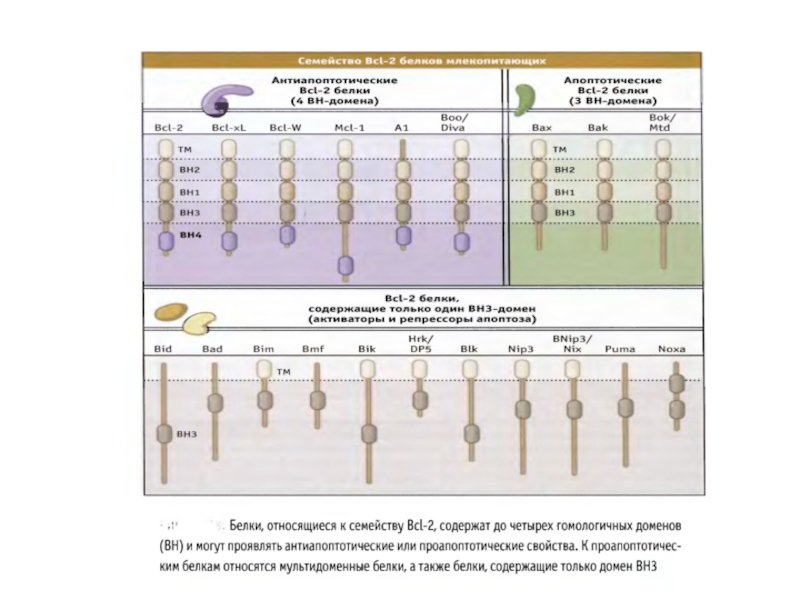
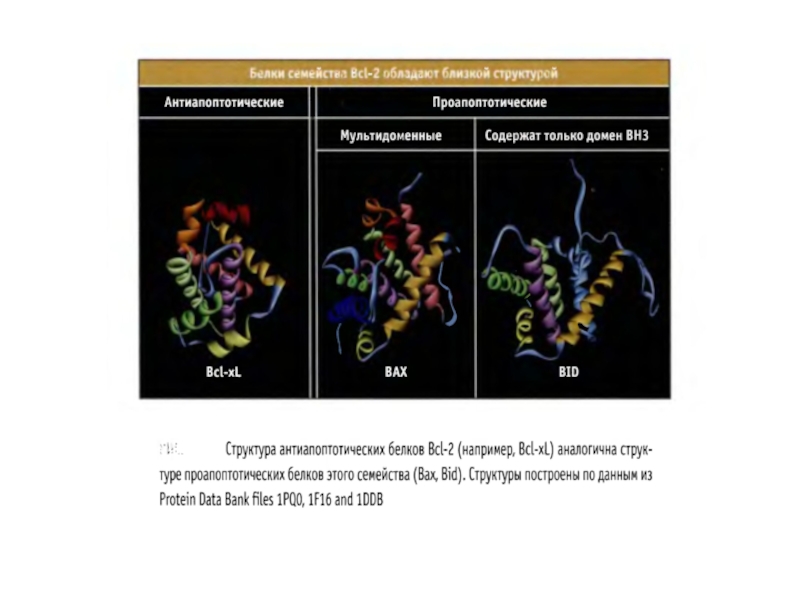
- 73. Белки семейства BCL-2
- 81. Фрагмент схемы апоптоза, протекающего под контролем белков семейства Bcl-2, а также с участием p53.
- 82. Митохондриальные белки, вызывающие фрагментацию ДНК независимо от каспаз Эндонуклеаза G AIF(Apoptosis Inducing Factor)
- 83. Роль митохондрий в индукции апоптоза. Открытие AIF Гвидо Крэмером
- 84. AIF (Apoptosis Inducing Factor) индуцирует крупноразмерную (50Kb),
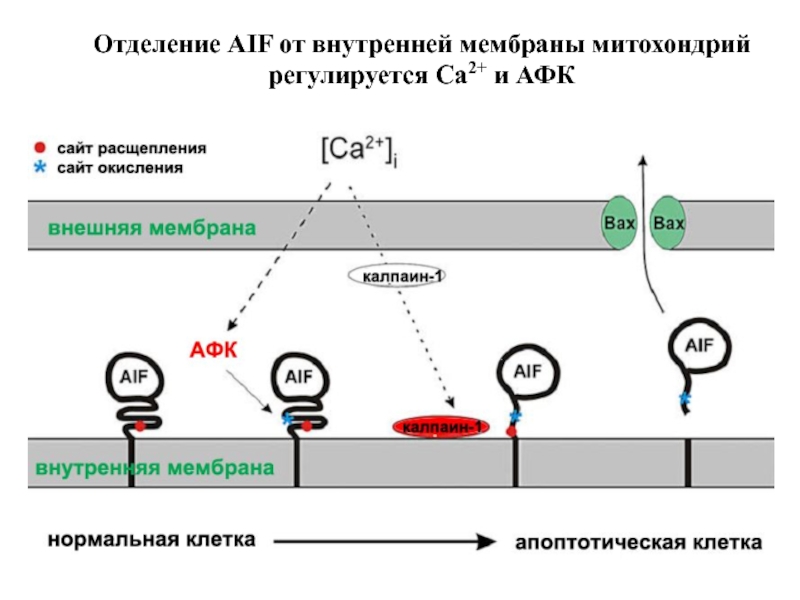
- 85. Отделение AIF от внутренней мембраны митохондрий регулируется Ca2+ и АФК
- 86. Эффекты AIF AIF Контроль сборки или
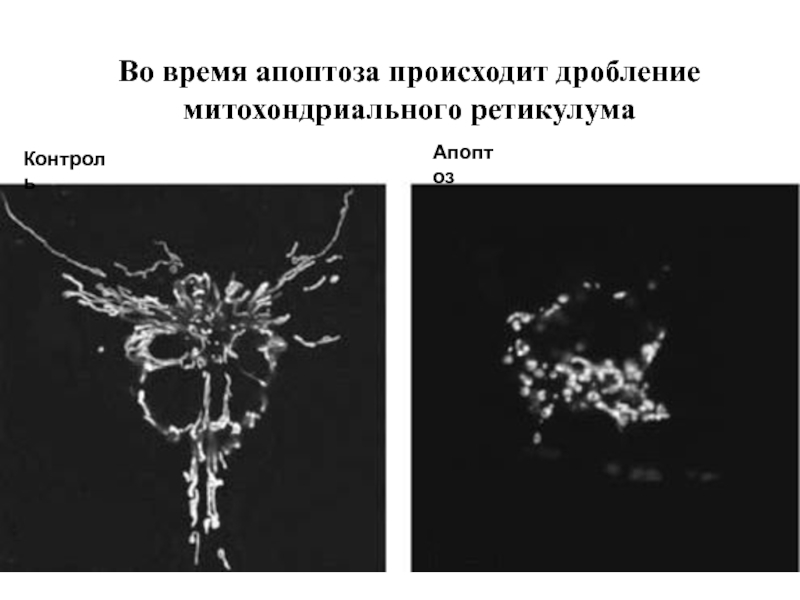
- 87. Во время апоптоза происходит дробление митохондриального ретикулума Контроль Апоптоз
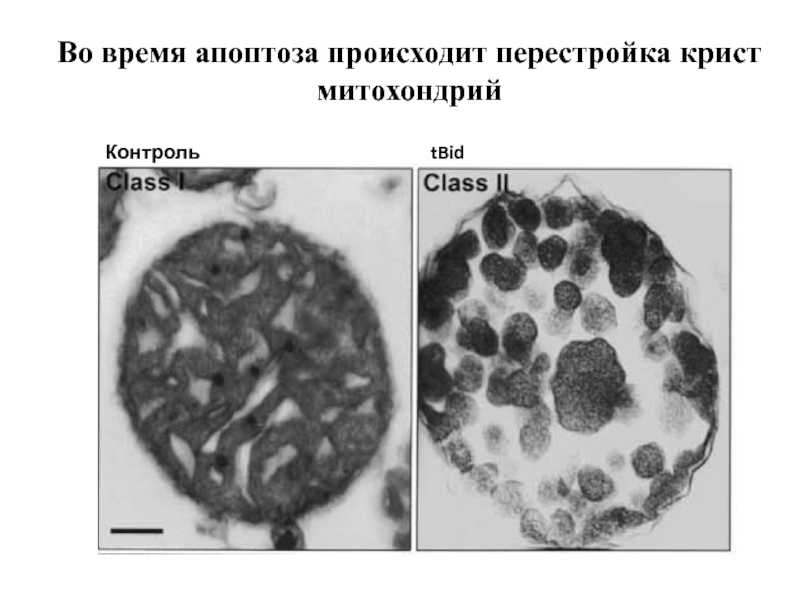
- 88. Во время апоптоза происходит перестройка крист митохондрий
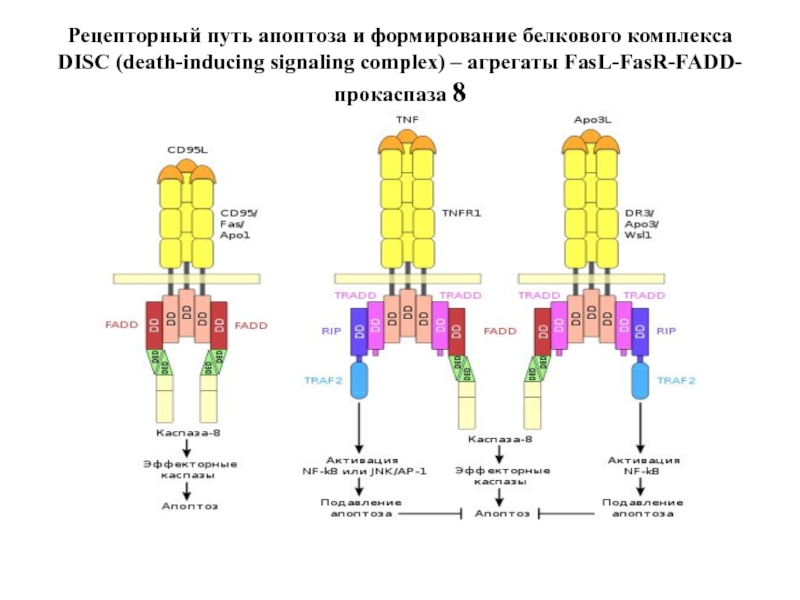
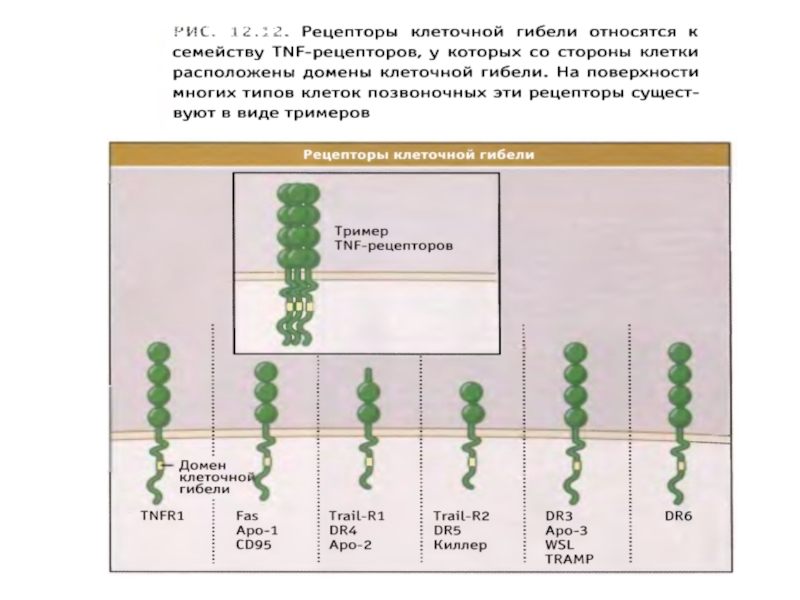
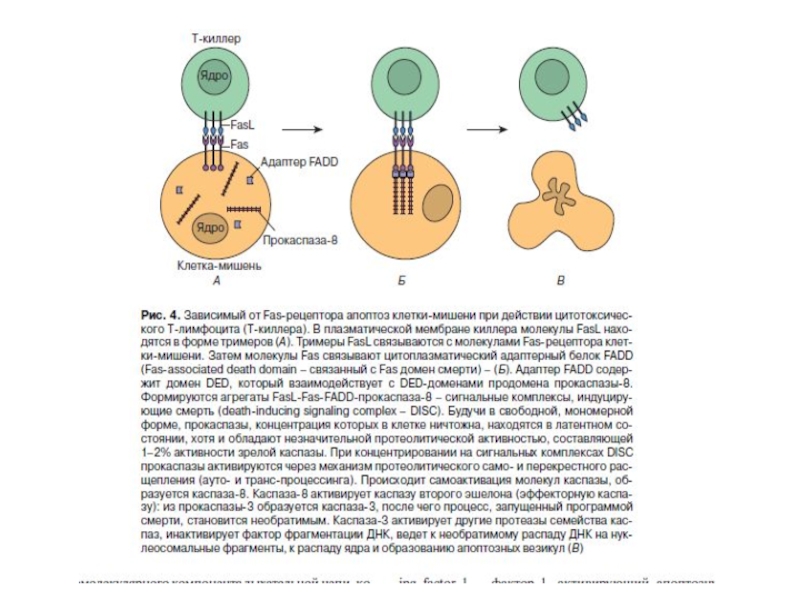
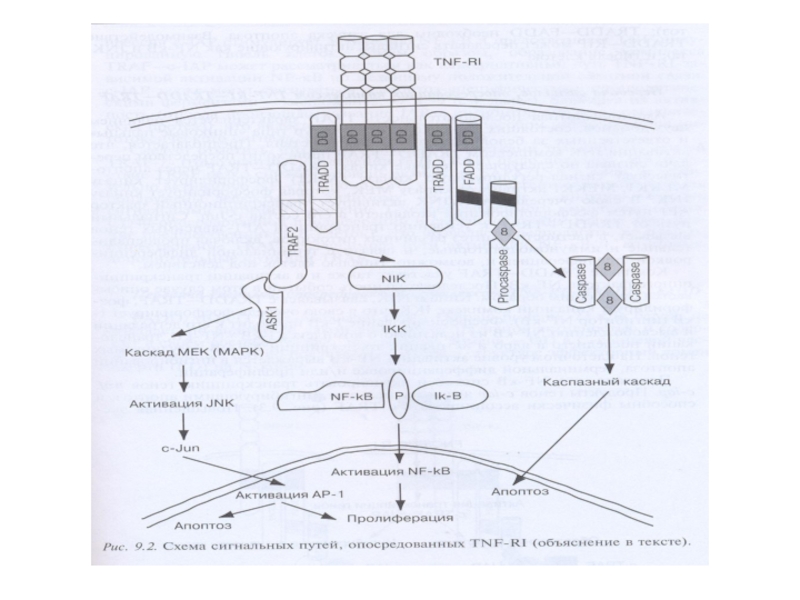
- 89. Рецепторный путь апоптоза и формирование белкового комплекса DISC (death-inducing signaling complex) – агрегаты FasL-FasR-FADD-прокаспаза 8
- 96. Деградация ДНК идет поэтапно 1 этап. Образование
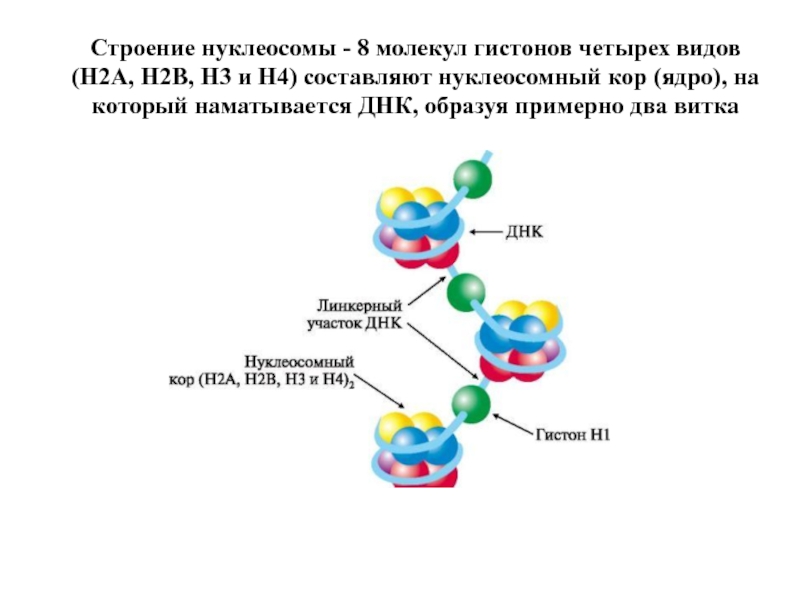
- 97. Строение нуклеосомы - 8 молекул гистонов четырех
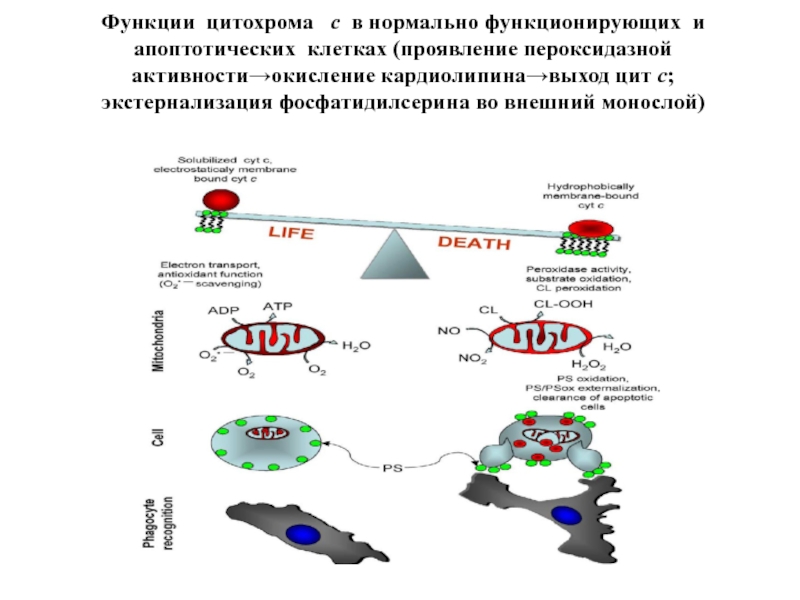
- 99. Функции цитохрома с в нормально функционирующих
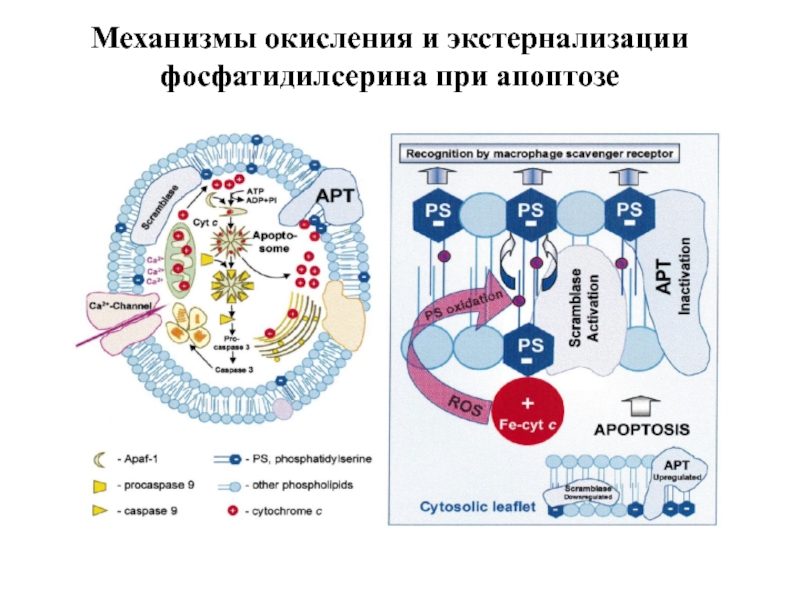
- 100. Механизмы окисления и экстернализации фосфатидилсерина при апоптозе
- 103. КОНТРОЛЬ интенсивность апоптоза – 27,4% ГБО
- 104. Транслоказы фосфолипидов создают асимметричное распределение мембранных липидов.
- 105. Защита клетки от апоптоза:
- 107. Ингибиторы каспаз: 1.Вирусные белки (белок CrmA вируса
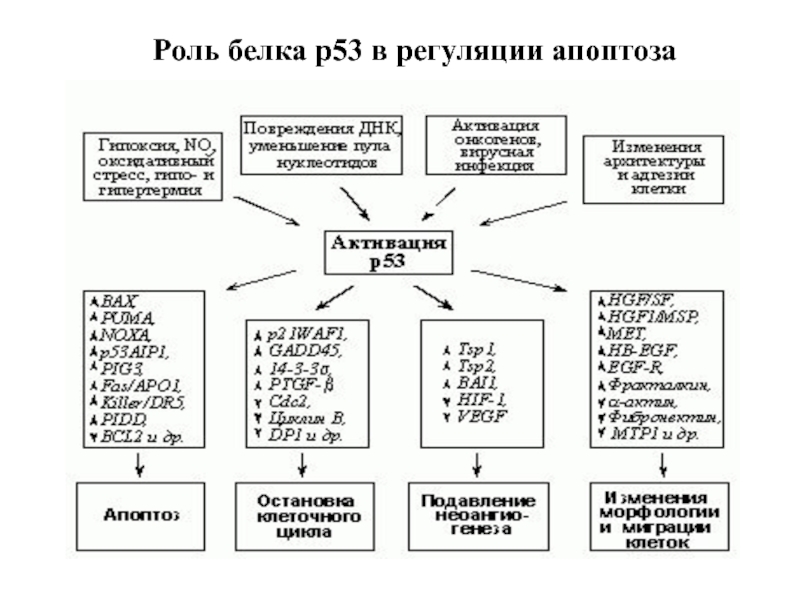
- 110. Роль белка р53 в регуляции апоптоза
- 111. Антионкоген
- 112. Перспективны для
- 113. Изменение уровня апоптоза при патологиях Канцерогенез
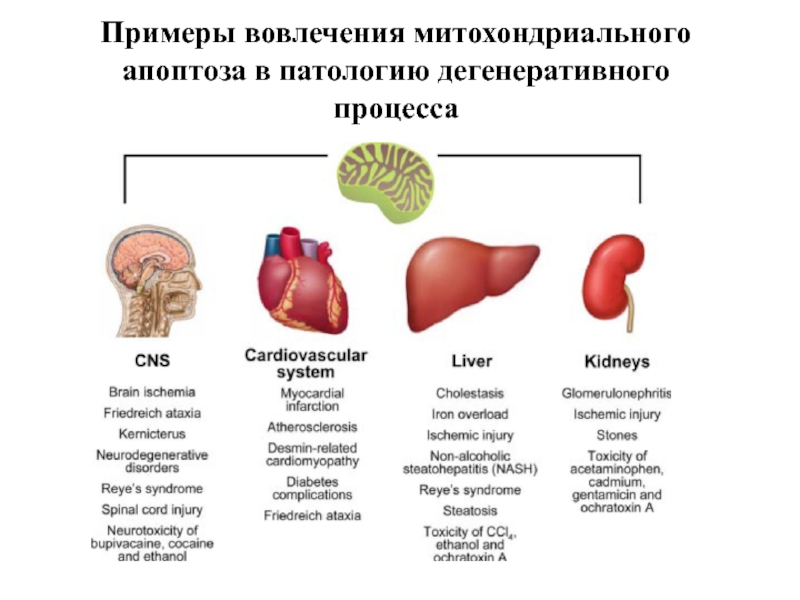
- 114. Примеры вовлечения митохондриального апоптоза в патологию дегенеративного процесса
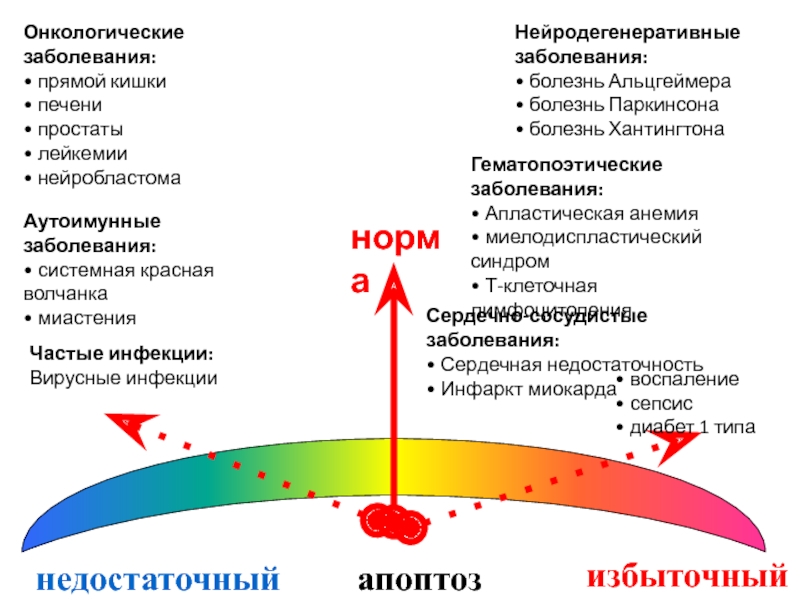
- 115. недостаточный апоптоз избыточный Онкологические заболевания: •
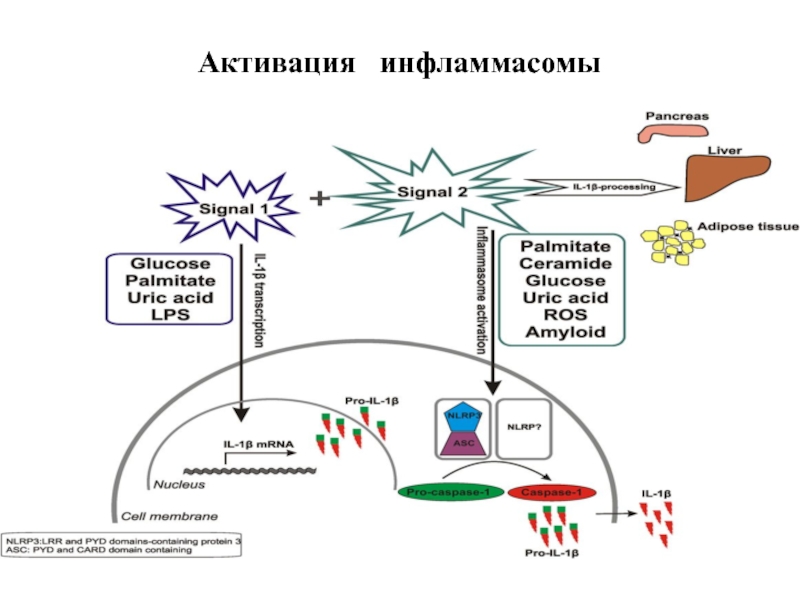
- 119. Активация инфламмасомы
- 120. Фрагментация ДНК идет поэтапно: 1. Образование крупных
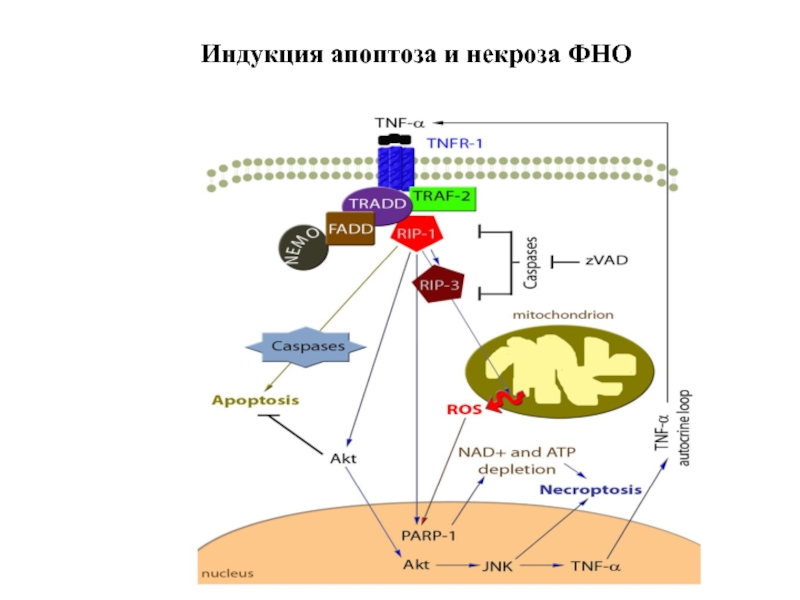
- 121. Индукция апоптоза и некроза ФНО
Слайд 2 «Апоптоз– это запрограммированный процесс уничтожения клетки, вызванный внутренними (внутриклеточными) или
Слайд 3Термин «апоптоз» впервые введен в 1972 г. J.Kerr, A.Wyllie, A.Currie при
Термин может быть переведен как опадание листьев, лепестков, но его также употребляли Гиппократ и Гален, обозначая отмирание и потерю ненужных организму частиц.
В 1987 г. А.Wyllie сфрмулировал главные признаки апоптоза:
уменьшение объема клетки;
конденсация и фрагментация хроматина, формирование апоптотических телец;
изменение мембраны клетки, приводящее к распознава-нию ее фагоцитами;
сопряжение апоптоза с активным синтезом белка
Слайд 4
Результатом совместной работы J.Kerr, A.Wyllie,
Любопытно, что трое соавторов посылали свою статью в ведущие журналы того времени и везде ее отклоняли, оценивая тему как малоинтересную. Карри был членом редколлегии «British Journal of Cancer», и он уговорил редактора принять статью к публикации (Kerr, Wyllie, Currie, 1972, 26, 4, 239—257, doi: 10.1038/bjc.1972.33). Это «любезное одолжение» в дальнейшем сильно увеличило импакт-фактор журнала — статью цитировали тысячи раз и продолжают цитировать по сей день.
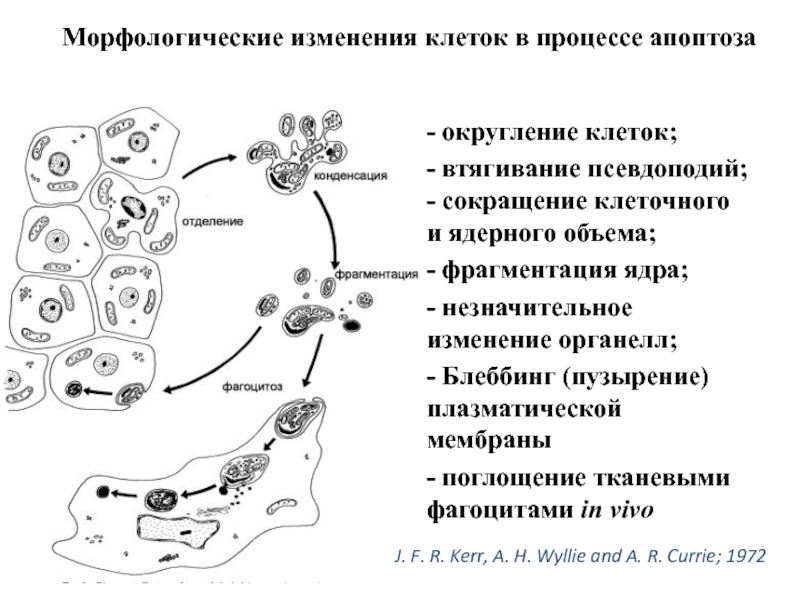
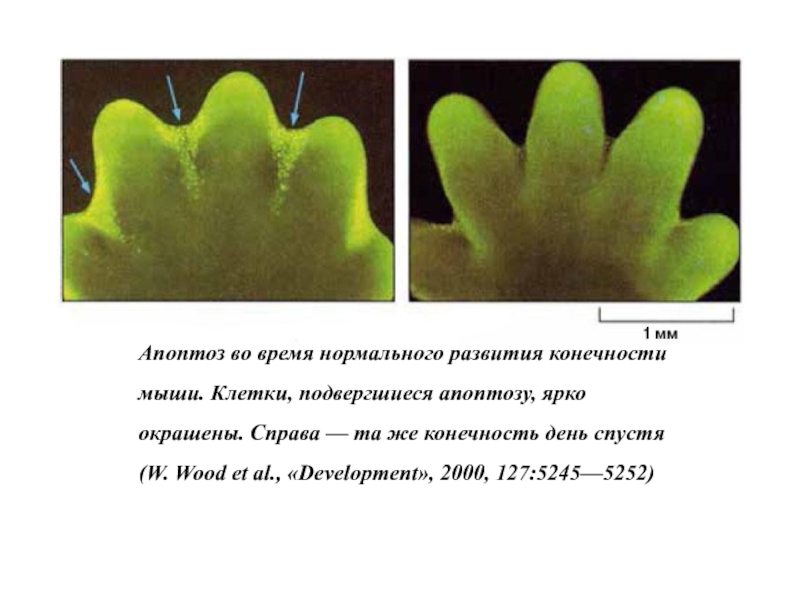
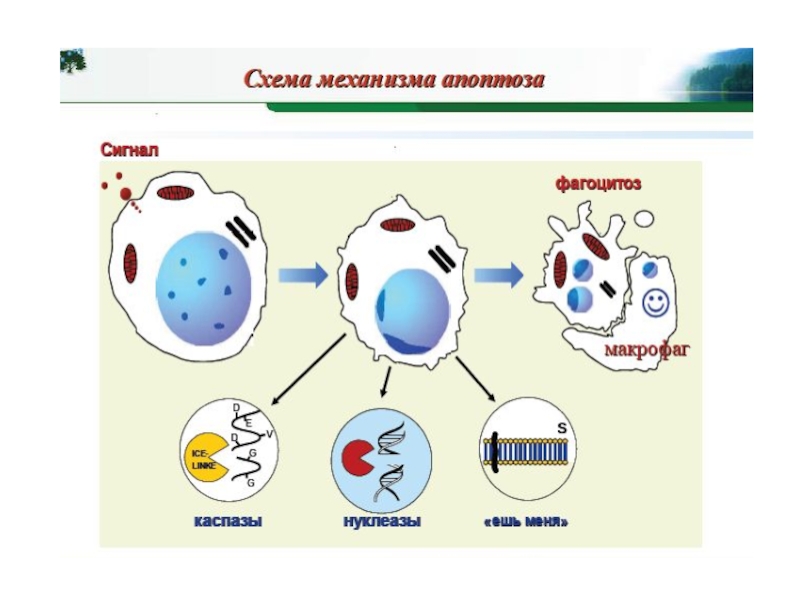
Слайд 6Морфологические изменения клеток в процессе апоптоза
- округление клеток;
- втягивание псевдоподий; -
- фрагментация ядра;
- незначительное изменение органелл;
- Блеббинг (пузырение) плазматической мембраны
- поглощение тканевыми фагоцитами in vivo
J. F. R. Kerr, A. H. Wyllie and A. R. Currie; 1972
Слайд 7Сидней Бреннер
Джон Салстон
Роберт Хорвиц
Нобелевская премия 2002 г. «за открытия, посвященные генетической
Слайд 8 Представляя работы Бреннера, Хорвица и Салстона, член
У. Лендал говорил, что важность деления, дифференциации и отмирания клеток и развития органов для человека понимали многие, но прогресс в исследовании этих процессов был медленным из-за сложности человеческого организма, состоящего из огромного количества клеток. Еще в 1960-е годы Бреннер выбрал в качестве модельного объекта изучения червя (1мм) - нематоду Caenorhabditis elegans с 959 клетками, питающуюся бактериями. В 1974г. он продемонстрировал, что мутации генов приводили к изменениям в развитии органов. Этот странный, как казалось, выбор привел к тому, что Бреннер создал важный инструмент исследования развития организмов.
Слайд 9В знак заслуг Бреннера и его пионерской роли во всеобщем исследовательском
В качестве многоклеточного, но простого организма Бреннер выбрал нематоду Caenorhabditis elegans – маленького червя (1 мм) с коротким жизненным циклом, прозрачного, так что процесс деления клеток можно было наблюдать под микроскопом. Выбор простого модельного организма, состоящего из обозримого числа клеток, но обладающего нервной, мускульной и репродуктивной системой, сам Бреннер считал очень важным для исследований.
"Я готов работать в чулане".
Сидни Бреннер, из переписки с Фрэнсисом Криком.
Слайд 10«Когда мы разгадаем червя - мы поймем жизнь»
Джон Салстон.
В 1970 г.
Слайд 11Р. Хорвиц открыл генетическую основу регуляции апоптоза и показал, что она
Тридцать лет своей жизни Хорвиц отдал изучению генов, которые влияют на развитие 22-х клеток одной из частей репродуктивной системы C. elegans. Чтобы поддерживать необходимую для эксперимента температуру, В 70-х-80-х годах ему часто приходилось по целым дням сидеть в специальной "холодовой" - термоизолированной неотапливаемой комнате без окон. Кому-то такая работа показалась бы сущей пыткой. Для Хорвица же она - удовольствие.
Слайд 12Выделяют 4 вида программированной гибели клеток (ПГК), основанные на морфо-физиологических изменениях
1)
2) ПГК II типа (аутофагия) (аутофагия органелл, набухание ЭПР, митохондрий, аутофагосомы, с участием лизосом)
3) ПГК III типа (некроз) (набухание органелл, без участия лизосом, есть разрыв плазматической мембраны и развитие воспаления)
4) ПГК IV типа (митотическая катастрофа) (гибель клетки в процессе митоза, в результате нарушения ДНК, остановка клетки в сверочных точках клеточного цикла)
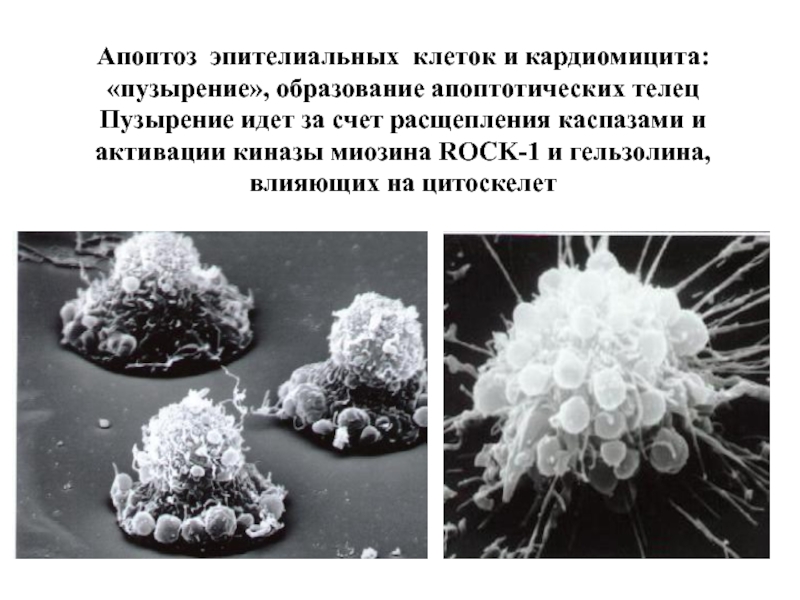
Слайд 18Апоптоз эпителиальных клеток и кардиомицита: «пузырение», образование апоптотических телец Пузырение идет
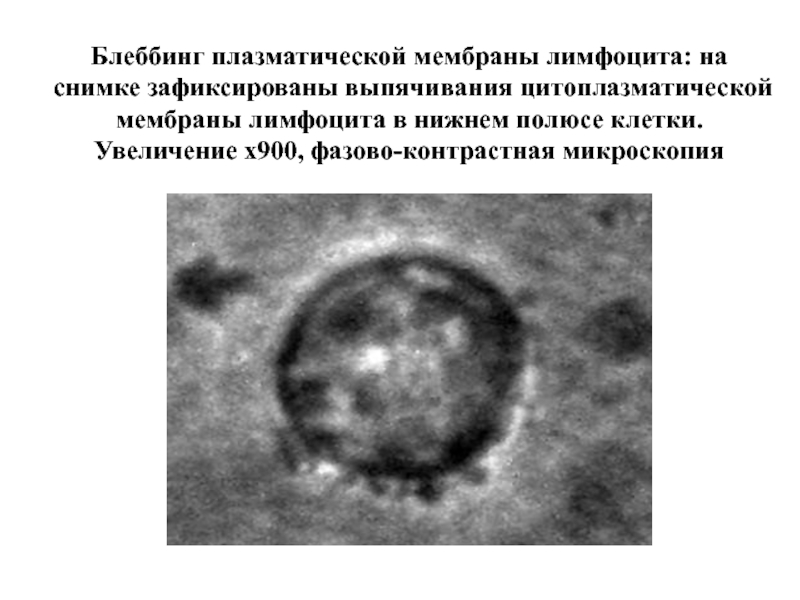
Слайд 19Блеббинг плазматической мембраны лимфоцита: на
снимке зафиксированы выпячивания цитоплазматической
мембраны лимфоцита в нижнем
Увеличение х900, фазово-контрастная микроскопия
Слайд 21 Программированная гибель клетки — активная форма
Апоптоз — форма гибели клетки, проявляющаяся в уменьшении ее размера, конденсации и фрагментации хроматина, уплотнении наружной и цитоплазматических мембран без выхода содержимого клетки в окружающую среду (морфологический способ определения).
Слайд 22 1. Апоптоз - фундаментальный процесс физиологического разрушения клеток в составе
2. Апоптоз происходит в процессе развития тканей и органов в эмбриогенезе, необходим для поддержания гомеостаза клеток.
3. Апоптоз необходим для удаления опухолевых и дефектных клеток, а также клеток, инфицированных вирусами.
Роль апоптоза
Слайд 25В организме среднестатистического взрослого человека в результате апоптоза погибает ежедневно порядка
Слайд 26 При описании каких процессов мы сталкиваемся с явлением
Роль апоптоза при протекании физиологических процессов:
- при эмбриогенезе (морфогенетический, гистогенетический, филогенетический)
- при пролиферацц в клеточных популяциях (поддержание тканевого гомеостаза и обеспечение дифференцировки клеток)
- при гормон-зависимой инволюции органов и тканей
Роль апоптоза при патологии:
- при повреждении ДНК
- при опухолевом процессе
- при ишемии органов и тканей
- при дефиците гормона (апоптоз гормон-зависимых органов)
- при окислительном стрессе
- при заражении клеток вирусом
- при трансплантации органов (апоптоз клеток «хозяина»)
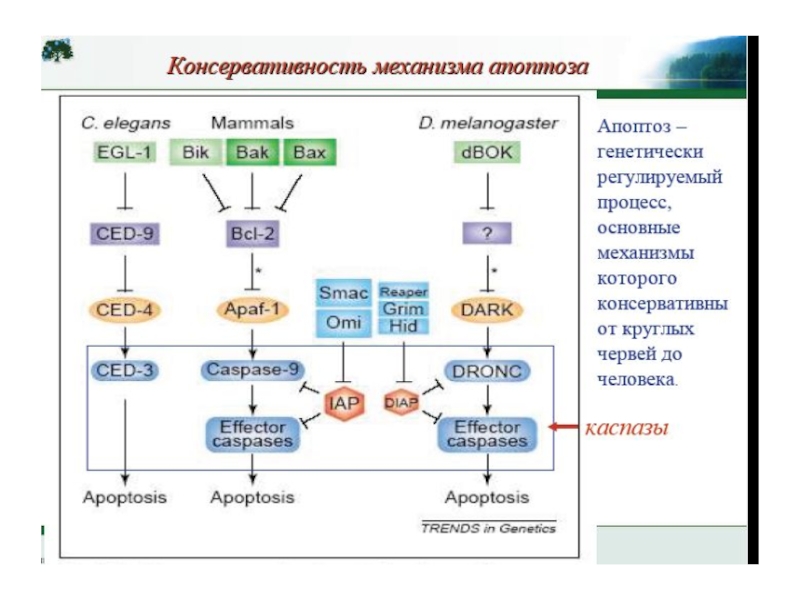
Слайд 29Апоптоз – эволюционно консервативный процесс
Апоптоз у нематоды осуществляется за счет протеолитического
Сигнальная платформа активации каспаз у нематоды связана с митохондриями
Слайд 32Стадии апоптоза
1.Индукция апоптоза: рецепция сигнала и начальные этапы его передачи (стадия
2.Эффекторная, стадия программирования: активация эффекторных каспаз, расщепление внутриклеточных субстратов
3.Реализация апоптоза, запрограммированного на предыдущей стадии (фрагментация ДНК, морфологические эффекты)
Стадии 2 и 3 необратимые, протекают по единому плану для всех клеток.
4. Поглощение фрагментов клетки.
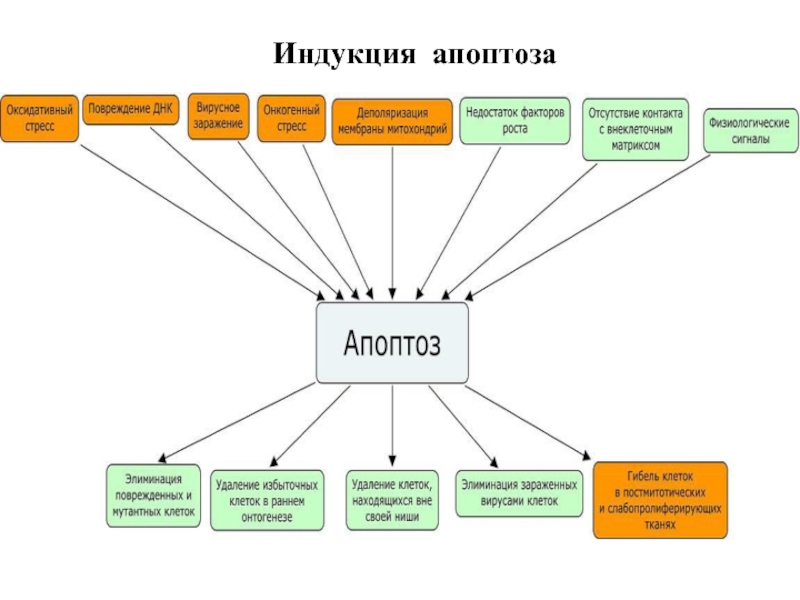
Слайд 33Индукция апоптоза :
Главные пути:
1.Митохондриальный ( внутренний) путь, приводящий к активации каспазы
2.Рецепторный (внешний) путь, приводящий к активации каспазы 8
Дополнительные пути:
ЭПР-зависимый (нарушение Са2+-гомеостаза)
Гранзим В-зависимый
Потеря клеточного ядра (кариорексис)
ПАРП-зависимый (ПАРП – поли-АДФ-рибоза-полимераза, репарирует разрывы в хроматине)
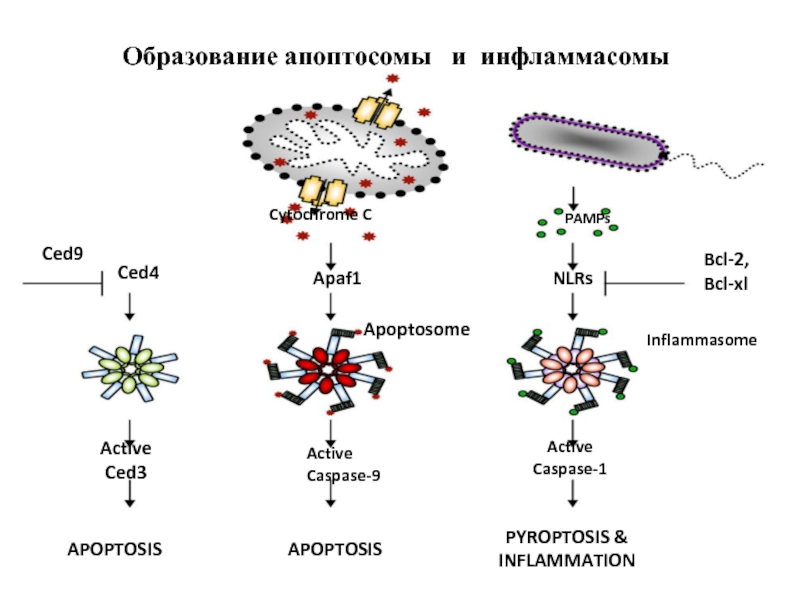
Слайд 37Две сигнальные платформы для активации каскадов каспаз у млекопитающих
Kelly M Boatright
Слайд 38APOPTOSIS
APOPTOSIS
PYROPTOSIS &
INFLAMMATION
Cytochrome C
Apaf1
Apoptosome
Active
Caspase-9
PAMPs
NLRs
Bcl-2,
Bcl-xl
Inflammasome
Active
Caspase-1
Active
Ced3
Ced4
Ced9
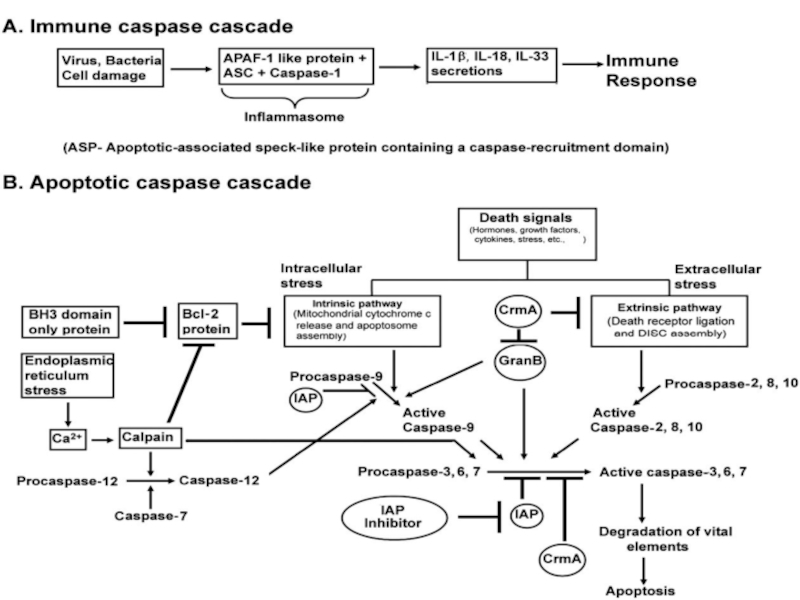
Образование апоптосомы и инфламмасомы
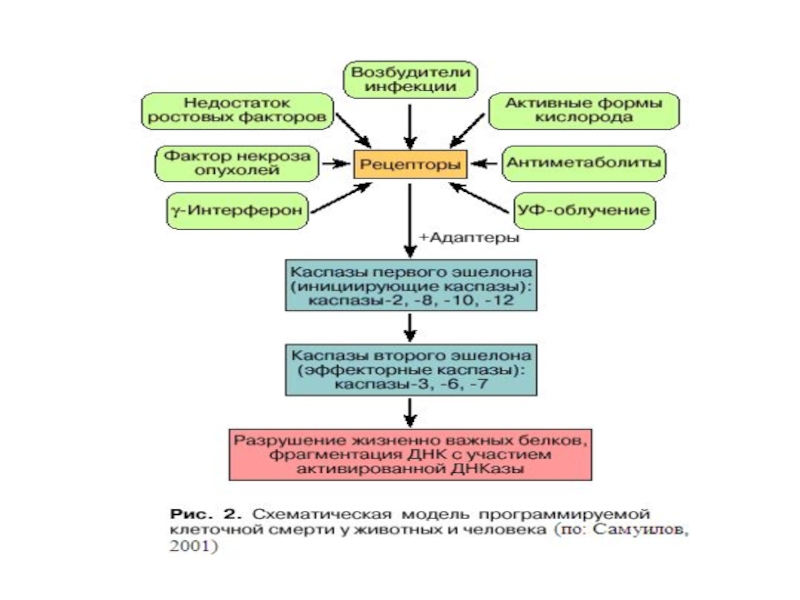
Слайд 39Общая характеристика каспаз: Каспазы – цистеин содержащие специфические протеазы, расщепляющие субстраты после
1.Инициаторные (касп-8, -9)
2. Эффекторные (касп-3, -7)
3. Каспазы, участвующие в воспалении (касп-1)
Присутствуют в клетке в виде неактивных зимогенов и при активации апоптоза не происходит их нового синтеза.
Расщепляют более 500 белковых субстратов.
Слайд 40Каспазы (caspase-cysteine-dependent aspartat specific protease) :
1.Каспазы 1-го эшелона (инициирующие) – каспазы-
2.Каспазы 2-го эшелона (эффекторные, «казнящие») – каспазы- 3,6,7, их субстраты > 500 различных белков (ДНК-аза, ПАРП, белки цитоскелета-ламины, фодрин, актин, кератин; cdk, антиапоптозные белки), имеют короткие продомены (30 АК).
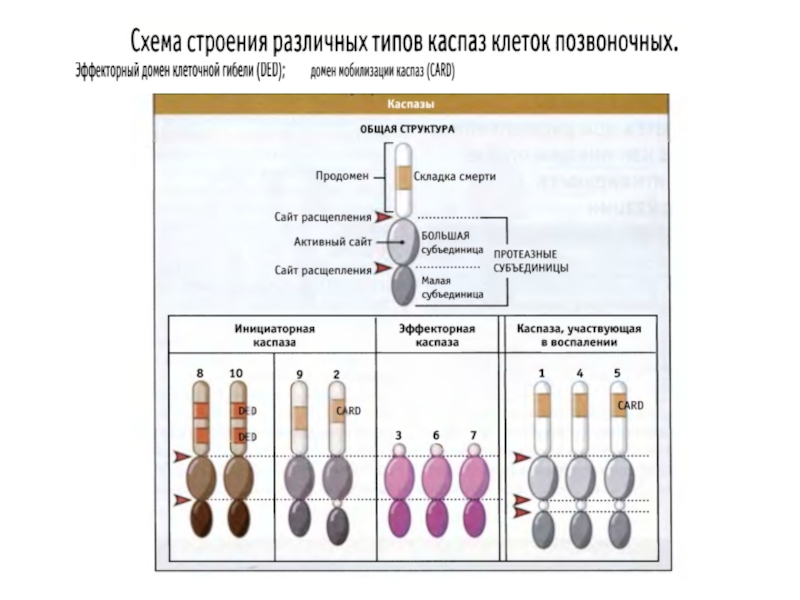
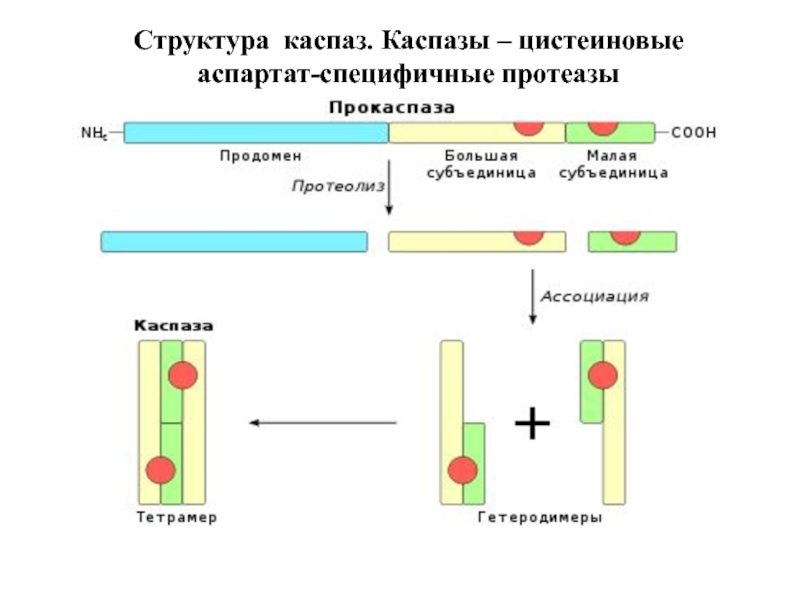
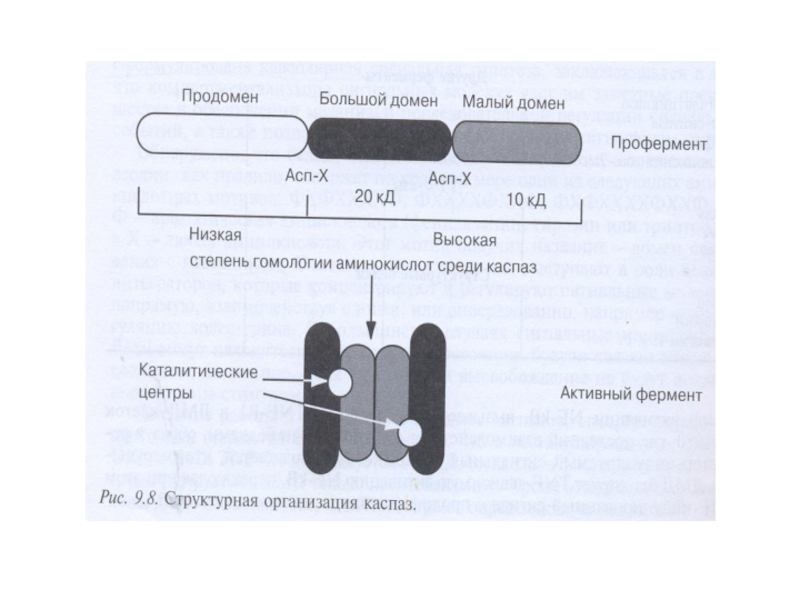
Слайд 41Структура каспаз
Прокаспазы представлены мономерами, которые содержат
3 домена: N-концевой
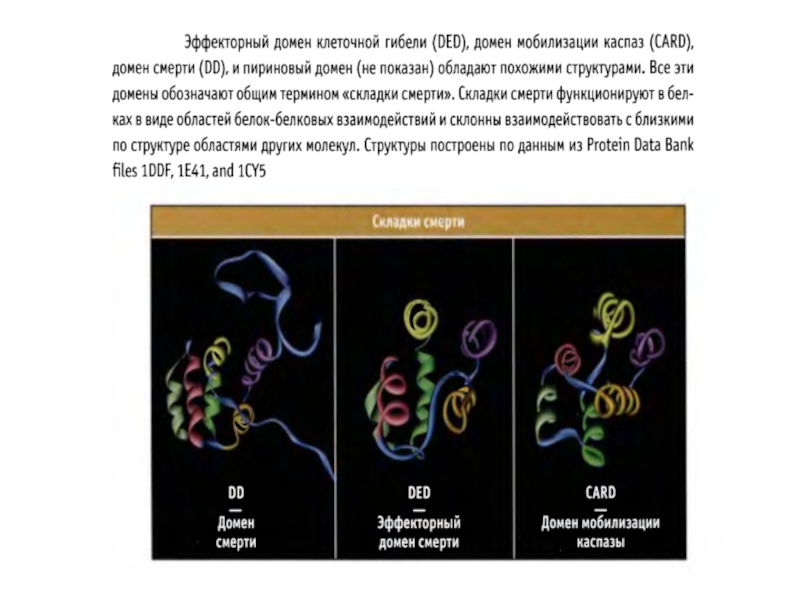
Инициаторные каспазы содержат длинные продомены (100 АК) с последовательностями, характерными для белок-белковых взаимодействий. Это домен смерти (DD), домен мобилизации каспаз (CАRD), эффекторный домен смерти (DED). Все вместе они называются складками смерти и структурно близки друг к другу.
Эффекторные каспазы содержат малый продомен (30 АК) без складок смерти.
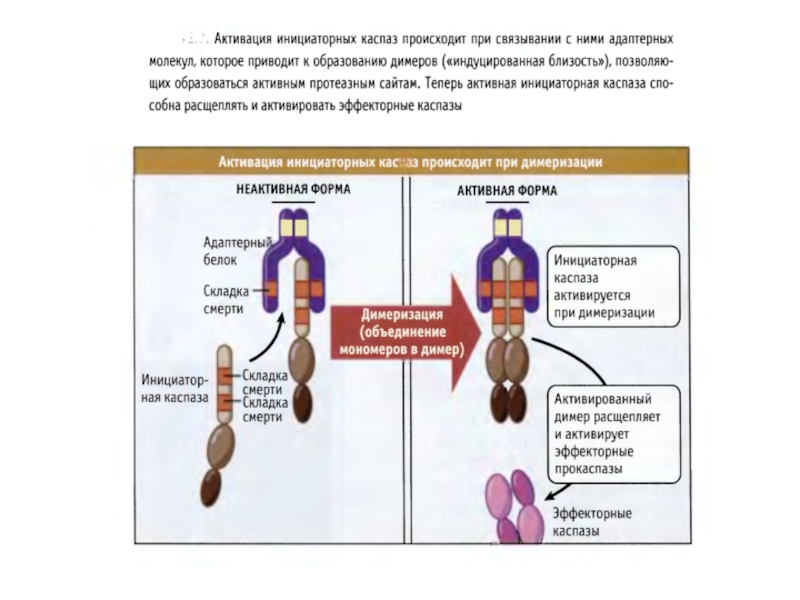
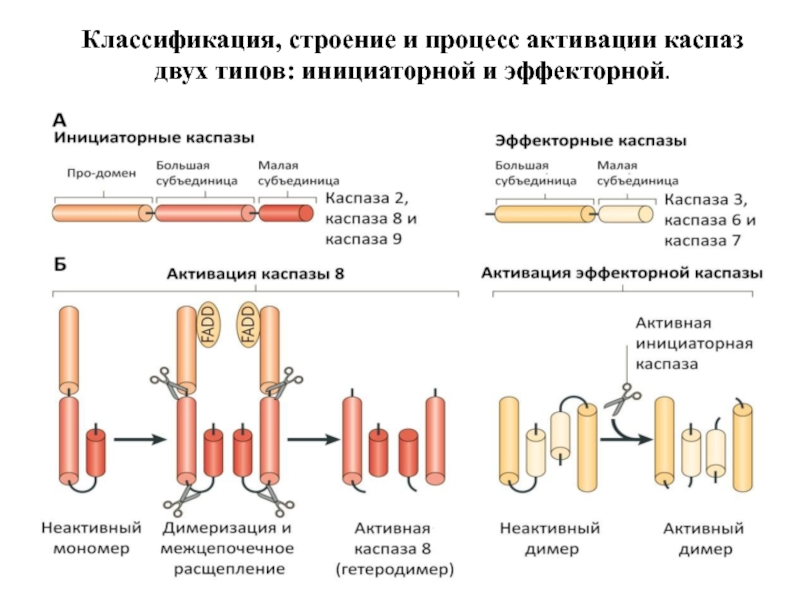
Слайд 44Активация инициаторных каспаз происходит по механизму индуцированного сближения
1. Инициаторные каспазы (-2,-8,-9,-10)
2. Активация происходит путем связывания с адаптерными белками и объединения двух мономеров в димер, в котором формируются активные сайты.
3. После образования димера происходит расщепление по сайтам, содержащим аспартат, что стабилизирует димер. Такой механизм активации за счет димериза-ции называется индуцированным сближением.
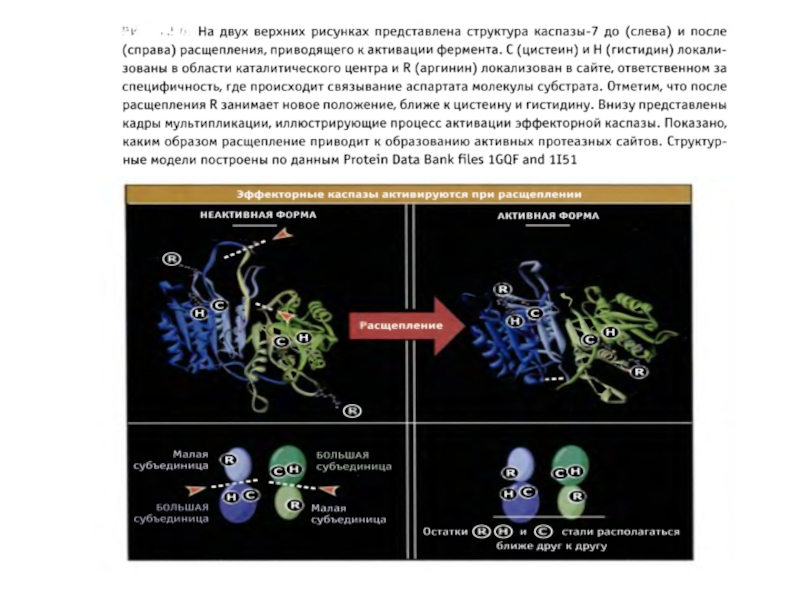
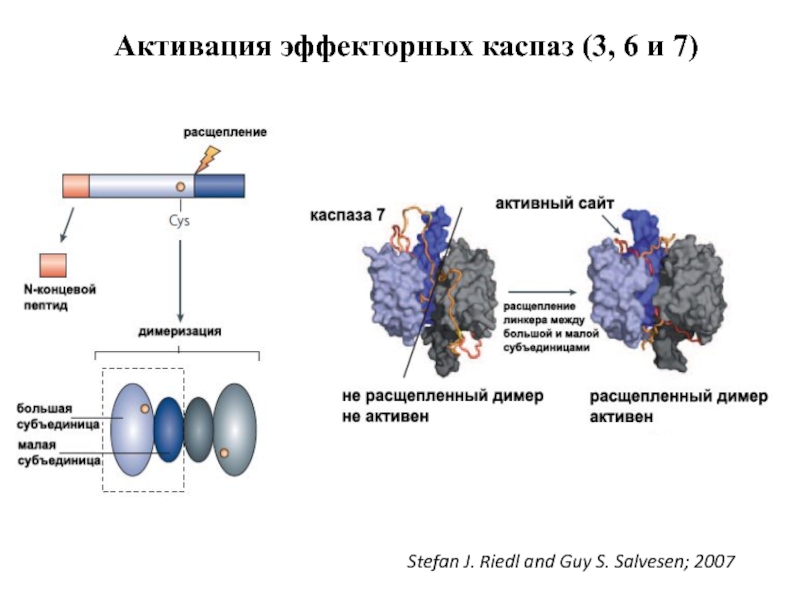
Слайд 47Активация эффекторных каспаз
1.Эффекторные каспазы (-7,-3,-6) присутствуют в клетках в виде неактивных
2.При активации происходит расщепление прокаспазы по аспартат-содержащим сайтам с помощью инициаторных каспаз.
3. Освобождается большая субъединица, содержащая в активном сайте Цис-Гис, и малая субъединица, содержащая Арг в сайте связывания субстрата.
4. Расщепление эффекторной каспазы формирует активный центр фермента, при этом каталитический димер Цис-Гис, необходимый для протеазной активности, сближается с Арг, который специфически связывает Асп субстрата.
5. Два гетеродимера объединяются, образуя тетрамер с 2 активными центрами.
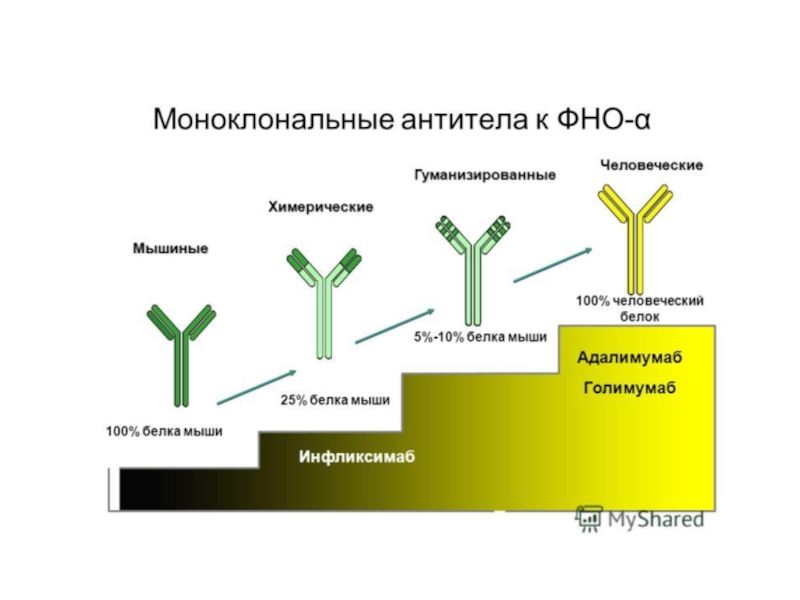
Слайд 52 В 1990—2000-е годы многие фармацевтические фирмы вкладывали
В настоящее время ингибиторы каспаз используют лишь в экстренных ситуациях, например при остром циррозе печени, когда необходимо как можно скорее остановить разрушение ткани.
Другой пример — такое тяжелое заболевание, как болезнь Крона: хроническое воспаление всех отделов желудочно-кишечного тракта, от полости рта до прямой кишки, с образованием свищей, инфекционными осложнениями и прочими проблемами. При лечении болезни Крона (а также ревматоидного артрита и язвенного колита) хорошо показал себя препарат инфликсимаб, в России известный как ремикейд, — он действует как раз через каспазу-1.
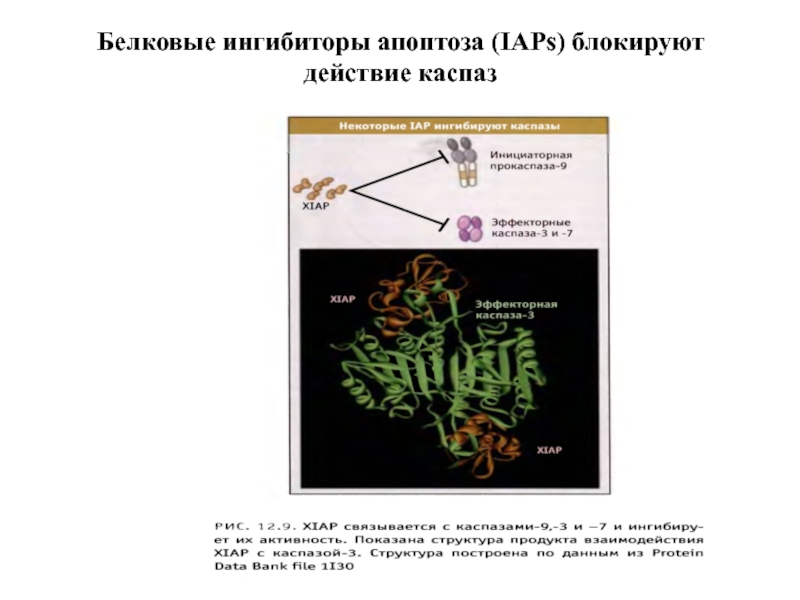
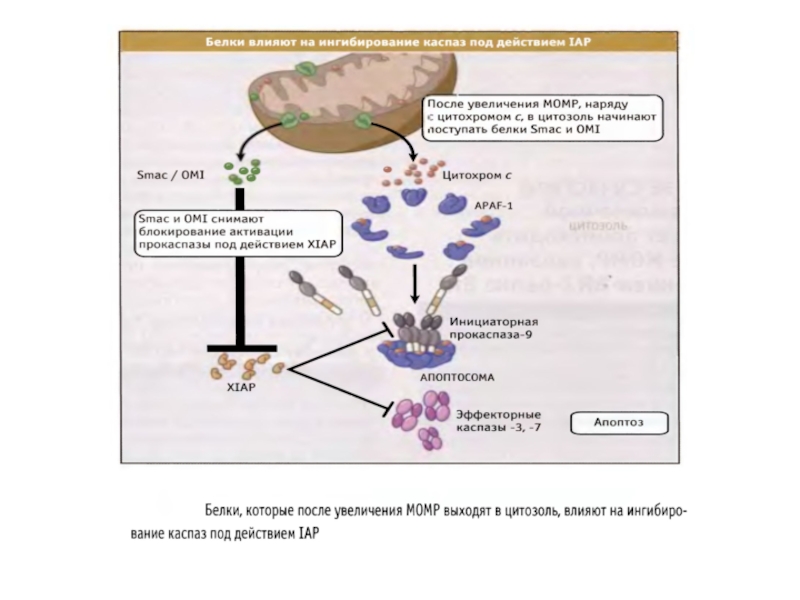
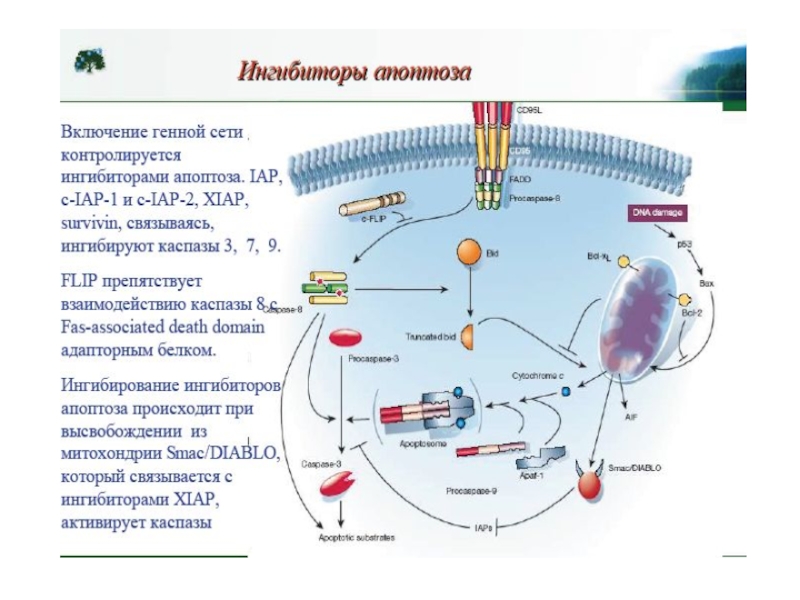
Слайд 55 Белки семейства IAP (ingibitors of
У млекопитающих обнаружено 8 представителей этого семейства, каждый из которых содержит от одного до трех 70-аминокислотных участков, называемых BIR-доменами (baculoviruses inhibitor of apoptosis repeat domains).
IAP (XIAP) кодируется Х-хромосомой и содержит каждый 3 N-концевых BIR-домена и С-концевой RING -домен (really interesting new gene). XIAP ингибируют каспазу-3, 7, 9.
BIR-домены связываются с каспазами, блокируя их активные сайты. С-Концевой RING-домен обеспечивает деградацию каспаз благодаря своей убиквитинлигазной активности ;
XIAP подвержен отрицательной регуляции. 25 кДа-митохондриальный полипептид Smac/DIABLO (direct IAP-binding protein with low pi), выходя из митохондрий в цитозоль, связывается с ними и нарушает их связывание с каспазами , ускоряя их активацию. Также ведет себя Omi/HtrA2 . При сверхэкспрессии каспаза-3 и каспаза-7 могут сами расщеплять XIAP .
По последним данным, XIAP способен противостоять ингибирующему действию Smac/DIABLO, присоединяя к нему убиквитин .
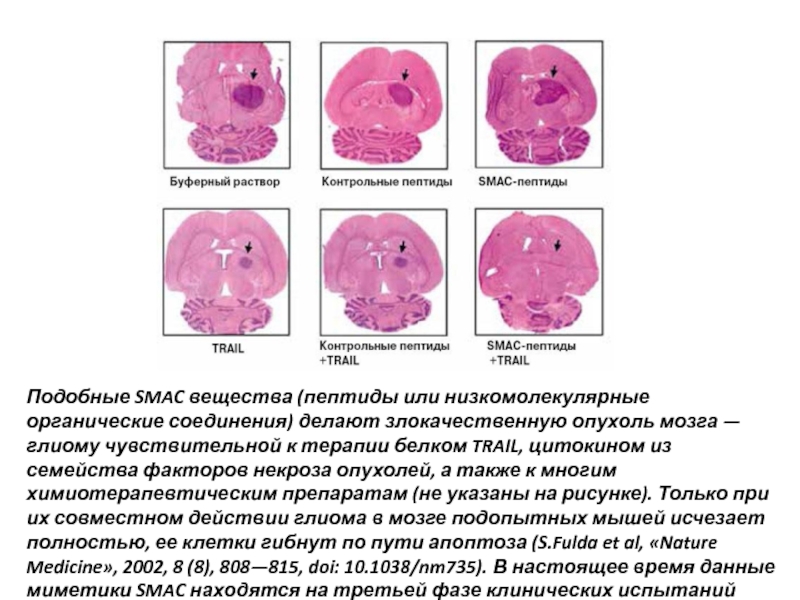
Низкомолекулярные миметики SMAC (небольшие молекулы, имитирующие функцию этого белка) показали себя достаточно эффективными при терапии глиомы — опухоли мозга
Слайд 57Подобные SMAC вещества (пептиды или низкомолекулярные органические соединения) делают злокачественную опухоль
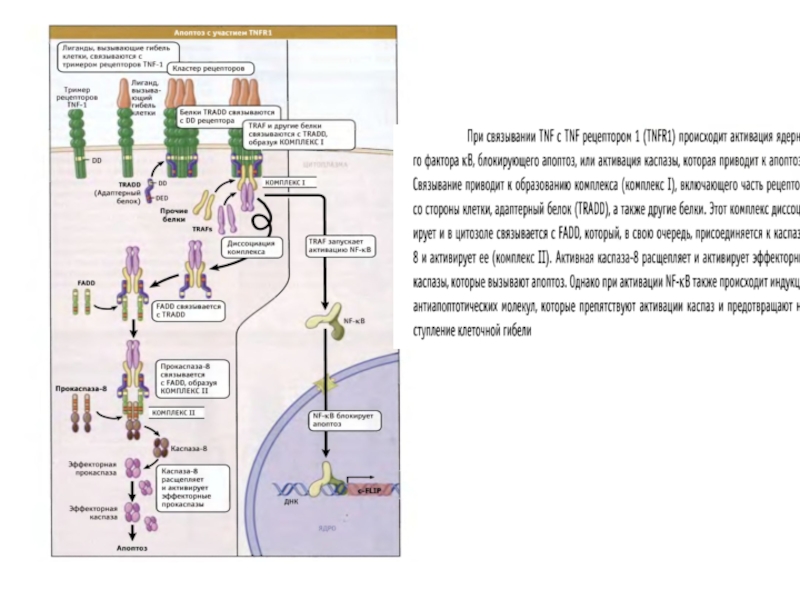
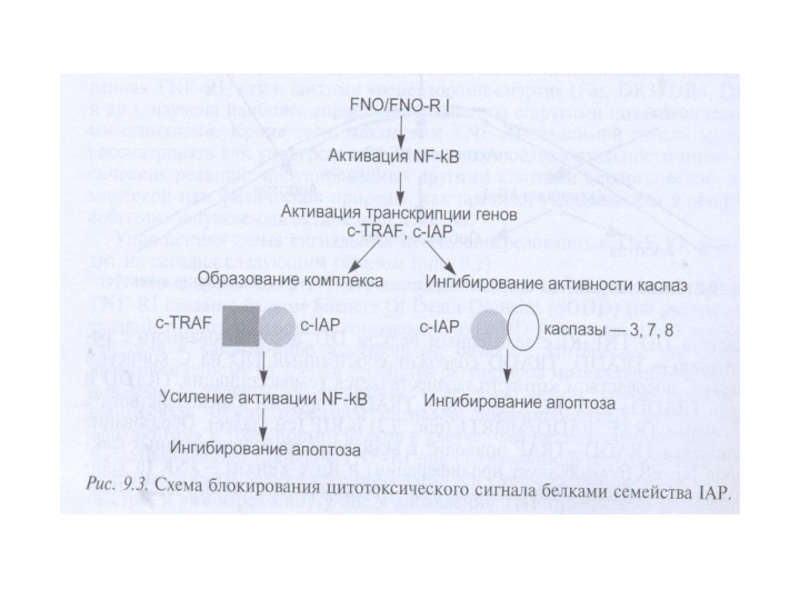
Слайд 58Митохондрии выполняют роль «контрольно-пропускного пункта» апоптотического сигнала
MMP
рецепторы
смерти
каспаза 8
поверхностные рецепторы
повреждения ДНК
каспаза
различные стрессы
эффекторные каспазы
Bid
MMP
цитохром с
каспаза 9
эффекторные каспазы
AIF
Эндонуклеаза G
фрагментация ДНК
Smac/Diablo
Omi/HtrA2
IAP XIAP (ингибиторы каспаз)
апоптоз
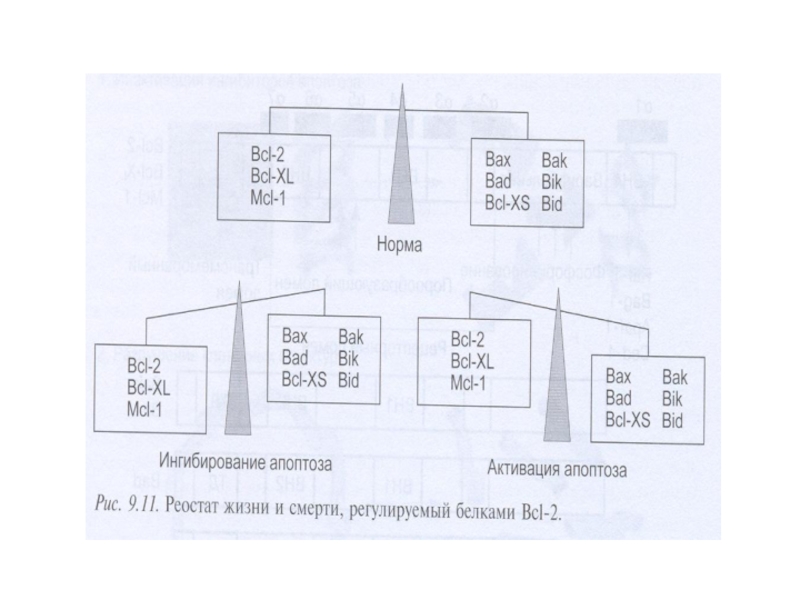
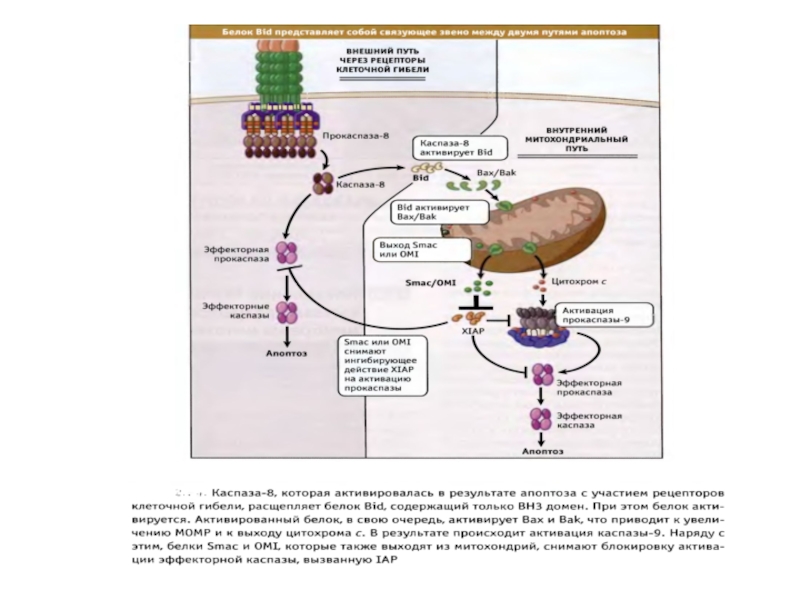
Слайд 70Белки сем Bcl-2 участвуют в апоптозе
Белки сем.Bcl-2 играют главную роль в
Известно 3 класса Bcl-2 белков, которые являются индукторами, непосредственной причиной или ингибиторами повышения проницаемости наружной мембраны митохондрий (MOMP).
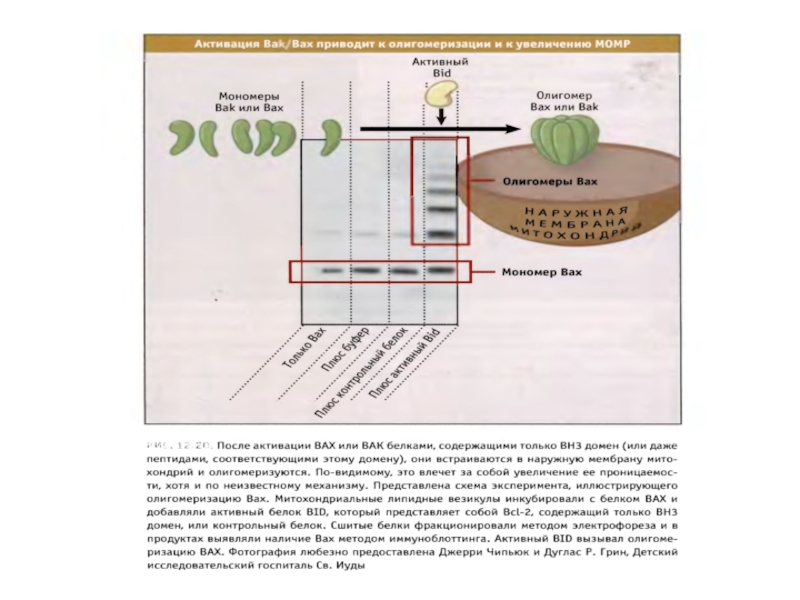
Белки Baх и Bak повышают МОМР и необходимы для реализации митохондриального пути апоптоза.
Антиапоптотические белки сем.Bcl-2 блокируют повышение МОМР, вызванное белками Bcl-2.
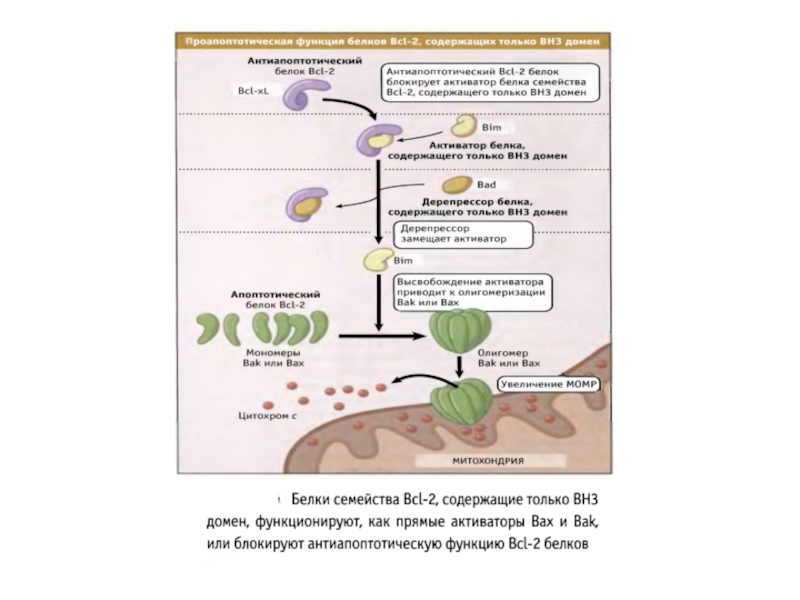
ВН3 белки сем.Bcl-2 могут активировать Baх и Bak или нарушают функции антиапоптотических белков.
Слайд 71 Bcl-2. Перенос его гена с одной хромосомы
В 80-е годы ХХ века австралийский биолог Дэвид Во с коллегами показал, что этот белок работает как антиапоптотический, препятствуя гибели В-клеток; вскоре это подтвердили и другие исследователи. Таким образом, впервые было доказано, что белки, участвующие в негативной регуляции гибели клеток, могут работать как онкогены: если апоптоз блокирован и дефектные клетки не погибают, заболевание развивается.
(D.L.Vaux, S. Cory, J.M.Adams, «Nature», 1988, 335, 440—442).
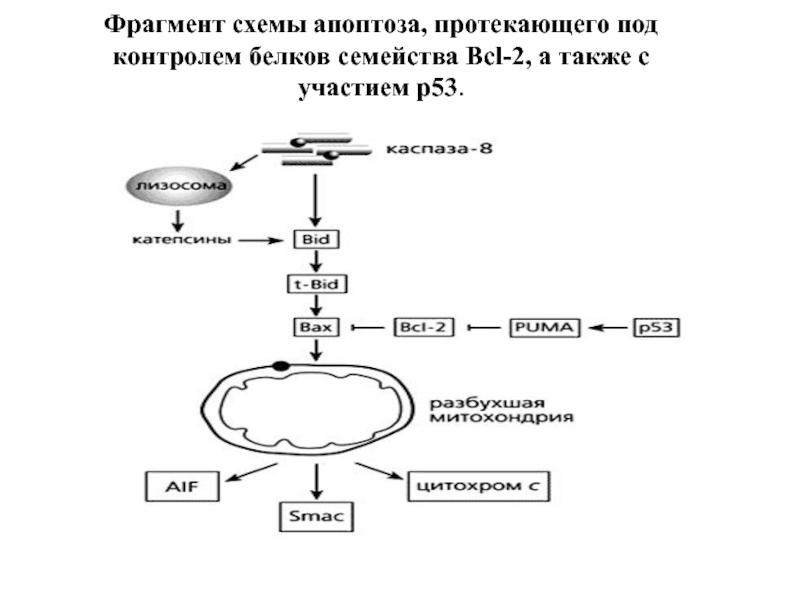
Слайд 81Фрагмент схемы апоптоза, протекающего под контролем белков семейства Bcl-2, а также
Слайд 82Митохондриальные белки, вызывающие фрагментацию ДНК независимо от каспаз
Эндонуклеаза G
AIF(Apoptosis Inducing Factor)
Слайд 84AIF (Apoptosis Inducing Factor) индуцирует крупноразмерную (50Kb), но не нуклеосомную фрагментацию
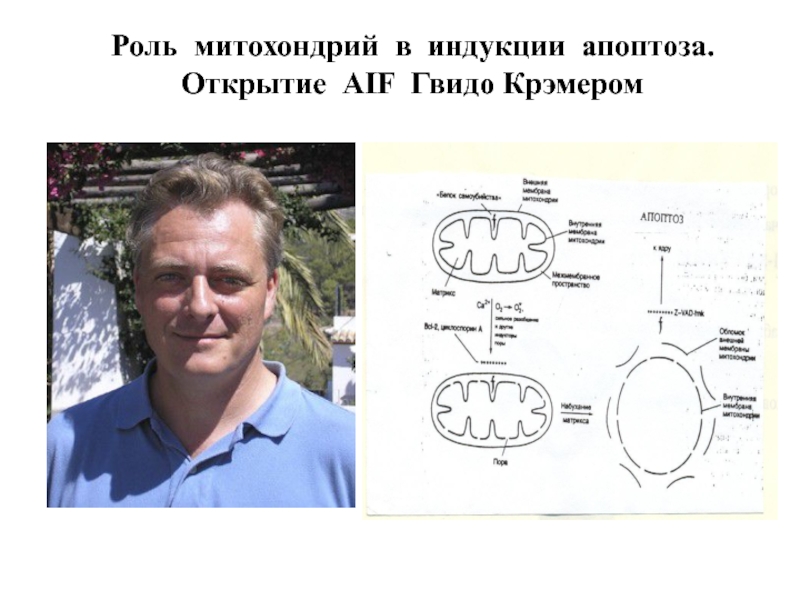
Слайд 86Эффекты AIF
AIF
Контроль сборки или разборки комплекса 1 дыхательной цепи митохондрий
MОMP- выход
НАДФН-оксидаза – генерация супероксид аниона
50Kb фрагментация
ДНК
Неизвестный ядерный эффектор
Неизвестный цитоплазматический эффектор
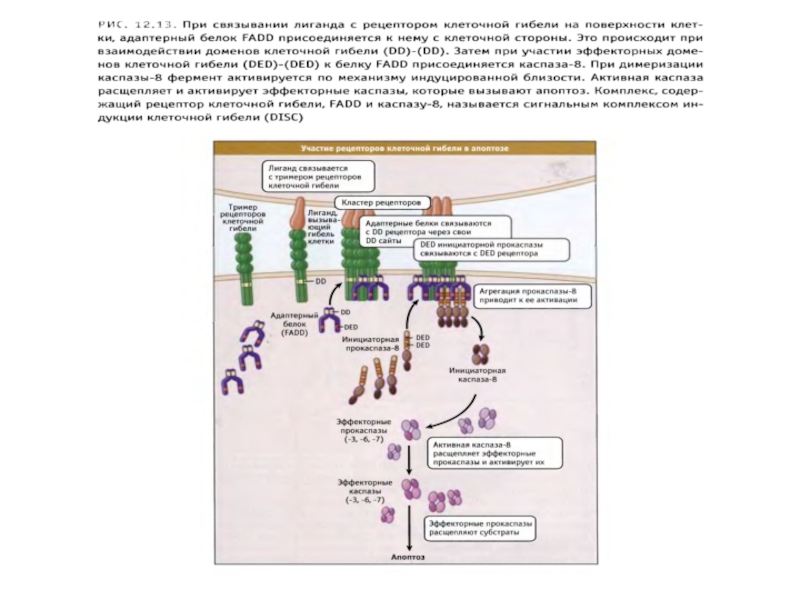
Слайд 89Рецепторный путь апоптоза и формирование белкового комплекса DISC (death-inducing signaling complex)
Слайд 96Деградация ДНК идет поэтапно
1 этап. Образование крупных фрагментов, содержащих 300 тыс.
Идет протеолиз топоизомеразы II, участвующей в формировании суперспи-рализованных петель по 50 тыс. п.н., 6 петель объединяются в дисковидную розетку – 300 тыс. п.н. Активны ДНК-азы I, II; Ca, Mg- зависимые эндонуклеазы.
2 этап. Межнуклеосомная деградация ДНК с образованием фрагментов в 180-200 п.н. (протяженность нити в нуклеосоме) или кратных им по величине. Расщепление гистона H1. Активируется эндонуклеаза CAD (в результате расщепления Касп-3 ингибитора ICAD).
Слайд 97Строение нуклеосомы - 8 молекул гистонов четырех видов (Н2А, Н2В, Н3
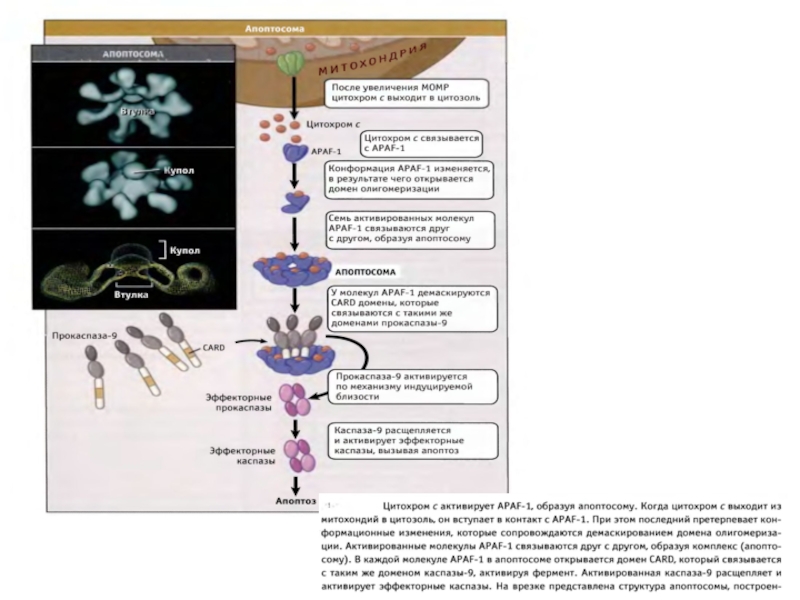
Слайд 99Функции цитохрома с в нормально функционирующих и апоптотических клетках (проявление
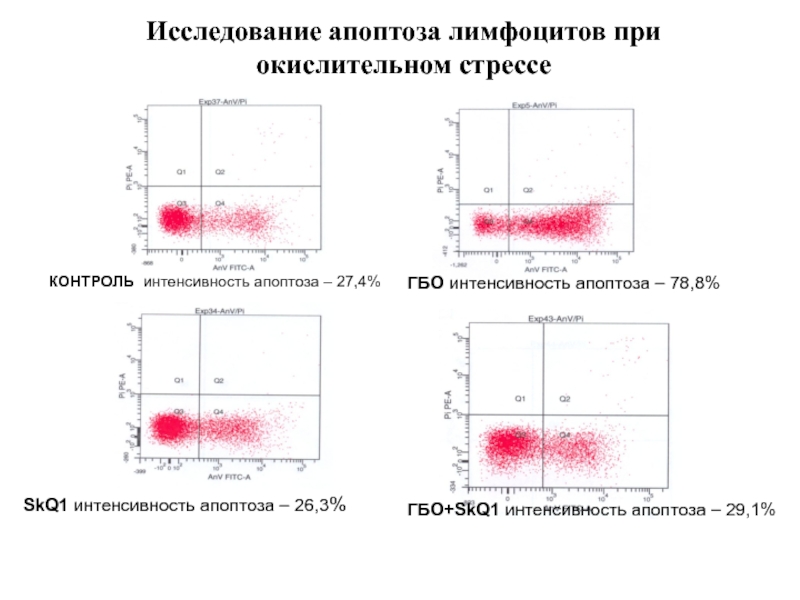
Слайд 103КОНТРОЛЬ интенсивность апоптоза – 27,4%
ГБО интенсивность апоптоза – 78,8%
SkQ1
ГБО+SkQ1 интенсивность апоптоза – 29,1%
Исследование апоптоза лимфоцитов при окислительном стрессе
Слайд 104Транслоказы фосфолипидов создают асимметричное распределение мембранных липидов. АТФ-зависимые специфические переносчики –
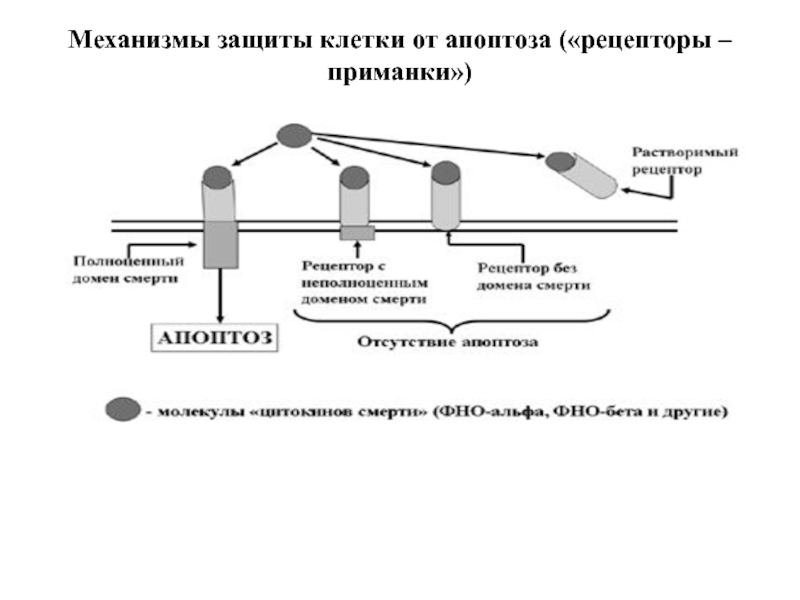
Слайд 105 Защита клетки от апоптоза:
1)Клетки способны синтезировать неполноценные рецепторы
2) Клетка способна «слущивать» (шеддинг) с себя экстрацеллюлярную часть рецепторов, которые при этом становиться так называемыми «растворимыми рецепторами». Появляющиеся в межклеточном пространстве молекулы ФНО прочно соединяются с ними и уже не могут воздействовать на реальные клеточные рецепторы смерти.
Слайд 107Ингибиторы каспаз:
1.Вирусные белки (белок CrmA вируса оспы ингибирует К-8, -1, гранзим
2.Белки сем.IAP (inhibitors of apoptosis) ингибируют К-9,-3,-7. Обнаружены первоначально у бакуловирусов, у млекопитающих 8 белков-ингибиторов (XIAP, cIAP1,cIAP2, NAIP и др.). имеют специфический домен BIR (70 АК).
Сурвивин обнаружен в клетках многих опухолей, ингибирует К-3,-7.
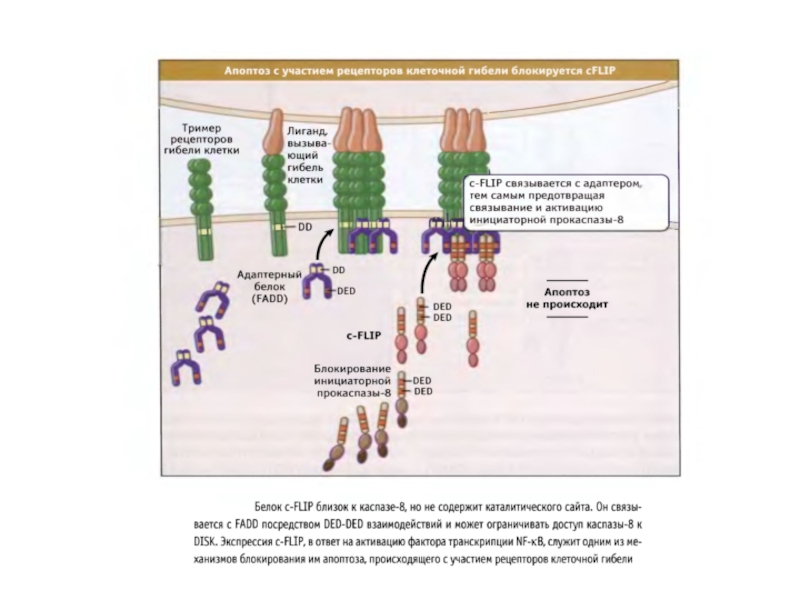
3.Белок FLIP связывается с белковым комплексом DISC и блокирует апоптоз.
4.Белок BAR конкурирует с адаптером FADD за свзывание с К-8,10 и ингибирует апоптоз.
Слайд 111 Антионкоген р53, который часто называют
1.Полифункционален - р53 активируется в ответ на стрессовые стимулы и другие факторы, способные привести к мутациям в ДНК, и включает гибель клетки.
2. В норме присутствует в следовых количествах и быстро расщепляется в протеасомах. При повреждающих сигналах стабилизируется путем ковалентной модификации (фосфорилирование, ацетилировние, гликозилирование и др.).
2. Мутации в гене этого белка часто бывают связаны с онкологическими заболеваниями. Нормальный же белок p53 заставляет клетку погибнуть в апоптозе, убирая антиапоптотическую функцию Bcl-2. Следовательно, если причина онкологического заболевания — мутация в p53, потенциально хорошим лекарством будет вещество, которое выключало бы функцию белков семейства Bcl-2. Нет активности антиапоптотических белков — есть апоптоз, и р53 уже не нужен.
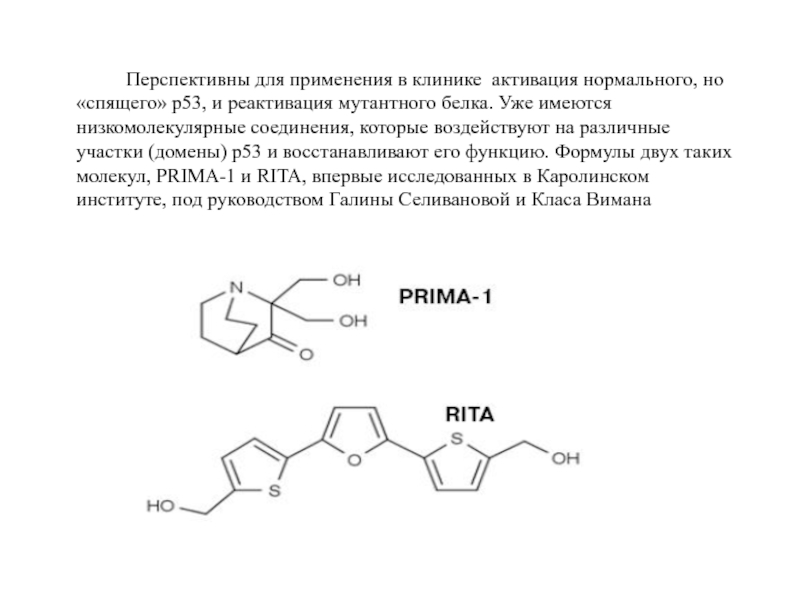
Слайд 112 Перспективны для применения в клинике активация
Слайд 115
недостаточный
апоптоз
избыточный
Онкологические заболевания:
• прямой кишки
• печени
• простаты
• лейкемии
• нейробластома
Аутоимунные заболевания:
• системная красная
• миастения
Частые инфекции:
Вирусные инфекции
норма
Нейродегенеративные заболевания:
• болезнь Альцгеймера
• болезнь Паркинсона
• болезнь Хантингтона
Гематопоэтические заболевания:
• Апластическая анемия
• миелодиспластический синдром
• Т-клеточная лимфоцитопения
Сердечно-сосудистые заболевания:
• Сердечная недостаточность
• Инфаркт миокарда
• воспаление
• сепсис
• диабет 1 типа
Слайд 120Фрагментация ДНК идет поэтапно:
1. Образование крупных фрагментов, содержащих 300 тыс. п.н.,
- активируются Са2+, Mg2+-зависимые эндонуклеазы, ДНК-азы I и II:
- протеолиз топоизомеразы II, участвующей в образовании структуры ДНК высшего порядка (суперспирализованных петель -50 тыс. п.н., дисковидных розеток – 300 тыс. п.н.)
2. Межнуклеосомная деградация ДНК с образованием фрагментов 180-200 п.н. (протяженность нити в нуклеосоме) или кратных им по величине.
- активация эндонуклеазы CAD (за счет расщепления К-3 ее ингибитора ICAD).
- расщепление гистона Н1, защищающего ДНК от действия ДНК-аз на межнуклеосомном уровне.