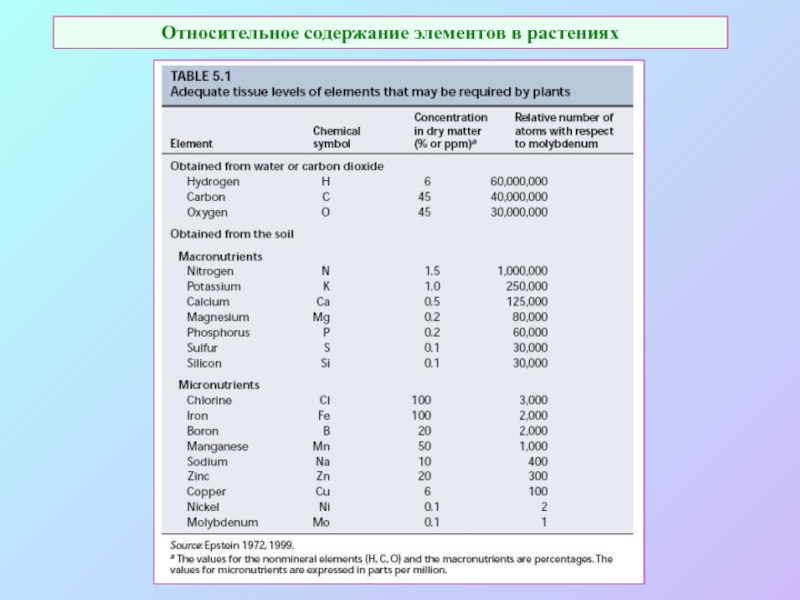
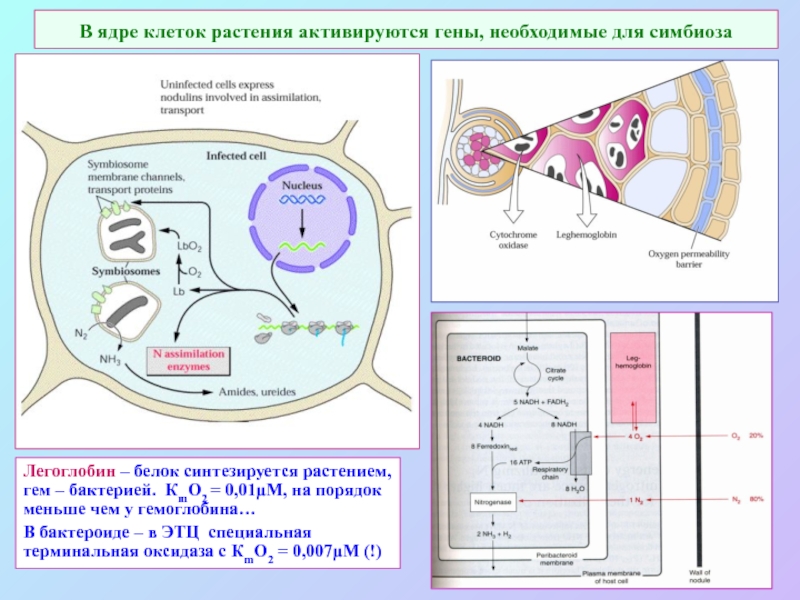
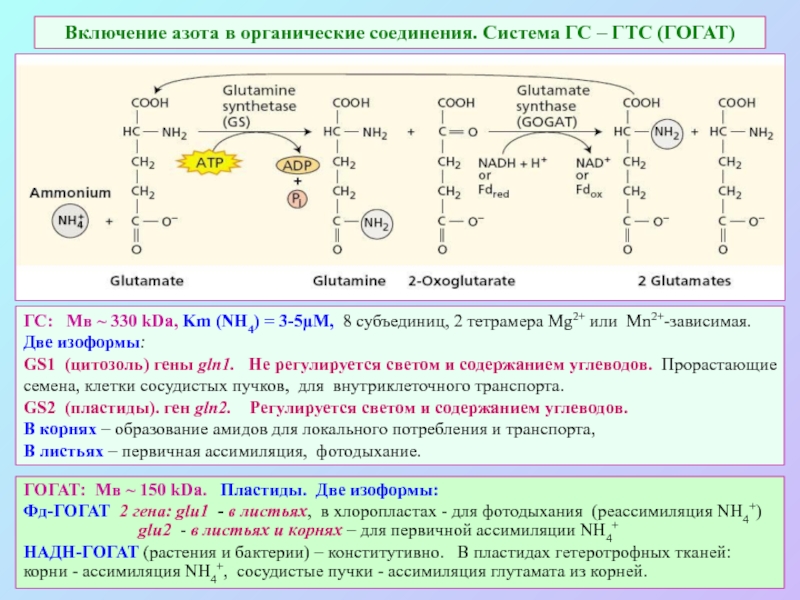
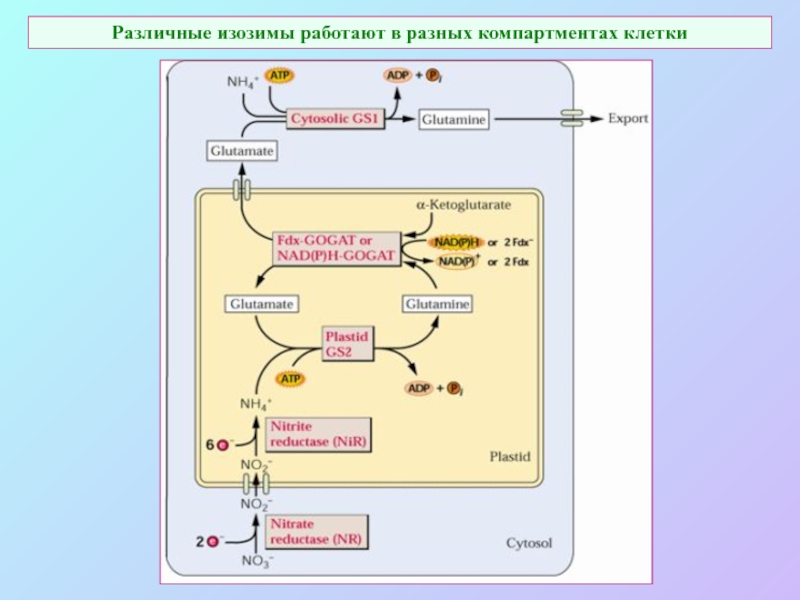
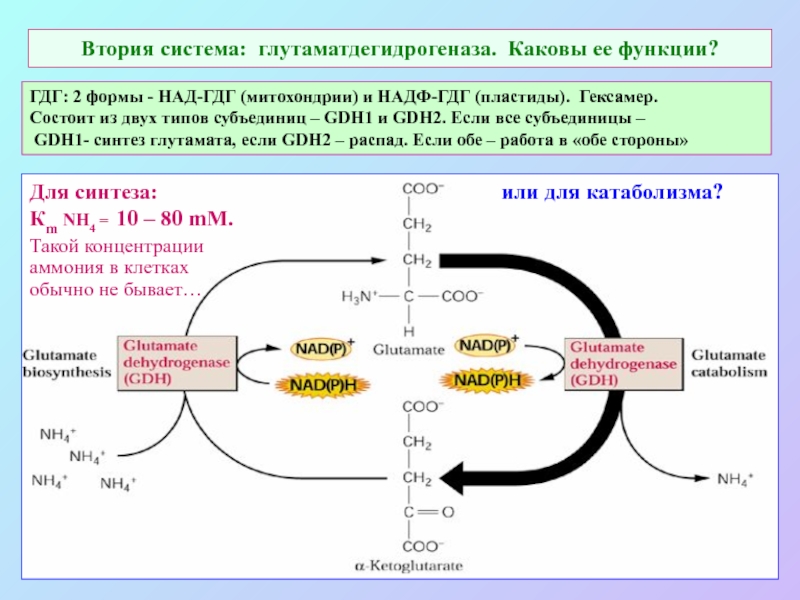
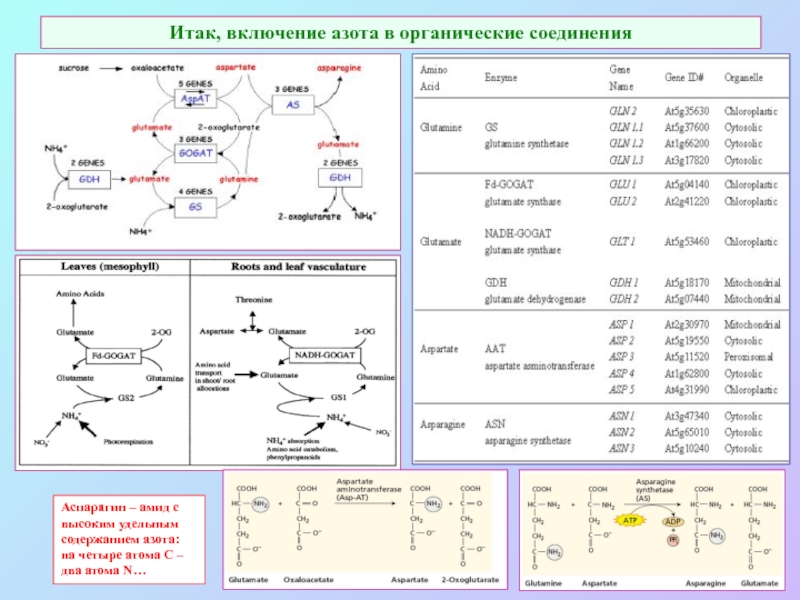
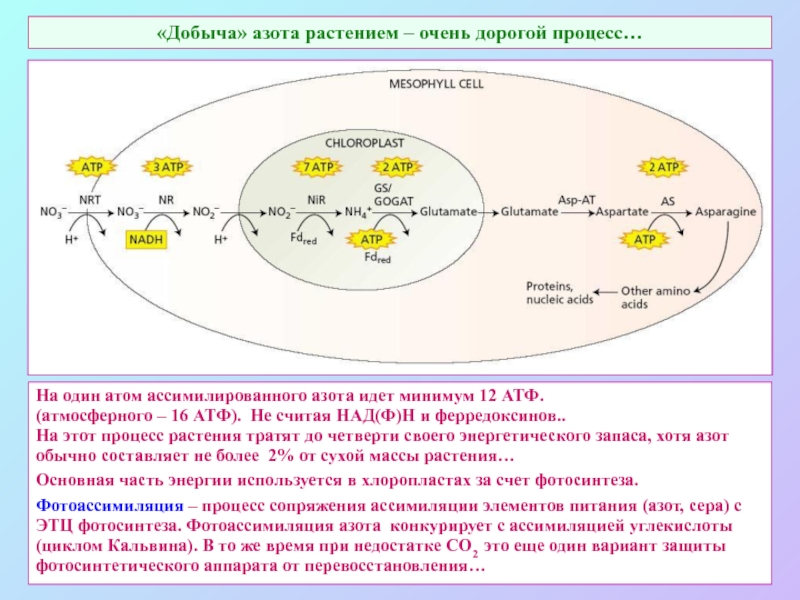
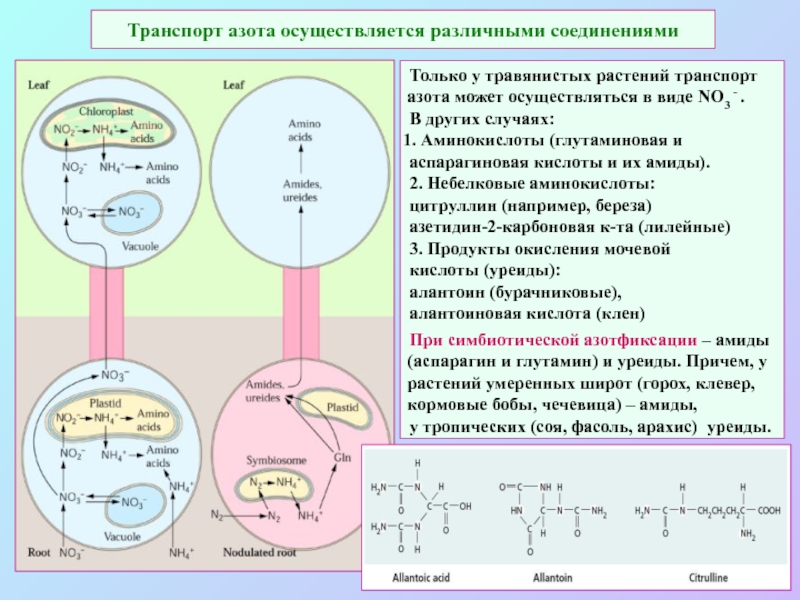
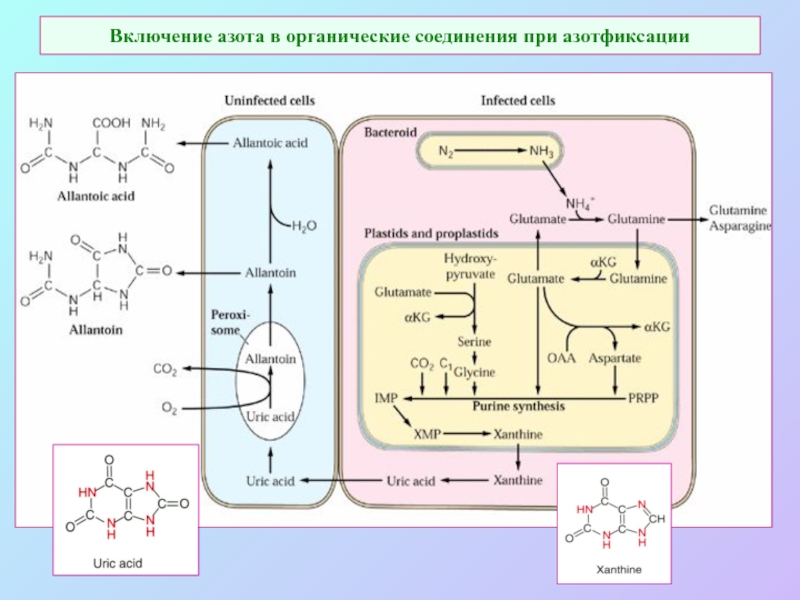
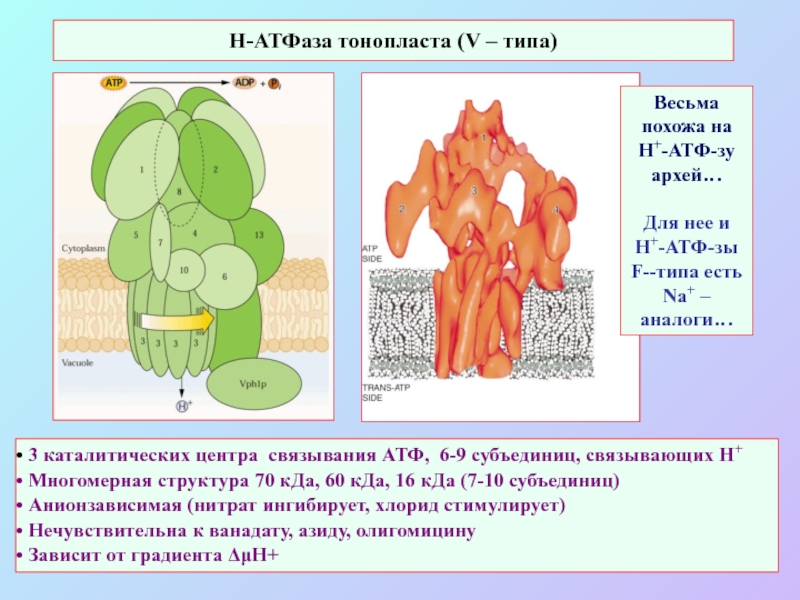
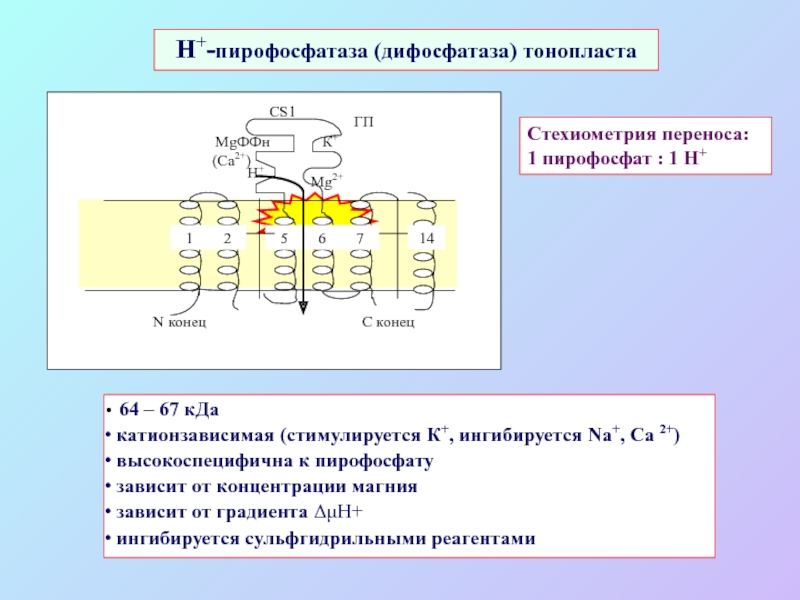
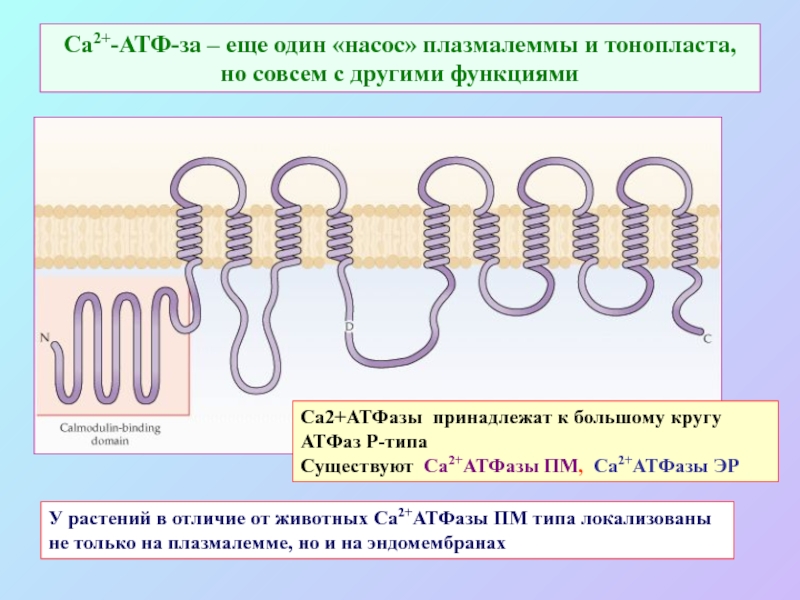
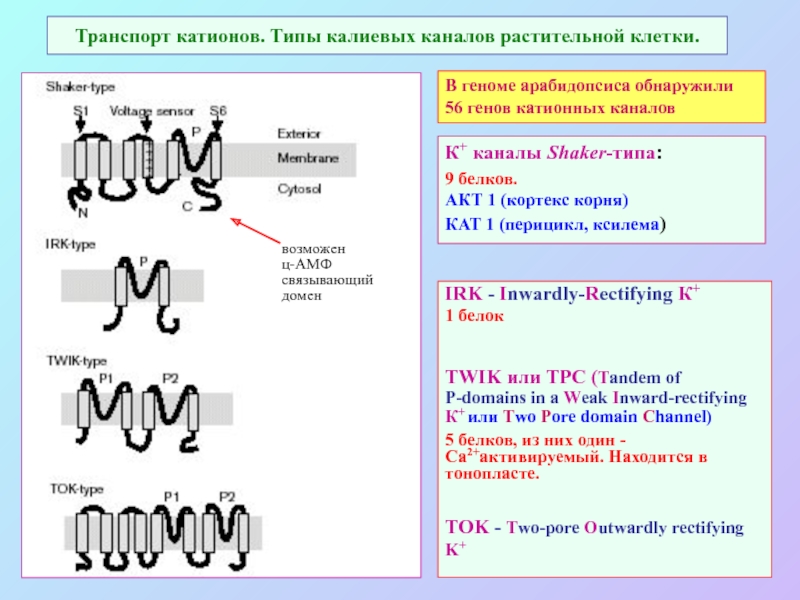
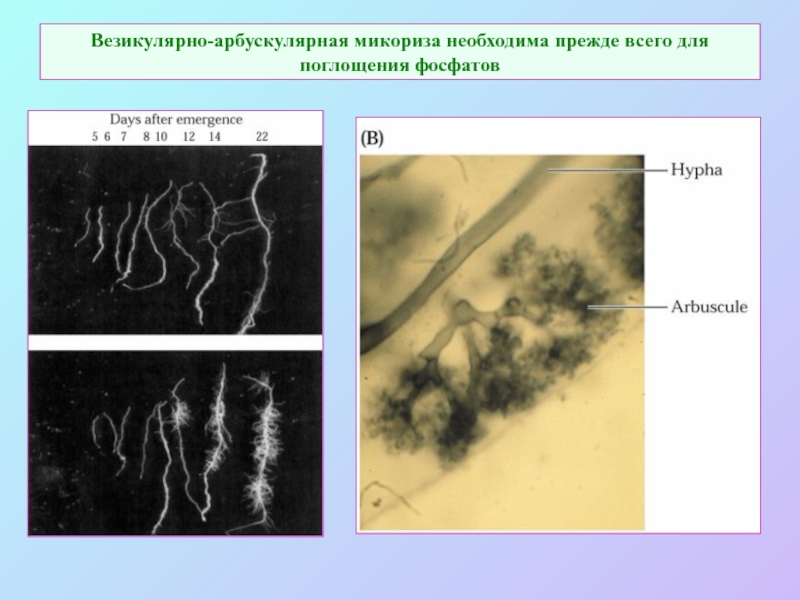
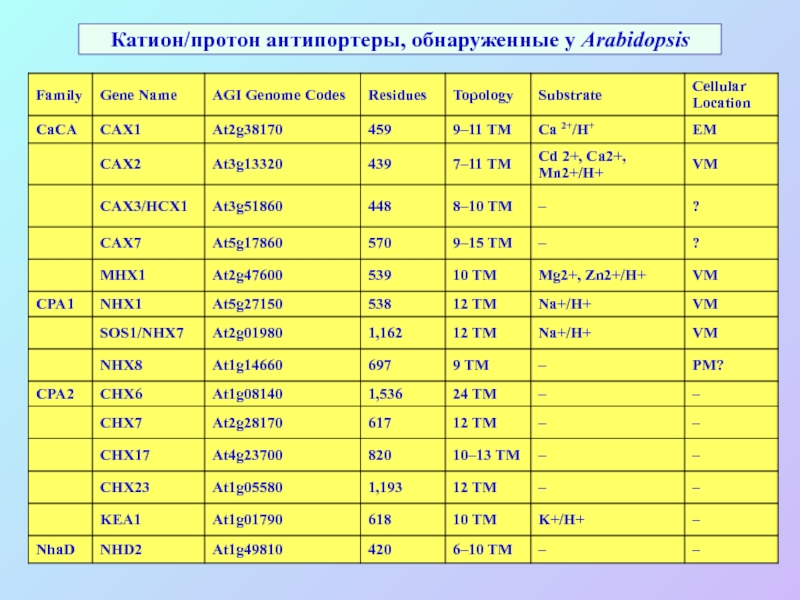
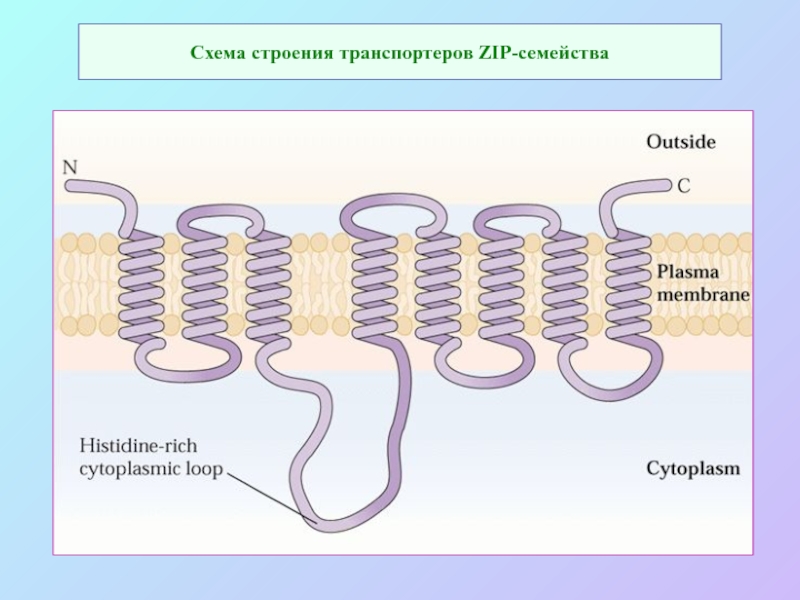
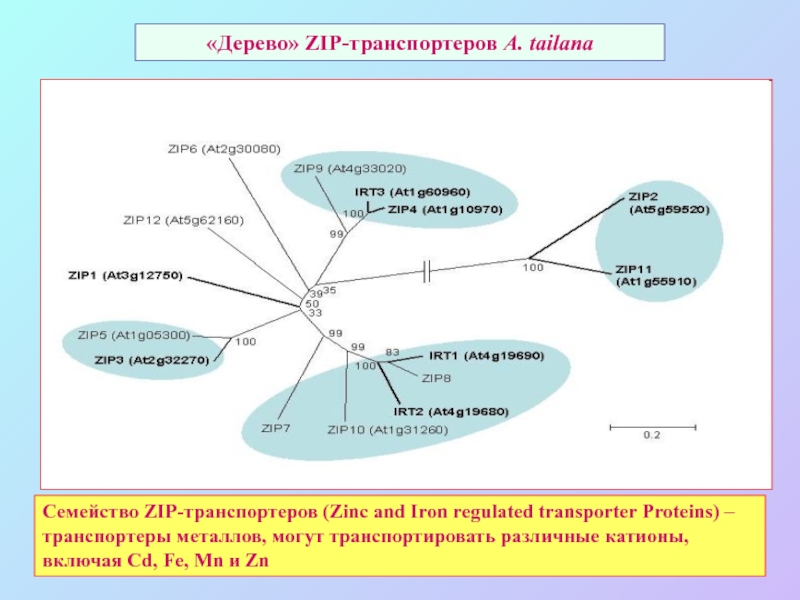
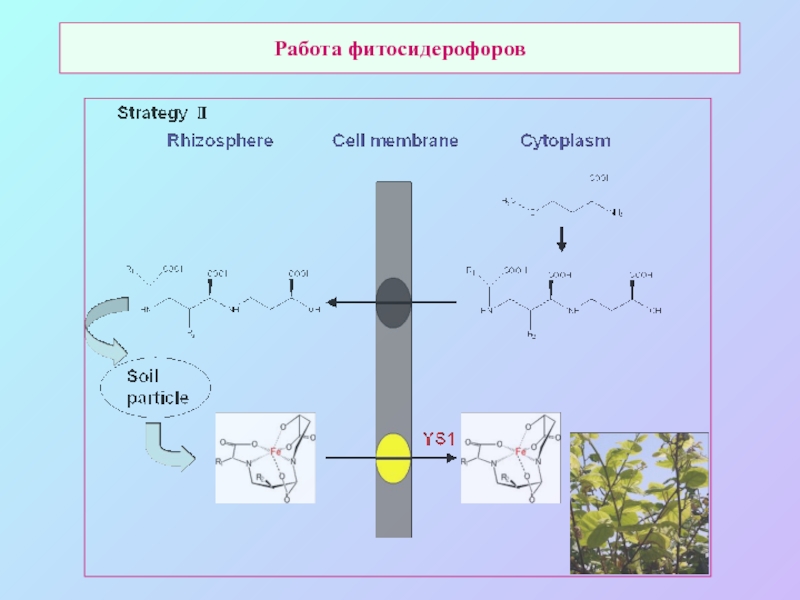
А также: S ~ 0,1%, P ~ 0,2%, K ~ 1,0%, Ca ~ 0,5%, Mg ~ 0,2%
Кроме того Na, Cl, Si.
Fe занимает промежуточное положение.
Микроэлементы: B, Mn, Cu, Zn, Mo.
кроме того - Co, V.
Возможна другая классификация – физиологическая, по процессам,
в которых ключевую роль играют те или иные элементы.
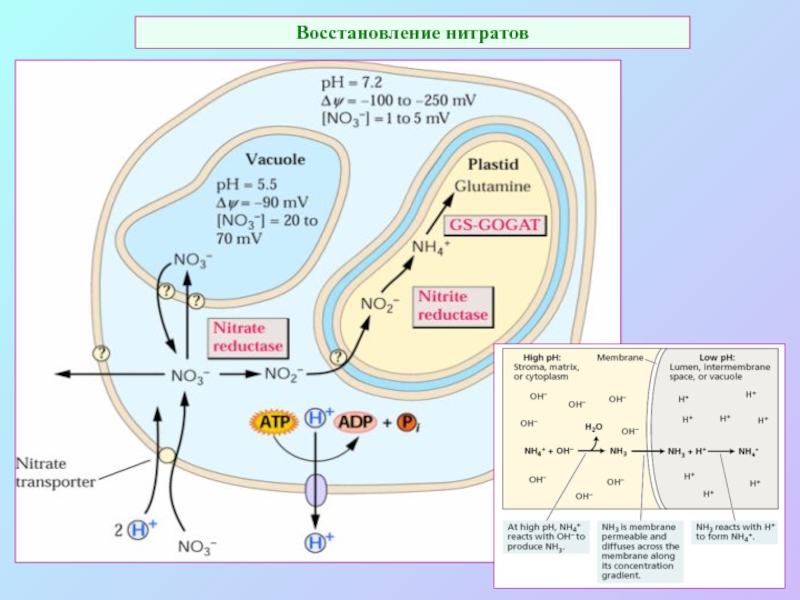
N, S – участвуют в построении органических веществ
P, Si, B – участвуют в запасании энергии и целостности структур клетки
K, Ca, Mg, Cl, Mn, Na – элементы, которые «работают» в ионной форме
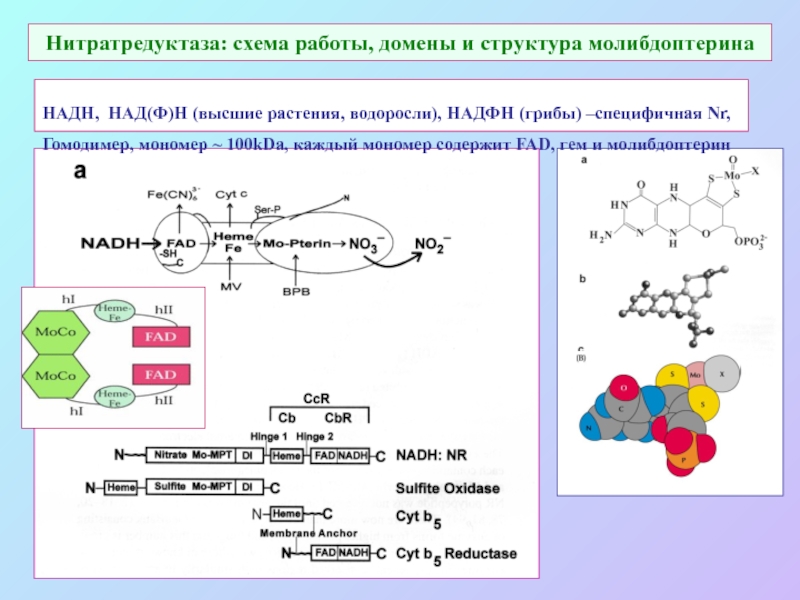
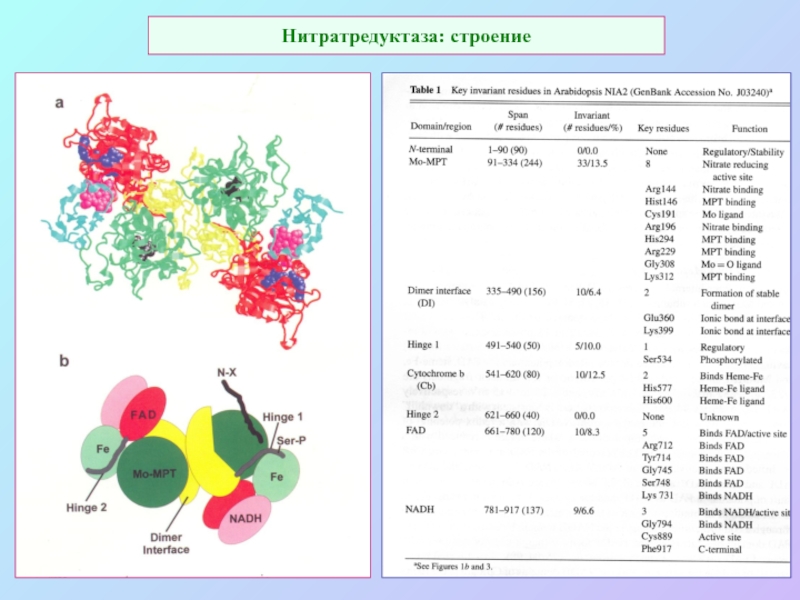
Fe, Zn, Cu, Ni, Mo – элементы, играющие роль в red-ox реакциях