- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Микробиологическая лаборатория и ее задачи. Микроскоп и работа с ним. Морфология шаровидных бактерий презентация
Содержание
- 1. Микробиологическая лаборатория и ее задачи. Микроскоп и работа с ним. Морфология шаровидных бактерий
- 2. Лабораторные занятия по общей микробиологии для факультета ветеринарной медицины
- 3. Тема: Микробиологическая лаборатория и ее задачи. Микроскоп
- 4. Задание: 1.Изучить правила и технику безопасности
- 5. Нa практических занятиях преподаватели и студенты должны
- 6. 1. Работать в халате. 2. В
- 7. 2. Изучить методы исследований, применяемые в микробиологической
- 8. 3. Изучить устройство микроскопов и правила работы
- 9. Бинокулярный микроскоп
- 10. Световой монокулярный микроскоп
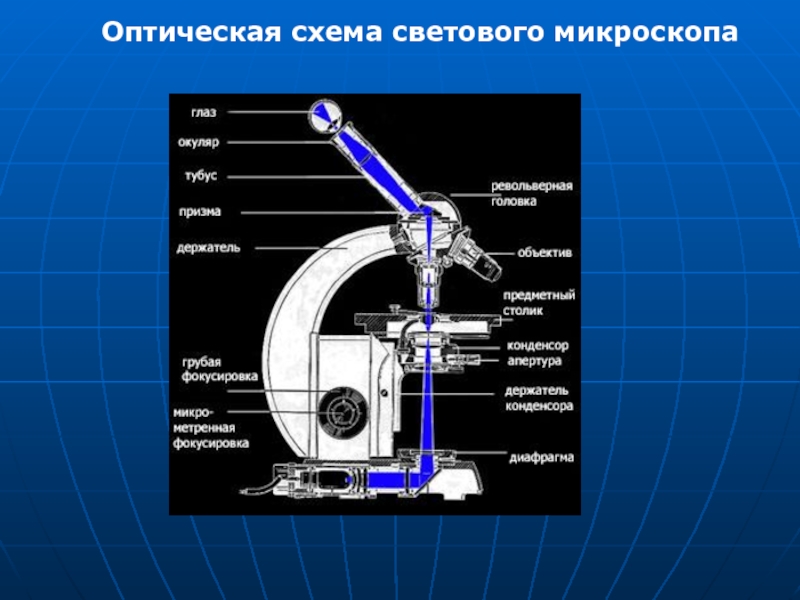
- 11. ордр Оптическая схема светового микроскопа
- 12. Механическая часть микроскопа включает штатив, состоящий из
- 13. Штатив имеет основание и колонку (тубусодержатель). К
- 14. При вращении винтов по часовой стрелке тубус
- 15. Винт перемещения конденсора расположен на штативе справа
- 16. Под предметным столиком находится конденсор (от лат.
- 17. Под конденсором располагается кольцевидный держатель для светофильтров
- 18. Объективы бывают сухие и погруженные (иммерсионные). При
- 19. Лучи в оптически однородной гомогенной среде не
- 20. Собственное увеличение объектива (V) определяют по формуле:
- 21. Величина увеличения объективов обозначена на их оправе
- 22. Окуляр (от лат. okularis – глазной)
- 23. Собственное увеличение окуляра вычисляют по формуле:
- 24. При длительной работе с микроскопом удобно пользоваться
- 25. Качество микроскопа определяется его увеличительной и разрешающей
- 26. Основные методы микроскопии 1)Микроскопия в темном
- 27. 2) Метод фазово-контрастной микроскопии Разработан для
- 28. 3)Люминесцентная, или флуоресцентная, микроскопия Ряд биологических
- 29. Нелюминесцирующие объекты можно обработать специальными флуоресцирующими красителями
- 30. 4) Электронная микроскопия В отличие от светового
- 31. микро Электронный микроскоп
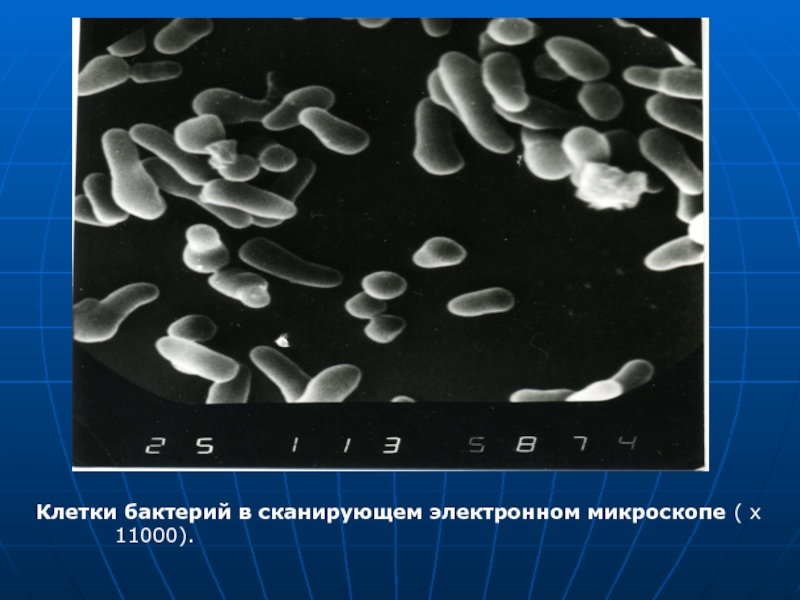
- 32. Клетки бактерий в сканирующем электронном микроскопе ( x 11000).
- 33. Рис. 3. - Микроскопическая картина (препарат
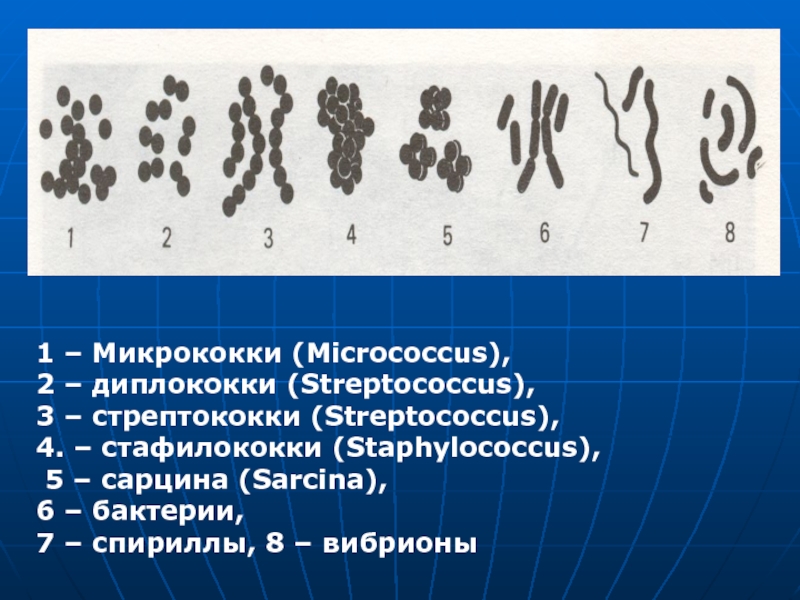
- 34. 1 – Микрококки (Micrococcus),
- 35. Шаровидные формы бактерий 1 – моно/микрококк
- 36. Шаровидные формы бактерий стрептококк стафилококк в чистой культуре в чистой культуре в гное в гное
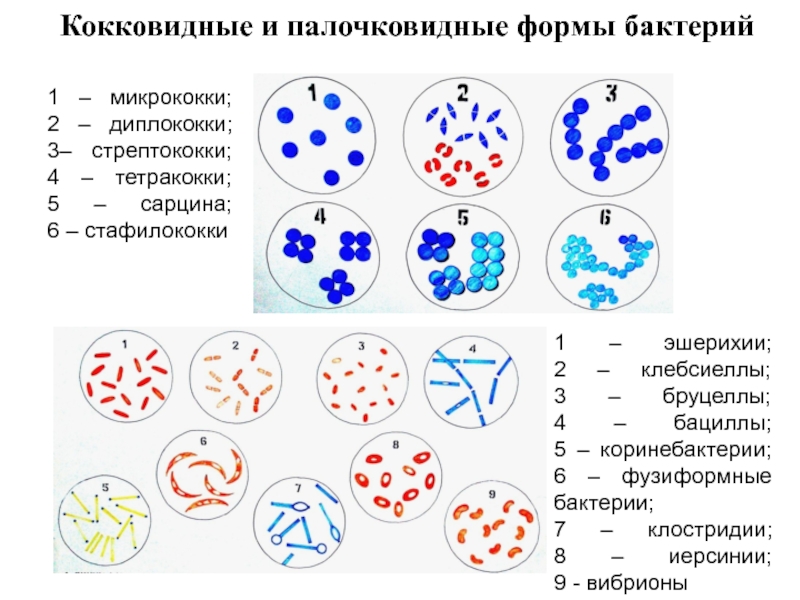
- 37. Кокковидные и палочковидные формы бактерий 1
- 38. 4. Исследование живых клеток микроорганизмов методами раздавленной
- 39. Препараты микроскопируют, слегка затемняя поле зрения; конденсор
- 40. При использовании метода раздавленной капли на чистое
- 41. Метод удобен для исследования подвижности бактериальных клеток,
- 42. Для длительных наблюдений за клетками микроорганизмов применяют
- 43. Размеры бактериальных клеток варьируют в широких пределах.
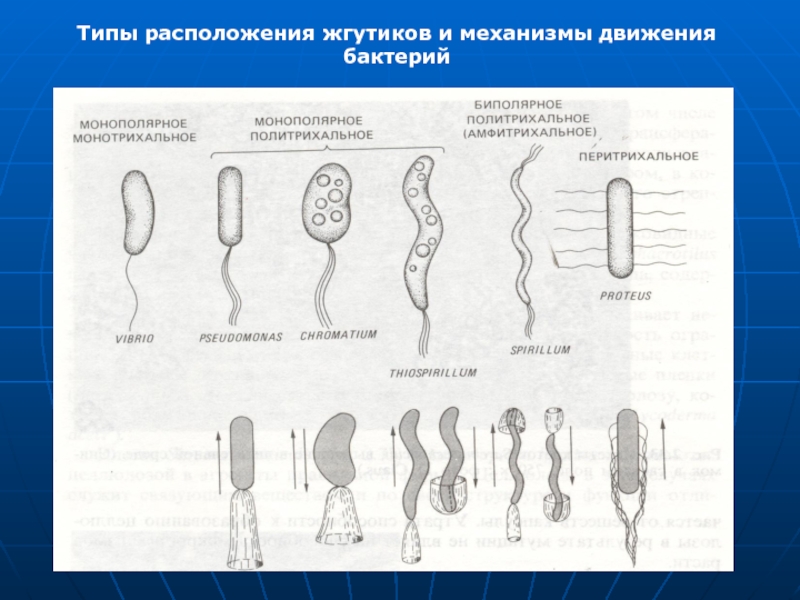
- 44. Типы расположения жгутиков и механизмы движения бактерий
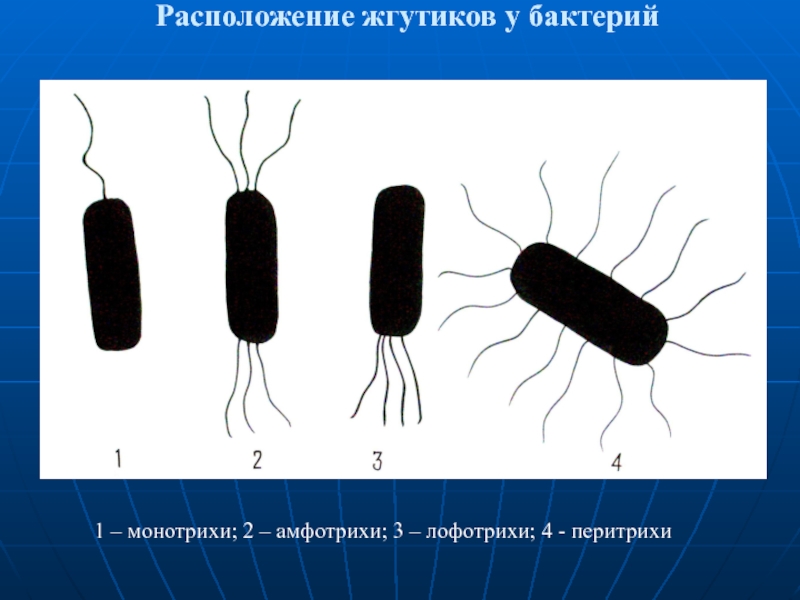
- 45. Расположение жгутиков у бактерий 1 – монотрихи;
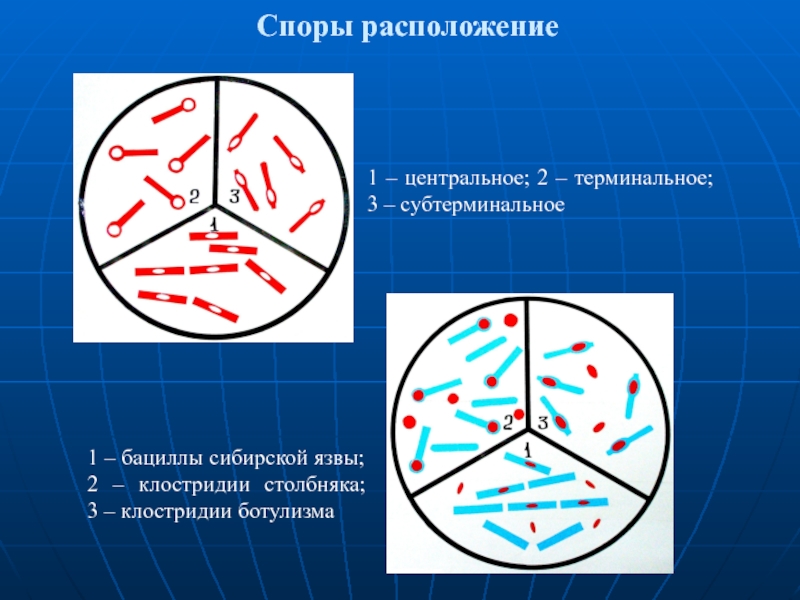
- 46. Формы и расположение спор у бацилл и
- 47. Споры расположение 1 – центральное; 2 –
- 48. Благодарю за внимание!
Слайд 1Куб ГАУ
кафедра микробиологии, эпизоотологии и вирусологии
Ведущий преподаватель доктор биологических наук, профессор
Нино
Слайд 3Тема:
Микробиологическая лаборатория и ее задачи. Микроскоп и работа с ним. Морфология
Техника безопасности в лаборатории
Слайд 4Задание:
1.Изучить правила и технику безопасности при работе в бактериологической лаборатории.
2.
3. Изучить устройство микроскопов и правила работы с ними.
4. Изучить морфологию шаровидных бактерий по рисункам, муляжам, зарисовать.
5. Освоить методику микроскопирования убитых микробов в готовых окрашенных препаратах в сухой и иммерсионной системе, методику определения подвижности микробов в препарате «раздавленная капля", зарисовать.
Слайд 5Нa практических занятиях преподаватели и студенты должны помнить, что они имеют
Слайд 61. Работать в халате.
2. В лаборатории не принимать пищу, воду,
3. Работать только за своим рабочим местом и прикрепленным к нему оборудованием.
4. Работать сидя, после окончания работы тщательно продезинфицировать и вымыть руки с мылом.
5. Использованную посуду, стекла помещают в 1 %й раствор хлорамина. Пинцеты и бактериологические петли фламбируют.
6. Стол, одежду, обувь и другие предметы, случайно загрязненные исследуемым материалом или культурой микроорганизмов, подвергают дезинфекции.
7. После окончания работы нужно поставить в термостат засеянные чашки и пробирки. Культуры микробов и остатки исследуемого материала сдать преподавателю, рабочее место привести в порядок.
Слайд 72. Изучить методы исследований, применяемые в микробиологической практике
Бактериоскопический метод –
Бактериологический метод – включает в себя посевы на обычные и специальные питательные среды с целью изучения культуральных, тинкториальных и биохимических свойств чистой культуры.
Биологический метод (метод биопробы) – заключается в определении патогенных микроорганизмов путём заражения лабораторных животных.
Серологический метод – основывается на идентификации бактерий по сыворотке крови, взятой от больного или переболевшего животного в различных серологических реакциях.
Слайд 83. Изучить устройство микроскопов и правила работы с ними
Изучение мелких
В лабораториях, как правило, имеются световые микроскопы, т.е. для освещения микроорганизмов используют либо естественное, либо искусственное освещение (от лампы накаливания). На следующем рисунке представлен монокулярный микроскоп. В нашей стране бинокулярные микроскопы марки ЛОМО производят на Ленинградском оптико-механическом объединении (г. Санкт-Петербург).
Слайд 12Механическая часть
микроскопа включает штатив, состоящий из основания и тубусодержателя. К тубусодержателю
Оптическая часть микроскопа:
осветительный аппарат (зеркало или лампа искусственного освещения), конденсор, диафрагма, светофильтры, объективы и окуляры.
Слайд 13Штатив имеет основание и колонку (тубусодержатель). К нему примыкают коробка механизмов,
Макрометрический винт (макровинт) служит для ориентировочной установки изображения рассматриваемого объекта.
Микрометрический винт (микровинт) используют для получения более контрастного изображения объекта, изменяя фокусное расстояние. При полном повороте микровинта труба передвигается на 0,1 мм (100 мкм).
Слайд 14 При вращении винтов по часовой стрелке тубус опускается по направлению к
Предметный столик служит для размещения на нем препарата с объектом исследования и фиксации его на столике с помощью препаратодержателя. Предметный столик перемещается во взаимно перпендикулярных плоскостях с помощью винтов препаратоводителя. В центре столика находится круглое отверстие для освещения препарата снизу лучами света, направляемыми зеркалом или лампочкой.
Слайд 15Винт перемещения конденсора расположен на штативе справа под столиком и служит
При поднятии конденсора и раскрытии диафрагмы освещенность объекта максимальна, при опускании конденсора и закрытии диафрагмы – наоборот минимальна.
Тубус (труба) — оправа, в которую вставлен окуляр микроскопа. К нижней части тубуса прикрепляется револьвер (объективодержатель) с гнездами для объективов.
Слайд 16Под предметным столиком находится конденсор (от лат. сопdenso – уплотняю, сгущаю),
Окрашенные препараты лучше рассматривать при почти полностью открытой диафрагме, неокрашенные – при уменьшенном отверстии диафрагмы.
Слайд 17Под конденсором располагается кольцевидный держатель для светофильтров (обычно к микроскопу прилагаются
Объектив (от лат. objectum — предмет) — наиболее важная часть микроскопа. Это многолинзовая короткофокусная система, от качества которой зависит в основном изображение объекта. К препарату обращена фронтальная линза объектива. Именно она обеспечивает увеличение. Остальные линзы в системе объектива выполняют преимущественно функции коррекции оптических недостатков, возникающих при исследовании объектов.
Слайд 18 Объективы бывают сухие и погруженные (иммерсионные). При работе с сухими объективами
Слайд 19Лучи в оптически однородной гомогенной среде не меняют своего направления. Иммерсионные
I — immersion (иммерсия), HI — homogen immersion (однородная иммерсия),
01 — oil immersion, МИ — масляная иммерсия.
Объективы различают по их увеличению.
Студентам необходимо записать характеристику объективов сухой и масляной системы, зарисовать ход лучей при разных системах микроскопирования.
Слайд 20Собственное увеличение объектива (V) определяют по формуле:
где l –
f – фокусное расстояние объектива: чем оно больше, тем меньше увеличение объектива.
Слайд 21 Величина увеличения объективов обозначена на их оправе (8х, 40х, 9х). Каждый
У объективов с малым увеличением расстояние от фронтальной линзы объектива до препарата больше, чем у объективов с большим увеличением. Так, объективы с увеличением 8х, 40х и 90х имеют соответственно рабочие расстояния 13,8; 0,6 и 0,12 мм. расстояние до объектива 0,12 мм, поэтому его нередко называют «близоруким».
Слайд 22Окуляр (от лат. okularis – глазной)
Окуляр состоит из двух линз
Увеличение окуляра указано на его оправе. Рабочее увеличение окуляров колеблется в пределах от 4х до 15х.
Слайд 23Собственное увеличение окуляра вычисляют по формуле:
где L – расстояние наилучшего
F – фокусное расстояние линз окуляра.
Слайд 24При длительной работе с микроскопом удобно пользоваться двойными окулярами – бинокулярной
Слайд 25Качество микроскопа определяется его увеличительной и разрешающей способностями.
Увеличительная способность микроскопа
Коэффициент
Слайд 26Основные методы микроскопии
1)Микроскопия в темном поле
В основе метода лежит эффект Тиндаля
Слайд 272) Метод фазово-контрастной микроскопии
Разработан для наблюдения за прозрачными объектами. Он
фазово-контрастное устройство состоит из фазовых объективов (на оправе имеется буква «Ф»), конденсоров с набором кольцевых диафрагм и вспомогательного микроскопа (оптического устройства, помещаемого в тубус вместо окуляра при установке фазового контраста
Слайд 283)Люминесцентная, или флуоресцентная, микроскопия
Ряд биологических объектов способен при освещении коротковолновыми лучами
Слайд 29 Нелюминесцирующие объекты можно обработать специальными флуоресцирующими красителями – флуорохромами (акридином желтым,
Препараты, окрашенные флуорохромами, изучают в средах, не люминесцирующих под действием коротковолновых лучей: в воде, глицерине, вазелиновом масле или физиологическом растворе.
Слайд 304) Электронная микроскопия
В отличие от светового микроскопа освещение объекта происходит не
Слайд 33 Рис. 3. - Микроскопическая картина (препарат шаровидных бактерий, простая окраска,
4. Изучить морфологию шаровидных бактерий по рисункам, муляжам, зарисовать
Слайд 34
1 – Микрококки (Micrococcus),
2 – диплококки (Streptococcus),
3 –
4. – стафилококки (Staphylococcus),
5 – сарцина (Sarcina),
6 – бактерии, 7 – спириллы, 8 – вибрионы
Слайд 35
Шаровидные формы бактерий
1 – моно/микрококк
2 – диплококк
3 – тетракокк
4 - стрептококк
5
6 - стафилококк
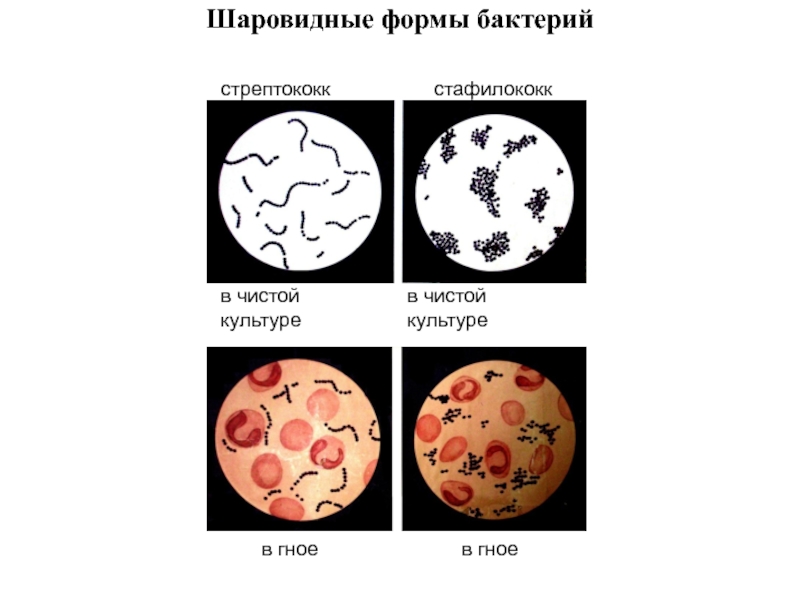
Слайд 36Шаровидные формы бактерий
стрептококк
стафилококк
в чистой культуре
в чистой культуре
в гное
в гное
Слайд 37Кокковидные и палочковидные формы бактерий
1 – микрококки; 2 –
1 – эшерихии; 2 – клебсиеллы; 3 – бруцеллы; 4 – бациллы; 5 – коринебактерии; 6 – фузиформные бактерии; 7 – клостридии; 8 – иерсинии; 9 - вибрионы
Слайд 384. Исследование живых клеток микроорганизмов методами раздавленной и висячей капли
В
Оба метода применяют для выявления подвижности клеток микроорганизмов, наблюдения за размножением, образованием и прорастанием спор, установления реакции микроорганизмов на химические соединения и физические факторы воздействия, изучения размеров клеток, характера их расположения, определения запасных веществ в клетке.
Слайд 39 Препараты микроскопируют, слегка затемняя поле зрения; конденсор немного опускают, поступление света
Слайд 40 При использовании метода раздавленной капли на чистое предметное стекло наносят каплю
Слайд 41Метод удобен для исследования подвижности бактериальных клеток, а также просмотра крупных
Слайд 42 Для длительных наблюдений за клетками микроорганизмов применяют метод висячей капли.
Для
Слайд 43 Размеры бактериальных клеток варьируют в широких пределах. Диаметр кокков и палочек
Слайд 46Формы и расположение спор у бацилл и клостридий
1– бациллярное центральное,
2 – бациллярное терминальное, 3 и 5 – плектридиальное,
4 – клостридиальное,
6 – латеральное