- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Методы исследования нуклеиновых кислот. Рекомбинантные ДНК. Генная терапия. Трансгенные организмы презентация
Содержание
- 1. Методы исследования нуклеиновых кислот. Рекомбинантные ДНК. Генная терапия. Трансгенные организмы
- 2. Методы исследования нуклеиновых кислот. Молекулярно-генетические методы —
- 3. Основные понятия Рестриктазы (эндонуклеазы рестрикции)
- 4. Радиоавтография - метод изучения распределения радиоактивных веществ
- 5. Основные ферменты, используемые в генной инженерии
- 6. Методы Электрофорез фрагментов ДНК обеспечивает разделение
- 7. Метод «сэндвич»- гибридизации - является одной из
- 8. Методы блот-гибридизации. ДНК, разделенную гель-электрофорезом переносят
- 10. КЛОНИРОВАНИЕ ФРАГМЕНТОВ НУКЛЕИНОВЫХ КИСЛОТ IN VITRO.
- 11. Полимеразная цепная реакция (ПЦР) — метод амплификации
- 12. Процесс амплификации заключается в осуществлении повторяющихся циклов.
- 14. Секвенирование ДНК Определение нуклеотидной последовательности. Метод
- 15. Секвенирование позволяет определить полную нуклеотидную последовательность всех
- 16. Рекомбинантные ДНК Рекомбинантная ДНК это молекула ДНК,
- 18. Генная инженерия и генная терапия.
- 19. Генная инженерия ГЕННАЯ ИНЖЕНЕРИЯ, или технология
- 20. Если внести в организм (растение,
- 21. Изменения генов прежде всего связано с преобразованием
- 22. Генная инженерия берет свое начало в 1973
- 23. Генная терапия -новая область современной биомедицины, основанная
- 24. - введение ретровирусного вектора, экспрессирующего
- 25. Концепция генной терапии существует уже на протяжении
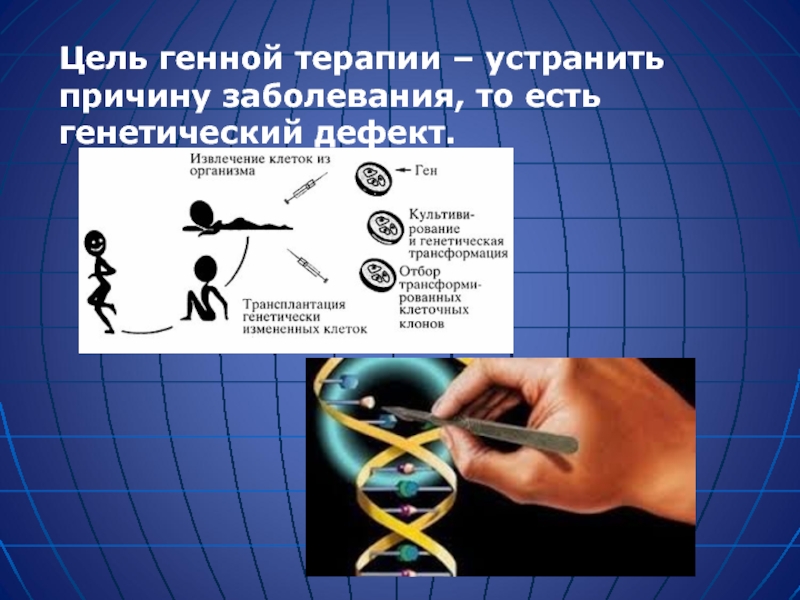
- 26. Цель генной терапии – устранить причину заболевания, то есть генетический дефект.
- 27. Методы генной терапии: Используют два основных подхода,
- 28. Подходы генной терапии Замещение нефункционального гена
- 29. Подходы генной терапии Подавление активности гена:
- 30. Методы доставки генов в клетки Невирусные:
- 31. Аденовирусы вызывают легкие формы инфекции верхних дыхательных
- 32. Бакуловирусы Вирусы насекомых, могут инфицировать человеческие
- 33. Генная терапия ex vivo Копию
- 34. Генная терапия in vivo Терапевтический ген вставляют
- 35. Перспективы применения генотерапии в мире •Первой
- 36. Трансгенные организмы. Трансге́нный органи́зм — живой организм,
- 37. Целью создания трансгенных организмов является получение организма
- 38. Создание трансгенных организмов используют: в научном
- 39. В различных отраслях хозяйственной деятельности человека используются
- 40. Разрабатываются трансгенные растения, способные продуцировать в интересах
- 41. Трансгенные животные созданы для производства продуктов медицинского
- 42. Трансгенные мыши оказались крайне необходимыми при изучении
- 43. Светящиеся в темноте коты В 2007 году
- 44. Эко-свинья Эко-свинья - это свинья, которая была
- 45. Борющиеся с загрязнениями растения Ученые Вашингтонского университета
- 46. Ядовитая капуста Ученые недавно выделили ген, отвечающий
- 47. Плетущие паутину козы Крепкий и гибкий паутиний
- 48. Быстрорастущий лосось Генетически модифицированный лосось компании «AquaBounty»
- 49. Помидор Flavr Savr Помидор Flavr Savr был
- 50. Банановые вакцины Вскоре люди смогут получать вакцину
- 51. Менее страдающие от метеоризма коровы Коровы производят
- 52. Генетически модифицированные деревья Деревья изменяются генетически для
- 53. Лекарственные яйца Британские ученые создали породу генетически
- 54. Активно связывающие углерод растения Ежегодно люди добавляют
- 56. Как осуществляется клонирование Из яйцеклетки удаляют ядро
- 57. Клонирование Из соматической клетки того организма, который
- 58. Клонирование В яйцеклетку вводят полученное ядро, содержащее ДНК клонируемого организма.
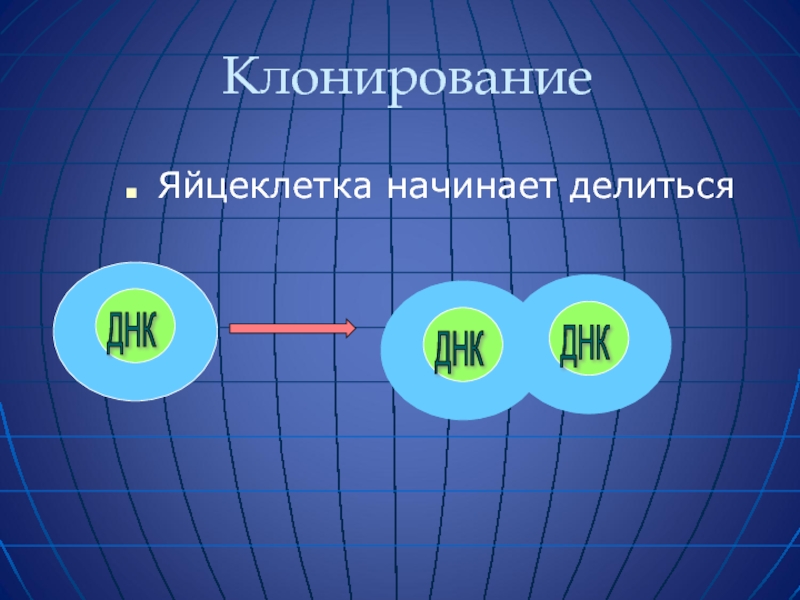
- 59. Клонирование Яйцеклетка начинает делиться
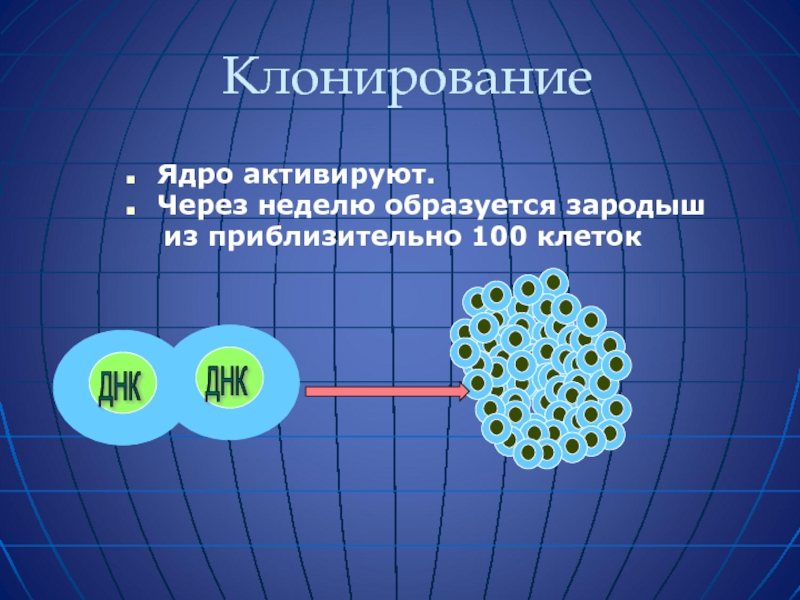
- 60. Клонирование Ядро активируют. Через неделю образуется зародыш из приблизительно 100 клеток
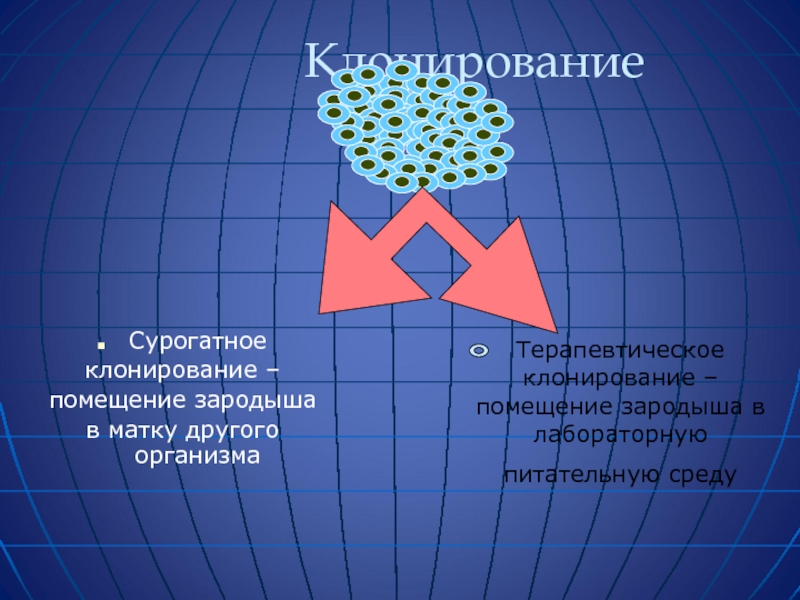
- 61. Клонирование Сурогатное
- 62. В 1997 году впервые было получено
- 63. Сама по себе технология клонирования весьма перспективна.
- 64. Первое клонированное животное - овечка Долли.
- 65. Но все же перспектив у клонирования много.
- 66. Задачи, стоящие перед клонированием: Клонирование органов и
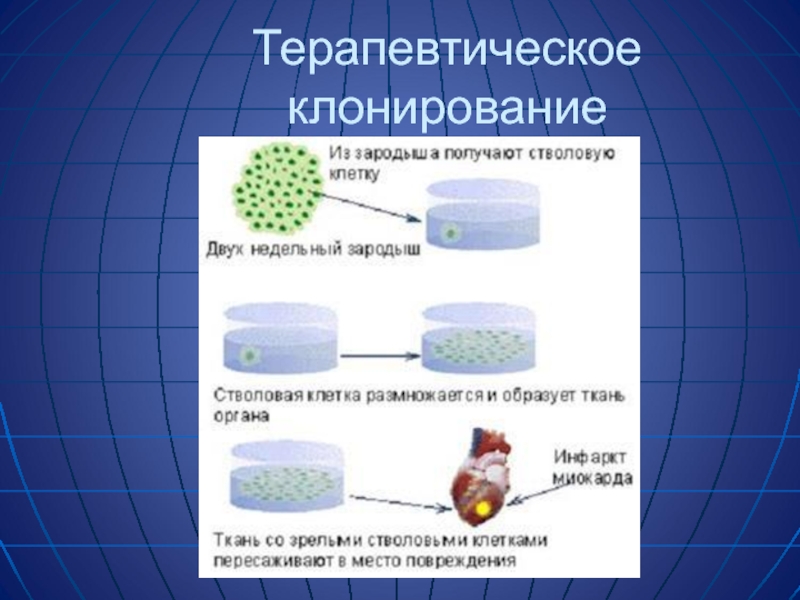
- 67. Терапевтическое клонирование
- 68. Человеческий
- 69. Репродуктивное
- 70. В каких сферах находят сегодня
- 71. Благодарю за внимание!
Слайд 1Методы исследования нуклеиновых кислот. Рекомбинантные ДНК. Генная терапия. Трансгенные организмы. Клонирование клеток
Слайд 2Методы исследования нуклеиновых кислот.
Молекулярно-генетические методы — большая и разнообразная группа методов,
Слайд 3Основные понятия
Рестриктазы (эндонуклеазы рестрикции) группа ферментов, относящихся к классу гидролаз,
Слайд 4Радиоавтография - метод изучения распределения радиоактивных веществ в исследуемом объекте
Гибридизационные
Слайд 6Методы
Электрофорез фрагментов ДНК обеспечивает разделение фрагментов при их распределении на
Слайд 7Метод «сэндвич»- гибридизации - является одной из разновидностей зондовой технологии. При
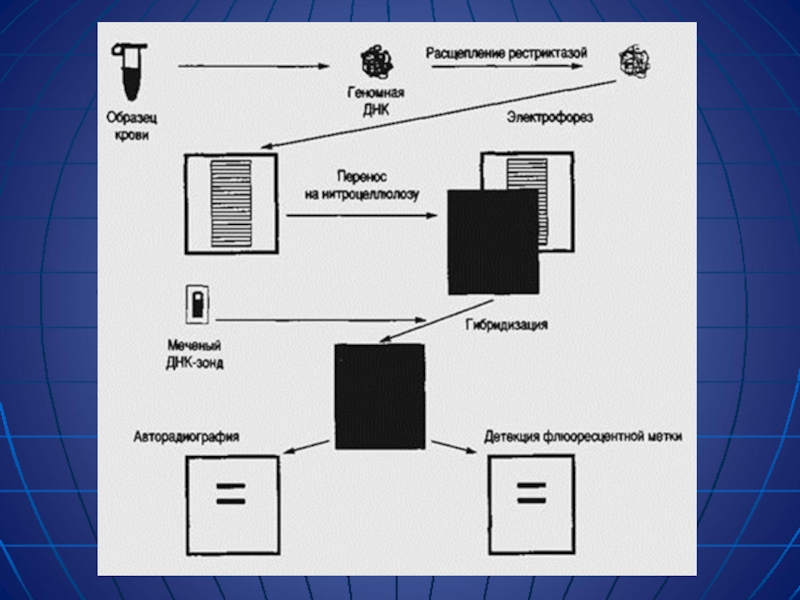
Слайд 8Методы блот-гибридизации.
ДНК, разделенную гель-электрофорезом переносят с геля на нитроцеллюлозный фильтр.
Слайд 10КЛОНИРОВАНИЕ ФРАГМЕНТОВ НУКЛЕИНОВЫХ КИСЛОТ IN VITRO.
В большинстве случаев для успешной
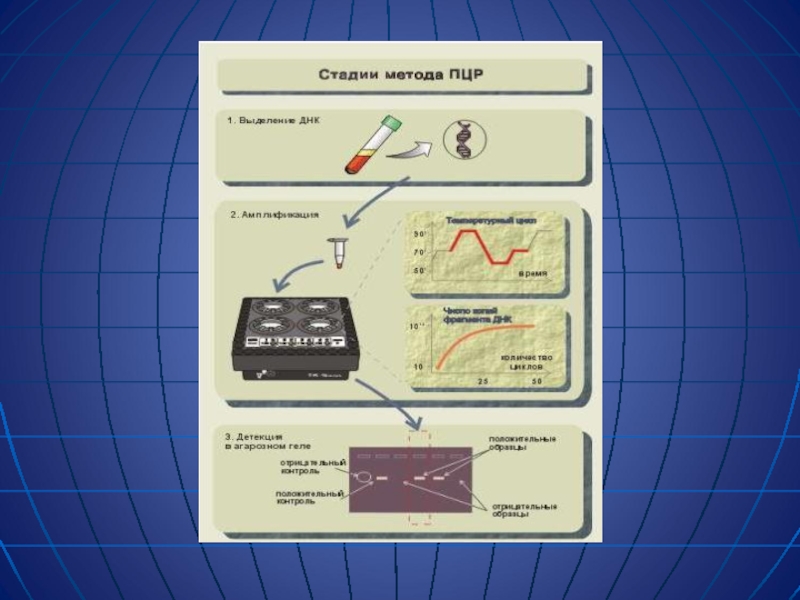
Слайд 11Полимеразная цепная реакция (ПЦР) — метод амплификации ДНК in vitro. В
Слайд 12Процесс амплификации заключается в осуществлении повторяющихся циклов. Каждый цикл включает 3
1. Температурная денатурация ДНК (разделение двухцепочечной ДНК на одноцепочечные молекулы)
2. Присоединение праймеров к комплементарным последовательностям одноцепочечных молекул (отжиг)
3. Синтез полинуклеотидных цепей на одноцепочечных молекулах в границах присоединенных праймеров с помощью полимеразы.
Слайд 14Секвенирование ДНК
Определение нуклеотидной последовательности.
Метод секвенирования по Максаму — Гилберту основан
Другой ферментативный метод (метод Сэнгера) базируется на применении аналогов нуклеотидов, прерывающих синтез комплементарной цепи ДНК по одноцепочечной матрице в месте встраивания в цепь соответствующего аналога.
Слайд 15Секвенирование позволяет определить полную нуклеотидную последовательность всех хромосом, всего ДНК любого
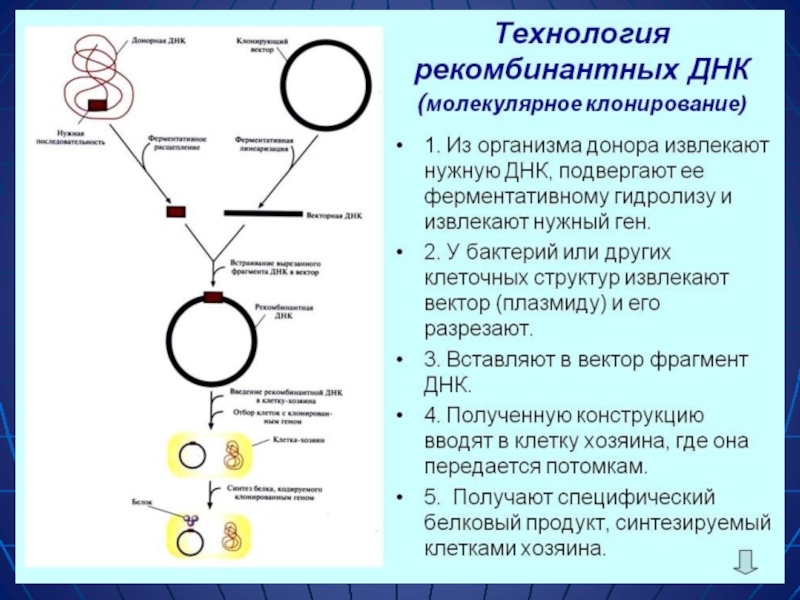
Слайд 16Рекомбинантные ДНК
Рекомбинантная ДНК это молекула ДНК, полученная в результате объединения in
Слайд 19Генная инженерия
ГЕННАЯ ИНЖЕНЕРИЯ, или технология рекомбинантных ДНК, изменение с помощью биохимических
Слайд 20
Если внести в организм (растение, микроорганизм, животное или даже человек) новые
Слайд 21Изменения генов прежде всего связано с преобразованием химической структуры ДНК: изменение
В результате в клетке начинает синтезироваться новый белок, что приводит к появлению у организма новых свойств.
Слайд 22Генная инженерия берет свое начало в 1973 году, когда генетики Стэнли
Слайд 23Генная терапия -новая область современной биомедицины, основанная на введении в организм
Слайд 24
- введение ретровирусного вектора, экспрессирующего ген аденозиндеаминазы (ADA) (частота встречаемости
(National Institute of Health (NIH), Bethesda, USA)
14 сентября 1990 г.
Слайд 25Концепция генной терапии существует уже на протяжении последних десятилетий. Она заключатся
Слайд 27Методы генной терапии:
Используют два основных подхода, различающиеся природой клеток- мишеней:
- фетальную
- соматическую генотерапию , при которой генетический материал вводят только в соматические клетки и он не передается половым клеткам.
Есть и третий подход - активация собственных генов организма с целью полного или частичного преодоления действия мутантного гена. Яркий пример такого подхода - использование гидроксимочевины для активации синтеза гемоглобина F у больных с серповидноклеточной анемией и талассемиями
Слайд 28Подходы генной терапии
Замещение нефункционального гена – потенциально самый простой и
Компенсация утраченной функции - добавление функциональной копии гена:Можно применять, если болезнь вызвана потерей функции гена (рецессивная мутация)
Подавление функции гена - добавление «ингибирующего» гена :Для болезней, вызванных чрезмерной активностью гена (доминантная мутация)
Слайд 29Подходы генной терапии
Подавление активности гена:
Можно использовать механизм РНК-интерференции
РНК может
Уничтожение мутантных клеток – лечение рака
Слайд 30Методы доставки генов в клетки
Невирусные:
•Прямая инъекция ДНК в ткани
•Искусственные липосомы
Вирусные:
•Эволюционно
•Используют модифицированные вирусы, утратившие способность размножаться
Слайд 31Аденовирусы вызывают легкие формы инфекции верхних дыхательных путей (обычную простуду). Инфицируют
Аденоассоциированные вирусы
•Вызывает бессимптомные инфекции, вызывает слабый иммунный ответ •Инфицируют широкий диапазон делящихся и неделящихся клеток
•Не может размножаться в отсутствии аденовируса
Слайд 32Бакуловирусы
Вирусы насекомых, могут инфицировать человеческие клетки, но не могут в
Вирусы герпеса
Имеет специфичность в отношении нервных клеток, могут установиться пожизненные латентные инфекции, находятся в эписомальном или интегрированном состоянии
Ретровирусы
Инфицируют только делящиеся клетки, интегрирует в геном хозяина, особенно пригодны для терапии рака
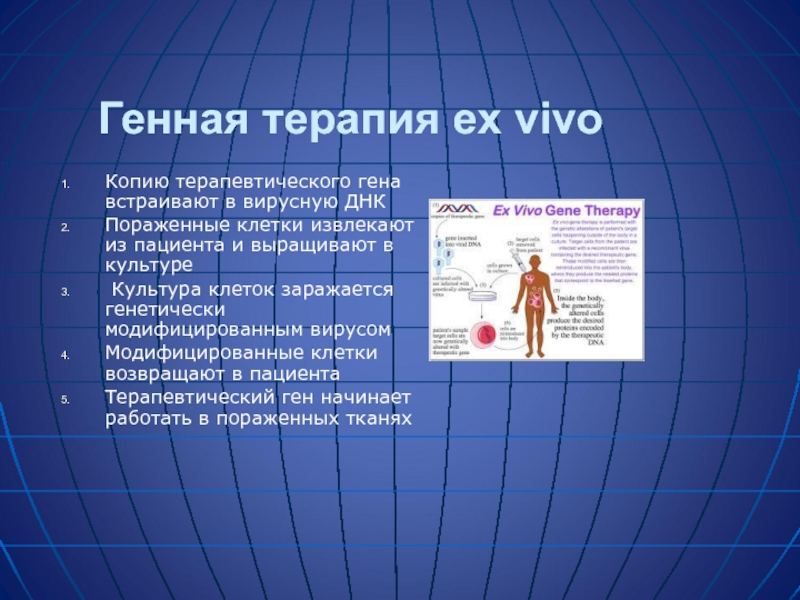
Слайд 33Генная терапия ex vivo
Копию терапевтического гена встраивают в вирусную ДНК
Пораженные клетки извлекают из пациента и выращивают в культуре
Культура клеток заражается генетически модифицированным вирусом
Модифицированные клетки возвращают в пациента
Терапевтический ген начинает работать в пораженных тканях
Слайд 34Генная терапия in vivo
Терапевтический ген вставляют в вирусную ДНК, липосому или
ДНК вводят в ткани пациента путем тканеспецифической инъекции
Терапевтический ген начинает работать в пораженных клетках
Слайд 35Перспективы применения генотерапии в мире
•Первой страной, разрешившей применение препаратов для генной
•В декабре 2011 года российский Институт Стволовых Клеток Человека получил регистрационное удостоверение на геннотерапевтический препарат «Неоваскулген», предназначенный для лечения ишемии нижних конечностей
•Препарат «Glybera» стал четвертым в мире геннотерапевтическим лекарством, получившим официальное одобрение
Слайд 36Трансгенные организмы.
Трансге́нный органи́зм — живой организм, в геном которого искусственно введен
Слайд 37Целью создания трансгенных организмов является получение организма с новыми свойствами. Клетки
Слайд 38Создание трансгенных организмов используют:
в научном эксперименте для развития технологии создания трансгенных
в сельском хозяйстве для получения новых сортов растений и пород животных;
в биотехнологическом производстве плазмид и белков.
Слайд 39В различных отраслях хозяйственной деятельности человека используются трансгенные бактерии. Кроме того,
Слайд 40Разрабатываются трансгенные растения, способные продуцировать в интересах человека химические вещества и
Слайд 41Трансгенные животные созданы для производства продуктов медицинского значения. Цепным инструментом для
Слайд 42Трансгенные мыши оказались крайне необходимыми при изучении моногенных болезней, злокачественных опухолей
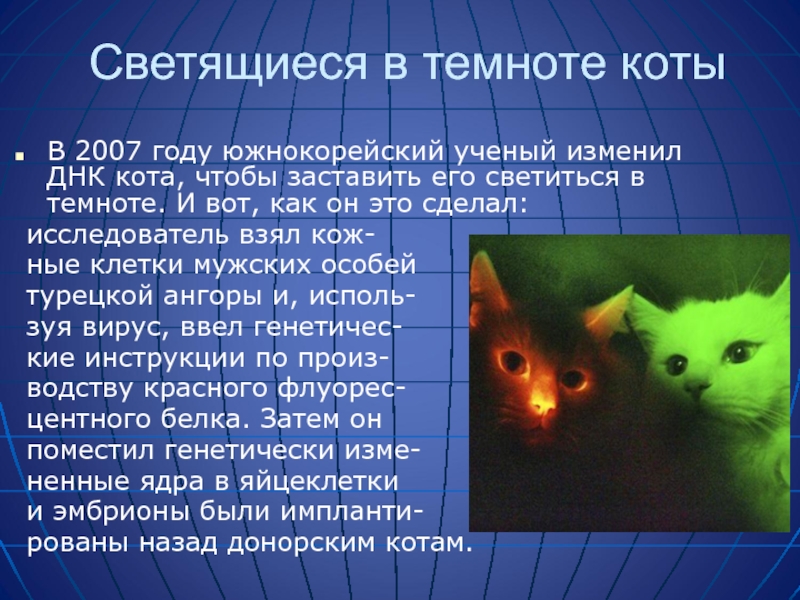
Слайд 43Светящиеся в темноте коты
В 2007 году южнокорейский ученый изменил ДНК кота,
исследователь взял кож-
ные клетки мужских особей
турецкой ангоры и, исполь-
зуя вирус, ввел генетичес-
кие инструкции по произ-
водству красного флуорес-
центного белка. Затем он
поместил генетически изме-
ненные ядра в яйцеклетки
и эмбрионы были импланти-
рованы назад донорским котам.
Слайд 44Эко-свинья
Эко-свинья - это свинья, которая была генетически изменена для лучшего переваривания
фермеры используют его
как удобрение, это химичес-
кое вещество попадает в
водосборы и становится при-
чиной цветения водорослей,
которые, в свою очередь,
уничтожают кислород в воде и убивают водную жизнь.
Ученые добавили бактерию E. Coli и ДНК мыши в эмбрион свиньи. Это изменение уменьшило производство фосфора свиньей ни много, ни мало на 70%, что сделало ее более экологически чистой.
Слайд 45Борющиеся с загрязнениями растения
Ученые Вашингтонского университета работают над созданием тополей, которые
содержащихся в подземных водах.
После этого растения разлагают
загрязнители на безвредные
побочные продукты, которые впи-
тываются корнями, стволом и
листьями или высвобождаются
в воздух.
В лабораторных испытаниях трансгенные растения удаляют ни много, ни мало 91% трихлорэтилена из жидкого раствора, химического вещества, являющегося самым распространенным загрязнителем подземных вод.
Слайд 46Ядовитая капуста
Ученые недавно выделили ген, отвечающий за яд в хвосте скорпиона,
Слайд 47Плетущие паутину козы
Крепкий и гибкий паутиний шелк является одним из самых
дователи вложили ген каркас-
ной нити паутины в ДНК козы
таким образом, чтобы живот-
ное стало производить паутин-
ный белок только в своем молоке.
Слайд 48Быстрорастущий лосось
Генетически модифицированный лосось компании «AquaBounty» растет в два раза быстрее,
Генетически созданный лосось
имеет дополнительный гормон
роста от чавычи, который поз-
воляет рыбе производить гор-
мон роста круглый год. Ученым
удалось сохранить активность
гормона при помощи гена, взя-
того у схожей на угря рыбы под названием «американская
бельдюга» и действующего как «включатель» для гормона.
Слайд 49Помидор Flavr Savr
Помидор Flavr Savr был первым коммерчески выращи-ваемым и генетически
лить процесс созревания поми-
дора, чтобы предотвратить про-
цесс размягчения и гниения,
давая при этом ему возможность
сохранить природный вкус и цвет. В итоге помидоры оказались слишком чувствительными к перевозке и совершенно безвкусными.
Слайд 50Банановые вакцины
Вскоре люди смогут получать вакцину от гепатита Б и холеры,
Когда измененная форма вируса
вводится в молодое банановое
дерево, его генетический мате-
риал быстро становится посто-
янной частью клеток растения.
С ростом дерева его клетки производят вирусные белки, но не инфекционную часть вируса. Когда люди съедают кусок генетически созданного банана, заполненного вирусными белками, их иммунная система создает антитела для борьбы с болезнью; то же происходит и с обычной вакциной.
Слайд 51Менее страдающие от метеоризма коровы
Коровы производят значительные объемы метана в результате
Исследователи в сфере
сельского хозяйства об-
наружили бактерию, от-
вечающую за производст-
во метана, и создали ли-
нию скота, выделяющего
на 25% меньше газа,
чем обычная корова.
Слайд 52Генетически модифицированные деревья
Деревья изменяются генетически для более быстрого роста, лучшей древесины
австралийское эвкалиптовое
дерево изменено для устой-
чивости к низким температу-
рам, была создана ладанная
сосна с меньшим содержани-
ем лигнина – вещества, даю-
щего деревьям твердость. В 2003 году Пентагон даже наградил создателей сосны, меняющей цвет во время биологической или химической атаки.
Слайд 53Лекарственные яйца
Британские ученые создали породу генетически модифицированных кур, которые производят в
Куры несут яйца с miR24 –
молекулой, способной лечить
злокачественные опухоли и
артрит, а также с человечес-
ким интерфероном b-1a –
антивирусным лекарством,
схожим на современные препа-
раты от множественного склероза.
Слайд 54Активно связывающие углерод растения
Ежегодно люди добавляют около девяти гигатонн углеро-да в
Углерод может в течение
десятилетий оставаться в
листьях, ветвях, семенах
и цветах растений, а тот,
что попадает в корни, мо-
жет быть там столетия. Та-
ким образом, исследователи
надеются создать биоэнер-
гетические культуры с обширной корневой системой, которые смогут связывать и сохранять углерод под землей.
Слайд 55 Клонирование
- это метод размножения
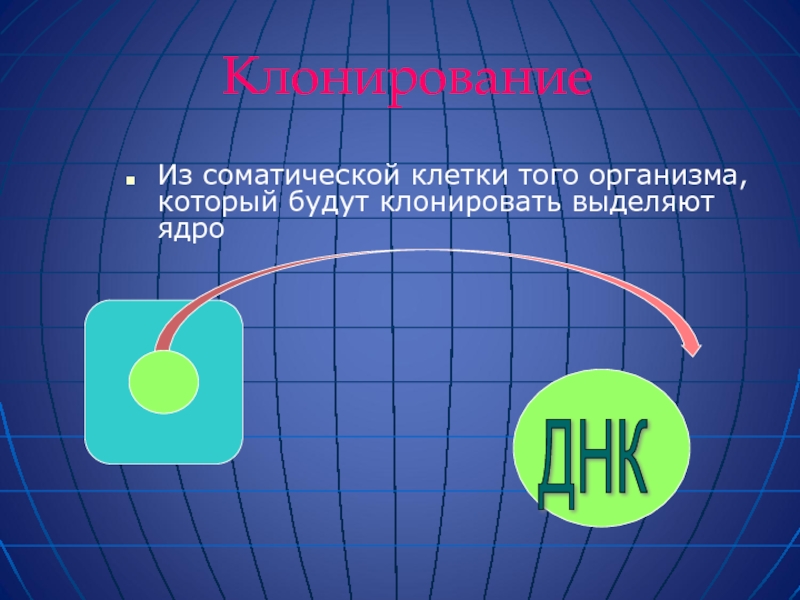
Слайд 57Клонирование
Из соматической клетки того организма, который будут клонировать выделяют ядро
ДНК
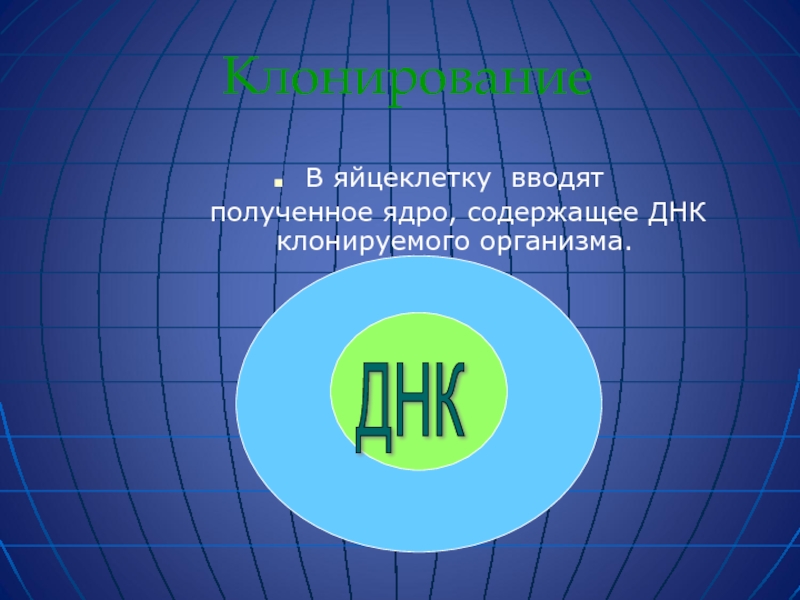
Слайд 61Клонирование
Сурогатное
клонирование –
помещение зародыша
в матку другого организма
Терапевтическое клонирование – помещение зародыша в лабораторную
питательную среду
Слайд 62 В 1997 году впервые было получено сообщение, что удалось, используя
Слайд 63Сама по себе технология клонирования весьма перспективна. Она может быть использована
очень часто хворают.
Слайд 64
Первое клонированное животное - овечка Долли. К 6 году своей жизни
Слайд 65Но все же перспектив у клонирования много. И возможно пройдет не так
Слайд 66Задачи, стоящие перед клонированием:
Клонирование органов и тканей
Возможность бездетным людям иметь детей
Помощь
Клонирование человеческих генов, терапевтических белков для лечения больных в сельскохозяйственных животных
Слайд 68 Человеческий клон
На самом деле клон
Слайд 70 В каких сферах находят сегодня применение в нашей стране методы генетики?
В криминалистике - анализы на соответствие ДНК подозреваемого образцам преступника.
В судебной практике - тесты на подтверждение родства.
В здравоохранении - создание методов диагностики генных заболеваний. Своевременная диагностика в случае таких недугов может многое изменить. Существуют центры пренатальной (предродовой) цитогенетической диагностики, где можно до рождения ребенка исследовать его геном на предмет отклонений