- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Культуры эукариотических клеток презентация
Содержание
- 1. Культуры эукариотических клеток
- 2. Лекции – 8 часов Практические занятия – 4 часа Зачет
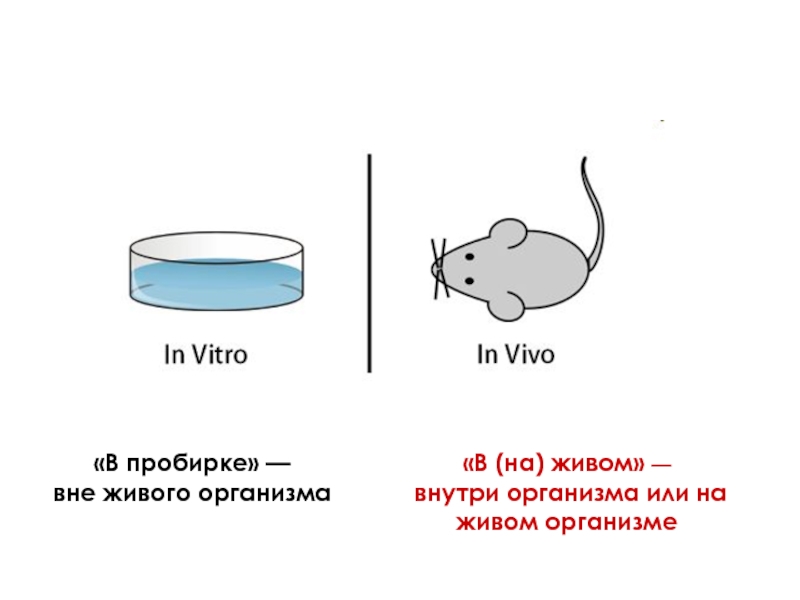
- 3. In vitro – культивирование объектов «в стекле»
- 4. «В (на) живом» — внутри организма
- 5. Клеточные технологии включают: культивирование растительных
- 6. Главное требование – соблюдение строгой асептики
- 7. Ламинар-боксы
- 8. Второе условие – использование специальных питательных
- 9. Способы культивирования растительных клеток Поверхностное культивирование на
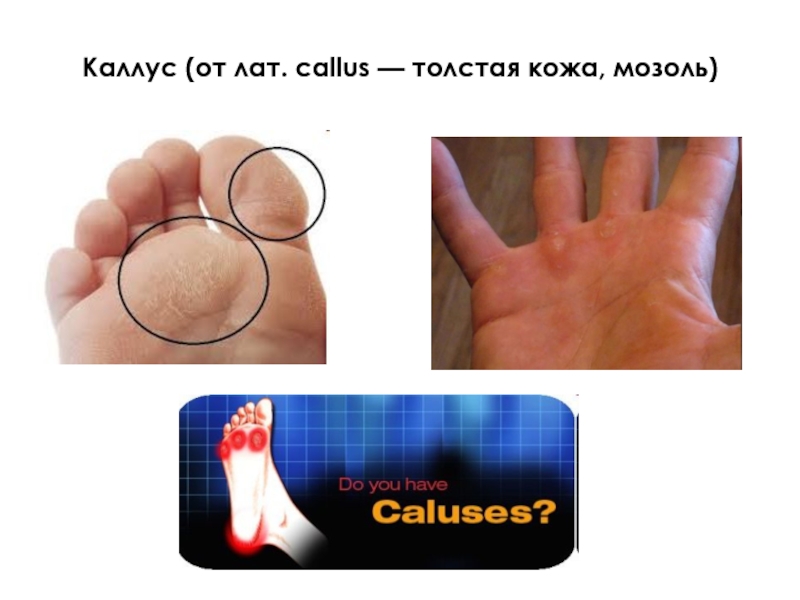
- 10. Каллус (от лат. callus — толстая кожа, мозоль)
- 11. Каллус - недифференцированные растительные клетки, выращиваемые поверхностным способом на полутвердой питательной среде
- 12. Каллус может образоваться не только в искусственных
- 13. 1. Выбор экспланта Эксплант - фрагмент ткани или органа, используемый для получения первичного каллуса
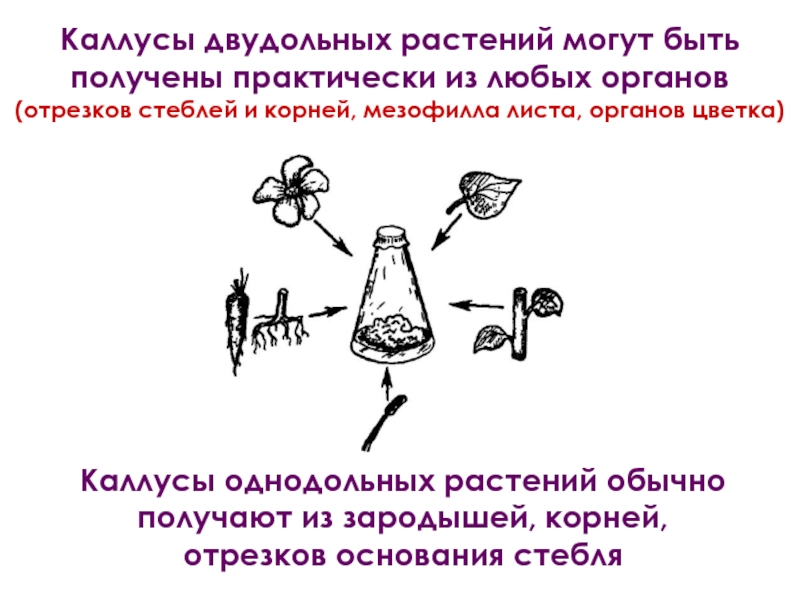
- 14. Каллусы однодольных растений обычно получают из зародышей,
- 15. Лучшими эксплантами для получения каллуса являются:
- 16. Проращивание простерилизованных семян в асептических условиях дает наиболее пригодный материал для получения каллусов
- 17. 2. Стерилизация растительного материала На поверхности органов
- 18. АНТИСЕПТИКИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ СТЕРИЛИЗАЦИИ РАСТИТЕЛЬНЫХ ТКАНЕЙ:
- 19. ТЕХНИКА ПРОВЕДЕНИЯ СТЕРИЛИЗАЦИИ РАСТИТЕЛЬНОГО МАТЕРИАЛА:
- 20. 3. Перенос стерильных эксплантов на питательную среду
- 21. 4. Получение первичного каллуса Образование каллуса, в первую очередь, отмечается на раневой поверхности экспланта
- 22. При оптимально подобранной среде первичные каллусы в
- 23. 5. Субкультивирование (пассирование) Первичный каллус разделяют на
- 24. Каллусные культуры различаются по: интенсивности роста; окраске; консистенции и др. Типы каллусных культур:
- 25. Типы каллусных культур: рыхлые
- 26. Направления использования каллусных культур: изучение процессов
- 27. Суспензионная культура – отдельные клетки или клеточные
- 28. Необходимое условие для поддержания суспензионных культур – постоянное перемешивание питательной среды
- 29. удобная модель для молекулярно-биологических и биохимических
- 30. 1. Отбор хорошо растущей каллусной культуры рыхлого
- 31. Суспензионные культуры состоят из: отдельных клеток;
- 32. А В С С
- 33. слабоагрегированные; (состоят из одиночных клеток
- 34. КУЛЬТУРЫ ПРОТОПЛАСТОВ
- 35. Протопласт – это живое содержимое растительной клетки, лишенное клеточной стенки
- 36. ИСТОЧНИКИ ПОЛУЧЕНИЯ ПРОТОПЛАСТОВ: изолированные органы растений и
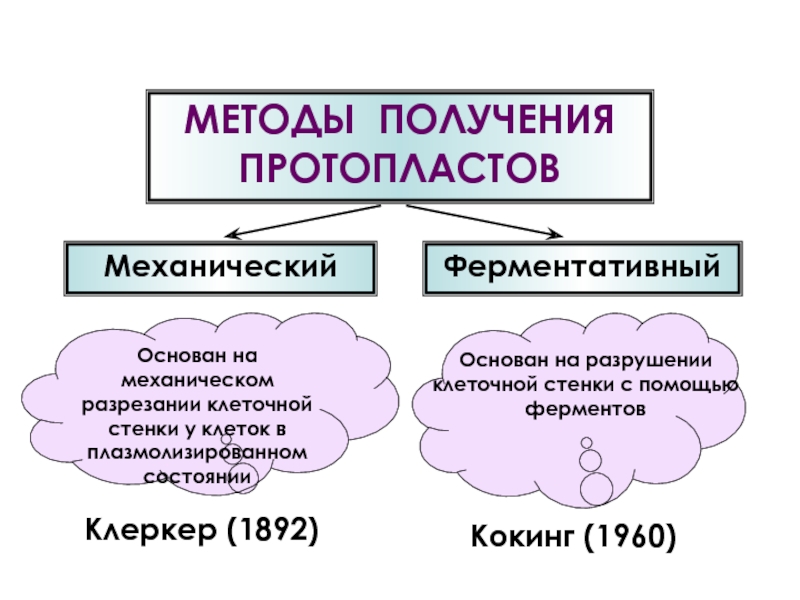
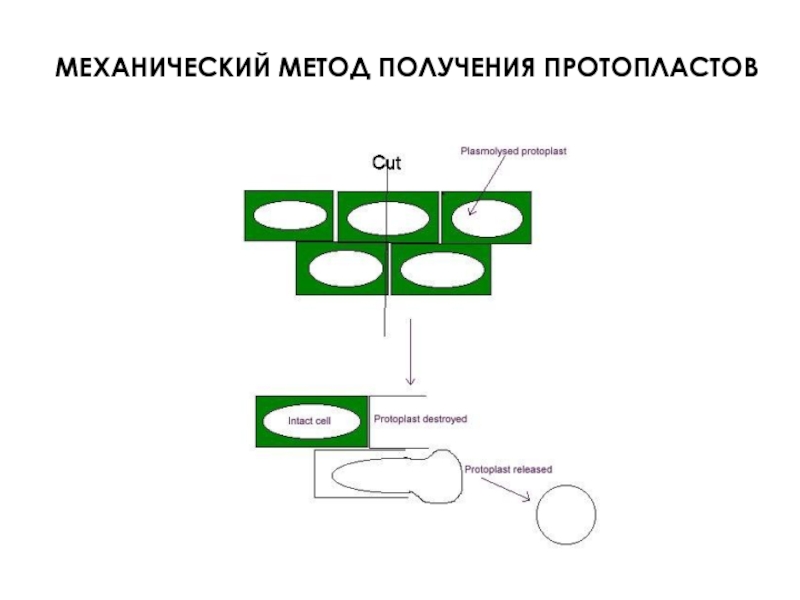
- 37. Основан на механическом разрезании клеточной стенки у
- 38. МЕХАНИЧЕСКИЙ МЕТОД ПОЛУЧЕНИЯ ПРОТОПЛАСТОВ
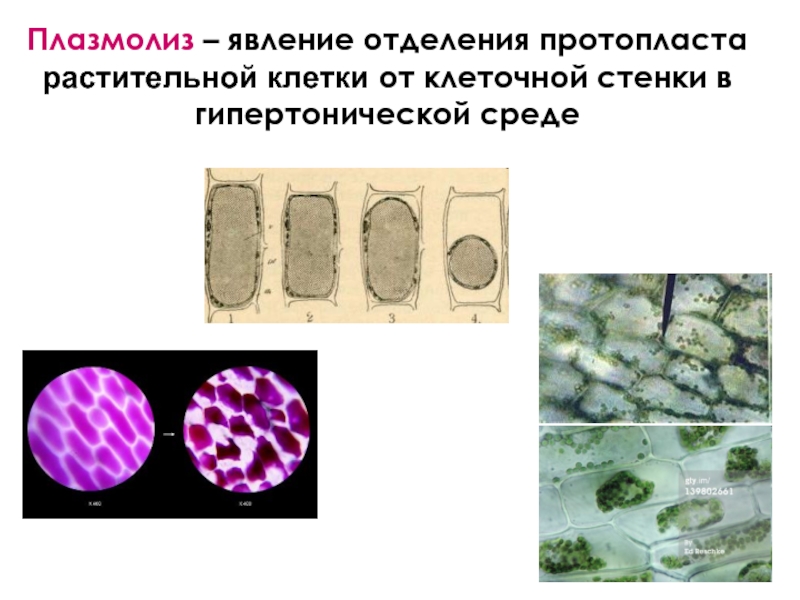
- 39. Плазмолиз – явление отделения протопласта растительной клетки от клеточной стенки в гипертонической среде
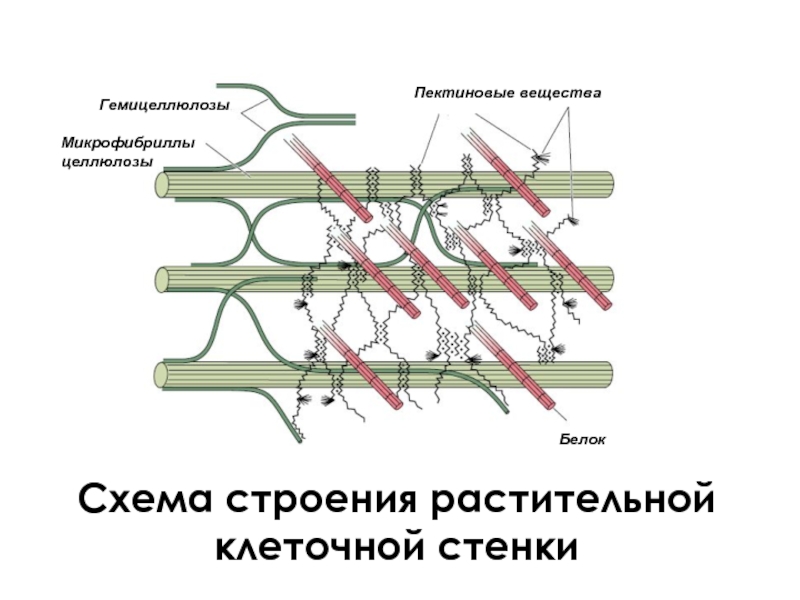
- 40. Схема строения растительной клеточной стенки
- 41. На практике часто используются ферментные препараты, включающие
- 42. Основные компоненты питательных сред для культивирования растительных
- 43. РЕГУЛЯТОРЫ РОСТА РАСТЕНИЙ Содержание регуляторов роста является
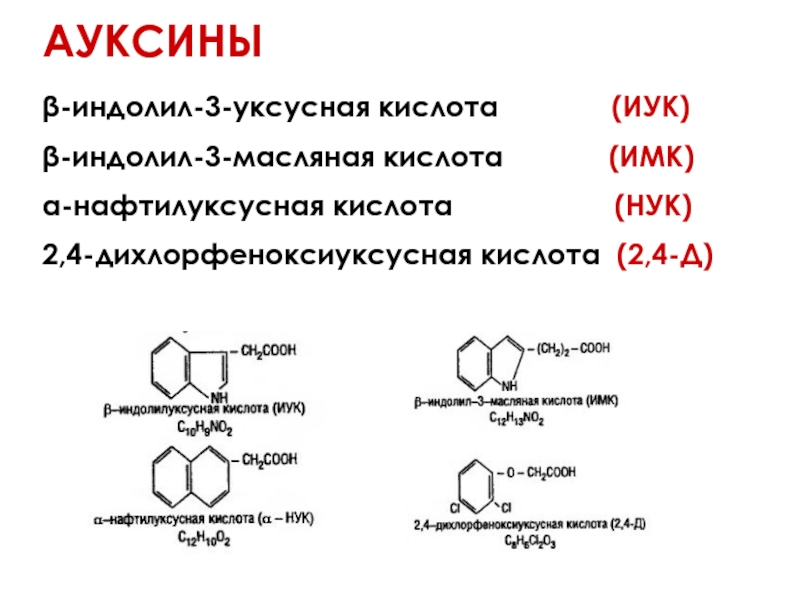
- 44. АУКСИНЫ β-индолил-3-уксусная кислота
- 45. АУКСИНЫ НЕОБХОДИМЫ ДЛЯ: стимуляции деления и
- 46. Стимуляция закладки корней (ризогенеза) у черенков под действием ауксинов
- 47. ИУК способна легко окисляться клетками растений.
- 48. ЦИТОКИНИНЫ Зеатин Изопентениладенин
- 49. Зеатин термолабилен, поэтому его нельзя автоклавировать
- 50. ЦИТОКИНИНЫ ВКЛЮЧАЮТ В СОСТАВ СРЕД ДЛЯ:
- 51. ФИЗИЧЕСКИЕ УСЛОВИЯ КУЛЬТИВИРОВАНИЯ: условия освещения; Каллусные
- 52. Ростовой цикл каллусных и суспензионных культур
- 53. 1- лаг-фаза; 2 - экспоненциальная; 3 -
Слайд 1Культуры эукариотических клеток
Дитченко Татьяна Ивановна
Кафедра клеточной биологии и биоинженерии растений
Слайд 3In vitro – культивирование объектов «в стекле» (пробирке, колбе, биореакторе) на
Культуры клеток – это клетки, растущие или сохраняющие жизнеспособность вне организма (в условиях in vitro)
Слайд 5Клеточные технологии включают:
культивирование растительных клеток;
культивирование животных клеток
Цель курса
Слайд 6Главное требование –
соблюдение строгой асептики
Все работы по получению культур растительных
Слайд 8Второе условие –
использование специальных питательных сред
Культуральная среда должна обеспечивать
Слайд 9Способы культивирования растительных клеток
Поверхностное культивирование на плотной (агаризованной) питательной среде
Глубинное культивирование
Каллусные культуры
Суспензионные культуры
Слайд 11Каллус - недифференцированные растительные клетки, выращиваемые поверхностным способом на полутвердой питательной
Слайд 12Каллус может образоваться не только в искусственных условиях, но и в
Слайд 131. Выбор экспланта
Эксплант - фрагмент ткани или органа, используемый для получения
Слайд 14Каллусы однодольных растений обычно получают из зародышей, корней,
отрезков основания стебля
Каллусы
Слайд 15Лучшими эксплантами для получения каллуса являются:
молодая ткань;
ткань ответственная за пролиферацию
Нежелательно использовать:
одревесневшие ткани;
старые ткани с низким уровнем метаболизма;
плохо пролиферирующие ткани (напр., мякоть плодов);
ткани, покрытые восками, суберином и т.п.
Слайд 16Проращивание простерилизованных семян в асептических условиях дает наиболее пригодный материал для
Слайд 172. Стерилизация растительного материала
На поверхности органов растений всегда находится эпифитная микрофлора.
Слайд 18АНТИСЕПТИКИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ СТЕРИЛИЗАЦИИ РАСТИТЕЛЬНЫХ ТКАНЕЙ:
соединения, содержащие активный хлор, –
двухлористая ртуть (сулема), 0,1-1 %-ный раствор;
формалин, 5%-ный раствор;
перекись водорода, 10-20%-ный раствор;
этиловый спирт, 70%-ный раствор;
фенол, 5%-ный раствор;
антибиотики (в случае внутренней инфекции)
Слайд 19ТЕХНИКА ПРОВЕДЕНИЯ СТЕРИЛИЗАЦИИ РАСТИТЕЛЬНОГО МАТЕРИАЛА:
Предварительная стерилизация
(проводят очистку поверхности путем
2) Стерилизация
(в условиях ламинар-бокса предварительно простерилизованные ткани помещают в стерилизующий раствор)
3) Постстерилизация
(растительный материал отмывают от стерилизующего агента 3-4 порциями стерильной дистиллированной воды)
Слайд 214. Получение первичного каллуса
Образование каллуса, в первую очередь, отмечается на раневой
Слайд 22При оптимально подобранной среде первичные каллусы в количестве достаточном для пересадки
Слайд 235. Субкультивирование (пассирование)
Первичный каллус разделяют на части, которые в дальнейшем культивируются
Слайд 24Каллусные культуры различаются по:
интенсивности роста;
окраске;
консистенции и др.
Типы каллусных культур:
Слайд 25Типы каллусных культур:
рыхлые
(легко распадаются на отдельные клетки);
среднеплотные
(клетки могут
плотные
(клетки очень мелкие, не отделяются взбалтыванием)
Слайд 26Направления использования каллусных культур:
изучение процессов цитодифференцировки и морфогенеза;
биохимические и молекулярно-биологические исследования;
изучение
получение суспензионных культур;
регенерация растений, получение новых форм растений;
сохранение в растущем состоянии коллекций разных видов растений
Слайд 27Суспензионная культура – отдельные клетки или клеточные агрегаты, выращиваемые в жидкой
Слайд 28Необходимое условие для поддержания суспензионных культур –
постоянное перемешивание питательной среды
Слайд 29 удобная модель для молекулярно-биологических и биохимических исследований;
(клетки в одинаковой степени
возможность быстрого набора биомассы для получения БАВ;
простота процессов субкультивирования
(легко заменить или отобрать питательную среду)
ОСНОВНЫЕ ПРЕИМУЩЕСТВА СУСПЕНЗИОННЫХ КУЛЬТУР:
Слайд 301. Отбор хорошо растущей каллусной культуры рыхлого типа
2. Инициализация первичной суспензии
2-3 г свежей массы каллусной ткани на 60-100 мл жидкой питательной среды.
3. Культивирование
Колбы помещают на качалку, скорость вращения которой составляет 100-120 об/мин.
Процесс получения первичной суспензии занимает 2-3 недели.
ЭТАПЫ ПОЛУЧЕНИЯ:
Слайд 31Суспензионные культуры состоят из:
отдельных клеток;
клеточных групп (2-10 клеток);
многоклеточных агрегатов
Слайд 33 слабоагрегированные;
(состоят из одиночных клеток (40%) и мелких агрегатов (60%),
среднеагрегированные;
(состоят из одиночных клеток (40%), мелких агрегатов (40%) и крупных агрегатов (20%))
высокоагрегированные;
(состоят из мелких (40%) и крупных агрегатов (60%)
ТИПЫ СУСПЕНЗИОННЫХ КУЛЬТУР:
(в зависимости от степени агрегированности)
Слайд 36ИСТОЧНИКИ ПОЛУЧЕНИЯ ПРОТОПЛАСТОВ:
изолированные органы растений и их части (листья, корни, лепестки);
суспензионная
каллусная ткань.
Слайд 37Основан на механическом разрезании клеточной стенки у клеток в плазмолизированном состоянии
Основан
Клеркер (1892)
Кокинг (1960)
Слайд 39Плазмолиз – явление отделения протопласта растительной клетки от клеточной стенки в
Слайд 41На практике часто используются ферментные препараты, включающие комплекс из нескольких гидролитических
Состав ферментативной смеси должен наиболее полно соответствовать составу клеточной стенки!
Слайд 42Основные компоненты питательных сред для культивирования растительных клеток:
макроэлементы;
микроэлементы;
источник углерода;
витамины;
регуляторы роста
Слайд 43РЕГУЛЯТОРЫ РОСТА РАСТЕНИЙ
Содержание регуляторов роста является определяющим фактором для успешного роста
АУКСИНЫ
ЦИТОКИНИНЫ
Слайд 44АУКСИНЫ
β-индолил-3-уксусная кислота (ИУК)
β-индолил-3-масляная кислота
α-нафтилуксусная кислота (НУК)
2,4-дихлорфеноксиуксусная кислота (2,4-Д)
Слайд 45АУКСИНЫ НЕОБХОДИМЫ ДЛЯ:
стимуляции деления и растяжения клеток каллусных и суспензионных культур;
стимуляции
в сочетании с другими фитогормонами для формирования у протопластов клеточных стенок
Слайд 47ИУК способна легко окисляться клетками растений.
Ее редко добавляют в среду
Синтетические ауксины (2,4-Д, НУК) обладают более высокой биологической активностью по сравнению с природными (ИУК, ИМК)
Например, ИУК в 300 раз менее активна, чем 2,4-Д и в 30 раз менее активна, чем НУК
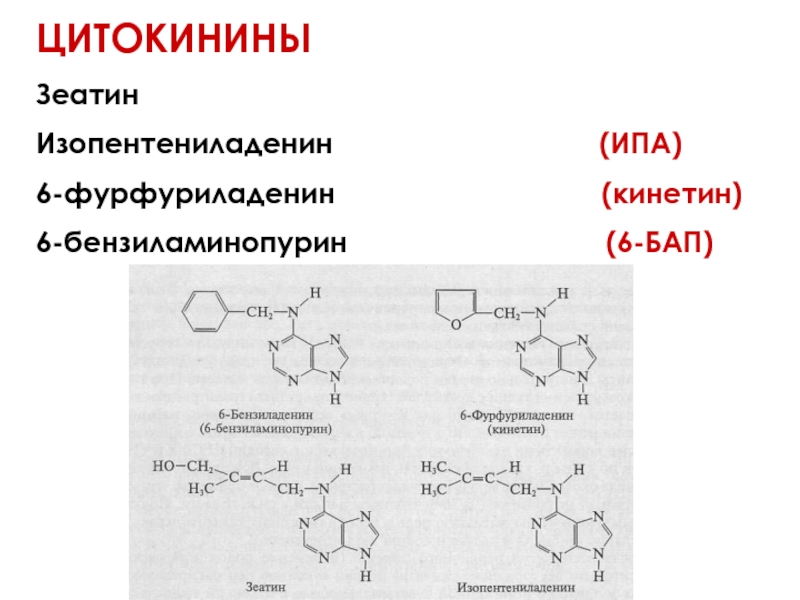
Слайд 48ЦИТОКИНИНЫ
Зеатин
Изопентениладенин
6-фурфуриладенин (кинетин)
6-бензиламинопурин (6-БАП)
Слайд 50ЦИТОКИНИНЫ ВКЛЮЧАЮТ В СОСТАВ СРЕД ДЛЯ:
стимуляции клеточных делений в каллусных и
образования побегов (стеблевой морфогенез)
Слайд 51ФИЗИЧЕСКИЕ УСЛОВИЯ КУЛЬТИВИРОВАНИЯ:
условия освещения;
Каллусные культуры и клеточные суспензии выращиваются либо темноте,
температура;
Для большинства культур поддерживается в термостатах на уровне 26±1°С.
условия аэрации;
Важны для суспензионных культур. Зависят от эффективности перемешивания питательной среды и подачи стерильного воздуха (в случае культивирования в биореакторах).
влажность воздуха
В культуральной комнате должна составлять 60–70 %
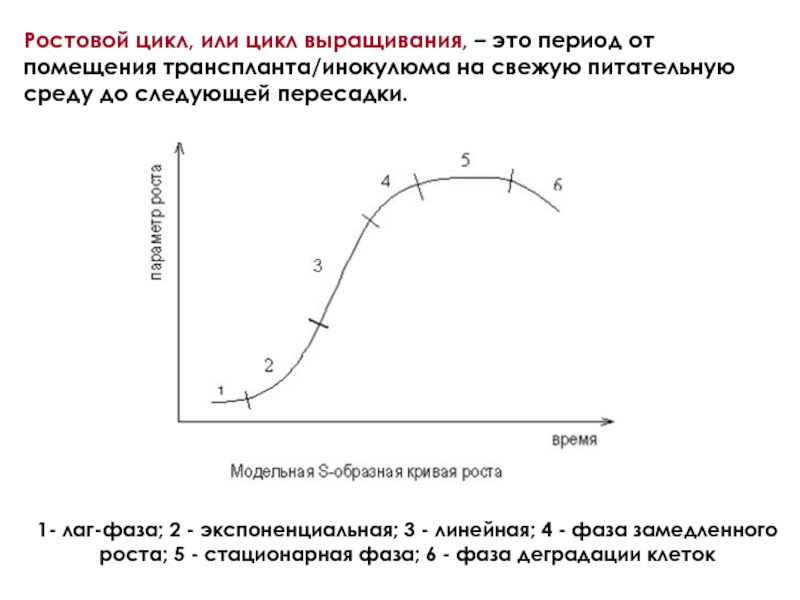
Слайд 531- лаг-фаза; 2 - экспоненциальная; 3 - линейная; 4 - фаза
Ростовой цикл, или цикл выращивания, – это период от помещения транспланта/инокулюма на свежую питательную среду до следующей пересадки.