- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Клеточный цикл презентация
Содержание
- 1. Клеточный цикл
- 2. Клеточный цикл. Деление гипотетической клетки с
- 3. Фазы клеточного цикла. М фаза –
- 4. Точки проверки системы контроля клеточного цикла
- 5. Циклины и фазы клеточного цикла. Имеется четыре
- 6. Упрощенная схема системы контроля клеточного цикла
- 7. Двухкомпонентная система контроля клеточного цикла. Связывание циклина
- 8. CKI p27 – ингибитор cyclin-Cdk комплекса.
- 9. Регуляция активности Cdk путём фосфорилирования и дефосфорилирования.
- 10. Контроль протеолиза SCF и APC во время
- 11. Упрощенная модель митогенной стимуляции клеточных делений.
- 12. Rb-механизм контроля инициации S-фазы в клетках животных.
- 13. cell proliferation TK RNR DHFR PCNA
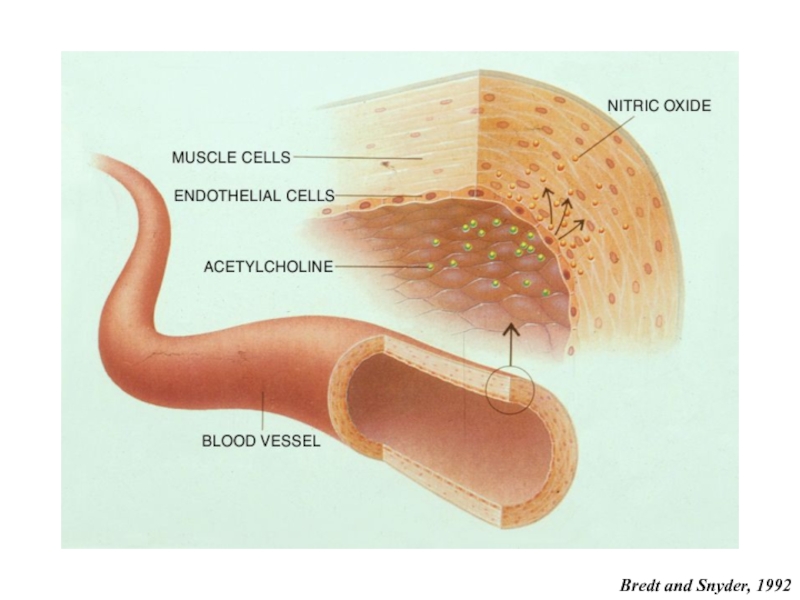
- 14. Bredt and Snyder, 1992
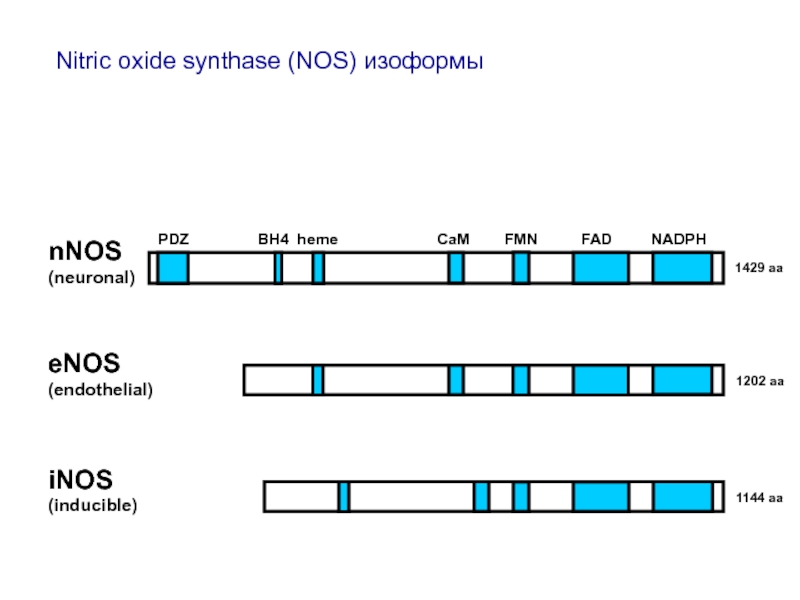
- 15. 1429 aa 1202 aa
- 18. NOS activity, pmol/mg/min
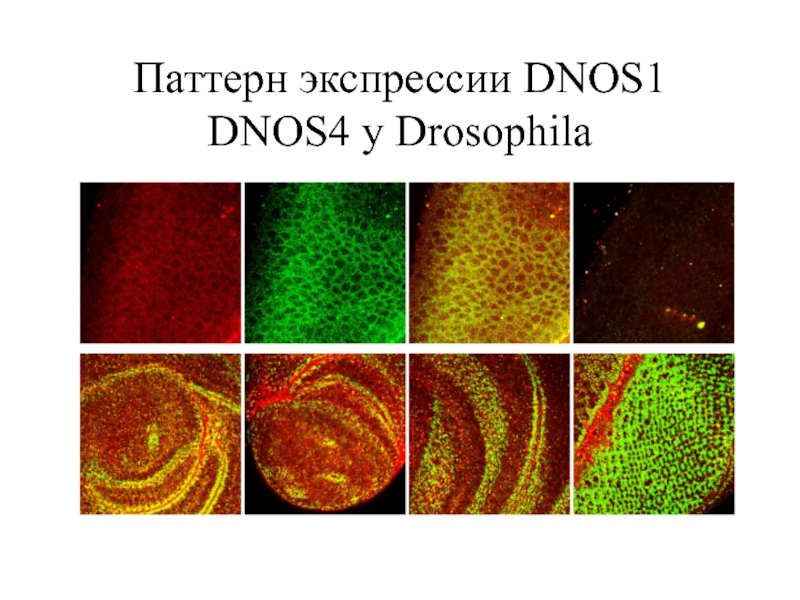
- 19. Паттерн экспрессии DNOS1 DNOS4 у Drosophila
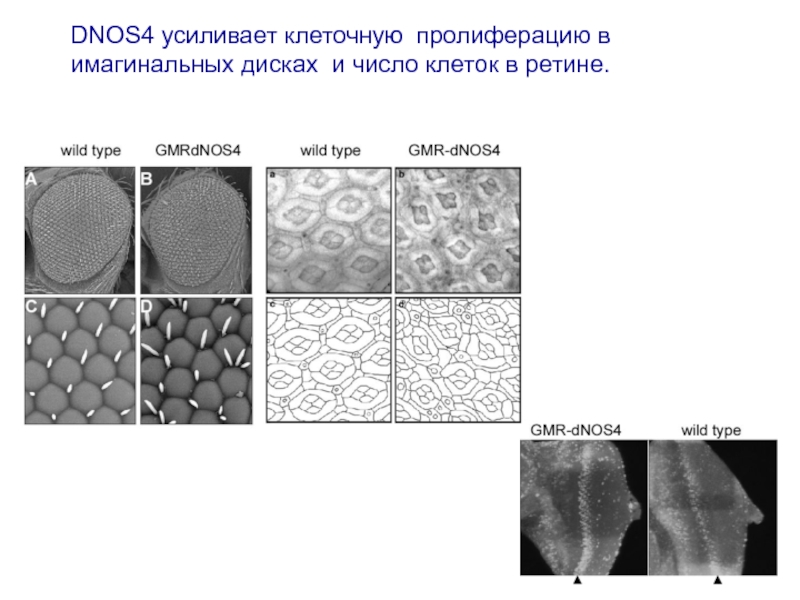
- 20. DNOS4 усиливает клеточную пролиферацию в имагинальных дисках и число клеток в ретине.
- 21. GMR-RBF4 GMR-RBF4 + + GMRdNOS4 GMRdNOS4 dNOS4 спасает RBF4 фенотип
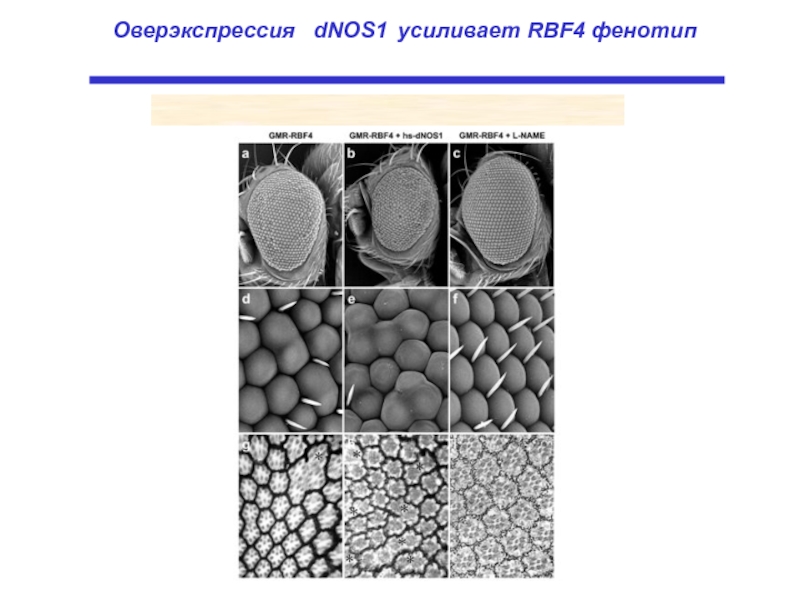
- 22. Оверэкспрессия dNOS1 усиливает RBF4 фенотип
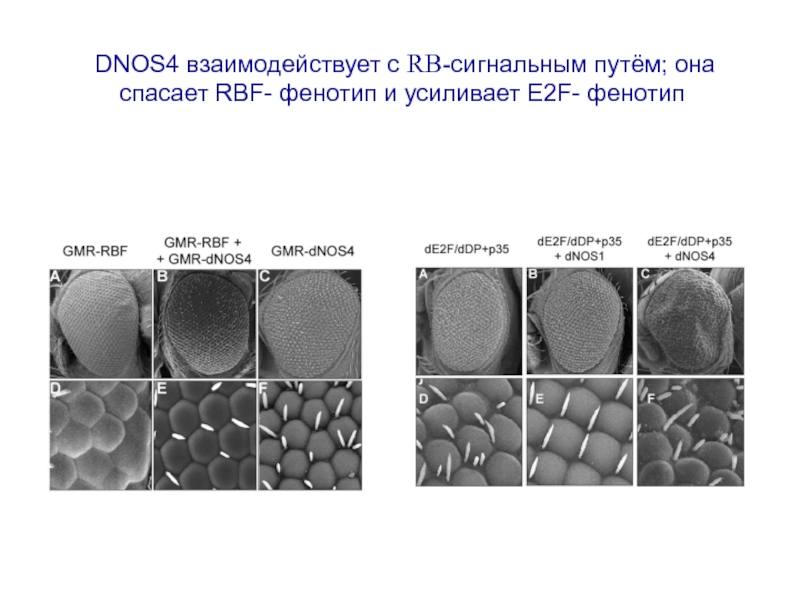
- 23. DNOS4 взаимодействует с RB-сигнальным путём; она спасает RBF- фенотип и усиливает E2F- фенотип
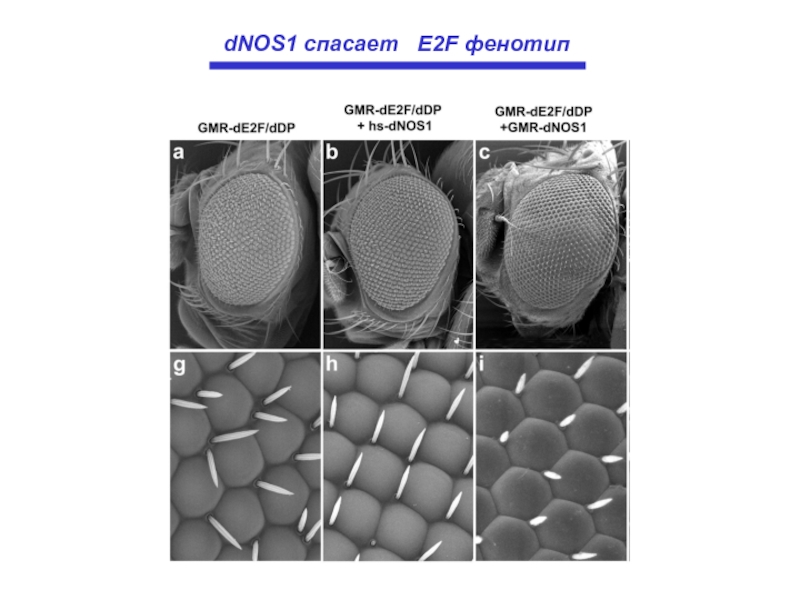
- 24. dNOS1 спасает E2F фенотип
- 25. cell proliferation TK RNR DHFR PCNA
- 26. Примеры фенотипических изменений мутациями генов определяющих планарную
- 27. Фенотипическое проявление нарушений планарной полярности у мутантов
- 28. Распределение субклеточных РСР-белков определяющих ориентацию клеток в
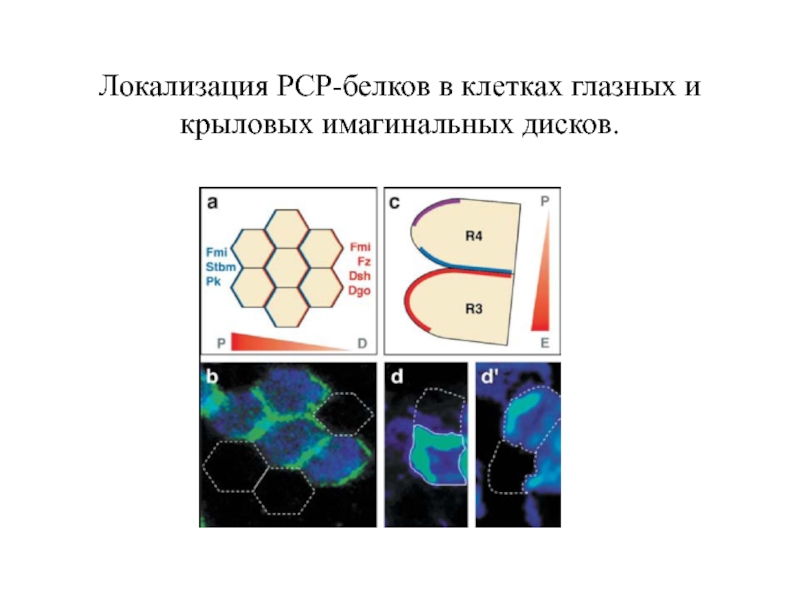
- 29. Локализация РСР-белков в клетках глазных и крыловых имагинальных дисков.
- 30. Нарушение полярности фоторецепторов
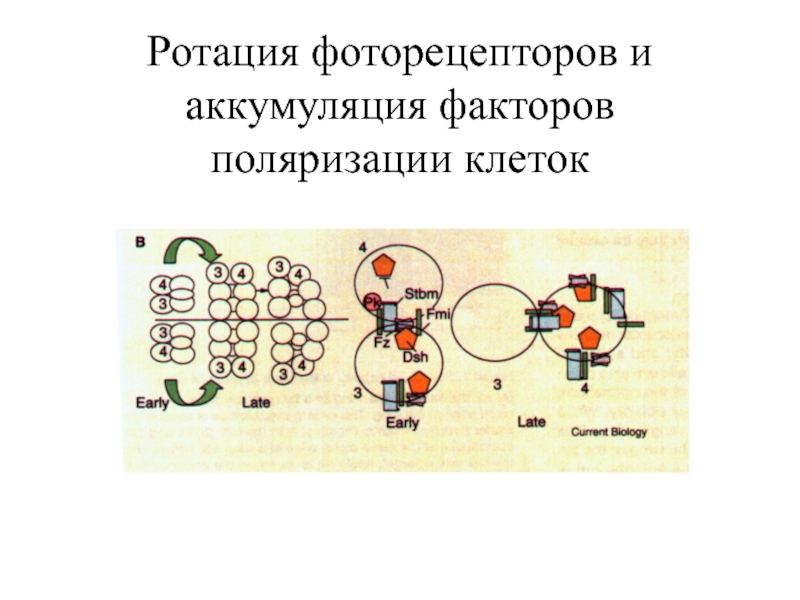
- 31. Ротация фоторецепторов и аккумуляция факторов поляризации клеток
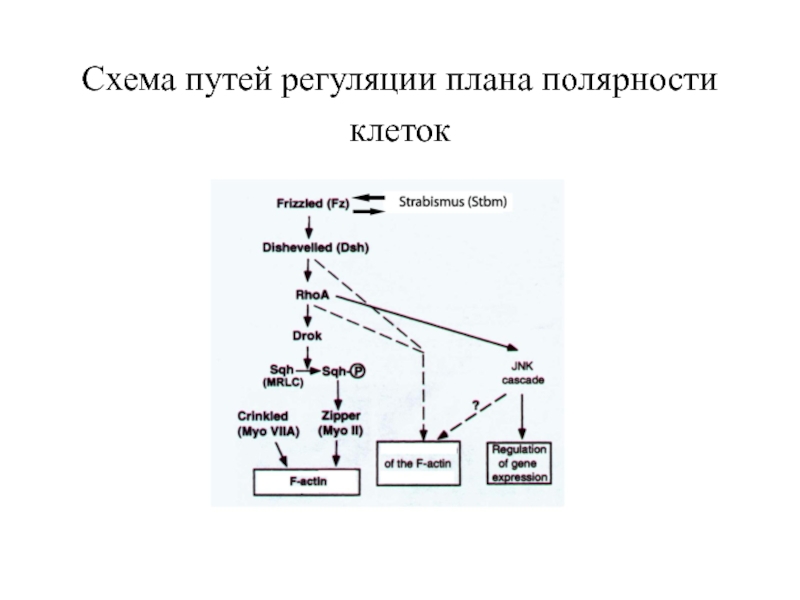
- 32. Схема путей регуляции плана полярности клеток
- 33. Fz сигнальный путь регуляции планарной полярности клеток
- 34. Эктопическая экспрессия NOS4 в крыловых структурах вызывает нарушение плана полярности клеток
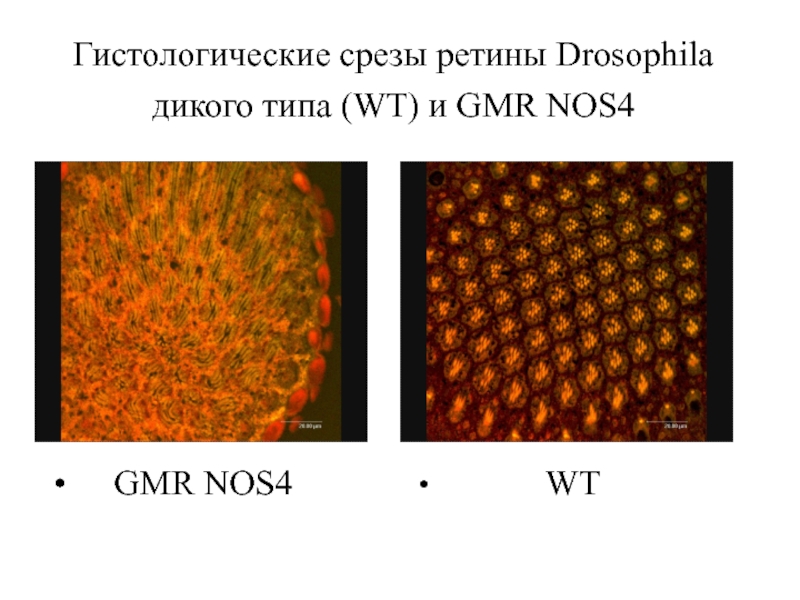
- 35. Гистологические срезы ретины Drosophila дикого типа (WT)
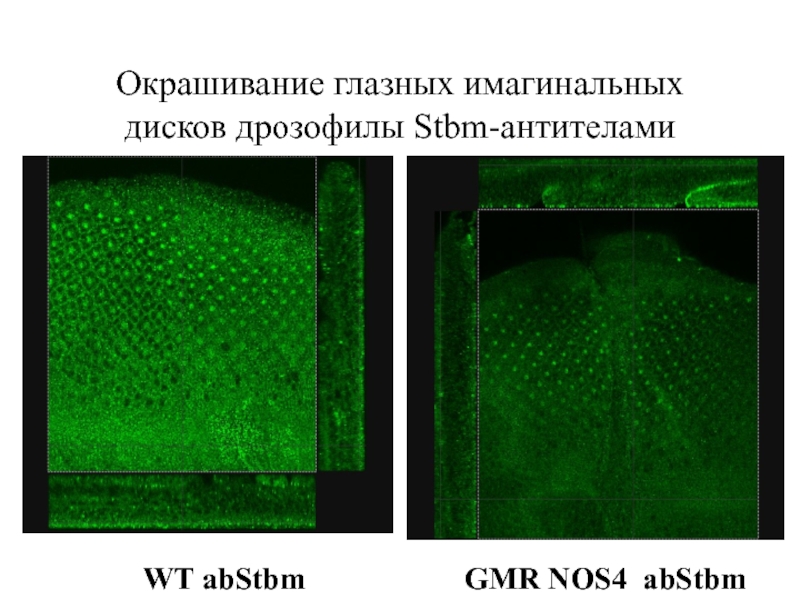
- 36. Окрашивание глазных имагинальных дисков дрозофилы Stbm-антителами GMR NOS4 abStbm WT abStbm
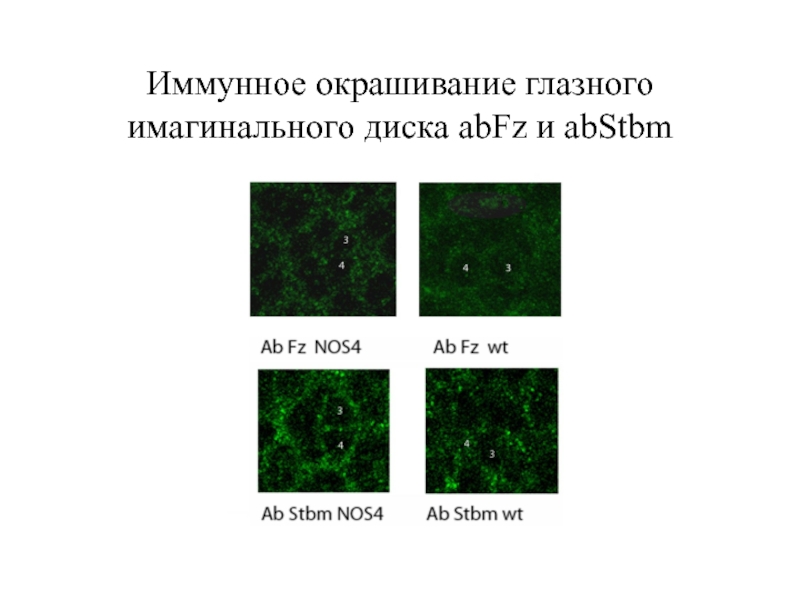
- 37. Иммунное окрашивание глазного имагинального диска abFz и abStbm
- 38. Стуктуры аристы на разных стадиях куколки (22ч.,
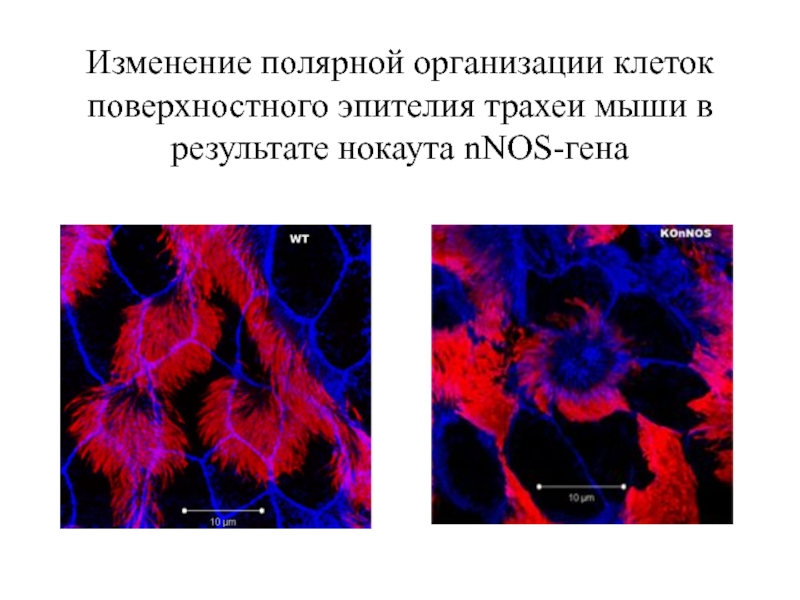
- 39. Изменение полярной организации клеток поверхностного эпителия трахеи мыши в результате нокаута nNOS-гена
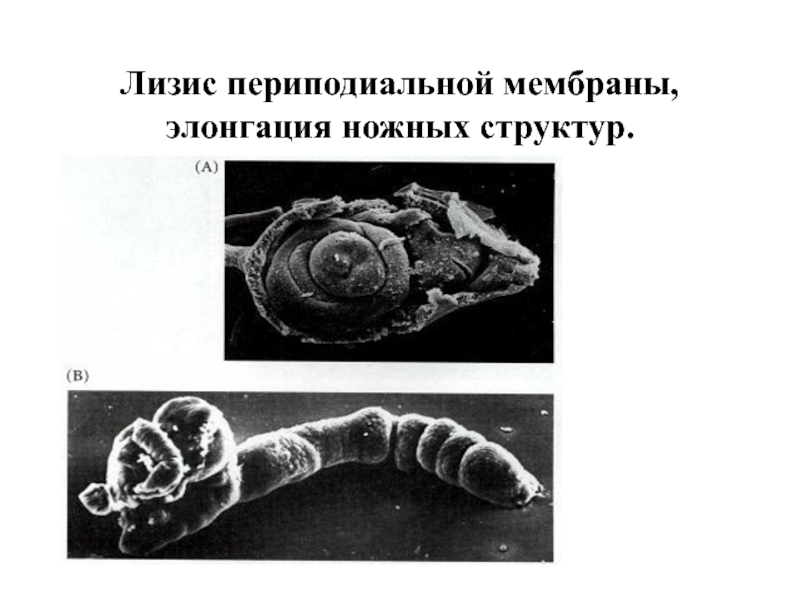
- 40. Лизис периподиальной мембраны, элонгация ножных структур.
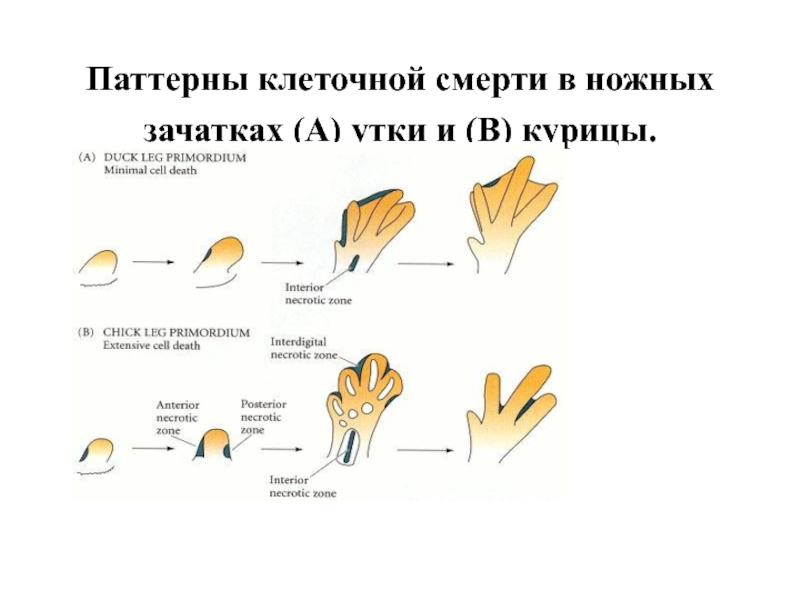
- 41. Паттерны клеточной смерти в ножных зачатках (A) утки и (B) курицы.
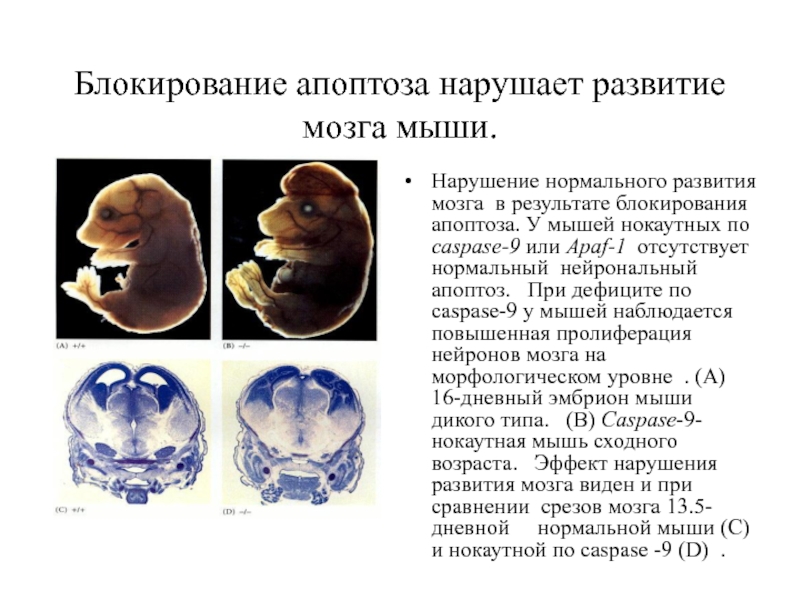
- 42. Блокирование апоптоза нарушает развитие мозга мыши. Нарушение
- 43. Апоптоз инициируется каскадом каспаз.
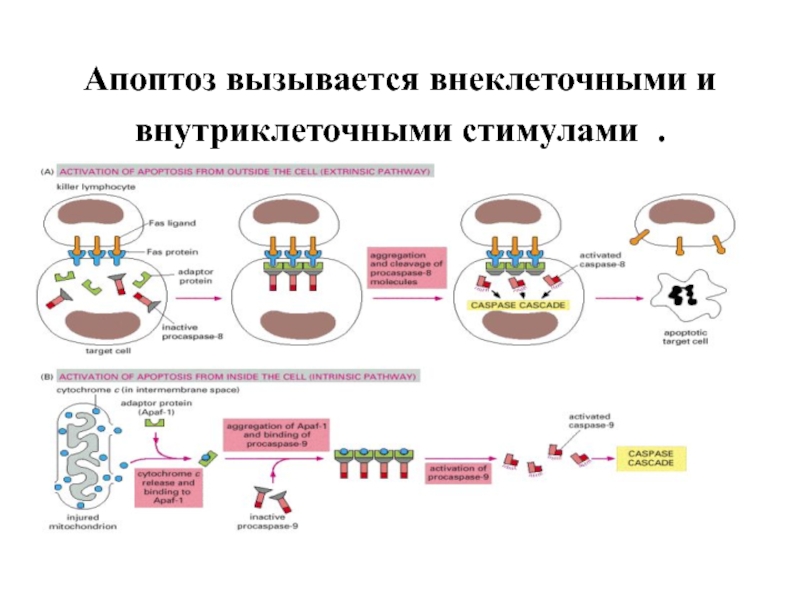
- 44. Апоптоз вызывается внеклеточными и внутриклеточными стимулами .
- 45. Сигнальные пути апоптоза у нематоды и млекопитающих.
- 46. Взаимодействие генов в ответ на воздействие внешней среды является важнейшим фактором индивидуального и исторического развития
- 47. Иллюстрация к «теории канализации развития», на примере шара скатывающегося по поверхности горного рельефа
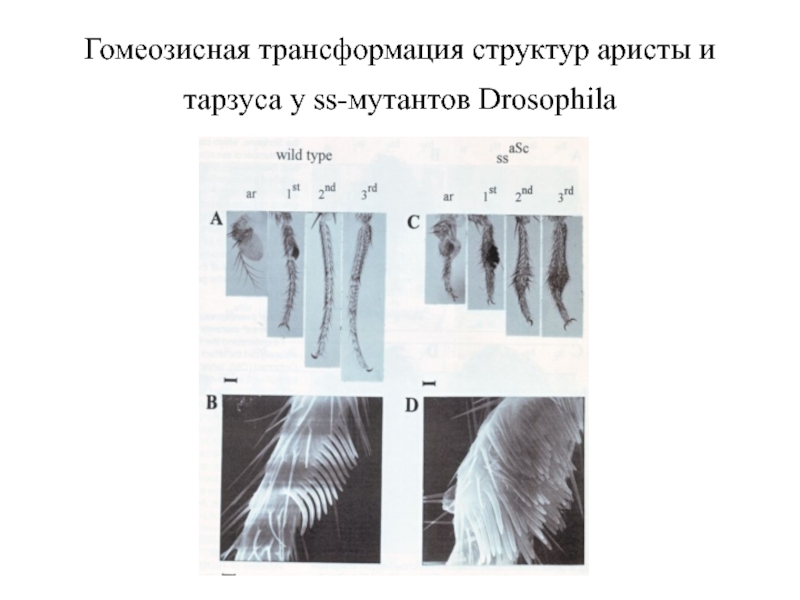
- 48. Гомеозисная трансформация структур аристы и тарзуса у ss-мутантов Drosophila
- 49. Мутации spineless-aristapedia нарушают: морфогенез конечностей; нейрогенез; дендритное
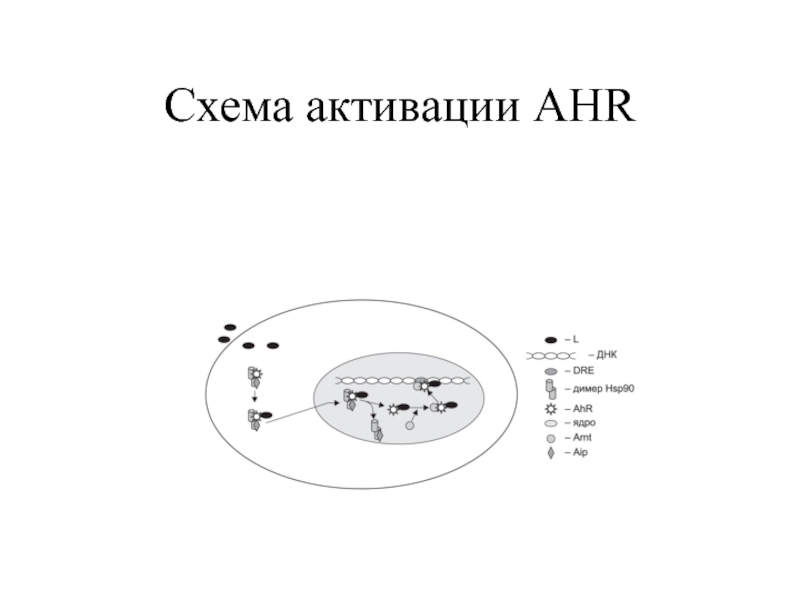
- 50. Схема активации AHR
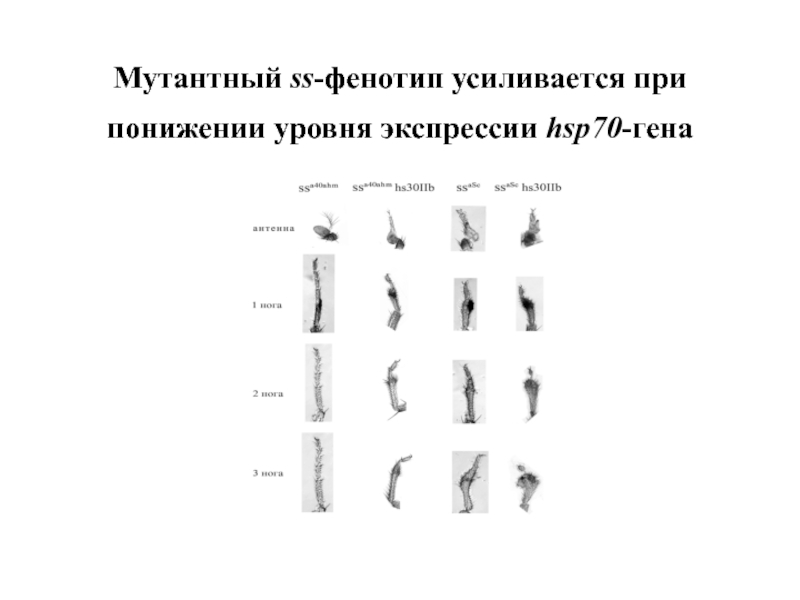
- 51. Мутантный ss-фенотип усиливается при понижении уровня экспрессии hsp70-гена
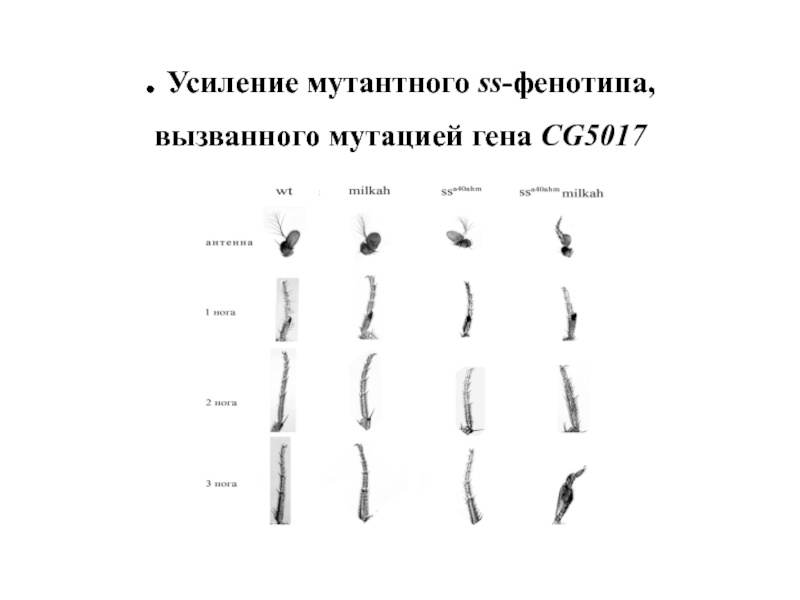
- 52. . Усиление мутантного ss-фенотипа, вызванного мутацией гена СG5017
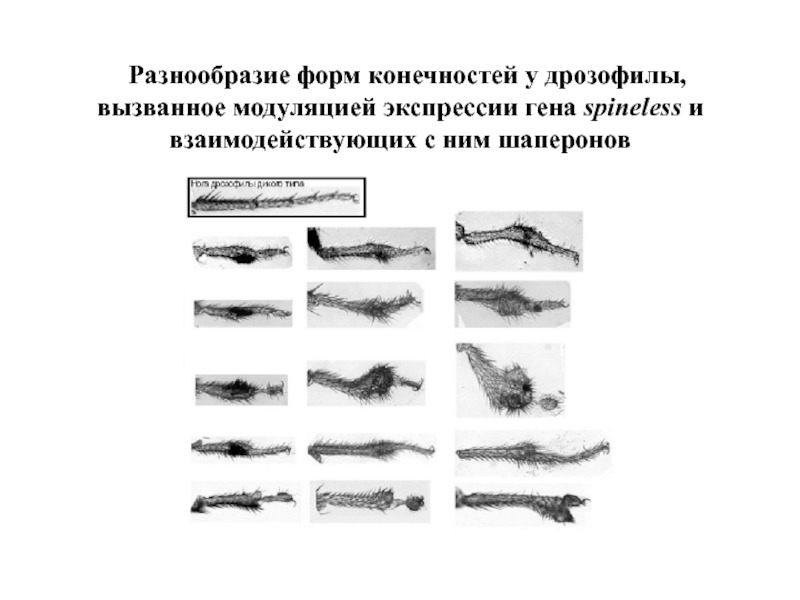
- 53. Разнообразие форм конечностей у дрозофилы, вызванное
- 54. Разнообразие форм конечностей внутри класса насекомых
- 55. Позвоночные
- 57. WT
- 58. One copy of GMR-dNOS4 transgene combined with
- 60. GMRdNOS4 WT Ectopic expression of dNOS4 in
- 61. (A) Schematic of third instar Drosophila
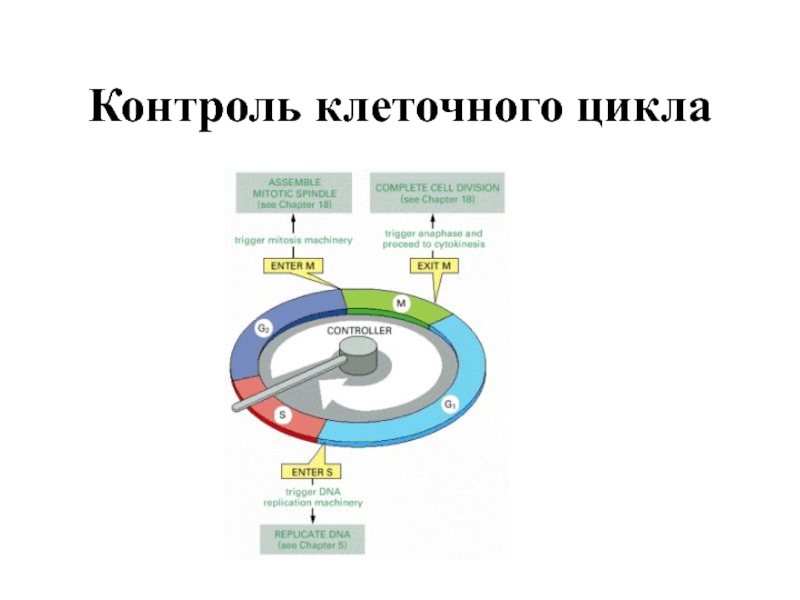
- 62. Контроль клеточного цикла
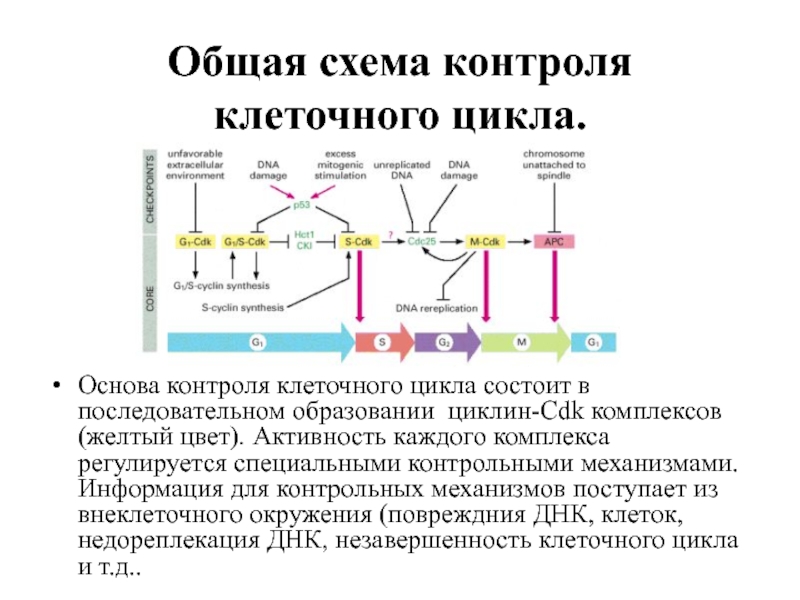
- 63. Общая схема контроля клеточного цикла.
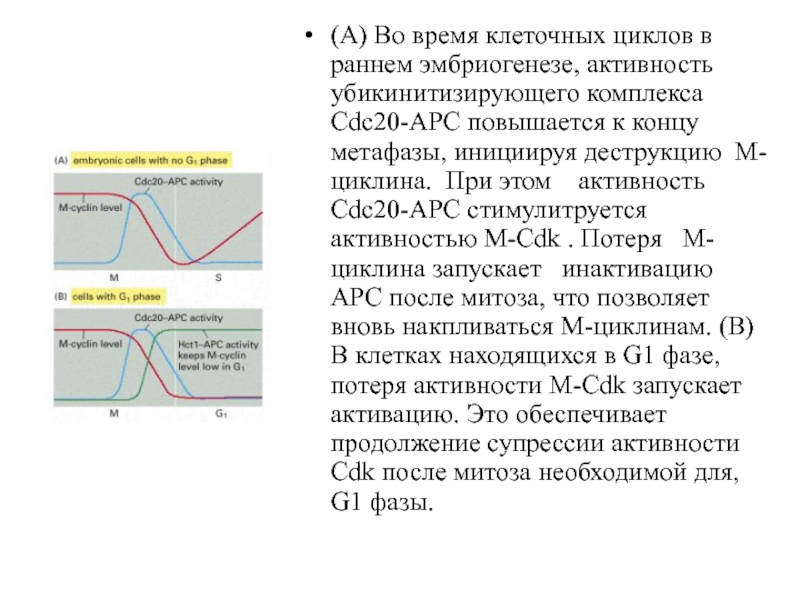
- 64. (A) Во время клеточных циклов в
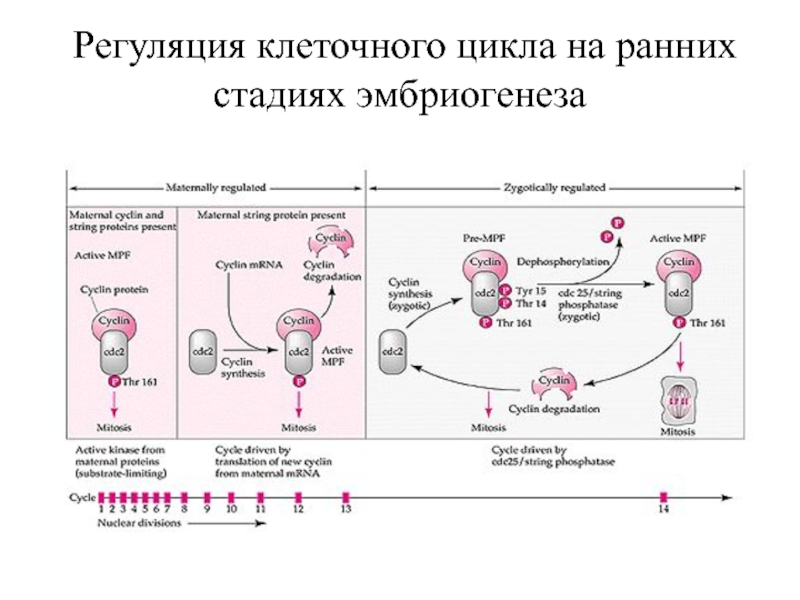
- 65. Регуляция клеточного цикла на ранних стадиях эмбриогенеза
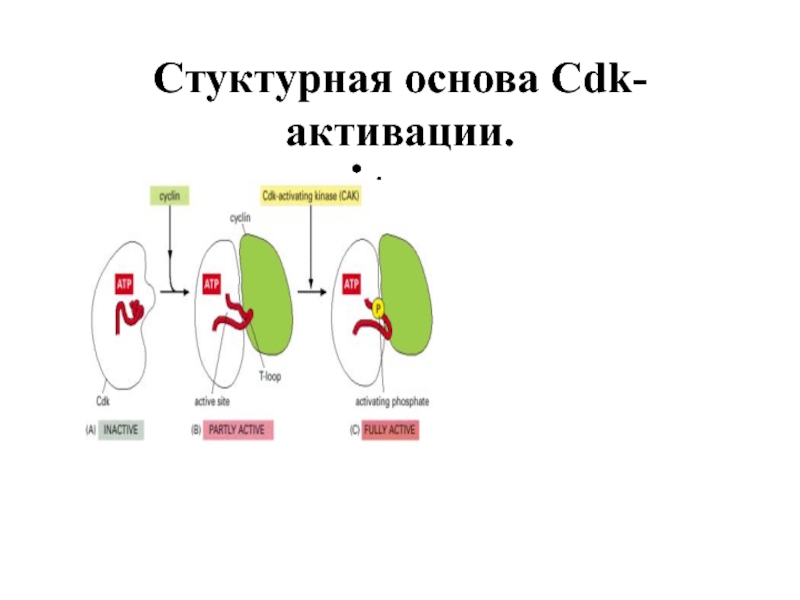
- 66. Стуктурная основа Cdk-активации. .
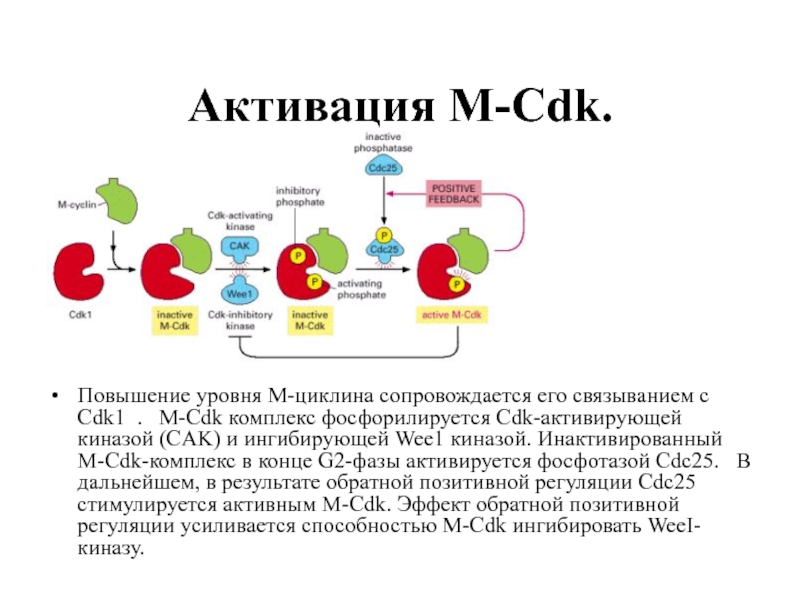
- 67. Активация M-Cdk. Повышение уровня М-циклина сопровождается
Слайд 1Все органы и ткани в процессе индивидуального развития формируются в результате
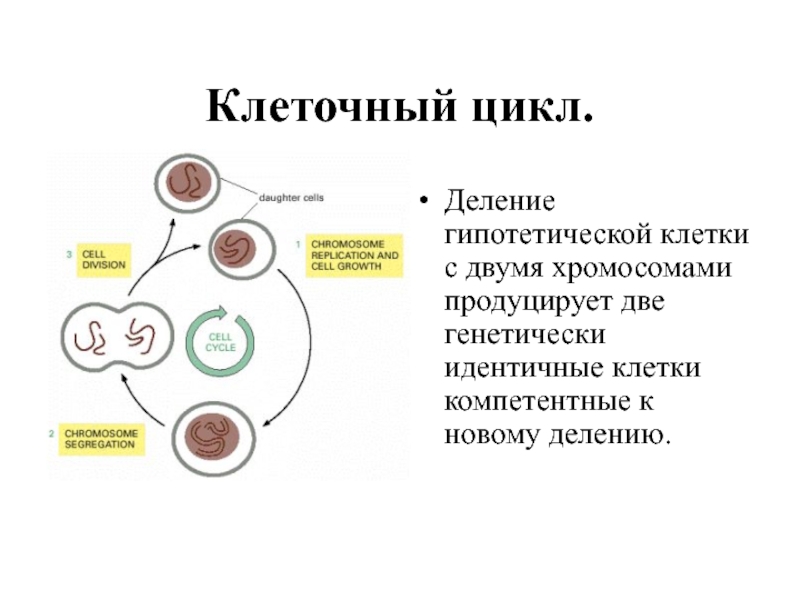
Слайд 2Клеточный цикл.
Деление гипотетической клетки с двумя хромосомами продуцирует две генетически
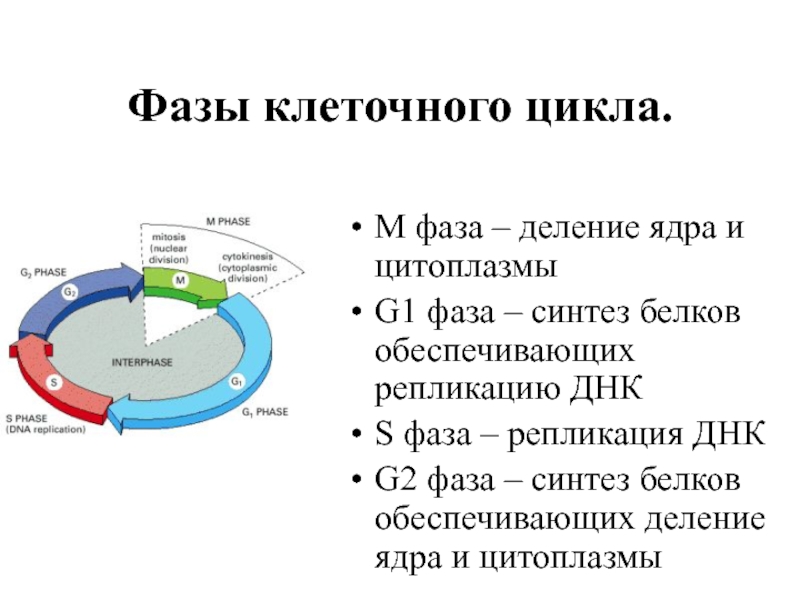
Слайд 3Фазы клеточного цикла.
М фаза – деление ядра и цитоплазмы
G1
S фаза – репликация ДНК
G2 фаза – синтез белков обеспечивающих деление ядра и цитоплазмы
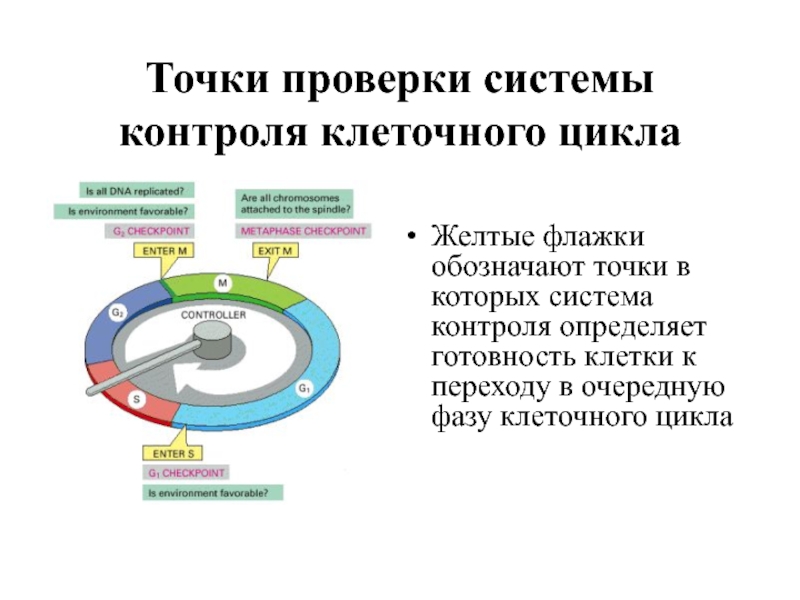
Слайд 4Точки проверки системы контроля клеточного цикла
Желтые флажки обозначают точки в
Слайд 5Циклины и фазы клеточного цикла.
Имеется четыре класса циклинов. Функция каждого из
1. G1/S-циклины связывают Cdk в конце G1-фазы и готовят клетки к DNA-репликации. 2. S-циклины связывают Cdk во время S-фазы и необходимы для инициации DNA-репликации. 3. М-циклины инициируют митоз.
4. G1-циклины помогают пройти контрольную точку поздней G1-фазы.
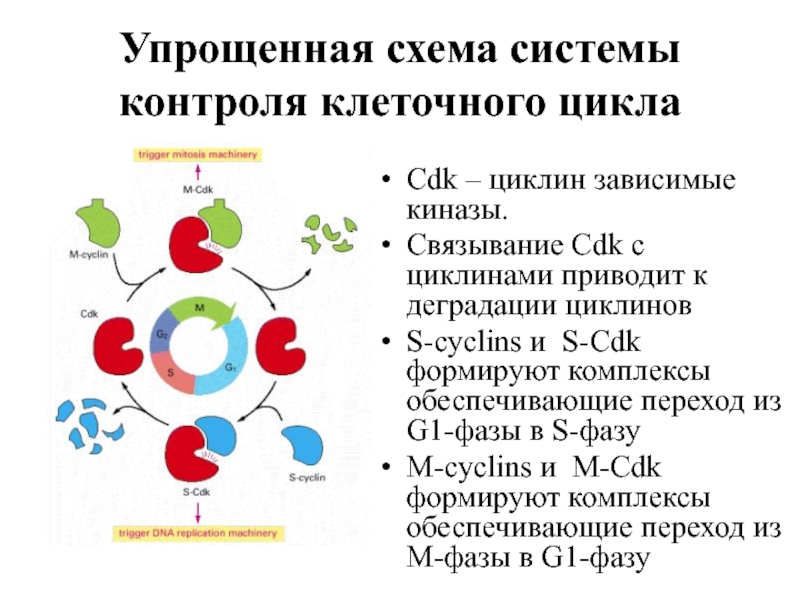
Слайд 6Упрощенная схема системы контроля клеточного цикла
Cdk – циклин зависимые киназы.
Связывание
S-cyclins и S-Cdk формируют комплексы обеспечивающие переход из G1-фазы в S-фазу
M-cyclins и M-Cdk формируют комплексы обеспечивающие переход из M-фазы в G1-фазу
Слайд 7Двухкомпонентная система контроля клеточного цикла.
Связывание циклина и Cdk активирует протеинкиназу к
Слайд 8CKI p27 – ингибитор cyclin-Cdk комплекса.
p27 связываясь с cyclin A-Cdk2
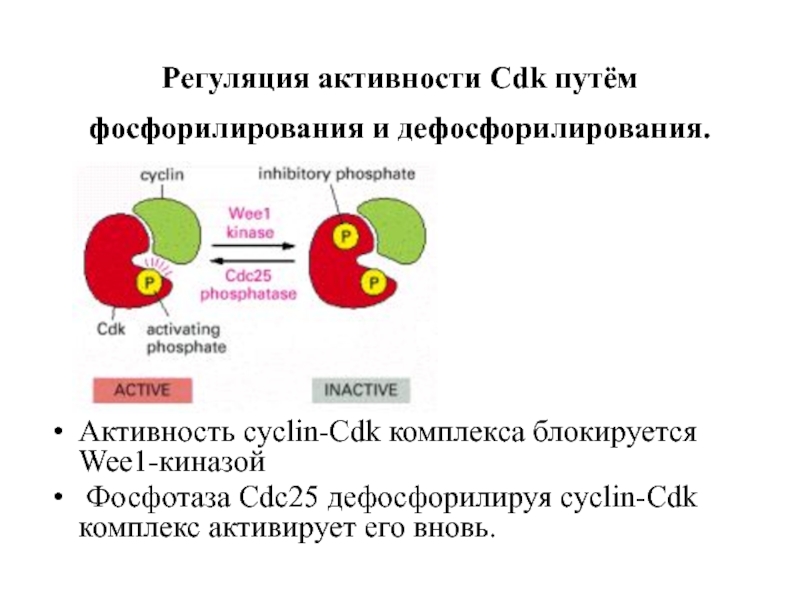
Слайд 9Регуляция активности Cdk путём фосфорилирования и дефосфорилирования.
Активность cyclin-Cdk комплекса блокируется
Фосфотаза Cdc25 дефосфорилируя cyclin-Cdk комплекс активирует его вновь.
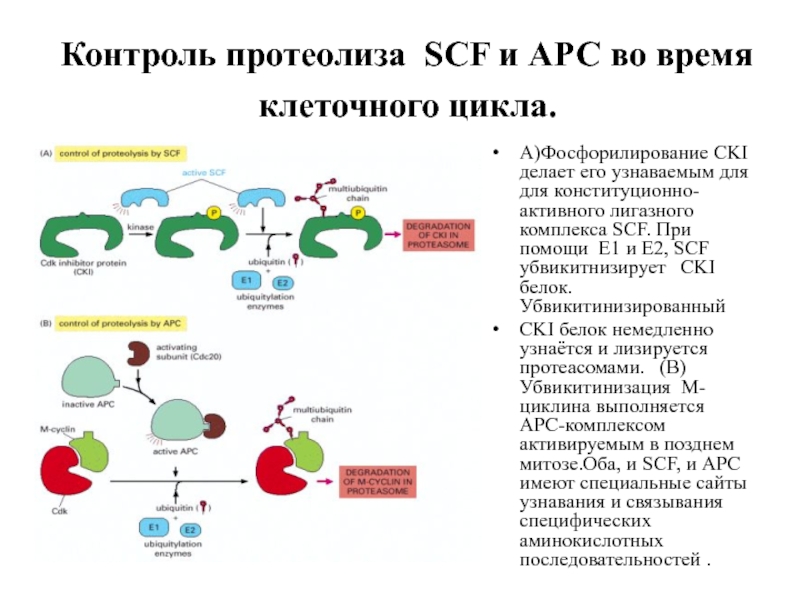
Слайд 10Контроль протеолиза SCF и APC во время клеточного цикла.
A)Фосфорилирование CKI
CKI белок немедленно узнаётся и лизируется протеасомами. (B) Убвикитинизация M-циклина выполняется APC-комплексом активируемым в позднем митозе.Оба, и SCF, и APC имеют специальные сайты узнавания и связывания специфических аминокислотных последовательностей .
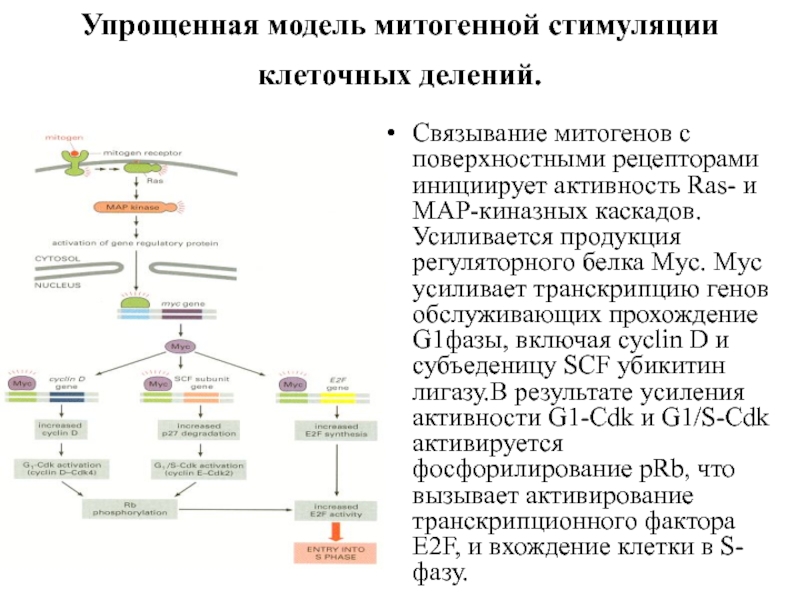
Слайд 11Упрощенная модель митогенной стимуляции клеточных делений.
Связывание митогенов с поверхностными рецепторами
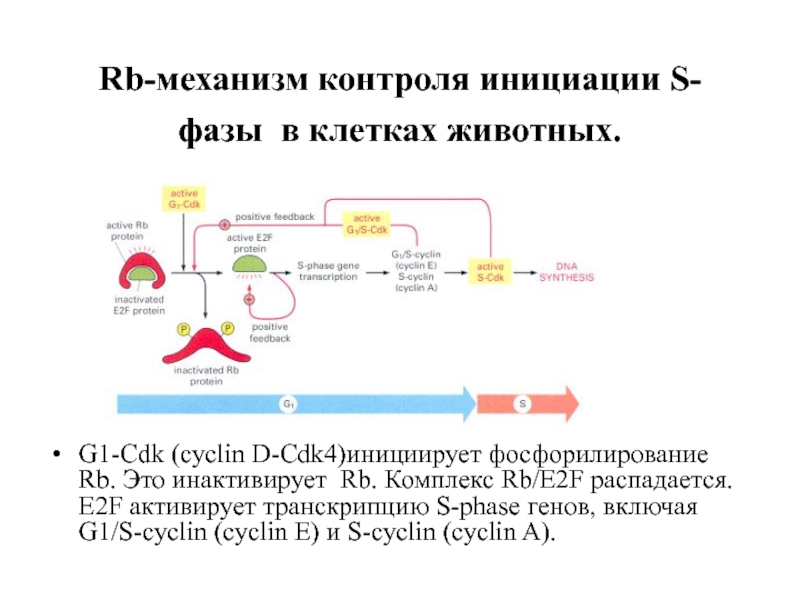
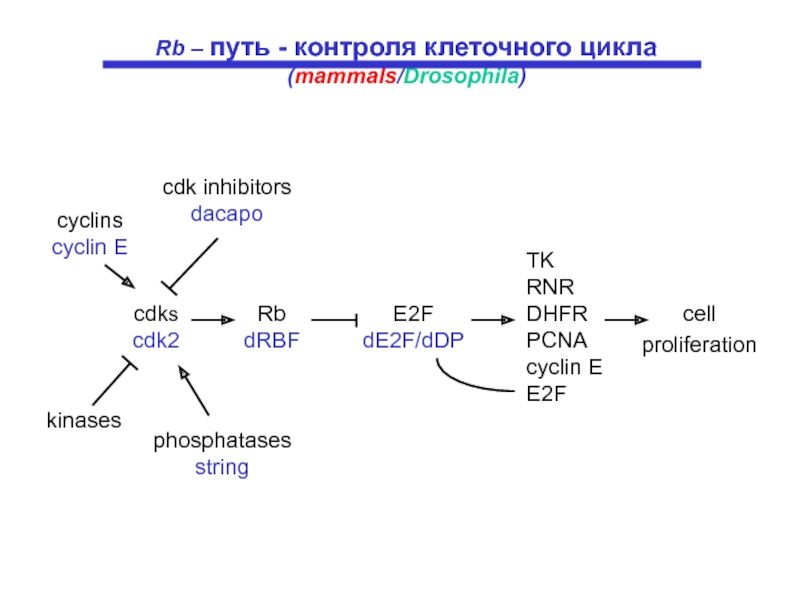
Слайд 12Rb-механизм контроля инициации S-фазы в клетках животных.
G1-Cdk (cyclin D-Cdk4)инициирует фосфорилирование
Слайд 13cell
proliferation
TK
RNR
DHFR
PCNA
cyclin E
E2F
phosphatases
string
kinases
cdks
cdk2
Rb
dRBF
E2F
dE2F/dDP
cdk inhibitors
dacapo
cyclins
cyclin E
Rb – путь - контроля клеточного цикла
Слайд 15
1429 aa
1202 aa
1144 aa
nNOS
(neuronal)
eNOS
(endothelial)
iNOS
(inducible)
PDZ
Nitric oxide synthase (NOS) изоформы
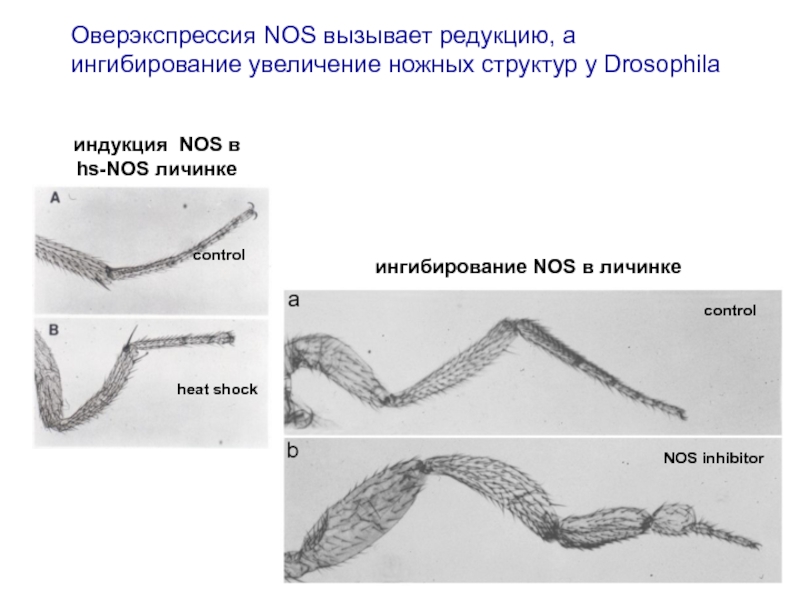
Слайд 16
Оверэкспрессия NOS вызывает редукцию, а ингибирование увеличение ножных структур у Drosophila
control
heat shock
NOS inhibitor
control
индукция NOS в
hs-NOS личинке
ингибирование NOS в личинке
Слайд 17
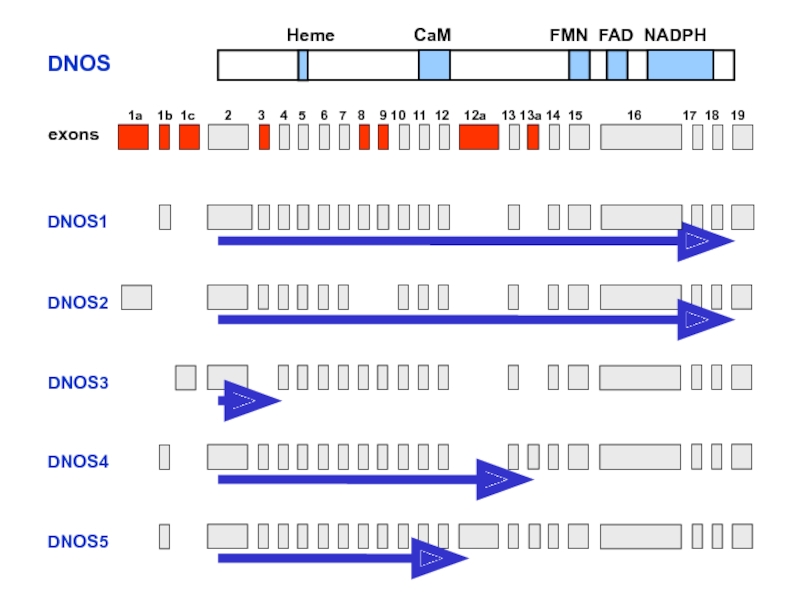
DNOS1
DNOS2
DNOS3
DNOS4
DNOS5
1a 1b 1c
exons
Heme CaM FMN FAD NADPH
DNOS
Слайд 18
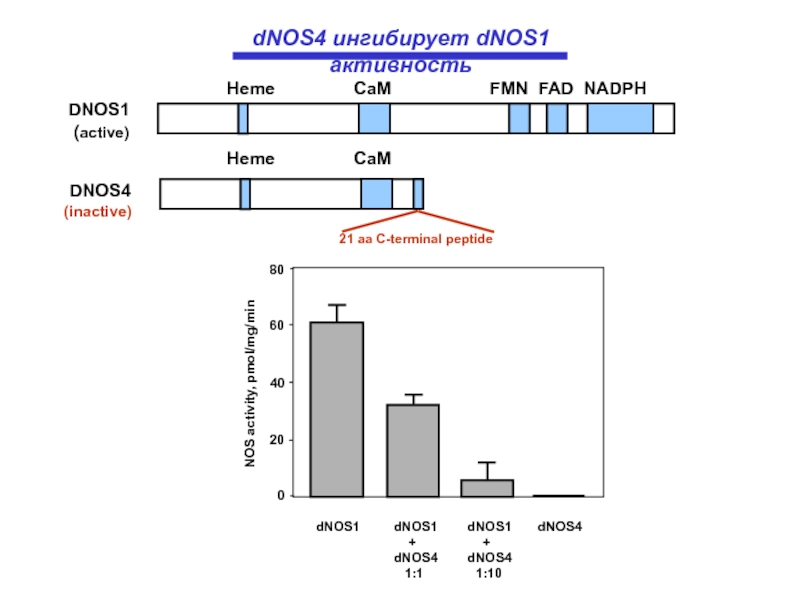
NOS activity, pmol/mg/min
0
20
40
60
80
dNOS1 dNOS1
+ +
dNOS4 dNOS4
1:1 1:10
DNOS1
(active)
DNOS4
(inactive)
21 aa C-terminal peptide
dNOS4 ингибирует dNOS1 активность
Heme CaM FMN FAD NADPH
Heme CaM
Слайд 23 DNOS4 взаимодействует с RB-сигнальным путём; она спасает RBF- фенотип и
Слайд 25cell
proliferation
TK
RNR
DHFR
PCNA
cyclin E
E2F
phosphatases
string
kinases
cdks
cdk2
Rb
dRBF
E2F
dE2F/dDP
cdk inhibitors
dacapo
cyclins
cyclin E
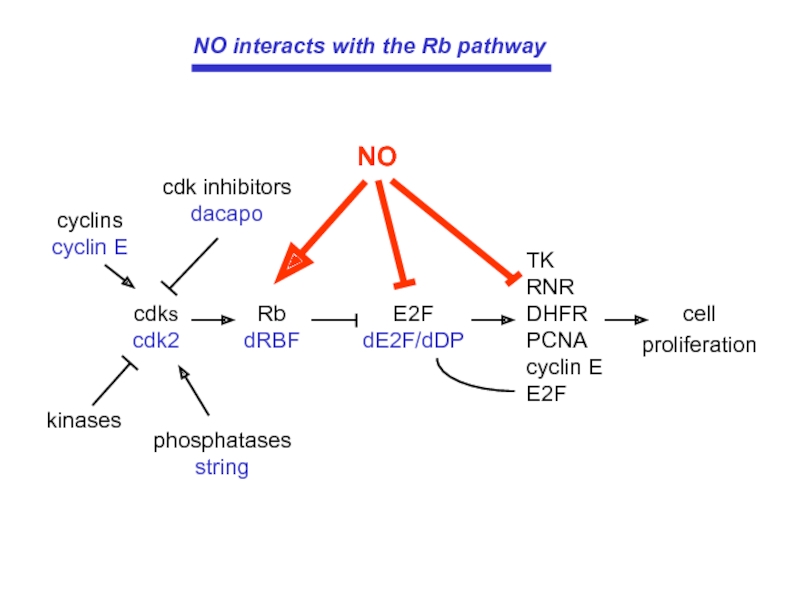
NO interacts with the Rb pathway
NO
Слайд 26Примеры фенотипических изменений мутациями генов определяющих планарную полярность клеток у дрозофилы
Дикий тип показан на панелях a, c, e, и g a мутантный фенотип показан в b, d, f, и h панелях
(a,b) Drosophila патерн волосков на крыльях;
(c,d) рисунок волосяного покрова мыши;
(e,f) Drosophila рисунок глазного нейроэпителия ;
(g,h) нейроэпителий внутреннего уха мыши.
Слайд 27Фенотипическое проявление нарушений планарной полярности у мутантов Stbm/Vang – генов.
.Часть крыла
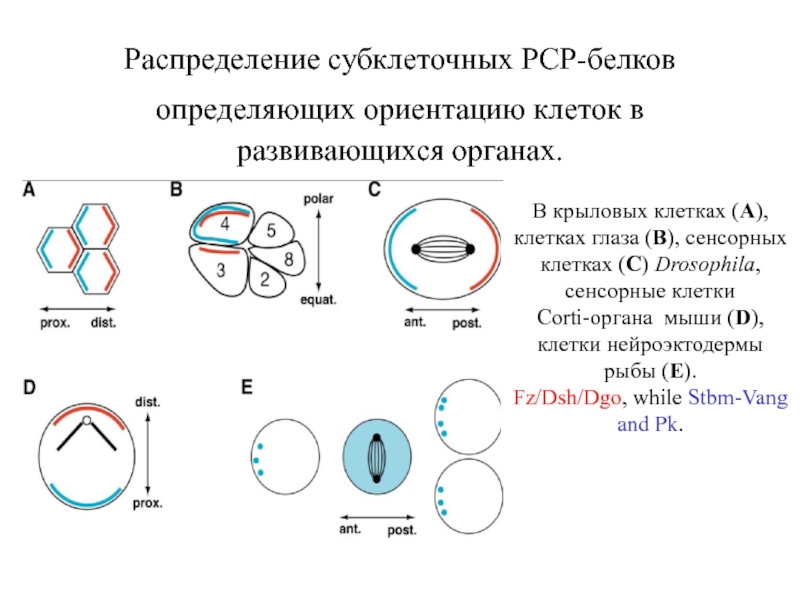
Слайд 28Распределение субклеточных РСР-белков определяющих ориентацию клеток в развивающихся органах.
В крыловых клетках
Corti-органа мыши (D), клетки нейроэктодермы рыбы (E).
Fz/Dsh/Dgo, while Stbm-Vang and Pk.
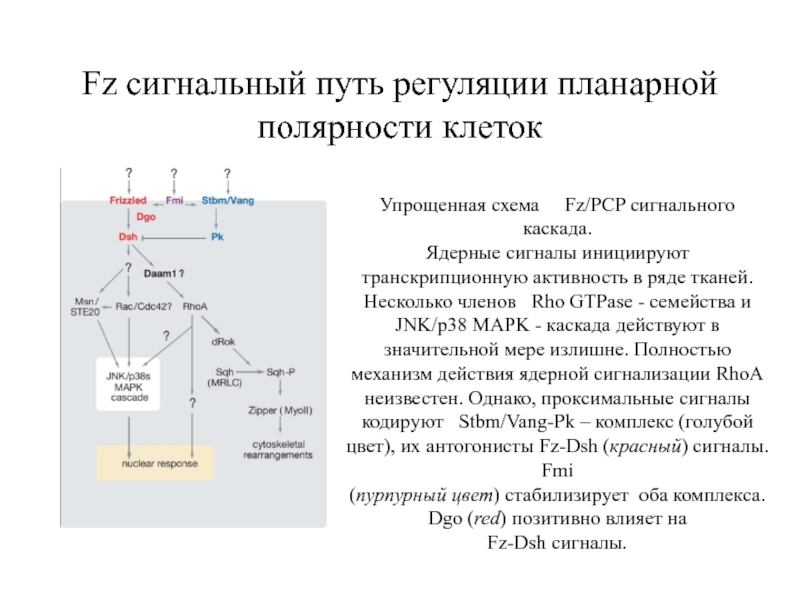
Слайд 33Fz сигнальный путь регуляции планарной полярности клеток
Упрощенная схема Fz/PCP
Ядерные сигналы инициируют транскрипционную активность в ряде тканей. Несколько членов Rho GTPase - семейства и JNK/p38 MAPK - каскада действуют в значительной мере излишне. Полностью механизм действия ядерной сигнализации RhoA неизвестен. Однако, проксимальные сигналы кодируют Stbm/Vang-Pk – комплекс (голубой цвет), их антогонисты Fz-Dsh (красный) сигналы. Fmi
(пурпурный цвет) стабилизирует оба комплекса. Dgo (red) позитивно влияет на
Fz-Dsh сигналы.
Слайд 34Эктопическая экспрессия NOS4 в крыловых структурах вызывает нарушение плана полярности клеток
Слайд 38Стуктуры аристы на разных стадиях куколки (22ч., 32 ч., 44ч.) и
Слайд 39Изменение полярной организации клеток поверхностного эпителия трахеи мыши в результате нокаута
Слайд 42Блокирование апоптоза нарушает развитие мозга мыши.
Нарушение нормального развития мозга в результате
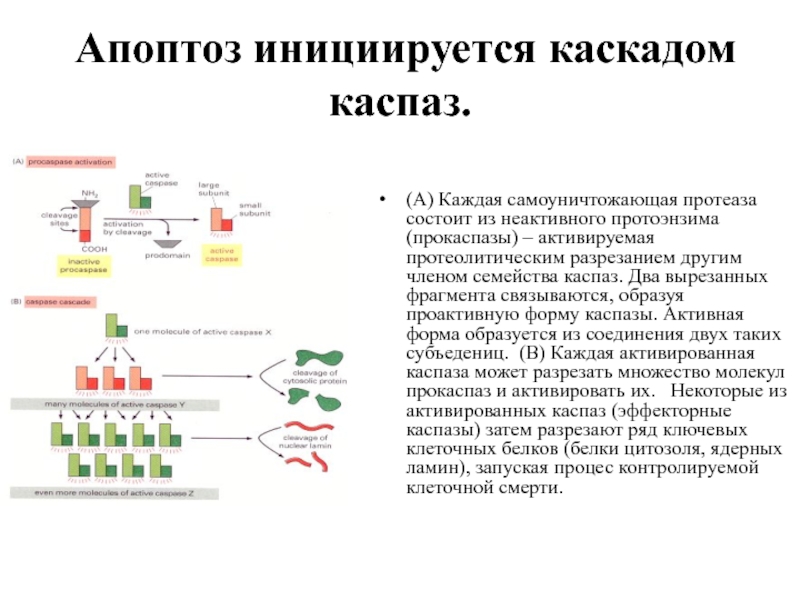
Слайд 43Апоптоз инициируется каскадом каспаз.
(A) Каждая самоуничтожающая протеаза состоит из
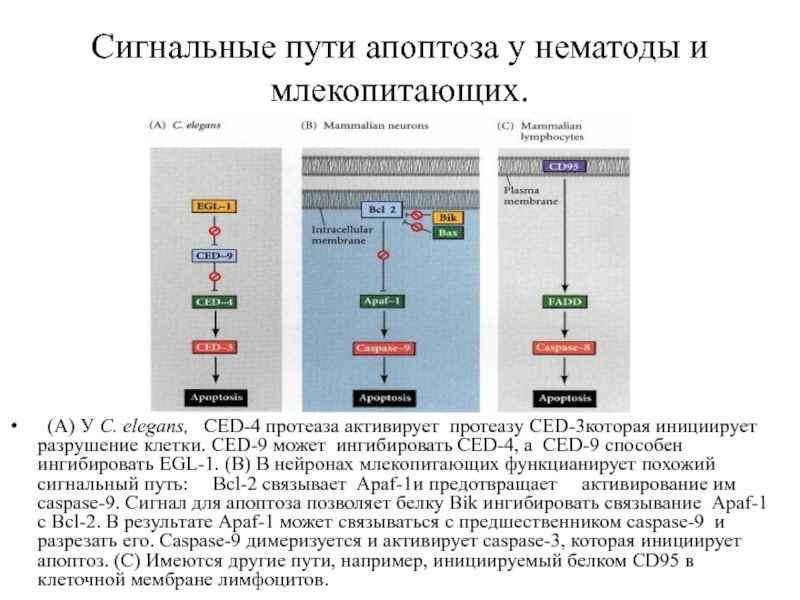
Слайд 45Сигнальные пути апоптоза у нематоды и млекопитающих.
(A) У C. elegans,
Слайд 46Взаимодействие генов в ответ на воздействие внешней среды является важнейшим фактором
Слайд 47 Иллюстрация к «теории канализации развития», на примере шара скатывающегося по
Слайд 49Мутации spineless-aristapedia нарушают:
морфогенез конечностей;
нейрогенез;
дендритное ветвление;
митоз
и характеризуются температурной чувствительностью
Слайд 53 Разнообразие форм конечностей у дрозофилы, вызванное модуляцией экспрессии гена spineless
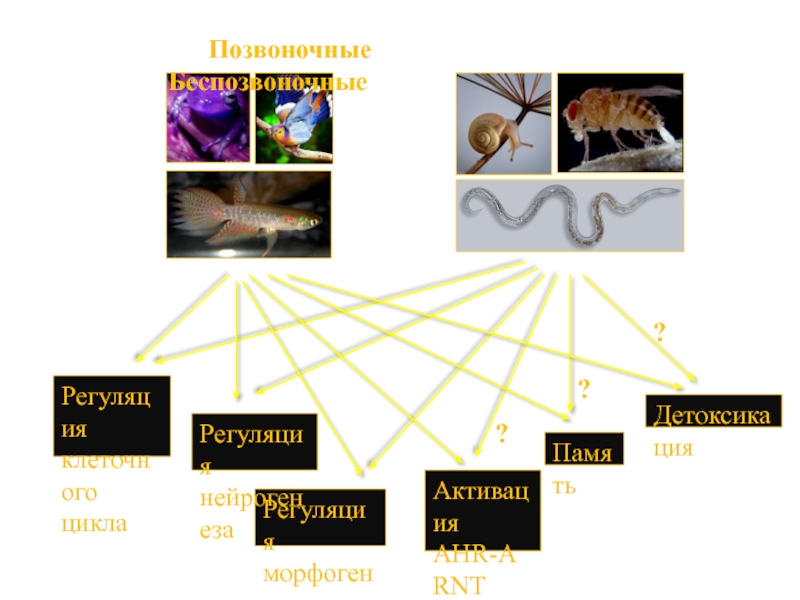
Слайд 55 Позвоночные
Регуляция
морфогенеза
Регуляция
клеточного
цикла
Детоксикация
Регуляция
нейрогенеза
Активация
AHR-ARNT
диоксином
Память
?
?
?
Слайд 58One copy of GMR-dNOS4 transgene combined with dNOS1
deficient allele causes
GMR-dNOS4
heterozygous
females
GMR-dNOS4 + 69F
heterozygous females
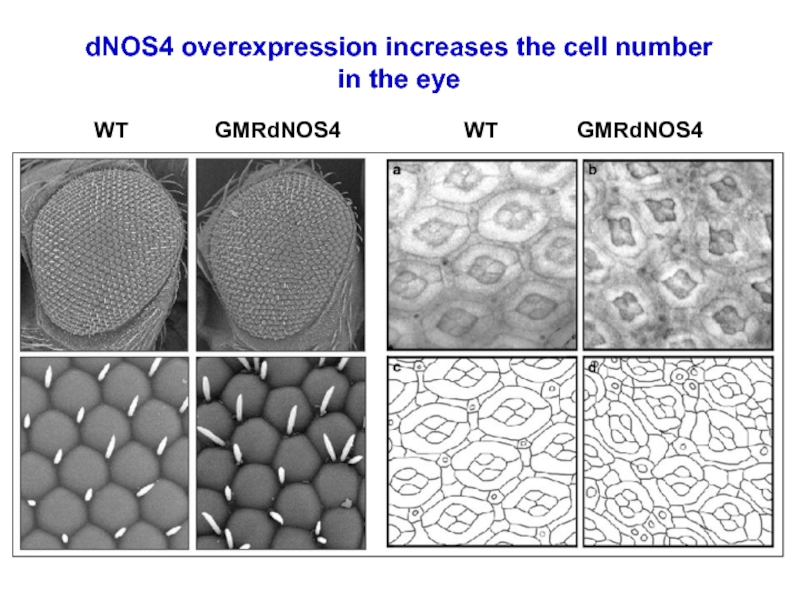
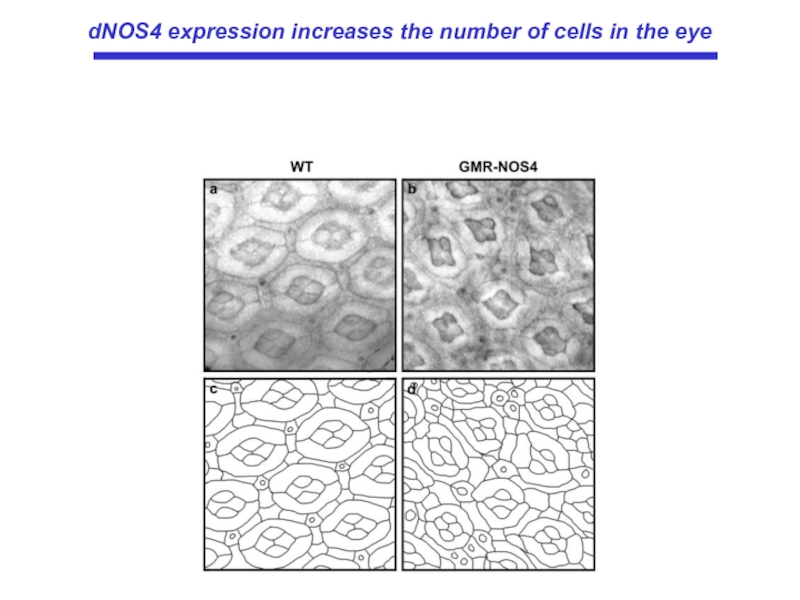
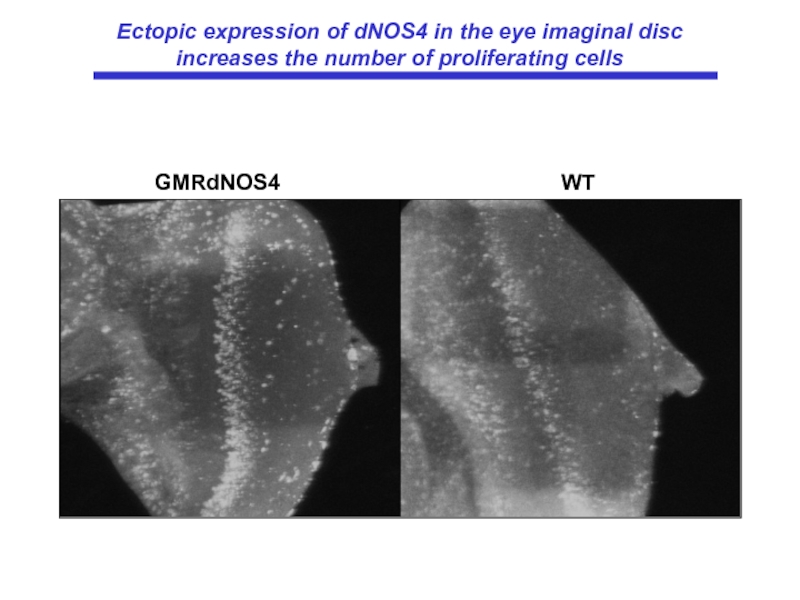
Слайд 60GMRdNOS4
WT
Ectopic expression of dNOS4 in the eye imaginal disc
Слайд 61
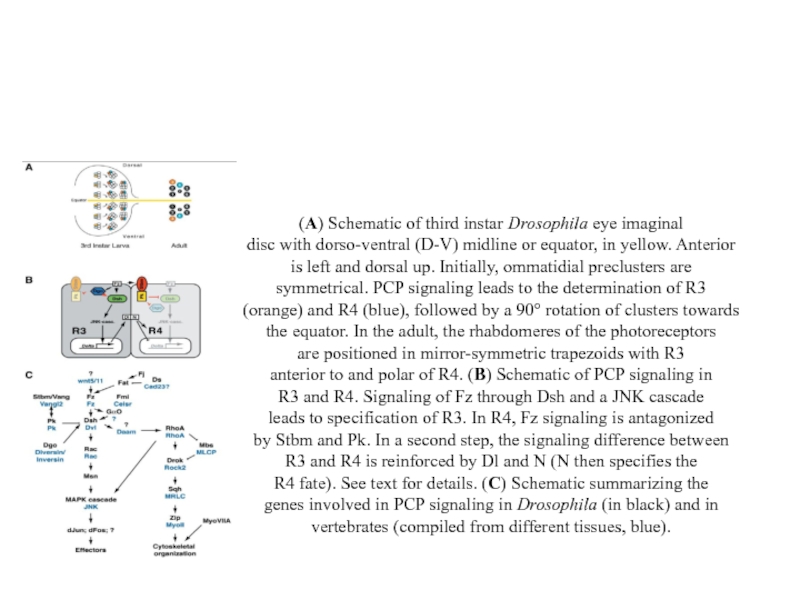
(A) Schematic of third instar Drosophila eye imaginal
disc with dorso-ventral (D-V)
is left and dorsal up. Initially, ommatidial preclusters are
symmetrical. PCP signaling leads to the determination of R3
(orange) and R4 (blue), followed by a 90° rotation of clusters towards
the equator. In the adult, the rhabdomeres of the photoreceptors
are positioned in mirror-symmetric trapezoids with R3
anterior to and polar of R4. (B) Schematic of PCP signaling in
R3 and R4. Signaling of Fz through Dsh and a JNK cascade
leads to specification of R3. In R4, Fz signaling is antagonized
by Stbm and Pk. In a second step, the signaling difference between
R3 and R4 is reinforced by Dl and N (N then specifies the
R4 fate). See text for details. (C) Schematic summarizing the
genes involved in PCP signaling in Drosophila (in black) and in
vertebrates (compiled from different tissues, blue).