- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислотные и основные свойства биоорганических соединений. (Лекция 2) презентация
Содержание
- 1. Кислотные и основные свойства биоорганических соединений. (Лекция 2)
- 2. Кислотность и основность - важные
- 3. Кислотно-основные взаимодействия А-Н + :В
- 4. [НСОО-]×[Н3О+] К=
- 5. Чем ниже кислотность, тем выше рКа Ка
- 6. Классификация кислот Выделяют : О-Н –кислоты (вода,
- 7. КИСЛОТНОСТЬ И ОСНОВНОСТЬ СВЯЗАНЫ СО ВЗАИМНЫМ ВЛИЯНИЕМ
- 8. Сила кислоты определяется стабильностью образующихся ионов, которая определяется: 1.Электроотрицательнью элементов
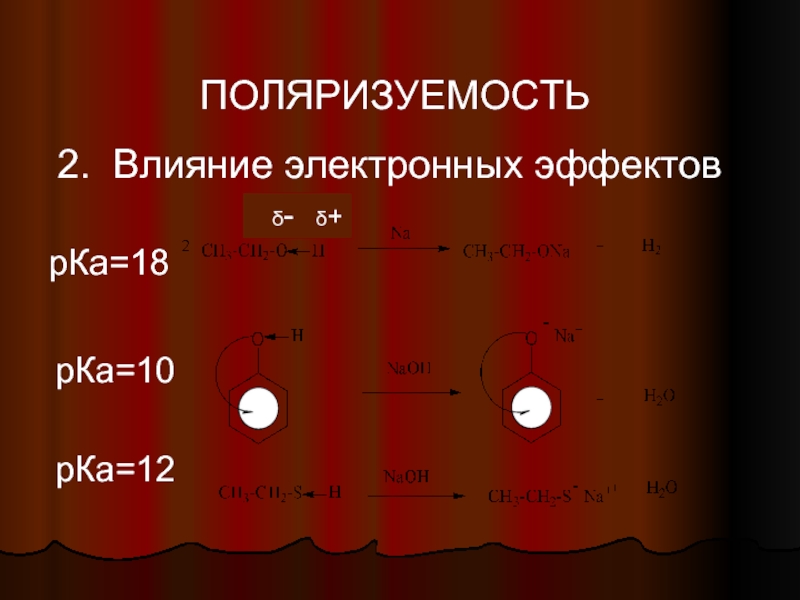
- 9. ПОЛЯРИЗУЕМОСТЬ 2. Влияние электронных эффектов δ- δ+ рКа=18 рКа=10 рКа=12
- 10. Поляризуемость Для S-H кислот преобладающим фактором является
- 11. Кислотность тиолов выше, чем
- 12. CH2-S-H CH2-S-H
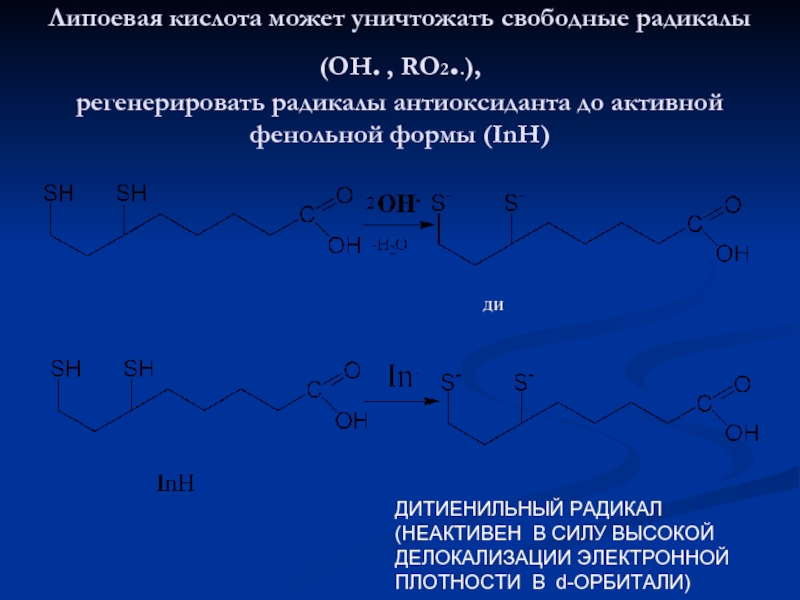
- 13. Липоевая кислота может уничтожать свободные радикалы (ОН.
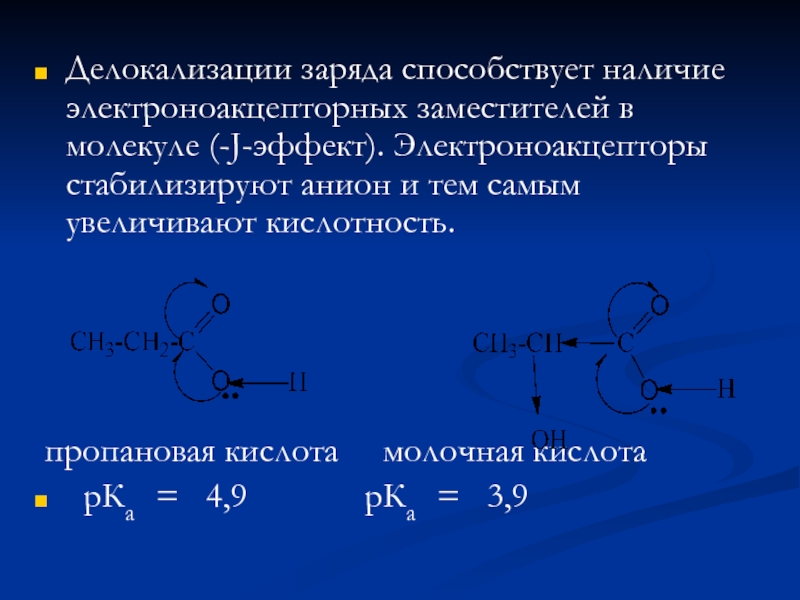
- 14. Делокализации заряда способствует наличие электроноакцепторных заместителей в
- 15. Атомы хлора выполняют роль электроноакцепторов
- 16. Основность –способность принимать и удерживать протоны Для
- 17. Сравнительная оценка основных свойств Величина основности определяется
- 18. Основания образуют соли с кислотами CH3→
- 21. О рН>>7
- 22. Классификации аминокислот, исходя из количества карбокси-
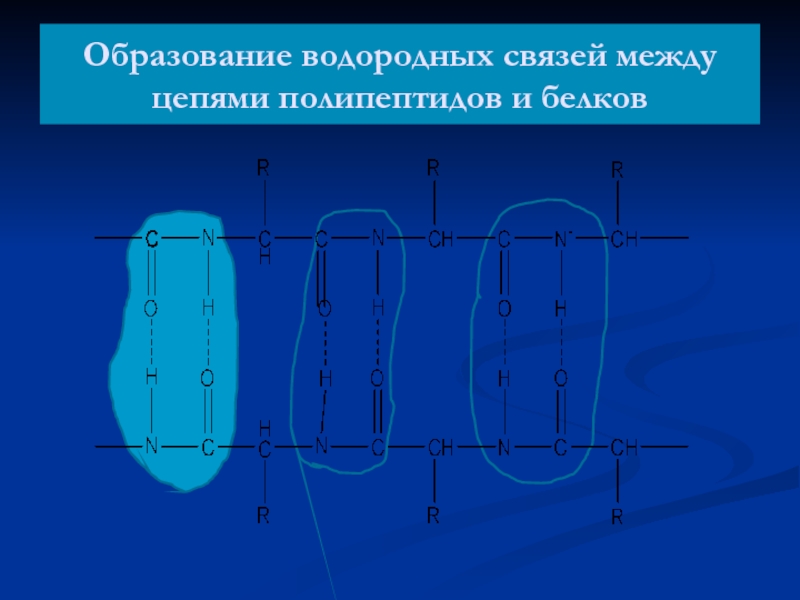
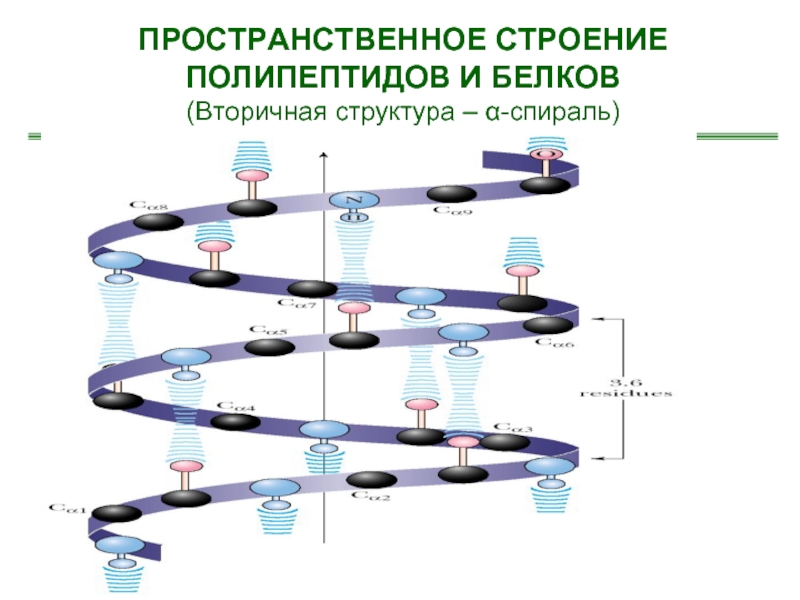
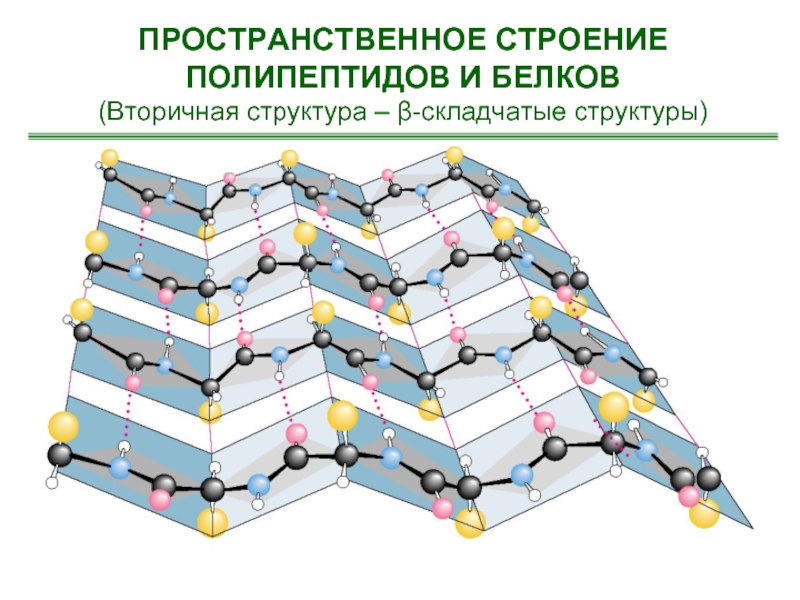
- 23. Образование водородных связей между цепями полипептидов и белков
Слайд 2Кислотность и основность - важные свойства соединений, определяющие их
Слайд 3Кислотно-основные взаимодействия
А-Н + :В ↔ А- +
кислота основание сопряженное сопряженная
основание кислота
По теории Бренстеда-Лоури
Кислоты - доноры протонов,
основания- акцепторы протонов
Слайд 6Классификация кислот
Выделяют :
О-Н –кислоты (вода, спирты, фенолы, карбоновые кислоты)
S-H – кислоты
N-H – кислоты (аммиак, амины, пиррол, имидазол)
С-Н – кислоты (углеводороды)
Слайд 7КИСЛОТНОСТЬ И ОСНОВНОСТЬ СВЯЗАНЫ СО ВЗАИМНЫМ ВЛИЯНИЕМ АТОМОВ В МОЛЕКУЛАХ БИООРГАНИЧЕСКИХ
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
(Лайнус Поллинг, 1932 г.)
Электроотрицательность – это способность атома притягивать валентные электроны, связывающие его с соседними атомами в молекуле.
Между атомами с разной электроотрицательностью возникает поляризация связи, обусловленная неравномерным распределением электронной плотности.
Слайд 8
Сила кислоты определяется стабильностью образующихся ионов, которая определяется:
1.Электроотрицательнью элементов
Слайд 10Поляризуемость
Для S-H кислот преобладающим фактором является поляризуемость. Атомы серы больше по
Слайд 11
Кислотность тиолов выше, чем кислотность спиртов
R-S-H +
R-O-H + NaOH →реакция не идет
2 R-O-H + Na → 2 R-O- Na + H2
Слайд 12
CH2-S-H CH2-S-H
| | Pb |
CH – S- H + PbO → CH – S H - S- CH
| | | +Н2О
CH2- O-H CH2- O-H H - O-CH2
Оксиды тяжелых металлов способны связывать S-H группы белков и отравлять (инактивировать) ферменты. Для выведения тяжелых металлов используют комплексообразователи (унитиол, британский антилюизиит и др.).
Дигидролипоевая кислота
α-липоевая кислота
Слайд 13Липоевая кислота может уничтожать свободные радикалы (ОН. , RO2..), регенерировать радикалы
ДИТИЕНИЛЬНЫЙ РАДИКАЛ
(НЕАКТИВЕН В СИЛУ ВЫСОКОЙ
ДЕЛОКАЛИЗАЦИИ ЭЛЕКТРОННОЙ
ПЛОТНОСТИ В d-ОРБИТАЛИ)
ди
Слайд 14Делокализации заряда способствует наличие электроноакцепторных заместителей в молекуле (-J-эффект). Электроноакцепторы стабилизируют
пропановая кислота молочная кислота
рКа = 4,9 рКа = 3,9
Слайд 15Атомы хлора выполняют роль электроноакцепторов ( - J
СCl3←СООН > Cl←СH2 ←СООН >СH3→СООН
pKa = 1,20 pKa = 3,75 pKa = 4,75
Электронодонорные заместители, напротив, уменьшают кислотность (+J )
Н – СООН > СН3-СООН > СН3-СН2 СООН
pKa = 3,7 pKa = 4,7 pKa = 4,9
Слайд 16Основность –способность принимать и удерживать протоны
Для образования ковалентной связи с протоном
Слайд 17Сравнительная оценка основных свойств
Величина основности определяется теми же факторами, что и
С увеличением электроотрицательности атомов основность уменьшается, поскольку атом прочнее удерживанет пару электронов и она становится менее доступной для связи с протоном.
N>O >S R-NH2> R-O-H > R-S-H
Слайд 18Основания образуют соли с кислотами
CH3→ NH2 + HCl →
хлорид метиламмония
CH3→ ОН + H2SO4 → [CH3→ O+H2 ] HSO4 -
гидроcульфат метилоксония
Соли органических соединений с минеральными и органическими кислотами, как правило, растворимы в воде, что используется при приготовлении фармпрепаратов.
Слайд 19
кислотно-основные свойства аминокислот
Влияние заместителя (-NH2)-группы на
Аминогруппа за счет – J-
кислотные свойства аминокислот
по сравнению с обычными кислотами
Слайд 20
Несуществующая
в природе форма
Биполярный ион
(цвиттер-ион),
внутренняя соль
АМФОЛИТЫ –соединения , имеющие
Слайд 21 О рН>>7 O
СН3-СН –
| O ←H | O-
:NH2 NH2
О рН<<7 O
СН3-СН – С ↔ СН3-СН – С
| O ←H | OН
:NH2 +NH3
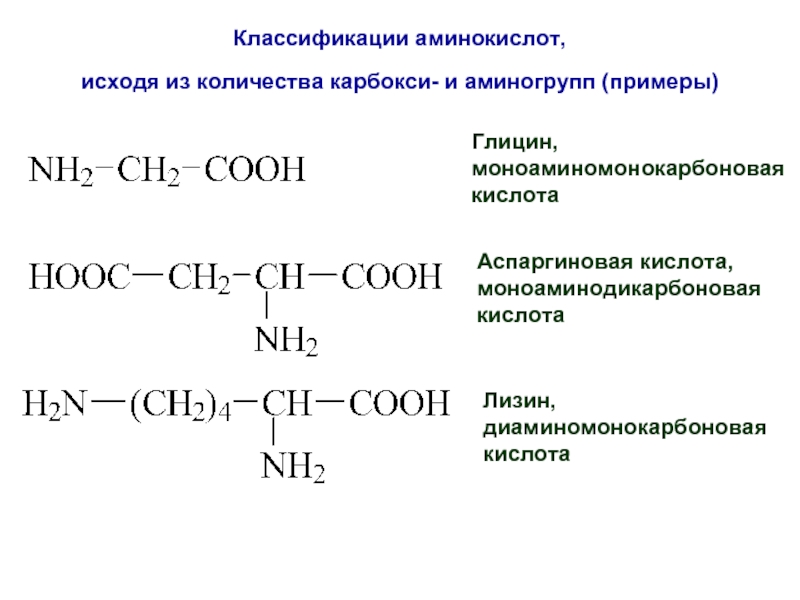
Слайд 22Классификации аминокислот,
исходя из количества карбокси- и аминогрупп (примеры)
Глицин,
моноаминомонокарбоновая
кислота
Аспаргиновая кислота,
моноаминодикарбоновая
кислота
Лизин,
диаминомонокарбоновая
кислота



![[НСОО-]×[Н3О+] К= [НСООН]×[Н2О]Ка = К×[Н2О] [НСОО-]×[Н3О+] Ка= [НСООН]](/img/tmb/3/216357/22c3a1caa0c2af3ea9d4c18c2aa2a0db-800x.jpg)










![Основания образуют соли с кислотамиCH3→ NH2 + HCl → [CH3→ N+H3 ] Cl-](/img/tmb/3/216357/ca7a46727da5d26b4229e15cbe1b60b8-800x.jpg)