- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Калориметрические методы анализа биомолекул презентация
Содержание
- 1. Калориметрические методы анализа биомолекул
- 2. Синхронное
- 3. Разница между «постепенным» переходом и переходом по
- 4. Холодовая денатурация
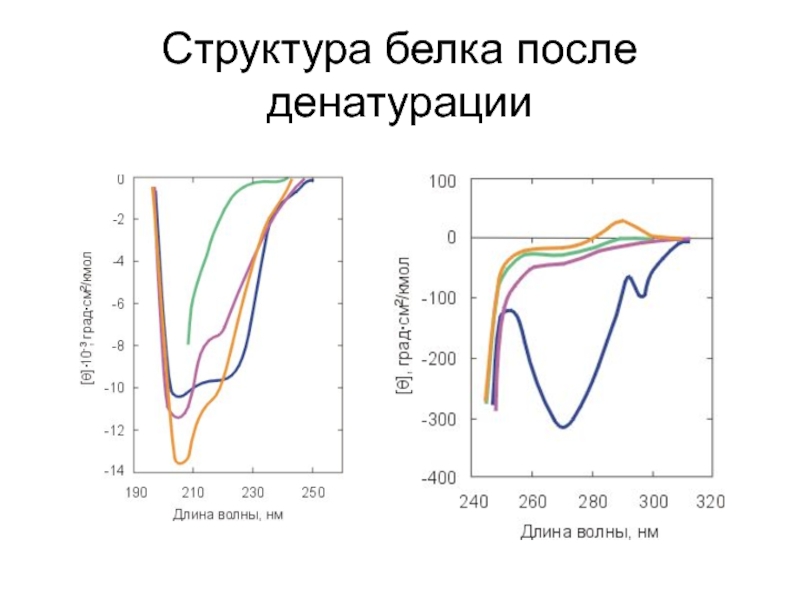
- 5. Структура белка после денатурации
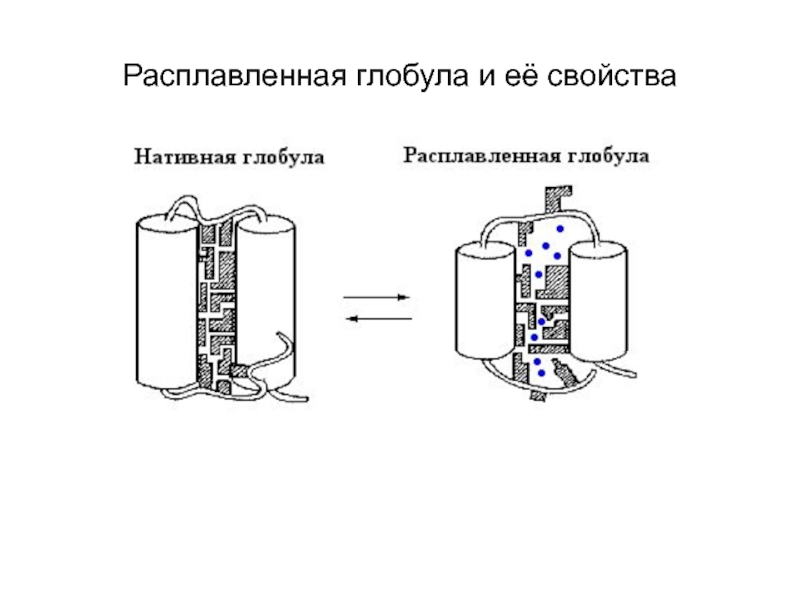
- 6. Расплавленная глобула и её свойства
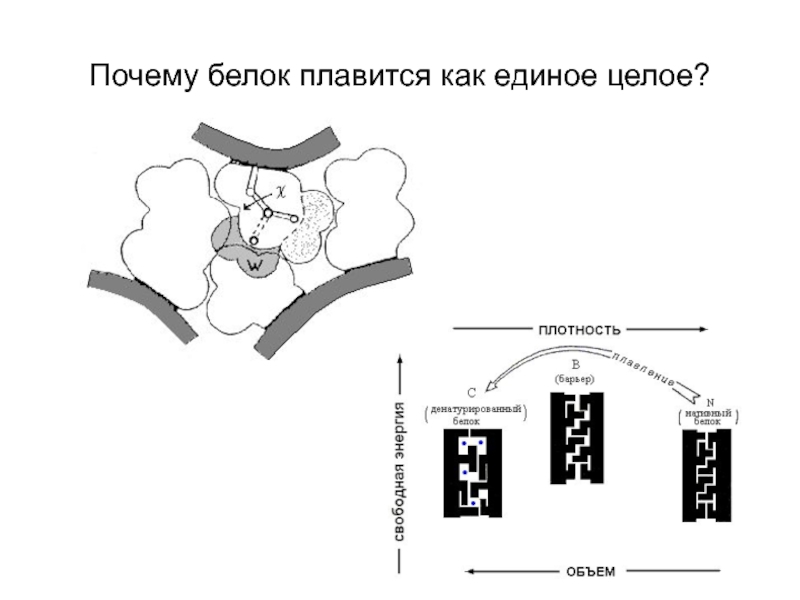
- 8. Почему белок плавится как единое целое?
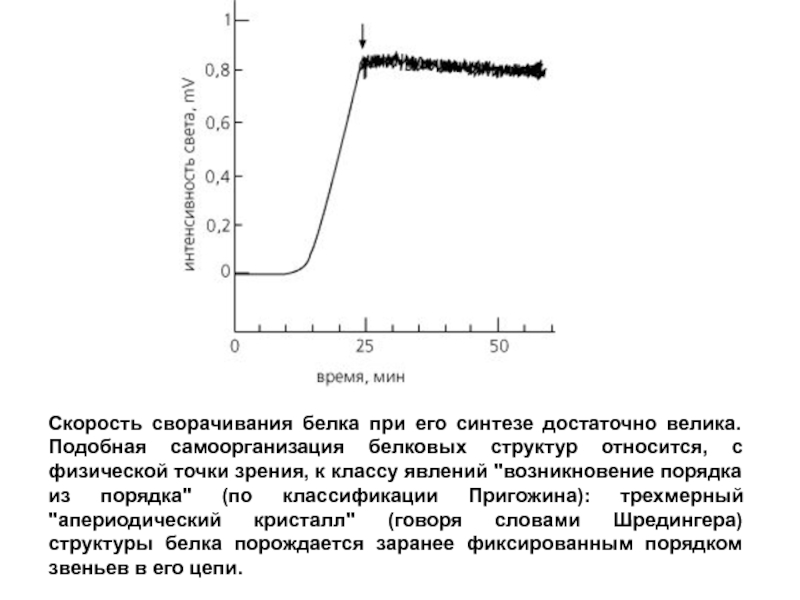
- 9. Скорость сворачивания белка при его синтезе достаточно
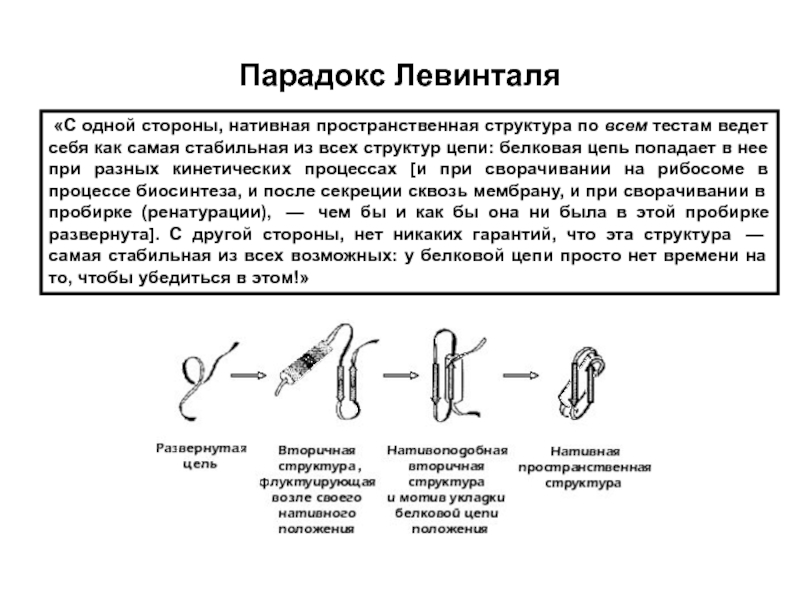
- 10. Парадокс Левинталя «С одной стороны, нативная
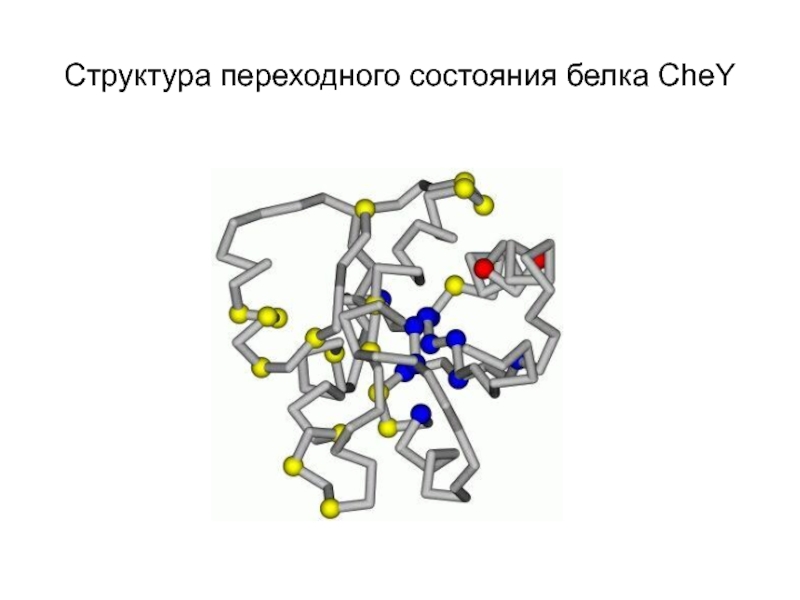
- 11. Структура переходного состояния белка CheY
- 12. Клеточная машинерия, способствующая правильному сворачиванию белка Шапероны Пролилизомераза Дисульфидизомераза
- 13. Шапероны Бывают двух типов: Фолдазы (GroEL/GroES, DnaK/DnaG)
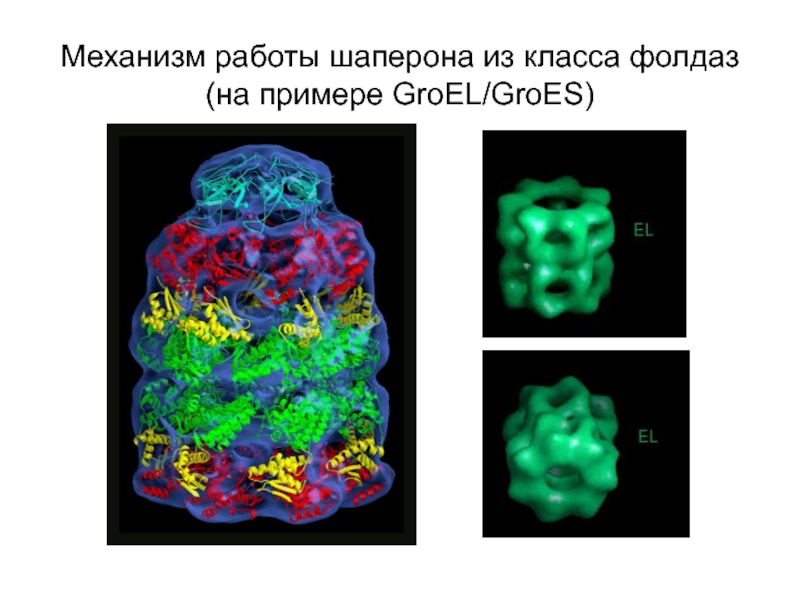
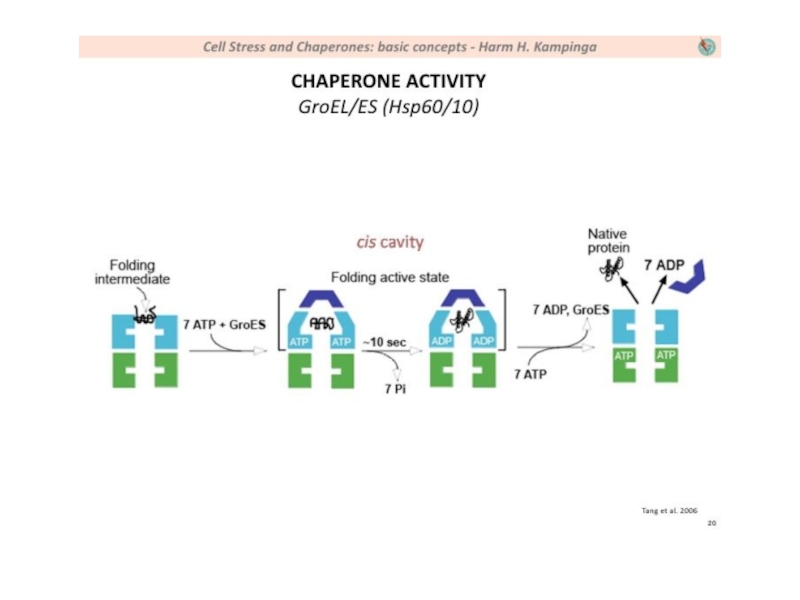
- 14. Механизм работы шаперона из класса фолдаз (на примере GroEL/GroES)
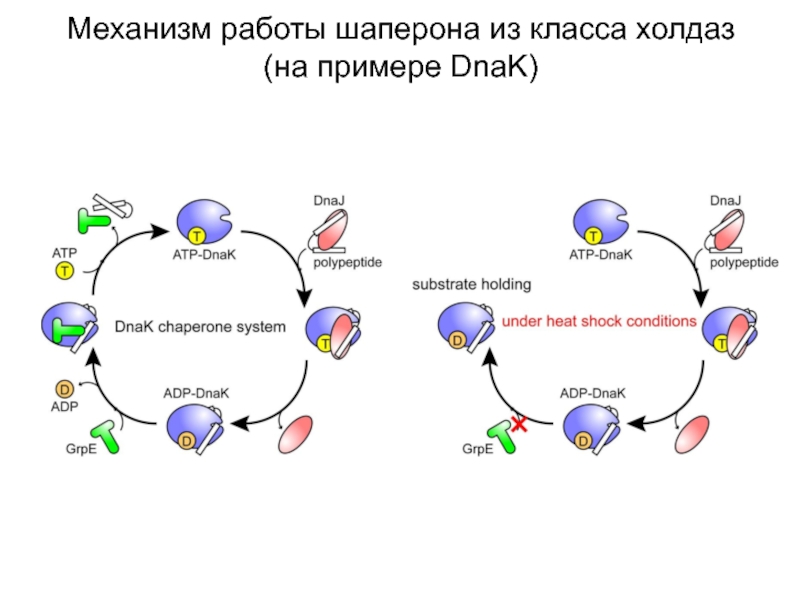
- 16. Механизм работы шаперона из класса холдаз (на примере DnaK)
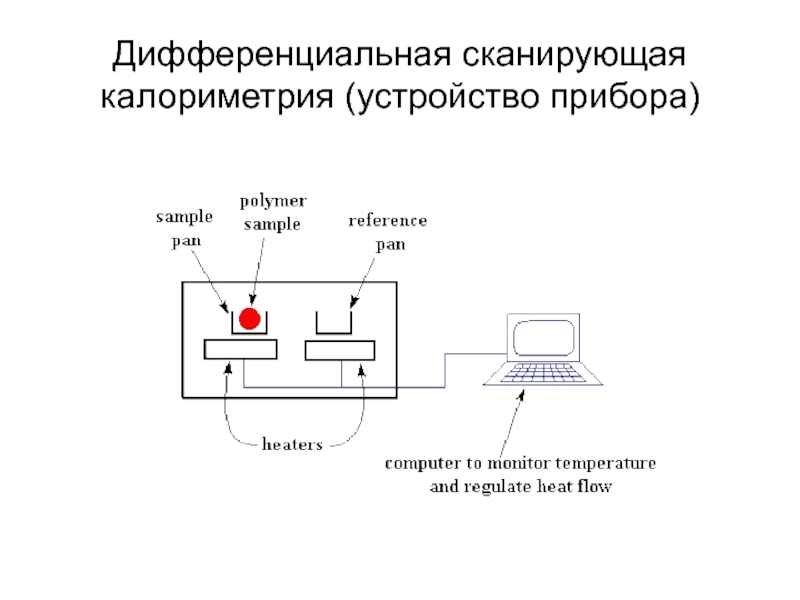
- 17. Дифференциальная сканирующая калориметрия (устройство прибора)
- 18. Дифференциальная сканирующая калориметрия (принцип метода) ΔH=∫ΔCp (T)dT
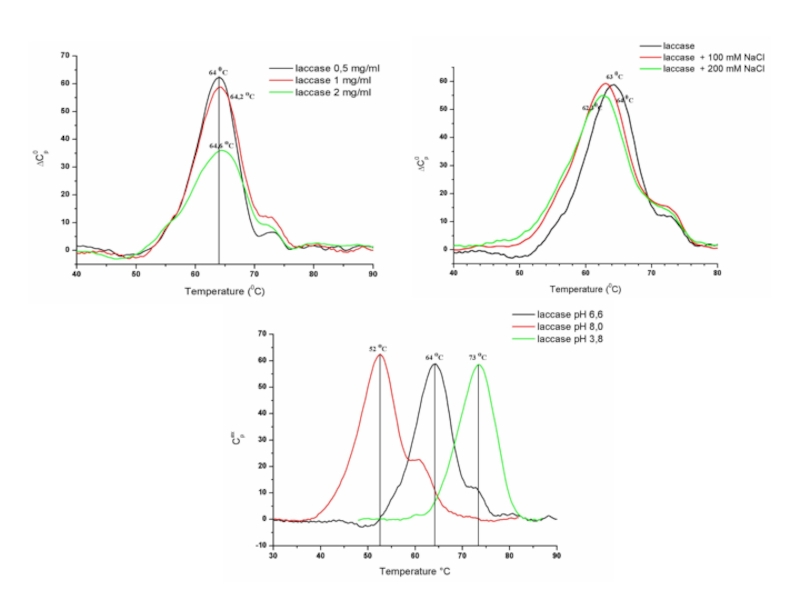
- 19. Кривые ДСК биомолекул зависят от: рН
- 21. Критерий Вант-Гоффа «Эффективная теплота" перехода, вычисляемая из
- 22. ΔHv-g= ΔHcal
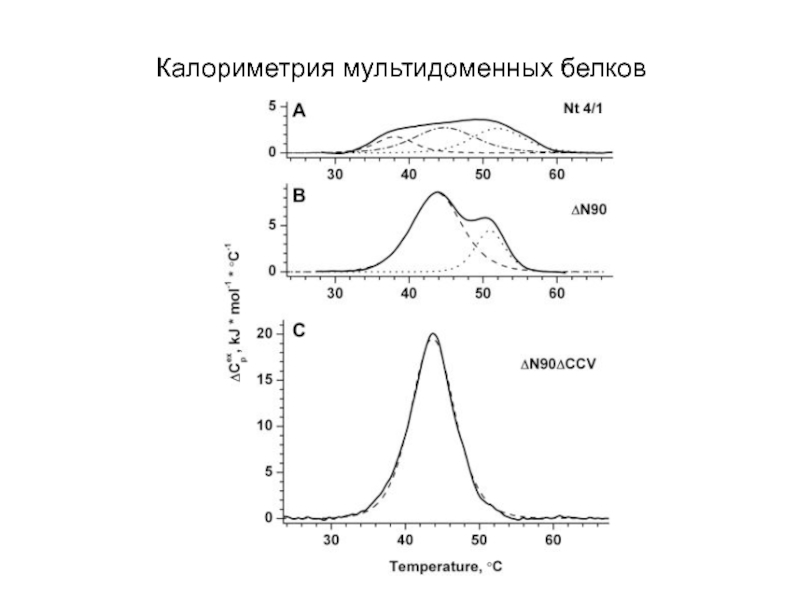
- 23. Калориметрия мультидоменных белков
- 24. Определение стабильности белков с помощью ДСК
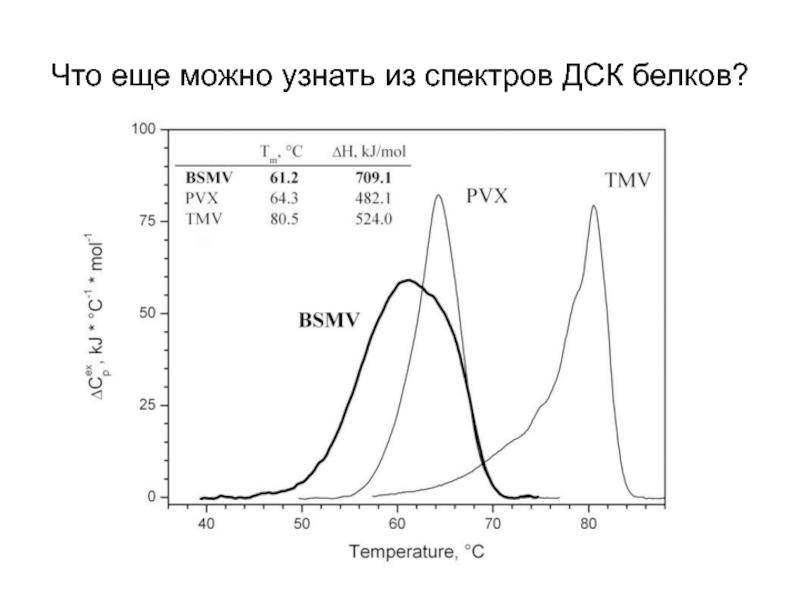
- 25. Что еще можно узнать из спектров ДСК белков?
- 26. Изотермическая калориметрия титрования (устройство прибора)
- 27. Изотермическая калориметрия титрования (принцип метода) ΔG = -RTlnKa = ΔH-TΔS
- 28. Изотермическая калориметрия титрования. Приложения метода Идентификация таргетного
- 29. Изотермическая калориметрия титрования. Приложения метода Идентификация таргетного белка из смеси биомолекул
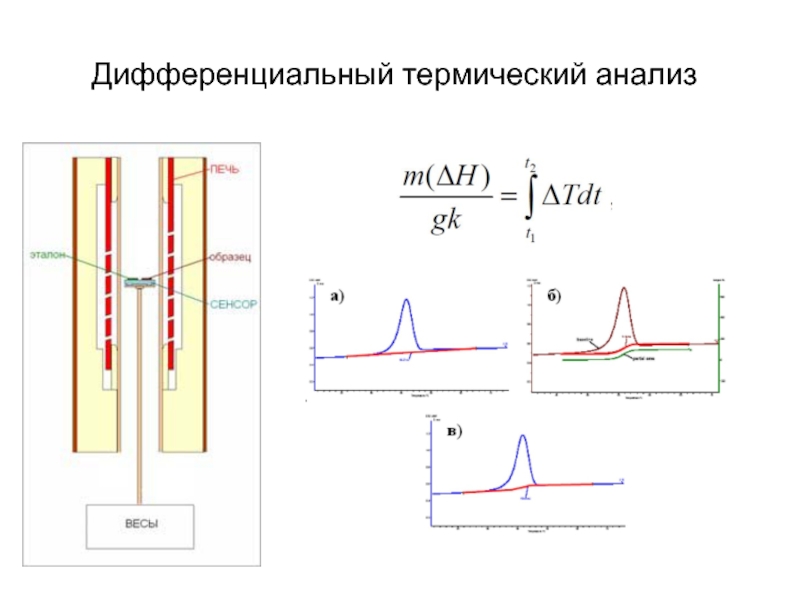
- 30. Дифференциальный термический анализ
- 31. Применение ДТА измерение теплоты химических и фазовых
Слайд 2
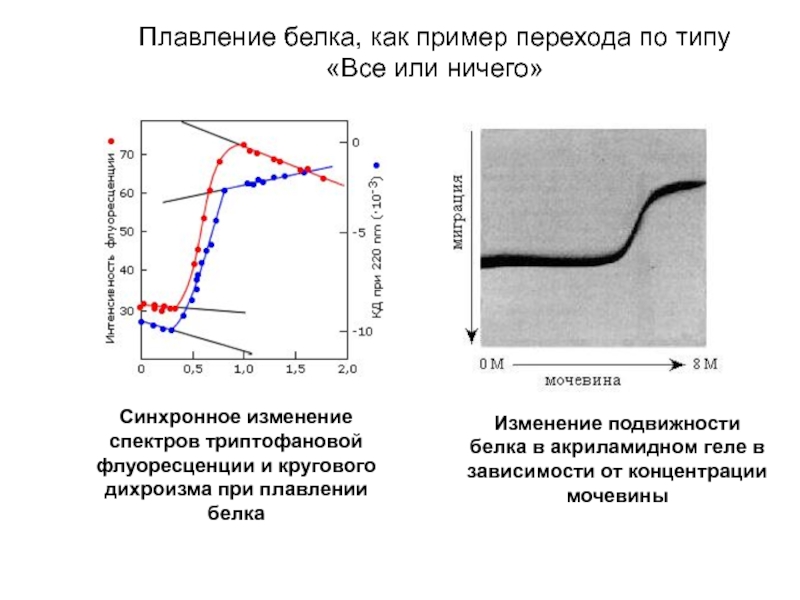
Синхронное изменение спектров триптофановой флуоресценции и кругового дихроизма при плавлении белка
Изменение
Плавление белка, как пример перехода по типу «Все или ничего»
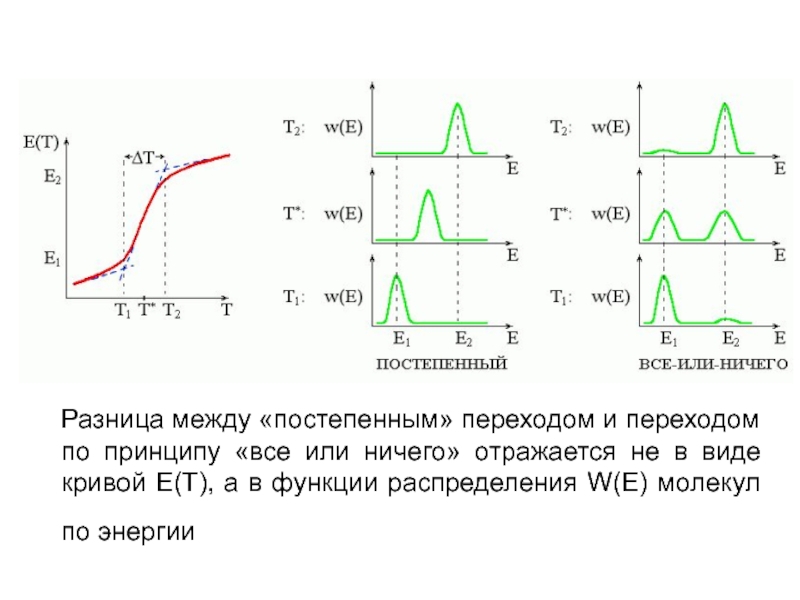
Слайд 3Разница между «постепенным» переходом и переходом по принципу «все или ничего»
Слайд 9Скорость сворачивания белка при его синтезе достаточно велика. Подобная самоорганизация белковых
Слайд 10Парадокс Левинталя
«С одной стороны, нативная пространственная структура по всем тестам ведет себя
Слайд 12Клеточная машинерия, способствующая правильному сворачиванию белка
Шапероны
Пролилизомераза
Дисульфидизомераза
Слайд 13Шапероны
Бывают двух типов:
Фолдазы (GroEL/GroES, DnaK/DnaG)
Холдазы (HsP 33)
Примеры эукариотических шаперонов:
GRP78/BiP, GRP94, GRP170,
Примеры прокариотических шаперонов:
Hsp60, Hsp70, Hsp90, Hsp100
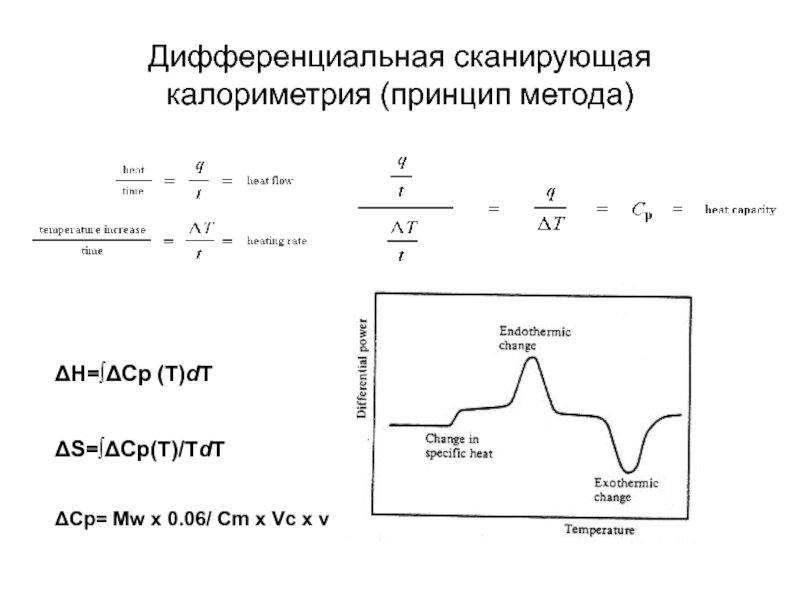
Слайд 18Дифференциальная сканирующая калориметрия (принцип метода)
ΔH=∫ΔCp (T)dT
ΔS=∫ΔCp(T)/TdT
ΔCp= Mw x 0.06/ Cm x
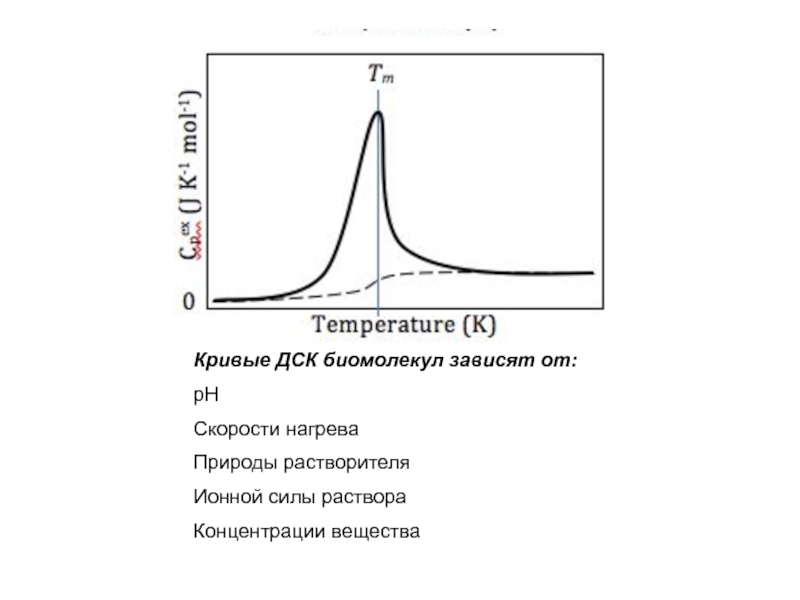
Слайд 19
Кривые ДСК биомолекул зависят от:
рН
Скорости нагрева
Природы растворителя
Ионной силы раствора
Концентрации вещества
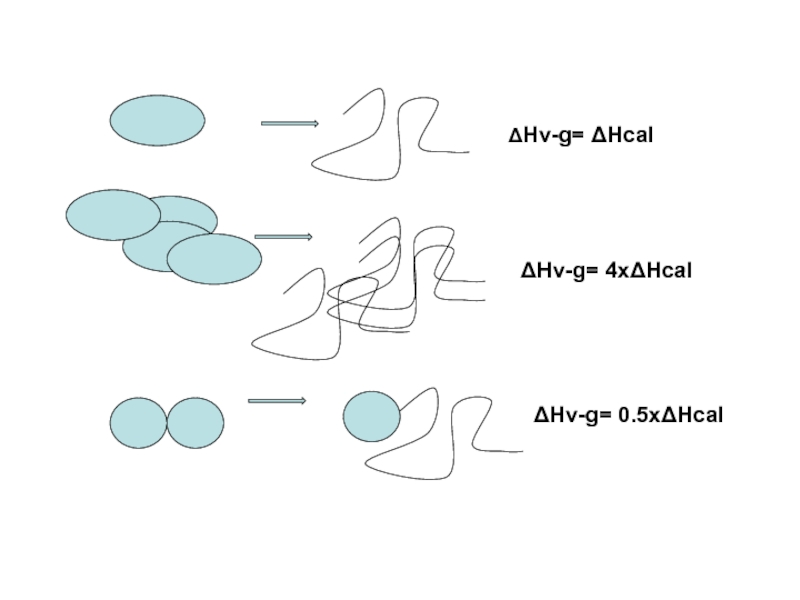
Слайд 21Критерий Вант-Гоффа
«Эффективная теплота" перехода, вычисляемая из его ширины совпадает с "калориметрической
Эффективная теплота перехода, следующая из его ширины, есть количество тепла, поглощенного одной независимой "единицей плавления". Если эффективная теплота перехода меньше калориметрической — "единица плавления" меньше, чем сама молекула, т.е. молекула плавится по частям. Если эффективная теплота перехода больше калориметрической — "единица плавления" больше молекулы, т.е. плавится не одна молекула белка, а какой-то их агрегат.
ΔE = 4κΤ02/ΔΤ.
Калориметрическая теплота плавления целого белка рассчитывается как ΔH/N, где ΔH количество тепла, поглощенного всеми имеющимися в калориметре N молекулами белка.
ΔE = ΔH/N
Слайд 28Изотермическая калориметрия титрования. Приложения метода
Идентификация таргетного белка из смеси биомолекул
Из кривой
-константу связывания
-энтальпию
-энтропию
-стихиометрию реакции
-другие термодинамические характериситки
Слайд 29Изотермическая калориметрия титрования. Приложения метода
Идентификация таргетного белка из смеси биомолекул
Слайд 31Применение ДТА
измерение теплоты химических и фазовых превращений, а также теплоемкости веществ
построение
определение содержания примесей в образце
ДТА активно применяют в археологии, криминалистике, пищевой индустрии, фармацевтике, геологии и экологии.