- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Использование ферментов в медицине. (Лекция 8) презентация
Содержание
- 1. Использование ферментов в медицине. (Лекция 8)
- 2. Иммуноферментные электроды К кислород-проницаемой тефлоновой пленке кислородного
- 3. В раствор, содержащий анализируемый антиген, добавляют определенное
- 4. Удаляют свободные антигены, путем промывки иммуноферментного электрода
- 5. Аналитические проточные реакторы с иммобилизованными ферментами Для
- 6. Ферментные микрокалориметрические датчики Две идентичные колонки ,заполненных
- 7. Основные направления использования ферментов в медицине: Энзимопатология 2) Энзимодиагностика 3) Энзимотерапия
- 8. Использование: 1. Заместительная терапия (ряда наследственных заболеваний
- 9. 6. В качестве локальных литических средств (для
- 10. Заместительная терапия При недостаточности поджелудочной железы применяют
- 11. 2. Тромболитическая терапия Стрептокиназа –активирует плазминогена (естественный
- 12. 2. Тромболитическая терапия Урокиназа - превращает
- 13. 3. Терапия воспалительных процессов В отличие
- 14. 4. Лечение онкологических заболеваний Аспарагиназа : L-аспарагин
- 15. 5. Терапия вирусных заболеваний Вирусные НК в
- 16. 6. В качестве локальных литических средств Протеолитические
- 17. 7. Для улучшения биодоступности лекарственных препаратов Гиалуронидаза
- 18. Недостатки применения ферментов: высокая иммуногенность
- 19. Недостатки можно устранить с помощью специфической модификации
- 20. Недостатки можно устранить с помощью специфической модификации
- 21. 8. Специфическая модуляция активности ферментов, детоксикация ксенобиотиков.
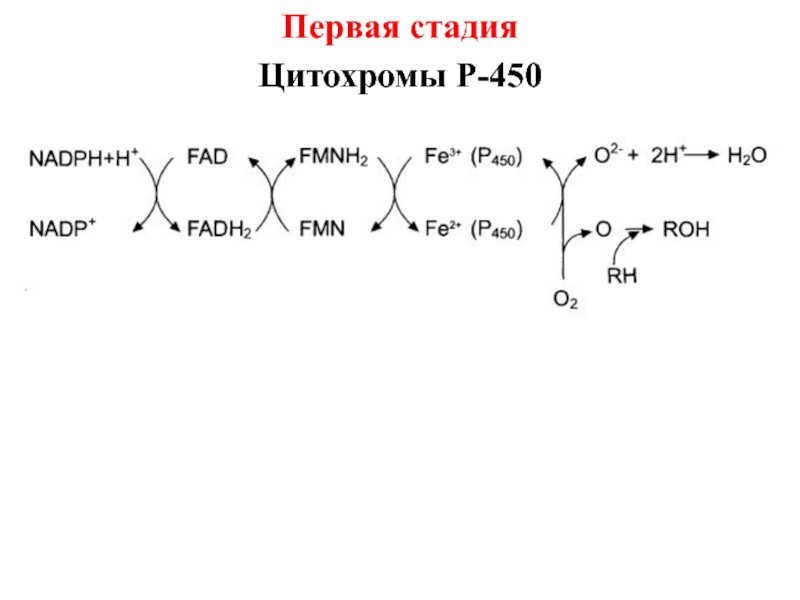
- 22. Первая стадия Цитохромы Р-450
- 23. Индукция цитохромов Р-450 флавоноидами Механизмы: прямая стимуляция
- 24. Индукция цитохромов Р-450 флавоноидами При низких концентрациях
- 25. Индукция цитохромов Р-450 флавоноидами Минусы: -Часто продукты
- 26. Ингибирование цитохромов Р-450 флавоноидами Ингибирование генной экспрессии
- 27. Эффекторное действие флавоноидов во многом определяется: особенностями
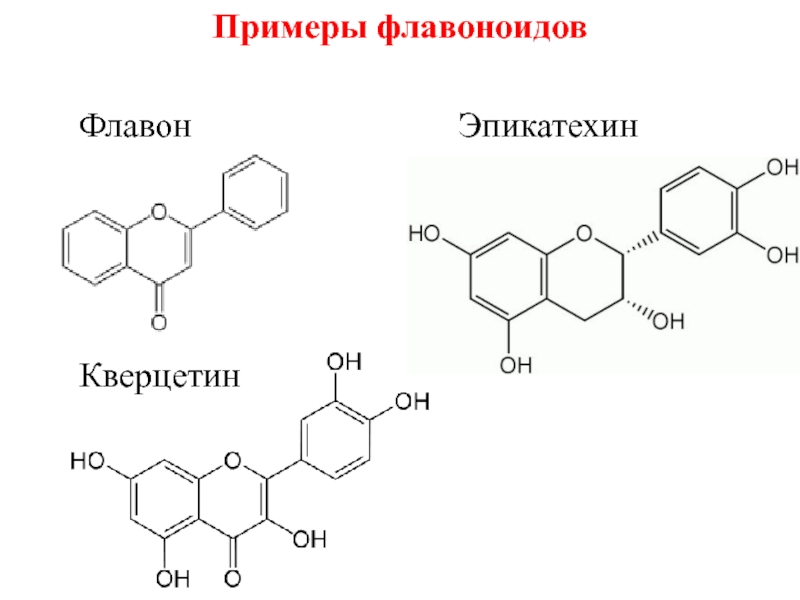
- 28. Примеры флавоноидов
- 29. Лучше действовать на вторую стадию биотрансформации ксенобиотиков.
- 31. Глутатион S-трансфераза 3 класса: альфа, мю и
- 32. В растительной пище много химических соединений, выступающих
- 33. Для профилактики цитотоксического действия ксенобиотиков при заболеваниях,
- 34. Глутатион S-трансферазы способны эффективно связывать билирубин и
Слайд 2Иммуноферментные электроды
К кислород-проницаемой тефлоновой пленке кислородного электрода Кларка плотно
прилегает мембрана не
с иммобилизованным ферментом, а с иммобилизованными антителами к анализируемому антигену.
Слайд 3В раствор, содержащий анализируемый антиген, добавляют определенное количество антигенов, предварительно меченных
каталазой.
↓
Иммуноферментный электрод погружают в исследуемый раствор и выдерживают при нужной температуре в течение необходимого времени.
↓
Меченые и немеченые антигены, конкурируя между собой, связываются с антителами на поверхности электрода.
↓
Иммуноферментный электрод погружают в исследуемый раствор и выдерживают при нужной температуре в течение необходимого времени.
↓
Меченые и немеченые антигены, конкурируя между собой, связываются с антителами на поверхности электрода.
Слайд 4Удаляют свободные антигены, путем промывки иммуноферментного электрода
↓
Добавляют в исследуемый раствор пероксид
водорода
↓
По сигналу электрода определяют скорость образования кислорода в результате катализируемой каталазой реакции :
H2O2 → H2O + 1/2O2
↓
Строят кривую зависимости сигнала от числа немеченых антигенов.
↓
По сигналу электрода определяют скорость образования кислорода в результате катализируемой каталазой реакции :
H2O2 → H2O + 1/2O2
↓
Строят кривую зависимости сигнала от числа немеченых антигенов.
Слайд 5Аналитические проточные реакторы
с иммобилизованными ферментами
Для анализа метаболитов и ферментов в клинической
и лабораторной практике достаточно широко используются аналитические проточные реакторы с иммобилизованными ферментами.
Пример: определение триптофана
В колонке иммобилизованы E: триптофаназа и лактатдегидрогеназа
триптофан + пиридоксальфосфат →
индол + NH3 +ПВК;
ПВК+ НАДН2 → молочная кислота + НАД.
Детекция убыли НАДН на 360 нм
Пример: определение триптофана
В колонке иммобилизованы E: триптофаназа и лактатдегидрогеназа
триптофан + пиридоксальфосфат →
индол + NH3 +ПВК;
ПВК+ НАДН2 → молочная кислота + НАД.
Детекция убыли НАДН на 360 нм
Слайд 6Ферментные микрокалориметрические датчики
Две идентичные колонки ,заполненных носителем с иммобилизованным на нем
E.
В нижней части каждой из колонок имеется термистор.
При пропускании через колонки простого буфера разность t◦ между термисторами будет равна нулю.
При введении в одну из колонок S в результате ферментативной реакции произойдет тепловыделение.
Разность t◦ между измерительной колонкой и колонкой сравнения будет пропорциональна количеству превращенного S.
В нижней части каждой из колонок имеется термистор.
При пропускании через колонки простого буфера разность t◦ между термисторами будет равна нулю.
При введении в одну из колонок S в результате ферментативной реакции произойдет тепловыделение.
Разность t◦ между измерительной колонкой и колонкой сравнения будет пропорциональна количеству превращенного S.
Слайд 7Основные направления использования ферментов в медицине:
Энзимопатология
2) Энзимодиагностика
3) Энзимотерапия
Слайд 8Использование:
1. Заместительная терапия (ряда наследственных заболеваний и функциональной недостаточности пищеварительных желез).
2.
Тромболитическая терапия (парентеральное применение свободных и связанных форм ферментов для лизиса тромбов в кровеносных со-
судах).
3. Терапия воспалительных процессов.
4. Лечение онкологических заболеваний.
5. Терапия вирусных заболеваний.
судах).
3. Терапия воспалительных процессов.
4. Лечение онкологических заболеваний.
5. Терапия вирусных заболеваний.
Слайд 96. В качестве локальных литических средств (для расщепления и удаления из
организма некротических масс и экссудатов).
7. Для улучшения биодоступности лекарственных препаратов (ускорения процессов их проникновения).
8. Специфическая модуляция активности ферментов, участвующих в патогенезе заболеваний, а также обеспечивающих детоксикацию ксенобиотиков.
7. Для улучшения биодоступности лекарственных препаратов (ускорения процессов их проникновения).
8. Специфическая модуляция активности ферментов, участвующих в патогенезе заболеваний, а также обеспечивающих детоксикацию ксенобиотиков.
Слайд 10Заместительная терапия
При недостаточности поджелудочной железы применяют смесь различных ферментов –
пепсина,
трипсина, химотрипсина, липазы и α-амилазы.
(надо кратко знать, как они действуют=)
(надо кратко знать, как они действуют=)
Слайд 112. Тромболитическая терапия
Стрептокиназа –активирует плазминогена (естественный предшественник протеиназы плазмина, предотвращающей образование
тромба в кровеносной системе).
Многие осложнения, связанные с применением стрептокиназы, были сняты благодаря внедрению иммобилизованной стрептокиназы,т.к. она:
1)Более стабильна
2)Не искажает общую формулу крови,
3) Нетоксична
4) Более безопасная с точки зрения иммуногенности.
Многие осложнения, связанные с применением стрептокиназы, были сняты благодаря внедрению иммобилизованной стрептокиназы,т.к. она:
1)Более стабильна
2)Не искажает общую формулу крови,
3) Нетоксична
4) Более безопасная с точки зрения иммуногенности.
Слайд 122. Тромболитическая терапия
Урокиназа - превращает плазминоген в плазмин.
Фибринолизин- гидролизует фибрин (основной
белка, образующегося при свертывании крови).
Слайд 133. Терапия воспалительных процессов
В отличие от живых клеток, мертвые клетки
обычно
не способны защищать себя от привнесенных извне протеаз.
Протеазы гидролизуют денатурированные белки в омертвевших тканях и не затрагивают нативные внутриклеточные белки из-за компактной третичной структуры.
При внутримышечном введении протеолитические ферменты оказывают противовоспалительное действие.
Протеазы гидролизуют денатурированные белки в омертвевших тканях и не затрагивают нативные внутриклеточные белки из-за компактной третичной структуры.
При внутримышечном введении протеолитические ферменты оказывают противовоспалительное действие.
Слайд 144. Лечение онкологических заболеваний
Аспарагиназа :
L-аспарагин + Н2О → L-аспартат + NH3
Для
некоторых опухолей и лейкемических клеток аспарагин -незаменимая аминокислота.
Аспарагиназа, введенная в область опухолевых клеток, разрушает аспарагин и вызывает этим торможение их роста и последующую гибель.
На нормальные клетки аспарагиназа существенного влияния не оказывает, так как они способны синтезировать аспарагин.
Аспарагиназа, введенная в область опухолевых клеток, разрушает аспарагин и вызывает этим торможение их роста и последующую гибель.
На нормальные клетки аспарагиназа существенного влияния не оказывает, так как они способны синтезировать аспарагин.
Слайд 155. Терапия вирусных заболеваний
Вирусные НК в период интенсивной репликации, транскрипции и
трансляции по сравнению с нуклеопротеидными комплексами инфицированной клетки в меньшей степени защищены от действия нуклеаз.
Нуклеазы из поджелудочной железы крупного рогатого скота используют для лечения вирусных заболеваний.
Пример: Для лечения клещевого энцефалита применяют панкреатическую РНКазу. Панкреатическая ДНКаза - при герпесных и аденовирусных инфекциях.
Нуклеазы из поджелудочной железы крупного рогатого скота используют для лечения вирусных заболеваний.
Пример: Для лечения клещевого энцефалита применяют панкреатическую РНКазу. Панкреатическая ДНКаза - при герпесных и аденовирусных инфекциях.
Слайд 166. В качестве локальных литических средств
Протеолитические Е расщепляют некротизированную ткань и
фибринозные образования, разжижают вязкие секреты, экссудаты (жидкость, накапливающаяся при воспалениях в тканях и полостях тела).
Трипсин (из поджелудочной железы крупного рогатого скота) облегчает удаление вязких секретов и экссудатов при воспалительных заболеваниях дыхательных путей (трахеитах, бронхитах, пневмонии и т. д.
Применяется в виде аэрозоля для ингаляции или в иммобилизованном виде. Носители (волокнистые материалы на основе целлюлозы, поливинилового спирта, солей альгиновой кислоты).
Трипсин (из поджелудочной железы крупного рогатого скота) облегчает удаление вязких секретов и экссудатов при воспалительных заболеваниях дыхательных путей (трахеитах, бронхитах, пневмонии и т. д.
Применяется в виде аэрозоля для ингаляции или в иммобилизованном виде. Носители (волокнистые материалы на основе целлюлозы, поливинилового спирта, солей альгиновой кислоты).
Слайд 177. Для улучшения биодоступности лекарственных препаратов
Гиалуронидаза (получают из семенников крупного рогатого
скота):
гиалуроновая кислота →глюкозамин + глюкуроновая кислота
Увеличивается проницаемость тканей, т.к. гиалуроновая кислота является своеобразным цементирующим веществом соединительной ткани
Применяют для ускорения всасывания различных лекарственных веществ, вводимых под
кожу и внутримышечно.
гиалуроновая кислота →глюкозамин + глюкуроновая кислота
Увеличивается проницаемость тканей, т.к. гиалуроновая кислота является своеобразным цементирующим веществом соединительной ткани
Применяют для ускорения всасывания различных лекарственных веществ, вводимых под
кожу и внутримышечно.
Слайд 18Недостатки применения ферментов:
высокая иммуногенность
2) невысокая стабильность
3) низкий терапевтический индекс
4)
кратковременность действия
Слайд 19Недостатки можно устранить с помощью специфической модификации ферментов:
нековалентная модификация
низкомолекулярные соли,
ионы которых влияют на растворимость, стабильность и специфическую активность E. Са2+стабилизируют и активируют α-амилазу.
Полиэлектролиты. Активность панкреатической РНКазы по отношению к вирусу стоматита в комплексе с сульфированными декстранами возрастала на несколько порядков.
Полиэлектролиты. Активность панкреатической РНКазы по отношению к вирусу стоматита в комплексе с сульфированными декстранами возрастала на несколько порядков.
Слайд 20Недостатки можно устранить с помощью специфической модификации ферментов:
2. Ковалентная модификация с
полисахаридами или полиэтиленгликолем часто приводит к снижению иммуногенности препарата, из-за снижения количества антигенных детерминант модифицированного белка.
3. Вторичная модификация
Террилитин (протеолитический фермент), связанный через полимерную цепочку с антителами к фибрину, более специфичен при лизисе тромбов.
3. Вторичная модификация
Террилитин (протеолитический фермент), связанный через полимерную цепочку с антителами к фибрину, более специфичен при лизисе тромбов.
Слайд 218. Специфическая модуляция активности ферментов, детоксикация ксенобиотиков.
Первая стадия биотрансформации ксенобиотиков микросомальная
монооксигеназная система (может приводить к образованию как более, так и
менее токсичных по сравнению с исходным соединением метаболитов).
Вторая стадия обеспечивается ферментативными системами, ведущими
различного рода реакции конъюгации и в большинстве случаев заканчивается полным обезвреживанием ксенобиотика и его реакционноспособных метаболитов.
менее токсичных по сравнению с исходным соединением метаболитов).
Вторая стадия обеспечивается ферментативными системами, ведущими
различного рода реакции конъюгации и в большинстве случаев заканчивается полным обезвреживанием ксенобиотика и его реакционноспособных метаболитов.
Слайд 23Индукция цитохромов Р-450 флавоноидами
Механизмы:
прямая стимуляция генной экспрессии через специфический рецептор (в
результате связывания с лиганд активируемым транскрипционным фактором – рецептором арилзамещенных углеводородов (AhR – aryl hydrocarbon receptor).
стабилизация мРНК
стабилизация мРНК
Слайд 24Индукция цитохромов Р-450 флавоноидами
При низких концентрациях флавоноиды выступают как AhR антагонисты,
связывающиеся с рецептором без активации транскрипционного фактора.
При высоких концентрациях те же самые флавоноиды функционируют как AhR агонисты
При высоких концентрациях те же самые флавоноиды функционируют как AhR агонисты
Слайд 25Индукция цитохромов Р-450 флавоноидами
Минусы:
-Часто продукты микросомального окисления ксенобиотика представляют большую опасность
для клетки по сравнению с исходным соединением.
-ускорение процессов микросомального окисления ксенобиотика сопровождается усилением генерации АФК (активных форм кислорода) и последующей инициацией процессов ПОЛ.
Часто используют соединения подавляющие активность микросомальных монооксигеназ.
-ускорение процессов микросомального окисления ксенобиотика сопровождается усилением генерации АФК (активных форм кислорода) и последующей инициацией процессов ПОЛ.
Часто используют соединения подавляющие активность микросомальных монооксигеназ.
Слайд 26Ингибирование цитохромов Р-450 флавоноидами
Ингибирование генной экспрессии семейства CYP1 посредством блокирования AhR
рецептора в ряде случаев определяет антиканцерогенную активность отдельных флавоноидов (пр. кверцетин).
Связывания флавоноида с NADPH – цитохром Р-450 редуктазой или с цитохромом Р-450;
Конкуренции с другими субстратами
Модификации мест их связывания
Изменение липидного микроокружени, вследствие чего затрудняется перенос электронов к цитохрому.
Связывания флавоноида с NADPH – цитохром Р-450 редуктазой или с цитохромом Р-450;
Конкуренции с другими субстратами
Модификации мест их связывания
Изменение липидного микроокружени, вследствие чего затрудняется перенос электронов к цитохрому.
Слайд 27Эффекторное действие флавоноидов во многом определяется:
особенностями структуры их пропанового фрагмента,
наличием различных
радикалов в ароматической части молекулы,
степенью гликозилирования,
местом присоединения углеводных остатков и их природой,
конфигурацией гликозидных связей
характером сочленения гликозидной части с агликоном (О-гликозиды, С-гликозиды).
степенью гликозилирования,
местом присоединения углеводных остатков и их природой,
конфигурацией гликозидных связей
характером сочленения гликозидной части с агликоном (О-гликозиды, С-гликозиды).
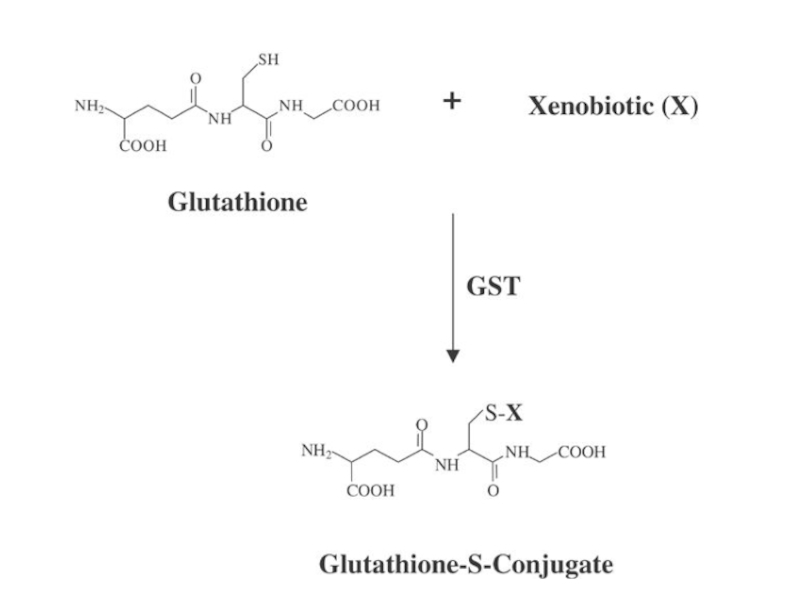
Слайд 29Лучше действовать на вторую стадию биотрансформации ксенобиотиков.
Действие на глутатион S-трансферазы(ГТ),которые
конъюгируют ксенобиотики
и их реакционноспособные метаболиты с глутатионом,
восстанавливают органические гидропероксиды,
участвуют в метаболизме конечных цитотоксичных продуктов ПОЛ
обеспечивают связывание и внутриклеточный транспорт ряда эндогенных лигандов (билирубина, желчных кислот, жирных кислот, производных гема, нейромедиаторов и стероидных гормонов).
восстанавливают органические гидропероксиды,
участвуют в метаболизме конечных цитотоксичных продуктов ПОЛ
обеспечивают связывание и внутриклеточный транспорт ряда эндогенных лигандов (билирубина, желчных кислот, жирных кислот, производных гема, нейромедиаторов и стероидных гормонов).
Слайд 31Глутатион S-трансфераза
3 класса: альфа, мю и пи.
У млекопитающих ГТ присутствуют
практически во всех типах клеток.
Изоферментный состав ГТ варьирует в зависимости от их локализации, что определяет разную устойчивость органов и тканей к окислительному стрессу,к действию ксенобиотиков и эндотоксинов.
Изоферментный состав ГТ варьирует в зависимости от их локализации, что определяет разную устойчивость органов и тканей к окислительному стрессу,к действию ксенобиотиков и эндотоксинов.
Слайд 32В растительной пище много химических соединений, выступающих в качестве индукторов ГТ,
что приводит к снижению частоты раковых заболеваний.
Флаваноны и флавоны увеличивают не только
активность ГТ, но и активность других ферментов второй стадии биотрансформации ксенобиотиков (УДФ-глюкуронозилтрансфераз).
При различных хронических и острых заболеваниях печени, сопровождающихся эндогенной интоксикацией организма, нормальное функционирование ГТ может нарушаться.
Флаваноны и флавоны увеличивают не только
активность ГТ, но и активность других ферментов второй стадии биотрансформации ксенобиотиков (УДФ-глюкуронозилтрансфераз).
При различных хронических и острых заболеваниях печени, сопровождающихся эндогенной интоксикацией организма, нормальное функционирование ГТ может нарушаться.
Слайд 33Для профилактики цитотоксического действия ксенобиотиков при заболеваниях, сопровождающихся эндогенной интоксикацией организма
используют эффекторные свойства флавоноидов.
Введение экспериментальным животным растительных экстрактов из семян расторопши, лофанта, душицы и горца с повышенным содержанием флавоноидов
↓
снижает тяжесть патобиохимических проявлений холестаза, благодаря способности флавоноидов индуцировать ГТ печени.
Введение экспериментальным животным растительных экстрактов из семян расторопши, лофанта, душицы и горца с повышенным содержанием флавоноидов
↓
снижает тяжесть патобиохимических проявлений холестаза, благодаря способности флавоноидов индуцировать ГТ печени.
Слайд 34Глутатион S-трансферазы способны эффективно связывать билирубин и желчные кислоты, которые в
избыточных количествах накапливаются в печени при холестазе.
Билирубин и желчные кислоты благодаря
своей гидрофобной природе активно взаимодействуют с мембранами и белками, вызывая различного рода повреждения.
Билирубин и желчные кислоты благодаря
своей гидрофобной природе активно взаимодействуют с мембранами и белками, вызывая различного рода повреждения.