- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Информационные макромолекулы презентация
Содержание
- 1. Информационные макромолекулы
- 2. Молекуля́рная биоло́гия — комплекс биологических наук, изучающих механизмы
- 3. Геномика
- 4. Протеомика — наука, основным предметом изучения которой являются белки, их
- 5. Информационные макромолекулы Живые организмы
- 6. Белки и нуклеиновые
- 8. Мономер белка Мономер нуклеиновых
- 9. Белки называют
- 10. Аминокислоты – это соединения, которые содержат
- 11. Аминокислоты Общее
- 12. Образование пептидной связи Пептидная связь —
- 14. Пептидная связь характеризуется следующими свойствами:
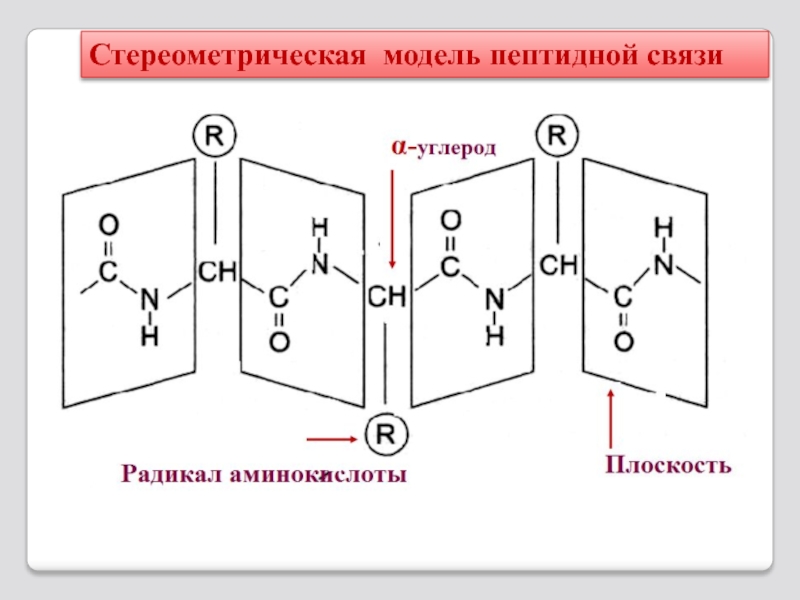
- 15. Стереометрическая модель пептидной связи
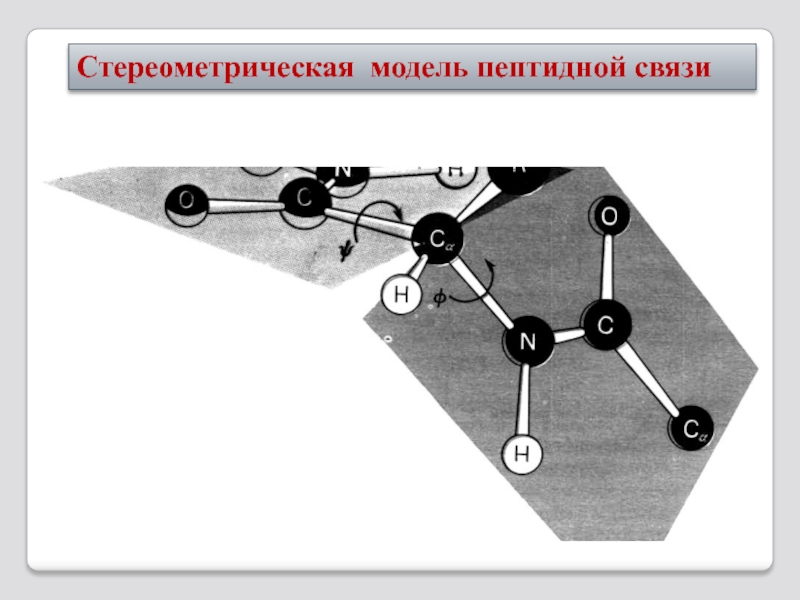
- 16. Стереометрическая модель пептидной связи
- 17. Соединения, в которых аминокислоты
- 18. В
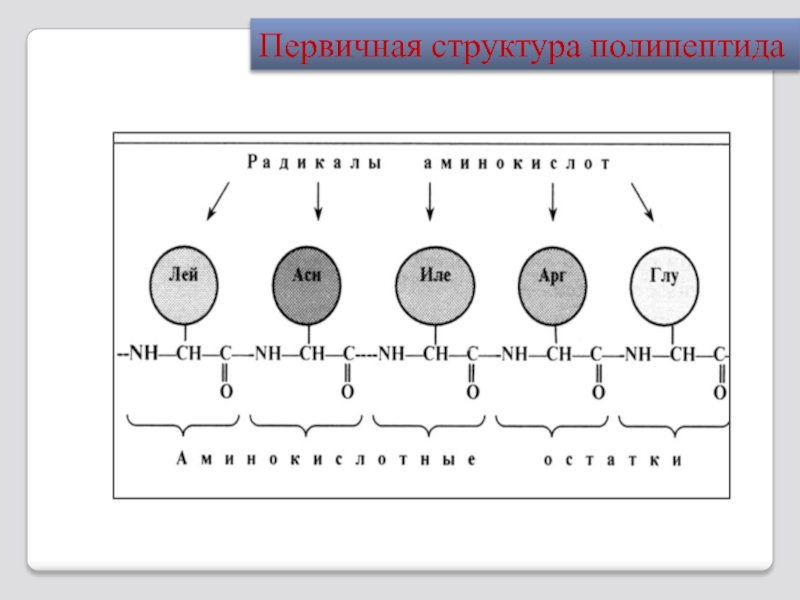
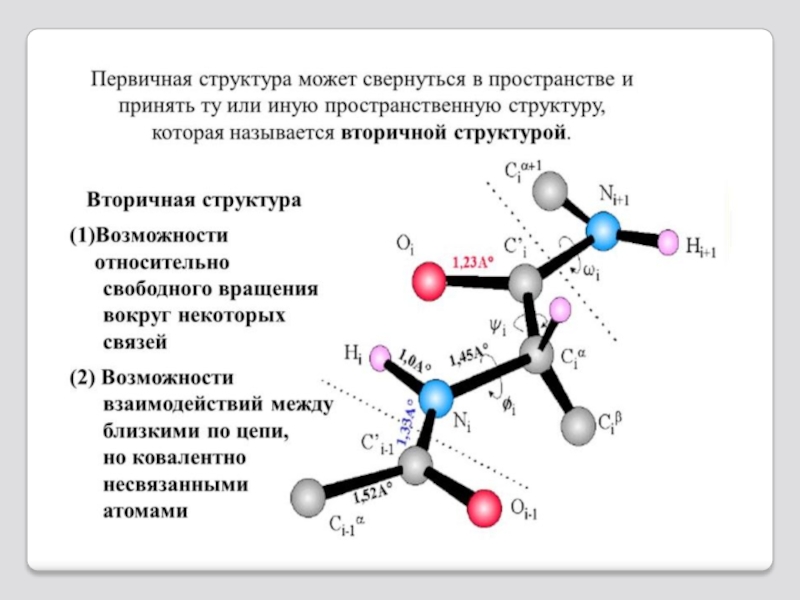
- 20. Первичная структура полипептида
- 24. Α-спираль вторичной структуры полипептида В
- 25. β-складчатый слой вторичной структуры полипептида
- 28. Пространственная структура каждого белка индивидуальна
- 29. Супервторичная структура белка Белок с мотивом «спираль-виток-спираль»:
- 30. А – мотив суперструктуры белка «лейциновая застежка-молния»
- 31. Третичная структура белка –
- 32. Типы связей, возникающих между радикалами аминокислот при
- 35. Доме́н белка́ — элемент третичной
- 36. Для выполнения белком его специфических функций
- 37. Активный центр – это
- 38. Связывание белка
- 39. Многие белки построены из
- 40. Расположение групп, образующих связи на
- 41. Белок в четвертичной структуре явля-ется
- 45. 1. Случайный белок – пептидная цепь в
- 46. Крупные молекулы белков с большим молекулярным весом
- 47. Фолдазы или ферменты фолдинга
- 49. Шапероны (от
- 50. Индуцибельные - их синтез в обычных условиях
- 53. І. Контроль за обеспечением «правильного» фолдинга новообразованных
- 59. Некоторые сложные белки
- 62. Глобулярные белки — белки, в молекулах которых полипептидные цепи
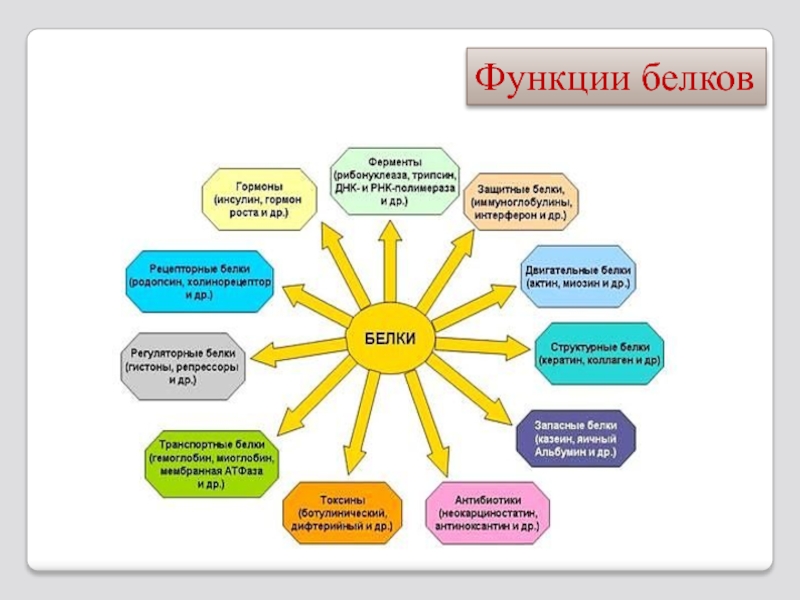
- 63. Функции белков
- 64. Денатурация белков (лат. denaturatus — лишённый природных свойств;
- 65. Информационные макромолекулы Нуклеиновые кислоты
- 66. Нуклеиновые кислоты – это высокомолекулярные биополимеры ,
- 67. Нуклеиновые кислоты были открыты в 1868
- 68. 1953 Открыта структура ДНК Дата рождения молекулярной биологии
- 69. Нобелевская премия 1962
- 70. ДНК – самая большая молекула в клетке.
- 71. В каждом живом организме присутствуют 2 типа
- 72. 2. фосфат 3. азотистое основание 1.
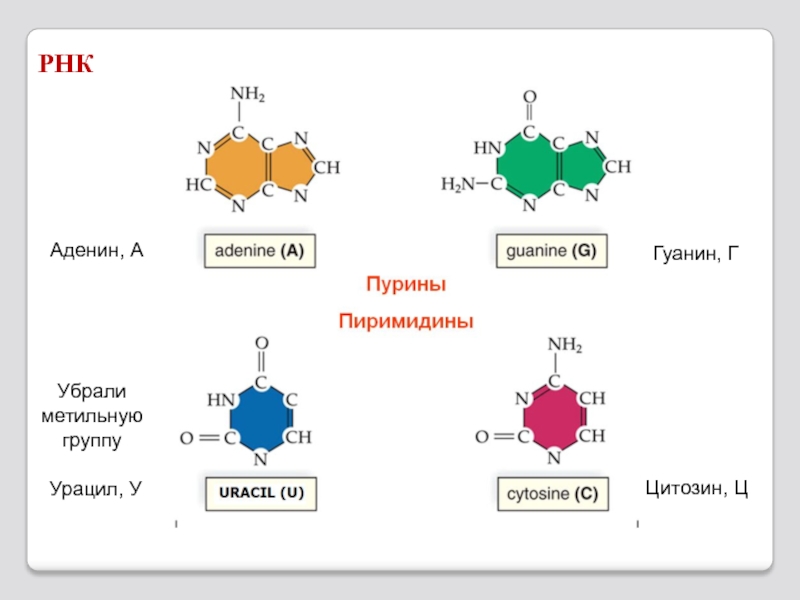
- 73. РНК Аденин, А Гуанин, Г Урацил, У Цитозин, Ц Убрали метильную группу
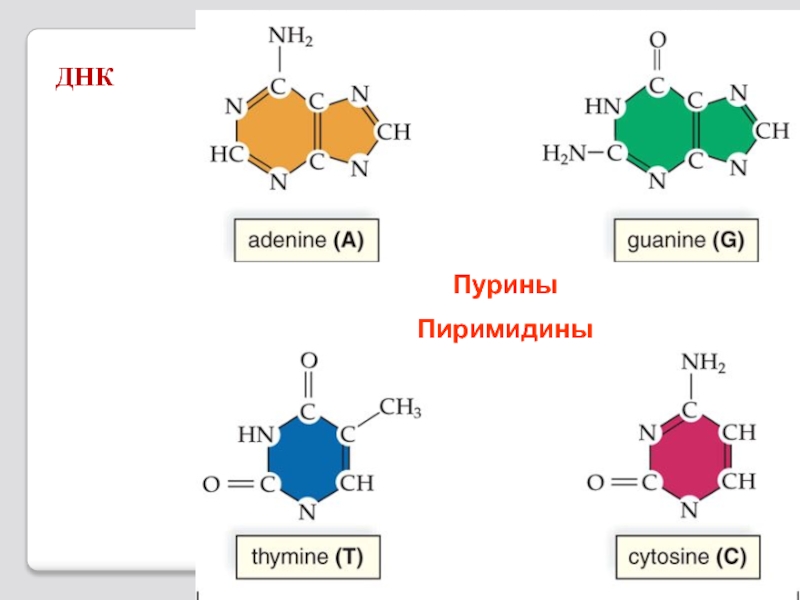
- 74. ДНК
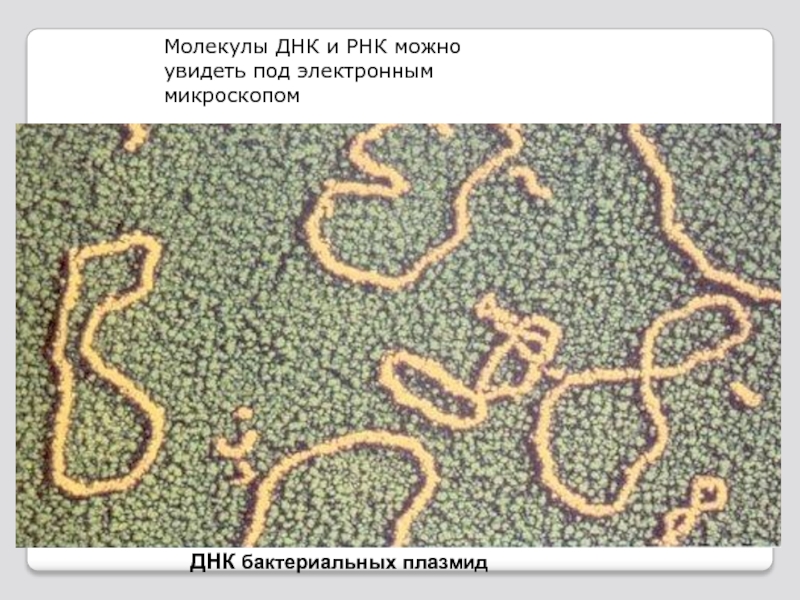
- 75. Молекулы ДНК и РНК можно увидеть под электронным микроскопом ДНК бактериальных плазмид
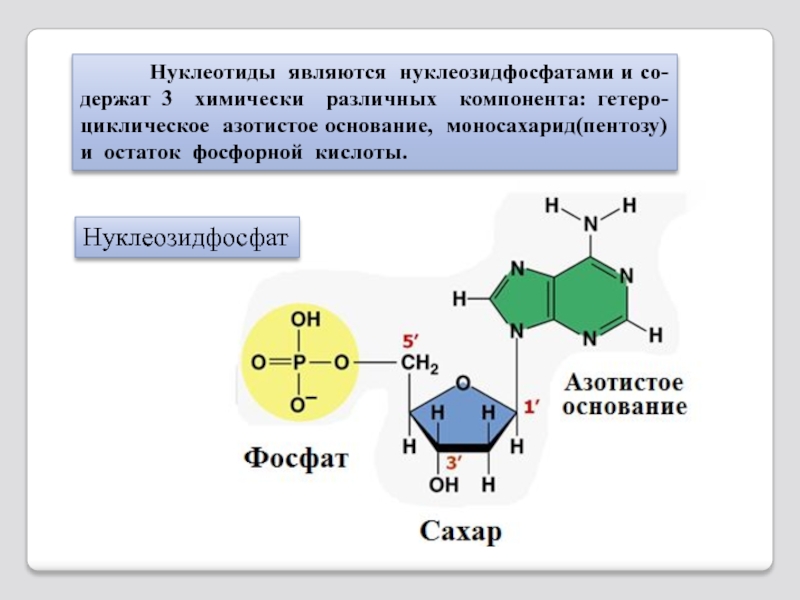
- 76. Нуклеотиды
- 77. В зависимости от характера пентозы (рибоза или
- 78. АТФ – аденозин трифосфат
- 79. Схема образования 3,5-фосфодиэфирной связи
- 80. Растущий конец – всегда
- 82. ДНК –
- 83. Принцип комплементар-ности: А
- 84. 1950 Правила Чаргаффа Эрвин Чаргафф
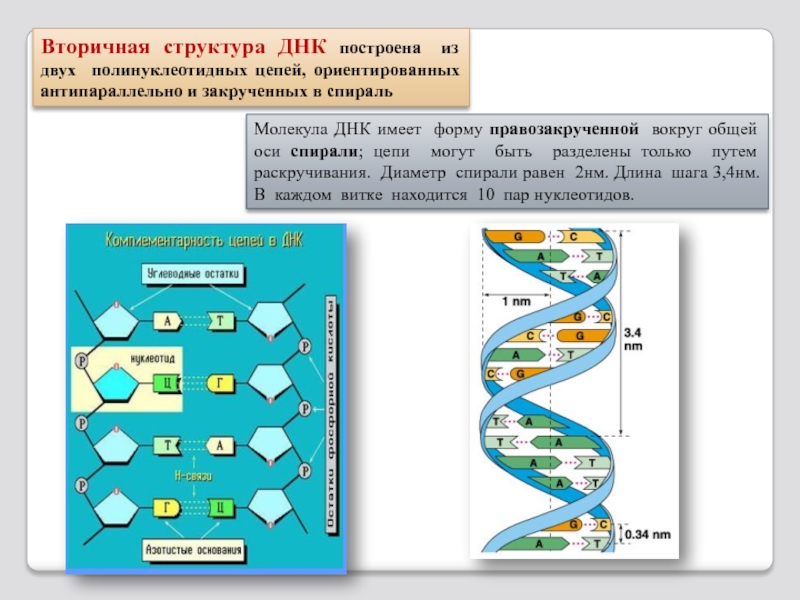
- 85. 1 виток – 10 н.п. На одну н.п. приходится 0.34 нм
- 87. Принципы строения ДНК А Г Г Т
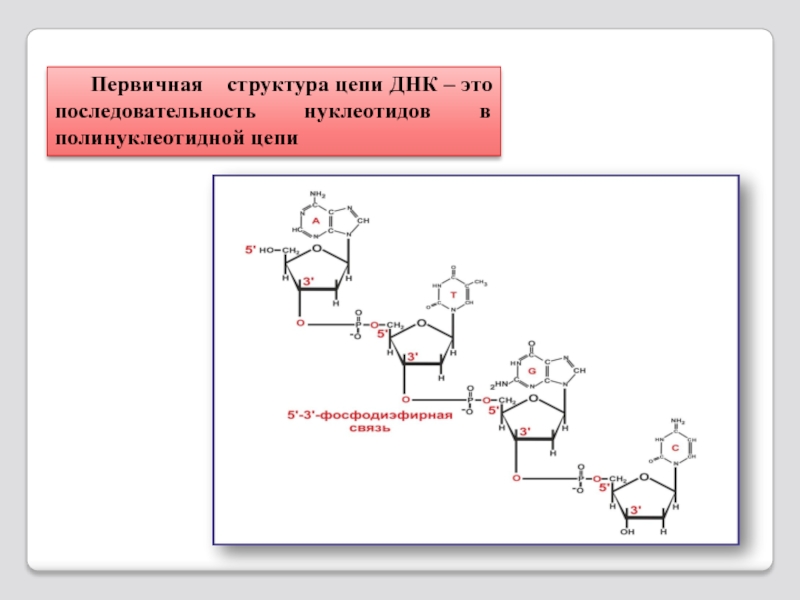
- 88. Первичная структура цепи ДНК – это последовательность нуклеотидов в полинуклеотидной цепи
- 89. ,
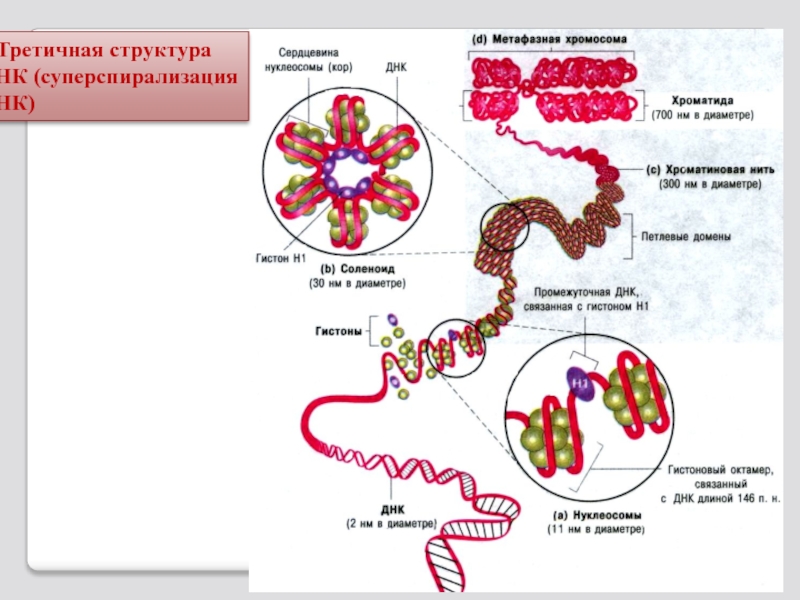
- 90. Третичная структура ДНК (суперспирализация ДНК)
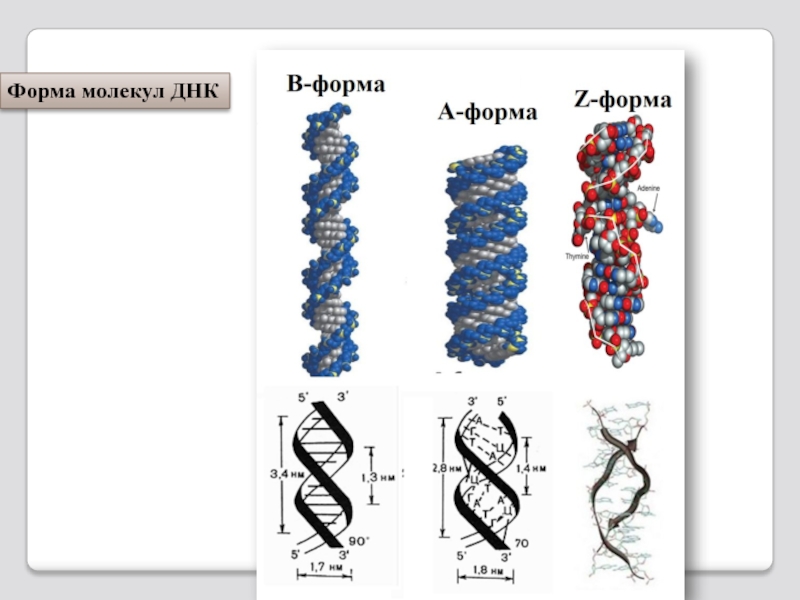
- 91. Форма молекул ДНК
- 92. A-ДНК —представляет собой право-закрученную
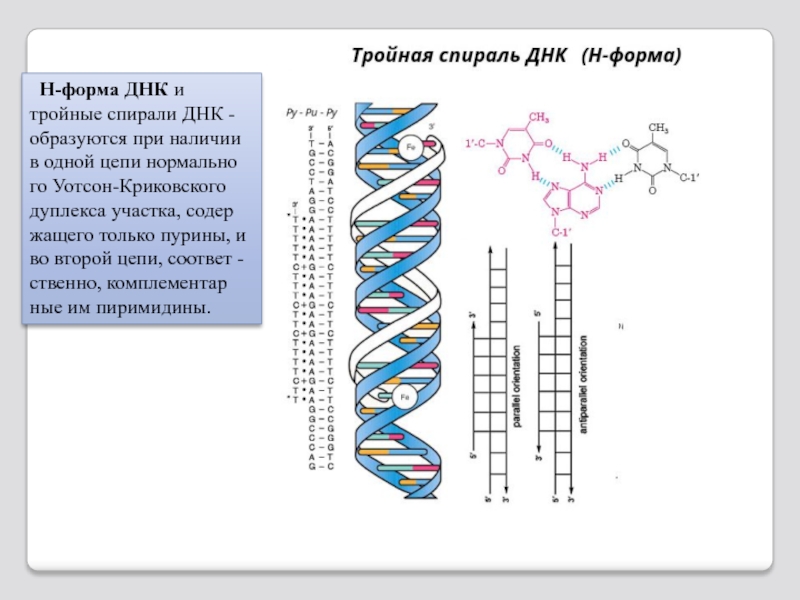
- 93. H-форма ДНК и тройные спирали ДНК
- 95. Строение РНК
- 96. Отличия от ДНК а) РНК – одноцепочный
- 97. Отличия РНК от ДНК Одноцепочечные молекулы Сахар
- 99. транспортная РНК (тРНК) Рибосомальная РНК (рРНК)
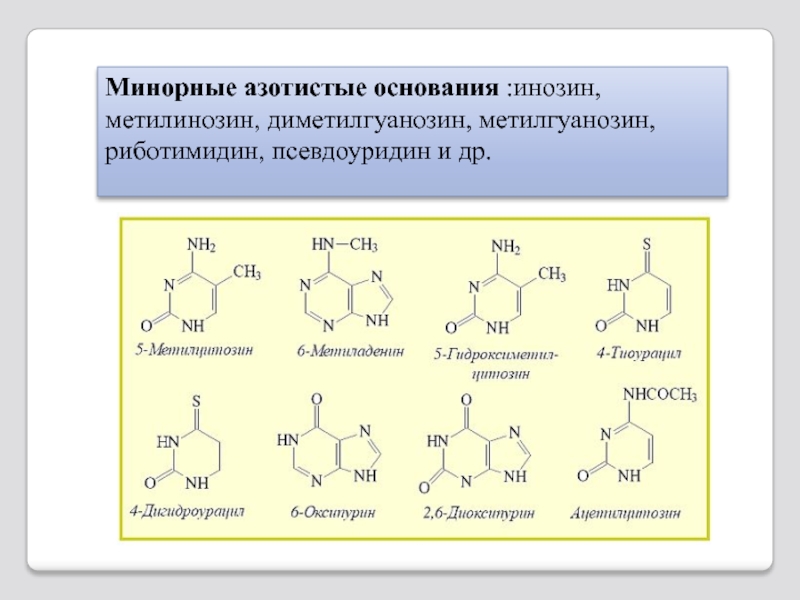
- 100. Минорные азотистые основания :инозин, метилинозин, диметилгуанозин, метилгуанозин, риботимидин, псевдоуридин и др.
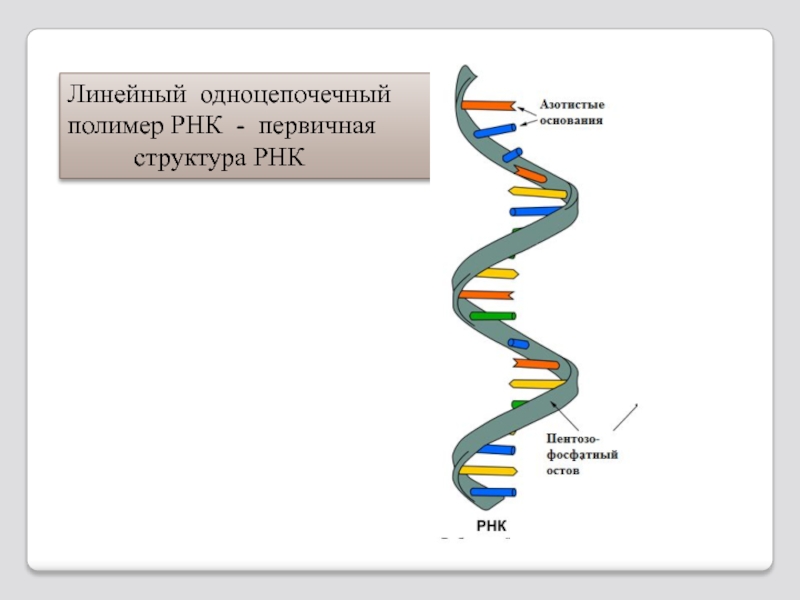
- 101. Линейный одноцепочечный полимер РНК - первичная структура РНК
- 102. Упаковка линейной молекулы РНК в спирали представляет
- 103. Элементы вторичной структуры
- 104. РНК укладывается в трехмерную структуру
- 105. мРНК–матричная РНК составляет 3% от всей
- 106. I. Колпачок (кэп) - участок из 1-4
- 107. Вторичная структура мРНК
- 108. Третичная структура РНК формируется при определенных значениях
- 109. тРНК (транспортные РНК) –
- 110. Вторичная структура тРНК Петля Д обеспечивает
- 111. Третичная структура тРНК формируется при
- 112. Функции тРНК. Для синтеза белка они выполняют
- 113. рРНК - рибосомальная РНК
- 115. Рибосомальная РНК 16 S р-РНК Самая большая
- 116. Вторичная структура рРНК представлена структурой
- 117. Молекулы рРНК в третичной структуре являются
- 118. 1 -
Слайд 2 Молекуля́рная биоло́гия — комплекс биологических наук, изучающих механизмы хранения, передачи и реализации генетичес-
кой
меров (белков и нуклеиновых кислот).
Слайд 3 Геномика — это раздел м.б.
Основу геномики составляет расшифровка генома человека, что является большим достижением биологии.
Геномика заложила основы клинической генетики на многие годы; она дала теоретическое обоснование и конкретные методические приемы, в том числе и автоматизированные, для поиска мутаций в отдельных генах (моногенная патология), которые являются этиологическими факторами врожденных нарушений метаболизма, формирующих фено-типические проявления — клинические симптомы.
Геномика выявляет возможные дефекты на пре- и трансляционном уровне, которые предшествуют передаче генетической информации с ДНК на РНК, синтезу матричной РНК (мРНК).
Слайд 4Протеомика — наука, основным предметом изучения которой являются белки, их функции и взаимодействия в
Основная задача протеомики — количественный анализ экспре-ссии белков в клетках в зависи-мости от их типа, состояния или влияния внешних условий. Протеомика осуществляет срав-нительный анализ больших групп белков — от всех белков, вовлеченных в тот или иной биологический процесс до полного протеома.
Метаболомика — это научное изучение химических процессов, в которые вовлечены метаболиты.
Транскриптомика - научное направление, занимающееся изучением транскриптома разных видов организмов. Транскриптом – это совокупность всех транскриптов, синтезируемых одной клеткой или группой клеток,
включая мРНК и не-кодирующие РНК. Транскрипт — молекула РНК, образующаяся в результате транскрипции
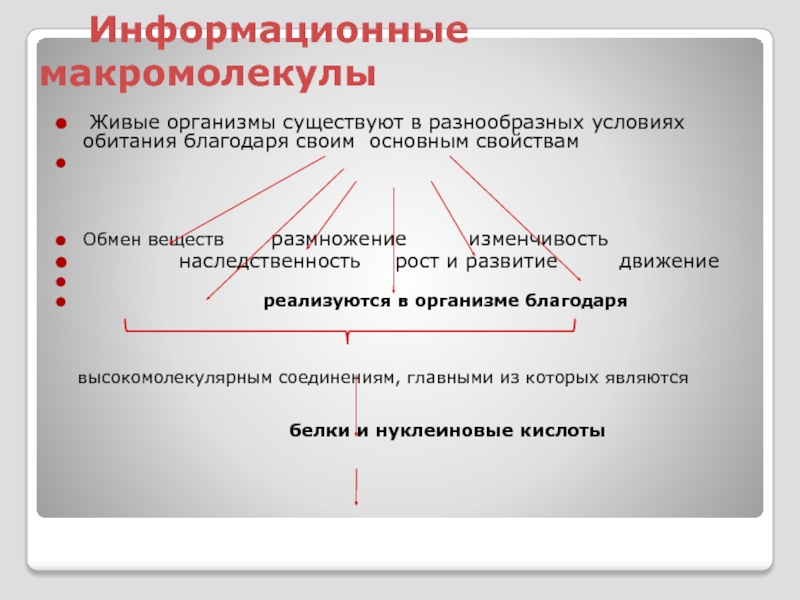
Слайд 5 Информационные макромолекулы
Живые организмы существуют в разнообразных условиях обитания
Обмен веществ размножение изменчивость
наследственность рост и развитие движение
реализуются в организме благодаря
высокомолекулярным соединениям, главными из которых являются
белки и нуклеиновые кислоты
Слайд 6 Белки и нуклеиновые кислоты являются информационными
во времени в пространстве
обеспечивая, тем самым
существование вида
разнообразие видов
Слайд 7 Белки и нуклеиновые кислоты
Белки
это органические вещества - биополимеры,
высокомолекулярные соединения , состоя-
щие из повторяющихся частей мономеров.
.
Процесс синтеза биополимеров называется
полимеризацией.
Ферменты каталитирующие процесс -
полимеразами
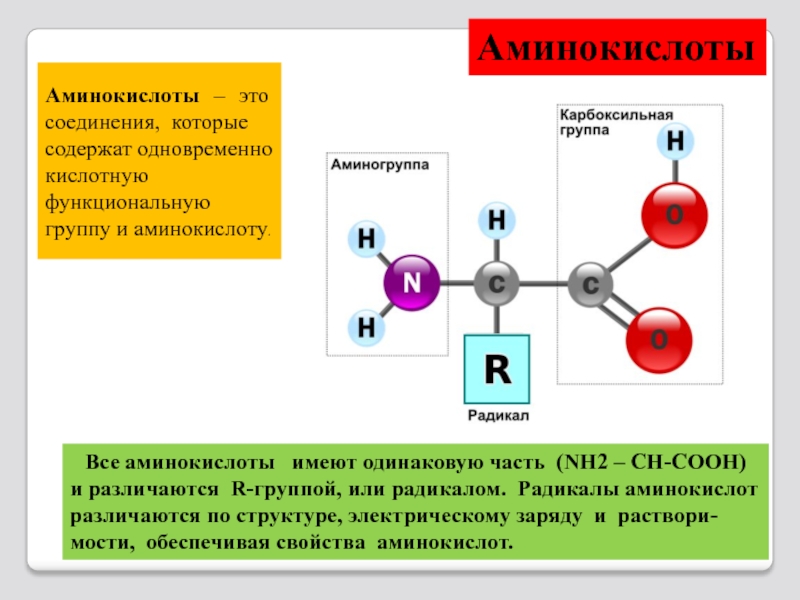
Слайд 10Аминокислоты – это соединения, которые
содержат одновременно кислотную
функциональную группу и
Аминокислоты
Все аминокислоты имеют одинаковую часть (NH2 – CH-COOH) и различаются R-группой, или радикалом. Радикалы аминокислот различаются по структуре, электрическому заряду и раствори-мости, обеспечивая свойства аминокислот.
Слайд 11Аминокислоты
Общее число ами-нокислот - 300; из
Их называют проте-иновыми или белковы-ми. В зависимости от способности раство-рятся в воде, ами-нокислоты делятся на: неполярные(гидрофобные) и полярные (гидрофильные)
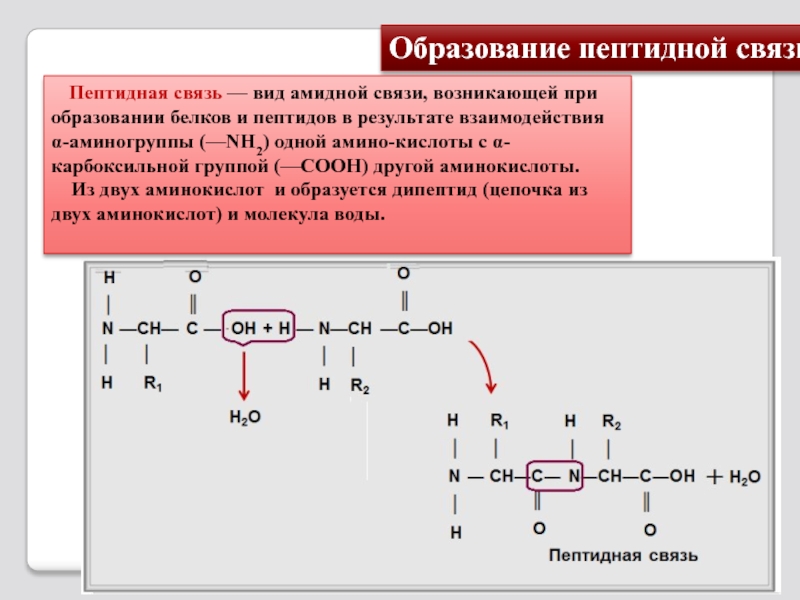
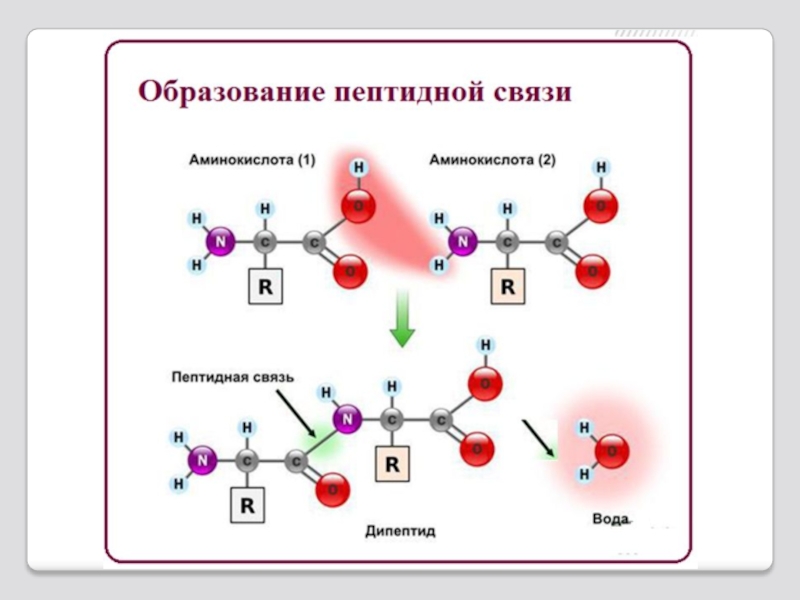
Слайд 12Образование пептидной связи
Пептидная связь — вид амидной связи, возникающей при
Из двух аминокислот и образуется дипептид (цепочка из двух аминокислот) и молекула воды.
Слайд 14Пептидная связь характеризуется следующими свойствами:
1. 4
2. Атомы -О- и -Н- пептидной связи имеют трансориентацию;
3. Длина С-N-связи имеет частично двойной характер, поэтому она короче, чем другие связи пептидной цепи и малоподвижна.
Вращение вокруг оси С-N практически невозможно, что связано с особенностями эле-ктронного строения связи.
Слайд 17 Соединения, в которых аминокислоты соединены пептидными связями, назы-вается
олигопептиды (содержат до 10 аминокислот),
полипептиды (до 10 аминокислот)
белки (свыше 100 аминокислот).
Мономеры полипептида называют аминокислотными остатками.
Пептиды
Слайд 18 В каждом полипептиде на одном
Пептиды пишутся, читаются и нумеруются с N-конца; аминокислот-ные остатки обозначаются символа-ми. Например:
Аla-Tyr-Ley-Ser-……….-Cys
Пептиды
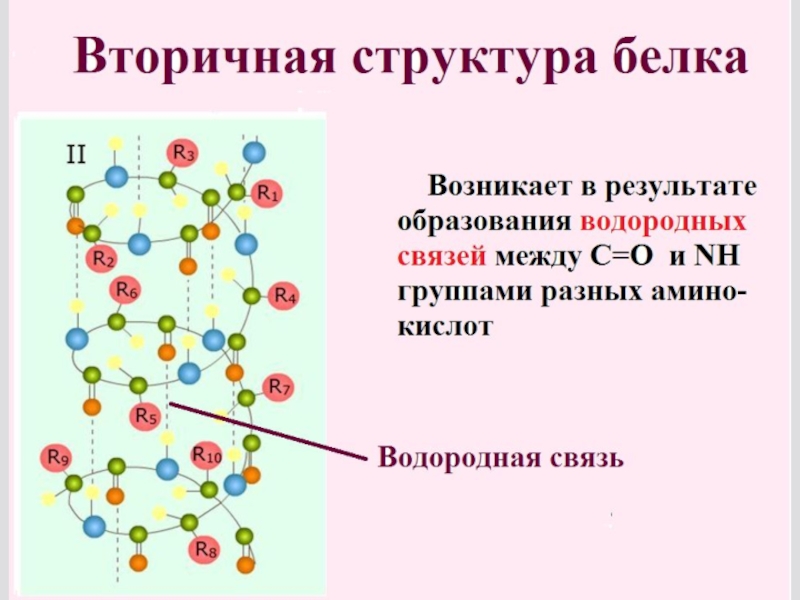
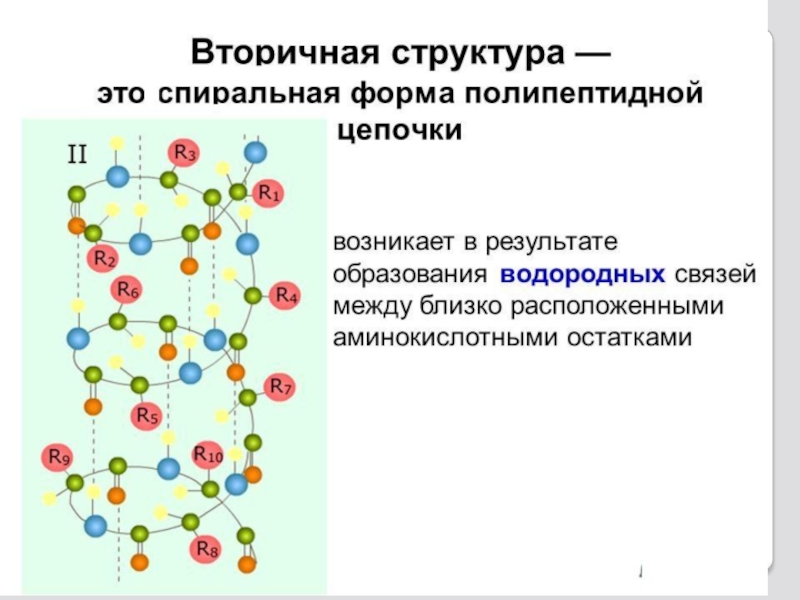
Слайд 24Α-спираль вторичной структуры полипептида
В α-спирали NH-группа одного остатка аминокислоты
В итоге образуется спираль, где на 1 виток приходится в сред-нем 3,6 аминокислотных остат-ков, шаг спирали равен 0,54мм, диаметр спирали - 0,5мм.
Водородные связи ориентиро-ваны вдоль оси спирали
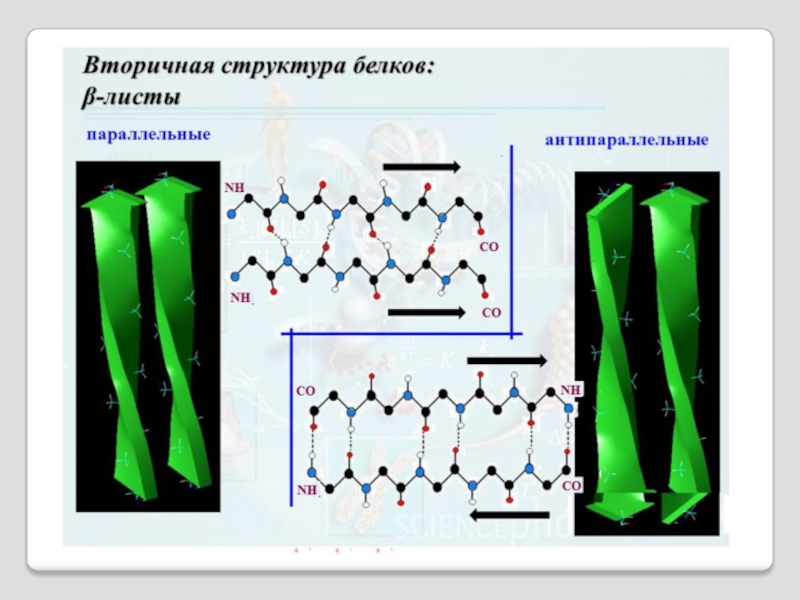
Слайд 25β-складчатый слой вторичной структуры полипептида
В случае β-струк-туры, или
ты, уложены па-раллельно друг другу и связаны между собой водо-родными связями.
Остов цепи не лежит в одной плоскости, а вследствие небольших изгибов при α-углеродных атомах образует слегка вол-нистый слой. Боковые группы распола-гаются перпендикулярно плоскости слоя.
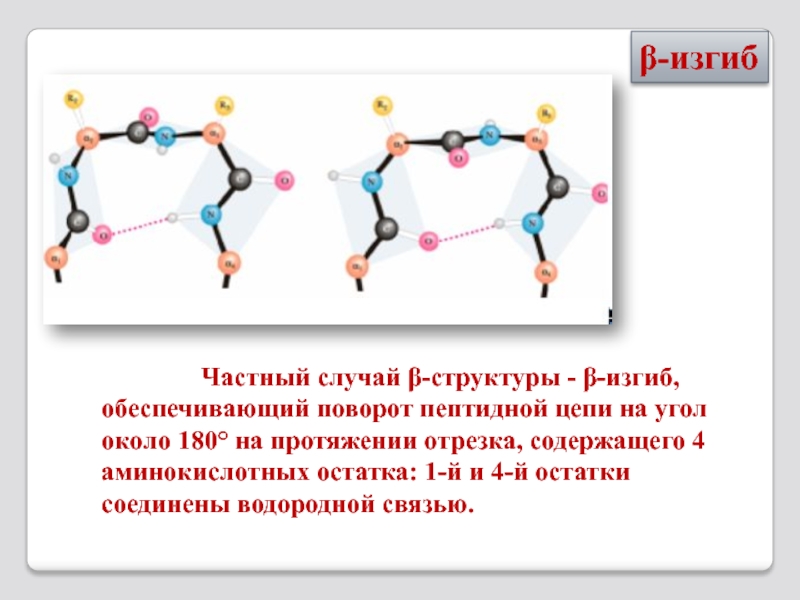
Слайд 27 Частный случай β-структуры
β-изгиб
Слайд 28 Пространственная структура каждого белка индивидуальна и определяется его первичной
Однако сравнение конформаций раз-ных по структуре и функциям белков выявило наличие у них похожих соче-таний элементов вторичной структуры.
Такой специфический порядок фор-мирования вторичных структур назы-вают супервторичной структурой белков. Супервторичная структура формируется за счёт межрадикальных взаимодействий.
Супервторичная структура белка
Супервторичная структура в виде α/β-бочонка. А - триозофосфатизомераза; Б - домен пируваткиназы.
Слайд 29Супервторичная структура белка
Белок с мотивом «спираль-виток-спираль»: а - α-спираль белка, содержащая
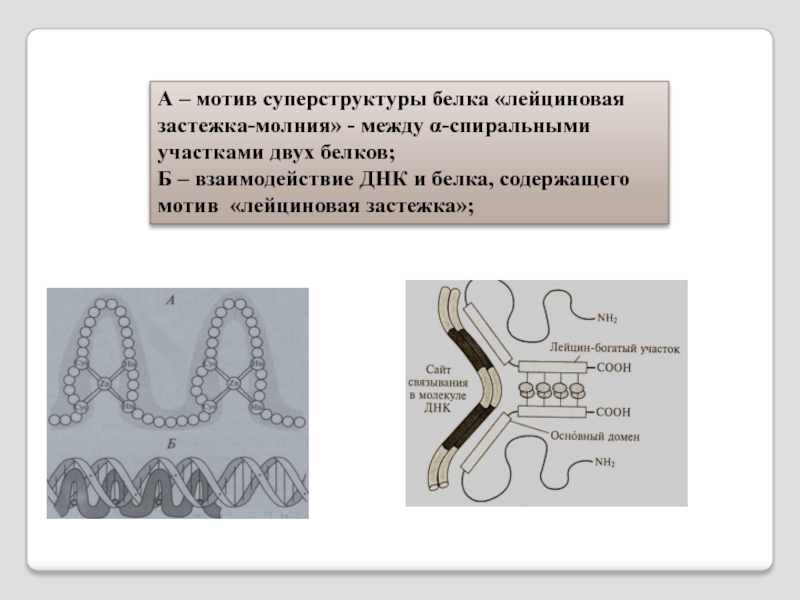
Слайд 30А – мотив суперструктуры белка «лейциновая застежка-молния» - между α-спиральными участками
Б – взаимодействие ДНК и белка, содержащего мотив «лейциновая застежка»;
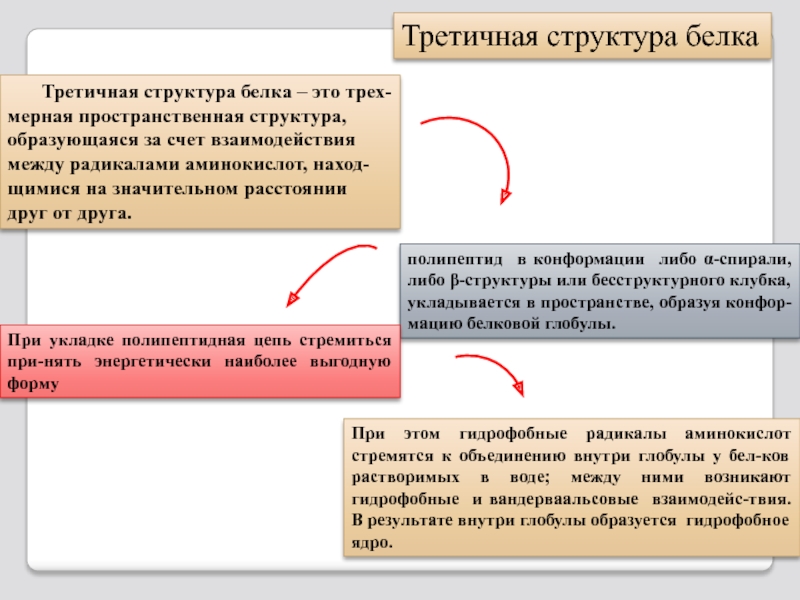
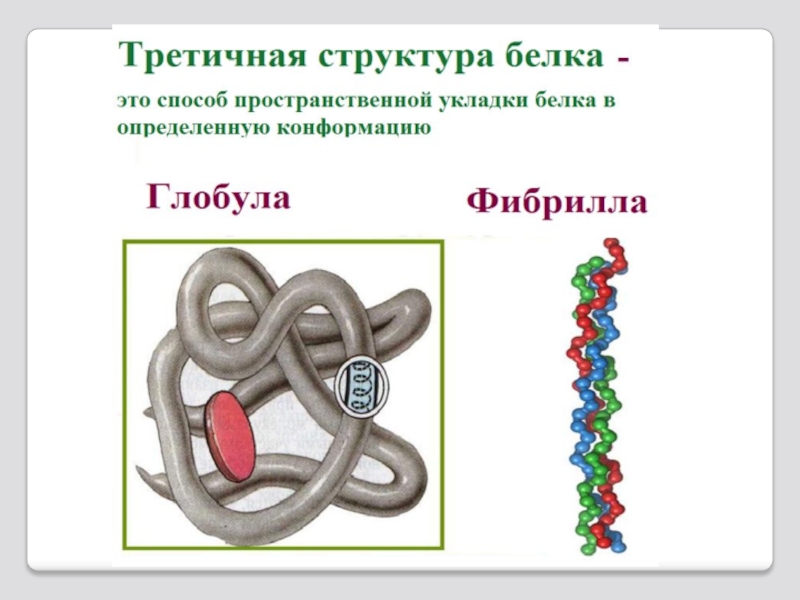
Слайд 31 Третичная структура белка – это трех-мерная пространственная структура,
Третичная структура белка
полипептид в конформации либо α-спирали, либо β-структуры или бесструктурного клубка, укладывается в пространстве, образуя конфор-мацию белковой глобулы.
При укладке полипептидная цепь стремиться при-нять энергетически наиболее выгодную форму
При этом гидрофобные радикалы аминокислот стремятся к объединению внутри глобулы у бел-ков растворимых в воде; между ними возникают гидрофобные и вандерваальсовые взаимодейс-твия. В результате внутри глобулы образуется гидрофобное ядро.
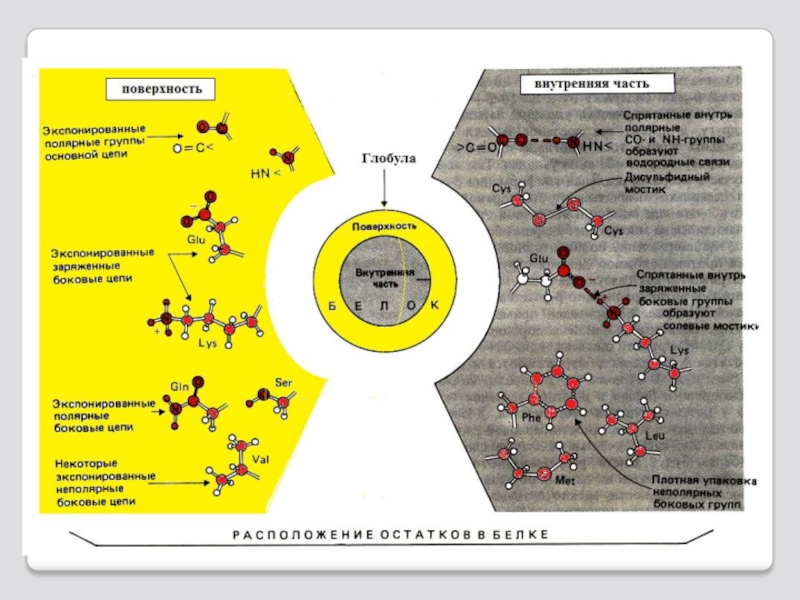
Слайд 32Типы связей, возникающих между радикалами аминокислот при формировании третичной структуры белка
1 - ионная
2 - водородная связь - возникает между гидрофильной незаряженной и любой другой гидрофильной группой;
3 - гидрофобные взаимодействия - возникают между гидрофобными радикалами;
4 - дисульфидная связь - формируется за счет окисления SH-групп остатков цистеина и их взаимодействия друг с другом
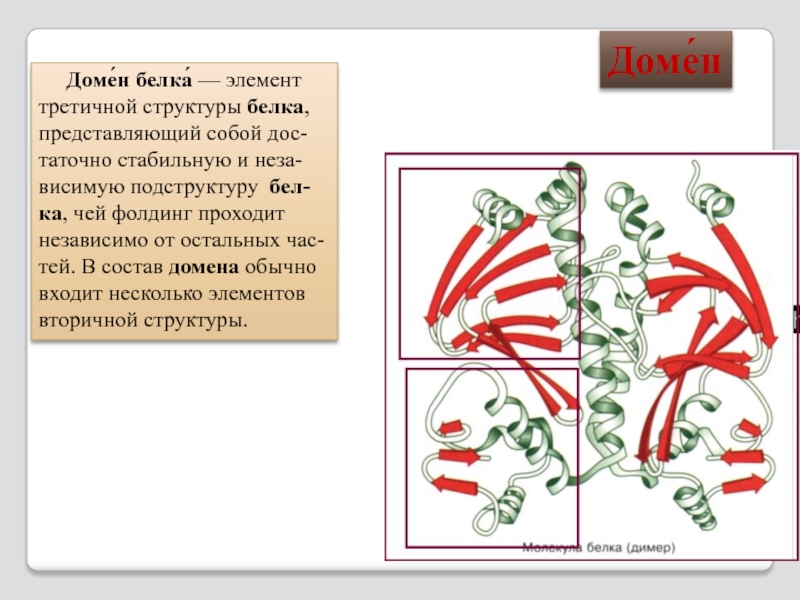
Слайд 35 Доме́н белка́ — элемент третичной структуры белка, представляющий собой дос-таточно
ка, чей фолдинг проходит независимо от остальных час-тей. В состав домена обычно входит несколько элементов вторичной структуры.
Доме́н
Слайд 36 Для выполнения белком его специфических функций и придания ему активности
Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы, в том числе и белок. Взаимодействие белка с лигандом специфично и определяется участком белковой молекулы, называемым активным центром или центром связывания белка с лигандом.
Лиганды
Лигандами могут быть неорганические (часто ионы металлов) и орга-нические низкомоле-кулярные и высокомо-лекулярные вещества.
Слайд 37 Активный центр – это участок молекулы белка, имеющий
сформирован радикалами аминокислот, собранными на определенном пространстве в процессе фолдинга третичной структуры данного белка и способных комплиментарно свя-зываться с лигандом.
Свойства активного центра зависят от химических свойств аминокислотных остатков в его составе и их точной взаимной ориентации в пространстве. Поэтому малейшие изменения в структуре белка приводят к изменению хими-ческих и физических свойств радикалов, нарушают структуру активного центра и связывание белка с лигандом.
Подобное наблюдается при денатурации, когда активный центр разрушается и утрачивается функциональная активность белка.
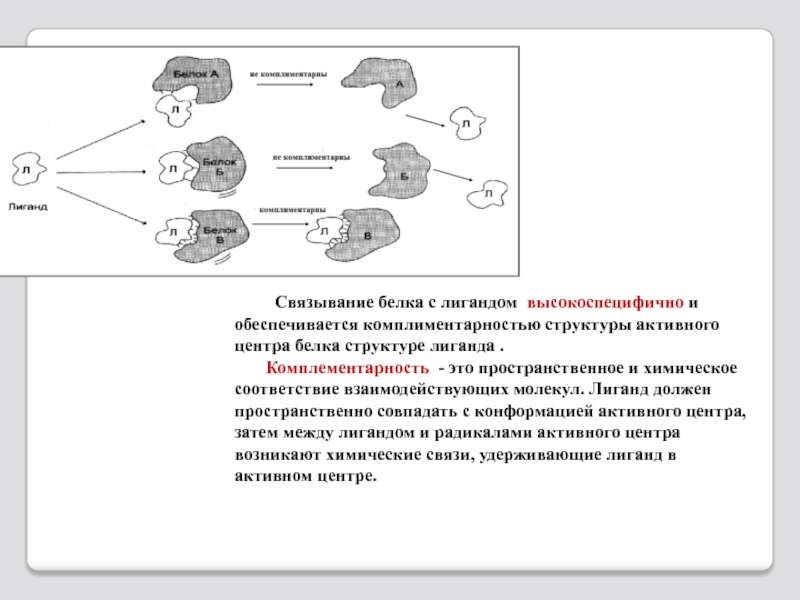
Слайд 38 Связывание белка с лигандом высокоспецифично и
Комплементарность - это пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен пространственно совпадать с конформацией активного центра, затем между лигандом и радикалами активного центра возникают химические связи, удерживающие лиганд в активном центре.
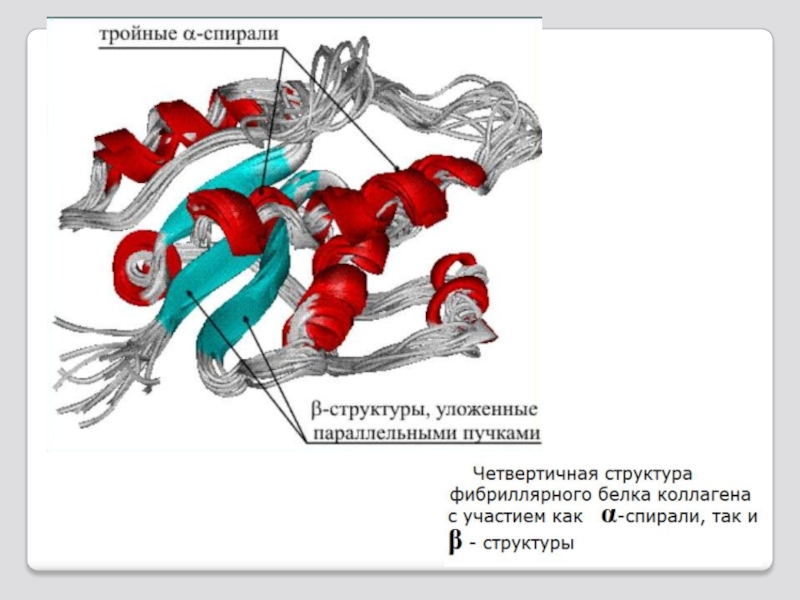
Слайд 39 Многие белки построены из 3 и более пептидных
Для таких белков харак-терно образование четвертич-ной структуры.
Четвертичная структура белка.
Белок крови гемоглобин состоит из 4 полипептидных цепей; каждая цепь называется субъединицей или прото-мером, само четвертичное образование – мультимером.
Четвертичная структура белка - эта способ укладки в прост-ранстве нескольких полипеп-тидных цепей, обладающих оди-наковой или разной простран-ственной структурой и форми-рование единого в структурном и функциональном отношениях макромолекулярного образо-вания.
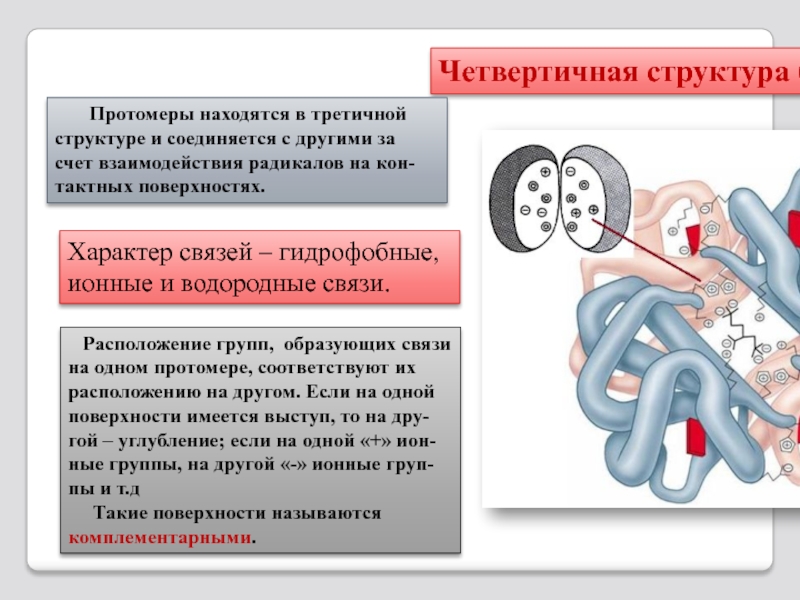
Слайд 40 Расположение групп, образующих связи на одном протомере, соответствуют их
Такие поверхности называются комплементарными.
Характер связей – гидрофобные, ионные и водородные связи.
Четвертичная структура белка
Протомеры находятся в третичной структуре и соединяется с другими за счет взаимодействия радикалов на кон-тактных поверхностях.
Слайд 41 Белок в четвертичной структуре явля-ется комплексом, который является единым
Белки, состоящие из нескольких поли-пептидных цепей, называются олигомер-ными белками. Количество протомеров колеблется от 2 до 10, редко больше (ферритин – 24 протомера).
Субъединичная структура глутаматсин-тетазы: а – протомер, б – мультимер белка
Четвертичная структура белка
Слайд 44 Первичная структура белка
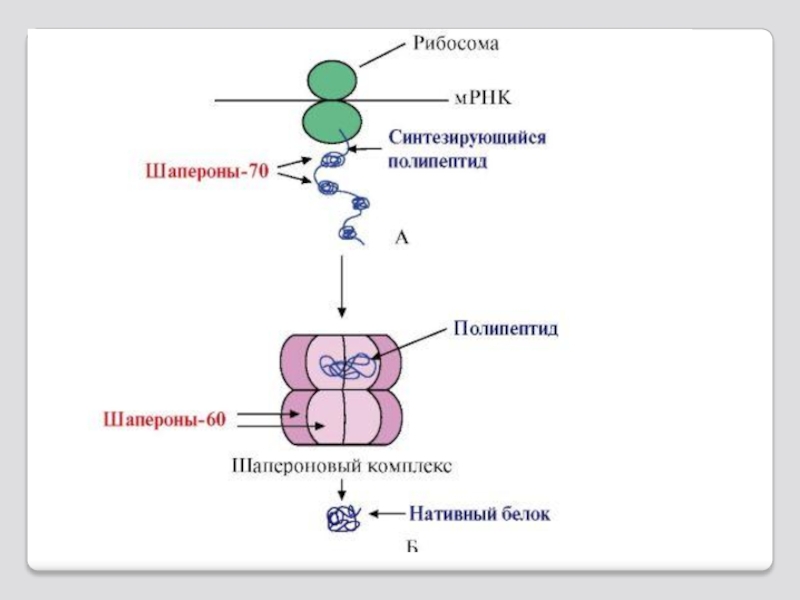
Пептидная цепь претерпевает пространственные изменения, приво-дящие к ее сворачиванию в пра-вильную трехмерную структуру.
Этот процесс называется фолдингом.
Фолдинг включает процессы образования вторичной, третичной и четвертичной структур белка.
Фолдинг белка
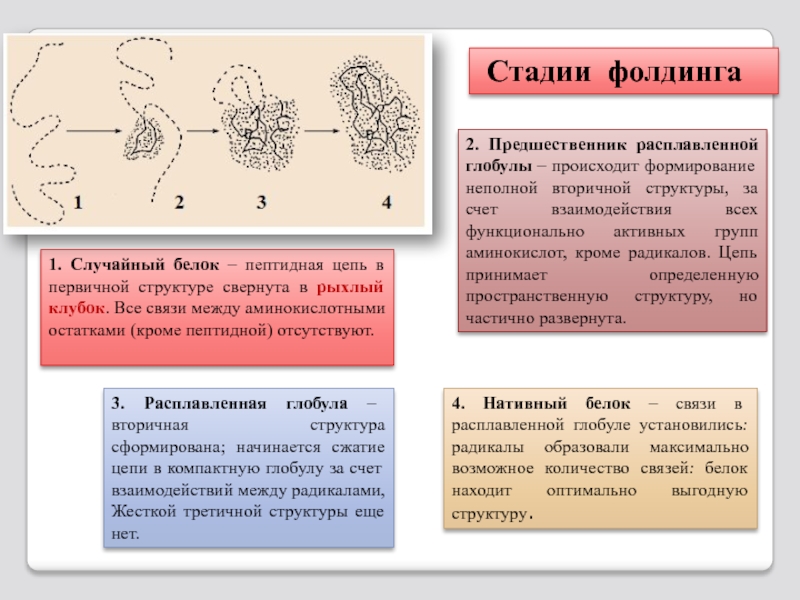
Слайд 451. Случайный белок – пептидная цепь в первичной структуре свернута в
2. Предшественник расплавленной глобулы – происходит формирование неполной вторичной структуры, за счет взаимодействия всех функционально активных групп аминокислот, кроме радикалов. Цепь принимает определенную пространственную структуру, но частично развернута.
3. Расплавленная глобула – вторичная структура сформирована; начинается сжатие цепи в компактную глобулу за счет взаимодействий между радикалами, Жесткой третичной структуры еще нет.
4. Нативный белок – связи в расплавленной глобуле установились: радикалы образовали максимально возможное количество связей: белок находит оптимально выгодную структуру.
Стадии фолдинга
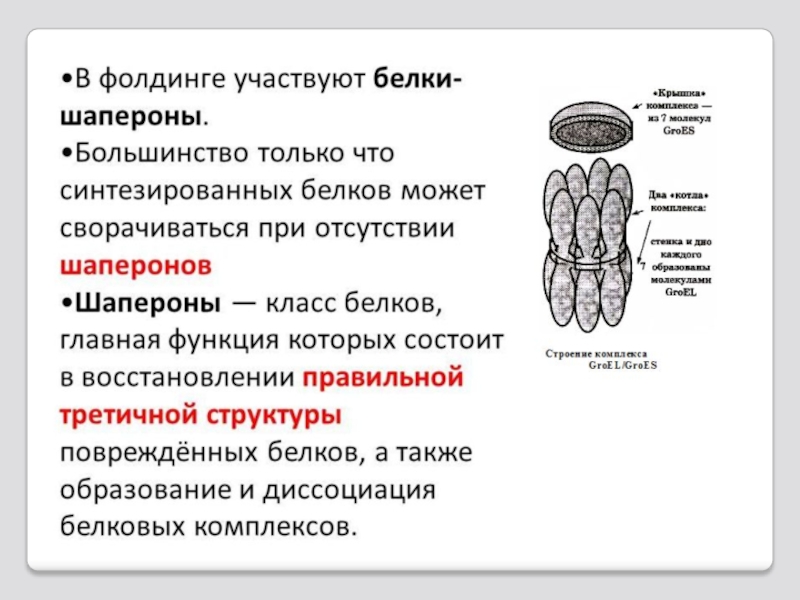
Слайд 46Крупные молекулы белков с большим молекулярным весом и сложной структурой в
Такие белки называются факторами фолдинга и делятся на две группы: фолдазы и шапероны.
Слайд 47 Фолдазы или ферменты фолдинга – это белки с
ПДИ (протеиндисульфидизомераза) каталитирует перемещение (раз- рыв одних и образование других) дисульфидных связей белка. Без этого фермента любая, образующаяся -Ѕ-Ѕ- связь, фиксировалась бы случайно, что с большой долей вероятности, проводило бы к образованию непра- вильных конформаций.
ППИ (пептидилпролилизомераза) обеспечивает «правильный» фолдинг белка, содержащего пролин.
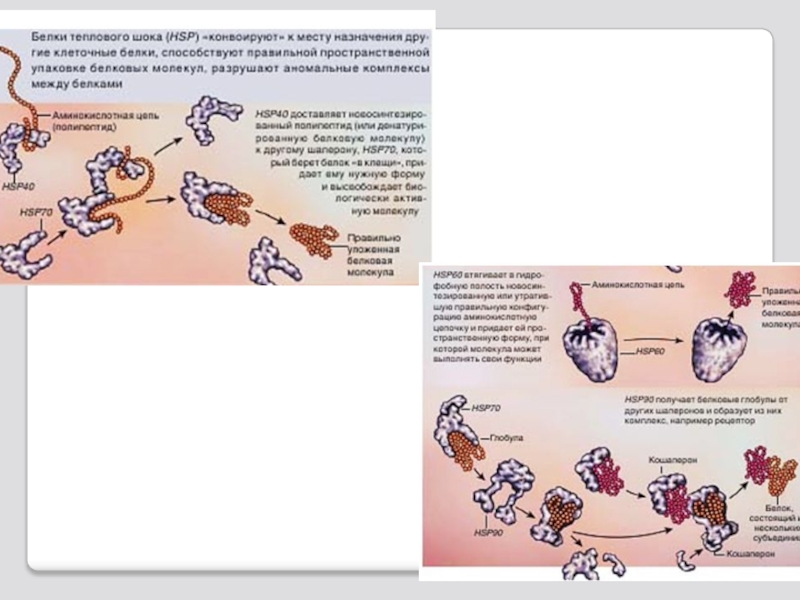
Слайд 49 Шапероны (от франц. shaperon - няня)
Высокомолекулярные шапероны от 100 до 110 кДа;
Ш-90 - молекулярная масса от 83-90 кДа;
Ш-70 - молекулярная масса от 66-70кДа;
Ш-60 - молекулярная масса от 60 кДа;
Ш-40 - молекулярная масса от 40 кДа;
Низкомолекулярные шапероны от 15 до 30 кДа.
Слайд 50Индуцибельные - их синтез в обычных условиях идет с низкой скоростью;
Шапероны делятся на:
Конститутивные - синтез таких шаперонов не зави-сит от стрессовых воздей-ствий на организм;
Индуцибельные шапероны относят к «белкам теплового шока»; их синтез резко возрастает практически во всех клетках при любых стрессовых влияниях. Название «белки теплового шока» возникло в результате того, что впервые эти были обнаружены в клетках микроорганизмов при воздействии высокими температурами.
Слайд 53І. Контроль за обеспечением «правильного» фолдинга новообразованных молекул белка
ІІ. Вторая функция
ІІІ. Шапероны участвуют в некоторых видах внутри-клеточного транспорта белков: транспорт новосинте-ризованных белков в лизосомы, митохондрии и другие органоиды, а также транспорт старых, отслуживших
белков, не поддающиеся рефолдингу в лизосомы.
ІV. Шапероны участвуют в поддержании ряда белков в состоянии определенной конформации, как бы незавершенном фолдинге.
Функции и механизм действия шаперонов
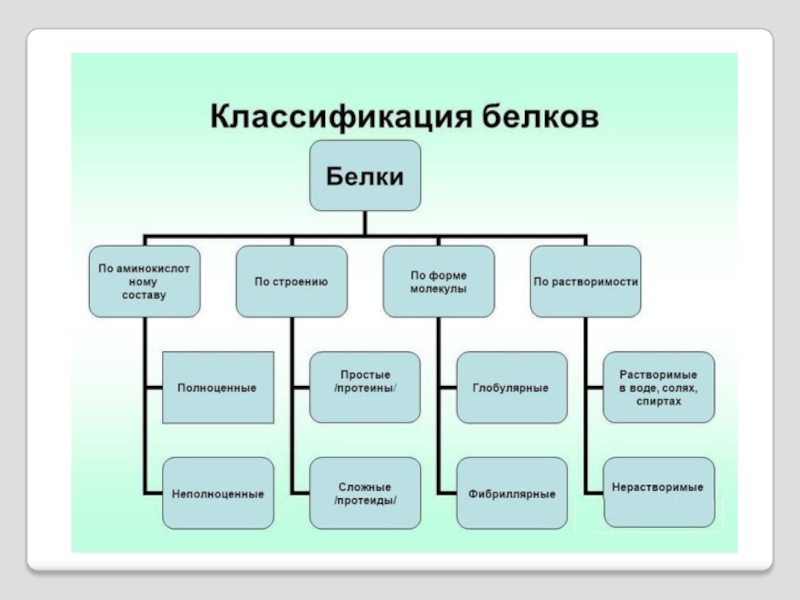
Слайд 55 Классификация белков
Белки можно классифицировать:
по молекулярной массе (низко-, высокомолекулярные и др.);
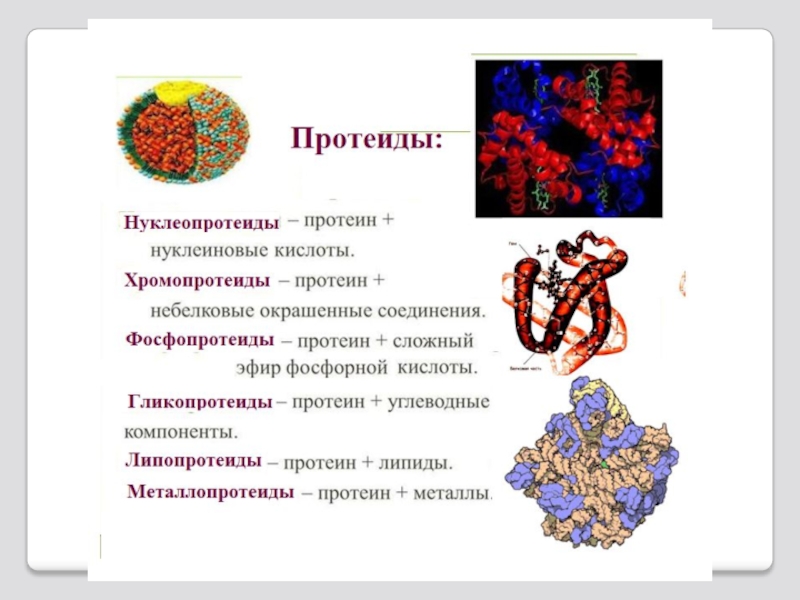
по химическому строению (отсутствие или наличию небелковой части): простые и сложные;
по функциям и локализации в клетке (ядерные, цитоплазматические, лизосомальные, митохондриальные и др.),
по возможности регулировать синтез белков (конститутивные, синтез которых идет с постоянной скоростью и индуцибельные, синтез которых возрастает при воздействии факторов среды),
по продолжительности жизни в клетке (очень быстро обновляющиеся, менее чем через час и медленно обновляющиеся в течении недель и месяцев),
по схожим участкам первичной структуры и родственным функциям (семейства белков): гемоглобины, иммуноглобулины, гистоны, серины.
Слайд 62 Глобулярные белки — белки, в молекулах которых полипептидные цепи плотно свёрнуты в глобулы
Глобулярная структура белков обусловлена гидрофобно-гидрофильными взаимодейств-ями: снаружи гидрофильные (имеющие водородные соединения с окружающей сре-дой), а внутри гидрофобные (отталкивающие воду).
К глобулярным белкам относятся фермен-
ты, иммуноглобулины,некоторые гормоны белковой природы (например,инсулин) а также другие белки, выполняющие транспортные, регуляторные и вспомогательные функции.
Глобулярные белки
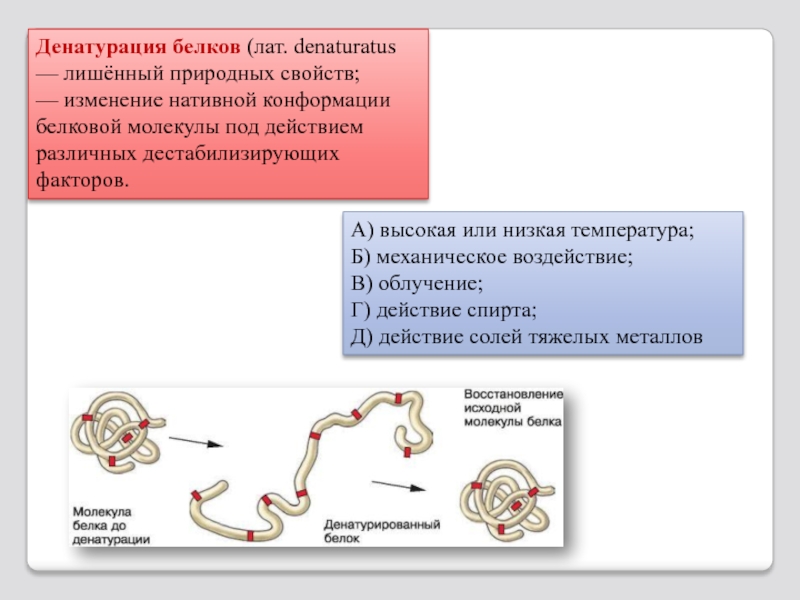
Слайд 64Денатурация белков (лат. denaturatus — лишённый природных свойств;
— изменение нативной конформации белковой
А) высокая или низкая температура;
Б) механическое воздействие;
В) облучение;
Г) действие спирта;
Д) действие солей тяжелых металлов
Слайд 66Нуклеиновые кислоты – это высокомолекулярные биополимеры , распадающиеся при гидролизе на
Слайд 67 Нуклеиновые кислоты были открыты в 1868 г. швейцарским врачом Ф.Мишером
Открытие НК
Слайд 70ДНК – самая большая молекула в клетке. Она намного больше белков
Каждая хромосома = одна молекула ДНК
23 хромосомы человека = 23 молекулы ДНК
ДНК – это молекула-текст. В после-довательности ее нуклеотидов за-писана вся наследственная прог-рамма организма
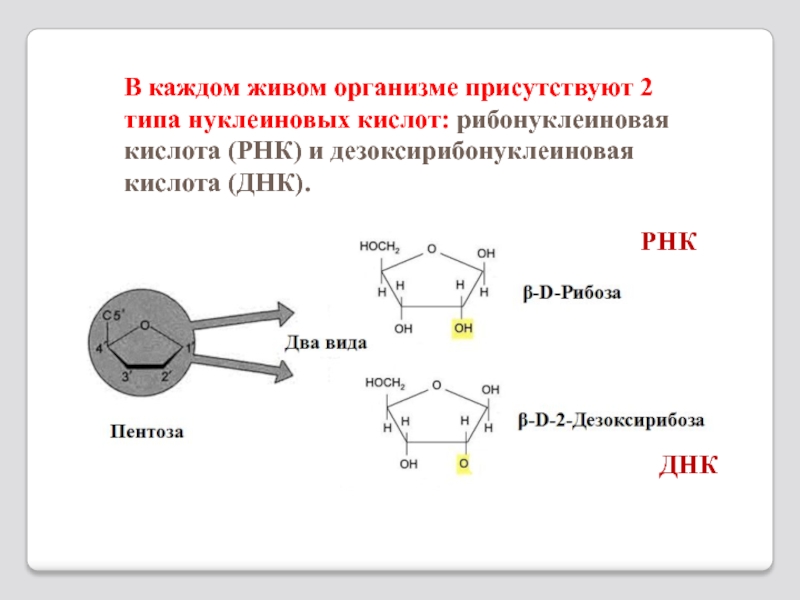
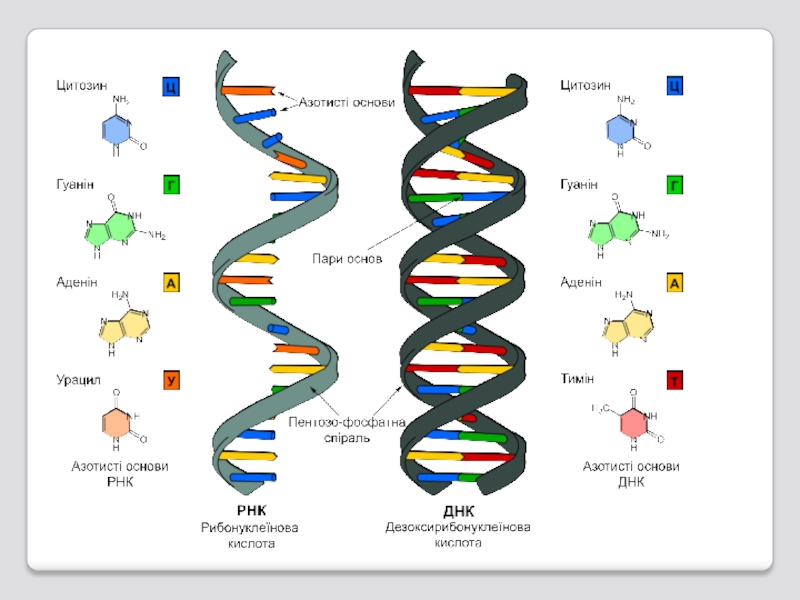
Слайд 71В каждом живом организме присутствуют 2 типа нуклеиновых кислот: рибонуклеиновая кислота
РНК
ДНК
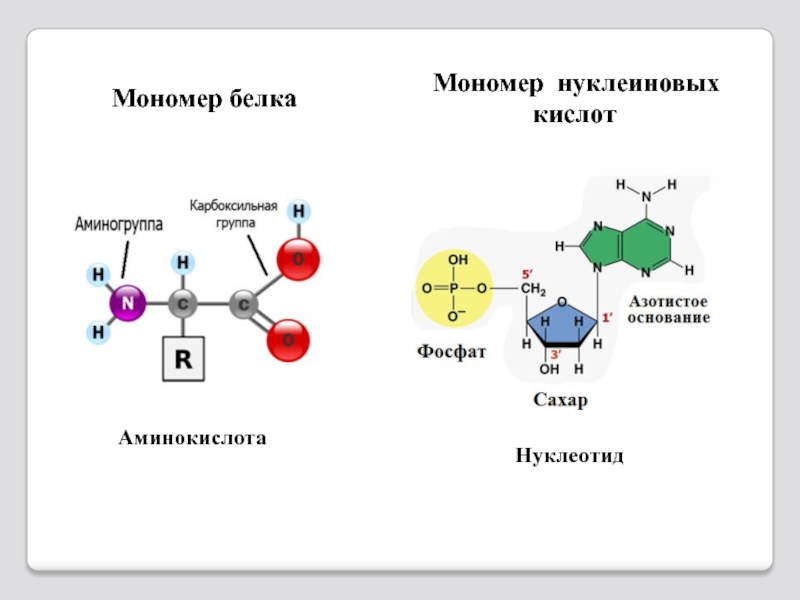
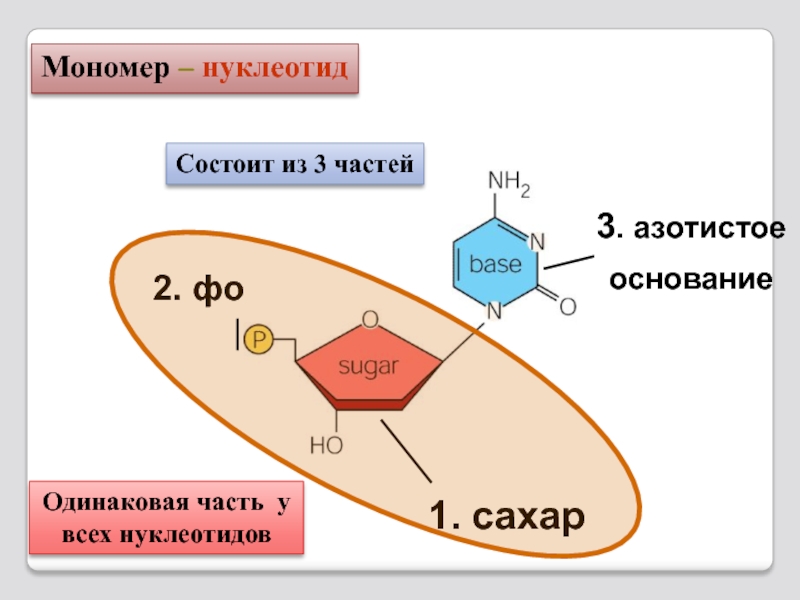
Слайд 722. фосфат
3. азотистое
основание
1. сахар
Одинаковая часть у
всех нуклеотидов
Мономер – нуклеотид
Состоит
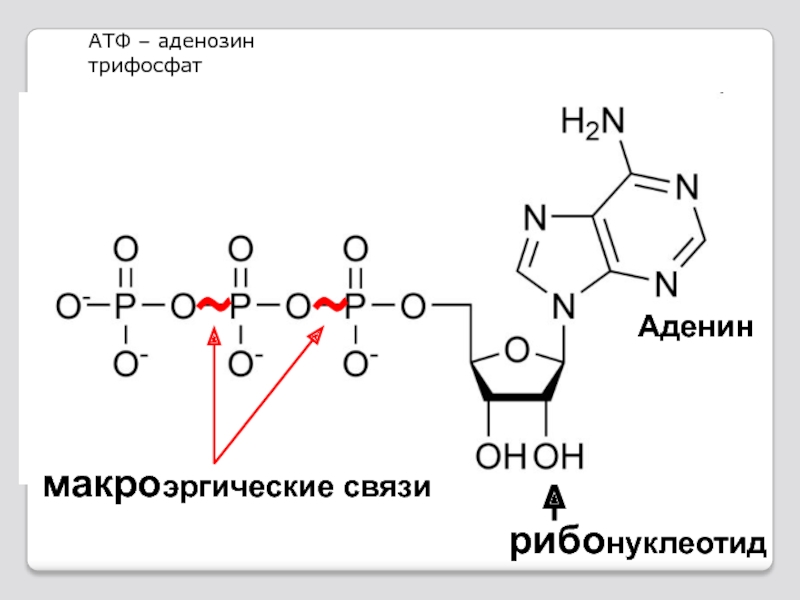
Слайд 76 Нуклеотиды являются нуклеозидфосфатами и со-держат
Нуклеозидфосфат
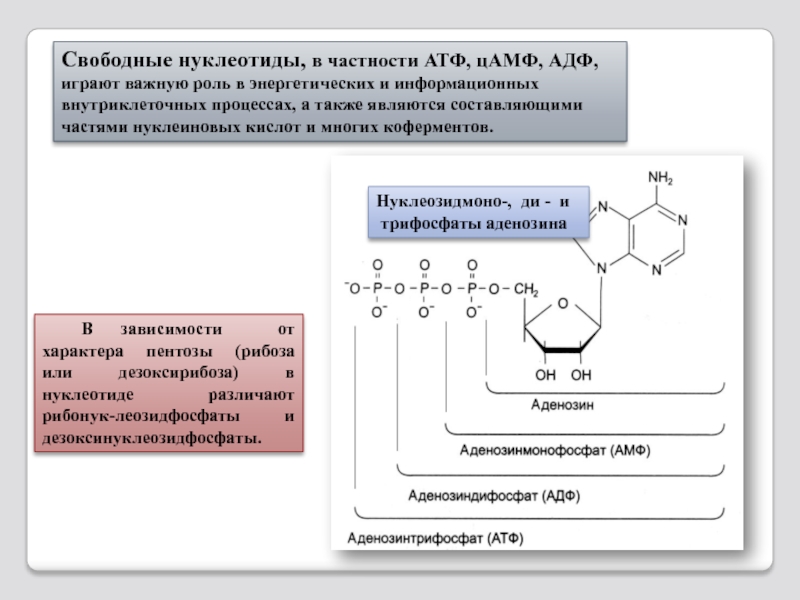
Слайд 77В зависимости от характера пентозы (рибоза или дезоксирибоза) в нуклеотиде различают
Нуклеозидмоно-, ди - и
трифосфаты аденозина
Свободные нуклеотиды, в частности АТФ, цАМФ, АДФ, играют важную роль в энергетических и информационных внутриклеточных процессах, а также являются составляющими частями нуклеиновых кислот и многих коферментов.
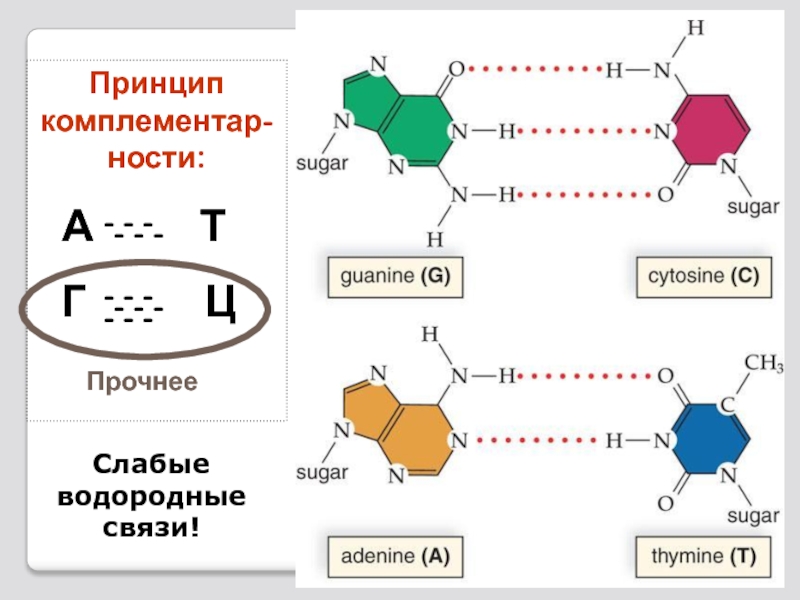
Слайд 82 ДНК – это двуцепче-чная молекула.
комплементарности
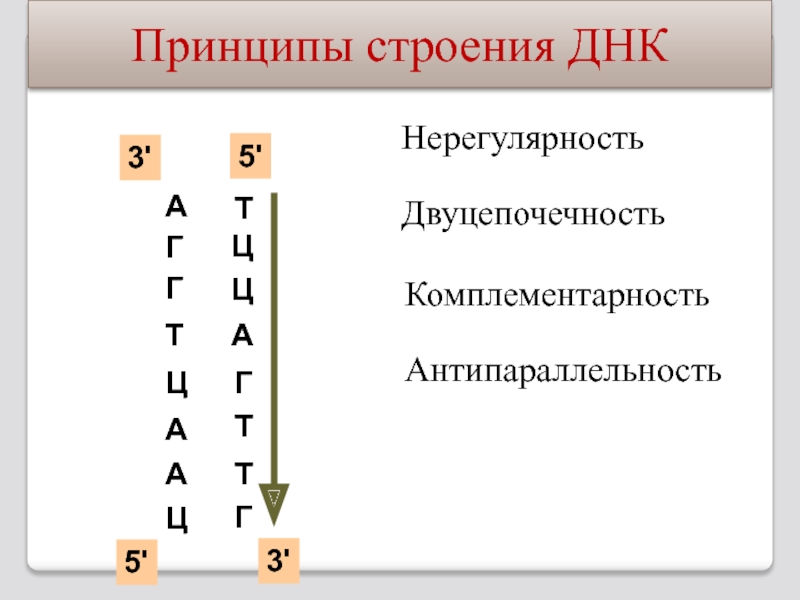
Слайд 87Принципы строения ДНК
А
Г
Г
Т
Ц
А
А
Ц
Нерегулярность
Двуцепочечность
Ц
Ц
Комплементарность
А
Г
Т
Т
Г
Антипараллельность
3'
5'
5'
3'
Т
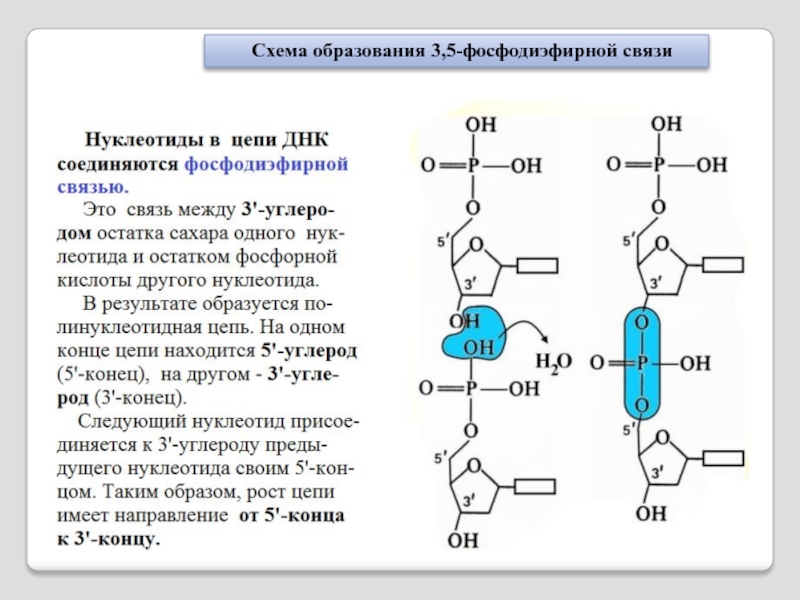
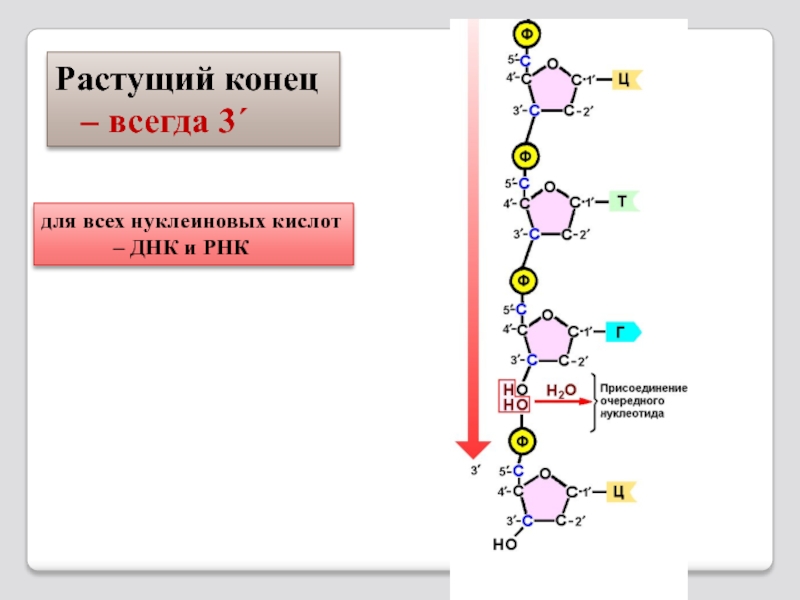
Слайд 89,
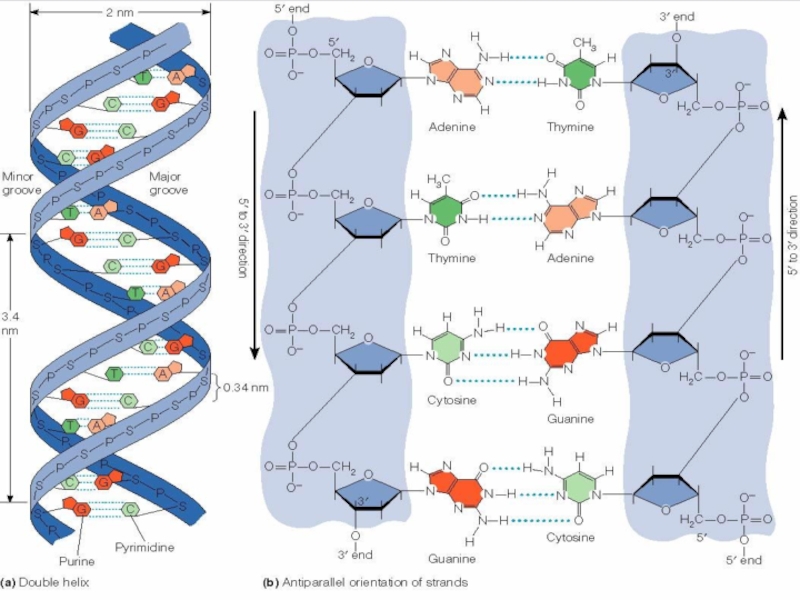
Молекула ДНК имеет форму
Вторичная структура ДНК построена из двух полинуклеотидных цепей, ориентированных антипараллельно и закрученных в спираль
Слайд 92 A-ДНК —представляет собой право-закрученную двусхпиральную молекулу. Основания располагаются
Биологическая роль - А-форма ДНК необходима в тех процессах, где образуются ДНК-РНК комплексы, так как РНК может принимать только А-форму спирали из-за ОН-группы.
В-форма - типичная право-закрученная спираль Уотсона-Крика с перпендикулярно рас-положенными основаниями и диаметром 3,4 нм.
ДНК в клетке находится в основном в В-форме, но от-дельные её участки могут находится в А- или Z-форме.
Z-форма - левозакрученная спираль с основаниями расположенными под углом ~20º к оси спирали и 12 парами оснований в шаге. Линия, соединяющая фосфатные группы, через каждые две пары нуклео- тидов имеет излом и принимает зигзагообразный вид.
Z-форма играет роль в процессе рекомбинации и регуляции действия генов, является временной структурой, появляющейся в результате биологической активности и быстро исчезающей.
Слайд 93 H-форма ДНК и тройные спирали ДНК - образуются при наличии
Слайд 96Отличия от ДНК
а) РНК – одноцепочный полимер;
б) сахарный остаток мономера -
допо-л-нительную гидроксильную группу;
в) среди главных (мажорных) азо-тистых оснований вместо тимина содержится урацил, который от-личается от тимина отсутствием метильной группы в 5-ом поло-жении;
г)в молекуле РНК высоко содержание минорных оснований и нуклеозидов, которые являются модифицированными производными как мажорных азотистых основании, так и сахара.
Химическая структура РНК
а) обе молекулы являются линей-ными полимерами;
б) мономеры –нуклеотиды явля-ются фосфорилированнымиN-гликозидами, которые соединяются фосфодиэфирной связью;
в) в состав РНК входят также 4 нуклеотида: аденин (А),гуанин (Г), цитозин (Ц) и урацил (У);
г) полинуклеотидная цепь РНК полярна: имеет четко различимые 5ʹ-, и 3ʹ-концы (рис.102).
Слайд 97Отличия РНК от ДНК
Одноцепочечные молекулы
Сахар – рибоза вместо дезоксирибозы
У вместо Т
Намного
Слайд 98 РНК – рибонуклеиновая
по особенностям строения и функциям делится на кодирующую белок и не кодиру-ющую белок.
Не несет информацию о струк-туре белка и, следовательно, не транслируются в белок.
Кодирующая белок
иРНК (информационная) или мРНК (матричная), несет информацию о стру-ктуре белка
Не кодирующая белок
Слайд 99транспортная РНК (тРНК)
Рибосомальная РНК (рРНК)
транспортно-матричная РНК (тмРНК),
микро РНК (миРНК),
малые ядерные РНК (мяРНК, snRNA),
малые ядрышковые РНК (мякРНК, snoRNA),
антисмысловые РНК (aRNA),
микроРНК (miRNA),
piРНК (piwiRNA, piRNA),
длинные некодирующие РНК
малая интерферирующая РНК миРНК (siRNA) и т. д.
Не кодирующая белок РНК
Слайд 100Минорные азотистые основания :инозин, метилинозин, диметилгуанозин, метилгуанозин, риботимидин, псевдоуридин и др.
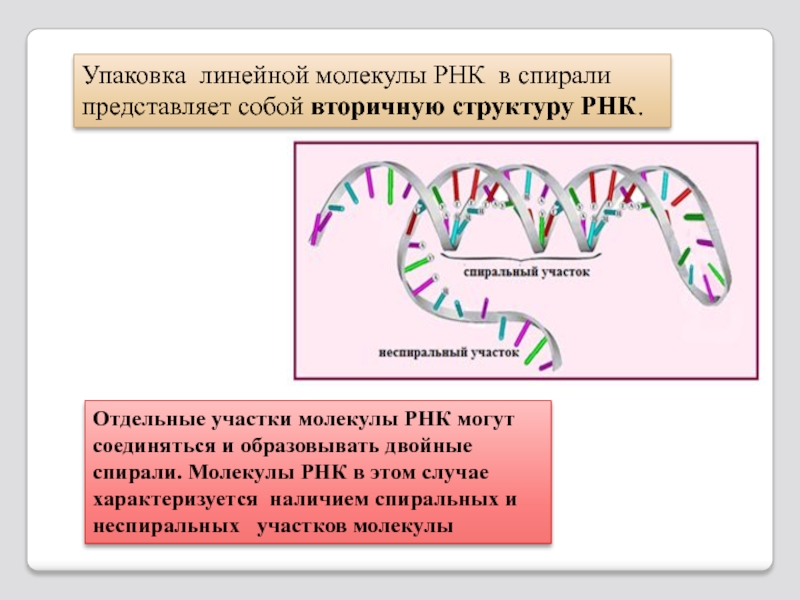
Слайд 102Упаковка линейной молекулы РНК в спирали представляет собой вторичную структуру РНК.
Отдельные
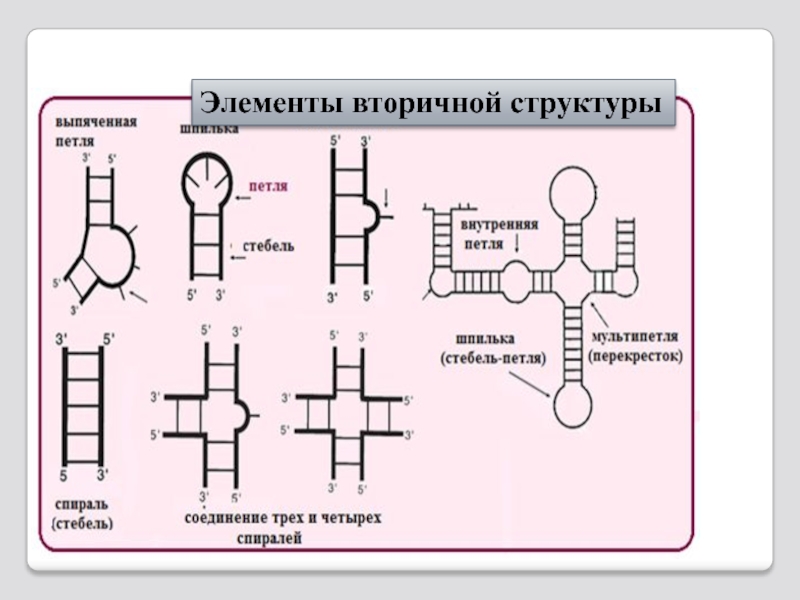
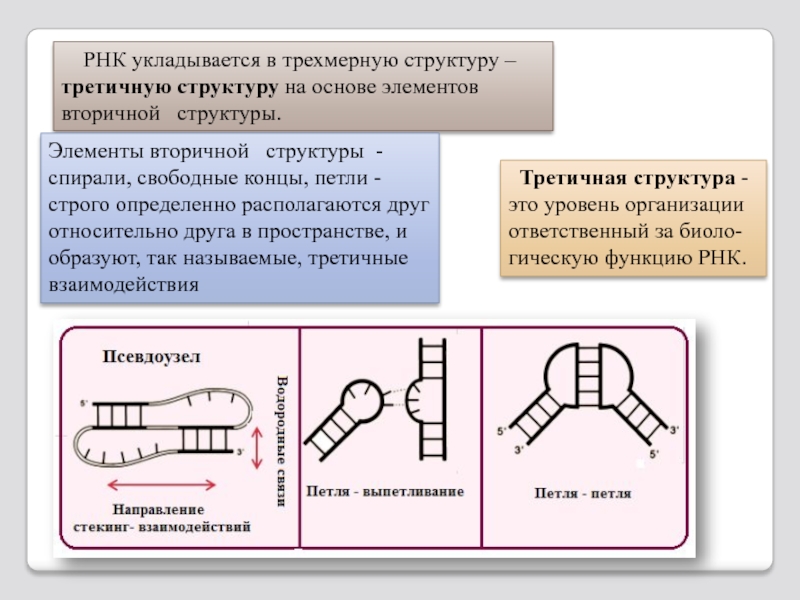
Слайд 104 РНК укладывается в трехмерную структуру – третичную структуру на
Элементы вторичной структуры - спирали, свободные концы, петли - строго определенно располагаются друг относительно друга в пространстве, и образуют, так называемые, третичные взаимодействия
Третичная структура - это уровень организации ответственный за биоло-гическую функцию РНК.
Слайд 105 мРНК–матричная РНК составляет 3% от всей РНК клетки. Это короткоживущая
Первичная структура мРНК
Слайд 106I. Колпачок (кэп) - участок из 1-4 модифицированных нуклеотидов, который
II. 5'- и 3'-нетранслируемый участок (область) - последователь-ность из нескольких десятков нуклеотидов. Участки мРНК, не не несущий информации о структуре белка.
5'-нетранслируемый участок - это последовательностькомплиментарная одному из отделов рРНК, входящему в малую субъединицу рибосомы, поэтому она отвечает за первичное связывание мРНК с рибосомой.
3'- нетранслируемыйучасток-последовательность нуклеотидов, превышающая по длине 5'-нетранслируемый участок. Является субстратом для присоединения поли-(А)-«хвоста
III. Инициирующий кодон (AUG) –
IV. Кодирующая часть (транслируемая область)
V.Кодон терминации (стоп-кодон) - один из 3 бессмысленных кодонов: УАА, УГА,УАГ.
VI.Поли-(А)-фрагмент - это последовательность из 150-200 адени- ловых нуклеотидов (рис.). Облегчает выход мРНК из ядра и защищает её от 3'-экзонуклеаз в цитоплазме.
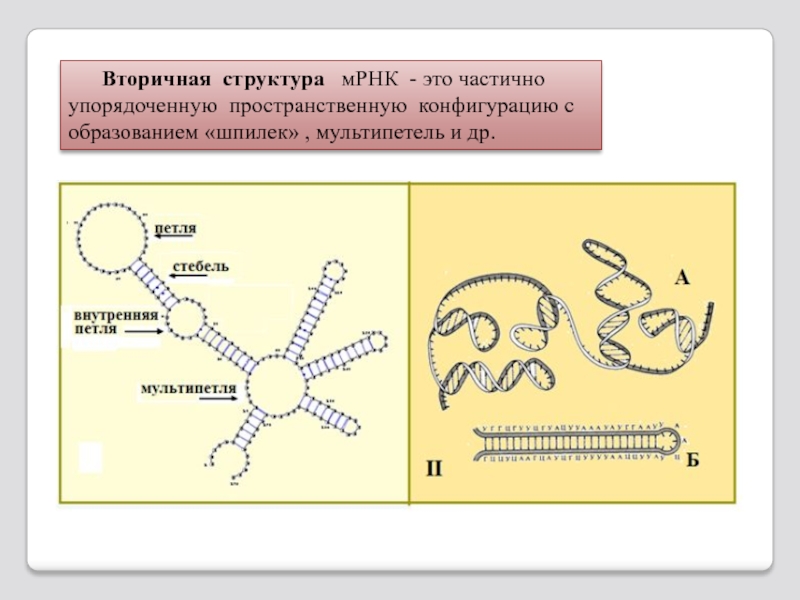
Слайд 107 Вторичная структура мРНК - это частично упорядоченную
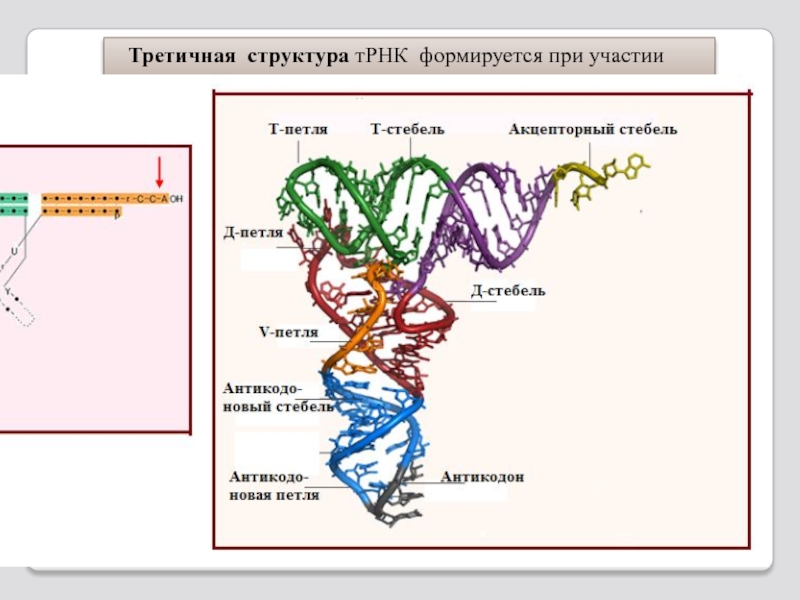
Слайд 108Третичная структура РНК формируется при определенных значениях рh среды, ионной силы
а – компактная палочка,
б – компактный клубок,
в - развернутая цепь
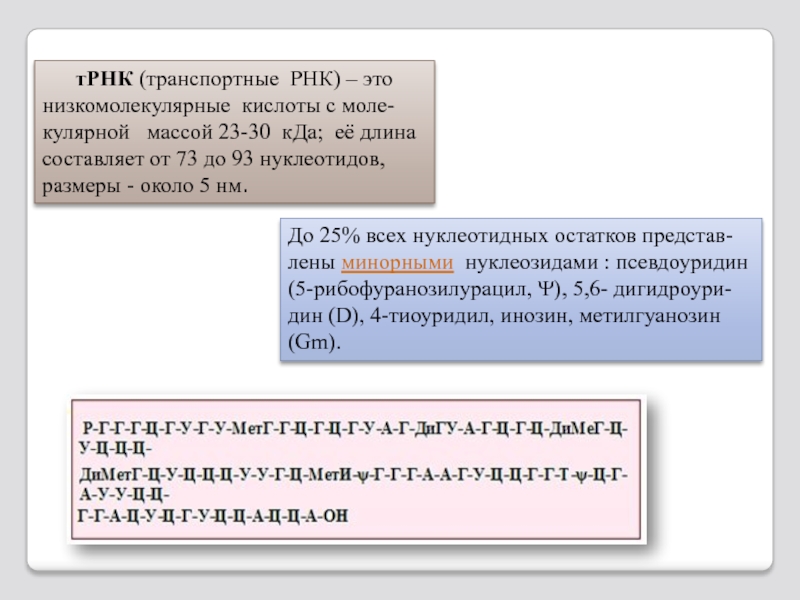
Слайд 109 тРНК (транспортные РНК) – это низкомолекулярные кислоты с
До 25% всех нуклеотидных остатков представ-лены минорными нуклеозидами : псевдоуридин (5-рибофуранозилурацил, Ψ), 5,6- дигидроури-дин (D), 4-тиоуридил, инозин, метилгуанозин (Gm).
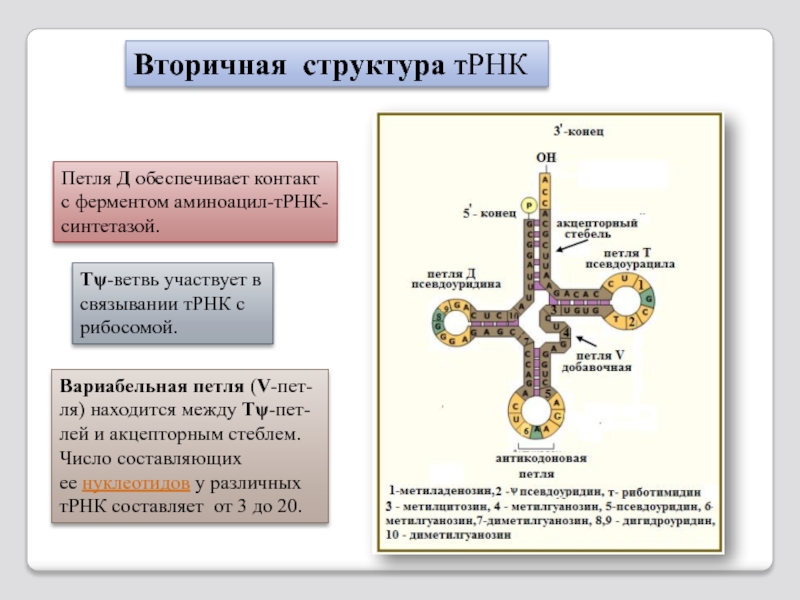
Слайд 110Вторичная структура тРНК
Петля Д обеспечивает контакт с ферментом аминоацил-тРНК-синтетазой.
Tψ-ветвь участвует
Вариабельная петля (V-пет-ля) находится между Tψ-пет-лей и акцепторным стеблем. Число составляющих
ее нуклеотидов у различных тРНК составляет от 3 до 20.
Слайд 112Функции тРНК.
Для синтеза белка они выполняют три функции:
- акцепторная -
- затравки при обратной транскрипции (синтезе ДНК на РНК-матрице);
- в переносеаминокислот через наружную мембрану клеток;
- в регуляции биосинтеза ряда аминокислот;
- в посттрансляционной модификации белков.
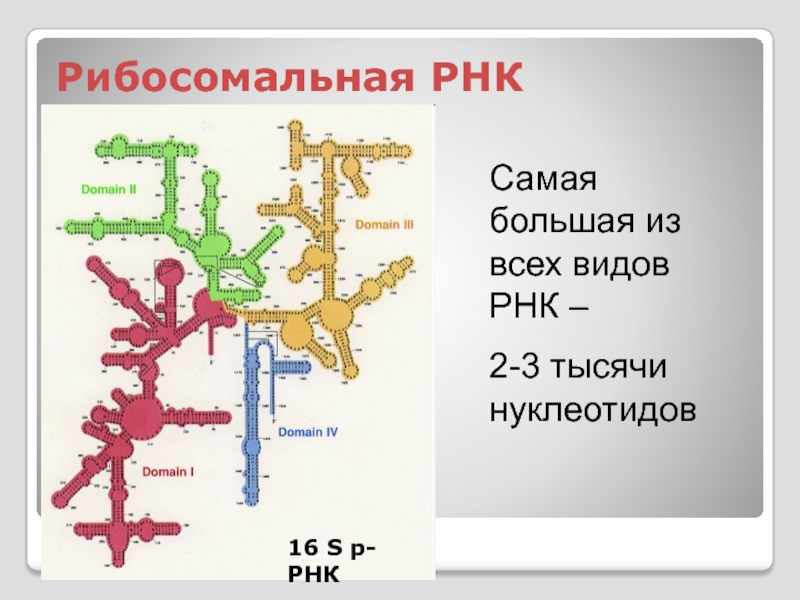
Слайд 113 рРНК - рибосомальная РНК - основа формирования
рРНК метаболически стабильная мо-лекула с молекулярным весом 2∙106кДа. На её долю приходится 85-90% всех РНК клетки. Степень спи-рализованности молекул достигает 70-80%.
Первичная структура
молекулы 5.8 рРНК
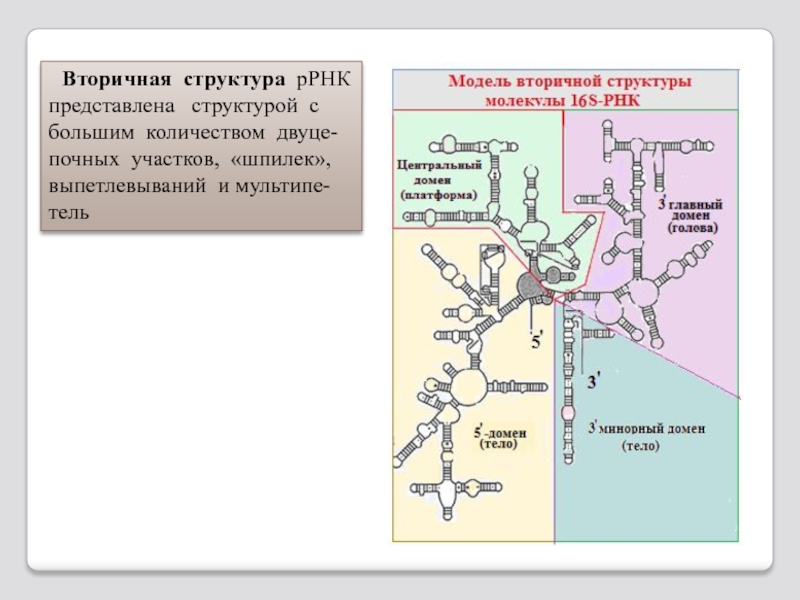
Слайд 116 Вторичная структура рРНК представлена структурой с большим количеством двуце-почных
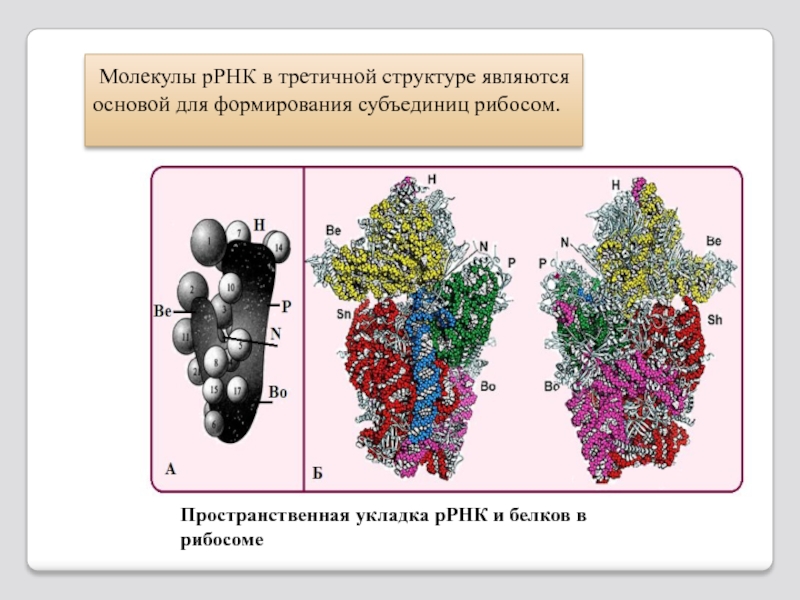
Слайд 117 Молекулы рРНК в третичной структуре являются основой для формирования субъединиц
Пространственная укладка рРНК и белков в рибосоме
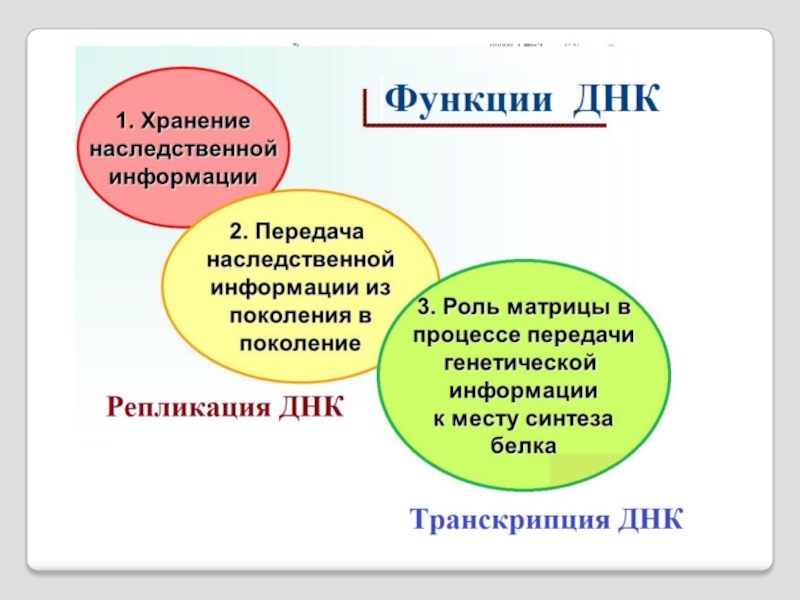
Слайд 118 1 - генетическая репликативная функция -
2 - кодирующая функция – программирование белкового синтеза линейными последовательностями нуклеотидов РНК (РНК-матрица). Триплеты нуклеотидов РНК являются программой для расстановки 20видов аминокислот в полипептидной цепи белка;
3 - структурная функция – молекула РНК образует трехмерные структуры - рибосомы;
4 - функция узнавания – способность узнавать и пространственно взаимодей- ствовать с другими видами РНК ( мРНК и рРНК при трансляции) и белками ( сплайсомы и информосомы );
5 - каталитическая функция - участие в специфическом катализе химиической реакции рибозимами.
Биологические функции молекулы РНК