- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
HLA-типирование Тоджаева Д,481а 2013г презентация
Содержание
- 1. HLA-типирование Тоджаева Д,481а 2013г
- 2. MHC – комплекс тесно сцепленных генетических локусов
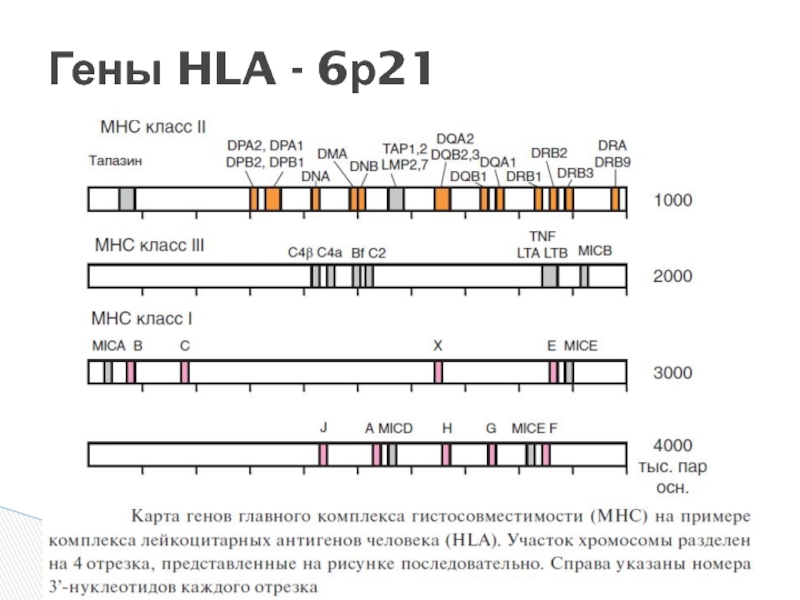
- 3. Гены HLA - 6р21
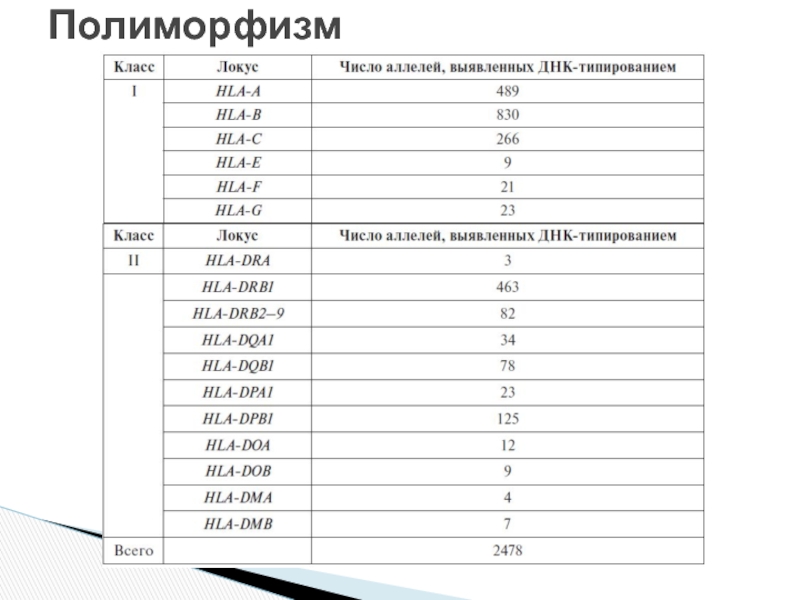
- 4. Полиморфизм
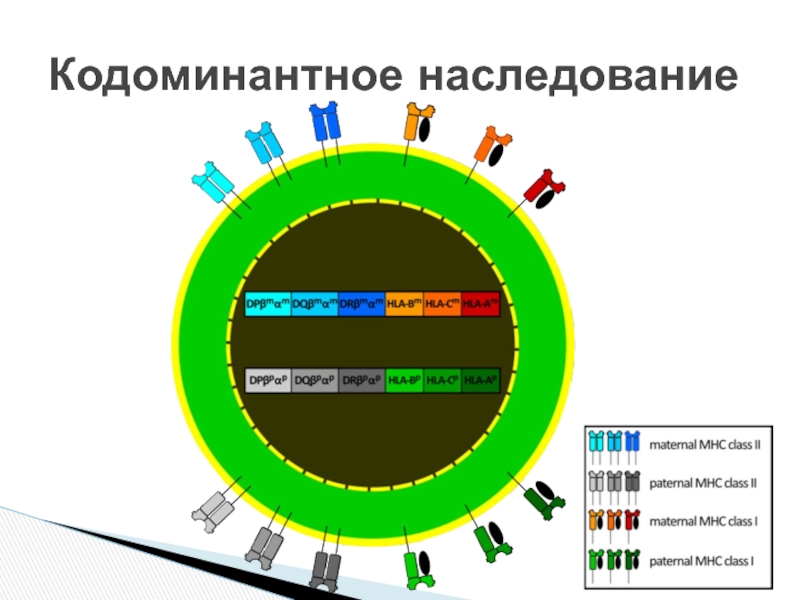
- 5. Кодоминантное наследование
- 7. Презентация АГ Т-лимфоцитам Селекция и обучение ЛФ
- 8. HLA-типирование При типировании определяют: Гаплотип (набор генов
- 9. Это метод определения тканевой совместимости донора и
- 10. Выраженность агглютинации: интенсивная, т.е. крупные агломераты, значительная
- 11. Метод заключается в следующем: К сывороткам против
- 12. Применяют в основном для определения HLA II
- 13. В настоящее время молекулярно- генетические методы используются
- 14. Метод основан на способности бактериальных эндонуклеаз расщеплять
- 15. Постановка: Фрагменты ДНК, полученные после ее обработки
- 16. Недостатки метода: большие затраты времени (обычно 2-3
- 17. Аллели генов HLA иногда отличаются друг от
- 18. метод избирательной амплификации, предназначенный для получения большого
- 19. Для проведения ПЦР в простейшем случае требуются
- 20. Денатурация ДНК - получение двух однонитевых фрагментов
- 21. Денатурация при 94—96 °C Отжиг при
- 22. Количественная ПЦР или ПЦР в реальном времени
- 23. Регистрируется количественное накопление продукта в реальном времени,
- 25. Исп-т 2 пары праймеров для уменьшения кол-ва
- 27. Дает возм-ть амплифицировать уч-ки ДНК, фланкирующие область
- 28. Метод заключается в последовательном сочетании обратной транскрипции
- 29. Одновременно используют более одной пары олигонуклеотидных праймеров,
- 30. Исп-т если в молекуле НК известна последовательность
- 31. Модификация ПЦР для амплификации протяженных участков ДНК
- 32. Вариант ПЦР, при котором концентрация одного из
- 33. С помощью этого подхода уменьшают влияние неспецифического
- 34. Метод молекулярных колоний (ПЦР в геле, англ.
- 35. SSO (sequence specific oligonucleotide) — неспецифическая амплификация
- 36. Гель-электрофорез Дот-блот-гибридизация Блот-гибридизация по Саузерну Секвенирование Олигонуклеотидные
- 37. Причины ложноположительных результатов: Контаминация от пробы к
- 38. История исследования связи антигенов системы HLA с
- 39. Рецепторная - молекулы HLA могут служить специфическими
- 40. Генетическая гипотеза - возможность плейотропного (множественного) эффекта
- 41. еще далеко не исчерпан круг заболеваний, для
- 43. Пересадка между сиблингами, т.е. между индивидуумами, связанных
- 44. Спасибо за внимание
Слайд 2MHC – комплекс тесно сцепленных генетических локусов и кодируемых ими молекул,
Особенности HLA-системы:
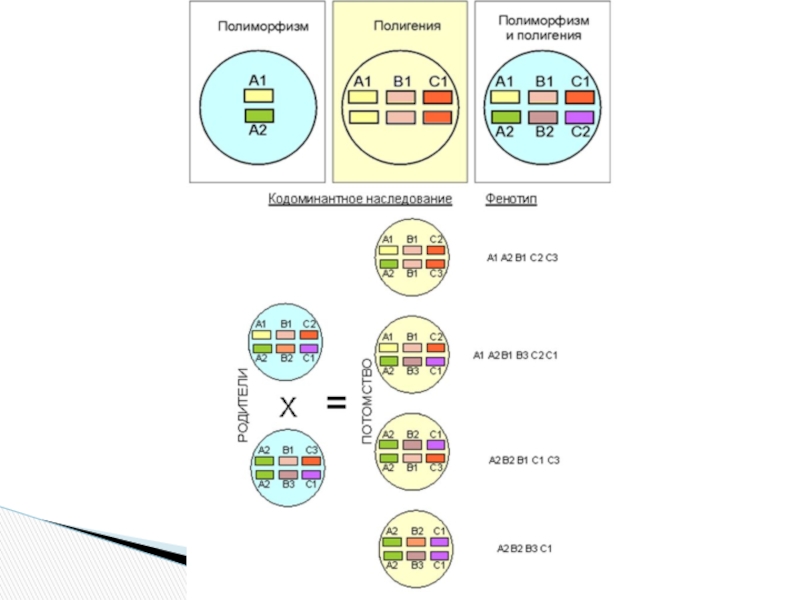
Полигенная система (более 200 генов)
Полиморфная система генов (ок. 2478 аллельных вариантов)
Кодоминантный тип наследования
MHC (HLA) - система
Слайд 7Презентация АГ Т-лимфоцитам
Селекция и обучение ЛФ в отношении «своего» и «чужого»
Взаимодействие
Генетический контроль иммунного ответа
Формирование имм.толерантности в период беременности к полуаллогенному плоду
Обеспечение выживания человека в условиях экзогенной и эндогенной агрессии за счет высокой степени полиморфизма
Функции HLA
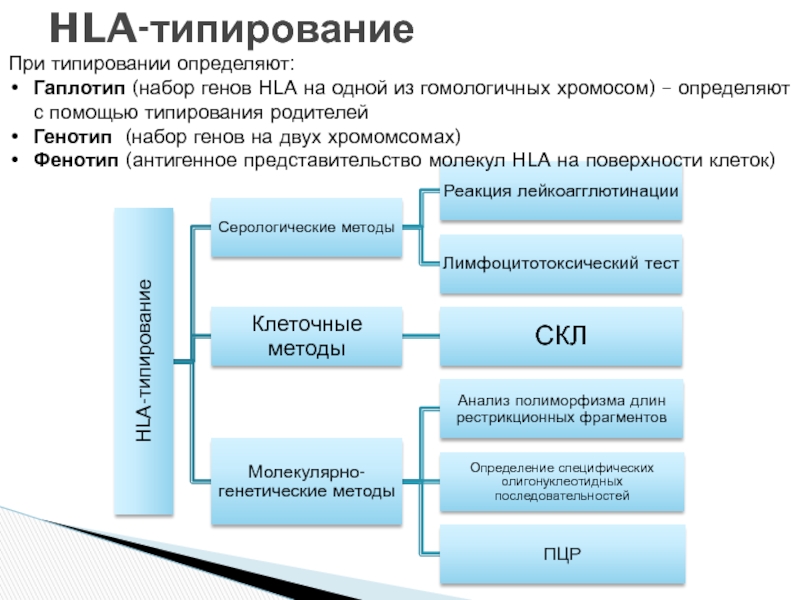
Слайд 8HLA-типирование
При типировании определяют:
Гаплотип (набор генов HLA на одной из гомологичных хромосом)
Генотип (набор генов на двух хромомсомах)
Фенотип (антигенное представительство молекул HLA на поверхности клеток)
Слайд 9Это метод определения тканевой совместимости донора и реципиента, основанный на феномене
Постановка:
Ряд разведений исследуемой сыворотки реципиента
Добавление взвеси лейкоцитов донора
Встряхивание и инкубация
Центрифугирование
Удаление супернатанта и лизис э/ц уксусной кислотой
Мазок для микроскопирования
Реакция лейкоагглютинации
Слайд 10Выраженность агглютинации:
интенсивная, т.е. крупные агломераты, значительная площадь свободной жидкости ++++
выраженная -
средняя - среди взвешенных клеток выявляются островки агглютинатов ++
слабая мелкоглыбчатая - преобладают свободные клетки, но встречаются небольшие комочки склеившихся клеток +
Разведение сыворотки, в которой еще отмечается агглютинация
Минусы:
Низкая воспроизводимость рез-ов
Неспецифическая агглютинация
Спонтанная агглютинация при высокой концентрации нежизнеспособных Лц
Учет реакции лейкоагглютинации
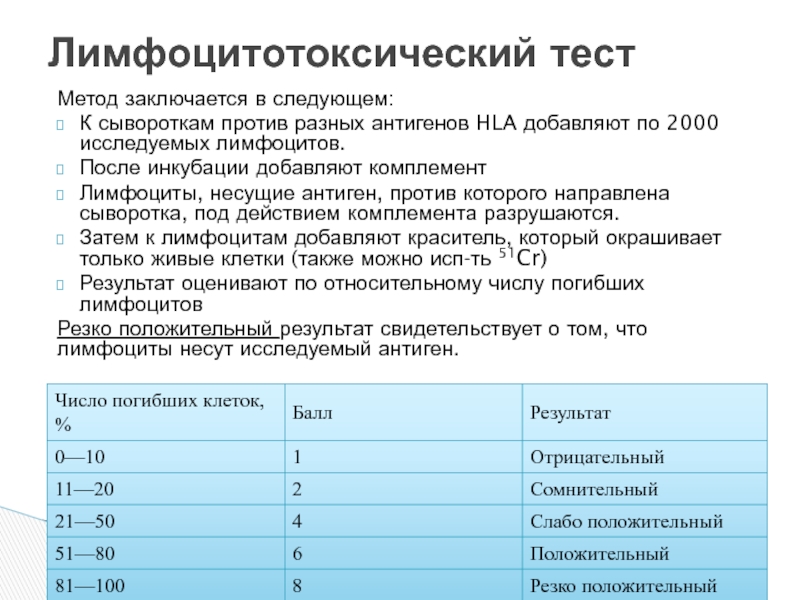
Слайд 11Метод заключается в следующем:
К сывороткам против разных антигенов HLA добавляют по
После инкубации добавляют комплемент
Лимфоциты, несущие антиген, против которого направлена сыворотка, под действием комплемента разрушаются.
Затем к лимфоцитам добавляют краситель, который окрашивает только живые клетки (также можно исп-ть 51Cr)
Результат оценивают по относительному числу погибших лимфоцитов
Резко положительный результат свидетельствует о том, что лимфоциты несут исследуемый антиген.
Лимфоцитотоксический тест
Слайд 12Применяют в основном для определения HLA II класса
В качестве «-» контроля
В качестве «+» контроля - культура отвечающих клеток, стимулированных смесью лимфоцитов от разных доноров
Если радиоак-ть в СКЛ > радиоак-ти в «-» контроле не более чем на 20% или составляет не более 20% от радиоак-ти в «+» контроле, считают, что донор и реципиент совместимы по антигенам HLA
СКЛ
Слайд 13В настоящее время молекулярно- генетические методы используются только для типирования генов
Анализ полиморфизма длин рестрикционных фрагментов
Определение специфических олигонуклеотидных последовательностей
ПЦР
Молекулярно-генетические методы
Слайд 14Метод основан на способности бактериальных эндонуклеаз расщеплять ДНК в сайтах рестрикции
Длину рестрикционных фрагментов оценивают методом гибридизации ДНК на твердой подложке
I. Анализ полиморфизма длин рестрикционных фрагментов
Слайд 15Постановка:
Фрагменты ДНК, полученные после ее обработки эндонуклеазами, разделяют с помощью электрофореза
Перенос на нитроцеллюлозную мембрану и инкубация с мечеными фрагментами ДНК, комплементарными уникальным нуклеотидным последовательностям какого-либо аллеля гена HLA
Выявление фрагментов, с которыми связались меченые фрагменты ДНК, и определение их длины (по длине пробега фрагментов ДНК в геле)
Учет:
По длине фрагментов судят о присутствии тех или иных аллелей HLA у исследуемого
Если у донора и реципиента выявляются фрагменты одинаковой длины, считается, что они несут одинаковый аллель HLA
Слайд 16Недостатки метода:
большие затраты времени (обычно 2-3 нед);
невозможность различить аллели, сайты рестрикции
большое количество клеток для исследования (для получения достаточного количества ДНК необходимо по крайней мере 10-15 млн клеток);
отсутствие эндонуклеаз, специфичных для определенных аллелей.
Слайд 17Аллели генов HLA иногда отличаются друг от друга лишь по одной
Синтезированы одноцепочечные олигонуклеотидные зонды, состоящие из 19-24 нуклеотидов, полностью комплементарные уникальным последовательностям каждого известного аллеля гена HLA
Созданы также зонды, комплементарные общим для нескольких аллелей последовательностям
Т.о., для определения неизвестного аллеля можно последовательно использовать серию зондов разной специфичности
Для гибридизации с олигонуклеотидными зондами можно использовать как рестрикционные фрагменты ДНК, полученные с помощью эндонуклеаз, так и фрагменты ДНК, полученные с помощью полимеразной цепной реакции
II. Определение специфических олигонуклеотидных последовательностей
Слайд 18метод избирательной амплификации, предназначенный для получения большого количества копий фрагментов ДНК
Достоинства метода:
высокая чувствительность
высокая специфичность
прост в исполнении
нет необходимости в сложной очистке матрицы
подходит практически любой материал
Реакция проводится в программируемом термостате – амплификаторе
III. ПЦР
Слайд 19Для проведения ПЦР в простейшем случае требуются следующие компоненты:
ДНК-матрица, содержащая тот
Два праймера, комплементарные концам требуемого фрагмента.
Термостабильная ДНК-полимераза — полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофилов — Thermusaquaticus (Taq-полимераза), Pyrococcusfuriosus (Pfu-полимераза), Pyrococcuswoesei (Pwo-полимераза) и другие.
dNTP (dATP, dGTP, dCTP, dTTP).
Буферный раствор, обеспечивающий необходимые условия реакции —pH, ионную силу раствора. Содержит соли, бычий сывороточный альбумин.
Компоненты реакции
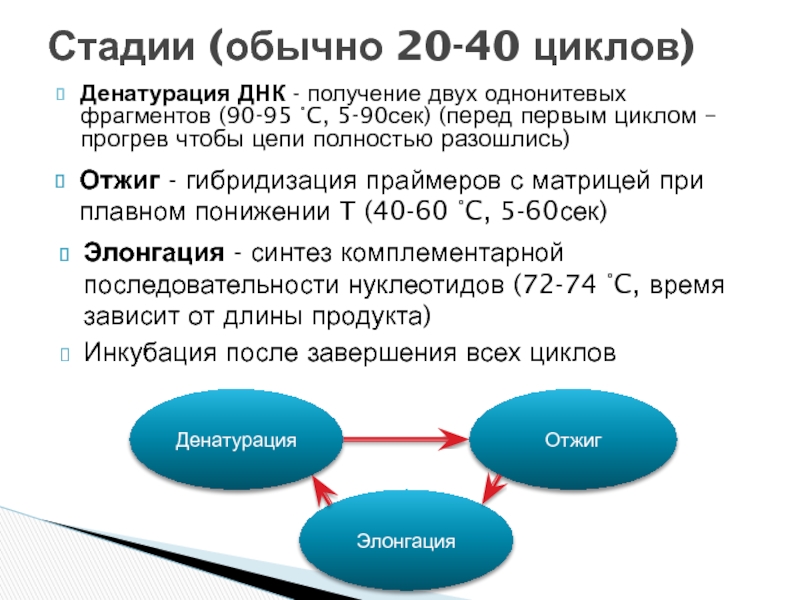
Слайд 20Денатурация ДНК - получение двух однонитевых фрагментов (90-95 °C, 5-90сек) (перед
Стадии (обычно 20-40 циклов)
Денатурация
Элонгация
Отжиг
Отжиг - гибридизация праймеров с матрицей при плавном понижении Т (40-60 °C, 5-60сек)
Элонгация - синтез комплементарной последовательности нуклеотидов (72-74 °C, время зависит от длины продукта)
Инкубация после завершения всех циклов
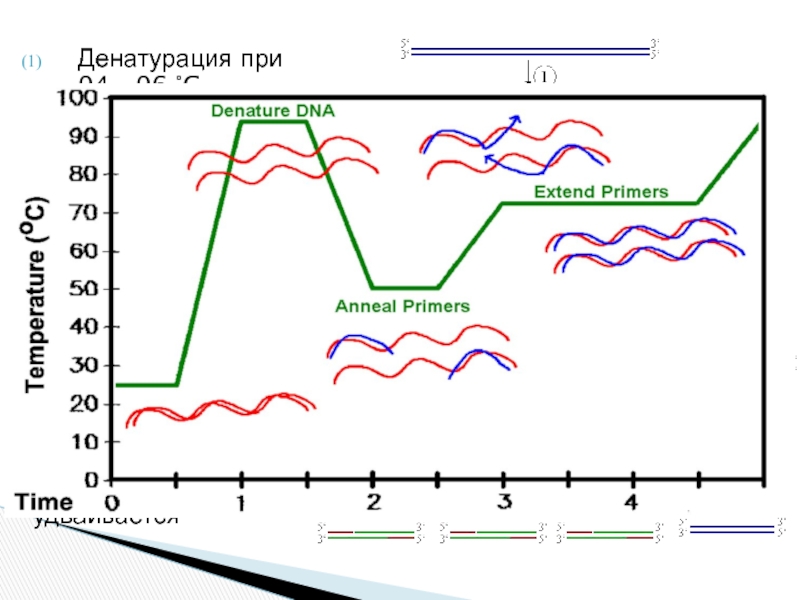
Слайд 21Денатурация при 94—96 °C
Отжиг при 68 °C (например)
Элонгация при
Закончен первый цикл.
Две получившиеся ДНК-цепи служат матрицей для следующего цикла, поэтому количество матричной ДНК в ходе каждого цикла удваивается
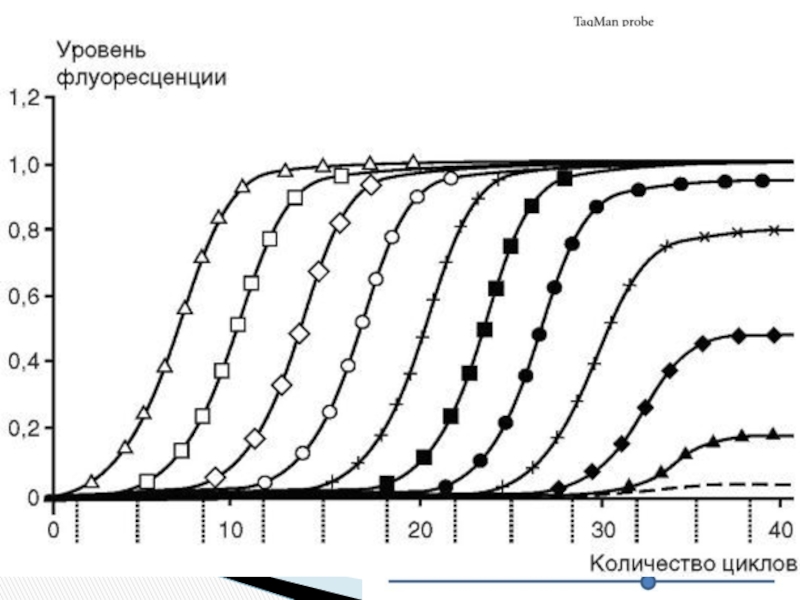
Слайд 22Количественная ПЦР или ПЦР в реальном времени (Q-PCR, RT-PCR)
«Вложенная» ПЦР (Nested
«Инвертированная» ПЦР (Inverse PCR)
ПЦР с обратной транскрипцией (Reverse Transcription PCR, RT-PCR)
Мультипраймерная полимеразная цепная реакция ПЦР (multiplex PCR, multiprimer PCR)
Заякоренная ПЦР
ПЦР длинных фрагментов (Long-range PCR)
Ассиметричная ПЦР (Asymmetric PCR)
Touchdown (Stepdown) ПЦР
Метод молекулярных колоний (ПЦР в геле, Polony - PCR Colony)
RAPD PCR (RandomAmplification of Polymorphic DNA PCR) ПЦР со случайной амплификацией полиморфной ДНК
ПЦР с использованием горячего старта (Hot-start PCR)
Виды ПЦР
Слайд 23Регистрируется количественное накопление продукта в реальном времени, т.е. после каждого цикла
Т.о.
Для этого исп-я специфические комп-ты:
- флуоресцентный интеркалирующий краситель (SYBR-green)
- гибридизационные зонды (метод «TaqMan») - добавляют олигонуклеотидный зонд, меченный по 5'-концу флюорофором и содержащий глушитель флуоресценции, в ходе реакции термостабильная Taq-полимераза вытесняет зонд из дуплекса, а затем отщепляет его 5'-концевой нуклеотид, меченный флуорофором (светится, если отделен от глушителя)
Real time-PCR
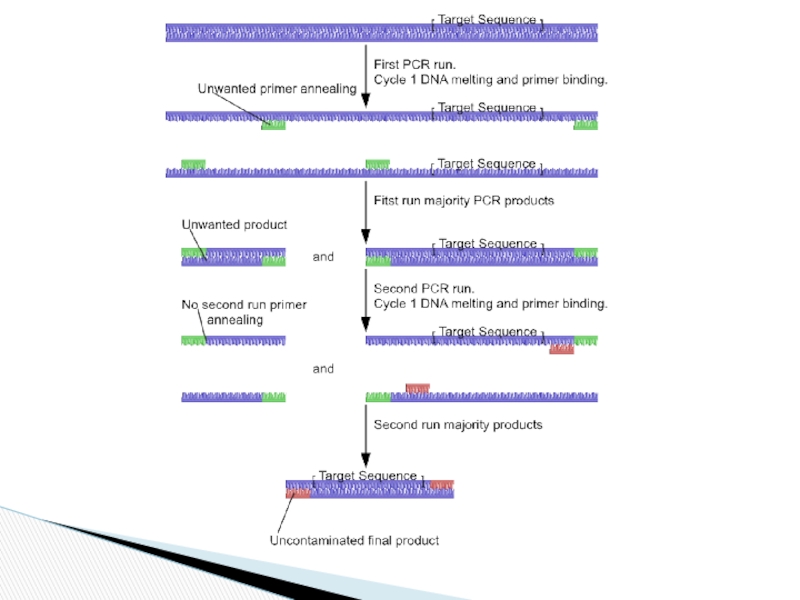
Слайд 25Исп-т 2 пары праймеров для уменьшения кол-ва побочных продуктов
Вторая пара амплифицирует
«Вложенная» ПЦР (Nested PCR)
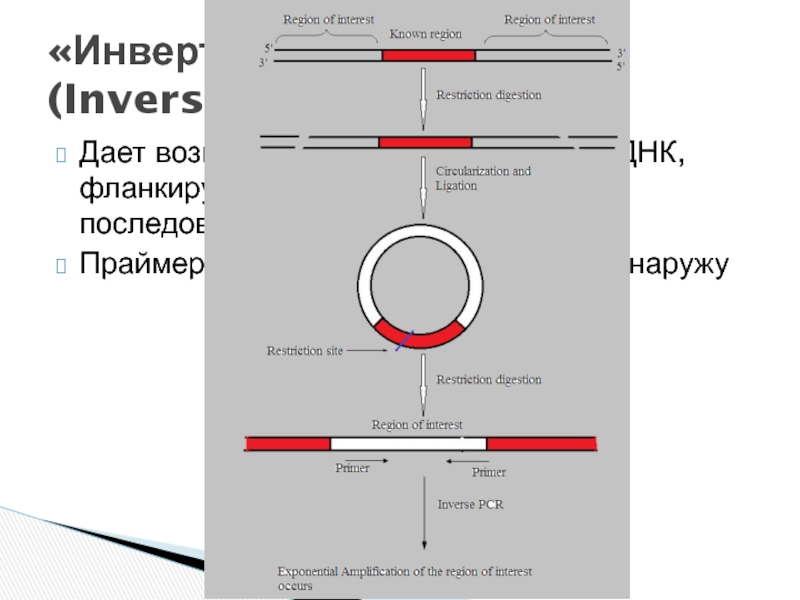
Слайд 27Дает возм-ть амплифицировать уч-ки ДНК, фланкирующие область с известной последовательностью
Праймеры ориентированы
«Инвертированная» ПЦР (Inverse PCR)
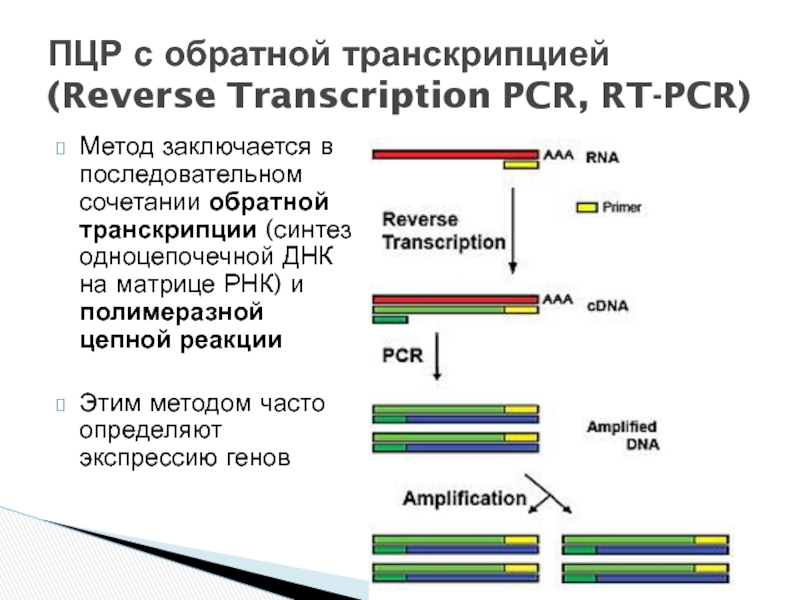
Слайд 28Метод заключается в последовательном сочетании обратной транскрипции (синтез одноцепочечной ДНК на
Этим методом часто определяют экспрессию генов
ПЦР с обратной транскрипцией (Reverse Transcription PCR, RT-PCR)
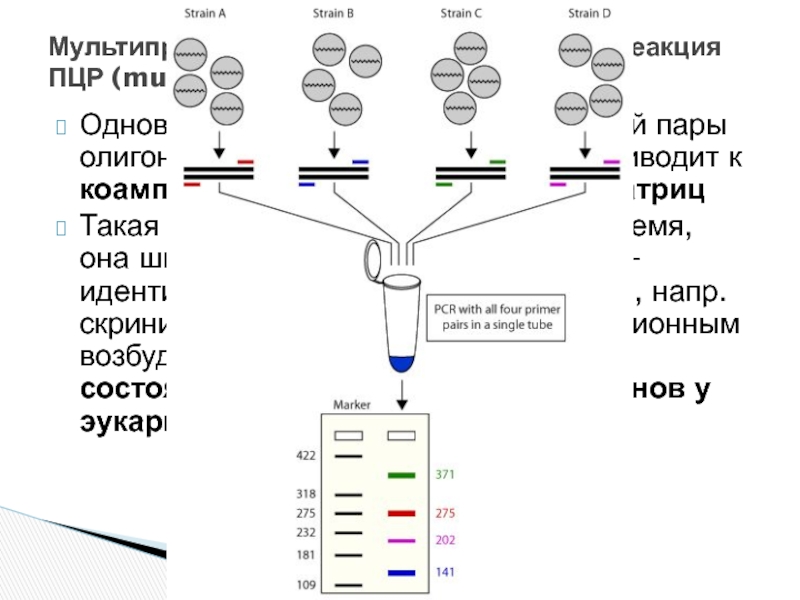
Слайд 29Одновременно используют более одной пары олигонуклеотидных праймеров, что приводит к коамплификации
Такая реакция позволяет экономить время, она широко используется для экспресс-идентификации инфекционных агентов, напр. скрининга сразу по нескольким инфекционным возбудителям, или для исследования состояния нескольких аллельных генов у эукариотических организмов
Мультипраймерная полимеразная цепная реакция ПЦР (multiplex PCR, multiprimer PCR)
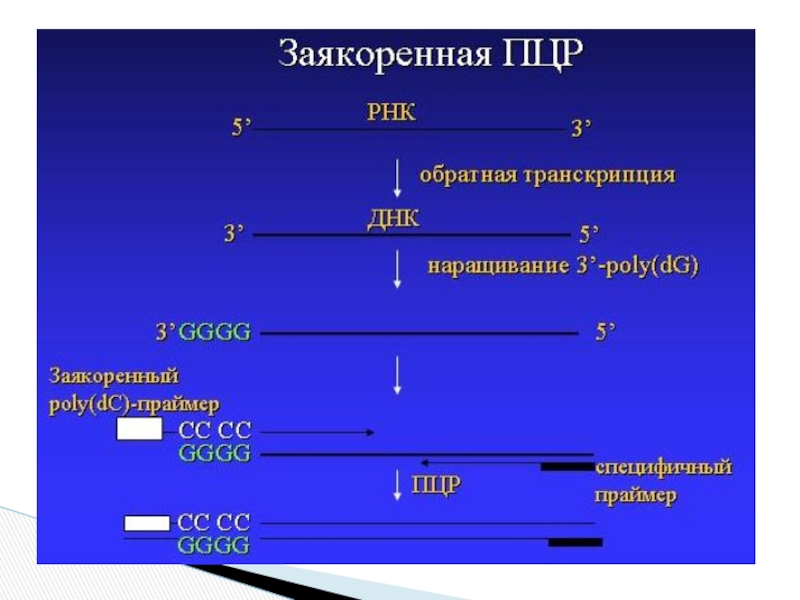
Слайд 30Исп-т если в молекуле НК известна последовательность лишь для одного из
Принцип:
РНК?ДНК, к 3’-концу которой присоединяют поли(dG)-блок с пом-ю терминальной трансферазы
Амплификацию проводят при участии «заякореннго» праймера, сод-го поли(dC)-послед-ть, и специфичного праймера
Заякоренная ПЦР
Слайд 31Модификация ПЦР для амплификации протяженных участков ДНК (10 тысяч и более
Используют смесь двух полимераз, одна из которых — Taq-полимераза с высокой процессивностью (то есть, способная за один проход синтезировать длинную цепь ДНК), а вторая — ДНК полимераза с 3'-5' экзонуклеазной активностью, обычно это Pfu полимераза
Вторая полимераза необходима для того, чтобы корректировать ошибки, внесённые первой
ПЦР длинных фрагментов (Long-range PCR)
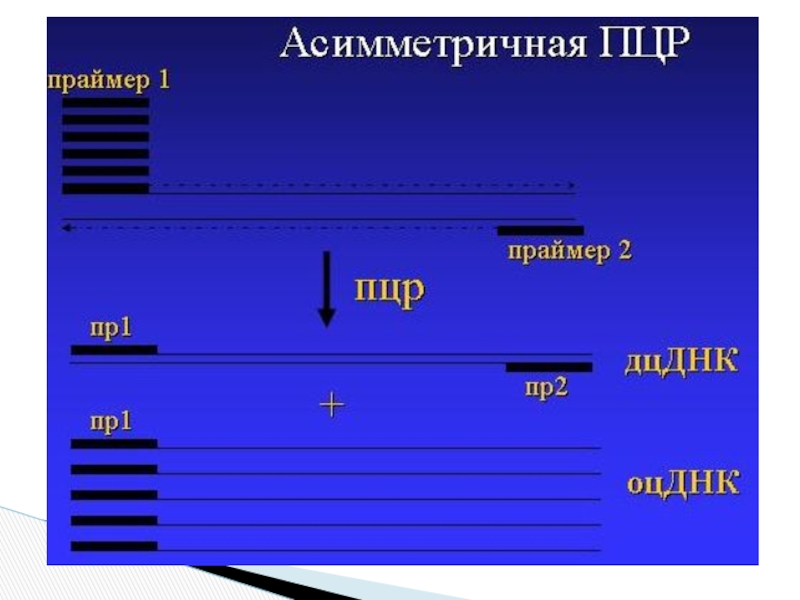
Слайд 32Вариант ПЦР, при котором концентрация одного из двух праймеров очень низка,
С этого момента синтез ДНК продолжается с одного праймера и нарабатываются одноцепочечные фрагмены ДНК
Проводится тогда, когда нужно амплифицировать преимущественно одну из цепей исходной ДНК
Используется в некоторых методиках секвенирования ДНК и гибридизационного анализа
Ассиметричная ПЦР (Asymmetric PCR)
Слайд 33С помощью этого подхода уменьшают влияние неспецифического связывания праймеров
Первые циклы проводят
Это делается для того, чтобы праймер гибридизовался с комплементарной цепью всей своей длиной; тогда как при оптимальной температуре отжига, праймер частично гибридизуется с комплементарной цепью.
Touchdown (Stepdown) ПЦР
Слайд 34Метод молекулярных колоний (ПЦР в геле, англ. Colony - PCR Colony)
ПЦР с использованием горячего старта (Hot-start PCR) — вариант полимеразной цепной реакции для предотвращения неспецифической амплификации фрагментов ДНК (в одном из вариантов метода для этой цели первоначально ДНК-полимеразу и реакционную смесь разделяют легкоплавким физическим барьером (напр., воском); при нагревании пробирки переход ДНК-полимеразы в реакционную смесь происходит при температуре около 55 °С)
Слайд 35SSO (sequence specific oligonucleotide) — неспецифическая амплификация исследуемого участка (локуса) ДНК
RFLP (restriction fragment length polymorphism) — неспецифическая амплификация с последующим расщеплением продуктов амплификации набором рестриктаз. По длине полученных продуктов судят о нуклеотидном составе.
SSCP (single-strand conformation polymorphism) — различие аллелей по электрофоретической подвижности одноцепочечных ДНК, обусловленной характерными элементами вторичной структуры.
SSP (sequence specific primer) — наиболее распространенная и технически простая методика, когда каждому аллельному варианту либо группе аллелей соответствует своя пара праймеров.
MSSP (mixture of sequence specific primer, новый вариант SSP) — позволяющая за счет более рационального выбора праймеров и режимов амплификации выявить сразу несколько специфичностей, используя одну пробирку и одну дорожку на геле. Длительность определения — около часа.
Методы ПЦР применительно к генотипированию HLA
Слайд 36Гель-электрофорез
Дот-блот-гибридизация
Блот-гибридизация по Саузерну
Секвенирование
Олигонуклеотидные зонды
Чаще всего используется самый простой метод – гель-электрофорез
Детекция
Слайд 37Причины ложноположительных результатов:
Контаминация от пробы к пробе
Контаминация продуктами амплификации
Для исключения ложноположительных
Положительный (образец содержит специфичную последовательность)
Отрицательный (не содержит последовательность -мишень)
Контаминация
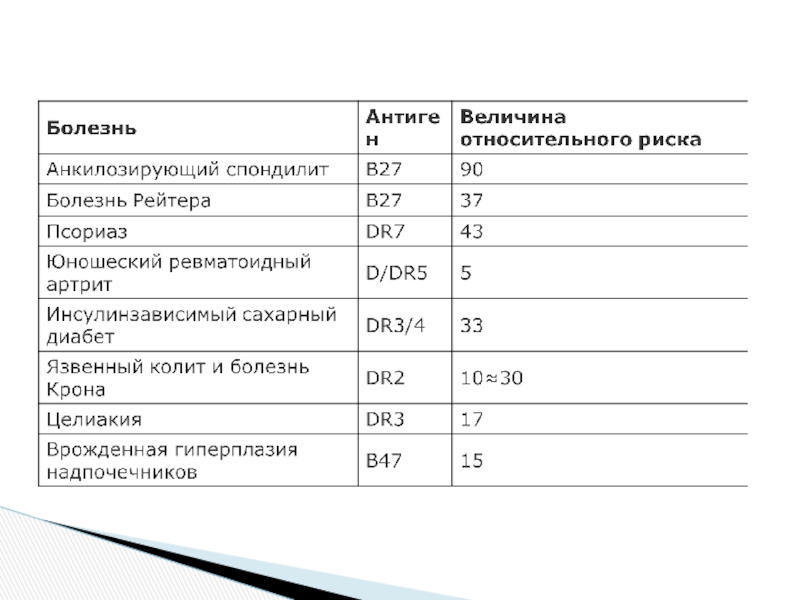
Слайд 38История исследования связи антигенов системы HLA с некоторыми заболеваниями включает два
Первый состоит из исследований связи между локусами А и В и болезнями (антигены локуса В чаще связаны с предрасположенностью к заболеваниям)
Второй этап включает изучение связей заболеваний с антигенами DR-локуса (при многих изученных ранее болезнях связь с локусом DR более высока, чем ранее выявленная для локусов А и В)
Связь HLA c болезнями
Слайд 39Рецепторная - молекулы HLA могут служить специфическими рецепторами для этиологических агентов
Молекулярная
Разрушение или модификация антигена HLA как результат воздействия инфекционного агента, лекарства и внешнесредового фактора
Гипотеза поврежденного «своего» - определенные молекулы гистосовместимости способны опосредовать презентацию собственных антигенов аутореактивным Т-хелперам
Существуют несколько гипотез, объясняющих ассоциацию локуса HLA с болезнью:
Слайд 40Генетическая гипотеза - возможность плейотропного (множественного) эффекта генов иммунорезистентности – сцепленные
Гипотеза влияния неклассических локусов генов гистосовместимости (речь идет о молекулах HLA III) – в частности, известно, что дефицит С1, С2 и С4 компонентов комплемента обуславливает развитие системной красной волчанки и мембранопролиферативного гломерулонефрита, а молекулярная мимикрия между хламидийными и собственными белками теплового шока является одним из аутоиммунных механизмов прогрессирования атеросклероза.
Слайд 41еще далеко не исчерпан круг заболеваний, для которых можно предполагать существование
механизмы уже найденных ассоциаций до сих пор остаются не до конца выясненными;
многочисленные наблюдения свидетельствуют о том, что HLA - антигены могут быть ассоциированы не с заболеванием, как нозологической единицей, а лишь с его отдельными клиническими формами течения.
Интерес к этой проблеме не ослабевает. Это объясняется по меньшей мере 3 обстоятельствами:
Слайд 43Пересадка между сиблингами, т.е. между индивидуумами, связанных братско-сестринским родством. Вероятность
Пересадка между родителем и ребенком. Вероятность значительно ниже. В худшем варианте ребенок получит половину антигенов от каждого из родителей.
Пересадка между индивидами, не связанными кровным родством, вероятность идентичности очень мала
Подбор донора