- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Хинолин, изохинолин, акридин. (Леция 6) презентация
Содержание
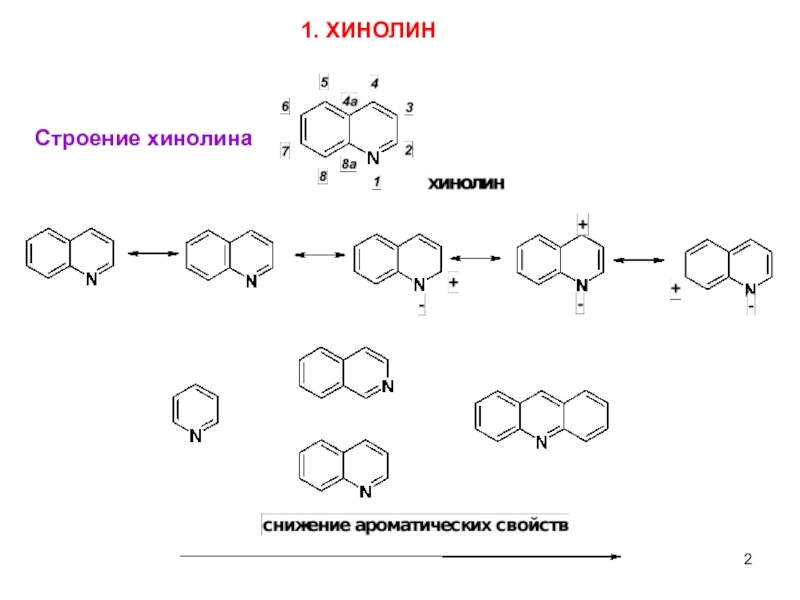
- 1. Хинолин, изохинолин, акридин. (Леция 6)
- 2. 3
- 3. 4
- 4. 6
- 5. Химические свойства хинолина Основные свойства Алкилирование Взаимодействие с кислотами Льюиса (BF3, SO3 и др.)
- 6. 9
- 7. 12
- 8. 13
- 9. 14
- 10. 3
- 12. Сотрудниками ВНИХФИ была разработана следующая схема синтеза хиноцида: Хиноцид (6-метокси-8-(4-аминопентил)- аминохинолина дигидрохлорид)
- 13. Синтез акрихина 9-хлоракридин – лакриматор, проблематична его
- 14. 5
- 15. 7
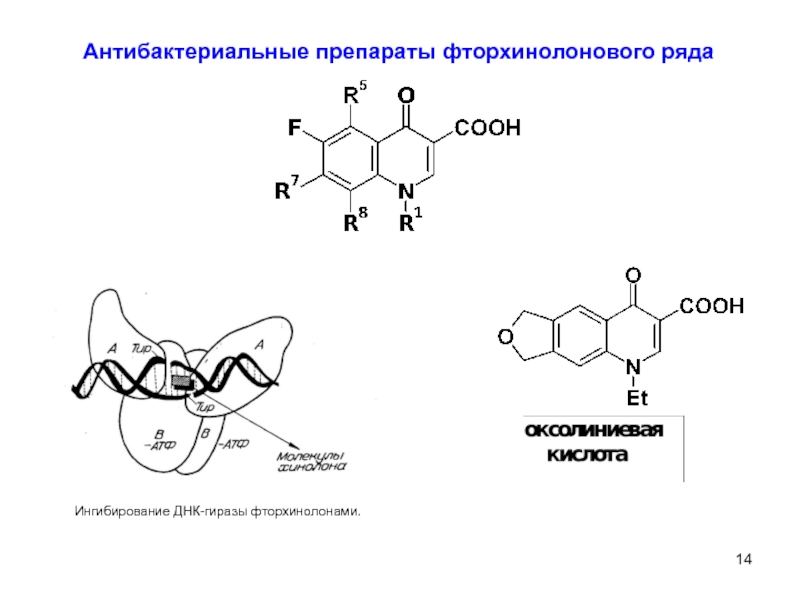
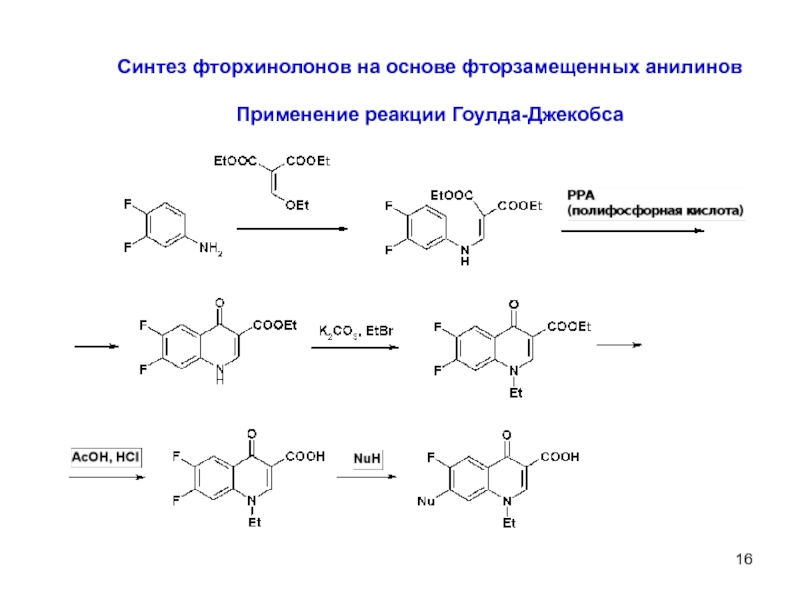
- 16. 8 Синтез фторхинолонов на основе фторзамещенных
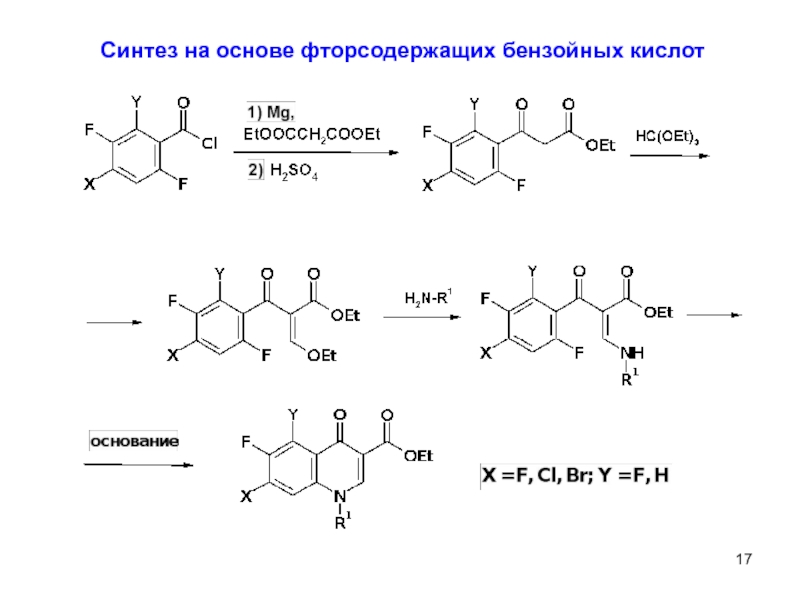
- 17. 9
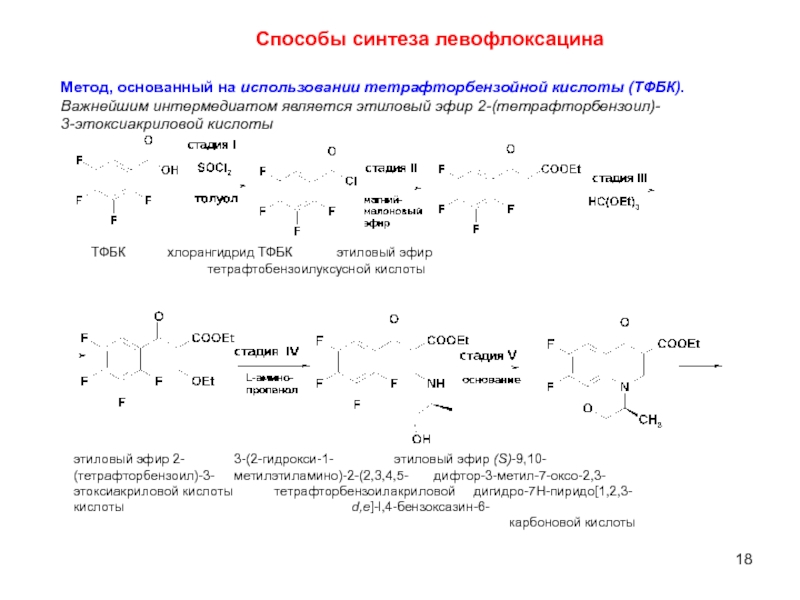
- 18. Способы синтеза левофлоксацина Метод, основанный на использовании
- 19. (S)-9,10-дифтор-3-метил-7-оксо-2,3- (S)-9-фтор-2,3-дигидро-3-метил-10-(4- дигидро-7H-пиридо[1,2,3-d,e]-l,4- метил-1-пиперазинил)-7-оксо-7Н- бензоксазин-6-карбоновая кислота пиридо[1,2,3-d,e]-1,4-бензоксазин-6-
- 20. Конденсация дифторбензоксазина с диэтилэтоксиметилен-малонатом (S)-7,8-дифтор- диэтиловый
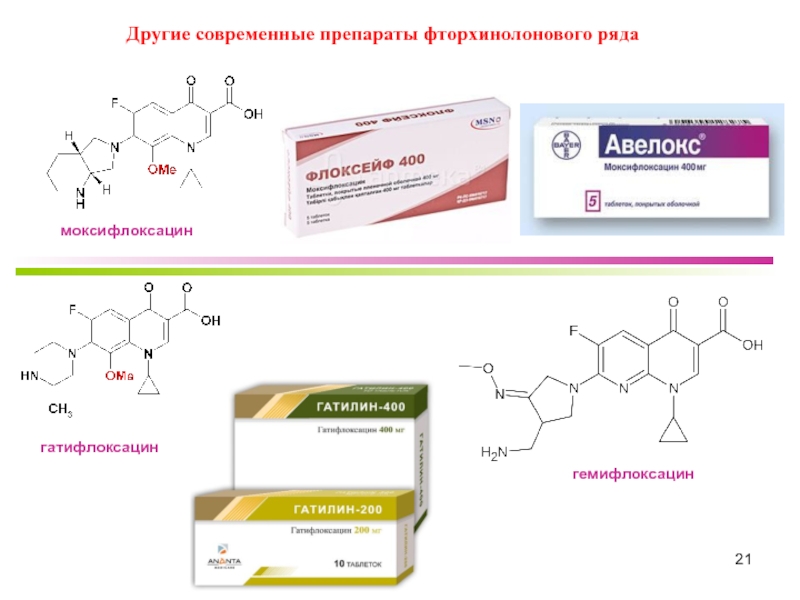
- 21. Другие современные препараты фторхинолонового ряда моксифлоксацин гатифлоксацин гемифлоксацин
- 22. 3
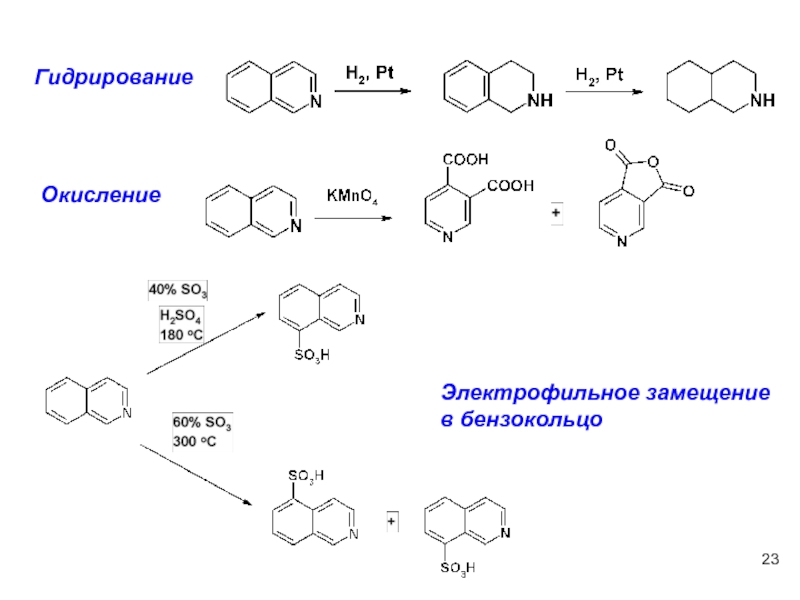
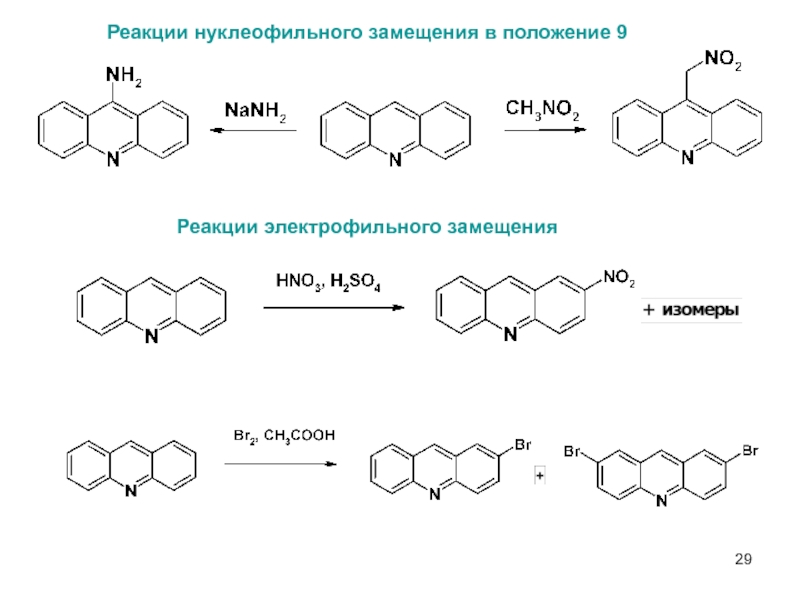
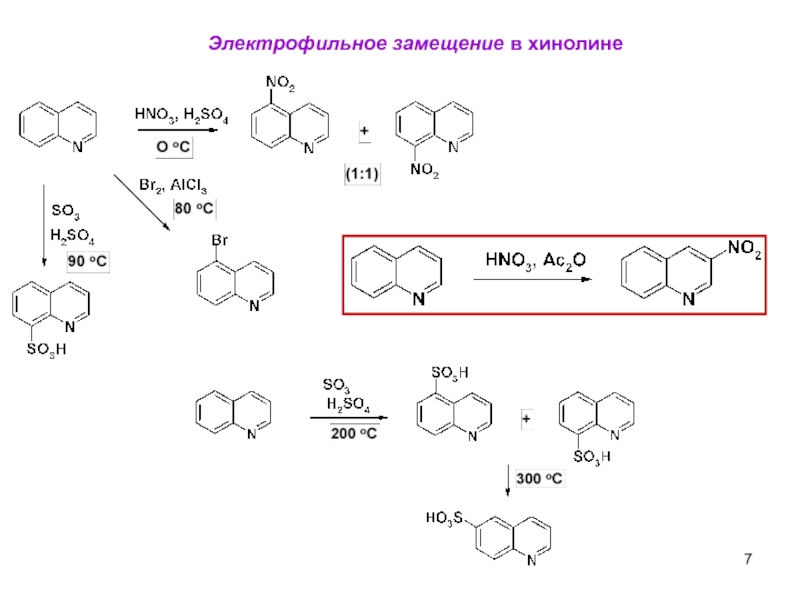
- 23. Гидрирование Окисление Электрофильное замещение в бензокольцо
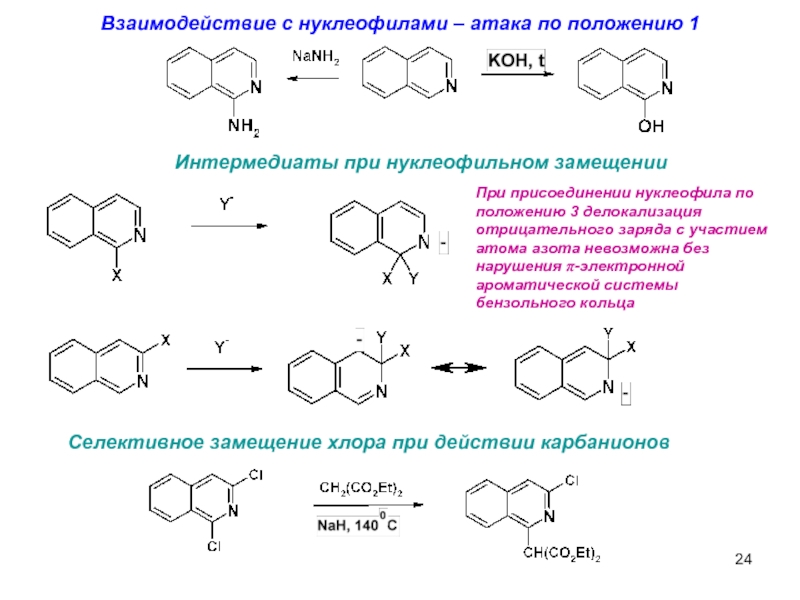
- 24. Взаимодействие с нуклеофилами – атака по положению
- 25. 7
- 26. Синтез папаверина Применяется в качестве эффективного противосудорожного и сосудорасширяющего средства.
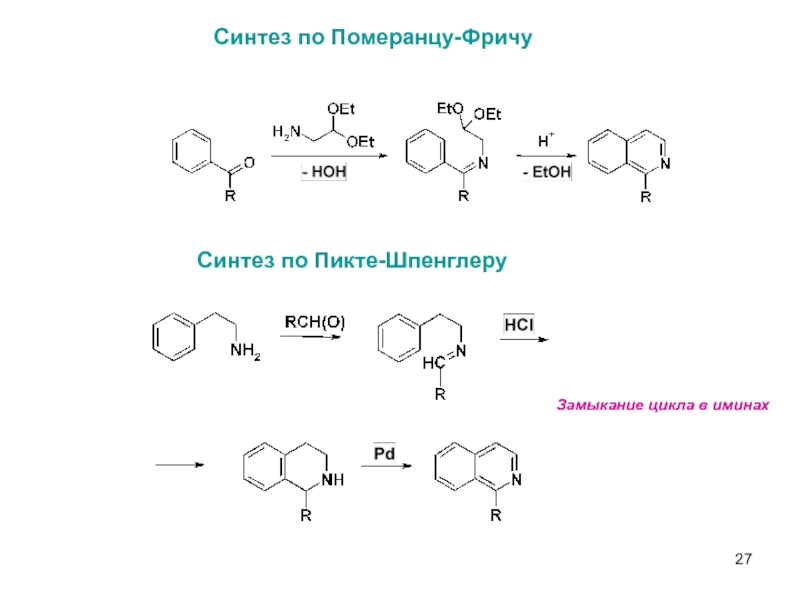
- 27. Синтез по Померанцу-Фричу Синтез по Пикте-Шпенглеру Замыкание цикла в иминах
- 29. 5 Реакции нуклеофильного замещения в положение 9 Реакции электрофильного замещения
- 30. 6
- 31. 18 Курс лекций является частью учебно-методического комплекса
Слайд 34
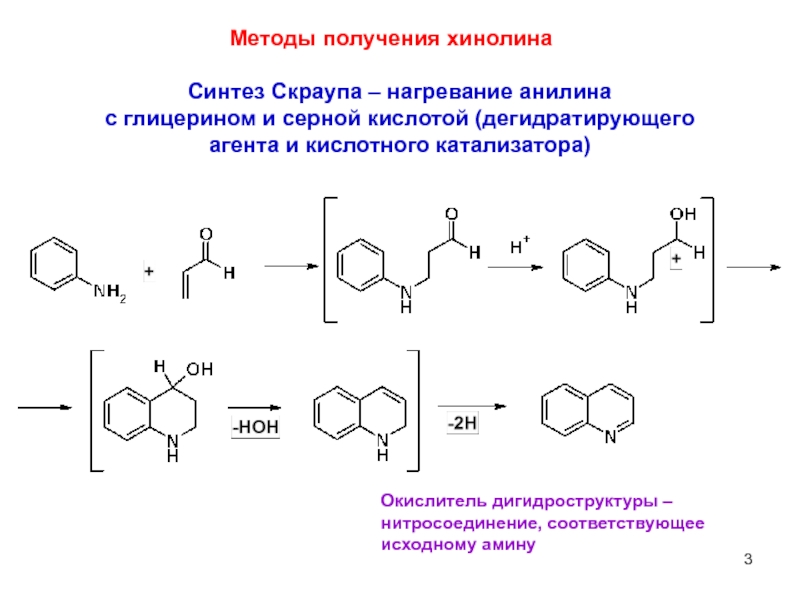
Методы получения хинолина
Синтез Скраупа – нагревание анилина
с глицерином и серной
Окислитель дигидроструктуры –
нитросоединение, соответствующее исходному амину
Слайд 46
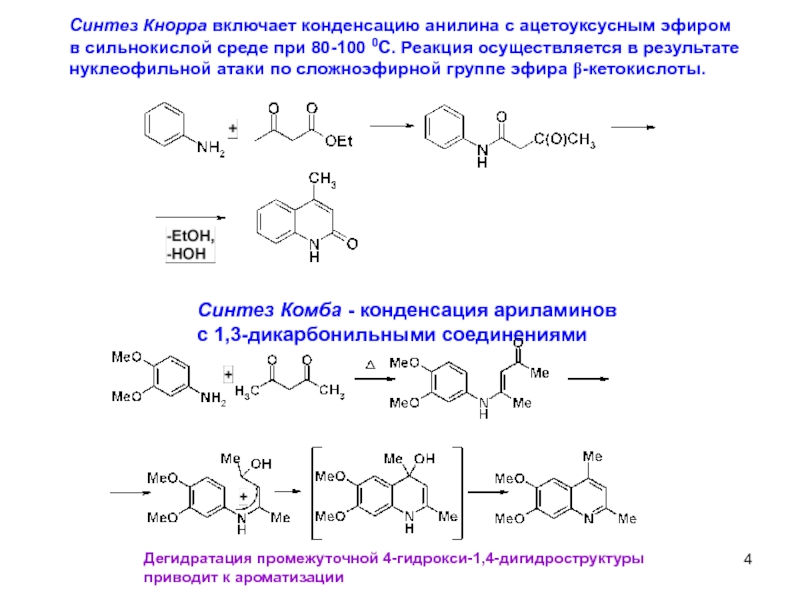
Синтез Кнорра включает конденсацию анилина с ацетоуксусным эфиром
в сильнокислой среде
нуклеофильной атаки по сложноэфирной группе эфира β-кетокислоты.
Синтез Комба - конденсация ариламинов
с 1,3-дикарбонильными соединениями
Дегидратация промежуточной 4-гидрокси-1,4-дигидроструктуры
приводит к ароматизации
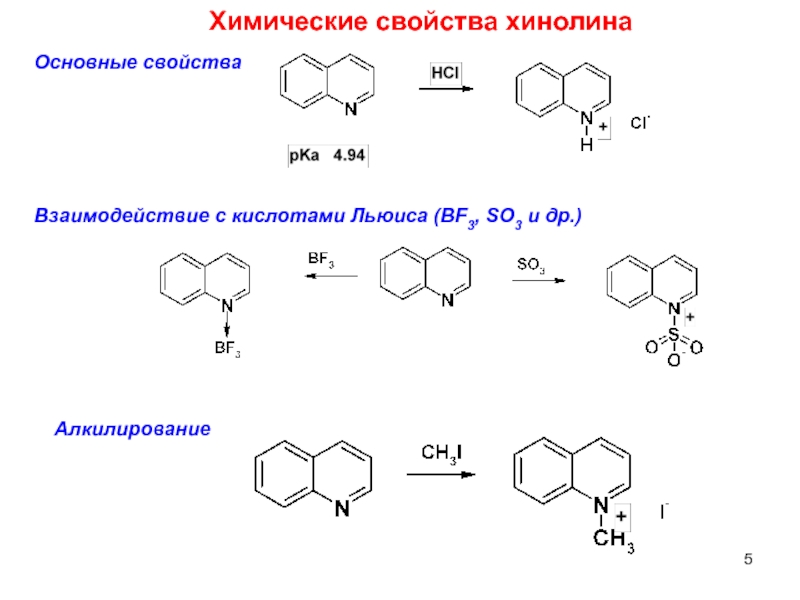
Слайд 5Химические свойства хинолина
Основные свойства
Алкилирование
Взаимодействие с кислотами Льюиса (BF3, SO3 и др.)
Слайд 69
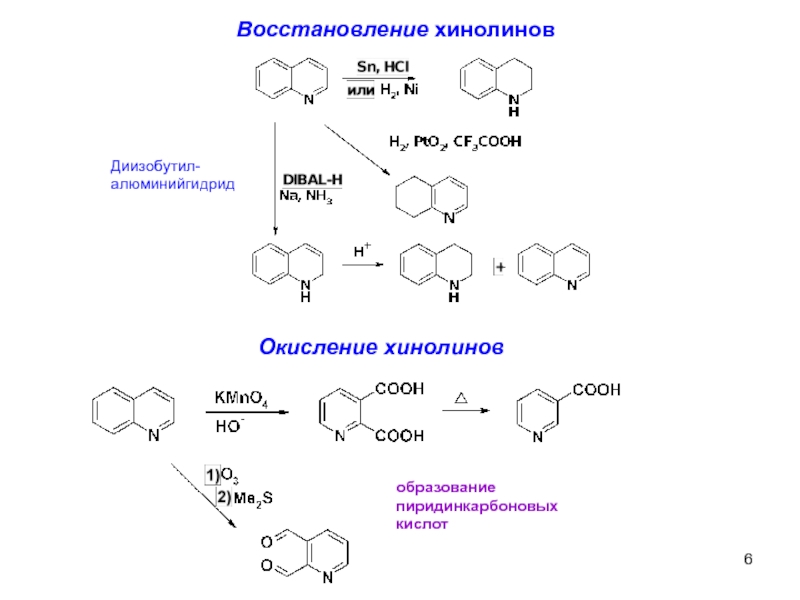
Восстановление хинолинов
Диизобутил-алюминийгидрид
Окисление хинолинов
образование
пиридинкарбоновых
кислот
Слайд 8
13
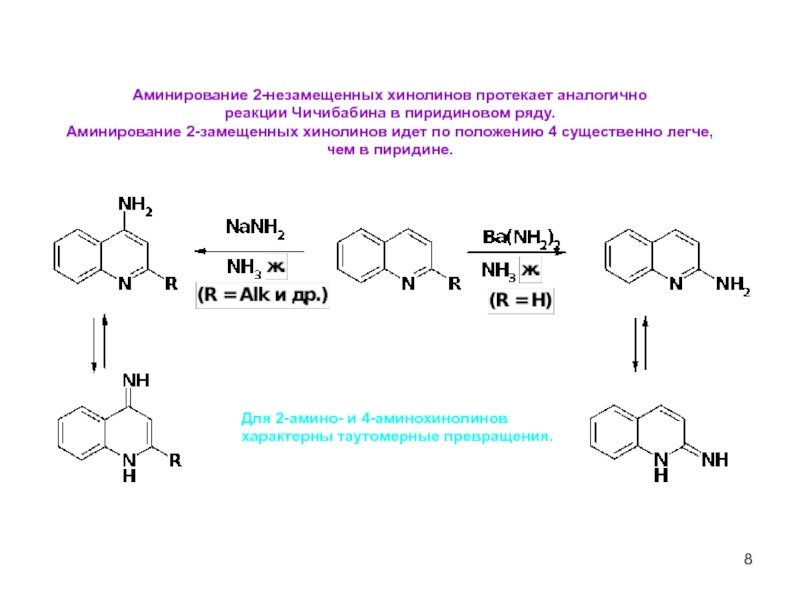
Аминирование 2-незамещенных хинолинов протекает аналогично
реакции Чичибабина в пиридиновом ряду.
Аминирование
чем в пиридине.
Для 2-амино- и 4-аминохинолинов
характерны таутомерные превращения.
Слайд 9
14
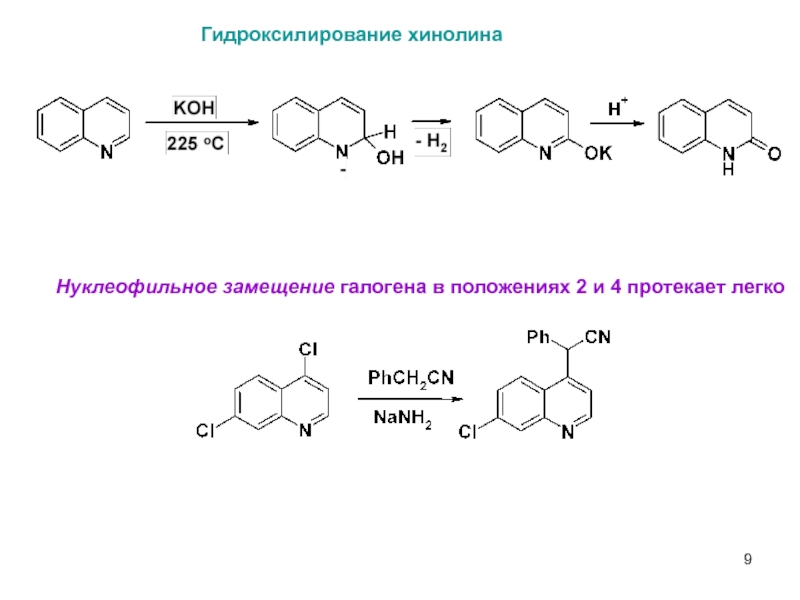
Гидроксилирование хинолина
Нуклеофильное замещение галогена в положениях 2 и 4 протекает
Слайд 103
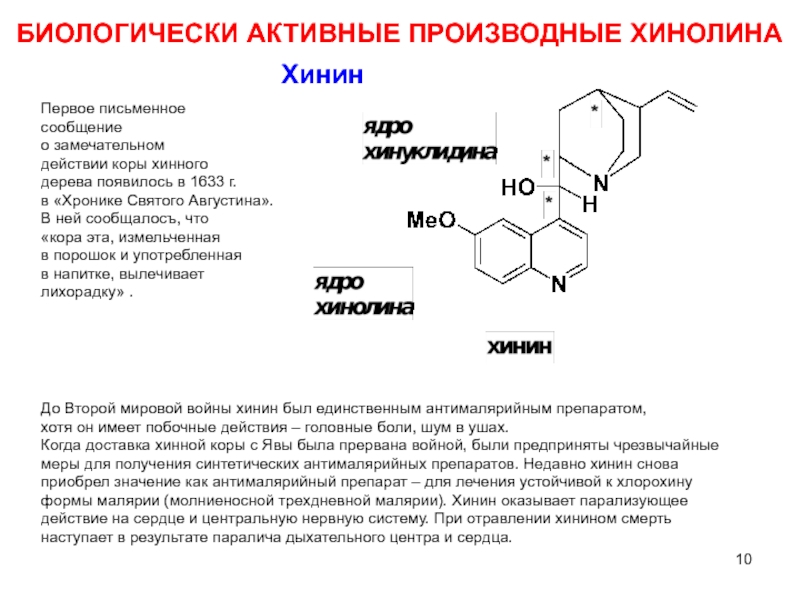
Хинин
До Второй мировой войны хинин был единственным антималярийным препаратом,
хотя он
Когда доставка хинной коры с Явы была прервана войной, были предприняты чрезвычайные
меры для получения синтетических антималярийных препаратов. Недавно хинин снова
приобрел значение как антималярийный препарат – для лечения устойчивой к хлорохину
формы малярии (молниеносной трехдневной малярии). Хинин оказывает парализующее
действие на сердце и центральную нервную систему. При отравлении хинином смерть
наступает в результате паралича дыхательного центра и сердца.
Первое письменное
сообщение
о замечательном
действии коры хинного
дерева появилось в 1633 г.
в «Хронике Святого Августина».
В ней сообщалосъ, что
«кора эта, измельченная
в порошок и употребленная
в напитке, вылечивает
лихорадку» .
БИОЛОГИЧЕСКИ АКТИВНЫЕ ПРОИЗВОДНЫЕ ХИНОЛИНА
Слайд 12
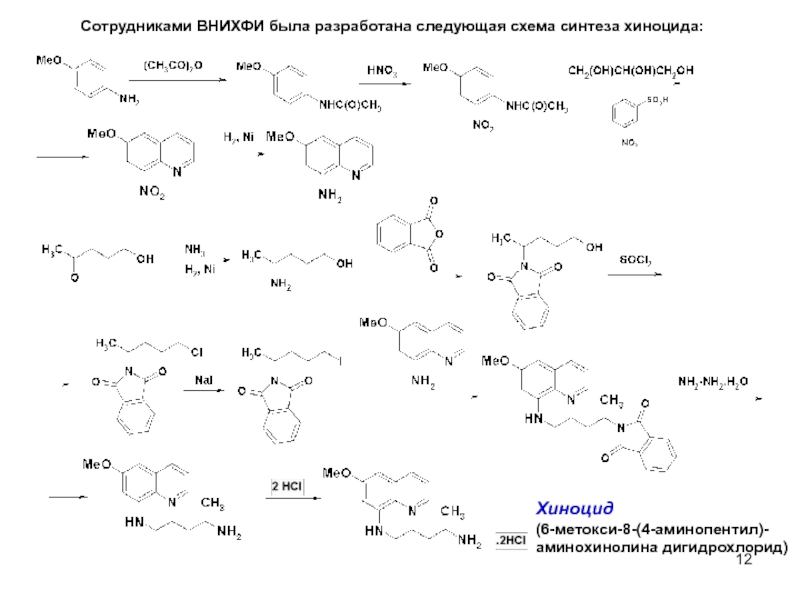
Сотрудниками ВНИХФИ была разработана следующая схема синтеза хиноцида:
Хиноцид
(6-метокси-8-(4-аминопентил)-
аминохинолина дигидрохлорид)
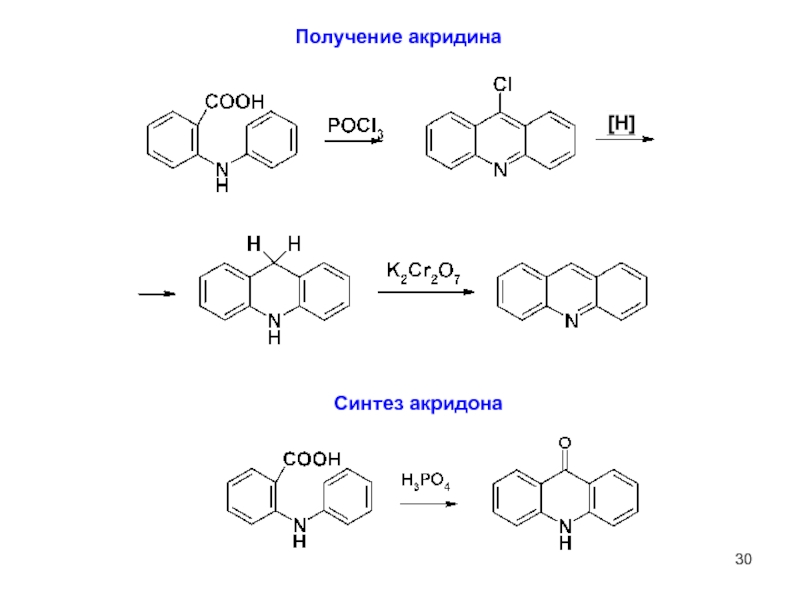
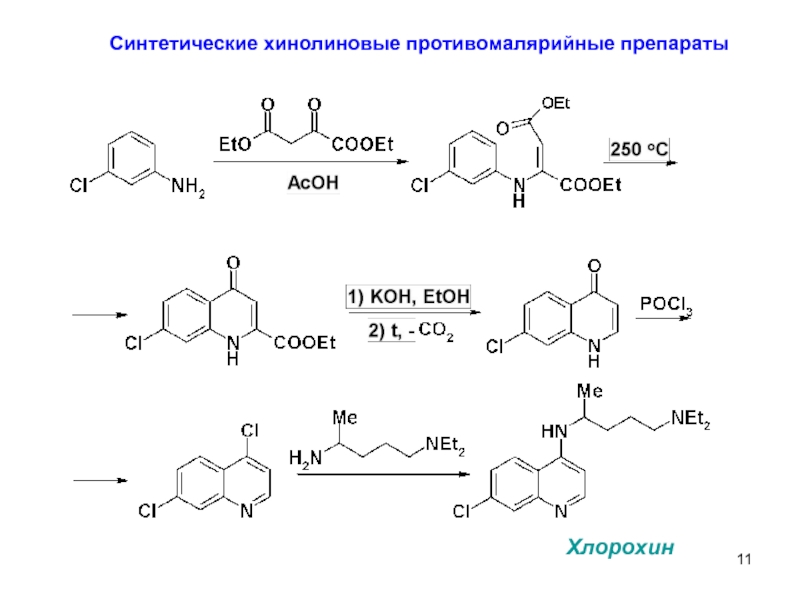
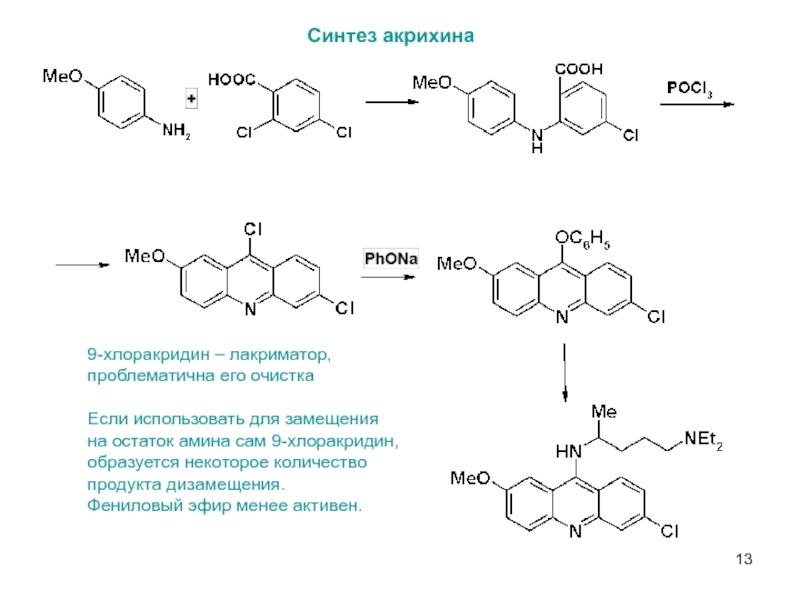
Слайд 13Синтез акрихина
9-хлоракридин – лакриматор,
проблематична его очистка
Если использовать для замещения
на остаток
образуется некоторое количество
продукта дизамещения.
Фениловый эфир менее активен.
Слайд 15
7
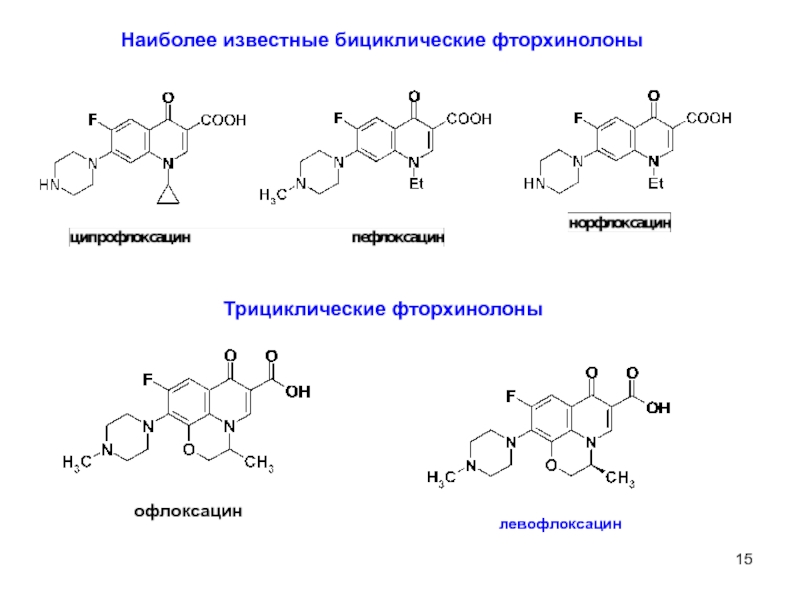
Наиболее известные бициклические фторхинолоны
офлоксацин
левофлоксацин
Трициклические фторхинолоны
Слайд 18Способы синтеза левофлоксацина
Метод, основанный на использовании тетрафторбензойной кислоты (ТФБК).
Важнейшим интермедиатом
3-этоксиакриловой кислоты
ТФБК хлорангидрид ТФБК этиловый эфир
тетрафтобензоилуксусной кислоты
этиловый эфир 2- 3-(2-гидрокси-1- этиловый эфир (S)-9,10-
(тетрафторбензоил)-3- метилэтиламино)-2-(2,3,4,5- дифтор-3-метил-7-оксо-2,3-
этоксиакриловой кислоты тетрафторбензоилакриловой дигидро-7H-пиридо[1,2,3-
кислоты d,e]-l,4-бензоксазин-6-
карбоновой кислоты
Слайд 19
(S)-9,10-дифтор-3-метил-7-оксо-2,3- (S)-9-фтор-2,3-дигидро-3-метил-10-(4-
дигидро-7H-пиридо[1,2,3-d,e]-l,4- метил-1-пиперазинил)-7-оксо-7Н-
бензоксазин-6-карбоновая кислота пиридо[1,2,3-d,e]-1,4-бензоксазин-6-
В зависимости от условий циклизация (стадия V) протекает в один или 2 этапа,
во втором случае выделяют промежуточный продукт – бициклический хинолон.
Слайд 20Конденсация дифторбензоксазина с диэтилэтоксиметилен-малонатом
(S)-7,8-дифтор- диэтиловый эфир этиловый эфир (S)-9,10-
2,3-дигидро-3-метил- 2-(7,8-дифтор-3-метил-2,3- дифтор-3-метил-7-оксо-2,3-
4H-1,4-бензоксазин
илметилен)малоновой d,e]-l,4-бензоксазин-6-
кислоты карбоновой кислоты
Слайд 223
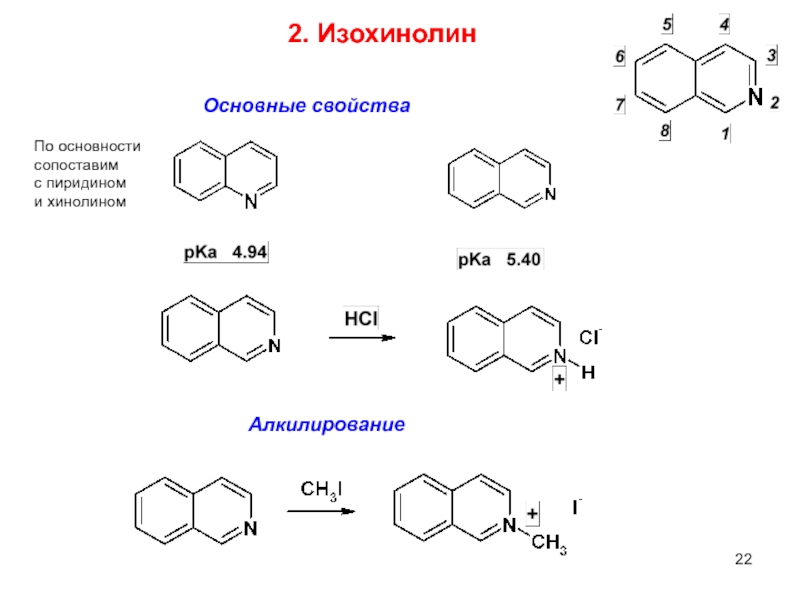
2. Изохинолин
Основные свойства
Алкилирование
По основности сопоставим
с пиридином
и хинолином
Слайд 24Взаимодействие с нуклеофилами – атака по положению 1
Интермедиаты при нуклеофильном замещении
При
Селективное замещение хлора при действии карбанионов
Слайд 257
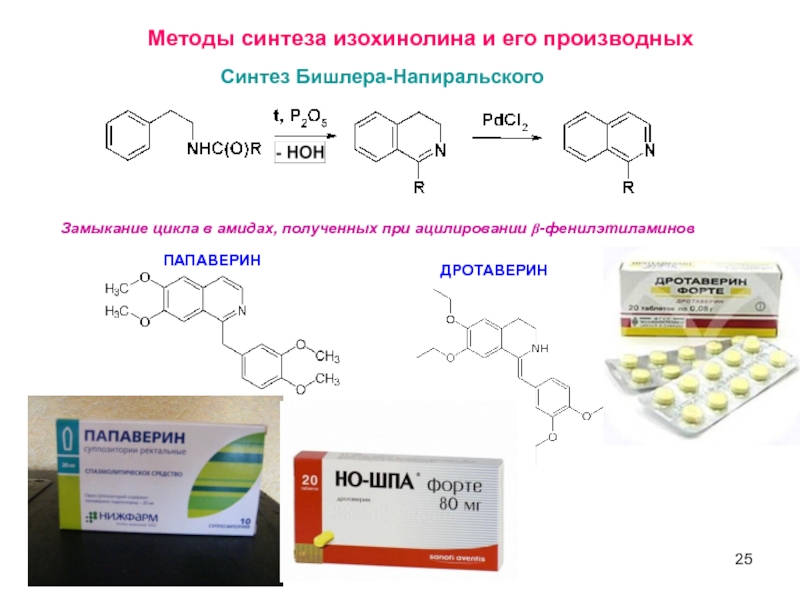
Методы синтеза изохинолина и его производных
Синтез Бишлера-Напиральского
Замыкание цикла в амидах,
ПАПАВЕРИН
ДРОТАВЕРИН
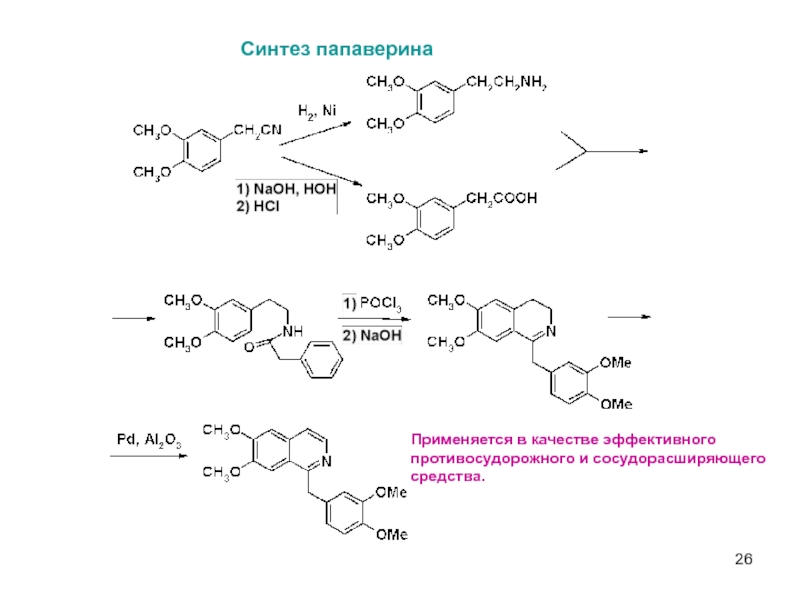
Слайд 26Синтез папаверина
Применяется в качестве эффективного
противосудорожного и сосудорасширяющего
средства.
Слайд 28
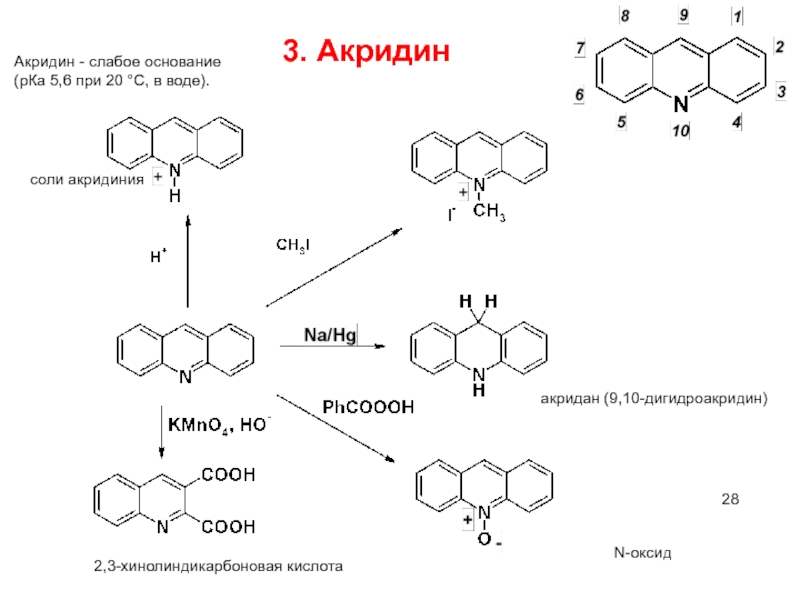
3. Акридин
Акридин - слабое основание
(рКа 5,6 при 20 °С, в
2,3-хинолиндикарбоновая кислота
N-оксид
соли акридиния
акридан (9,10-дигидроакридин)
Слайд 3118
Курс лекций является частью учебно-методического комплекса
«Химия биологически активных веществ»
автор:
Носова
Учебно-методический комплекс подготовлен на кафедре органической химии
химико-технологического института УрФУ
Никакая часть презентации не может быть воспроизведена в какой бы то ни было форме без письменного разрешения авторов

![(S)-9,10-дифтор-3-метил-7-оксо-2,3- (S)-9-фтор-2,3-дигидро-3-метил-10-(4-дигидро-7H-пиридо[1,2,3-d,e]-l,4- метил-1-пиперазинил)-7-оксо-7Н-бензоксазин-6-карбоновая кислота пиридо[1,2,3-d,e]-1,4-бензоксазин-6-](/img/tmb/6/503101/b6f3e4efad07435452abcd18fb5b8d46-800x.jpg)
![Конденсация дифторбензоксазина с диэтилэтоксиметилен-малонатом (S)-7,8-дифтор- диэтиловый эфир этиловый эфир (S)-9,10-2,3-дигидро-3-метил- 2-(7,8-дифтор-3-метил-2,3- дифтор-3-метил-7-оксо-2,3-4H-1,4-бензоксазин дигидро[1,4]бензоксазин-4-](/img/tmb/6/503101/e3a48f577bd7dbef0063e1a2f6d32d24-800x.jpg)