Глава I.
Химический состав клетки
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химический состав клетки. Тема: Строение белков презентация
Содержание
- 1. Химический состав клетки. Тема: Строение белков
- 2. «Живые тела, существующие на Земле, представляют собой
- 3. Из органических веществ клетки по количеству и
- 4. В зависимости от того, могут ли аминокислоты
- 5. Все аминокислоты содержат хотя бы одну карбоксильную
- 6. Аминокислоты
- 7. Нейтральные аминокислоты? Основные аминокислоты? Кислые аминокислоты? Серусодержащие аминокислоты? Аминокислоты
- 8. Структуры белковых молекул
- 9. Выделяют 4 уровня пространственной организации белков. Под
- 10. В организме человека обнаружено порядка 10 тыс.
- 11. Вторичная структура. Основным вариантом вторичной структуры является
- 12. Третичная структура. Глобула, возникающая в результате возникновения
- 13. Структуры белковых молекул
- 14. Четвертичная структура. Характерна для сложных белков, молекулы
- 15. Структуры белковых молекул
- 16. Повторение: Что обозначено на рисунке цифрами 1
- 17. Тест 1. На первом месте по массе
- 18. **Тест 4. Количество незаменимых для человека аминокислот:
- 19. Тест 7. Пептидная связь образуется в результате:
- 20. **Тест 10. Третичную структуру белков стабилизируют: Ковалентные.
Слайд 1Тема: «Строение белков»
Задачи:
Изучить особенности строения белков, их свойства и функции
Слайд 2«Живые тела, существующие на Земле, представляют собой открытые, саморегулирующиеся и самовоспроизводящиеся
«Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка». Ф. Энгельс
Слайд 3Из органических веществ клетки по количеству и значению на первом месте
В состав белков входят: С, Н, О, N, S. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают огромной молекулярной массой: молекулярная масса альбумина (одного из белков яйца) — 36000, гемоглобина — 152000, миозина (одного из белков мышц) — 500000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Белки являются непериодическими полимерами, мономерами которых являются 20 видов α-аминокислот.
Общая характеристика белков
Слайд 4В зависимости от того, могут ли аминокислоты синтезироваться в организме, различают:
Незаменимые аминокислоты должны поступать в организм вместе с пищей.
В зависимости от аминокислотного состава, белки бывают: полноценными, если содержат весь набор незаменимых аминокислот; неполноценными, если в их составе отсутствует хотя бы одна незаменимая аминокислота.
Различают простые белки — белки, состоящие только из аминокислот (фибрин, трипсин) и сложные — белки, содержащие помимо аминокислот еще и небелковую — простетическую группу.
Она может быть представлена ионами металлов (металлопротеины — гемоглобин), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Общая характеристика белков
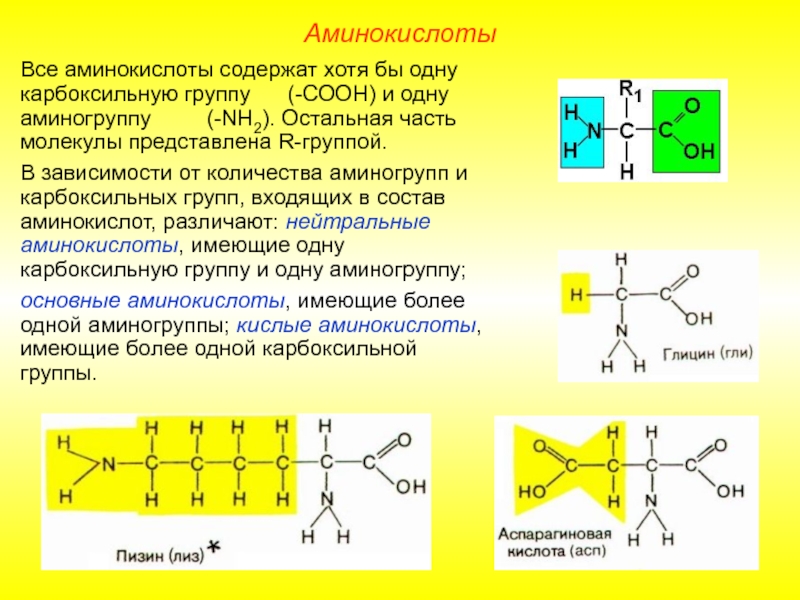
Слайд 5Все аминокислоты содержат хотя бы одну карбоксильную группу (-СООН)
В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу;
основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты
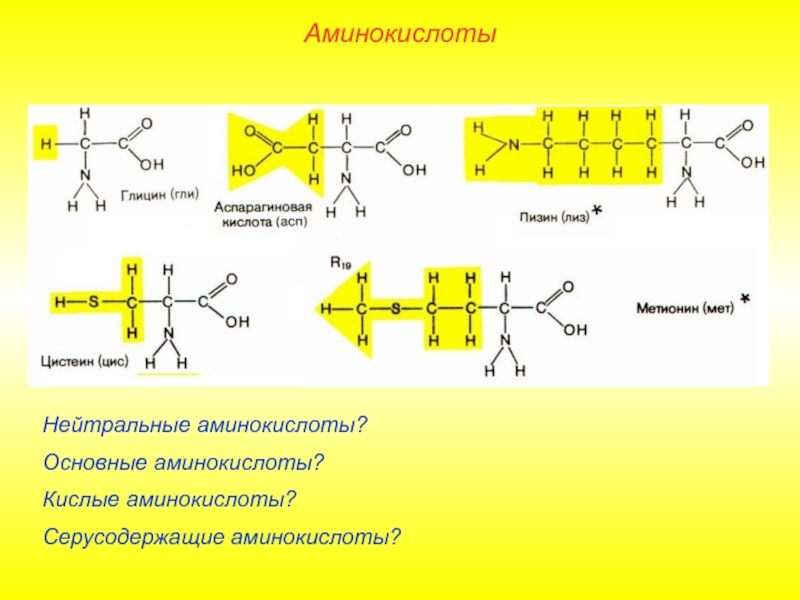
Слайд 7Нейтральные аминокислоты?
Основные аминокислоты?
Кислые аминокислоты?
Серусодержащие аминокислоты?
Аминокислоты
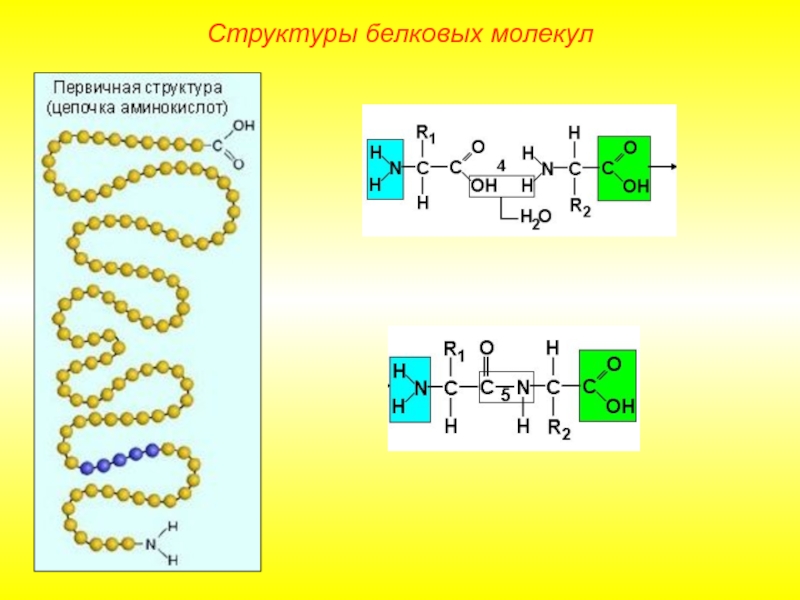
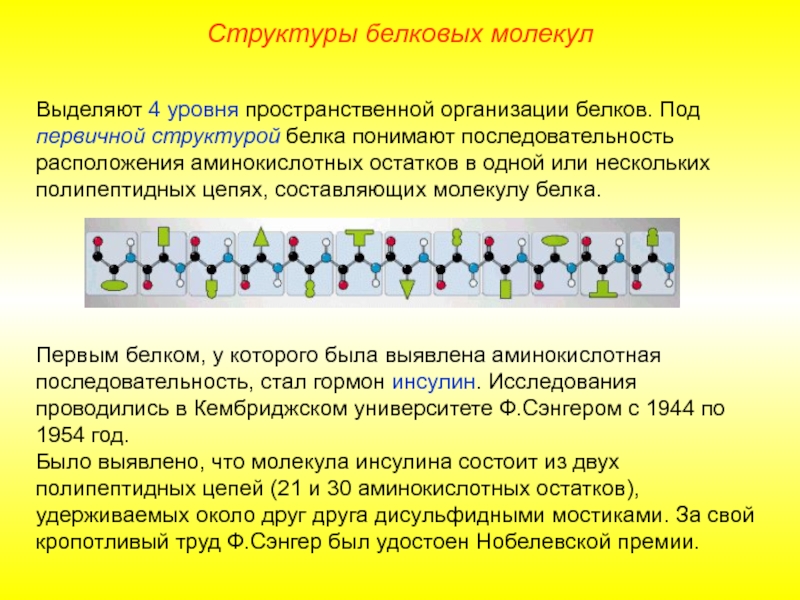
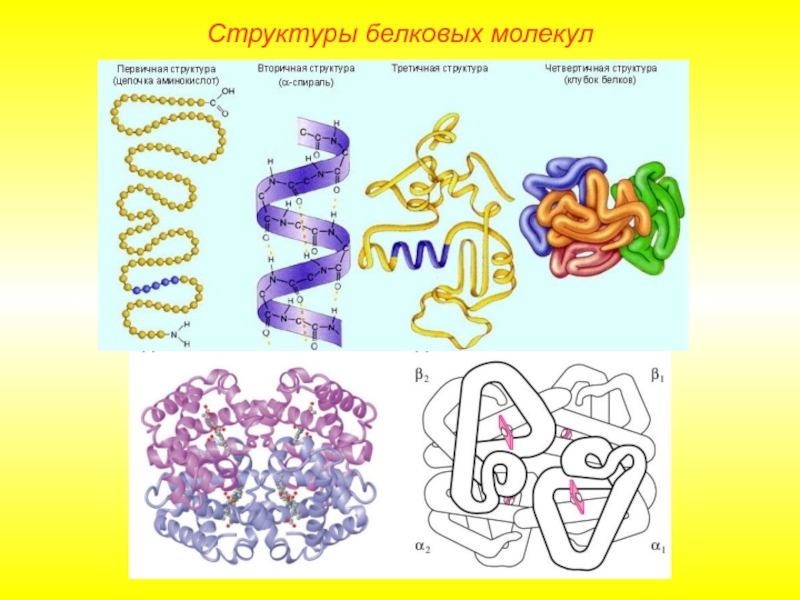
Слайд 9Выделяют 4 уровня пространственной организации белков. Под первичной структурой белка понимают
Структуры белковых молекул
Первым белком, у которого была выявлена аминокислотная последовательность, стал гормон инсулин. Исследования проводились в Кембриджском университете Ф.Сэнгером с 1944 по 1954 год.
Было выявлено, что молекула инсулина состоит из двух полипептидных цепей (21 и 30 аминокислотных остатков), удерживаемых около друг друга дисульфидными мостиками. За свой кропотливый труд Ф.Сэнгер был удостоен Нобелевской премии.
Слайд 10В организме человека обнаружено порядка 10 тыс. различных белков. Имея всего
Первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке может привести к изменению свойств и функций белка.
Лишь незначительное количество белков имеет строго линейную структуру. Основная масса белков подвергается дальнейшей укладке, что приводит к образованию вторичной структуры белковой молекулы.
Структуры белковых молекул
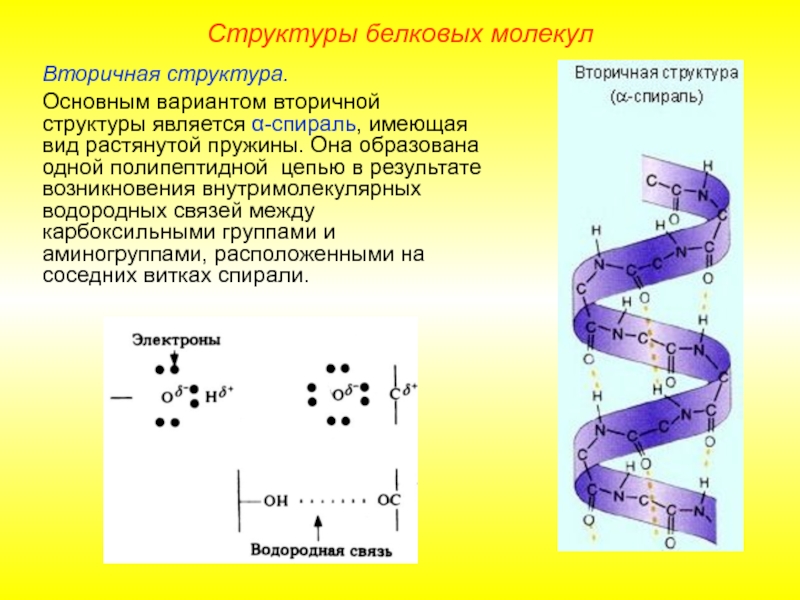
Слайд 11Вторичная структура.
Основным вариантом вторичной структуры является α-спираль, имеющая вид растянутой пружины.
Структуры белковых молекул
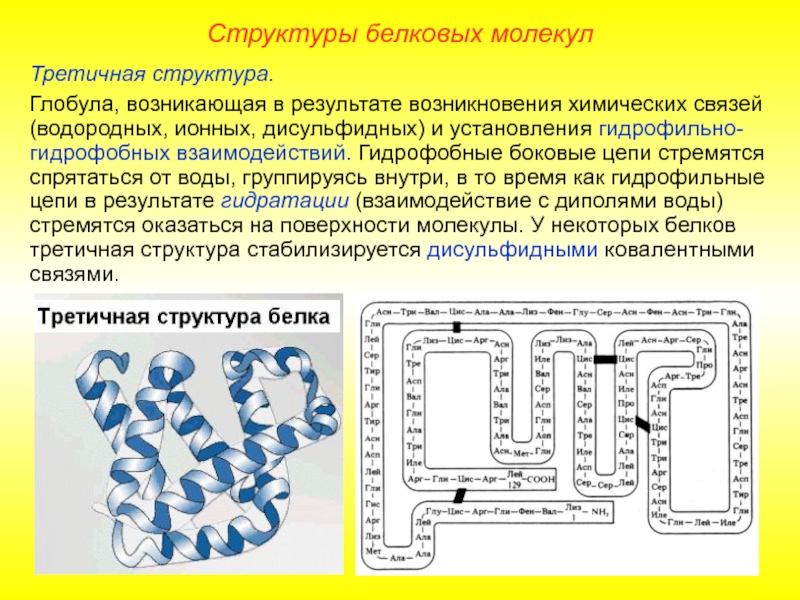
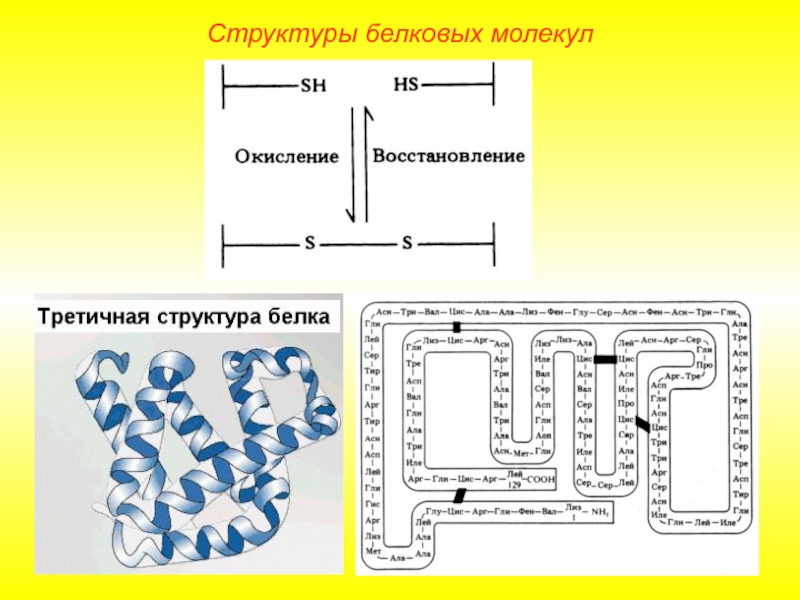
Слайд 12Третичная структура.
Глобула, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных)
Структуры белковых молекул
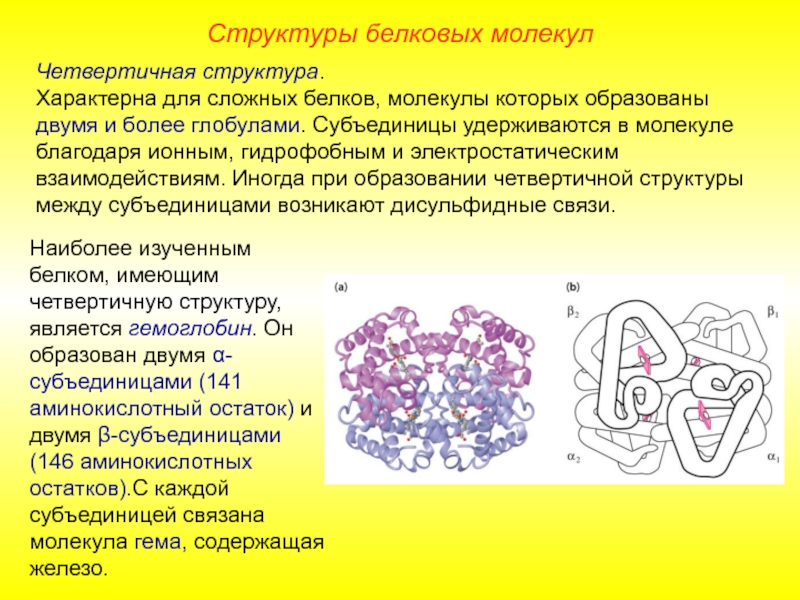
Слайд 14Четвертичная структура.
Характерна для сложных белков, молекулы которых образованы двумя и более
Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков).С каждой субъединицей связана молекула гема, содержащая железо.
Структуры белковых молекул
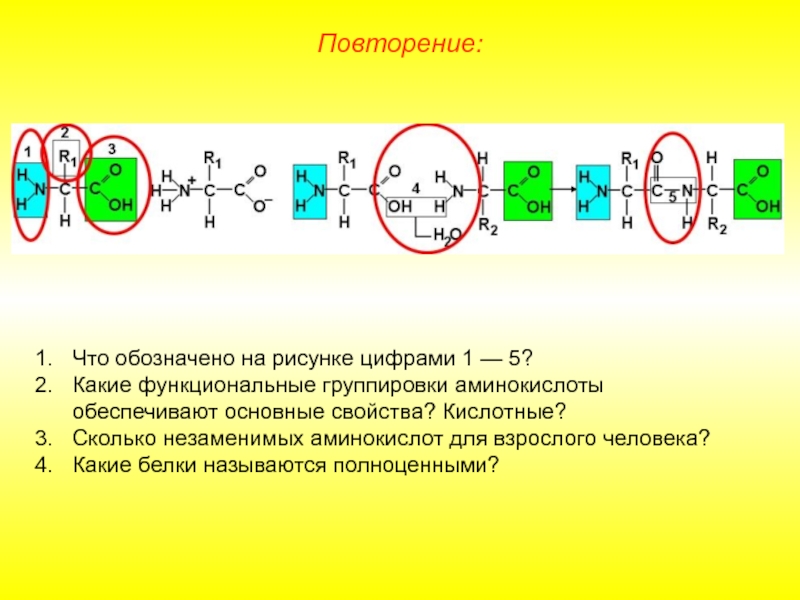
Слайд 16Повторение:
Что обозначено на рисунке цифрами 1 — 5?
Какие функциональные группировки аминокислоты
Сколько незаменимых аминокислот для взрослого человека?
Какие белки называются полноценными?
Слайд 17Тест 1. На первом месте по массе из органических веществ в
Углеводы.
Белки.
Липиды.
Нуклеиновые кислоты.
**Тест 2. В состав простых белков входят следующие элементы:
Углерод. 5. Фосфор.
Водород. 6. Азот.
Кислород. 7. Железо.
Сера. 8. Хлор.
Тест 3. Количество различных стандартных аминокислот, встречающихся в белках:
170.
26.
20.
10.
Повторение:
Слайд 18**Тест 4. Количество незаменимых для человека аминокислот:
Таких аминокислот нет.
20.
10.
7.
**Тест 5. Неполноценные
В которых отсутствуют некоторые аминокислоты.
В которых отсутствуют некоторые незаменимые аминокислоты.
В которых отсутствуют некоторые заменимые аминокислоты.
Все известные белки являются полноценными.
Тест 6. Придают аминокислотам свойства:
Кислые — радикал, щелочные — аминогруппа.
Кислые — аминогруппа, щелочные — радикал.
Кислые — карбоксильная группа, — щелочные — радикал.
Кислые — карбоксильная группа, щелочные — аминогруппа.
Повторение:
Слайд 19Тест 7. Пептидная связь образуется в результате:
Реакции гидролиза.
Реакции гидратации.
Реакции конденсации.
Все выше
Тест 8. Пептидная связь образуется:
Между карбоксильными группами соседних аминокислот.
Между аминогруппами соседних аминокислот.
Между аминогруппой одной аминокислоты и радикалом другой.
Между аминогруппой одной аминокислоты и карбоксильной группой другой.
**Тест 9. Вторичную структуру белков стабилизируют:
Ковалентные.
Водородные.
Ионные.
Такие связи отсутствуют.
Повторение: