- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Функционирование белков презентация
Содержание
- 1. Функционирование белков
- 2. Функционирование белков Набор индивидуальных белков выполняет в
- 3. Активный центр белков Активный центр белков - определённый
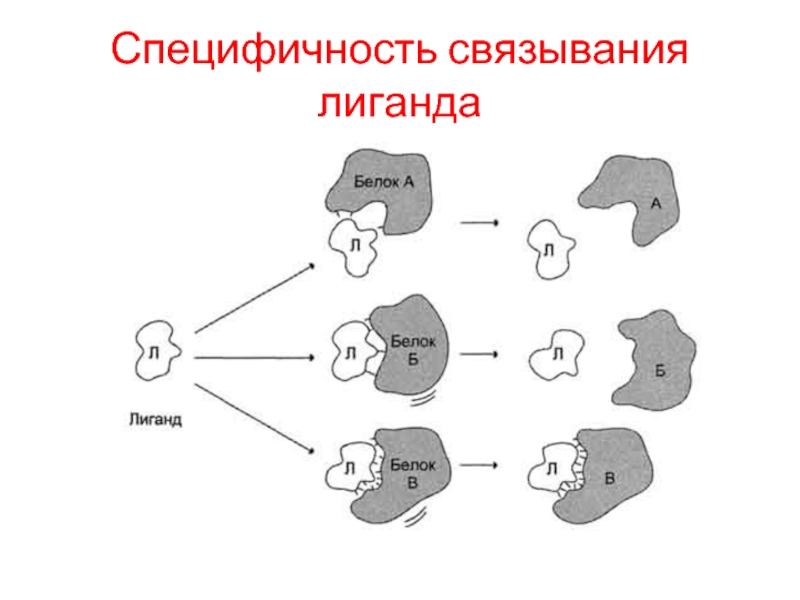
- 4. Специфичность связывания лиганда
- 5. Активный центр белков Набор аминокислот, входящих в
- 6. Активный центр белков При денатурации активный центр
- 7. Активный центр белков В некоторых случаях лиганд
- 8. Лиганды Лиганды обладают разнообразной химической природой: это
- 9. Степень диссоциации Так как присоединение лиганда к
- 10. Изменение активности белков Не смотря на то,
- 11. Модуляторы белковых функций в медицине Широкое применение
- 12. Модуляторы белковых функций в медицине В качестве
- 13. Ингибирование Н-холинорецепторов В нервно-мышечных синапсах присутствуют Н-холинорецепторы,
- 14. Ингибирование М-холинорецепторов Наиболее известный специфический ингибитор М-холинорецепторов
- 15. Ацетилхолин и его ингибиторы
- 16. Стимуляторы белковых функций Некоторые структурные аналоги лигандов
- 17. Нейротоксины Некоторые яды, попадая в организм человека,
- 18. Граница между ядом и лекарством Механизм действия
Слайд 2Функционирование белков
Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных
функций.
Необходимое условие для функционирования белков - присоединение к нему другого вещества, которое называют "лиганд".
Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандом высокоспецифично, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром.
Необходимое условие для функционирования белков - присоединение к нему другого вещества, которое называют "лиганд".
Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандом высокоспецифично, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром.
Слайд 3Активный центр белков
Активный центр белков - определённый участок белковой молекулы, как правило,
находящийся в её углублении ("кармане"), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом.
В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.
В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.
Слайд 5Активный центр белков
Набор аминокислот, входящих в состав активного центра называется «ансамблем».
Это название связано с тем, что объединение таких аминокислот в единый функциональный комплекс изменяет реакционную способность их радикалов, подобно тому, как меняется звучание музыкального инструмента в ансамбле.
Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию.
Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию.
Слайд 6Активный центр белков
При денатурации активный центр белков разрушается, и происходит утрата
их биологической активности.
Часто активный центр формируется таким образом, что доступ воды к функциональным группам его радикалов ограничен, т.е. создаются условия для связывания лиганда с радикалами аминокислот.
Часто активный центр формируется таким образом, что доступ воды к функциональным группам его радикалов ограничен, т.е. создаются условия для связывания лиганда с радикалами аминокислот.
Слайд 7Активный центр белков
В некоторых случаях лиганд присоединяется только к одному из
атомов, обладающему определённой реакционной способностью, например присоединение О2 к железу миоглобина или гемоглобина. Однако свойства данного атома избирательно взаимодействовать с О2 определяются свойствами радикалов, окружающих атом железа.
Основное свойство белков, лежащее в основе их функций, - избирательность присоединения к определённым участкам белковой молекулы специфических лигандов.
Основное свойство белков, лежащее в основе их функций, - избирательность присоединения к определённым участкам белковой молекулы специфических лигандов.
Слайд 8Лиганды
Лиганды обладают разнообразной химической природой: это могут быть неорганические (часто ионы
металлов) и органические вещества, низкомолекулярные и высокомолекулярные вещества.
Существуют лиганды, которые изменяют свою химическую структуру при присоединении к активному центру белка (изменения субстрата в активном центре фермента);
Некоторые лиганды, присоединяющиеся к белку только в момент функционирования (например, О2, транспортируемый гемоглобином), и лиганды, постоянно связанные с белком, выполняющие вспомогательную роль при функционировании белков (например, железо, входящее в состав гемоглобина).
В олигомерных белках (белки с четвертичной структурой) белки-протомеры являются лигандом для других протомеров.
Существуют лиганды, которые изменяют свою химическую структуру при присоединении к активному центру белка (изменения субстрата в активном центре фермента);
Некоторые лиганды, присоединяющиеся к белку только в момент функционирования (например, О2, транспортируемый гемоглобином), и лиганды, постоянно связанные с белком, выполняющие вспомогательную роль при функционировании белков (например, железо, входящее в состав гемоглобина).
В олигомерных белках (белки с четвертичной структурой) белки-протомеры являются лигандом для других протомеров.
Слайд 9Степень диссоциации
Так как присоединение лиганда к белку является обратимой реакцией, то
её (как и любую другую обратимую реакцию) можно охарактеризовать с помощью константы равновесия – константы диссоциации Kдис:
P+L↔PL
Kдис = [PL]/[L][P]
Чем меньше Kдис, тем прочнее связь между лигандом и белком. Иногда, для оценки устойчивости комплекса белок-лиганд (PL) используется обратная величина – константа связывания:
Kсв=1/Kдис
P+L↔PL
Kдис = [PL]/[L][P]
Чем меньше Kдис, тем прочнее связь между лигандом и белком. Иногда, для оценки устойчивости комплекса белок-лиганд (PL) используется обратная величина – константа связывания:
Kсв=1/Kдис
Слайд 10Изменение активности белков
Не смотря на то, что взаимодействие между белком и
лигандом специфично можно подобрать похожее на лиганд вещество, при связывании которого активным центром белка меняется его(белка) активность.
Если активность белка при этом падает, то такой лиганд называется «ингибитором белка».
Если вещество, замещающее лиганд, обладает похожей структурой, то оно называется «структурным аналогом лиганда».
При совпадении этих двух факторов (лиганд похож на естественный и уменьшает активность белка) вещество называется «конкурентным ингибитором белка».
Такие вещества используются человечеством в медицине, и животными в качестве природных ядов.
Если активность белка при этом падает, то такой лиганд называется «ингибитором белка».
Если вещество, замещающее лиганд, обладает похожей структурой, то оно называется «структурным аналогом лиганда».
При совпадении этих двух факторов (лиганд похож на естественный и уменьшает активность белка) вещество называется «конкурентным ингибитором белка».
Такие вещества используются человечеством в медицине, и животными в качестве природных ядов.
Слайд 11Модуляторы белковых функций в медицине
Широкое применение такие лекарства нашли в регуляции
передачи возбуждения через синапсы.
Передача сигнала от нерва к нерву или от нерва к эффекторному органу осуществляется через синапсы с помощью химических молекул, называемых нейромедиаторами. Нейромедиатор, выделяемый при прохождении импульса нервными окончаниями, должен высокоспецифично взаимодействовать с белками-рецепторами на постсинаптической мембране.
Однако, модифицируя химическую структуру нейромедиатора, можно получить вещества, которые также связывались бы с рецептором, но при этом менялся физиологический эффект: уменьшался или усиливался.
В фармакологии такие вещества называют "антагонисты" и "агонисты" соответственно.
Передача сигнала от нерва к нерву или от нерва к эффекторному органу осуществляется через синапсы с помощью химических молекул, называемых нейромедиаторами. Нейромедиатор, выделяемый при прохождении импульса нервными окончаниями, должен высокоспецифично взаимодействовать с белками-рецепторами на постсинаптической мембране.
Однако, модифицируя химическую структуру нейромедиатора, можно получить вещества, которые также связывались бы с рецептором, но при этом менялся физиологический эффект: уменьшался или усиливался.
В фармакологии такие вещества называют "антагонисты" и "агонисты" соответственно.
Слайд 12Модуляторы белковых функций в медицине
В качестве примера можно рассмотреть лекарства, нарушающие
проведение нервного импульса через холинергические синапсы (синапсы, где в качестве нейромедиатора используется ацетилхолин). Холинергические белки-рецепторы неоднородны по своей структуре и способны связываться с другими, кроме ацетилхолина, лигандами. Их делят на 2 большие группы:
М-холинорецепторы, названные так из-за их способности избирательно взаимодействовать с мускарином (токсин мухомора);
Н-холинорецепторы, избирательно связывающие никотин.
М-холинорецепторы, названные так из-за их способности избирательно взаимодействовать с мускарином (токсин мухомора);
Н-холинорецепторы, избирательно связывающие никотин.
Слайд 13Ингибирование Н-холинорецепторов
В нервно-мышечных синапсах присутствуют Н-холинорецепторы, взаимодействие которых с ацетилхолином вызывает
сокращение мышц. Для расслабления мышц в эндоскопических исследованиях, а также при разнообразных хирургических операциях используют структурные аналоги ацетилхолина, служащие ингибиторами данных рецепторов.
Пример такого вещества - дитилин, относящийся к группе лекарственных веществ, называемых миорелаксантами (вызывающими мышечное расслабление).
Пример такого вещества - дитилин, относящийся к группе лекарственных веществ, называемых миорелаксантами (вызывающими мышечное расслабление).
Слайд 14Ингибирование М-холинорецепторов
Наиболее известный специфический ингибитор М-холинорецепторов - атропин. Атропин - алкалоид,
содержащийся в некоторых растениях: красавке, белене, дурмане. Он препятствует взаимодействию с ацетилхолином (антагонист природного лиганда), тем самым устраняя эффекты раздражения парасимпатических нервов.
Так как ацетилхолин, связываясь с М-холинорецепторами, вызывает сокращение многих гладких мышц, атропин (как лекарственный препарат) снимает мышечные спазмы (спазмолитик).
М-холинорецепторы присутствуют в разных отделах ЦНС. Передозировка атропина может вызвать двигательное и речевое возбуждение.
Так как ацетилхолин, связываясь с М-холинорецепторами, вызывает сокращение многих гладких мышц, атропин (как лекарственный препарат) снимает мышечные спазмы (спазмолитик).
М-холинорецепторы присутствуют в разных отделах ЦНС. Передозировка атропина может вызвать двигательное и речевое возбуждение.
Слайд 16Стимуляторы белковых функций
Некоторые структурные аналоги лигандов рецепторных белков не являются ингибиторами,
а вызывают такие же или более сильные физиологические эффекты, чем природные лиганды. Их более сильный и длительный эффект часто связан с тем, что модифицированные лиганды медленнее инактивируются и разрушаются в организме.
Например, мезатон по структуре похож на нейромедиаторы симпатической нервной системы (норадреналин и адреналин). Мезатон повышает тонус сосудов и АД, поэтому его используют при гипотонии и коллапсе. Он менее подвержен действию инактивирующих его ферментов, поэтому оказывает более длительный и сильный эффект, чем его природные аналоги:
Например, мезатон по структуре похож на нейромедиаторы симпатической нервной системы (норадреналин и адреналин). Мезатон повышает тонус сосудов и АД, поэтому его используют при гипотонии и коллапсе. Он менее подвержен действию инактивирующих его ферментов, поэтому оказывает более длительный и сильный эффект, чем его природные аналоги:
Слайд 17Нейротоксины
Некоторые яды, попадая в организм человека, прочно связываются с определёнными белками,
ингибируют их и тем самым вызывают нарушения биологических функций.
Например, нейротоксины кобр и крайтов специфически взаимодействуют с холинергическими рецепторами постсинаптических мембран, блокируя их работу, и оказывают курареподобное действие. Нейротоксины - небольшие белки с молекулярной массой около 7000 Д (65-70 аминокислотных остатков). Их третичную структуру стабилизируют 4 или 5 специфических дисульфидных связей (в зависимости от вида токсина). Сродство нейротоксинов к холинергическим рецепторам очень высоко (Кдисс = 10-11).
Очевидно, между токсином и рецептором образуется множество связей, что и приводит к их практически необратимому соединению.
Например, нейротоксины кобр и крайтов специфически взаимодействуют с холинергическими рецепторами постсинаптических мембран, блокируя их работу, и оказывают курареподобное действие. Нейротоксины - небольшие белки с молекулярной массой около 7000 Д (65-70 аминокислотных остатков). Их третичную структуру стабилизируют 4 или 5 специфических дисульфидных связей (в зависимости от вида токсина). Сродство нейротоксинов к холинергическим рецепторам очень высоко (Кдисс = 10-11).
Очевидно, между токсином и рецептором образуется множество связей, что и приводит к их практически необратимому соединению.
Слайд 18Граница между ядом и лекарством
Механизм действия лекарств-ингибиторов и нейротоксинов одинаков, поэтому
между лекарствами и ядами часто существует прозрачная граница, и эффект их действия зависит от дозы вводимого вещества.
Так, лекарства, назначаемые в дозах, больших чем терапевтические, могут действовать как яды, т.е. вызывать серьёзные нарушения обмена веществ и функций организма, а яды в микродозах часто используют как лекарственные препараты.
Например, атропин, широко применяемый для снятия спазмов гладких мышц, в больших дозах вызывает возбуждение ЦНС, а в ещё больших дозах - сон, переходящий в кому.
Так, лекарства, назначаемые в дозах, больших чем терапевтические, могут действовать как яды, т.е. вызывать серьёзные нарушения обмена веществ и функций организма, а яды в микродозах часто используют как лекарственные препараты.
Например, атропин, широко применяемый для снятия спазмов гладких мышц, в больших дозах вызывает возбуждение ЦНС, а в ещё больших дозах - сон, переходящий в кому.