- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Функции и разнообразие РНК. Транскрипция презентация
Содержание
- 1. Функции и разнообразие РНК. Транскрипция
- 2. Все типы РНК образуются в результате реакции
- 3. Первичные транскрипты, образующиеся в процессе синтеза РНК,
- 4. Это последовательность из шести нуклеотидов AGGAGG .
- 5. Роджер Корнберг В 2006 году была
- 6. Транскрипция у эукариот Транскрипция у эукариотов происходит
- 7. Транскрипция у эукариот ТАТА-бокс содержащие Около
- 8. Транскрипция у эукариот Инициация Активация
- 9. Транскрипция у эукариот Элонгация Факторы элонгации повышают
- 10. Транскрипция у эукариот Терминация Завершается синтез РНК
- 11. Транскрипционный фактор – регулирует транскрипцию, специфически взаимодействуя
- 12. Транскрипция у эукариот ТФ , связывающиеся с
- 13. Транскрипция у эукариот 4. Известны ТФ,
- 14. Процессинг матричной РНК Первичные транскрипты мРНК, прежде
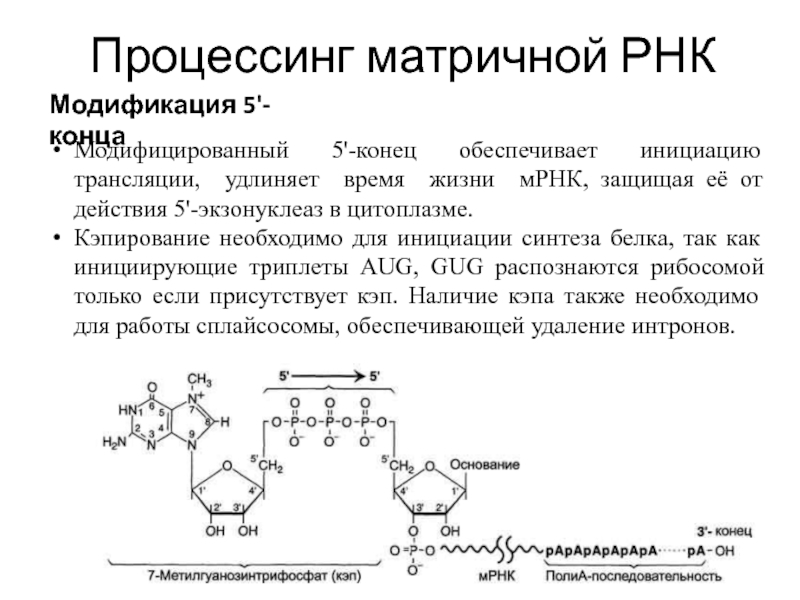
- 15. Процессинг матричной РНК Модификация 5'-конца Модификации пре-мРНК
- 16. Процессинг матричной РНК Модификация 5'-конца Модифицированный 5'-конец
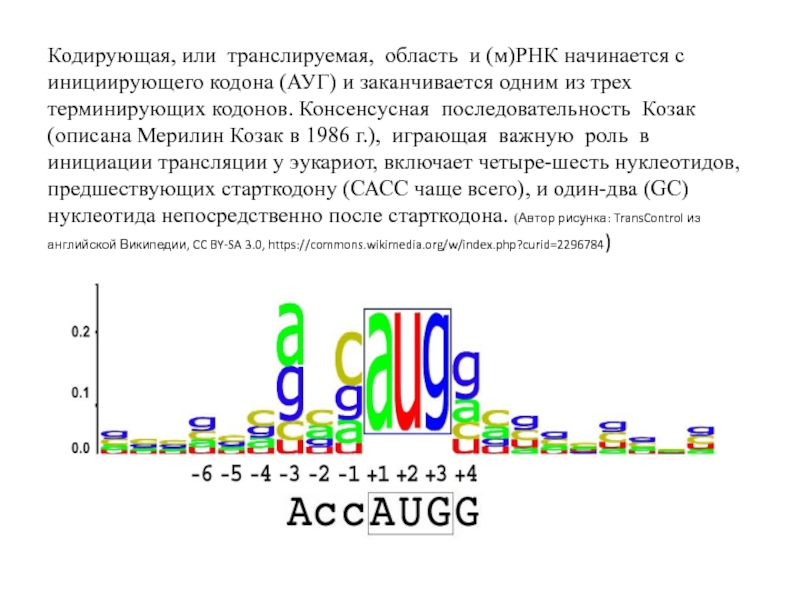
- 17. Кодирующая, или транслируемая, область и (м)РНК начинается
- 18. У эукариот имеются два механизма нахождения рибосомой
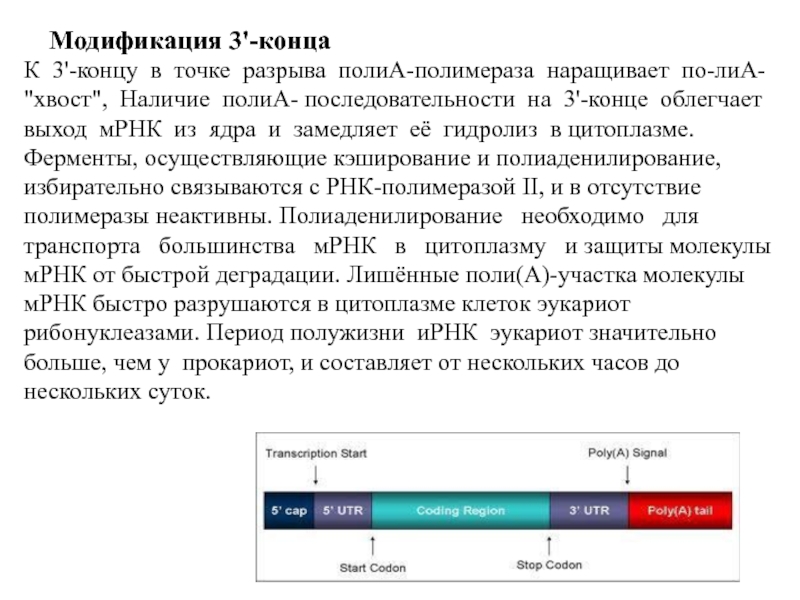
- 19. Модификация 3'-конца 3'-Конец большинства транскриптов,
- 20. Модификация 3'-конца К 3'-концу в точке разрыва
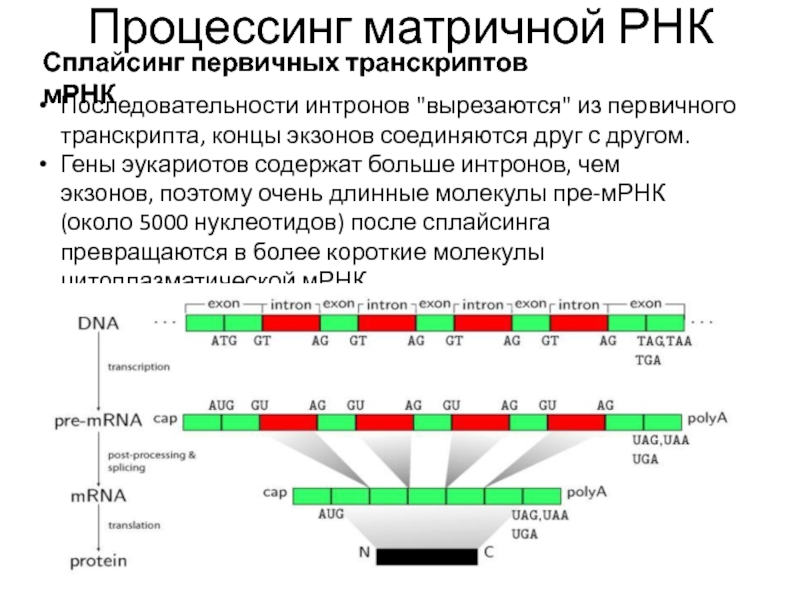
- 21. Процессинг матричной РНК Сплайсинг первичных транскриптов мРНК
- 22. Процессинг матричной РНК Сплайсинг первичных транскриптов мРНК
- 23. Процессинг матричной РНК Сплайсинг первичных транскриптов
- 24. Процессинг матричной РНК Альтернативный сплайсинг первичных транскриптов мРНК
- 25. У высших организмов первичный РНК-транскрипт
- 26. В результате альтернативного сплайсинга по
- 27. Некоторые белки напрямую участвуют
- 28. Стабильность и время жизни матричной РНК
- 29. Транспорт матричной РНК Зрелые мРНК распознаются по
- 30. Рибосомы. В прокариотических рибосомах присутствуют три вида
- 31. В эукариотических – 4 рРНК и 70-85
- 32. Из них 18S, 5,8S и 28S рРНК
- 33. Количество ядрышек в клетках обычно от1 до
- 34. рРНК катализирует пептидилтрансферазную реакцию, в результате которой
- 35. Двухнитевые спиральные элементы рРНК соединены петлями, которые
- 36. Молекулы тРНК состоят примерно из 75 нуклеотидов
- 37. Участки, в которых посредством Н-связей образовались пары
- 38. Аминокислотный остаток присоединяеться к З'-концу молекулы тРНК.
- 39. Каждая аминокислота, как правило, имеет несколько соответсвующих
- 40. На заключительных стадиях созревания тРНК к 3’-концу
- 41. В последние годы была установлена роль коротких
- 42. В нормально работающей клетке каждый ген выполняет
- 43. РНК интерференция Нобелевскую премию за открытия в
- 44. РНК-интерференция (RNAi, RNA interference) — специфическая деградация
- 45. В класс малых РНК включают молекулы, содержащие
- 46. Если молекула siRNA по тем или иным
- 47. Итак, основная «специальность» siRNA в клетке -
- 48. Такие «вторичные» молекулы смогут специфично связываться не
- 49. У млекопитающих же, в отличие от насекомых
- 50. Как можно заметить, обе системы во многом
- 51. В этом и заключается основное преимущество малых
- 52. Геном любого многоклеточного организма включает в себя
- 53. LINEs, SINEs, остатки вирусной ДНК и транспозоны,
- 54. Система внутриклеточных siRNA выполняет «надзирательскую» функцию за
- 55. МУЛЬТИФУНК ЦИОНАЛЬНОСТЬ РНК (1) Кодирующая
- 56. КОДИРУЮЩИЕ ФУНКЦИИ РНК (1) РНК (как
- 57. КАТАЛИТИЧЕСКАЯ ФУНКЦИЯ РНК (РИБОЗИМЫ) (1)
- 58. КАТАЛИТИЧЕСКИЕ (ЕСТЕСТВЕННАЯ И ИССКУСТВЕННАЯ) ФУНКЦИИ РНК
- 59. КАТАЛИТИЧЕСКИЕ (ЕСТЕСТВЕННАЯ И ИССКУСТВЕННАЯ) ФУНКЦИИ РНК
- 60. ФУНКЦИЯ УЗНАВАНИЯ МАЛЫХ ЛИГАНДОВ (СУБСТРАТОВ)
- 61. ФУНКЦИЯ УЗНАВАНИЯ МАЛЫХ ЛИГАНДОВ (СУБСТРАТОВ)
- 62. Таким образом, рибонуклеиновые кислоты способны осуществлять
Слайд 2Все типы РНК образуются в результате реакции матричного синтеза, в большинстве
1.Информационная/матричная РНК – содержит от нескольких 100-1000 нуклеотидов. Представляет незамкнутую цепочку, переносит информацию о структуре белка с ДНК на рибосому.
2.Гетерогенная ядерная РНК (гя-РНК) – является предшественником и-РНК превращается в и –РНК в результате процессинга. Обычно гя-РНК длинее чем и-РНК.
3.Рибосомальная РНК – входит в состав рибосом и выполняет структурную функцию, принимает участие в синтезе полипептидной цепочки, составляет 85% всей РНК. Клетки прокариот содержат 3 вида р-РНК, а эукариот - 4 вида.
4.Транспортная РНК – переносит аминокислоты к месту синтеза белков на рибосомы, каждая молекула т-РНК содержит 80 нуклеотидов. Ее специфичность определяется структурой антикодона – это участок соединения с конкретным триплетом и-РНК.
5. Малые РНК. Кодируются в ядре, но работают как в ядре (small nuclear - SN), так и в цитоплазме (small cytoplasmic - SC). в ядре snРНК входят в состав РНП (рибонуклеопротеидные комплексы), участвующих в полиаденилировании и сплайсинге.
6. Малая интерферирующая РНК (siRNA) обладает способностью "выключать" гены.
Слайд 3Первичные транскрипты, образующиеся в процессе синтеза РНК, часто подвергаются посттранскрипционным модификациям,
иРНК (или матричные РНК) – это одноцепочечные молекулы. Молекула
иРНК может кодировать одну или несколько полипептидных цепей.
иРНК, кодирующая информацию об одной полипептидной цепи,
называется моноцистронной, о двух или более – полицистронной.
Информационная РНК прокариот короткоживущая. Средняя
продолжительность жизни – 2 минуты.
иРНК прокариот в большинстве случаев являются полицистронными,
и только некоторые из них – моноцистронными. Полицистронные иРНК
содержат нетранслируемые межцистронные области, которые
разделяют участки, кодирующие полипептидные цепи (цистроны). Со
стороны 5’- конца иРНК располагается лидерная некодирующая
последовательность, содержащая в своем составе консенсусную
последовательность Шайна-Дальгарно.
Слайд 4Это последовательность из шести нуклеотидов AGGAGG . Комплементарная последовательность UCCUCC, называемая
Межцистронные области имеют размер от 1 до 40 и более нуклеотидов.
Иногда межцистронные области могут отсутствовать. Более того,
последний нуклеотид одного цистрона может являться первым
нуклеотидом следующего цистрона, например: АГАУГ.
иРНК эукариот являются моноцистронными и составляют 2 – 6 % от
всей РНК в клетке. У эукариотов гены почти всегда одиночные и только
гены т- и р-РНК собраны в кластеры, напоминающие опероны бактерий.
Слайд 5
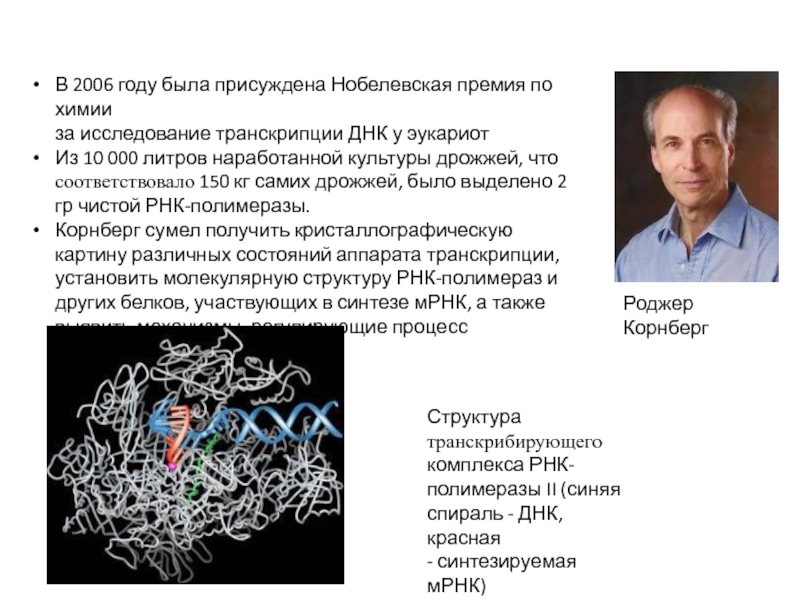
Роджер Корнберг
В 2006 году была присуждена Нобелевская премия по химии
за исследование
Из 10 000 литров наработанной культуры дрожжей, что соответствовало 150 кг самих дрожжей, было выделено 2 гр чистой РНК-полимеразы.
Корнберг сумел получить кристаллографическую картину различных состояний аппарата транскрипции, установить молекулярную структуру РНК-полимераз и других белков, участвующих в синтезе мРНК, а также выявить механизмы, регулирующие процесс транскрипции
Структура транскрибирующего комплекса РНК- полимеразы II (синяя спираль - ДНК, красная
- синтезируемая мРНК)
Слайд 6Транскрипция у эукариот
Транскрипция у эукариотов происходит в ядре
Синтез молекул РНК начинается
У эукариот имеется 3 типа РНК-полимераз (не считая митохондриальной и хлоропластной):
РНК полимераза I - синтезирует в ядрышках рибосомные RNA (18S и 28S рРНК, кроме 5S);
РНК-полимераза II - синтезирует mRNA и некоторых sRNA;
РНК-полимераза III - синтезирует tRNA, sRNA, 5S rRNA.
Слайд 7Транскрипция у эукариот
ТАТА-бокс содержащие
Около 24% генов человека
ТАТА-бокс не содержащие
Участвуют различные транскрипционные
На расстоянии 27-30 п.н. от кэп-сайта расположен TATA-мотив, усредненный вариант которого можно представить как TATA(A/T)A(A/T).
Положение TATA-элемента строго определяет сайт инициации транскрипции, т.е. 5'-конец транскрипта.
При повреждении или удалении TATA-элемента образуется набор молекул РНК с разными 5'-концами.
Отдельные нуклеотидные замены в TATA-элементе могут приводить к резкому снижению эффективности транскрипции.
Промоторы
Слайд 8Транскрипция у эукариот
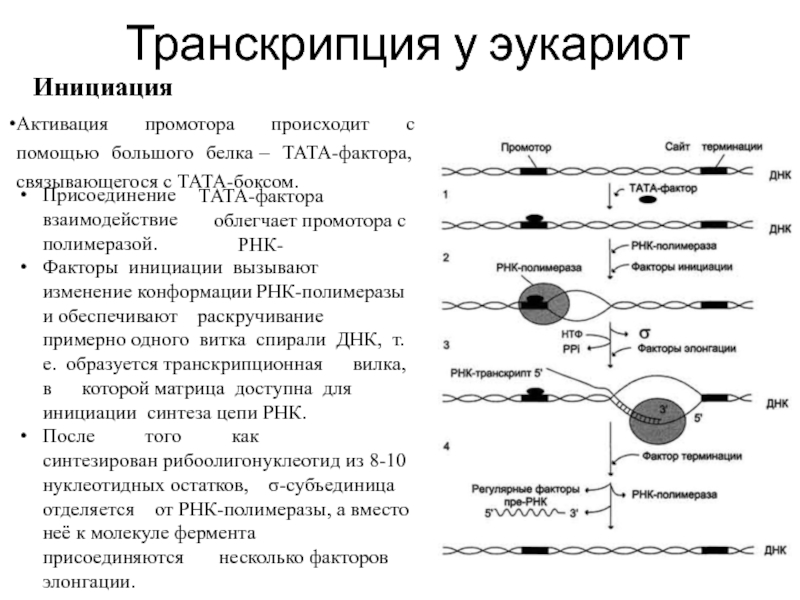
Инициация
Активация промотора происходит
Присоединение взаимодействие полимеразой.
ТАТА-фактора облегчает промотора с РНК-
Факторы инициации вызывают изменение конформации РНК-полимеразы и обеспечивают раскручивание примерно одного витка спирали ДНК, т.е. образуется транскрипционная вилка, в которой матрица доступна для инициации синтеза цепи РНК.
После того как синтезирован рибоолигонуклеотид из 8-10 нуклеотидных остатков, σ-субъединица отделяется от РНК-полимеразы, а вместо неё к молекуле фермента присоединяются несколько факторов элонгации.
Слайд 9Транскрипция у эукариот
Элонгация
Факторы элонгации повышают активность РНК-полимеразы и облегчают расхождение цепей
На стадии элонгации, в области транскрипционной вилки, одновременно разделены примерно 18 нуклеотидных пар ДНК.
Растущий конец цепи РНК образует временную гибридную спираль, около 12
пар нуклеотидных остатков, с матричной цепью ДНК.
По мере продвижения РНК-полимеразы по матрице в направлении от 3'- к 5'- концу впереди неё происходит расхождение, а позади - восстановление двойной спирали ДНК.
Слайд 10Транскрипция у эукариот
Терминация
Завершается синтез РНК в строго определенных участках матрицы -
Раскручивание двойной спирали ДНК в области сайта терминации делает его доступным для фактора терминации.
Фактор терминации облегчает отделение первичного транскрипта (пре-мРНК), комплементарного матрице, и РНК-полимеразы от матрицы. РНК-полимераза может вступить в следующий цикл транскрипции после присоединения субъединицы σ.
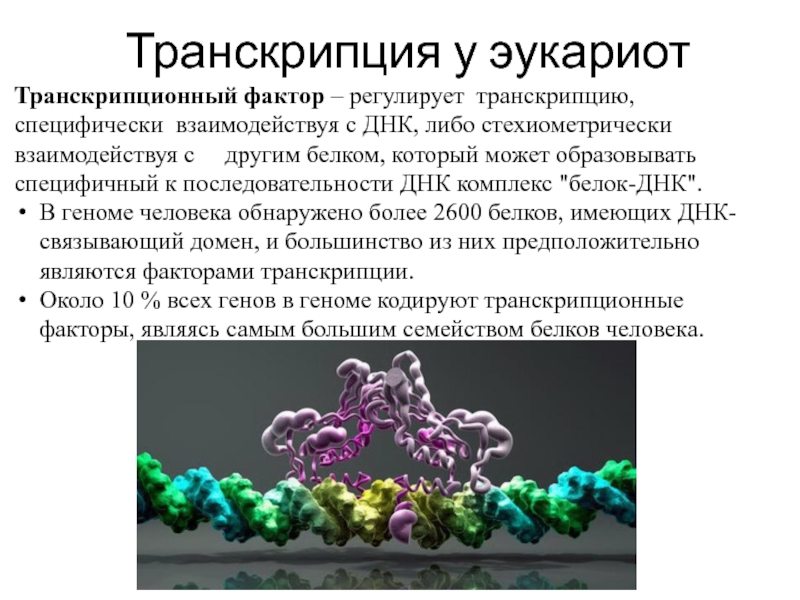
Слайд 11Транскрипционный фактор – регулирует транскрипцию, специфически взаимодействуя с ДНК, либо стехиометрически
В геноме человека обнаружено более 2600 белков, имеющих ДНК-связывающий домен, и большинство из них предположительно являются факторами транскрипции.
Около 10 % всех генов в геноме кодируют транскрипционные факторы, являясь самым большим семейством белков человека.
Транскрипция у эукариот
Слайд 12Транскрипция у эукариот
ТФ , связывающиеся с ДНК, могут влиять на транскрипцию
В большинстве изученных к настоящему времени случаев ТФ стимулируют формирование комплекса преинициации на TATA- боксе - инициаторном элементе за счет взаимодействия их транс- активирующих доменов с компонентами базального транскрипционного комплекса (либо непосредственно, либо через коактиваторы/ медиаторы ).
Некоторые ТФ вызывают изменения структуры хроматина , делая его более доступным для РНК-полимераз .
Другие ТФ являются вспомогательными, создавая оптимальную конформацию ДНК для действия других транскрипционных факторов.
Слайд 13Транскрипция у эукариот
4. Известны ТФ, которые подавляют транскрипцию за счет непосредственного
Наконец, имеются ТФ, которые сами не связываются с ДНК, а объединяются в более сложные комплексы посредством белок- белковых взаимодействий.
Слайд 14Процессинг матричной РНК
Первичные транскрипты мРНК, прежде чем будут использованы в
Модификация 5'-конца
Модификация 3'-конца
Сплайсинг первичных транскриптов мРНК
Альтернативный сплайсинг
Слайд 15Процессинг матричной РНК
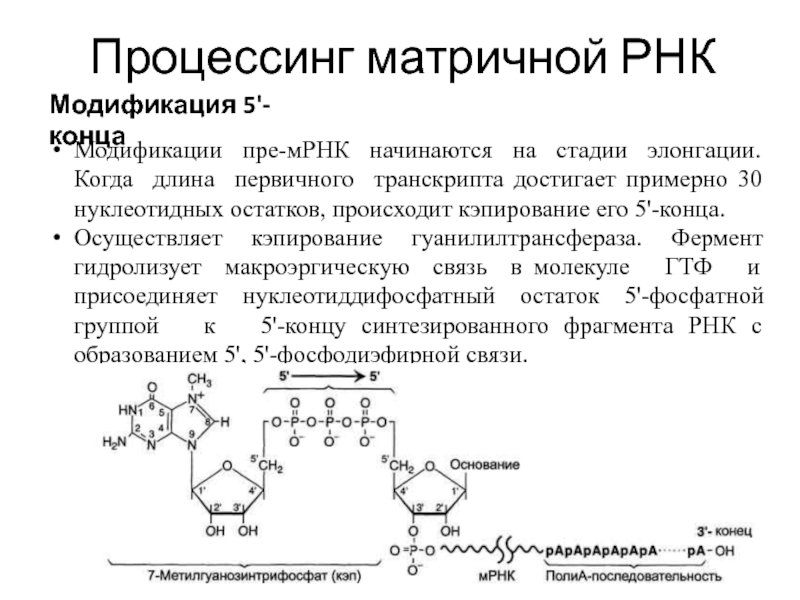
Модификация 5'-конца
Модификации пре-мРНК начинаются на стадии элонгации. Когда длина
Осуществляет кэпирование гуанилилтрансфераза. Фермент гидролизует макроэргическую связь в молекуле ГТФ и присоединяет нуклеотиддифосфатный остаток 5'-фосфатной группой к 5'-концу синтезированного фрагмента РНК с образованием 5', 5'-фосфодиэфирной связи.
Слайд 16Процессинг матричной РНК
Модификация 5'-конца
Модифицированный 5'-конец обеспечивает инициацию трансляции, удлиняет время жизни
Кэпирование необходимо для инициации синтеза белка, так как инициирующие триплеты AUG, GUG распознаются рибосомой только если присутствует кэп. Наличие кэпа также необходимо для работы сплайсосомы, обеспечивающей удаление интронов.
Слайд 17Кодирующая, или транслируемая, область и (м)РНК начинается с инициирующего кодона (АУГ)
Слайд 18У эукариот имеются два механизма нахождения рибосомой старт-кодона AUG: кэп –
Слайд 19Модификация 3'-конца
3'-Конец большинства транскриптов, синтезированных РНК-полимеразой
Специальным ферментом полиА-полимеразой формируется полиА-последовательность (полиА-"хвост"), состоящая из 100-200 остатков аденозина.
Сигналом к началу полиаденилирования является последовательность -AAUAAA- на растущей цепи РНК. Фермент полиА-полимераза, проявляя экзонуклеазную активность, разрывает 3'- фосфоэфирную связь после появления в цепи РНК специфической последовательности - AAUAAA-.
Слайд 20Модификация 3'-конца
К 3'-концу в точке разрыва полиА-полимераза наращивает по-лиА-
"хвост", Наличие полиА-
выход мРНК из ядра и замедляет её гидролиз в цитоплазме.
Ферменты, осуществляющие кэширование и полиаденилирование,
избирательно связываются с РНК-полимеразой II, и в отсутствие
полимеразы неактивны. Полиаденилирование необходимо для
транспорта большинства мРНК в цитоплазму и защиты молекулы
мРНК от быстрой деградации. Лишённые поли(А)-участка молекулы
мРНК быстро разрушаются в цитоплазме клеток эукариот
рибонуклеазами. Период полужизни иРНК эукариот значительно
больше, чем у прокариот, и составляет от нескольких часов до
нескольких суток.
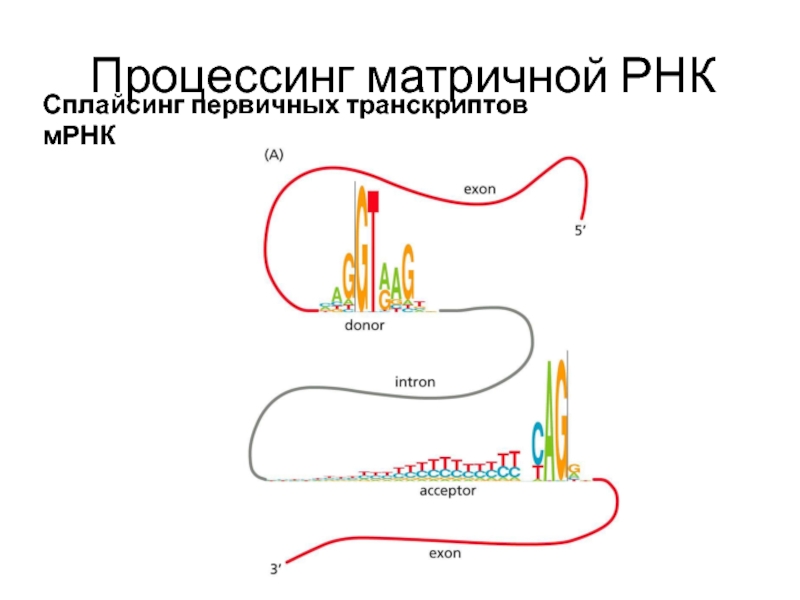
Слайд 21Процессинг матричной РНК
Сплайсинг первичных транскриптов мРНК
Последовательности интронов "вырезаются" из первичного транскрипта,
Гены эукариотов содержат больше интронов, чем экзонов, поэтому очень длинные молекулы пре-мРНК (около 5000 нуклеотидов) после сплайсинга превращаются в более короткие молекулы цитоплазматической мРНК
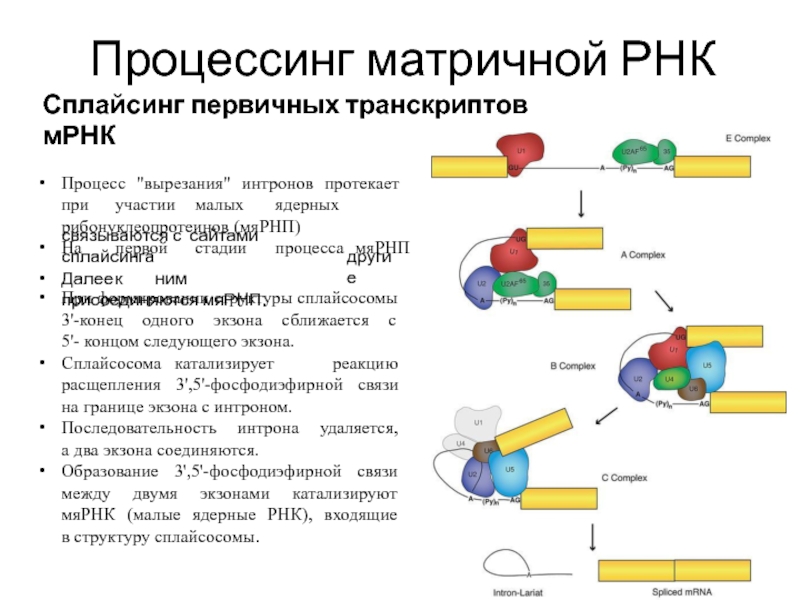
Слайд 23Процессинг матричной РНК
Сплайсинг первичных транскриптов мРНК
Процесс "вырезания" интронов протекает при участии малых ядерных рибонуклеопротеинов
На первой стадии процесса мяРНП
связываются с сайтами сплайсинга
Далее к ним присоединяются мяРНП.
другие
При формировании структуры сплайсосомы 3'-конец одного экзона сближается с 5'- концом следующего экзона.
Сплайсосома катализирует реакцию расщепления 3',5'-фосфодиэфирной связи на границе экзона с интроном.
Последовательность интрона удаляется, а два экзона соединяются.
Образование 3',5'-фосфодиэфирной связи между двумя экзонами катализируют мяРНК (малые ядерные РНК), входящие в структуру сплайсосомы.
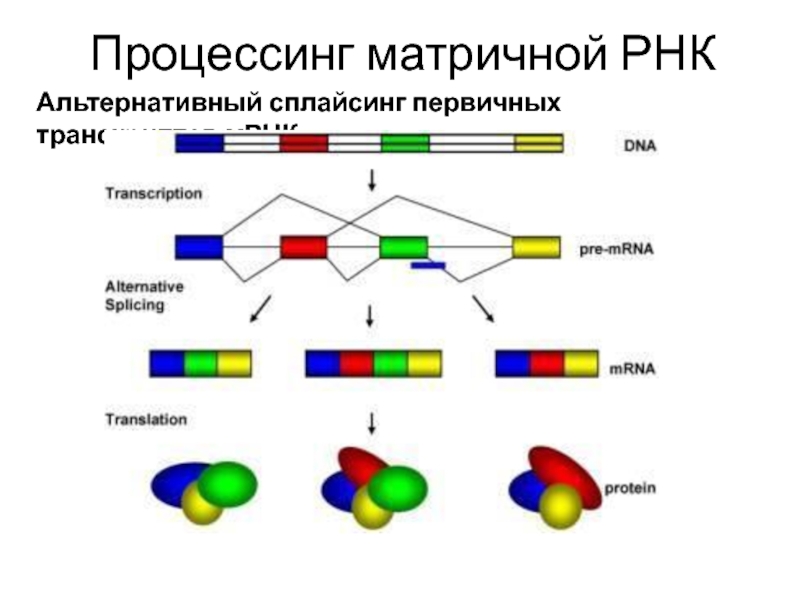
Слайд 25 У высших организмов первичный РНК-транскрипт может подвергаться альтернативному сплайсингу.
Слайд 26 В результате альтернативного сплайсинга по каждому гену высших эукариот
Слайд 27 Некоторые белки напрямую участвуют в сплайсинге, большая их
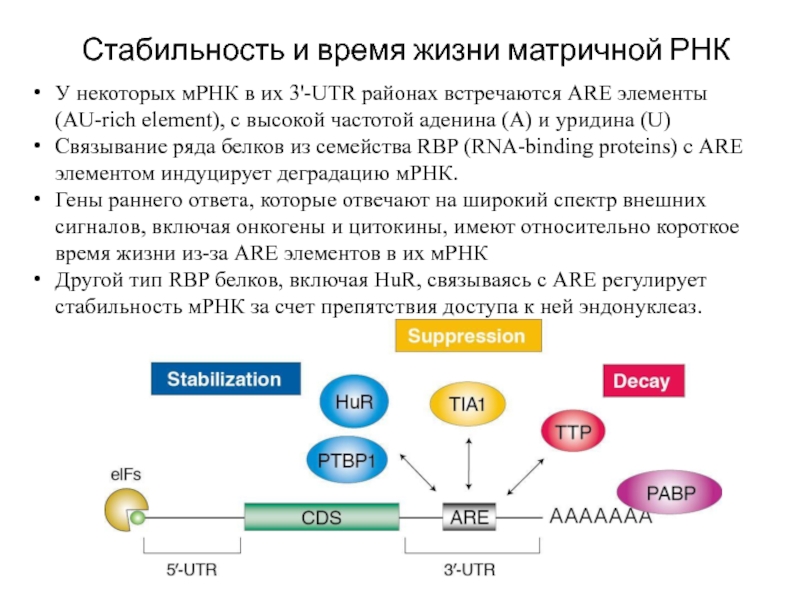
Слайд 28Стабильность и время жизни матричной РНК
У некоторых мРНК в их 3'-UTR
Связывание ряда белков из семейства RBP (RNA-binding proteins) с ARE элементом индуцирует деградацию мРНК.
Гены раннего ответа, которые отвечают на широкий спектр внешних сигналов, включая онкогены и цитокины, имеют относительно короткое время жизни из-за ARE элементов в их мРНК
Другой тип RBP белков, включая HuR, связываясь с ARE регулирует стабильность мРНК за счет препятствия доступа к ней эндонуклеаз.
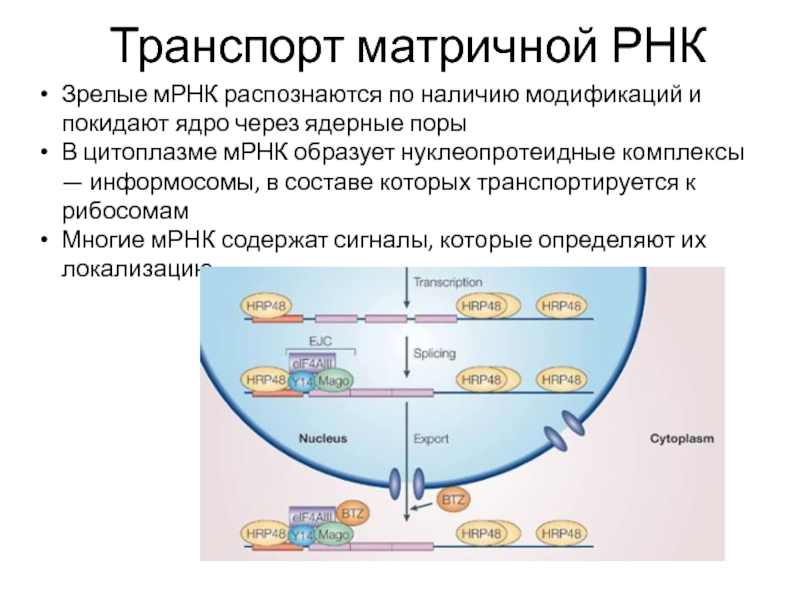
Слайд 29Транспорт матричной РНК
Зрелые мРНК распознаются по наличию модификаций и покидают ядро
В цитоплазме мРНК образует нуклеопротеидные комплексы — информосомы, в составе которых транспортируется к рибосомам
Многие мРНК содержат сигналы, которые определяют их локализацию
Слайд 30Рибосомы. В прокариотических рибосомах присутствуют три вида рРНК и 55-60 рибосомных
Полная прокариотическая рибосома имеет коэффициент седиментаци
и 70S и диссоциирует на две субъединицы. Малая рибосомальная
субъединица имеет палочковидную форму с несколькими небольшими
выступами и состоит из одной молекулы РНК. Большая субъединица
похожа на полусферу с тремя торчащими выступами. При ассоциации в
полную 70S рибосому малая субчастица ложится одним концом на один
из выступов 50S частицы, а другим в ее желобок. В составе большой
молекулы находятся 2 молекулы РНК.
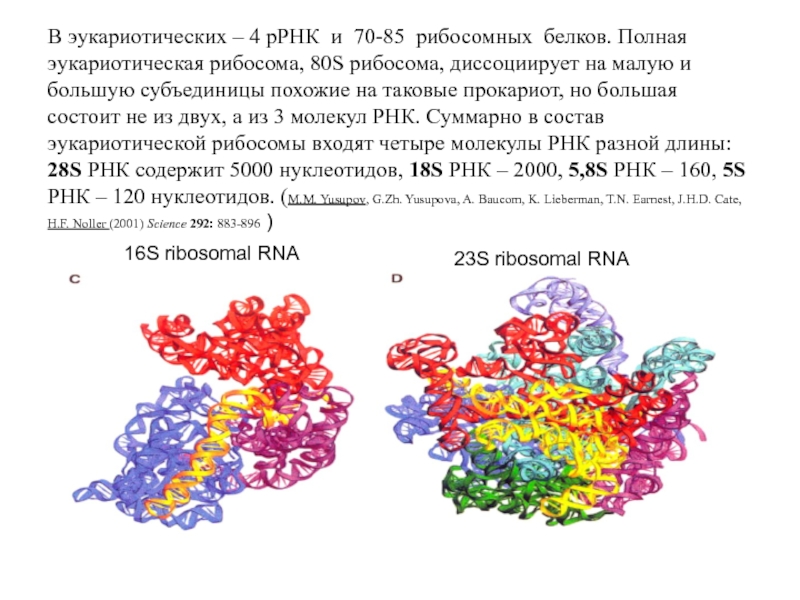
Слайд 31В эукариотических – 4 рРНК и 70-85 рибосомных белков. Полная эукариотическая
16S ribosomal RNA
23S ribosomal RNA
Слайд 32Из них 18S, 5,8S и 28S рРНК синтезируются в ядрышке
Слайд 33Количество ядрышек в клетках обычно от1 до 5, но оно не
в половых клетках количество ядрышек может достигать несколько сотен.
Увеличение числа ядрышек называется амплификацией ядрышек. Число
ядрышек зависит от «ядрышковых организаторов», которые локализованы во
вторичных перетяжках хромосом. Чем больше число «ядрышковых
организаторов», тем больше ядрышек. Число ядрышек увеличивается согласно
плоидности ядра. Количество ядрышек меньше числа «ядрышковых
организаторов», так как «ядрышковые организаторы» могут сливаться.
«Ядрышковые организаторы» представляют полицистронные
участки, которые содержат множество одинаковых генов (полиизогенные
участки), т.е. рибосомные гены. В ядрах встречаются ядрышки, не связанные с
ядрышковыми организаторами. Их копии могут либо включаться в состав
хромосом, либо становиться свободными. В структуре ядрышка различают:
Глобулярный центр, фибриллярный центр, плотный фибриллярный компонент
(ПФК), хроматин, белковый сетчатый матрикс. На поверхности фибриллярного
центра происходит активация транскрипционных единиц – связывание с
факторами транскрипции и РНКполимеразой I, которая начинает считывать
первичный транскрипт рРНК. По мере прохождения первой РНК-полимеразы на
освобождающийся участок транскрипционной единицы садится следующая
РНК-полимераза и начинается синтез новой рРНК.
Слайд 34рРНК катализирует пептидилтрансферазную реакцию, в
результате которой происходит образование пептидных связей в
процессе
заканчивается образованием функционального
рибонуклеопротеида (конмплекс рРНК и белков).
Рибосомные белки. Во-первых, рибосомные белки располагаются
преимущественно на обращенной к растворителю поверхности
рибосомы, а между субчастицами белков практически нет.
Во-вторых, большинство рибосомных белков имеют глобулярную
конформацию, однако некоторые содержат вытянутые
нерегулярные участки, которые приобретают упорядоченную третичную
структуру при связывании с рРНК. Были обнаружены также белки,
которые не имеют глобулярной формы, например, белок S14.
В-третьих, главной ролью рибосомных белков, по-видимому, является
роль «скрепок», стабилизирующих структуру рРНК. Тем не менее, часть
рибосомных белков может играть самостоятельную роль в составе
рибосомы.
В-четвертых, вторичная структура рРНК почти полностью состоит из
элементов известных ранее для малых фрагментов РНК.
Слайд 35Двухнитевые спиральные элементы рРНК соединены петлями, которые часто
представляют собой нерегулярные участки
взаимодействуют между собой малыми желобками (аналогично упаковке
интрона I рибозима). Часто такие взаимодействия стабилизированы
внедрением аденина в малый желобок спирали рРНК или взаимодействиями
фосфатной группы одной спирали с малым желобком второй, а также
взаимодействиями неспаренных пуринов в двух перпендикулярных спиралях
РНК. Рибосомные белки, взаимодействующие с рРНК независимо от других
белков и связывающиеся только со специфическими участками рРНК,
Называются сердцевинными или первичными РНК- связывающими
Рибосомными белками. Остальные рибосомные белки также связываются с
рРНК, но участки связывания этих белков формируются только после
Связывания сердцевинных белков. В настоящее время модели рибосомных
субчастиц активно используются для определения положения антибиотиков
на рибосоме и предсказания их контактов с рРНК.
Слайд 36Молекулы тРНК состоят примерно из 75 нуклеотидов и начинаются с фосфорилированного
тРНК узнает соответствующий кодон в
мРНК и переносит нужную аминокислоту
к растущей полипептидной цепи.
Узнавание кодона в мРНК существляется
с помощью трех последовательных
оснований в тРНК, называемых
антикодоном. Между азотистыми
основаниями кодона и антикодона
образуются уотсон-криковские водородные связи
при условии, что полинуклеотидные
цепи антипараллельны.
Слайд 37Участки, в которых посредством Н-связей образовались пары
оснований, называются стеблями, а
петлями. Все известные тРНК образуют «клеверный лист» с
четырьмя стеблями (акцепторным, D, антикодоновым и Т) и тремя
петлями (D, антикодоновой и Т). Некоторые тРНК имеют
дополнительные петли и/или стебли (например, вариабельная
петля дрожжевой фенилаланиновой тРНК). Каждый стебель
состоит из двух антипараллельных цепей, образующих правую двойную
спираль, известную как А-форма РНК. Эта форма содержит 11 пар
оснований на виток, шаг спирали равен 3.1 нм. Плоскости оснований
составляют около 20° с нормалью к оси двойной спирали. А-форма РНК
близка к аналогичной форме ДНК. РНК не способна менять
конформацию и переходить в В-форму, что обусловлено наличием 2'-ОН
группы в рибозе, которой нет в дезоксирибозе. Пространственная
(третичная) структура молекулы тРНК напоминает по форме букву Г.
«Перекладину» этой буквы образует спираль из акцепторного и Т-
стеблей, а антикодоновый и D-стебли формируют «ножку». В каждой
части содержится примерно 10 пар оснований.
Слайд 38Аминокислотный остаток присоединяеться к З'-концу молекулы тРНК.
Специфичность такой системы переноса обеспечивается
имеется, по крайней мере, одна тРНК для каждой аминокислоты. Так,
тРНК для Рhе обозначается тPHKPhe.
Следует подчеркнуть, что Ф, участвующие в транскрипции, являются
мишенями для ряда БАВ, в частности антибиотиков и токсинов. Например,
токсин бледной поганки - α-аманитин - блокирует РНК-полимеразу II эукариот,
что приводит к прекращению синтеза новых молекул мРНК и многих жизненно
важных белков. Таким образом, формируется вторичная структура, получившая
название клеверного листа. В ней выделяют: а) дигидроуридиловую ветвь, содержащую до 3 остатков дигидроуридина; б) псевдоуридиловую ветвь, содержащую минорные азотистые основания псевдоуридина; в) антикодоновую ветвь, в центре которой находится антикодон, который комплементарен в антипаралельном направлении кодону иРНК; г) дополнительную ветвь. Число составляющих ее нуклеотидов варьирует от 3 до 20. В некоторых тРНК данная ветвь отсутствует; д) акцепторную ветвь с универсальной 3'-концевой последовательностью ЦЦА, служащей акцептором остатка аминокислоты. Который присоединяется к 3’-или 2’-гироксильной группе остатка рибозы последнего нуклеотида .
Слайд 39Каждая аминокислота, как правило, имеет несколько соответсвующих ей
тРНК, которые называются изоакцепторными.
отличаются антикодонами и используются для считывания разных
кодонов иРНК, соответствующих одной и той же аминокислоте. Общее
число генов тРНК в различных организмах сильно варьирует
(у Escherichia coli их около 70, у шпорцевой лягушки Xenopus laevis
около 7 000, у человека – 1300.). Каждый ген тРНК может быть
представлен в геноме десятками копий. Почти все тРНК синтезируются
в виде предшественников – более длинных молекул (пре-тРНК). В
результате процессинга происходит удаление нуклеотидных
последовательностей с флангов пре-тРНК. С 5’-конца фрагмент
нуклеотидной цепи отщепляет фермент, называемой РНКазой Р.
РНКазой P является рибонуклеопротеином, каталитическую функцию в
котором осуществляет РНК-компонент, белок же выполняет структурную
роль. В бактериальной РНКазе P есть участок, комплементарный ЦЦА
участку тРНК. Эукариотическая РНКаза P узнает другие элементы
предшественника тРНК. С 3’-конца пре-тРНК действует экзонуклеаза,
укорачивающая РНК постепенно, удаляя по одному нуклеотиду.
Слайд 40На заключительных стадиях созревания тРНК к 3’-концу
полинуклеотидилтрансфераза присоединяет последовательность ЦЦА.
У эукариот
Она добавляется посттранскрипционно. У прокариот первичный
транскрипт может содержать несколько последовательностей тРНК,
их процессинг включает вырезание индивидуальных молекул тРНК. В
процессе созревания тРНК также происходит модификация
азотистых оснований – в результате которой образуются минорные
основания: псевдоуридин, дигидроуридин, тимидин,
7-метилгуанозин, инозин и др.
Канонические последовательности на границе интрона и экзона,
характерные для пре-иРНК, у пре-тРНК отсутствуют. В тоже время в
составе интронов имеются последовательности комплементарные
антикодону. Спаривание этих последовательностей с антикодоном,
по-видимому, и обуславливает формирование структур,
обеспечивающих протекания сплайсинга.
Слайд 41В последние годы была установлена роль коротких отрезков РНК (малых РНК).
Слайд 42В нормально работающей клетке каждый ген выполняет собственную, строго определенную функцию.
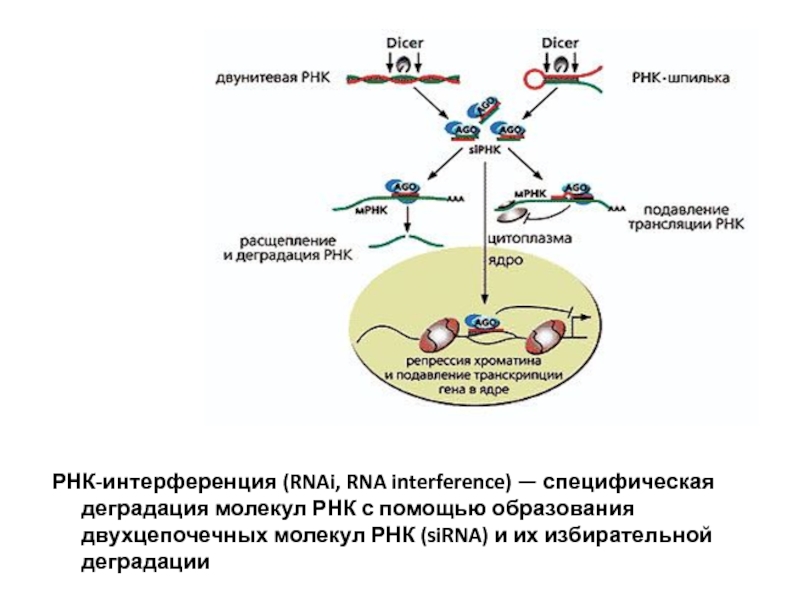
При этом говорят о нормальной экспрессии (от лат. expressus - выразительный, явный) гена в клетке. Если же количество продукта данного гена (например, белка) снижается, то говорят о снижении экспрессии данного гена. Эффект «гашения» экспрессии определенных генов малыми РНК получил название РНК - интерференции, а молекулы, вызывающие его, назвали siRNA (small interfering Ribonucleic Acids - малые интерферирующие рибонуклеиновые кислоты). С открытием siRNA - интерференции стало ясно, что этот феномен может иметь огромное практическое значение.
Слайд 43РНК интерференция
Нобелевскую премию за открытия в области медицины и физиологии в
Малая интерферирующая РНК (siRNA) обладает способностью "выключать" гены, воздействуя на процесс передачи "инструкций" между ДНК и всей остальной «машинерией» клетки.
Обладает исключительной специфичностью по отношению к своему гену-мишени. Основная функция этого механизма – защита наследственной информации. Механизм, связанный с siRNA предохраняет нас как от спорадических мутаций, так и от внешних атак на нашу наследственную информацию.
Слайд 44РНК-интерференция (RNAi, RNA interference) — специфическая деградация молекул РНК с помощью
Слайд 45В класс малых РНК включают молекулы, содержащие от 20 до 300
Слайд 46Если молекула siRNA по тем или иным причинам (например, по воле
Слайд 47Итак, основная «специальность» siRNA в клетке - это блокирование тех генов,
Слайд 48Такие «вторичные» молекулы смогут специфично связываться не только с тем участком
Таким образом, у растений и низших животных организмов siRNA являются важным звеном своеобразного «внутриклеточного иммунитета», позволяющего распознавать и быстро уничтожать чужую РНК. В том случае, если в клетку проник РНК - содержащий вирус, такая система защиты не даст ему размножиться. Если же вирус содержит ДНК, система siRNA будет мешать ему производить вирусные белки (так как необходимая для этого мРНК будет распознаваться и разрезаться), и с помощью этой стратегии, замедлит его распространение по организму.
Слайд 49У млекопитающих же, в отличие от насекомых и растений, работает и
Слайд 50Как можно заметить, обе системы во многом схожи: у них общая
Слайд 51В этом и заключается основное преимущество малых РНК: ни один из
Слайд 52Геном любого многоклеточного организма включает в себя множество элементов, которые когда-то
Слайд 53LINEs, SINEs, остатки вирусной ДНК и транспозоны, за свою способность к
Слайд 54Система внутриклеточных siRNA выполняет «надзирательскую» функцию за поведением мобильных элементов. На
Кроме того, ошибки в развитии органов и тканей при отключении генов, кодирующих систему siRNA у подопытных животных, а также ее активность в «незрелых» клетках указывают на то, что механизм РНК - интерференции активно участвует в регуляции программы «созревания» клеток и, как следствие, может играть одну из ключевых ролей в формировании целостного организма.
Еще одна из предполагаемых нормальных функций siRNA - отслеживание неправильно обработанных копий других типов РНК в клетке.
Имеются данные, что в некоторых случаях siRNA, видимо, воздействует прямо на ДНК, изменяя структуру хроматина и способствуя длительному «замолканию» одних, и, возможно, активизации других генов.
Слайд 55МУЛЬТИФУНК ЦИОНАЛЬНОСТЬ РНК
(1) Кодирующая функция:
программирование белкового синтеза линейными последовательностями полирибонуклеотидов.
(2) Репликативная
(3) Структурообразующая функция (формирование трехмерных структур): само-сворачивание линейных полирибонуклеотидов в уникальные компактные конформации.
(4) Функция специфического узнавания лигандов: специфические пространственные взаимодействия с другими макромолекулами и малыми лигандами.
(5) Каталитическая функция: специфический катализ химических реакций рибозимами.
Слайд 56
КОДИРУЮЩИЕ ФУНКЦИИ РНК
(1) РНК (как и ДНК!) могут служить матрицей для
1962-1964 – открытие самовоспроизведения полиовирусной РНК в животных клетках (D. Baltimore).
1965-1966 – открытие самовоспроизведение РНК бактериофагов типа R17 и MS2 в бактериальных клетках (S. Spiegelman).
(2) РНК могут служить матрицей для синтеза ДНК:
1970 – открытие обратной транскрипции (H.M. Temin, D. Baltimore).
Слайд 57КАТАЛИТИЧЕСКАЯ ФУНКЦИЯ РНК
(РИБОЗИМЫ)
(1) Открытие природных рибозимов:
K. Kruger, P.J. Grabowski, A.J.
C. Guerrier-Takada, K. Gardiner, T. Marsh, N. Pace and S. Altman (1983) The RNA moiety of ribonuclease P is the catalytic subunit of the enzyme. Cell 35: 849-857.
(2) Создание искусственных рибозимов:
D.L. Robertson and G.F. Joyce (1990) Selection in vitro of an RNA enzyme that specifically cleaves single-stranded DNA. Nature 344: 467-468.
Reviewed in: T.R. Cech and B.L. Golden (1999) Building a catalytic active site using only RNA. In The RNA World, 2nd Edition (Eds. R.F. Gesteland et al.), CSHL Press, New York.
Слайд 58КАТАЛИТИЧЕСКИЕ (ЕСТЕСТВЕННАЯ И ИССКУСТВЕННАЯ)
ФУНКЦИИ РНК (РИБОЗИМЫ)
Гидролиз фосфоэфирных связей
Трансэстерификация
Лигирование и
Алкилирование и аминоацилирование нуклеотидов
Синтез амидных (пептидных) связей между аминокислотами
Транспептидация
Синтез углерод-углеродных связей
Слайд 59КАТАЛИТИЧЕСКИЕ (ЕСТЕСТВЕННАЯ И ИССКУСТВЕННАЯ)
ФУНКЦИИ РНК (РИБОЗИМЫ)
Гидролиз фосфоэфирных связей
Трансэстерификация
Лигирование и
Алкилирование и аминоацилирование нуклеотидов
Синтез амидных (пептидных) связей между аминокислотами
Транспептидация
Синтез углерод-углеродных связей
Слайд 60ФУНКЦИЯ УЗНАВАНИЯ МАЛЫХ ЛИГАНДОВ (СУБСТРАТОВ)
(1) E. Cundliffe (1986) Involvement of
«До сих пор не подозреваемая способность РНК узнавать малые молекулы».
(2) Открытие и создание аптамеров. Методология SELEX’a.
А. Ellington and J. Szostak (1990) In vitro selection of RNA molecules that bind specific ligands. Nature 346: 818-822.
C. Tuerk and L. Gold (1990) Systematic evolution of ligands by exponential enrichment. Science 249: 505-510.
Слайд 61ФУНКЦИЯ УЗНАВАНИЯ МАЛЫХ ЛИГАНДОВ (СУБСТРАТОВ)
(3) Демонстрация специфических взаимодействий природных РНК
D. Fourmy, M.I. Recht, S.C. Blanchard and J.D. Puglisi (1996) Structure of the A site of E. coli 16S rRNA complexed with an aminoglycoside antibiotic. Science 274: 1367-1371.
Трехмерные структуры комплексов РНК с аминогликозидными антибиотиками.
(a) Paromomycin-A-site RNA complex.
(b) Tobramycin-RNA aptamers complex.
Reproduced from J.D. Puglisi and J.R. Williamson (1999) In The RNA World,
2nd Edition (Eds. R.F. Gesteland et al.), CSHL Press, New York.