- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Физиология мышц презентация
Содержание
- 1. Физиология мышц
- 2. Классификация мышечных волокон медленные фазические
- 3. быстрые фазические волокна с гликолитическим типом
- 4. Типы мышечных сокращений Изотоническое изометрическое
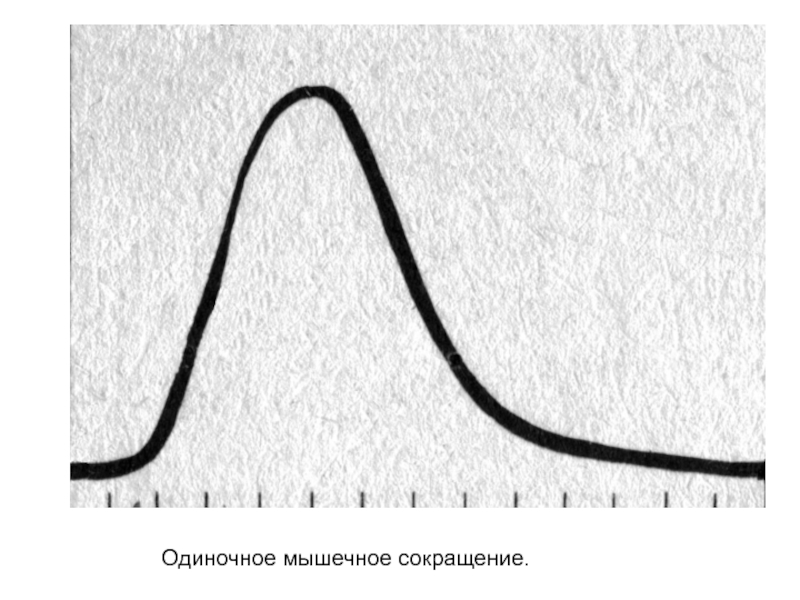
- 5. Одиночное мышечное сокращение.
- 8. Моторная единица (двигательная, нейромоторная ) мотонейрон
- 9. Функциональные особенности Медленные мало утомляемые (тонические)
- 10. Быстрые (фазные) легко утомляемые ДЕ (белые волокна)
- 11. Быстрые устойчивые к утомлению ДЕ по
- 12. Абсолютная сила скелетных мышц (6—17 кг/см2)
- 13. Оптимум и пессимум частоты и силы сокращения.
- 14. Теория мышечного сокращения и расслабления. Хаксли, Хью
- 16. Теория мышечного сокращения и расслабления.
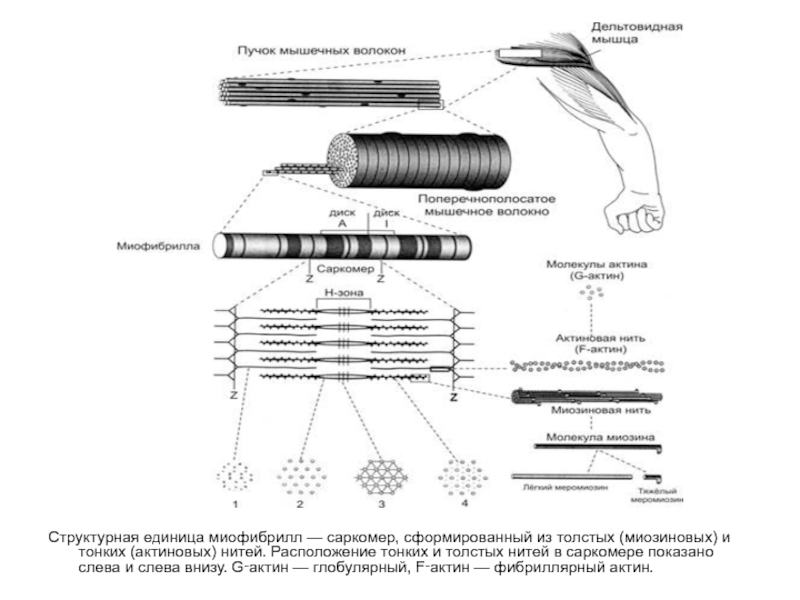
- 17. Структурная единица миофибрилл — саркомер, сформированный из
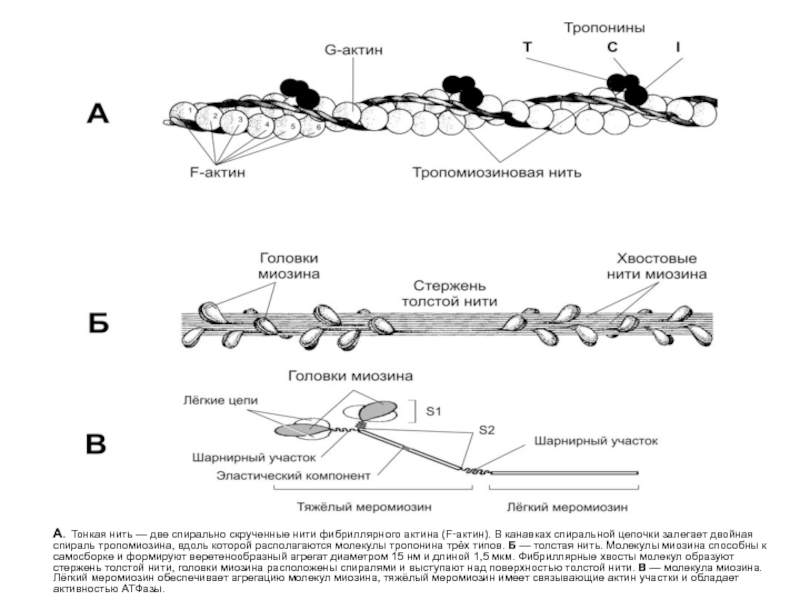
- 19. А. Тонкая
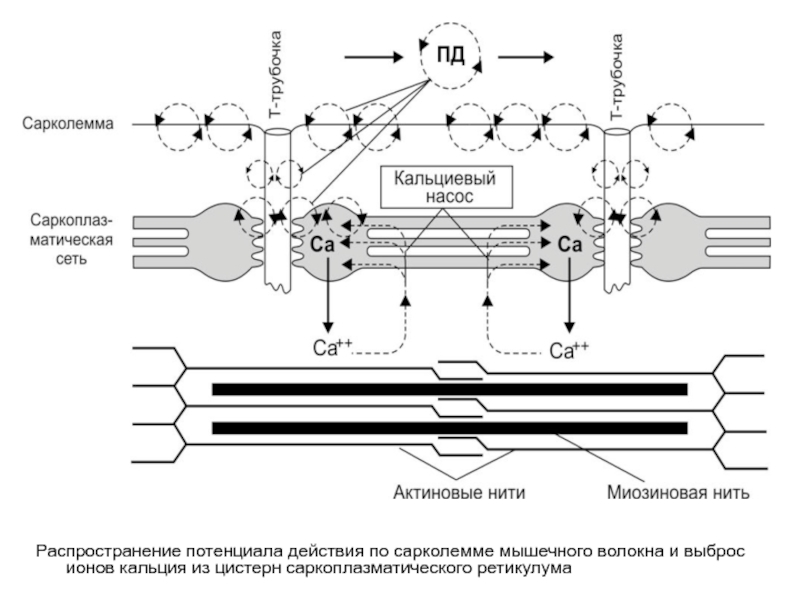
- 20. Распространение потенциала действия по сарколемме мышечного
- 21. Ca2+–зависимый механизм
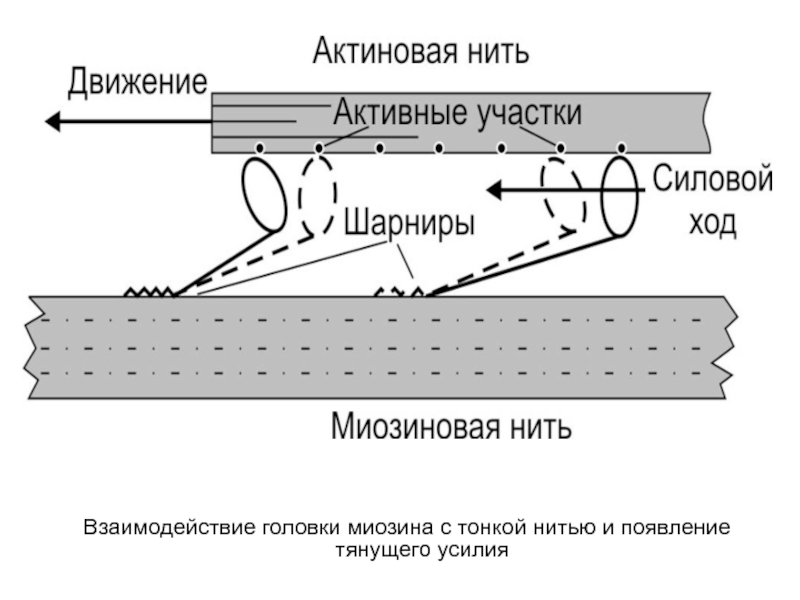
- 22. Взаимодействие головки миозина с тонкой нитью и появление тянущего усилия
- 23. Цикл взаимодействия
- 26. Энергетика мышечного сокращения АТФ в мышце
- 27. Три основных механизма ресинтеза АТФ креатинфосфокиназный (КФ,
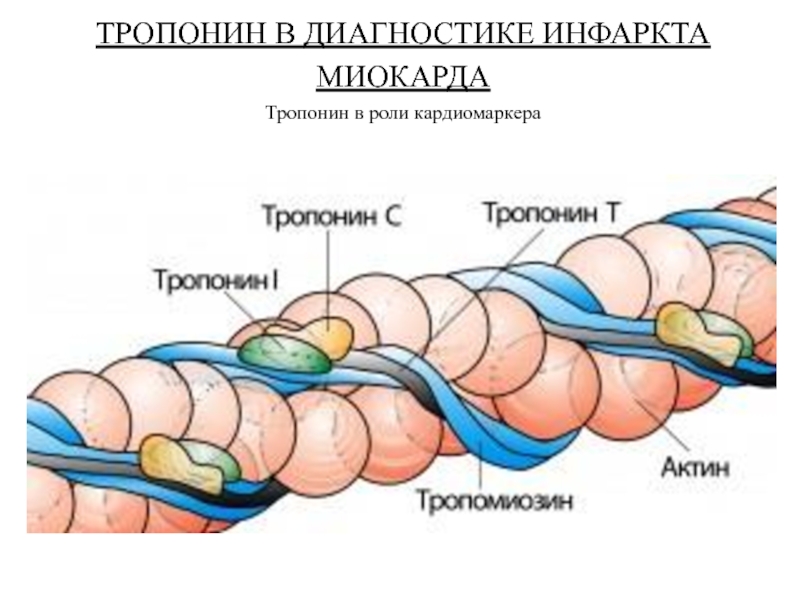
- 31. ТРОПОНИН В ДИАГНОСТИКЕ ИНФАРКТА МИОКАРДА Тропонин в роли кардиомаркера
- 32. Тропонин Т, тропонин С и тропонин I в соотношении 2:1:1.
Слайд 1ФИЗИОЛОГИЯ МЫШЦ
Физиологические свойства мышц
Обмен
проводимость; сократимость; эластичность; пластичность.
Обеспечение позы тела человека, перемещение тела и его частей в пространстве, движение крови по сосудам, дыхание, образование тепла и др.
Слайд 2Классификация мышечных волокон
медленные фазические
волокна окислительного типа (с высоким содержанием
быстрые фазические
волокна окислительного типа (много митоходрий, устойчивы к утомлению, участвуют в выполнении быстрых энергичных движений, АТФ образуется путем окислительного фосфорилирования);
Слайд 3быстрые фазические
волокна с гликолитическим типом окисления (митохондрий мало, осуществляют быстрые,
Классификация мышечных волокон
тонические волокна
сокращение и расслабление медленное, эффективно работают в изометрическом режиме, не подчиняются закону "все или ничего"...;
Слайд 4Типы мышечных сокращений
Изотоническое
изометрическое
ауксометрическое
(смешанное, промежуточное)
Режимы
одиночное;
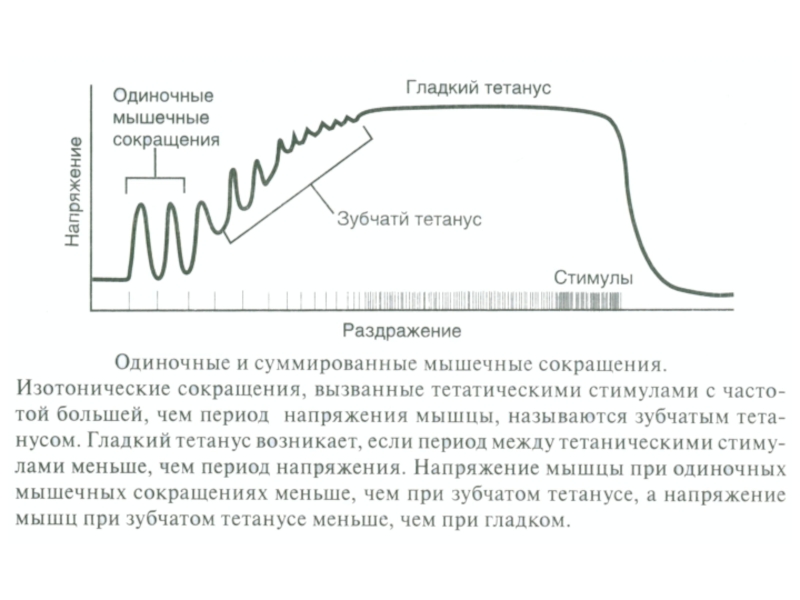
Тетанус
(гладкий, зубчатый;).
Слайд 8Моторная единица (двигательная, нейромоторная ) мотонейрон с группой иннервируемых им мышечных
Виды двигательных единиц
Медленные мало утомляемые (тонические) ДЕ
(красные волокна)
Быстрые (фазные) легко утомляемые ДЕ
(белые волокна)
Быстрые устойчивые к утомлению
В мышце имеются, как правило, все виды ДЕ, но в разных соотношениях.
Слайд 9Функциональные особенности
Медленные мало утомляемые (тонические) ДЕ
(красные волокна)
- иннервируются небольшими
- количество мышечных волокон в ДЕ сравнительно небольшое, они имеют меньшее количество миофибрилл и развивают меньшую силу сокращения;
- волокна имеют низкую активность миозиновой АТФазы и низкую скорость сокращения;
- имеют хорошее кровоснабжение, много митохондрий, миоглобина, высокий аэробный обмен, поэтому обладают низкой утомляемостью. Способны выполнять длительную маломощную работу;
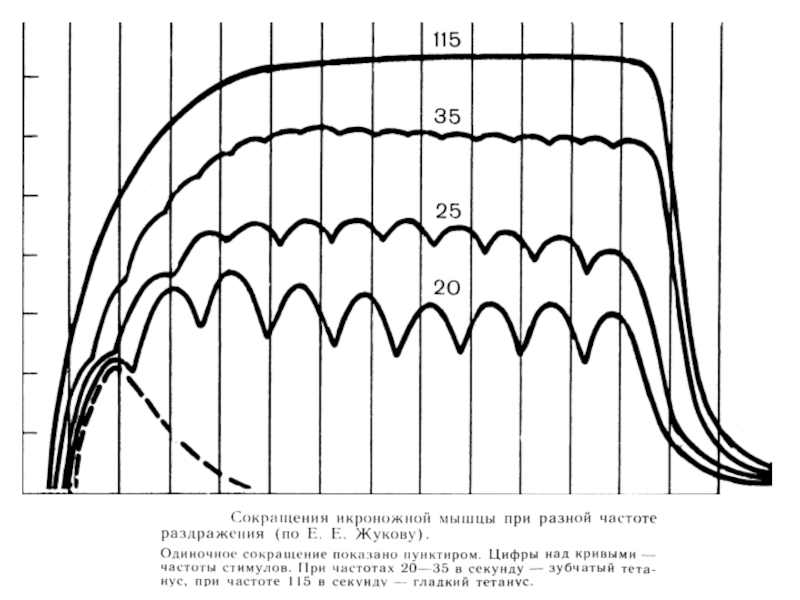
- дают гладкий тетанус при небольшой частоте разряда мотонейрона (около 16 Гц);
- в регуляции движения обеспечивают мышечный тонус и позу, а также способность к длительной циклической работе — бегу, плаванию и др. (например, у марафонцев их количество в мышцах ног достигает 85 %);
- длительность сокращения более 100 мс, не подчиняются закону «все или ничего»
Слайд 10Быстрые (фазные) легко утомляемые ДЕ
(белые волокна)
- иннервируются крупными менее возбудимыми альфа-мотонейронами
- количество мышечных волокон в ДЕ сравнительно большое;
- содержат большое число миофибрилл и развивают большую силу сокращения;
- имеют высокую активность миозиновой АТФазы и развивают высокую скорость сокращения;
- имеют слаборазвитую капиллярную сеть, мало митохондрий, миоглобина, но содержат много гликолитических ферментов, большой запас креатинфосфата и гликогена, анаэробный тип энергообеспечения;
- способны развивать большую мощность, но быстро утомляются;
- дают гладкий тетанус при большей частоте разряда мотонейрона (около 30 Гц);
- в регуляции движения обеспечивают преимущественно фазический компонент — перемещение организма и его частей в пространстве с большой скоростью и мощностью (например, у спринтеров и прыгунов количество быстрых ДЕ в мышцах ног достигает 90 %);
- длительность сокращения 10-30 мс; гладкий тетанус возникает при большей частоте;
Слайд 11Быстрые устойчивые к утомлению ДЕ
по структурно-функциональным свойствам занимают среднее положение между
(вероятно, используются в быстрых ритмических движениях: ходьбе, беге).
Слайд 12Абсолютная сила скелетных мышц (6—17 кг/см2)
максимальная произвольная сила — 50
Факторы, определяющие силу сокращения мышцы
соотношение медленных и быстрых ДЕ (композиция мышцы);
число активных ДЕ, их включение в соответствии с возбудимостью их мотонейронов;
режим работы активных ДЕ (одиночное сокращение, зубчатый и гладкий тетанус);
величина физиологического сечения мышцы (сумма поперечного сечения всех ее волокон; в перистых мышцах она больше геометрического сечения);
длина мышцы и сила сокращения;
сила сокращения мышцы (точнее саркомера) пропорциональна зоне перекрытия актиновых и миозиновых нитей, т. е. количеству образующихся актомиозиновых мостиков. Наибольшая сила развивается при длине мышцы в состоянии покоя;
- при укорочении или удлинении мышцы на 50 % зона перекрытия нитей и сила сокращения резко снижаются.
Слайд 13Оптимум и пессимум частоты и силы сокращения.
В ответ на
Слайд 14Теория мышечного сокращения и расслабления.
Хаксли, Хью англ. биолог
исследовал ультраструктуру
мышечной ткани;
теорию, объясняющую мышечное
сокращение скольжением белковых
нитей (1954)
Хаксли, Эндрю (1917-2012)
Лауреат Нобелевской премии,
создатель теории происхождения потенциала действия (совместно с Ходжкиным и Экклсом),
теории мышечного сокращения (1954)
Слайд 16Теория мышечного сокращения и расслабления.
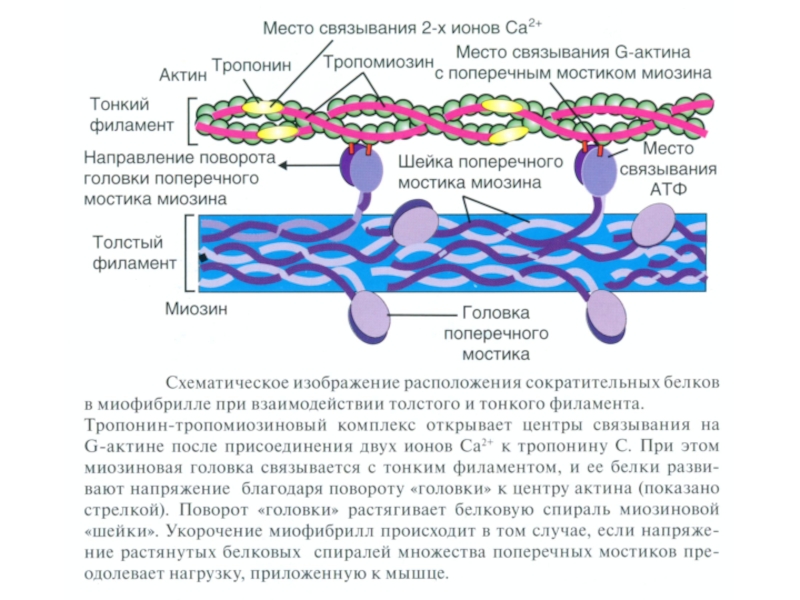
Миозин - обладает длинной прямой цепью с двумя глобулярными головками, каждая из которых содержит зону связывания с АТФ и зону связывания с актином.
Актин – состоит из двух винтообразных тяжей полимеризованных субъединиц (g-актин) с локусами, которые взаимодействуют с головками молекул миозина для образования поперечных мостиков с толстыми волоконами.
Тропомиозин - регуляторный белок фиброзного типа, расположенный в желобке винтообразного тяжа актина, который препятствует взаимодействию актина и миозина, когда мышца находится в покое.
Тропонин - регуляторный белок, состоящий из трех субъединиц: тропонина С (связывает ионы Са++ во время активации и инициирует изменения конфигурации регуляторных белков); тропонина Т (привязывает комплекс тропонина С и тропонина I к тропомиозину); и тропонина I (участвует в ингибировании взаимодействия актина и миозина в состоянии покоя).
Слайд 17
Структурная единица миофибрилл — саркомер, сформированный из толстых (миозиновых) и тонких (актиновых)
Слайд 19
А. Тонкая нить — две спирально скрученные нити
Слайд 20
Распространение потенциала действия по сарколемме мышечного волокна и выброс ионов кальция
Слайд 21
Ca2+–зависимый механизм регуляции взаимодействия актина с миозином
Слайд 23
Цикл взаимодействия тонких и толстых нитей [5].
Слайд 25 Схема
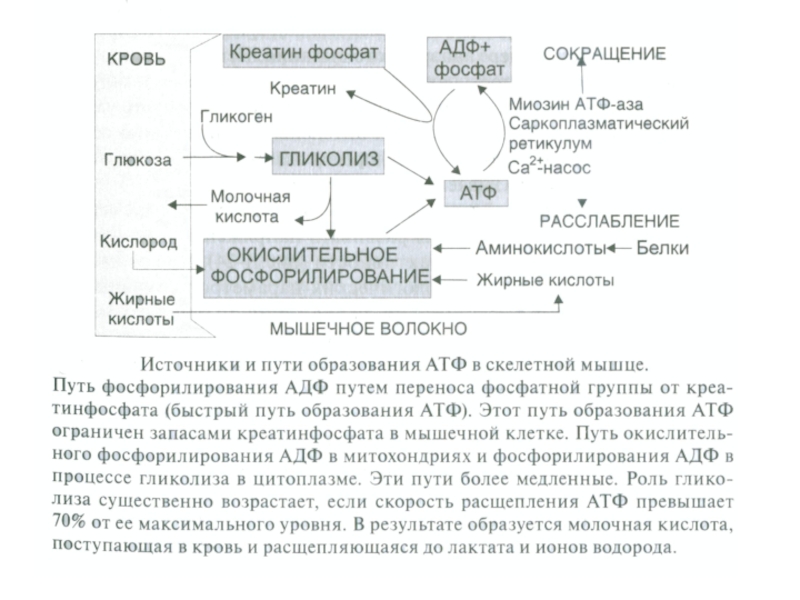
Слайд 26Энергетика мышечного сокращения
АТФ в мышце необходима для:
сокращения (образование мостиков);
расслабления (разрыва мостиков);
работы
- работы Nа-К-насоса (для ликвидации нарушенных ионных градиентов при возбуждении).
Слайд 27Три основных механизма ресинтеза АТФ
креатинфосфокиназный (КФ, фосфагенный; перенос фосфата с креатинфосфата
гликолитический (окислительное фосфорилирование АДФ в митохондриях; до 1,2 моль АТФ в мин.);
- аэробное окисление (окислительный; окислительное фосфорилирование АДФ в митохондриях; при окислении глюкозы АТФ образуется до 0,8 моль/мин, при окислении жиров до 0,4 моль в мин.).














![Ca2+–зависимый механизм регуляции взаимодействия актина с миозином [11]. В покое миозин-связывающие участки тонкой](/img/tmb/5/435311/ffeca6e0df79e241507fbbf8600b0c1c-800x.jpg)
![Цикл взаимодействия тонких и толстых нитей [5]. (А) Исходное положение: головка миозина выстоит](/img/tmb/5/435311/cd43765e3c0b7bd7fb3dbdae55c72df1-800x.jpg)