- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ферменты. Свойства и строение ферментов презентация
Содержание
- 1. Ферменты. Свойства и строение ферментов
- 2. ПОНЯТИЕ О ФЕРМЕНТАХ
- 3. Ферменты или энзимы – это белковые катализаторы,
- 4. От неорганических катализаторов ферменты отличаются рядом характерных
- 5. Ферменты или энзимы обозначают буквой Е Обладают
- 6. Зависимость от РН
- 7. Зависимость от температуры Оптимум температуры для большинства
- 8. Специфичность действия Специфичность действия определяется структурой
- 9. Субстратная специфичность. Различают: абсалютную , групповую и стереоспецифичность
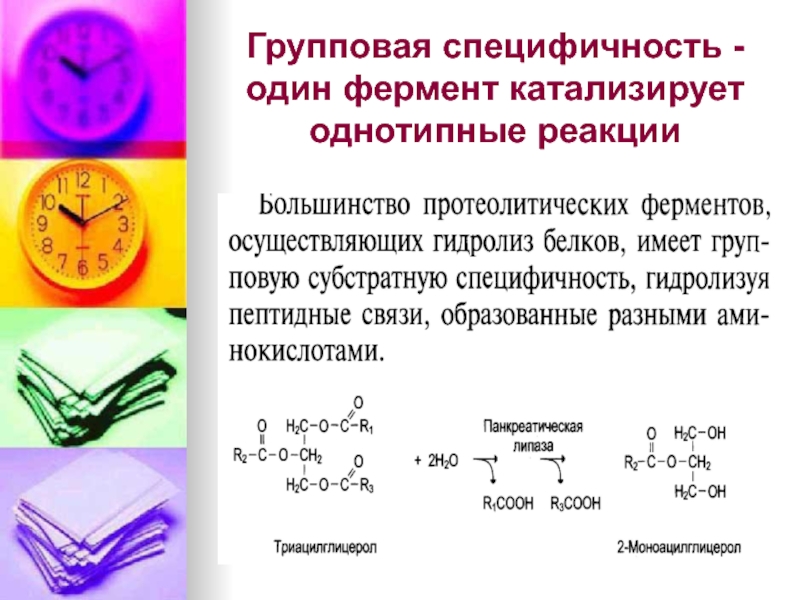
- 10. Групповая специфичность -один фермент катализирует однотипные реакции
- 11. Стереоспецифичность к Д – сахарам Стереоспецифичность к
- 12. Каталитическая специфичность Фермент катализирует превращение
- 13. Строение ферментов Апофермент + Кофактор = Холофермент
- 14. По способам взаимодействия с ферментом различают: коферменты
- 15. Ферменты имеют 2 центра: Активный
- 18. Аллостерический центр Аллостерический центр - комбинация аминокислотных
- 19. Рибозимы
- 20. РИБОЗИМЫ Несмотря на то, что большинство рибозимов
- 21. 3. Способность ферментов к регуляции
- 22. Типы метаболических путей, которые регулируются ключевыми ферментами.
- 23. Регуляция каталитической активности фермента.
- 24. На схемах представлена аллостерическая регуляция по типу:
Слайд 1Ферменты – биологические катализаторы. Свойства и строение ферментов. Автор – доцент Рыскина
Слайд 3Ферменты или энзимы – это белковые катализаторы, ускоряющие химические реакции в
Как и другие катализаторы ферменты: Ускоряют скорость реакции, но не расходуются и не претерпевают необратимых изменений.
Не изменяют состояния равновесия химической реакции, ускоряют как прямую так и обратную реакции в одинаковой степени.
Повышают скорость реакции, понижая энергию активации, тот энергетический барьер который отделяет одно состояние от другого.
Слайд 4От неорганических катализаторов ферменты отличаются рядом характерных особенностей.
Высокой эффективностью действия,
Ферменты отличаются высокой специфичностью действия в отношении как химической природы субстрата, так и типа реакции, т.е. каждый фермент катализирует в основном только определенную химическую реакцию.
Мягким условиями действия (в условиях умеренной температуры, нормального давления и в области близких к нейтральным значениям рН среды.
Способностью к регуляции – возможностью изменять активность в зависимости от концентрации регуляторов и концентрации субстрата
Слайд 5Ферменты или энзимы обозначают буквой Е
Обладают свойствами белков, но имеют и
1. Зависимость от РН
2. Зависимость от температуры
3. Высокая специфичность действия
4. Способностью к регуляции – т.е. могут подвергаться влиянию активаторов или ингибиторов
Слайд 6
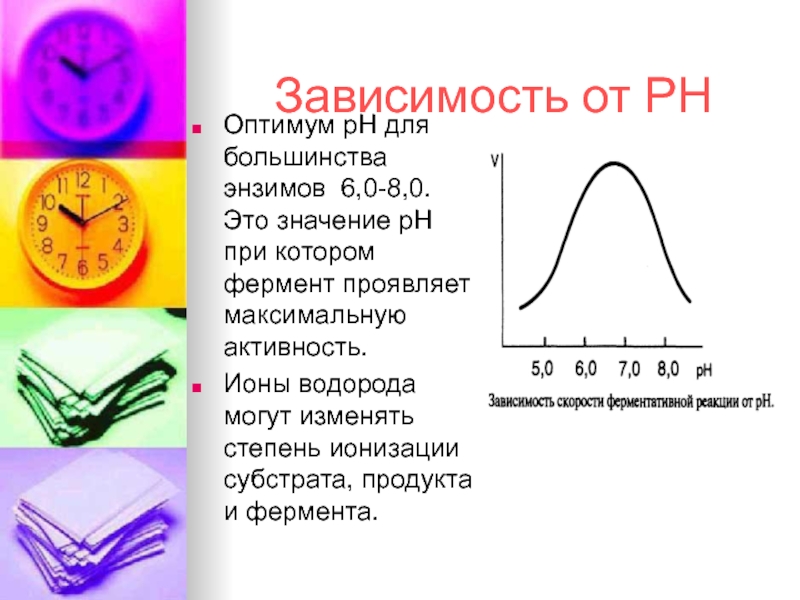
Зависимость от РН
Оптимум рН для большинства энзимов 6,0-8,0. Это значение
Ионы водорода могут изменять степень ионизации субстрата, продукта и фермента.
Слайд 7Зависимость от температуры
Оптимум температуры для большинства энзимов 38-40С, при 41-42С происходит
При повышение t на 10С, скорость ферментативной реакции увеличивается в 2 раза.
Слайд 8Специфичность действия
Специфичность действия определяется структурой активного центра фермента и заключается в
Существуют несколько видов специфичности:
1.Субстратная специфичность
2. Каталитическая специфичность
Слайд 11Стереоспецифичность к Д – сахарам
Стереоспецифичность к L - АМК
Стереоспецифичность к
Например: фумараза активна в отношение транс-изомера – фумарата, и не активна в отношение цис-изомера – малеината.
Слайд 12Каталитическая специфичность
Фермент катализирует превращение субстрата по одному из возможных метаболических путей.
Слайд 13Строение ферментов
Апофермент + Кофактор = Холофермент
Кофакторы ферментов м.б. представлены:
Коферментами – могут быть органические вещества, в состав который часто входят витамины. Обратимо связываются с апоферментом. Функция – только катализ.
Простетической группой, которая прочно связывается с апоферментом. Функции – биологические и катализ. Чаще всего ионы металлов.
Слайд 14По способам взаимодействия с ферментом различают: коферменты и простетические группы.
Кофермент присоединяется
Простетической группой называется кофермент, который прочно связан с ферментом и во время реакции его не покидает. Группа, связавшаяся с коферментом, далее переносится на следующий субстрат или другую молекулу кофермента.
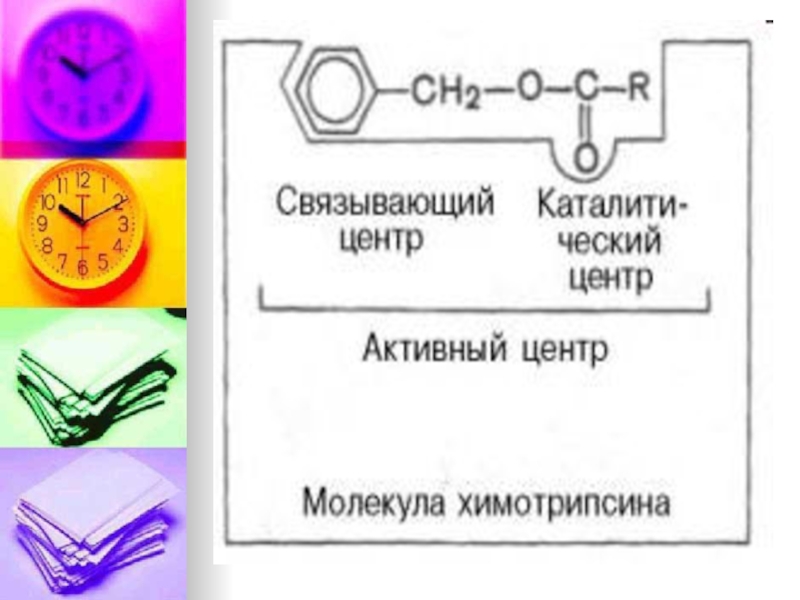
Слайд 15Ферменты имеют 2 центра:
Активный центр и Аллостерический центр.
Активный центр
Слайд 18Аллостерический центр
Аллостерический центр - комбинация аминокислотных остатков на поверхности фермента, с
Присоединение эффектора изменяет третичную структуру и соответственно и конфигурацию АЦФ, вызывая тем самым снижение (ингибиторы) или повышение (активаторы) активности.
Ферменты, которые подвергались воздействию эффекторов называются аллостерическими.