- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ферменты. Общие свойства ферментов презентация
Содержание
- 1. Ферменты. Общие свойства ферментов
- 2. Энергетические изменения ПРИ ХИМИЧЕСКИХ РЕАКЦИЯХ. Любые химические
- 3. Катализ Возможность протекания хим.реакций обусловлена разницей
- 4. Основным механизмом обеспечения протекания жизненных процессов является
- 5. Изменение свободной энергии при разложении угольной кислоты.
- 6. Изменение свободной энергии в ходе химической реакции,
- 7. Энзимы Не каждое столкновение молекул сопровождается
- 8. Ферменты Все биохимические реакции и физиологические процессы
- 9. Ферменты Все ферменты
- 10. Свойства ферментов 1. Очень высокая
- 11. Характеристики ферментов Ферменты характеризуются следующими свойствами:
- 12. Кофакторы и коферменты 1. Небелковые части
- 13. Молекулярная масса РИБОНУКЛЕАЗА ……………....………………..……………………..13700 ТРИПСИН ………………………………………………………………23800
- 14. Состав ферментов в клетке Количественный и качественный
- 15. Избирательность катализа Среди бесчисленного множества возможных биохимических
- 16. Локализация в клетке В каждой клетке имеются
- 17. Полиферментные системы Комплексы ферментов, катализирующих несколько
- 18. Участие ионов магния в присоединении субстрата
- 19. Роль ионов цинка в стабилизации четвертичной структуры алкогольдегидрогеназы.
- 20. Структура ферментов Большинство ферментов являются сложными
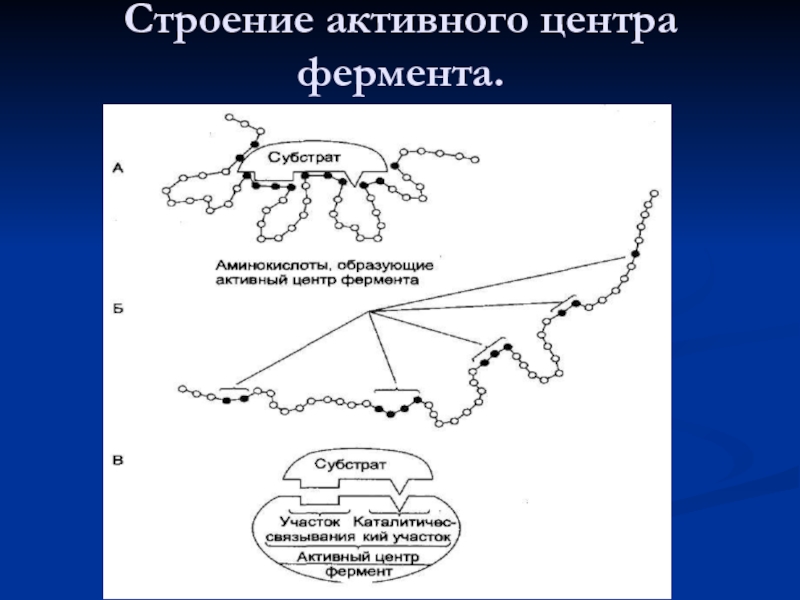
- 21. Строение активного центра фермента.
- 22. Аминокислоты, образующие каталитические центры Серин –
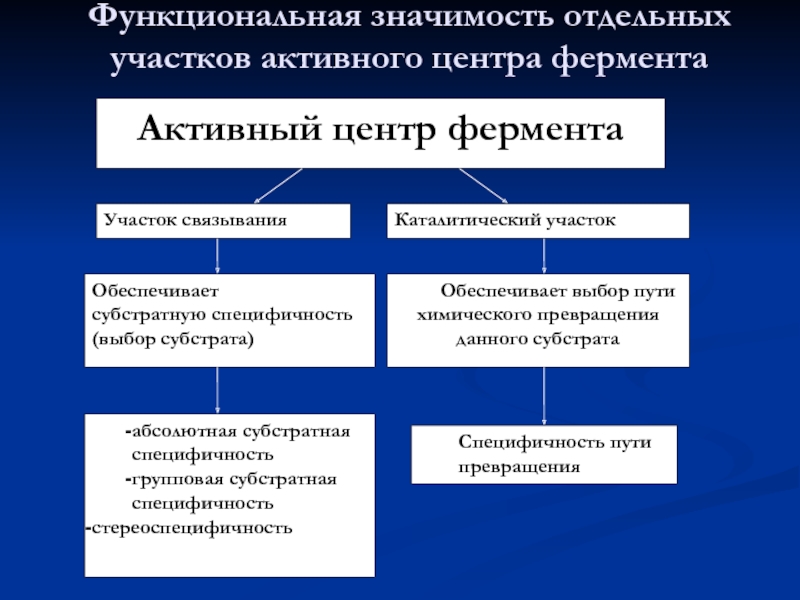
- 23. Функциональная значимость отдельных участков активного центра фермента
- 24. Роль активного центра Активный центр фермента способствует
- 25. К коферментам относят следующие соединения: производные
- 26. Механизмы катализа Повышение скорости биохимических реакций происходит
- 27. Снижение энергетического барьера происходит за счет:
- 28. Механизм ферментативного катализа В механизме ферментативного катализа
- 29. Механизм действия ферментов 1. Стадия: диффузия,
- 30. Функции ферментов Ферменты выполняют три
- 31. Каталитическая эффективность. Большинство катализируемых ферментами реакций
- 32. Молекулярные механизмы 1. Эффект ориентации реагентов
- 33. Для оценки активности ферментов определяют удельную активность
- 34. Активность ферментов Е (международная единица фермента) –
- 35. Значение ферментов Таким образом, клетки и организмы
- 36. Мультисубстратные реакции: Большинство ферментов катализирует реакции,
- 37. Полиферментные системы 1. Каждая клетка имеет
- 38. Роль металлов в присоединении субстрата в активном
- 39. В участке связывания субстрат при помощи
- 40. Образование фермент-субстратного комплекса. где Е — фермент
- 41. Механизм упорядоченного взаимодействия субстрата с активным центром
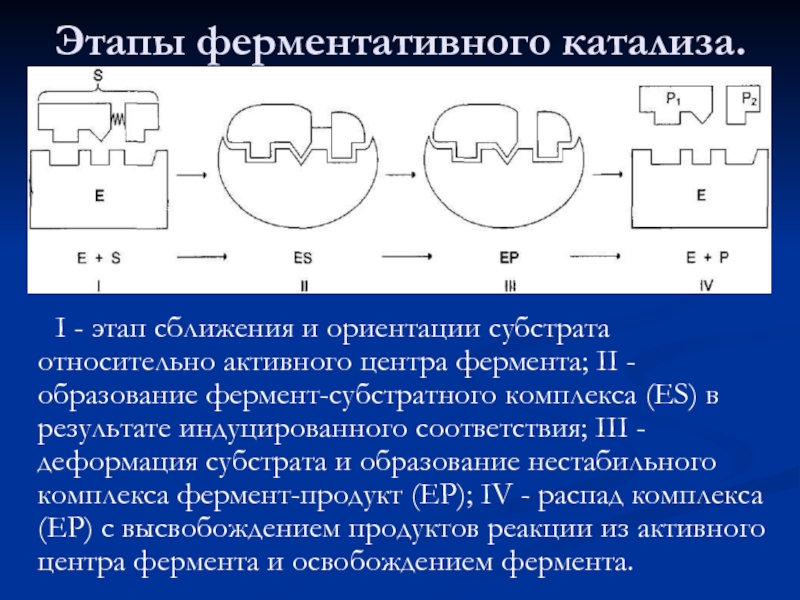
- 42. Этапы ферментативного катализа. I -
- 43. Общие свойства 1. Спецефичность:
- 44. Специфичность. Специфичность — наиболее важное свойство ферментов,
- 45. Специфичность Биологическая функция фермента, как и любого
- 46. Специфичность ферментов В основе лежит строгое
- 47. Лабильность ферментов Каталитическая эффективность фермента, как и
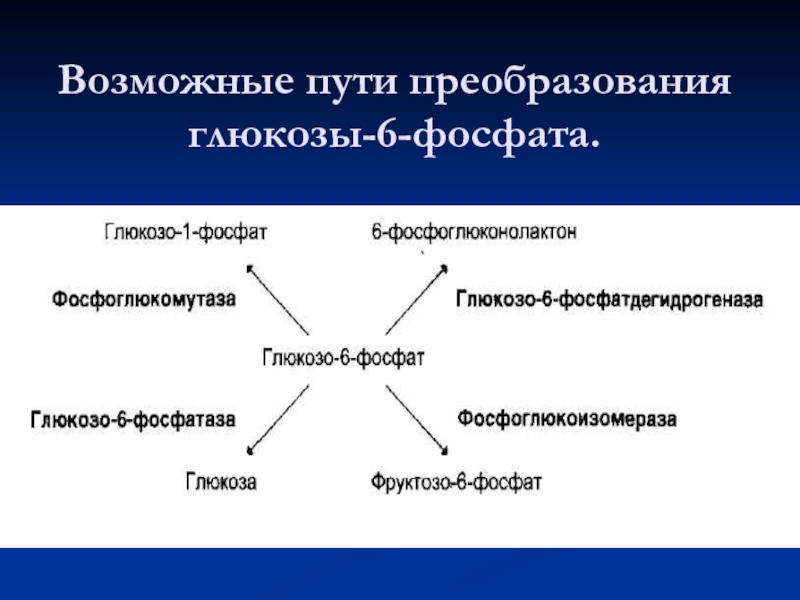
- 48. Возможные пути преобразования глюкозы-6-фосфата.
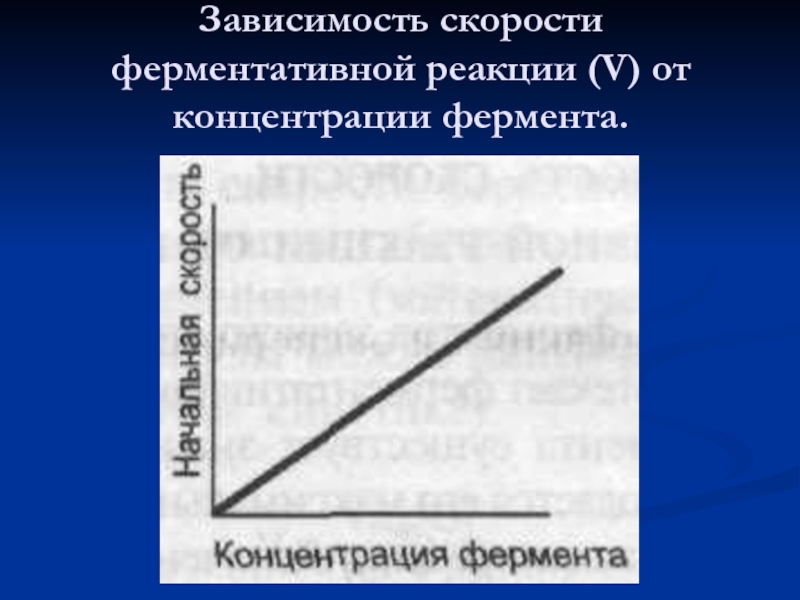
- 49. Зависимость скорости ферментативной реакции (V) от концентрации фермента.
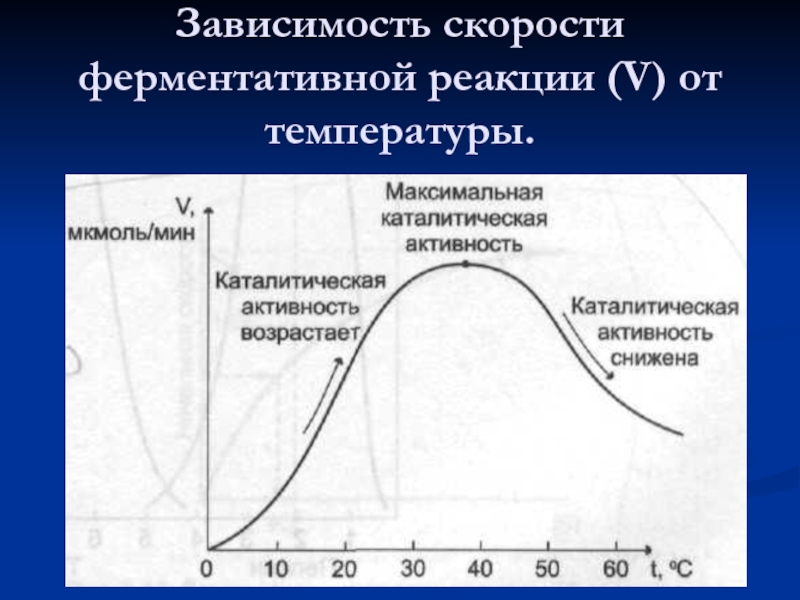
- 50. Зависимость скорости ферментативной реакции (V) от температуры.
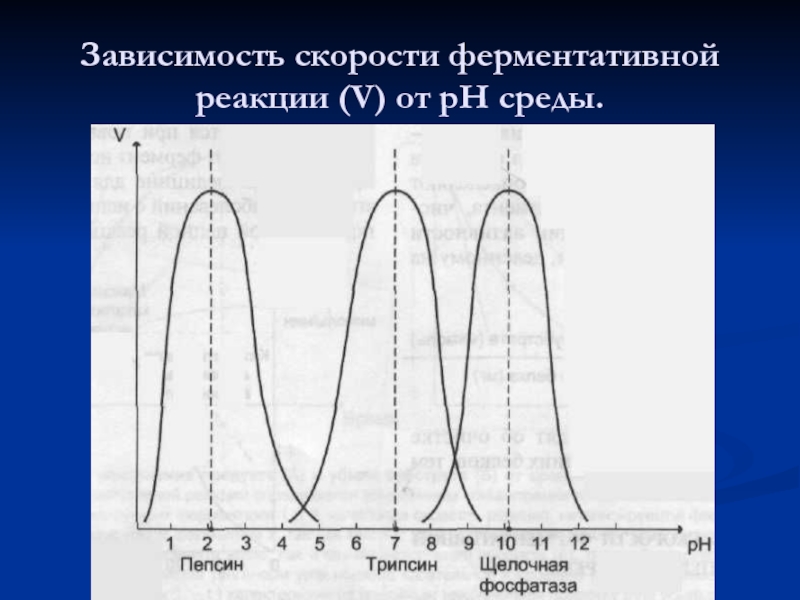
- 51. Зависимость скорости ферментативной реакции (V) от рН среды.
- 52. Оптимальные значения рН для некоторых ферментов.
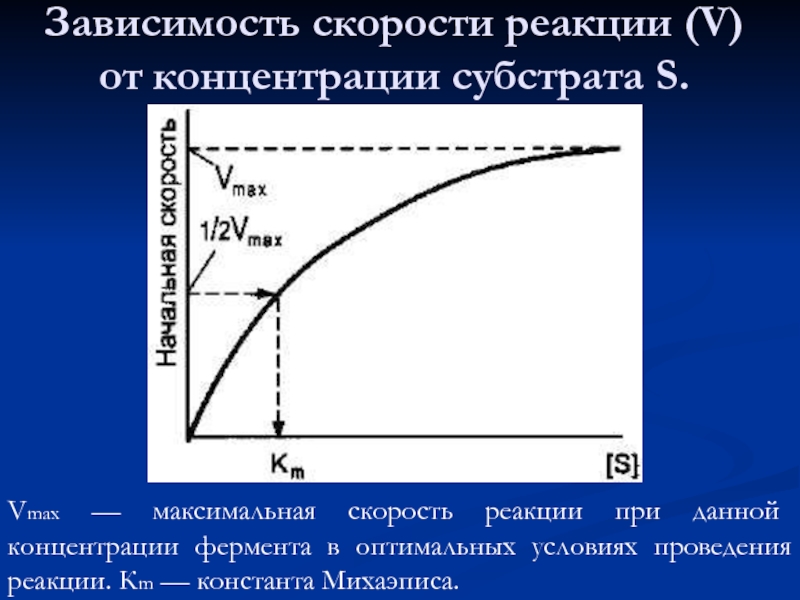
- 53. Зависимость скорости реакции (V) от концентрации субстрата
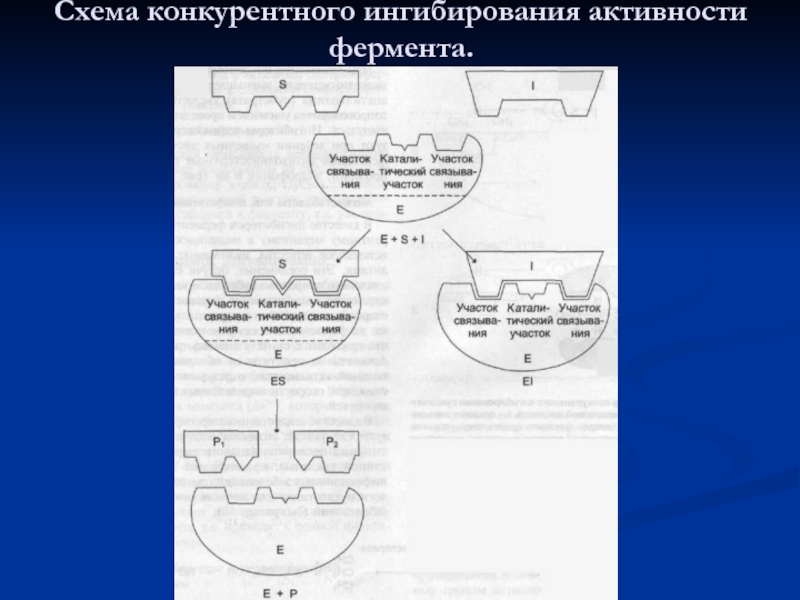
- 54. Схема конкурентного ингибирования активности фермента.
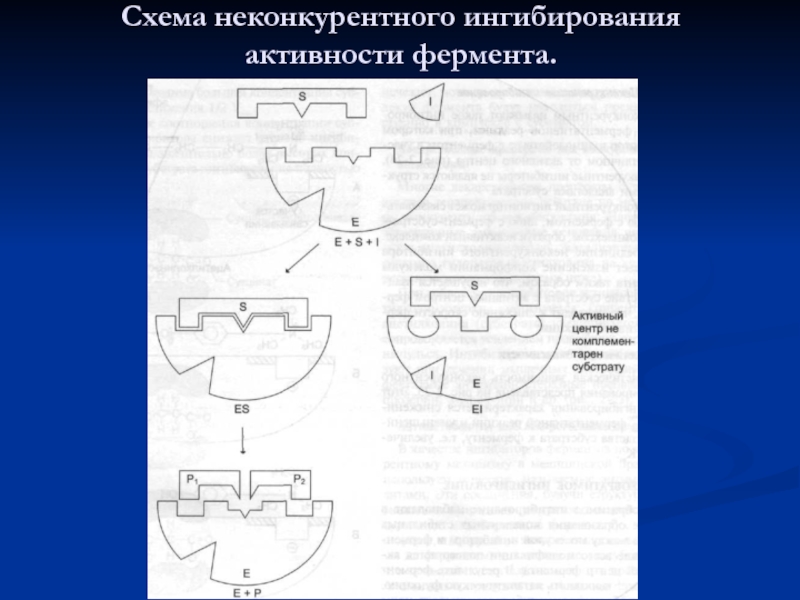
- 55. Схема неконкурентного ингибирования активности фермента.
- 56. Механизм действия ионов ртути как необратимого ингибитора.
- 57. Основные способы регуляции активности ферментов: аллостерическая регуляция;
- 58. Схема положительной и отрицательной регуляции катаболизма глюкозы.
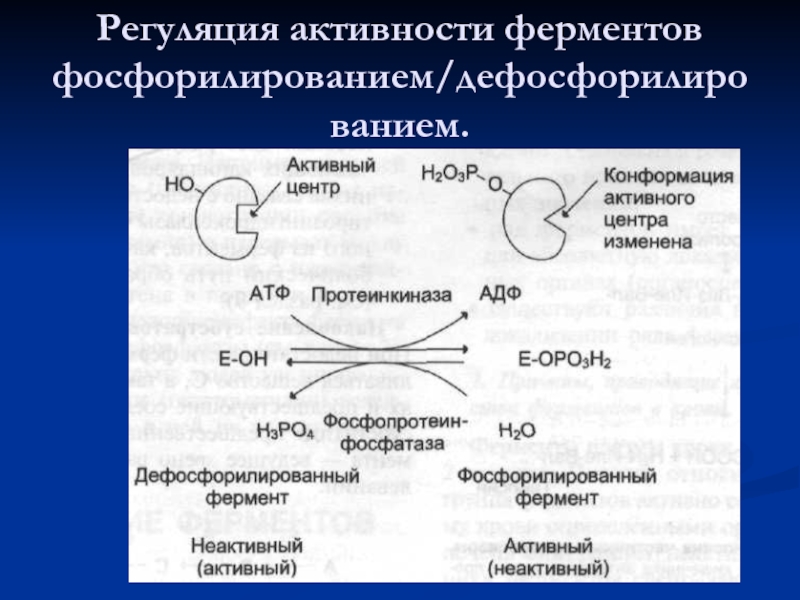
- 59. Регуляция активности ферментов фосфорилированием/дефосфорилированием.
- 60. Каждый фермент имеет 2 названия. Первое
- 61. Оксидоредуктазы.
- 62. Дегидрогеназы. В этот подкласс входят ферменты,
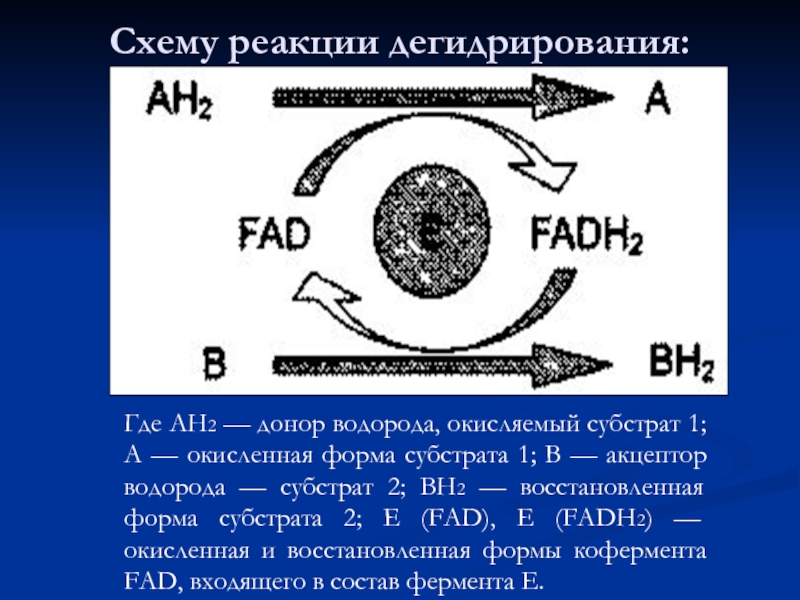
- 63. Схему реакции дегидрирования: Где АН2 — донор
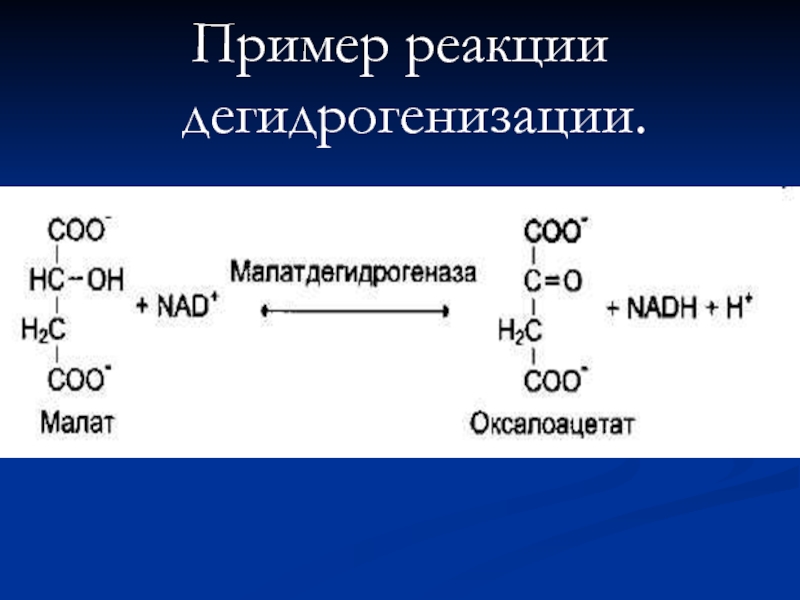
- 64. Пример реакции дегидрогенизации.
- 65. Оксидазы. Акцептором электрона служит молекулярный кислород. Пример реакции, катализируемой цитохромоксидазой:
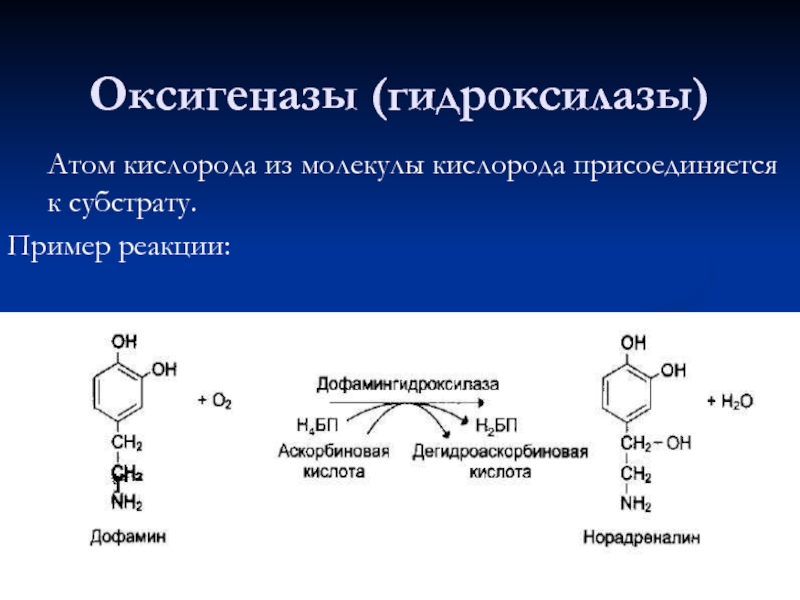
- 66. Оксигеназы (гидроксилазы) Атом кислорода из молекулы
- 67. Трансферазы. Катализируют перенос функциональных групп от одного
- 68. Примеры реакций с участием трансфераз.
- 69. Гидролазы Катализируют реакции гидролиза (расщепления ковалентной
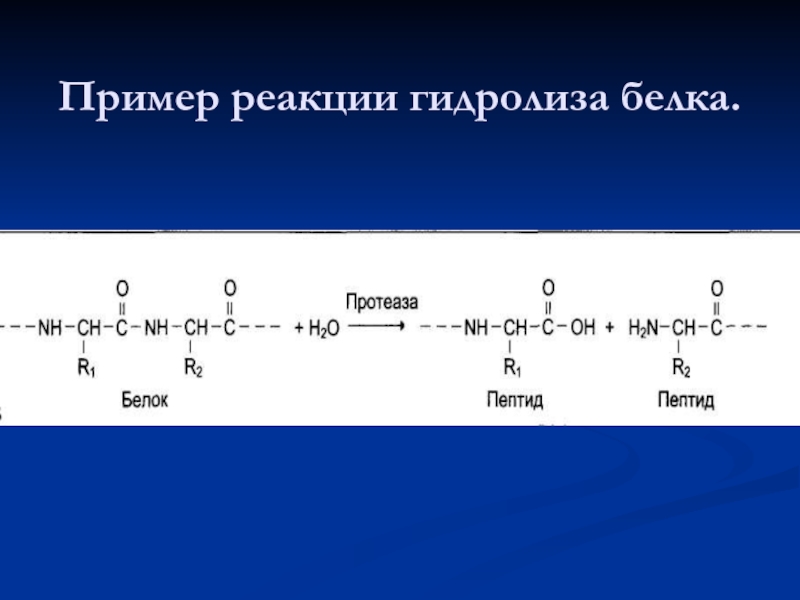
- 70. Пример реакции гидролиза белка.
- 71. Лиазы К лиазам относят ферменты, отщепляющие от
- 72. Примеры реакций с участием лиаз.
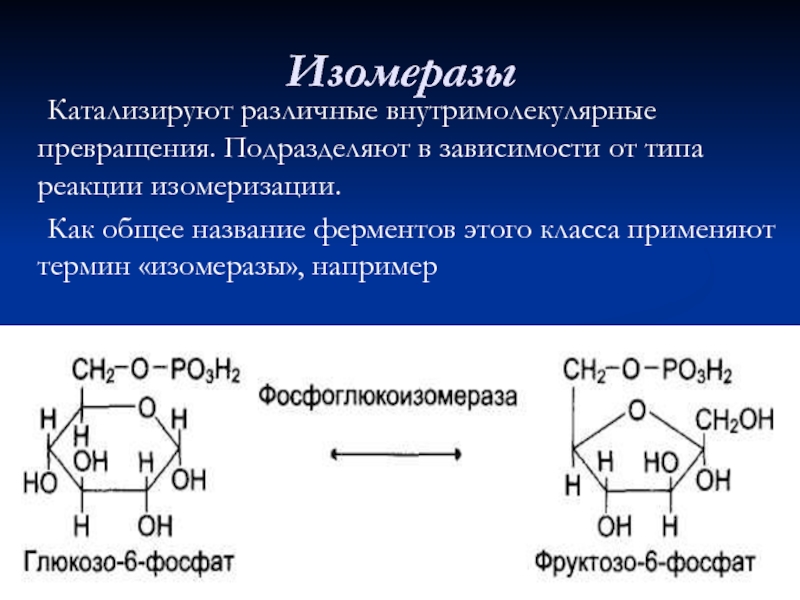
- 73. Изомеразы Катализируют различные внутримолекулярные превращения. Подразделяют в
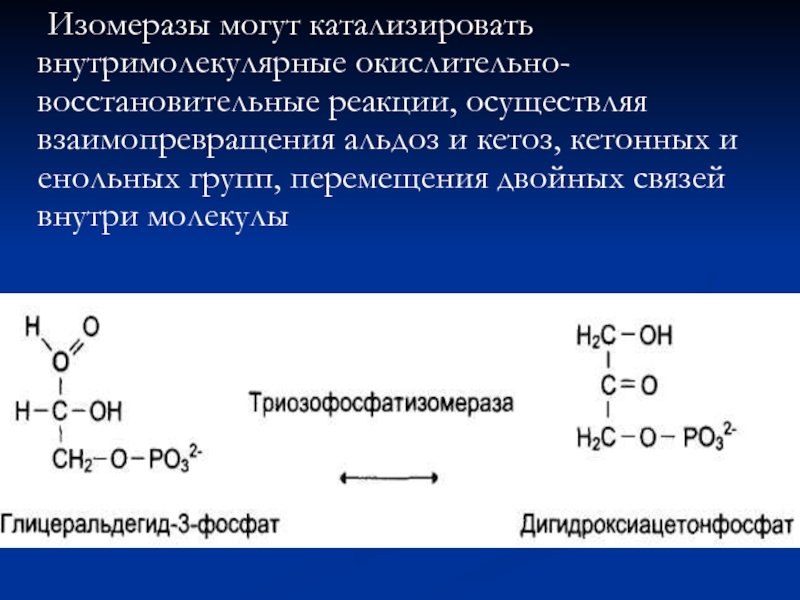
- 74. Изомеразы могут катализировать внутримолекулярные окислительно-восстановительные реакции, осуществляя
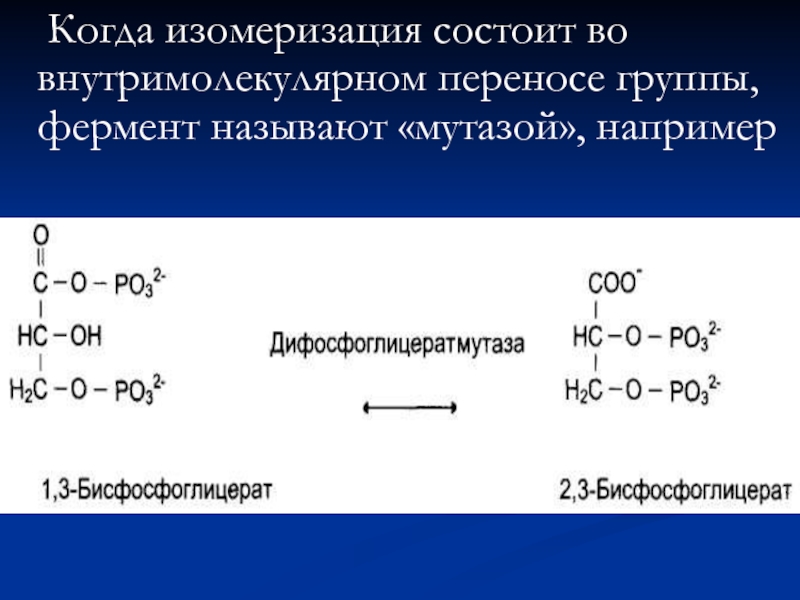
- 75. Когда изомеризация состоит во внутримолекулярном переносе группы, фермент называют «мутазой», например
- 76. Лигазы (синтетазы) Катализируют реакции присоединения друг к другу двух молекул с образованием ковалентной связи.
- 77. Этот процесс сопряжён с разрывом фосфоэфирной связи
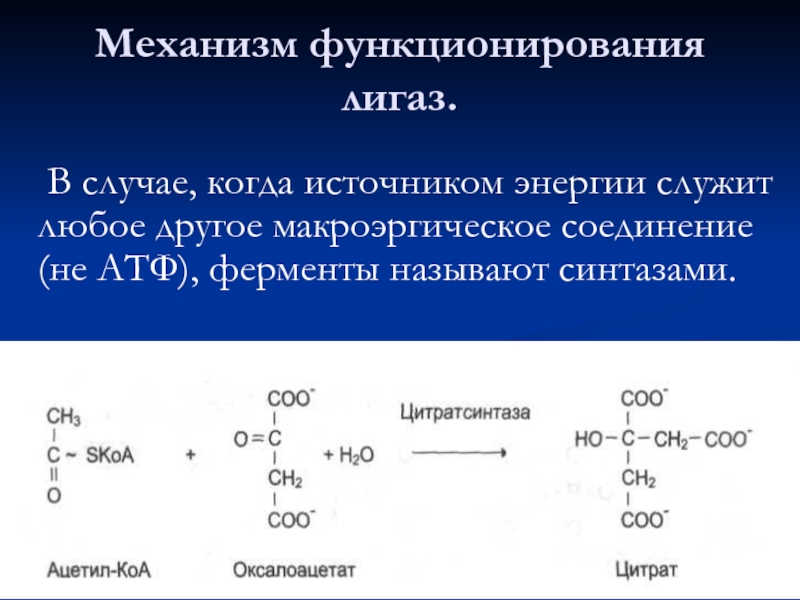
- 78. В случае, когда источником энергии служит любое
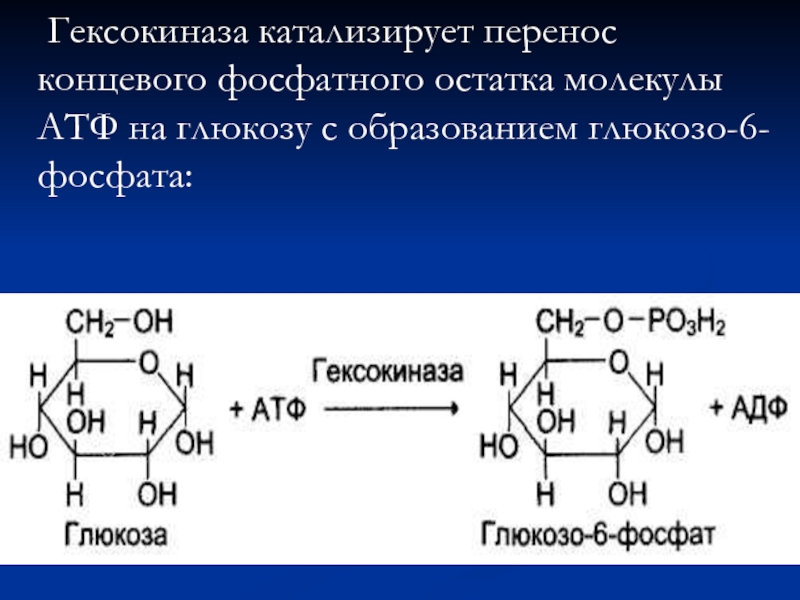
- 79. Гексокиназа катализирует перенос концевого фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата:
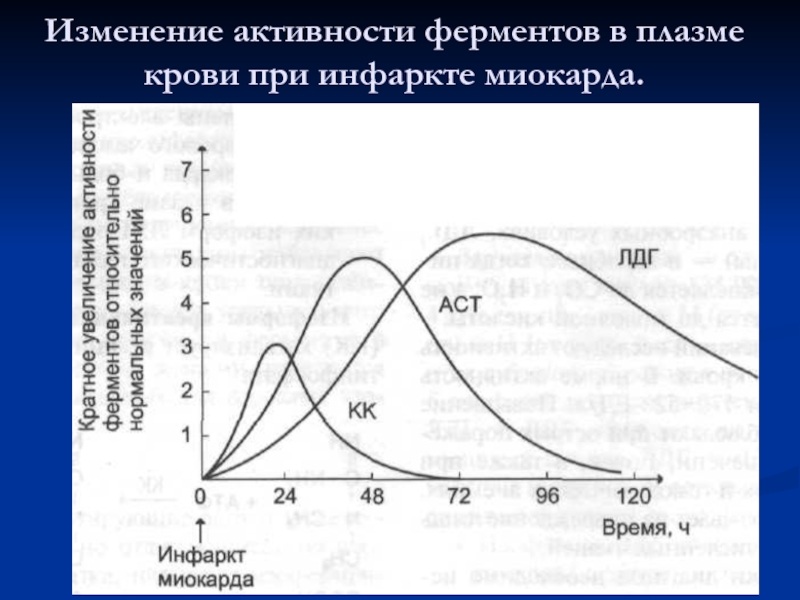
- 80. Изменение активности ферментов в плазме крови при инфаркте миокарда.
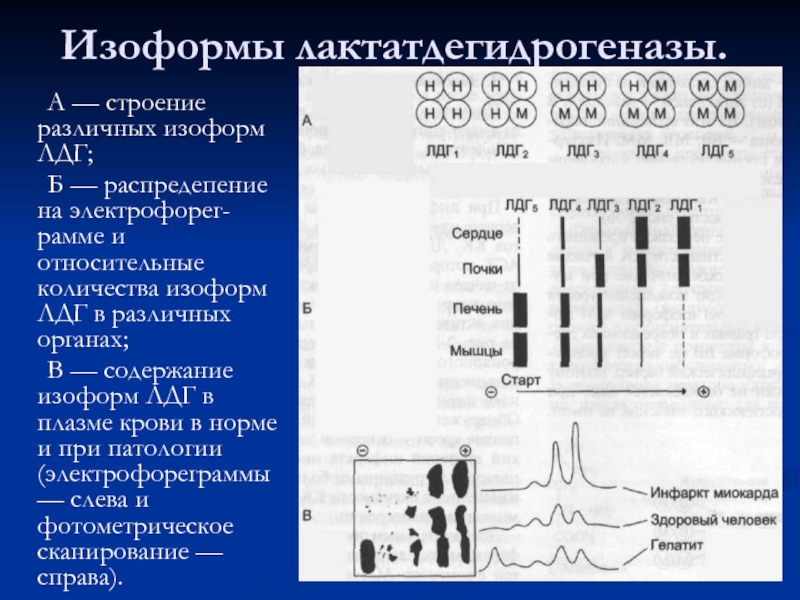
- 81. Изоформы лактатдегидрогеназы. А — строение различных
- 82. Участие в окислительно-восстановительных реакциях: Ионы металлов с
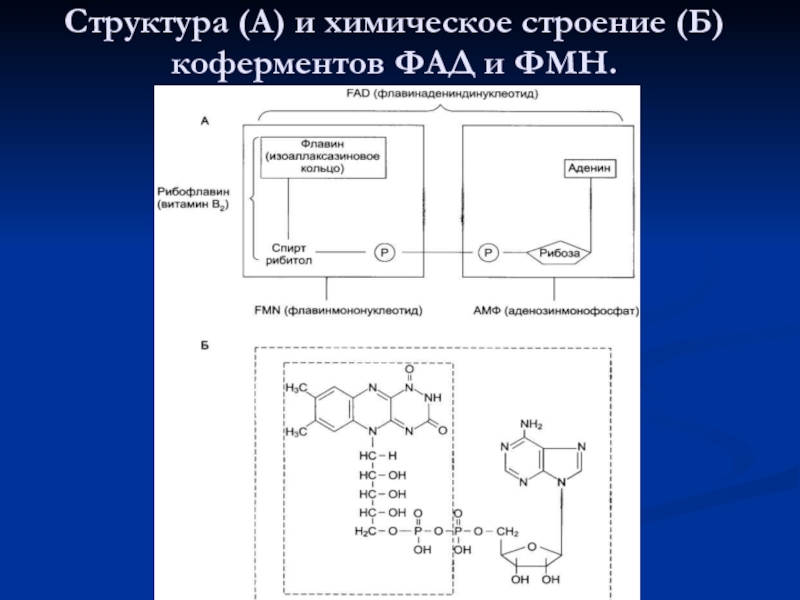
- 83. Структура (А) и химическое строение (Б) коферментов ФАД и ФМН.
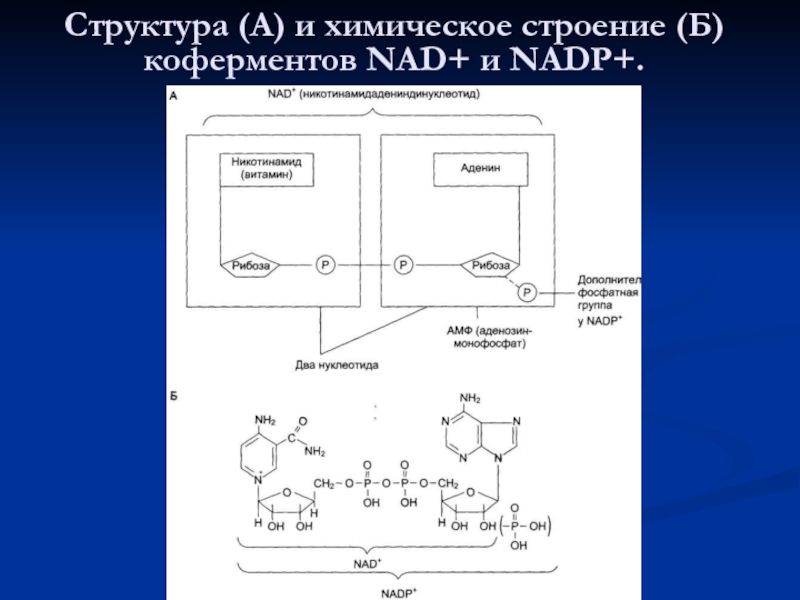
- 84. Структура (А) и химическое строение (Б) коферментов NAD+ и NADP+.
Слайд 1Ферменты
План лекции:
Явление катализа.
Определение, характеристика и значение ферментов.
Локализация ферментов в клетке.
Организация ферментов. Активный центр. Коферменты.
Свойства ферментов: а)специфичность, б) лабильность, в) способность к регуляции, г)эффективность.
Механизм действия ферментов. Полиферментные системы.
Этапы ферментативного катализа.
Активность ферментов и ее регуляция.
Кинетика ферментативных процессов.
Номенклатура и классификация ферментов.
Слайд 2Энергетические изменения
ПРИ ХИМИЧЕСКИХ РЕАКЦИЯХ.
Любые химические реакции протекают, подчиняясь двум основным законам
Слайд 3Катализ
Возможность протекания хим.реакций обусловлена разницей свободной энергии исх. веществ и продуктов.
Возможность протекания и скорость экзергонической реакции зависит от «энергетического барьера», который нужно преодолеть веществом. То есть нужна дополнительная энергия. У реакционно способных молекул энергии достаточно для преодоления барьера.
Энергетическая активация – дополнительное количество энергии, необходимое молекулярным веществам для преодоления энергетического барьера.
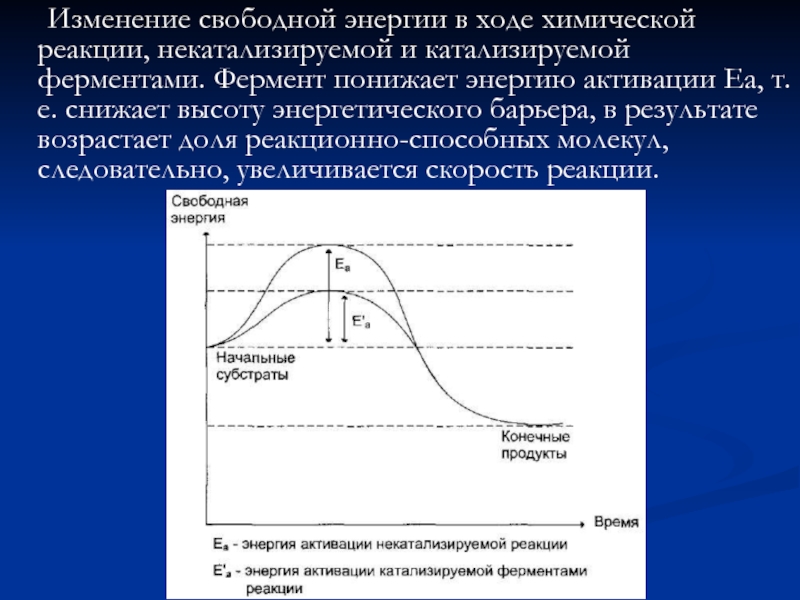
Ферменты снижают энергию активации (Еа) (энергетический барьер) процесса, воздействуя на хим. связи реагирующих веществ. Без привлечения дополнительной энергии. В результате возрастает доля реагирующих молекул, возрастает скорость реакции.
Слайд 4Основным механизмом обеспечения протекания жизненных процессов является избирательный катализ.
Катализ – это
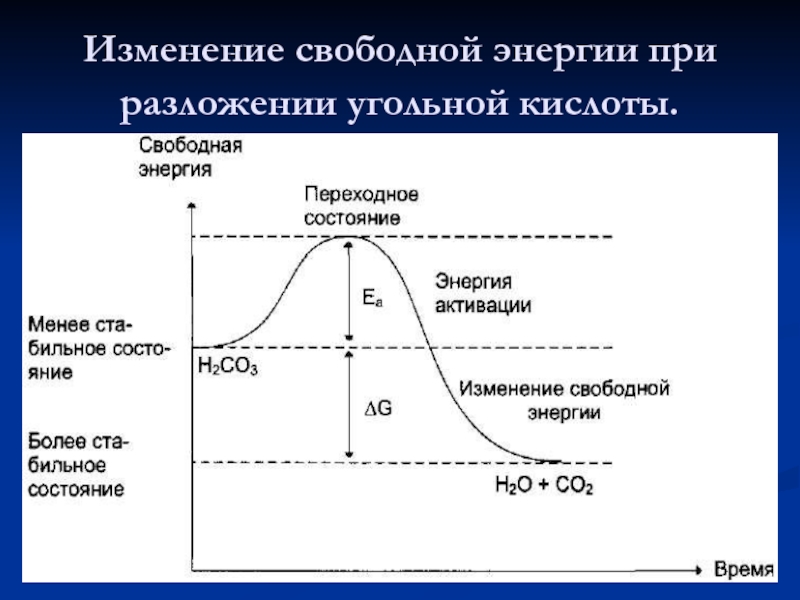
Слайд 6 Изменение свободной энергии в ходе химической реакции, некатализируемой и катализируемой ферментами.
Слайд 7Энзимы
Не каждое столкновение молекул сопровождается их взаимодействием, а только в том
Нагрев, облучение – повышает энергию молекул. Катализатор снижает энергетический барьер, действия на субстраты, расшатывая хим.связи и образуя промежуточные продукты с низким энергетическим уровнем. Происходит внутримолекулярная перестройка молекул субстрата.
Энзимы = Ферменты – катализаторы белковой природы.
Fermentum – закваска; enzyme – в дрожжах.
Катализ – ускорение хим.реакций веществами участвующих в процессе (ферментами), но не расходующихся.
Слайд 8Ферменты
Все биохимические реакции и физиологические процессы в клетках осуществляются при участии
Слайд 9Ферменты
Все ферменты являются белками:
а) простые белки – состоят
б) сложные белки (холоферменты) - состоят из белковой части – апофермента и небелковой - кофермента (простетическая группа).
Слайд 10 Свойства ферментов
1. Очень высокая эффективность.
2. Очень высокая специфичность.
3. Регулируемость, что
4. Работают в мягких условиях (t, р, рН). Чувствительны к изменению этих факторов.
5. Нет побочных продуктов и процессов.
6.Сохраняют активность в изолированном виде.
7. Кооперативность, взаимосвязанность и запрограмированность действия.
Слайд 11Характеристики ферментов
Ферменты характеризуются следующими свойствами: а) практически все ферменты -
Слайд 12Кофакторы и коферменты
1. Небелковые части нуклеотидного типа
2. Нуклеотид три- и дифосфаты
3. Витаминные коферменты
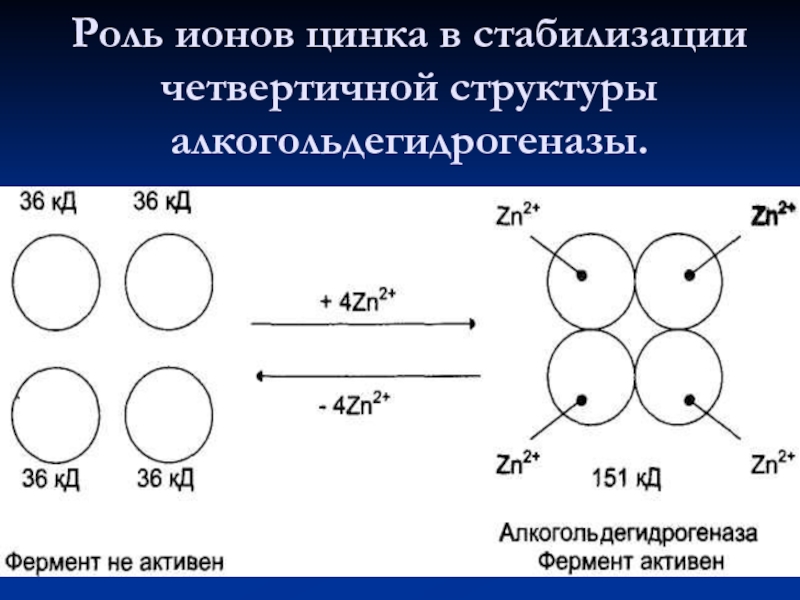
4. Металлы (Zn2+, Cu2+, Fe2+, Mo2+)
5. Пептидные коферменты (глутатион).
Слайд 13Молекулярная масса
РИБОНУКЛЕАЗА ……………....………………..……………………..13700
ТРИПСИН ………………………………………………………………23800
ГЕКСОКИНАЗА ……………………...………………….……………..45000
АЛЬДОЛАЗА ………………………………………………...………..142000
УРЕАЗА ………………………………………………………………..480000
ПИРУВАТДЕГИДРОГЕНАЗА ………………………………...……4500000
Слайд 14Состав ферментов в клетке
Количественный и качественный состав ферментов в клетках контролируется
Слайд 15Избирательность катализа
Среди бесчисленного множества возможных биохимических реакций в клетках, ферменты избирательно
Слайд 16Локализация в клетке
В каждой клетке имеются сотни разновидностей ферментов, катализирующих свои,
Слайд 17Полиферментные системы
Комплексы ферментов, катализирующих несколько последовательных реакций превращения одного вещества,
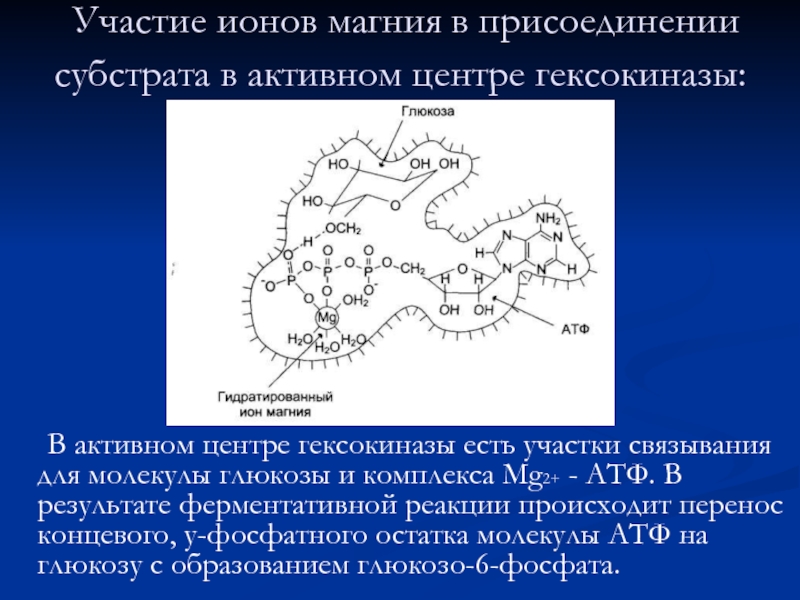
Слайд 18 Участие ионов магния в присоединении субстрата в активном центре гексокиназы:
В активном центре гексокиназы есть участки связывания для молекулы глюкозы и комплекса Мg2+ - АТФ. В результате ферментативной реакции происходит перенос концевого, у-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата.
Слайд 20Структура ферментов
Большинство ферментов являются сложными белками, т.е. состоят из белковой
Слайд 22Аминокислоты, образующие каталитические центры
Серин – ОН
Треонин – ОН
Тирозин – ОН
Цистеин –
Лизин – NH2
Аргинин – HN – C – NH2
||
NH
Гистидин - имидазол
Слайд 24Роль активного центра
Активный центр фермента способствует дестабилизации межатомных связей в молекуле
Слайд 25К коферментам относят следующие соединения:
производные витаминов;
гемы, входящие в состав цитохромов,
нуклеотиды — доноры и акцепторы остатка осфорной кислоты;
убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
S-аденозилметионин (SАМ) — донор метильной группы;
глутатион, участвующий в окислительно-восстановительных реакциях.
Слайд 26Механизмы катализа
Повышение скорости биохимических реакций происходит за счет понижения энергетического барьера
Слайд 27Снижение энергетического барьера происходит за счет:
1. Повышения вероятности столкновения субстратов.
2. Строгая
3. Максимальное сближение субстратов.
4. Действие на определённые атомы субстрата атомами активного центра.
5. Смещение электронов и протонов, что повышает реакционоспособность атомов.
Слайд 28Механизм ферментативного катализа
В механизме ферментативного катализа решающее значение имеет образование нестойких
Слайд 29Механизм действия ферментов
1. Стадия: диффузия, связывание S и образование фермент –
Индуцированное соответствие S активному центру.
ЭА измеряется незначительно. Очень быстрый процесс.
2. Стадия: образование активированного ES*. Резкое снижение ЭА. Взаимодействие Ф и S. Дестабилизация химических связей в S.
3. Стадия: образование продуктов и их выход.
Слайд 30Функции ферментов
Ферменты выполняют три глобальные функции, по обеспечению жизненных
а) катализ – ускорение в тысячи раз химических процессов;
б) избирательность протекания только каталитических процессов, что повышает вероятность осуществления только определенных биохимических реакций из миллионов возможных;
в) целенаправленное использование энергии.
Слайд 31 Каталитическая эффективность.
Большинство катализируемых ферментами реакций высокоэффективны, они протекают в 10—10¹ раз
Количество молекул субстрата, превращенных в продукт с помощью одной молекулы фермента за 1 с, называют числом оборотов фермента, или молярной активностью.
Слайд 32Молекулярные механизмы
1. Эффект ориентации реагентов снижает энтропию и энергию активации, ускоряет
2. Эффект «деформации» субстрата – «растягивается» хим.связь, снижается энергия её разрыва (снижается энергия активации).
3. Кислотно-основной катализ. В активном центре имеются функциональные группы аминокислотных остатков с кислотными и основными группами.
Фермент является и акцептором и донором протонов и электронов. Происходит перераспределение электронной плотности на участке субстрата. Это облегчает перестройку и разрыв связей.
4. Ковалентный катализ – образование ковалентных связей с субстратами.
Слайд 33 Для оценки активности ферментов определяют удельную активность (уд. ак.), равную количеству
Слайд 34Активность ферментов
Е (международная единица фермента) – количество фермента, превращающее 1 мк
Катал (кат) – количество фермента, превращающее 1 моль/сек.
1Е = 16,67 н кат
Удельная активность – количество Е / мг белка.
О наличии фермента судят по действию на субстрат.
Активность определяют косвенно:
по количеству образующегося продукта (Р),
По количеству потребляемого субстрата.
Слайд 35Значение ферментов
Таким образом, клетки и организмы обеспечивают свой метаболизм и функции
Слайд 36Мультисубстратные реакции:
Большинство ферментов катализирует реакции, в которых участвует более чем
Слайд 37Полиферментные системы
1. Каждая клетка имеет специфичный состав ферментов.
2. Некоторые ферменты содержатся
3. Работа каждого фермента, обычно, не индивидуальна, а связана с другими ферментами из которых формируется полиферментные системы – конвейеры.
4. Субстрат проходит длинную цепь реакции многих ферментов Р1→S2→Р2→S3
5. Некоторые ферменты системы связаны с органеллами, биомембранной или цитоскелетом.
6. Некоторые ферменты одной цепи метаболизма объединяются в мультиферментные комплексы с определенной функцией.
Слайд 38Роль металлов в присоединении субстрата в активном центре фермента.
Ионы металла выполняют
Слайд 39 В участке связывания субстрат при помощи нековалентных связей взаимодействует (связывается)
Механизм действия ферментов
Слайд 40Образование фермент-субстратного комплекса.
где Е — фермент (энзим), 3 — субстрат, Р
Схематично процесс катализа можно представить следующим уравнением:
Слайд 41Механизм упорядоченного взаимодействия субстрата с активным центром фермента:
Первым в активный центр
Слайд 42Этапы ферментативного катализа.
I - этап сближения и ориентации субстрата
Слайд 43Общие свойства
1. Спецефичность:
относительная
оптическая
2. Эффективность
3. Способность к регуляции
4. Чувствительность к рН
5. Термолабильность
Слайд 44Специфичность.
Специфичность — наиболее важное свойство ферментов, определяющее биологическую значимость этих молекул.
Слайд 45Специфичность
Биологическая функция фермента, как и любого белка, обусловлена наличием в его
Слайд 46Специфичность ферментов
В основе лежит строгое соответствие размеров и структуры субстратов активному
1. Абсолютная специфичность – только один субстрат (уреаза взаимодей твует только с мочевиной).
2. Разновидность-стехиометрическая специфичность – действие только на определенные стереоизомеры. Фумараза действует только на фумаровую к-ту.
3. Относительная (групповая) – действуют на группу веществ имеющих один тип связи. Амилаза – на крахмал, гликоген, декстрины, пепсин – на разные белки.
Слайд 47 Лабильность ферментов
Каталитическая эффективность фермента, как и любой белковой молекулы, зависит от
Для ферментов характерна конформационная лабильность — способность к небольшим изменениям нативной конформации вследствие разрыва слабых связей. Поэтому воздействие денатурирующих агентов, способных изменять конформацию молекулы фермента, приводит к изменению конформации активного центра и снижению способности присоединять субстрат. В результате этого уменьшается каталитическая эффективность фермента.
Слайд 53Зависимость скорости реакции (V) от концентрации субстрата S.
Vmax — максимальная
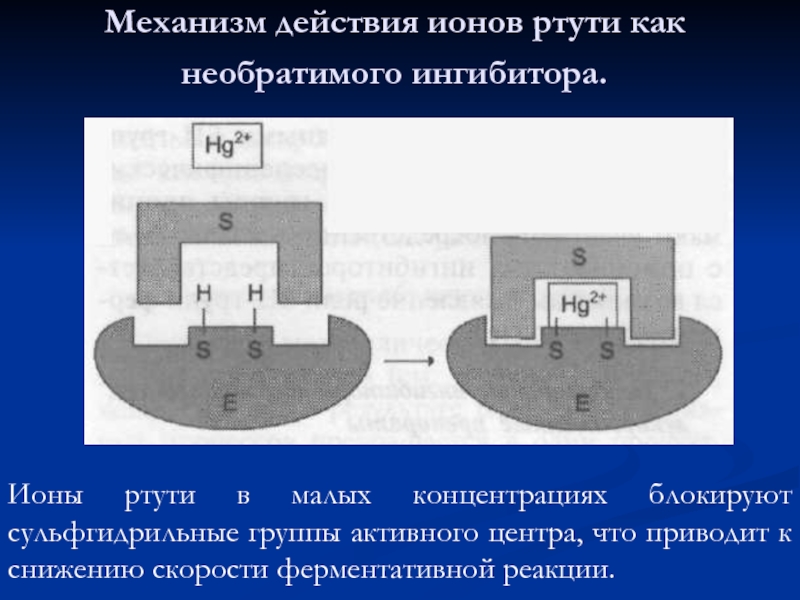
Слайд 56Механизм действия ионов ртути как необратимого ингибитора.
Ионы ртути в малых
Слайд 57Основные способы регуляции активности ферментов:
аллостерическая регуляция;
регуляция с помощью белок-белковых взаимодействий;
регуляция путём
регуляция частичным (ограниченным) про- теолизом.
регуляция путем синтеза ферментов.
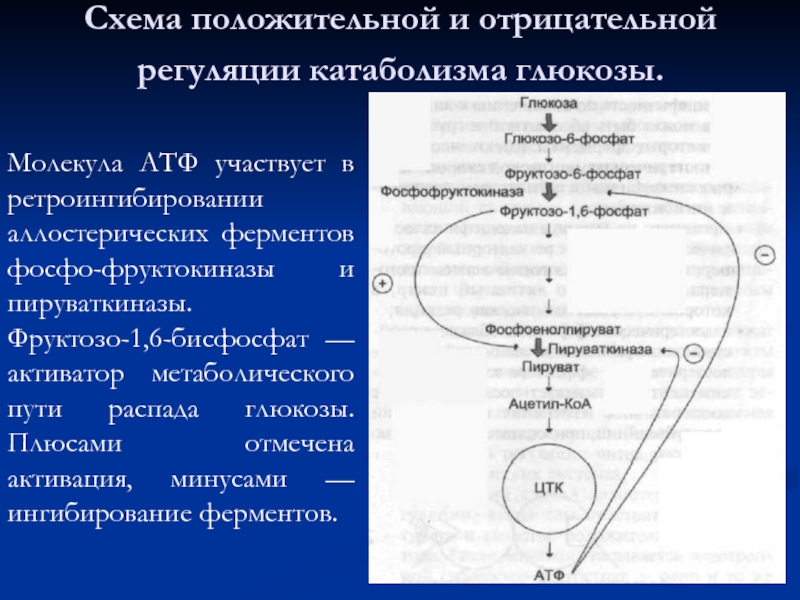
Слайд 58Схема положительной и отрицательной регуляции катаболизма глюкозы.
Молекула АТФ участвует в
Слайд 60
Каждый фермент имеет 2 названия. Первое — короткое, так называемое рабочее,
КЛАССИФИКАЦИЯ
И НОМЕНКЛАТУРА ФЕРМЕНТОВ
Слайд 62Дегидрогеназы.
В этот подкласс входят ферменты, катализирующие реакции дегидрирования (отщепления водорода).
Слайд 63Схему реакции дегидрирования:
Где АН2 — донор водорода, окисляемый субстрат 1; А
Слайд 65Оксидазы.
Акцептором электрона служит молекулярный кислород. Пример реакции, катализируемой цитохромоксидазой:
Слайд 66Оксигеназы (гидроксилазы)
Атом кислорода из молекулы кислорода присоединяется к субстрату.
Пример
Слайд 67Трансферазы.
Катализируют перенос функциональных групп от одного соединения к другому. Подразделяют в
Название этих ферментов составляют по формуле «донор: акцептор транспортируемая групга-трансфераза». К классу трансфераз относят аминотрансферазы, ацилтрансферазы, метилтрансферазы, гликозилтрансферазы, киназы (фосфо-трансферазы).
Слайд 69Гидролазы
Катализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды
Наименование ферментов составляют по формуле «субстрат—гидролаза» или прямым присоединением к названию субстрата суффикса «аза», например протеаза, липаза, фосфолипаза, рибонуклеаза.
Для отдельных классов гидролаз применимы специальные термины, характеризующие гидролиз определённой химической связи: эстеразы, фосфатазы и др.
Слайд 71Лиазы
К лиазам относят ферменты, отщепляющие от субстратов негидролитическим путём определённую группу
Наименование ферментов составляют по формуле «субстрат—отщепляемая или присоединяемая группировка».
Слайд 73Изомеразы
Катализируют различные внутримолекулярные превращения. Подразделяют в зависимости от типа реакции изомеризации.
Как
Слайд 74 Изомеразы могут катализировать внутримолекулярные окислительно-восстановительные реакции, осуществляя взаимопревращения альдоз и кетоз,
Слайд 75 Когда изомеризация состоит во внутримолекулярном переносе группы, фермент называют «мутазой», например
Слайд 76Лигазы (синтетазы)
Катализируют реакции присоединения друг к другу двух молекул с образованием
Слайд 77 Этот процесс сопряжён с разрывом фосфоэфирной связи в молекуле АТФ (или
Слайд 78 В случае, когда источником энергии служит любое другое макроэргическое соединение (не
Механизм функционирования лигаз.
Слайд 79 Гексокиназа катализирует перенос концевого фосфатного остатка молекулы АТФ на глюкозу с
Слайд 81Изоформы лактатдегидрогеназы.
А — строение различных изоформ ЛДГ;
Б — распредепение
В — содержание изоформ ЛДГ в плазме крови в норме и при патологии (электрофореграммы — слева и фотометрическое сканирование — справа).