- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ферменты. Общие свойства ферментов презентация
Содержание
- 1. Ферменты. Общие свойства ферментов
- 2. Катализ Возможность протекания хим.реакций обусловлена разницей свободной
- 3. Ферменты = Энзимы Fermentum – закваска; enzyme
- 4. Ферменты 1) простые белки 2) сложные белки
- 5. Молекулярная масса РИБОНУКЛЕАЗА ……………....………………..……………………..13700 ТРИПСИН ………………………………………………………………23800 ГЕКСОКИНАЗА ……………………...………………….……………..45000 АЛЬДОЛАЗА ………………………………………………...………..142000 УРЕАЗА ………………………………………………………………..480000 ПИРУВАТДЕГИДРОГЕНАЗА ………………………………...……4500000
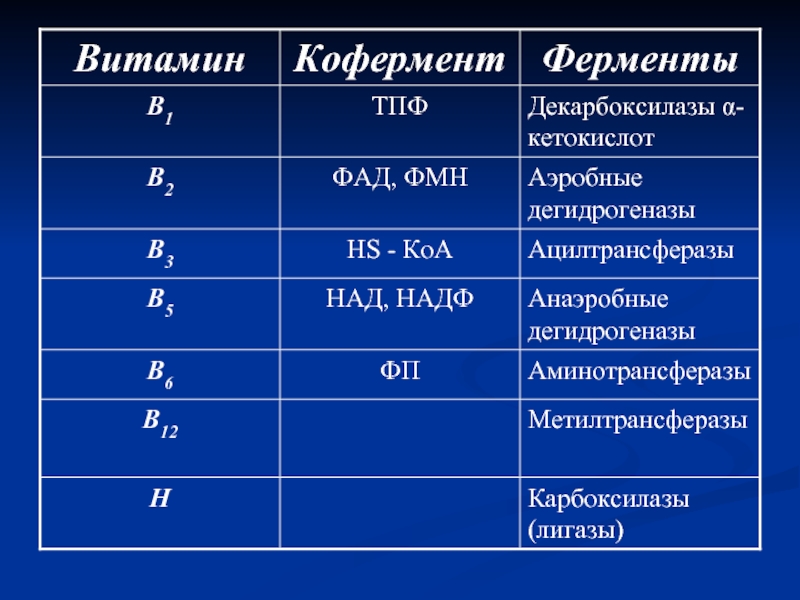
- 6. Кофакторы и коферменты 1. Небелковые части нуклеотидного
- 7. К коферментам относят следующие соединения: производные
- 8. Аминокислоты, образующие каталитические центры Серин – ОН
- 10. Роль металлов в присоединении субстрата в активном
- 11. Организация ферментов 1. Активный центр
- 12. Функциональная значимость отдельных участков активного центра фермента
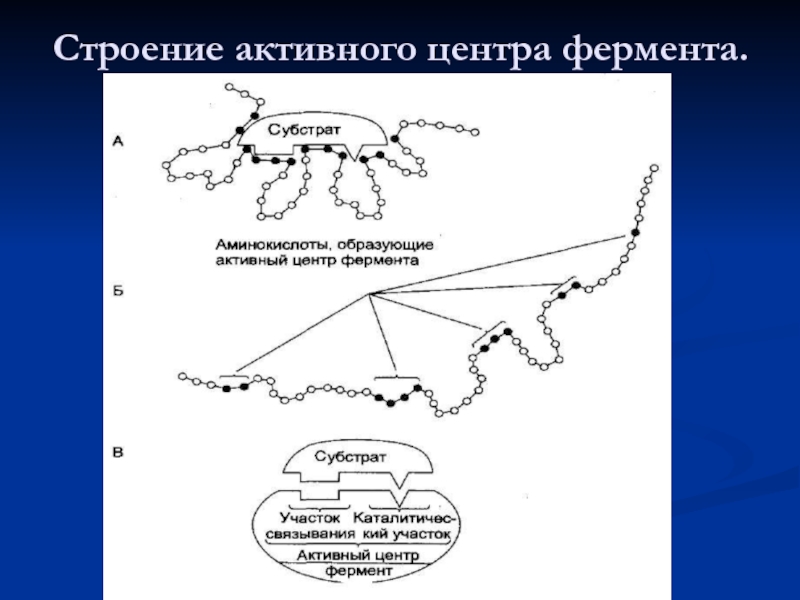
- 13. Строение активного центра фермента.
- 14. Сходство и отличия между биологическими и небиологическими катализаторами
- 15. Общие свойства ферментов 1. Очень высокая эффективность.
- 17. Для оценки количества молекул фермента среди других
- 18. Каталитическая эффективность. Большинство катализируемых ферментами реакций
- 19. Специфичность. Специфичность — наиболее важное свойство ферментов,
- 20. Субстратная специфичность ферментов В основе лежит строгое
- 21. Каталитическая специфичность Биологическая функция фермента, как и
- 22. Полиферментные системы 1. Каждая клетка имеет специфичный
- 23. Ферментные ансамбли или мультиферменты – комплекс ферментов, катализирующих последовательные реакции при превращении одного вещества.
- 24. Энергетические изменения ПРИ ХИМИЧЕСКИХ РЕАКЦИЯХ. Любые химические
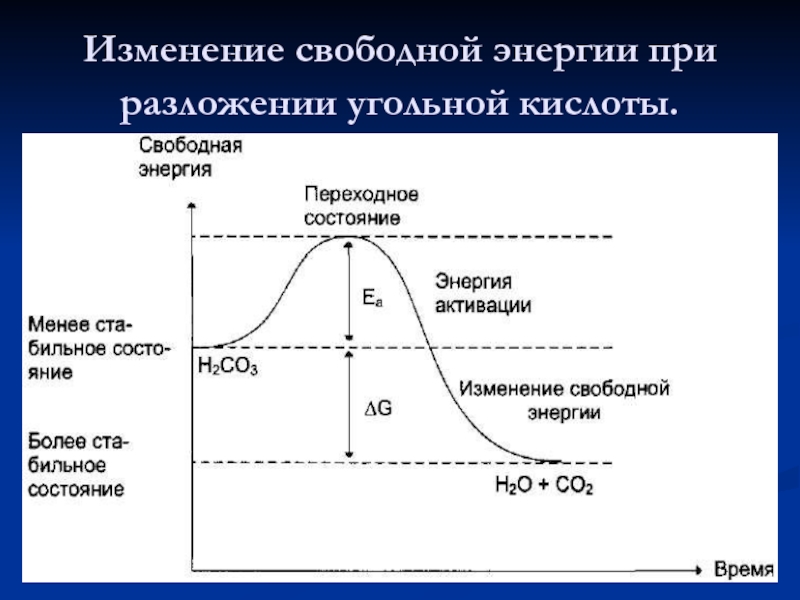
- 25. Изменение свободной энергии при разложении угольной кислоты.
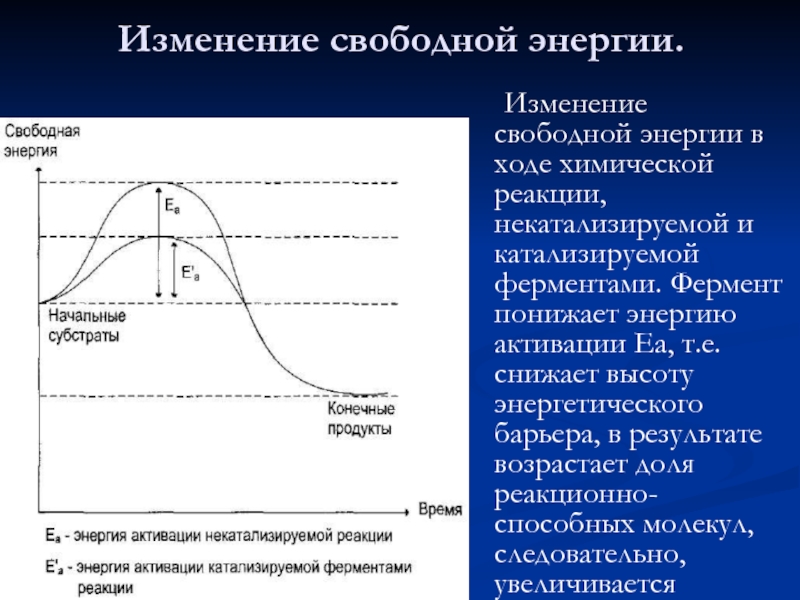
- 26. Изменение свободной энергии в ходе химической реакции,
- 27. Механизм ферментативного катализа. В механизме ферментативного катализа
- 28. Эффект деформации. Активный центр фермента также способствует
- 29. В участке связывания субстрат при помощи
- 30. Механизм действия ферментов 1. Стадия: диффузия, связывание
- 31. Образование фермент-субстратного комплекса. где Е — фермент
- 32. Мультисубстратные реакции: Большинство ферментов катализирует реакции,
- 33. Механизм упорядоченного взаимодействия субстрата с активным центром
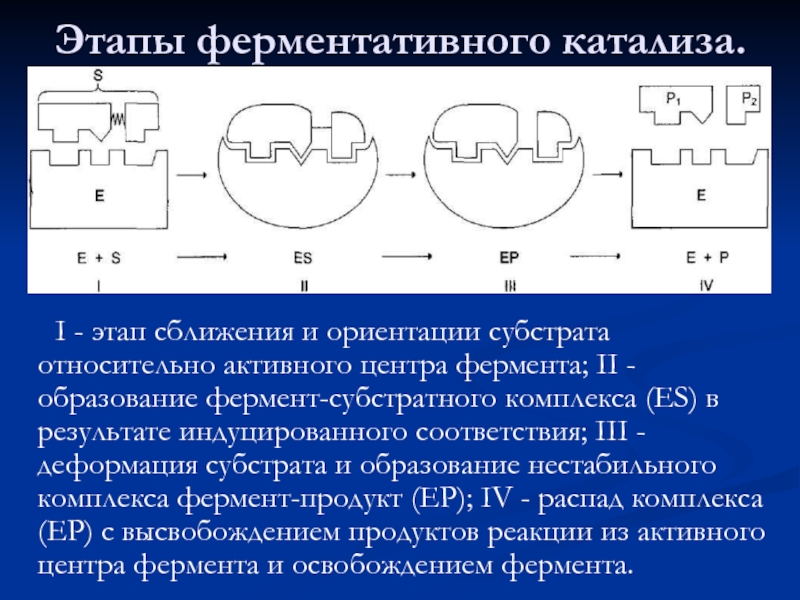
- 34. Этапы ферментативного катализа. I -
- 35. Молекулярные механизмы ферментативного катализа 1. Эффект ориентации
- 36. Снижение энергетического барьера происходит за счет: 1.
- 37. Ферментативная кинетика Раздел биохимии, который изучает ферментативную
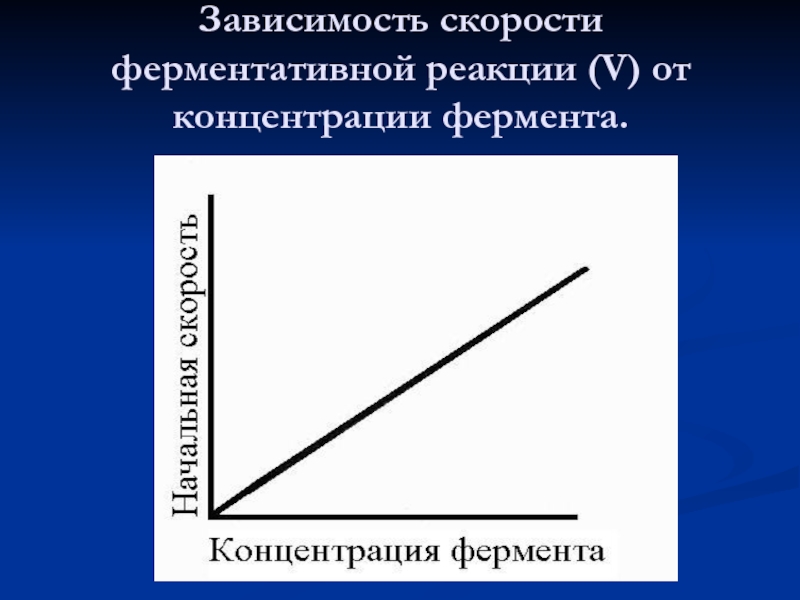
- 38. Зависимость скорости ферментативной реакции (V) от концентрации фермента.
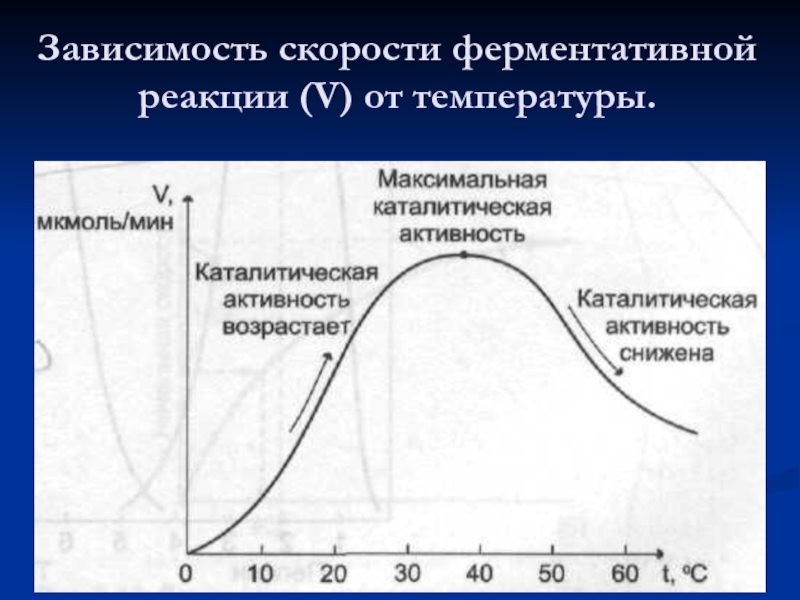
- 39. Зависимость скорости ферментативной реакции (V) от температуры.
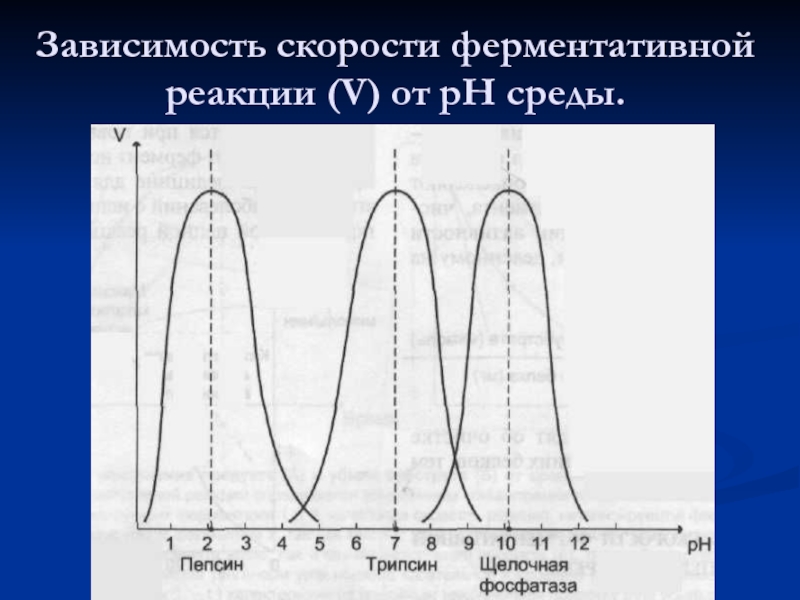
- 40. Зависимость скорости ферментативной реакции (V) от рН среды.
- 41. Оптимальные значения рН для некоторых ферментов.
- 42. Зависимость скорости реакции (V) от концентрации субстрата
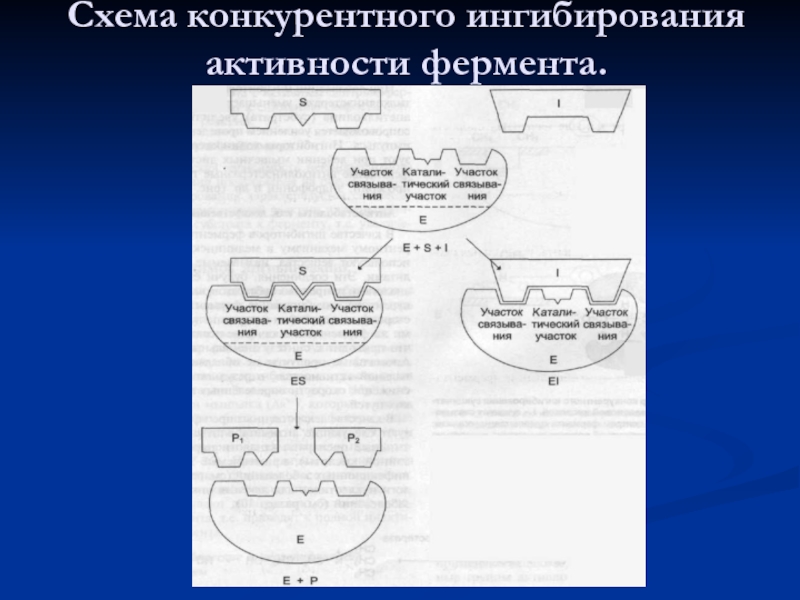
- 43. Схема конкурентного ингибирования активности фермента.
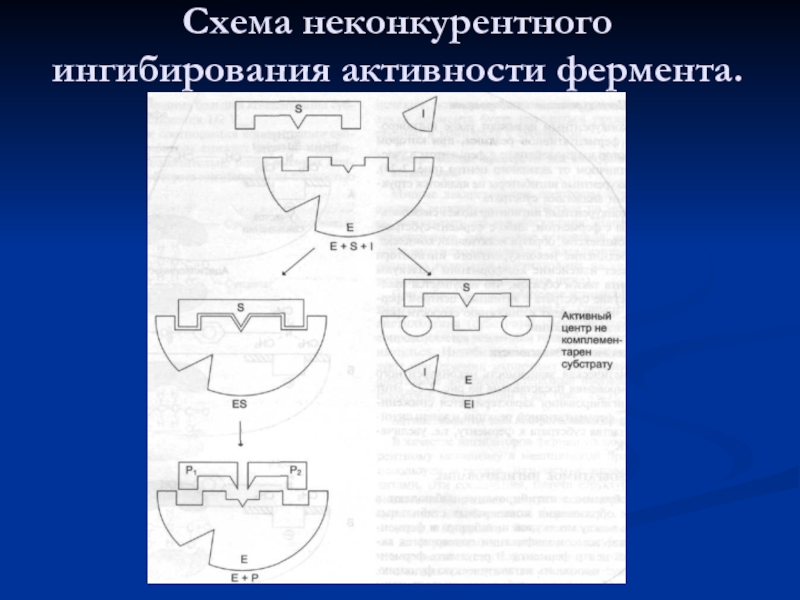
- 44. Схема неконкурентного ингибирования активности фермента.
- 45. Механизм действия ионов ртути как необратимого ингибитора.
- 46. Основные способы регуляции активности ферментов: аллостерическая регуляция;
- 47. Схема положительной и отрицательной регуляции катаболизма глюкозы.
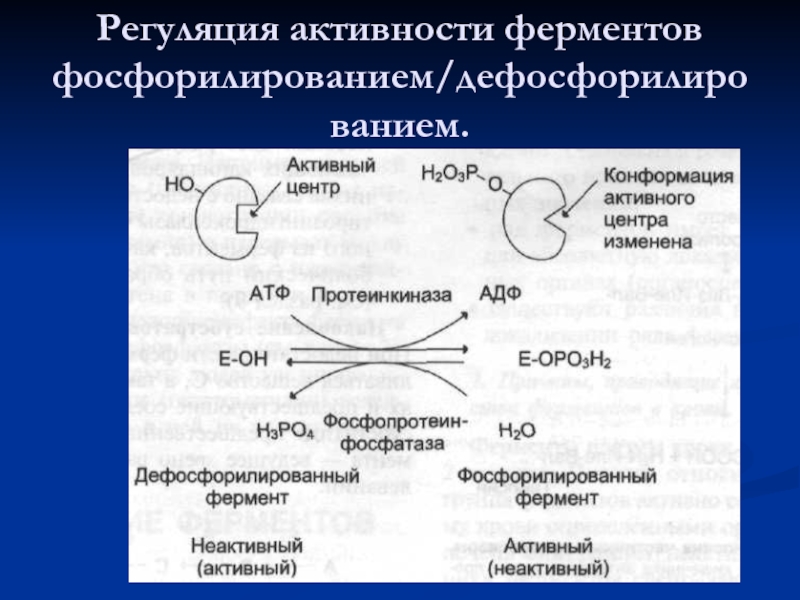
- 48. Регуляция активности ферментов фосфорилированием/дефосфорилированием.
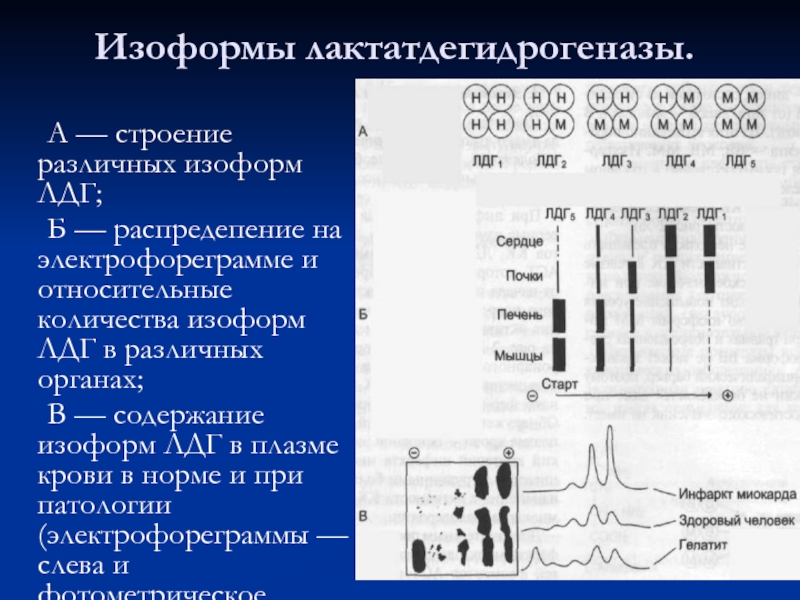
- 49. Изоформы лактатдегидрогеназы. А — строение различных
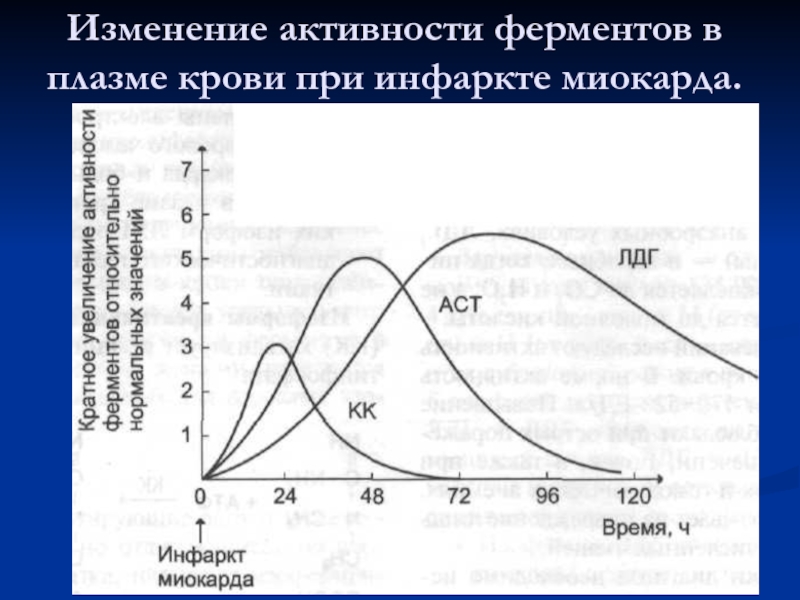
- 50. Изменение активности ферментов в плазме крови при инфаркте миокарда.
- 51. Лабильность ферментов Каталитическая эффективность фермента, как
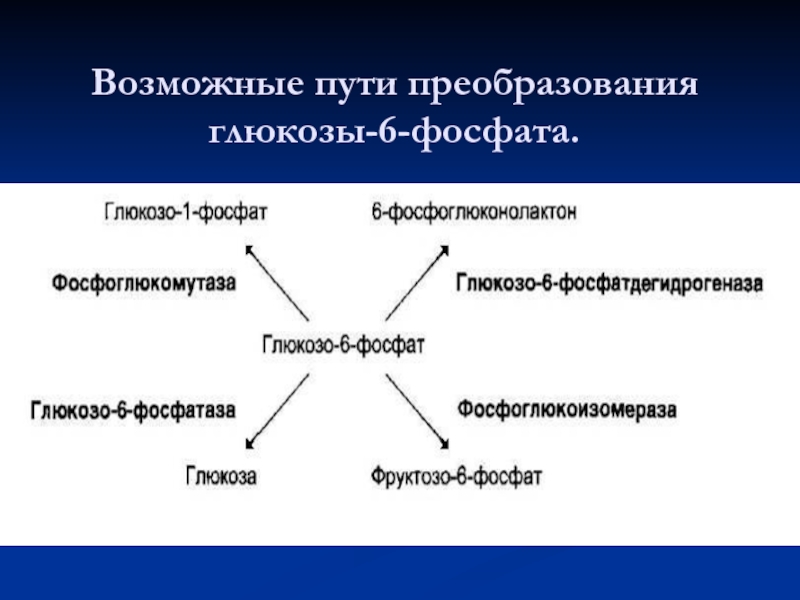
- 52. Возможные пути преобразования глюкозы-6-фосфата.
- 53. Известно 6 классов ферментов: Оксидоредуктазы Трансферазы Гидролазы
- 54. 1. Оксидоредуктазы.
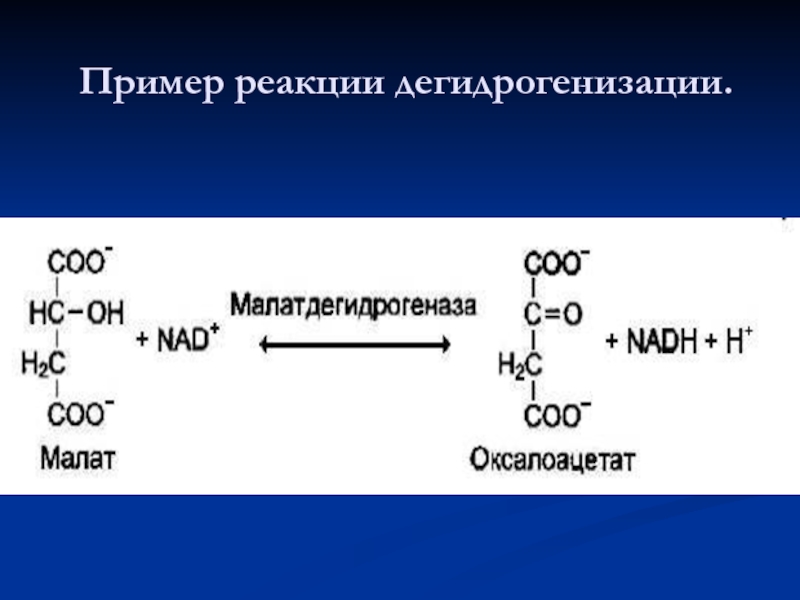
- 55. Дегидрогеназы. В этот подкласс входят ферменты,
- 56. Пример реакции дегидрогенизации.
- 57. Оксидазы. Акцептором электрона служит молекулярный кислород. Пример реакции, катализируемой цитохромоксидазой:
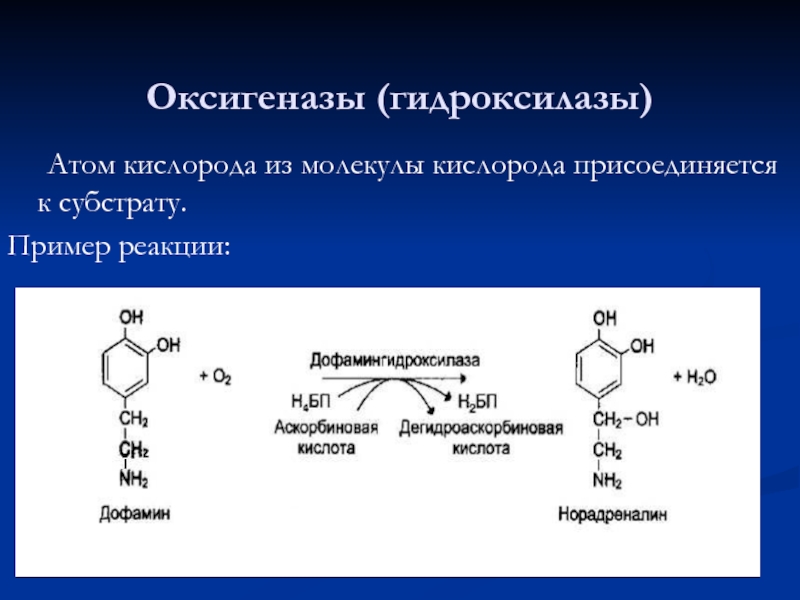
- 58. Оксигеназы (гидроксилазы) Атом кислорода из молекулы кислорода присоединяется к субстрату. Пример реакции:
- 59. 2. Трансферазы. Катализируют перенос функциональных групп от
- 60. Примеры реакций с участием трансфераз.
- 61. 3. Гидролазы Катализируют реакции гидролиза (расщепления
- 62. Пример реакции гидролиза белка.
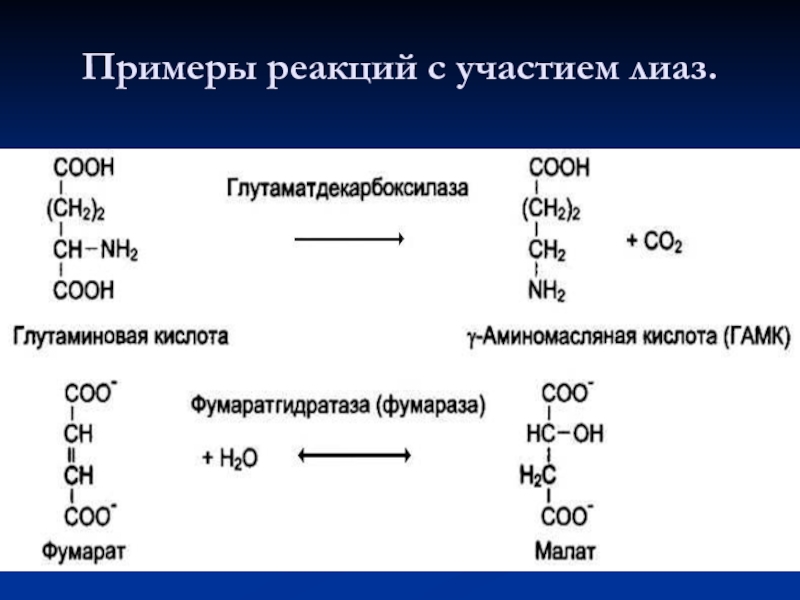
- 63. 4. Лиазы К лиазам относят ферменты, отщепляющие
- 64. Примеры реакций с участием лиаз.
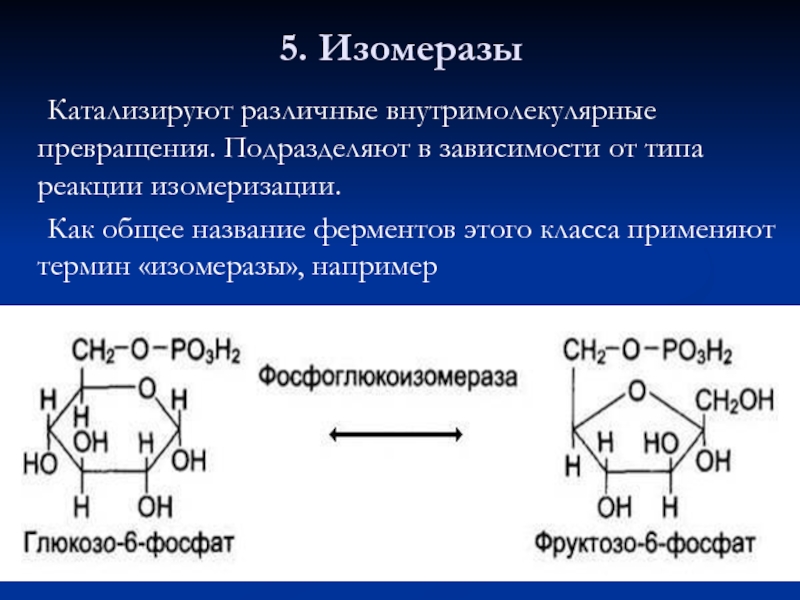
- 65. 5. Изомеразы Катализируют различные внутримолекулярные превращения. Подразделяют
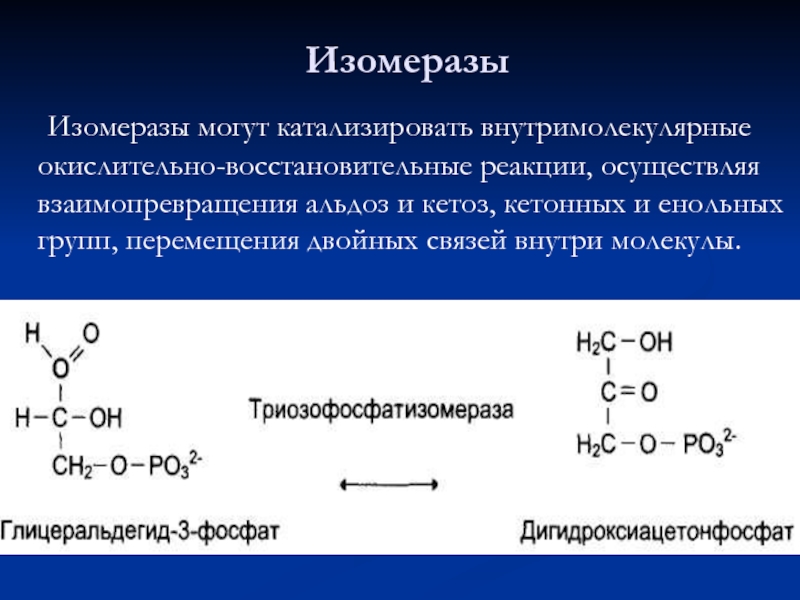
- 66. Изомеразы могут катализировать внутримолекулярные окислительно-восстановительные реакции, осуществляя
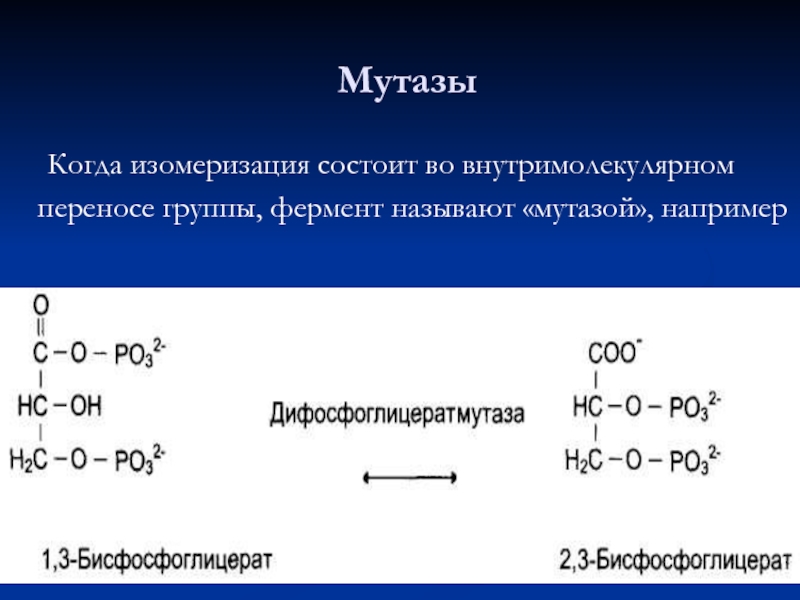
- 67. Когда изомеризация состоит во внутримолекулярном переносе группы, фермент называют «мутазой», например Мутазы
- 68. 6. Лигазы (синтетазы) Катализируют реакции присоединения друг к другу двух молекул с образованием ковалентной связи.
- 69. Этот процесс сопряжён с разрывом фосфоэфирной связи
- 70. В случае, когда источником энергии служит любое
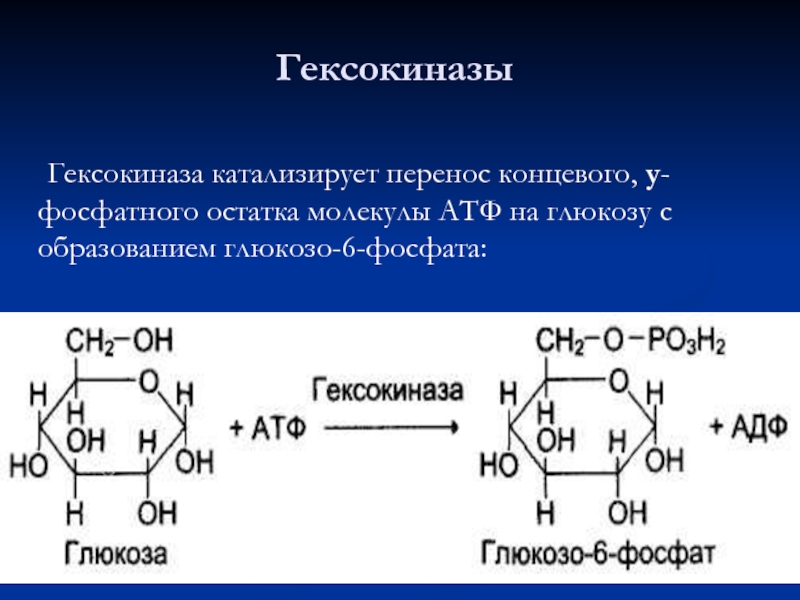
- 71. Гексокиназа катализирует перенос концевого, у-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата: Гексокиназы
- 72. Участие ионов магния в присоединении субстрата
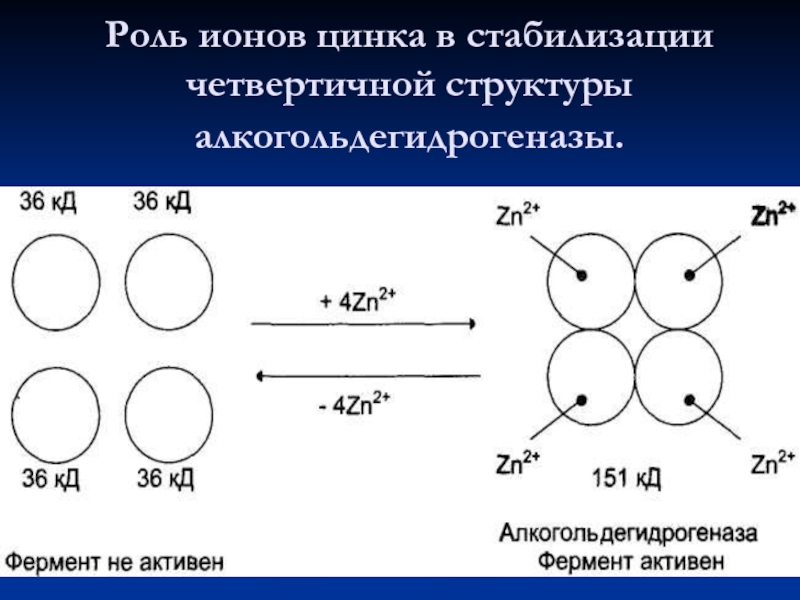
- 73. Роль ионов цинка в стабилизации четвертичной структуры алкогольдегидрогеназы.
- 74. Участие металлов в окислительно-восстановительных реакциях: Ионы металлов
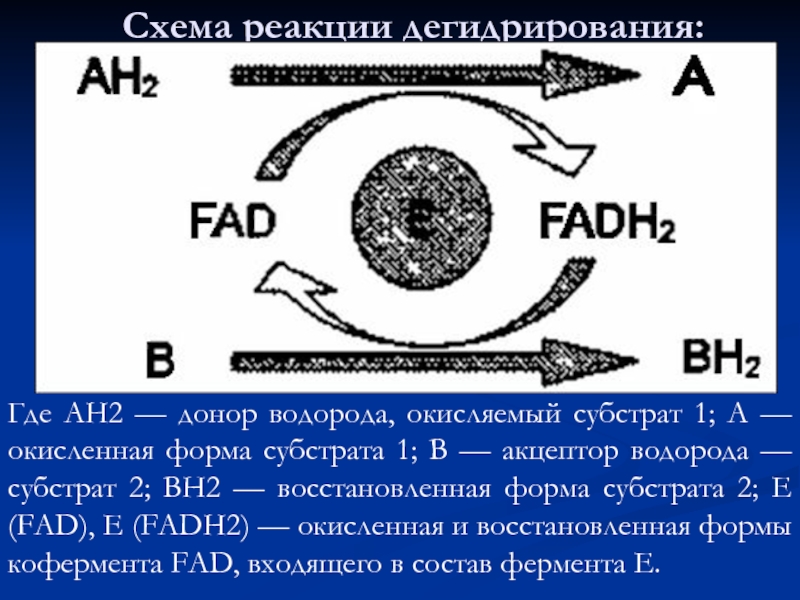
- 75. Схема реакции дегидрирования: Где АН2 — донор
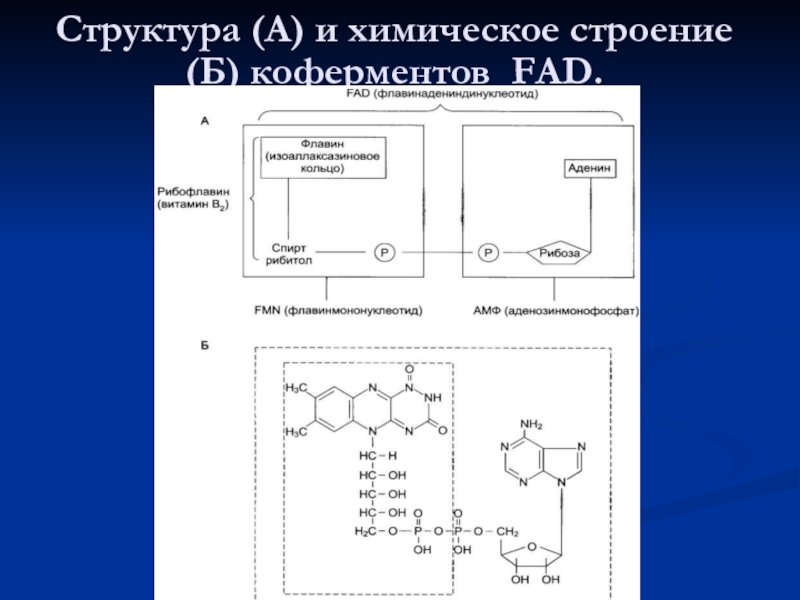
- 76. Структура (А) и химическое строение (Б) коферментов FAD.
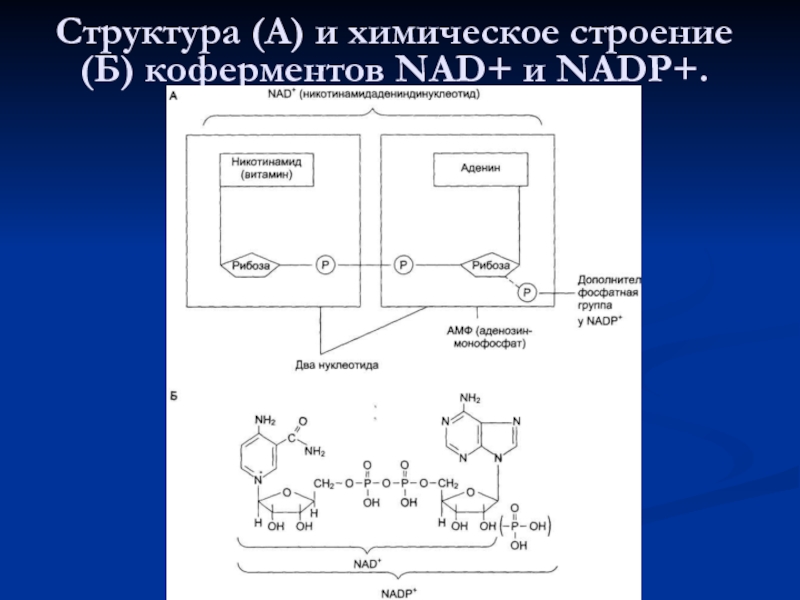
- 77. Структура (А) и химическое строение (Б) коферментов NAD+ и NADP+.
Слайд 1Ферменты
1. Явление катализа
2. Общие свойства ферментов
3. Структура ферментов
4. Активность ферментов
5. Кофакторы
6. Механизм действия ферментов
7. Классификация и номенклатура ферментов.
Слайд 2Катализ
Возможность протекания хим.реакций обусловлена разницей свободной энергии исх. веществ и продуктов.
Скорость экзергонической реакции зависит от «энергетического барьера», который нужно преодолеть веществом. У реакционно способных молекул энергии достаточно для преодоления барьера.
Энергетическая активация – дополнительное количество энергии, необходимое молекулам веществ для преодоления энергетического барьера.
Катализ – ускорение хим.реакций веществами участвующих в процессе, но не расходующихся. Катализаторы – вещества ускоряющие химические реакции.
Ферменты снижают энергию активации (Еа) (понижают энергетический барьер) процесса, воздействуя на хим. связи реагируемых веществ. В результате возрастает доля активированных молекул, возрастает скорость реакции.
Слайд 3Ферменты = Энзимы
Fermentum – закваска; enzyme – в дрожжах.
Ферменты – катализаторы
Катализ – ускорение хим.реакций веществами участвующих в процессе, но не расходующихся.
Не каждое столкновение молекул сопровождается их взаимодействием, а только в том случае, если достаточно много энергии для преодоления «энергетического барьера». Энергия активации - дополнительно энергия необходима для преодоления «энергетического барьера» (нагрев, облучение, давление, катализатор).
Нагрев, облучение – повышает энергию молекул. Катализатор не повышает энергию молекул, а снижает энергетический барьер, действуя на субстраты, расшатывая хим.связи и образуя промежуточные продукты с низким энергетическим уровнем. Происходит внутримолекулярная перестройка молекул субстрата.
Слайд 4Ферменты
1) простые белки
2) сложные белки (холоферменты)
апофермент
(протеин) (простетическая
группа)
3) рибозимы
Слайд 5Молекулярная масса
РИБОНУКЛЕАЗА ……………....………………..……………………..13700
ТРИПСИН ………………………………………………………………23800
ГЕКСОКИНАЗА ……………………...………………….……………..45000
АЛЬДОЛАЗА ………………………………………………...………..142000
УРЕАЗА ………………………………………………………………..480000
ПИРУВАТДЕГИДРОГЕНАЗА ………………………………...……4500000
Слайд 6Кофакторы и коферменты
1. Небелковые части нуклеотидного типа.
2. Нуклеотид три- и дифосфаты
3. Витаминные коферменты.
4. Металлы (Zn2+, Cu2+, Fe2+, Mo2+ и др.).
5. Пептидные коферменты (глутатион).
Слайд 7К коферментам относят следующие соединения:
производные витаминов;
гемы, входящие в состав цитохромов,
нуклеотиды — доноры и акцепторы остатка фосфорной кислоты;
убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
S-аденозилметионин (SАМ) — донор метильной группы;
глутатион, участвующий в окислительно-восстановительных реакциях.
Слайд 8Аминокислоты, образующие каталитические центры
Серин – ОН
Треонин – ОН
Тирозин – ОН
Цистеин –
Лизин – NH2
Аргинин – HN – C – NH2
||
NH
Гистидин - имидазол
Слайд 10Роль металлов в присоединении субстрата в активном центре фермента.
Ионы металла выполняют
Слайд 11Организация ферментов
1. Активный центр
Контактный участок
2. Регуляторный (аллостерический) центр.
Слайд 15Общие свойства ферментов
1. Очень высокая эффективность.
2. Очень высокая специфичность.
3. Регулируемость, это
4. Работают в мягких условиях (t, р, рН). Чувствительны к изменению этих факторов.
5. Нет побочных продуктов и процессов.
6.Сохраняют активность в изолированном виде.
7. Кооперативность, взаимосвязанность и запрограмированность действия.
Слайд 16
АКТИВНОСТЬ ФЕРМЕНТОВ
Активность ферментов
по количеству образующегося продукта (Р),
по количеству потребляемого субстрата (S).
Международная единица активности фермента Е – количество фермента, превращающее 1 мкмольS / мин в стандартных условиях в расчете на 1 г ткани.
Удельная активность – количество Е / мг белка.
Слайд 17 Для оценки количества молекул фермента среди других белков данной ткани определяют
Активность ферментов.
Слайд 18 Каталитическая эффективность.
Большинство катализируемых ферментами реакций высокоэффективны, они протекают в 10—10¹ раз
Каждая молекула фермента способна за секунду трансформировать от 100 до 1000 молекул субстрата в продукт.
Количество молекул субстрата, превращенных в продукт с помощью одной молекулы фермента за 1 с, называют числом оборотов фермента, или молярной активностью.
Слайд 19Специфичность.
Специфичность — наиболее важное свойство ферментов, определяющее биологическую значимость этих молекул.
Слайд 20Субстратная специфичность ферментов
В основе лежит строгое соответствие размеров и структуры субстратов
1. Абсолютная специфичность – действие только на один субстрат (уреаза взаимодействует только с мочевиной).
2. Разновидность – стехиометрическая (оптическая) специфичность – действие только на определенные стереоизомеры. Фумараза действует только на фумаровую кислоту.
3. Относительная (групповая) – действие на группу веществ имеющих один тип связи. Амилаза – на крахмал, гликоген, декстрины, пепсин – на разные белки.
Слайд 21Каталитическая специфичность
Биологическая функция фермента, как и любого белка, обусловлена наличием в
Слайд 22Полиферментные системы
1. Каждая клетка имеет специфичный состав ферментов.
2. Некоторые ферменты содержатся
3. Работа каждого фермента, обычно, не индивидуальна, а связана с другими ферментами из которых формируется полиферментные системы – конвейеры.
4. Субстрат проходит длинную цепь реакции многих ферментов Р1→S2→Р2→S3
5. Некоторые ферменты системы связаны с органеллами, биомембранной или цитоскелетом.
6. Некоторые ферменты одной цепи метаболизма объединяются в мультиферментные комплексы с определенной функцией.
Слайд 23Ферментные ансамбли или мультиферменты – комплекс ферментов, катализирующих последовательные реакции при
Слайд 24Энергетические изменения
ПРИ ХИМИЧЕСКИХ РЕАКЦИЯХ.
Любые химические реакции протекают, подчиняясь двум основным законам
Слайд 26 Изменение свободной энергии в ходе химической реакции, некатализируемой и катализируемой ферментами.
Изменение свободной энергии.
Слайд 27Механизм ферментативного катализа.
В механизме ферментативного катализа решающее значение имеет образование нестойких
Слайд 28Эффект деформации.
Активный центр фермента также способствует дестабилизации межатомных связей в молекуле
Слайд 29 В участке связывания субстрат при помощи нековалентных связей взаимодействует (связывается)
В каталитическом участке субстрат претерпевает химическое превращение в продукт, который затем высвобождается из активного центра фермента.
Последовательность действия ферментов
Слайд 30Механизм действия ферментов
1. Стадия: диффузия, связывание S ферментом Е и образование
Индуцированное соответствие S активному центру.
ЭА измеряется незначительно. Очень быстрый процесс.
2. Стадия: образование активированного ES*. Резкое снижение ЭА. Взаимодействие Е и S. Дестабилизация химических связей в S.
3. Стадия: образование продуктов и их выход.
Слайд 31Образование фермент-субстратного комплекса.
где Е — фермент (энзим), 3 — субстрат, Р
Схематично процесс катализа можно представить следующим уравнением:
Слайд 32Мультисубстратные реакции:
Большинство ферментов катализирует реакции, в которых участвует более чем
Слайд 33Механизм упорядоченного взаимодействия субстрата с активным центром фермента:
Первым в активный центр
Слайд 34Этапы ферментативного катализа.
I - этап сближения и ориентации субстрата
Слайд 35Молекулярные механизмы ферментативного катализа
1. Эффект ориентации реагентов снижает энтропию и энергию
2. Эффект «деформации» субстрата – «растягивается» хим.связь, снижается энергия её разрыва (снижается энергия активации).
3. Кислотно-основной катализ. В активном центре имеются функциональные группы аминокислотных остатков с кислотными и основными группами.
Фермент является и акцептором и донором протонов и электронов. Происходит перераспределение электронной плотности на участке субстрата. Это облегчает перестройку и разрыв связей.
4. Ковалентный катализ – образование ковалентных связей с субстратами.
Слайд 36Снижение энергетического барьера происходит за счет:
1. Повышения вероятности столкновения субстратов.
2. Строгая
3. Максимальное сближение субстратов.
4. Действие на определённые атомы субстрата атомами активного центра.
5. Смещение электронов и протонов, что повышает реакционоспособность атомов.
Слайд 37Ферментативная кинетика
Раздел биохимии, который изучает ферментативную активность в зависимости от условий
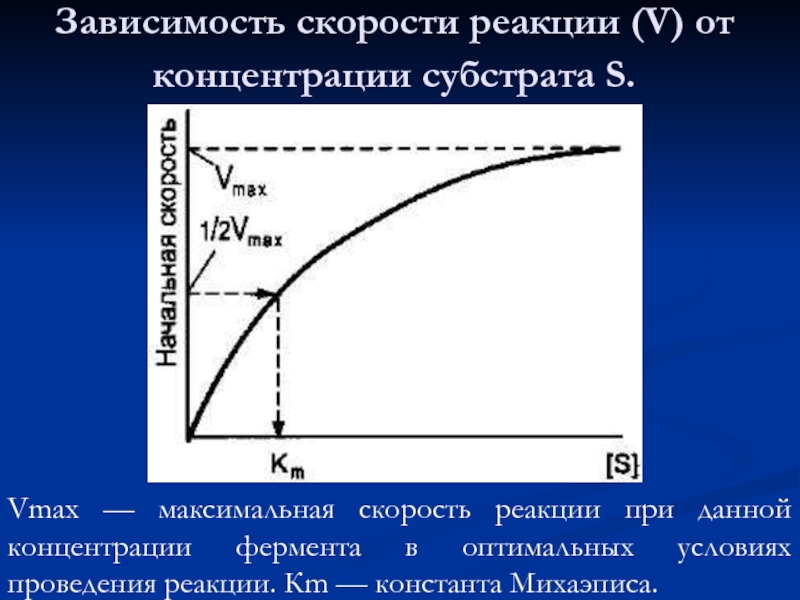
Слайд 42Зависимость скорости реакции (V) от концентрации субстрата S.
Vmax — максимальная
Слайд 45Механизм действия ионов ртути как необратимого ингибитора.
Ионы ртути в малых
Слайд 46Основные способы регуляции активности ферментов:
аллостерическая регуляция;
регуляция с помощью белок-белковых взаимодействий;
регуляция путём
регуляция частичным (ограниченным) протеолизом.
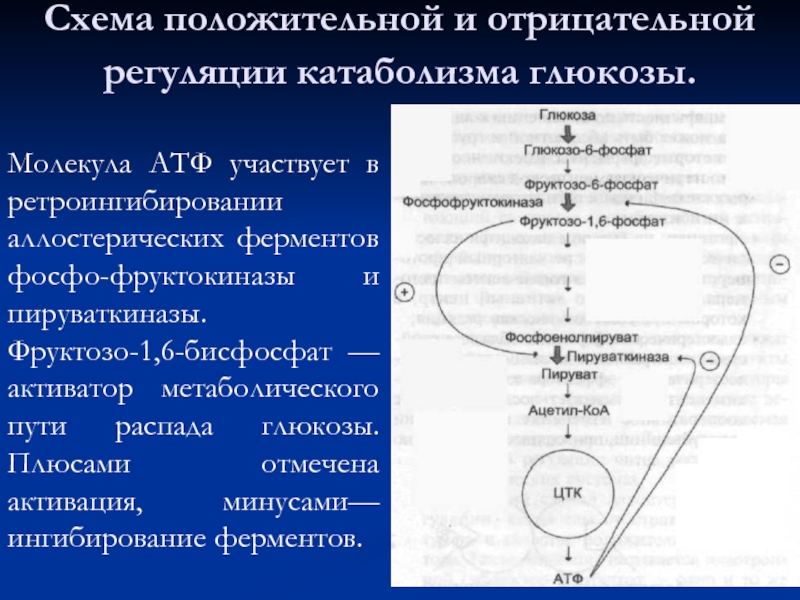
Слайд 47Схема положительной и отрицательной регуляции катаболизма глюкозы.
Молекула АТФ участвует в
Слайд 49Изоформы лактатдегидрогеназы.
А — строение различных изоформ ЛДГ;
Б — распредепение
В — содержание изоформ ЛДГ в плазме крови в норме и при патологии (электрофореграммы — слева и фотометрическое сканирование — справа).
Слайд 51 Лабильность ферментов
Каталитическая эффективность фермента, как и любой белковой молекулы, зависит от
Для ферментов характерна конформационная лабильность — способность к небольшим изменениям нативной конформации вследствие разрыва слабых связей. Поэтому воздействие денатурирующих агентов, способных изменять конформацию молекулы фермента, приводит к изменению конформации активного центра и снижению способности присоединять субстрат. В результате этого уменьшается каталитическая эффективность фермента.
Слайд 53Известно 6 классов ферментов:
Оксидоредуктазы
Трансферазы
Гидролазы
Лиазы
Изомеразы
Лигазы
Каждый фермент имеет 2 названия. Первое — короткое,
Классификация и номенклатура ферментов.
Слайд 55Дегидрогеназы.
В этот подкласс входят ферменты, катализирующие реакции дегидрирования (отщепления водорода).
Слайд 57Оксидазы.
Акцептором электрона служит молекулярный кислород. Пример реакции, катализируемой цитохромоксидазой:
Слайд 58Оксигеназы (гидроксилазы)
Атом кислорода из молекулы кислорода присоединяется к субстрату.
Пример
Слайд 592. Трансферазы.
Катализируют перенос функциональных групп от одного соединения к другому. Подразделяют
Название этих ферментов составляют по формуле «донор: акцептор транспортируемая группа-трансфераза». К классу трансфераз относят аминотрансферазы, ацилтрансферазы, метилтрансферазы, гликозилтрансферазы, киназы (фосфотрансферазы).
Слайд 613. Гидролазы
Катализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы
Наименование ферментов составляют по формуле «субстрат—гидролаза» или прямым присоединением к названию субстрата суффикса «аза», например протеаза, липаза, фосфолипаза, рибонуклеаза.
Для отдельных классов гидролаз применимы специальные термины, характеризующие гидролиз определённой химической связи: эстеразы, фосфатазы и др.
Слайд 634. Лиазы
К лиазам относят ферменты, отщепляющие от субстратов негидролитическим путём определённую
Слайд 655. Изомеразы
Катализируют различные внутримолекулярные превращения. Подразделяют в зависимости от типа реакции
Как общее название ферментов этого класса применяют термин «изомеразы», например
Слайд 66 Изомеразы могут катализировать внутримолекулярные окислительно-восстановительные реакции, осуществляя взаимопревращения альдоз и кетоз,
Изомеразы
Слайд 67 Когда изомеризация состоит во внутримолекулярном переносе группы, фермент называют «мутазой», например
Мутазы
Слайд 686. Лигазы (синтетазы)
Катализируют реакции присоединения друг к другу двух молекул с
Слайд 69 Этот процесс сопряжён с разрывом фосфоэфирной связи в молекуле АТФ (или
Лигазы
Слайд 70 В случае, когда источником энергии служит любое другое макроэргическое соединение (не
Механизм функционирования лигаз.
Слайд 71 Гексокиназа катализирует перенос концевого, у-фосфатного остатка молекулы АТФ на глюкозу с
Гексокиназы
Слайд 72 Участие ионов магния в присоединении субстрата в активном центре гексокиназы:
В активном центре гексокиназы есть участки связывания для молекулы глюкозы и комплекса Мg2+ - АТФ. В результате ферментативной реакции происходит перенос концевого фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата.