- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ферменты. Механизм ферментативного катализа. Клакссификация ферментов. Общая характеристика представителей класса гидролаз презентация
Содержание
- 1. Ферменты. Механизм ферментативного катализа. Клакссификация ферментов. Общая характеристика представителей класса гидролаз
- 2. Цель Дать представление о ферментах, как о
- 3. ПЛАН ЛЕКЦИИ Ферменты, понятие Механизм действия
- 4. Ферменты ФЕРМЕНТЫ - это специализированные белки,
- 5. Термин «фермент» произошел от лат. «fermentum» -
- 6. Долгое время многие ученые продолжали считать ферменты,
- 7. Сходство ферментов и неорганических катализаторов:
- 8. Отличия между ферментами и неорганическими катализаторами
- 9. Механизм действия ферментов
- 10. Активный центр фермента (АЦФ) Это уникальная для
- 11. Первая стадия фермент отличается от белка наличием
- 13. Первая стадия 1 этап- сближение и ориентации
- 14. Вторая стадия 2 этап - образование ЕS
- 15. Вторая стадия функционально-активные группы АЦ фермента действуют
- 16. Третья стадия 3 этап – деформация S
- 17. Четвертая стадия от нее зависит скорость реакции.
- 20. Этапы ферментативного катализа 1 этап- сближение и
- 21. 3 этап – деформация S и образование
- 22. Любая химическая реакция происходит при столкновении молекул
- 23. Все катализаторы, в т.ч. ферменты понижают энергетический
- 24. Общие свойства ферментов 1. Ферменты –
- 25. 2. имеют сложное химическое строение.
- 26. Однокомпонентные ферменты Специфические простые белки. Каталитическая активность
- 28. Ферменты-протеиды (двукомпонентные) (холоферменты) Состоят из белковой
- 29. Апофермент обуславливает субстратную специфичность фермента (на что
- 30. Двукомпонентные ферменты могут иметь несколько молекулярных форм,
- 31. Изоферменты— молекулярные формы ферментов, катализирующие одну
- 32. Лактатдегидрогеназа (ЛДГ) ускоряет реакцию дегидрирования молочной кислоты,
- 33. НАД
- 34. Изоф Типы пп цепей ЛДГ1
- 35. Место нахождения ЛДГ1 в сердце; ЛДГ2
- 36. ЛДГ1 ЛДГ2 ЛДГ3
- 37. Изоферменты позволяют лучше приспособиться к изменению внешних
- 38. 3. Ферменты обладают специфичностью действия способны
- 39. СПЕЦИФИЧНОСТЬ субстратная Ферменты могут воздействовать на один
- 40. При абсолютной (индивидуальной) специфичности фермент воздействует
- 42. Стереохимическая субстратная специфичность — —
- 43. Специфичность действия - это способность ферментов
- 44. НАД
- 45. Относительная (групповая) специфичность. Фермент, обладающий
- 47. 4. Ферменты обладают большой мощностью действия.
- 48. Для характеристики мощности действия ферментов введено понятие
- 49. Мощность большинства ферментов равна 1000 каталов,
- 50. 5. Ферменты не входят в состав конечных
- 51. Факторы, влияющие на активность ферментов
- 52. Влияние рН среды Оптимум рН =
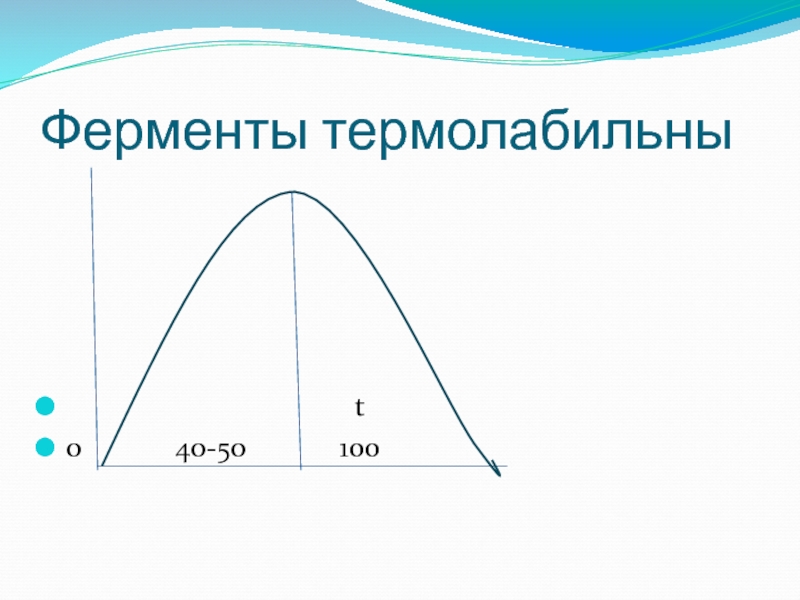
- 53. Ферменты термолабильны
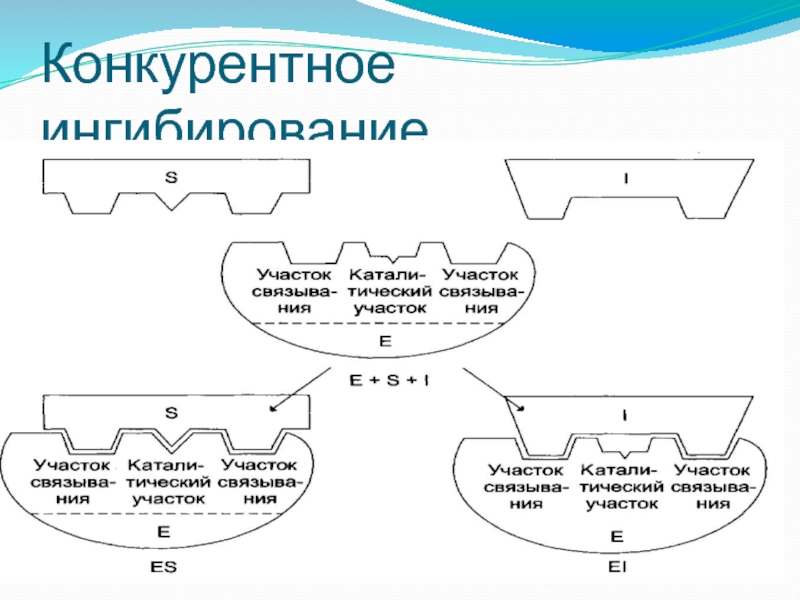
- 55. Конкурентное ингибирование
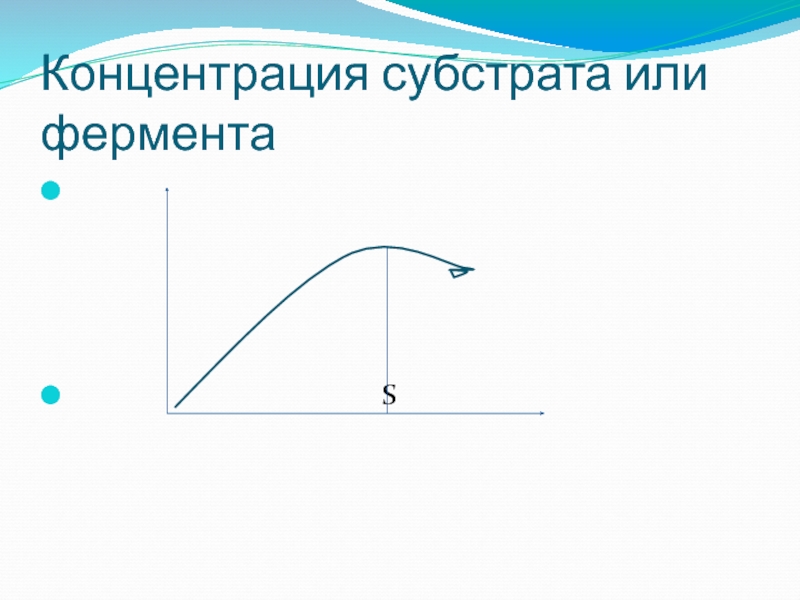
- 56. Концентрация субстрата или фермента
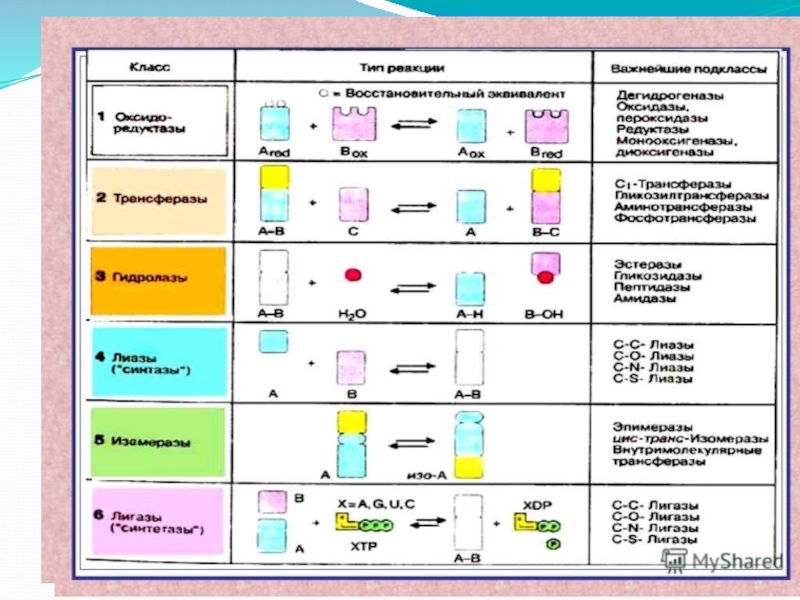
- 58. 1 класс - Оксидоредуктазы 2 класс
- 60. Номенклатура и классификация ферментов класс подкласс,
- 61. Поэтому для каждого фермента существует шифр, состоящий
- 62. Шифр для липазы поджелудочной железы – 3.1.1.3.,
- 63. 1 класс - Оксидоредуктазы – ускоряют окислительно-восстановительные реакции.
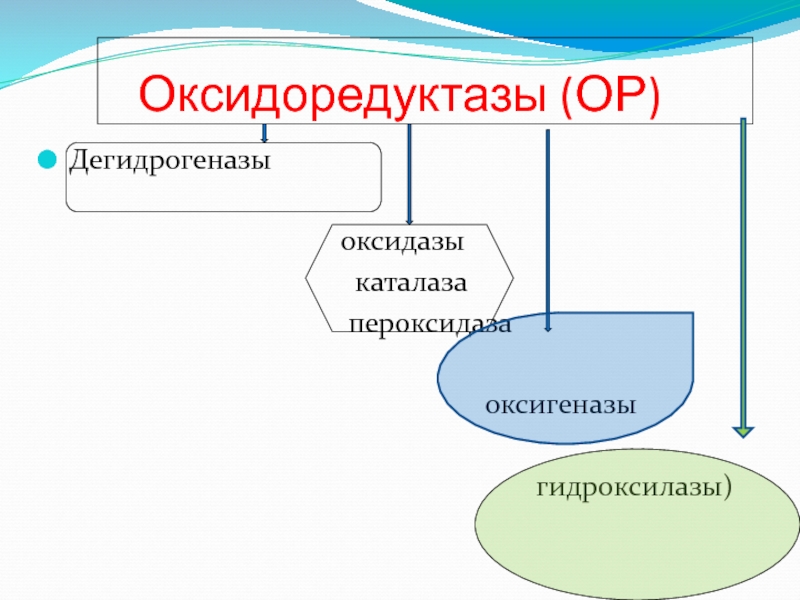
- 64. Оксидоредуктазы (ОР) Дегидрогеназы
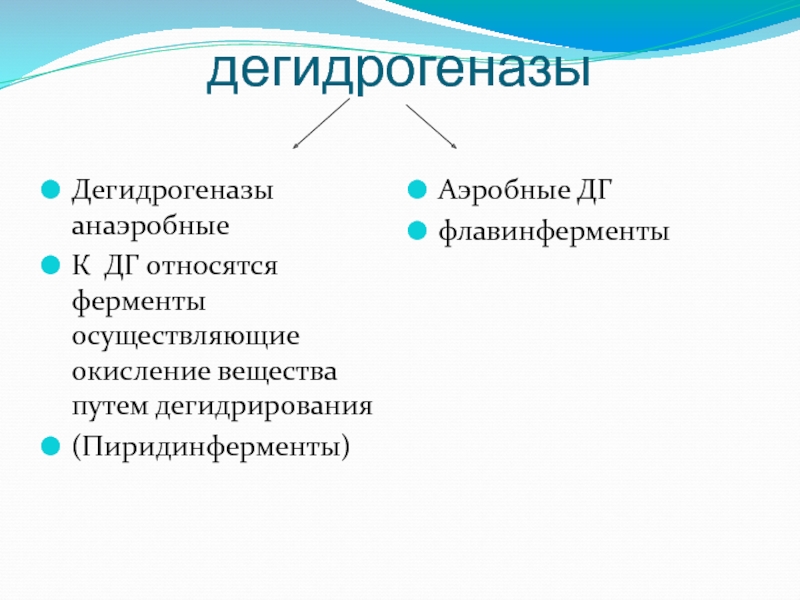
- 65. дегидрогеназы Дегидрогеназы анаэробные К ДГ относятся
- 66. оксидазы Цитохромы ЦХ (гемсодержащие гемопротеиды). ЦХ служат переносчиками электронов
- 67. гидропероксидазы Каталаза и пероксидаза Катализируют реакции разложения перекиси водорода
- 68. оксигеназы Гидроксилазы и оксигеназы Способствуют окислению субстрата,
- 69. трансферазы 2 класс - Трансферазы – катализируют
- 70. гидролазы 3 класс - Гидролазы – катализируют
- 71. лиазы 4 класс - Лиазы – катализируют распад или синтез веществ без участия воды.
- 72. изомеразы 5 класс - Изомеразы – катализируют процесс изомеризации.
- 73. Лигазы или синтетазы 6 класс - Лигазы
- 74. Применение ферментов в медицине Ферментные препараты широко
- 75. Применение ферментов в медицине Ферментные препараты широко
- 76. Клиническое значение определения отдельных ферментов Большинство ферментов
- 77. В этой связи наиболее значимыми для клиники
- 78. Уровень активности сывороточной альдолазы составляет 1-7,5ЕД/л (0,0038-0,020мкМ/мин•мл).
- 79. ЩФ (щелочная фосфатаза) широко распространена в тканях
- 80. Активность ЩФ повышается при холестазе (застое желчи), или механической желтухе, а также при заболеваниях костей
- 81. Кислая фосфатаза Уровень активности КФ (кислая фосфатаза)
- 82. КФ (кислая фосфатаза) увеличивается в основном
- 83. Аланинаминотрансфераза (АЛТ) Аспартатаминотрансфераза (АСТ) АЛТ и АСТ
- 84. Активность данных ферментов повышается значительно при
- 85. ГГТ находится в больших количествах в печени,
- 86. Для клинической диагностики важно понятие «изоферменты» Изоферменты
- 87. Изоферменты имеют одинаковое строение кофермента (небелковой части)
- 88. Креатинфосфотрансфераза, или креатинфосфокиназа (КФК) имеет 3 изофермента
- 89. ЛДГ1 находится в сердце и эритроцитах;
- 90. Клиническое значение определения отдельных ферментов Большинство ферментов
- 91. В этой связи наиболее значимыми для клиники
- 92. Уровень активности сывороточной альдолазы составляет 1-7,5ЕД/л (0,0038-0,020мкМ/мин•мл).
- 93. ЩФ широко распространена в тканях человека, особенно
- 94. Активность ЩФ повышается при холестазе (застое желчи),
- 95. КФ увеличивается в основном при прогрессирующей болезни
- 96. АЛТ и АСТ находятся во многих тканях,
- 97. ГГТ находится в больших количествах в печени,
- 98. Для клинической диагностики важно понятие «изоферменты» Изоферменты
- 99. Креатинфосфотрансфераза, или креатинфосфокиназа (КФК) имеет 3 изофермента
- 100. ЛДГ1 находится в сердце и эритроцитах;
- 101. Изоферменты имеют одинаковое строение кофермента (небелковой части)
- 102. Применение гидролаз в медицине
- 103. для растворения тромба при тромбофлебитах,
- 104. для рассасывания гематом при
- 105. Литература основная Т.Ш.Шарманов, С.М.Плешкова «Метаболические основы
- 106. дополнительная Б.Гринстейн, А.Гринстейн «Наглядная биохимия», 2000 г.
- 107. КОНТРОЛЬНЫЕ ВОПРОСЫ: Что такое ферменты?
Слайд 1Лекция №2
17-18 учебный год
ТЕМА: Ферменты.
Механизм ферментативного катализа.
Клакссификация ферментов. Общая
Клиническое значение определения ферментов
Слайд 2Цель
Дать представление о ферментах, как о биологических катализаторах белковой природы.
Ознакомить
Значением ферментов в медицине
Слайд 3ПЛАН ЛЕКЦИИ
Ферменты, понятие
Механизм действия ферментов
Номенклатура и классификация ферментов
Значение ферментов в медицине
Слайд 4Ферменты
ФЕРМЕНТЫ - это специализированные белки, образующиеся в клетках и способные ускорять
т.е. ферменты - биологические катализаторы.
Слайд 5Термин «фермент» произошел от лат. «fermentum» - закваска, бродило.
Был предложен
Слайд 6Долгое время многие ученые продолжали считать ферменты, выделяемые клетками, чем-то принципиально
В англоязычной литературе употребляется термин «энзим» от греч. «en zyme» – в закваске.
Слайд 7Сходство ферментов и неорганических катализаторов:
катализируют только энергетически возможные реакции;
- не
- не изменяют направление реакции;
- не расходуются в результате реакции.
Слайд 8Отличия между ферментами и неорганическими катализаторами
Ферменты имеют более сложное химическое строение
Ферменты
Ферменты обладают специфичностью
Ферменты - это вещества с регулируемой активностью;
Ферменты действуют в мягких условиях
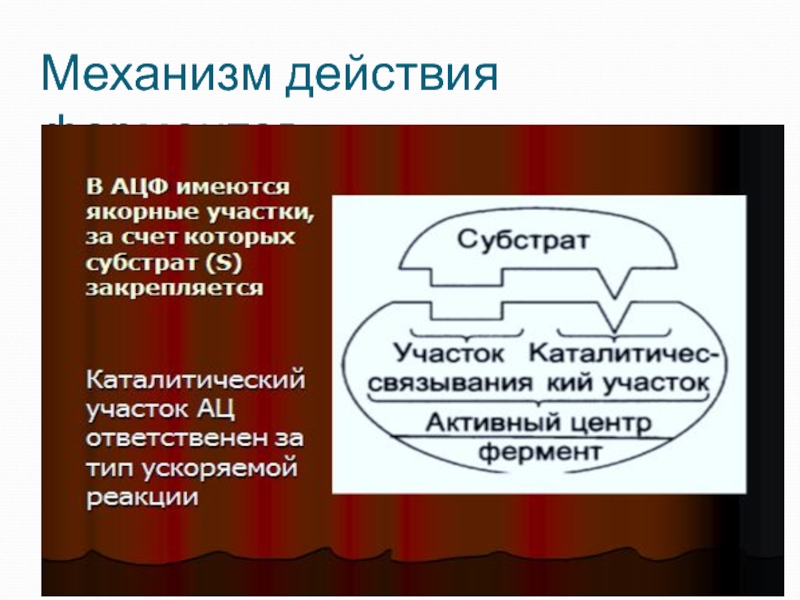
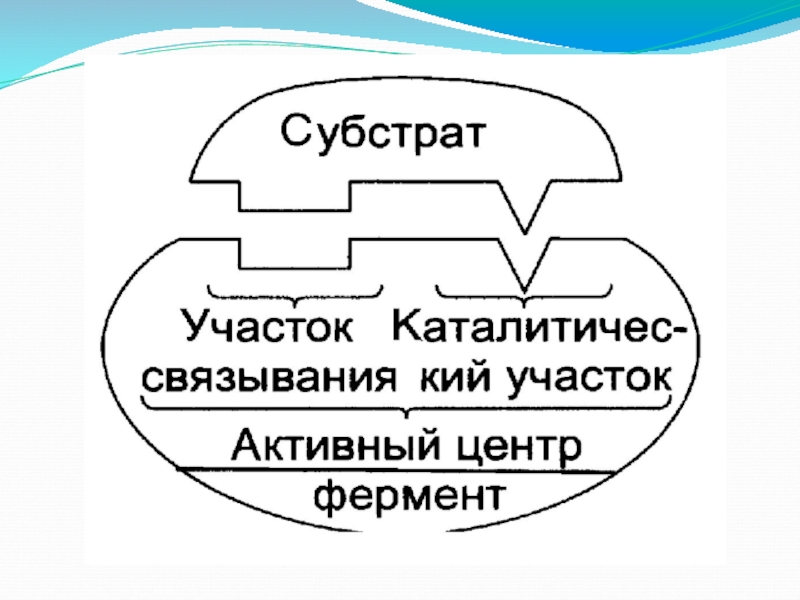
Слайд 10Активный центр фермента (АЦФ)
Это уникальная для каждого Фермента совокупность функциональных групп
Слайд 11Первая стадия
фермент отличается от белка наличием активного центра (АЦФ - участка,
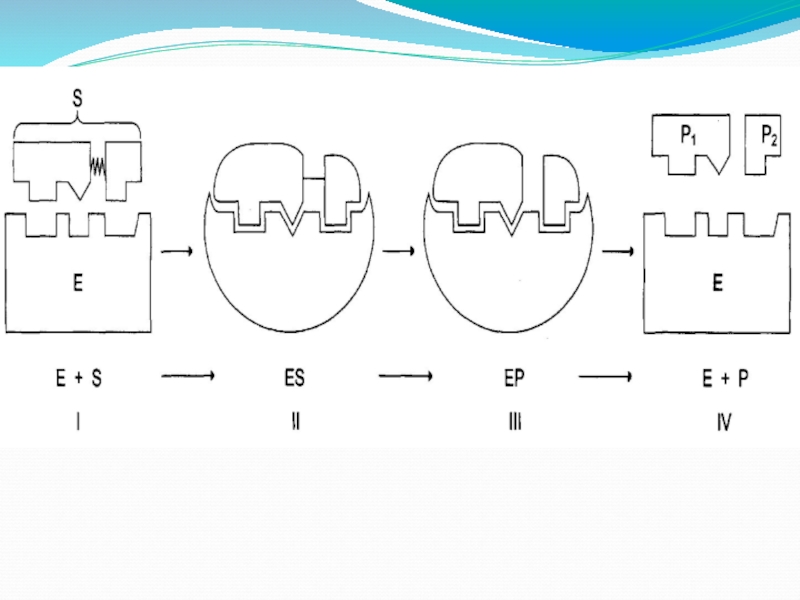
Слайд 13Первая стадия
1 этап- сближение и ориентации субстрата относительно активного центра фермента
Е + S Е S
Е – фермент
S - субстрат
Слайд 14Вторая стадия
2 этап - образование ЕS комплекса в результате индуцированного взаимодействия
Е
Слайд 15Вторая стадия
функционально-активные группы АЦ фермента действуют на субстрат, дестабилизируя связи в
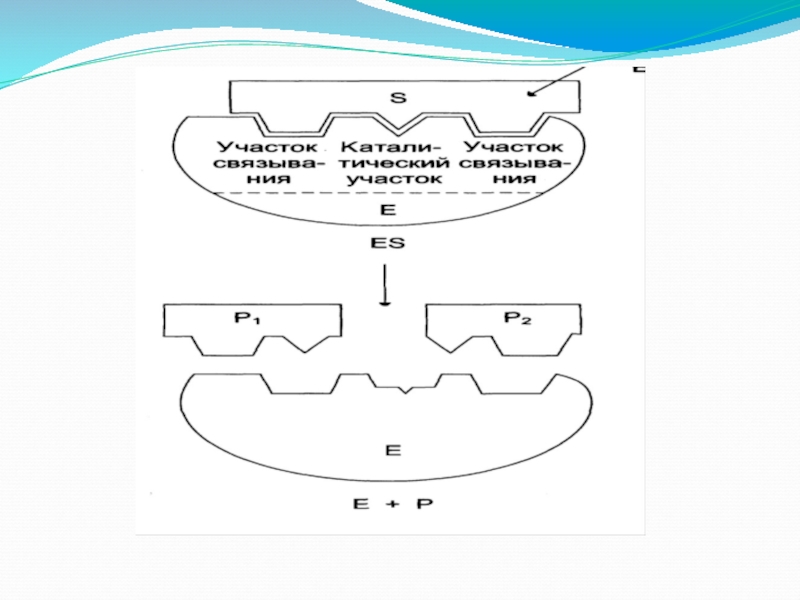
Слайд 16Третья стадия
3 этап – деформация S и образование нестабильного комплекса
Е-ПР
ПР – продукт реакции
Е S Е-ПР
Слайд 17Четвертая стадия
от нее зависит скорость реакции. Происходит отделение фермента от продуктов
ЕР Е + ПР
Слайд 20Этапы ферментативного катализа
1 этап- сближение и ориентации субстрата относительно активного центра
2 этап - образование ЕS комплекса в результате индуцированного взаимодействия
Слайд 213 этап – деформация S и образование нестабильного комплекса Е-ПР
4 этап
Слайд 22Любая химическая реакция происходит при столкновении молекул реагирующих веществ. Движение молекул
Для протекания химической реакции необходимо, чтобы молекулы исходных веществ достигли переходного состояния, т.е. чтобы реагирующие молекулы имели достаточно энергии для преодоления энергетического барьера.
Энергетический барьер – это минимальное количество энергии, необходимое для того, чтобы все молекулы стали реакционно-способными.
Разность значений свободной энергии исходного продукта (субстрата) и энергии, которая потребуется для того, чтобы субстрат перешел в переходное состояние, соответствует свободной энергии активации.
Скорость любой химической реакции пропорциональна концентрации молекул, находящихся в переходном состоянии.
Слайд 23Все катализаторы, в т.ч. ферменты понижают энергетический барьер реакции (снижают энергию
Слайд 24Общие свойства ферментов
1. Ферменты –
это вещества белковой природы,
свойствами, характерными для
белков
Слайд 252. имеют сложное химическое строение.
Различают ферменты-протеины-
однокомпонентные
И ферменты-протеиды –
двукомпонентные ферменты
Слайд 26Однокомпонентные ферменты
Специфические простые белки.
Каталитическая активность зависит от наличия активного центра (АЦ)
АЦ
каталитический и субстратный
У некоторых ферментов имеется так называемый аллостерический центр, участвующий в регуляции АЦ
Слайд 28Ферменты-протеиды (двукомпонентные) (холоферменты)
Состоят из белковой части –
И вещества небелковой природы –
кофермент
Роль коферментов выполняют производные различных витаминов, металлы (железо, медь)
Слайд 29Апофермент обуславливает субстратную специфичность фермента (на что действует фермент)
Кофермент – обеспечивает
Слайд 30Двукомпонентные ферменты могут иметь несколько молекулярных форм, которые называются
изоферментами
Слайд 31
Изоферменты— молекулярные формы ферментов, катализирующие одну и ту же реакцию с
Они различаются по строению апофермента, по физико-химическим свойствам, по сродству апофермента к субстрату
Коферменты изоферментов одинаковы, поэтому биологическое действие изоферментов одинаково. Различия проявляются в аминокислотном составе полипептидных цепей, вследствие этого изоферменты имеют различную молекулярную массу, различный по величине заряд и легко разделяются при электрофорезе.
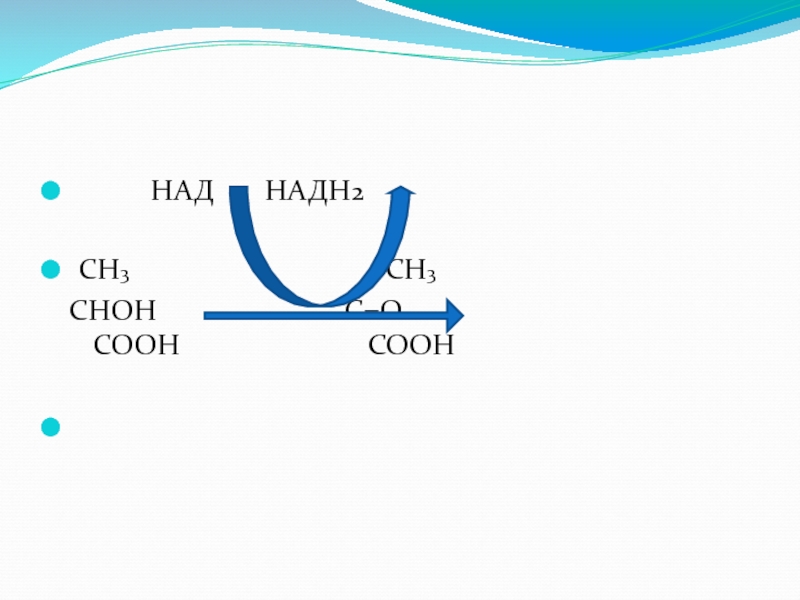
Слайд 32Лактатдегидрогеназа (ЛДГ)
ускоряет реакцию дегидрирования молочной кислоты,
имеет пять изоферментов, которые отличаются
В состав апофермента ЛДГ входят четыре полипептидные цепи.
Различают Н-цепи (heart-сердце) и
М-цепи (muscle-мышцы).
Изоферменты ЛДГ отличаются соотношением входящих в их состав цепей.
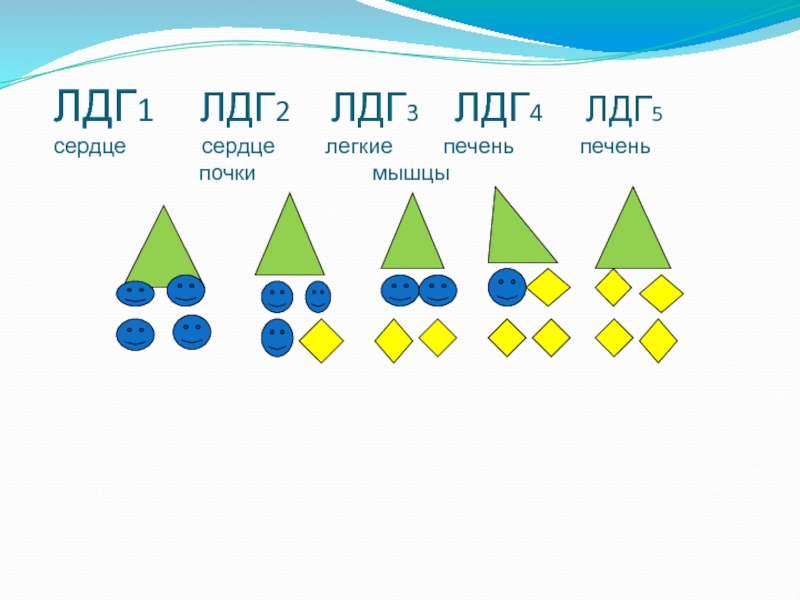
Слайд 34Изоф Типы пп цепей
ЛДГ1 - 4 цепи Н
ЛДГ2 - 3 цепи Н-типа и 1 цепь М-
типа
ЛДГ3 - 2 цепи Н типа 2 цепи М-типа
ЛДГ4 – 1 цепь Н-типа 3 цепи М-типа
ЛДГ5 - 4 цепи М-типа
Слайд 35Место нахождения
ЛДГ1 в сердце;
ЛДГ2 в основном, в сердце, почках
ЛДГ3 в легких
ЛДГ4,
ЛДГ5 в печени
Слайд 37Изоферменты позволяют лучше приспособиться к изменению внешних и внутренних факторов
и
при различной концентрации субстрата и продуктов реакции,
разных значениях рН,
имеют разную чувствительность к ингибиторам.
Слайд 383. Ферменты обладают специфичностью действия
способны избирательно действовать на определенный субстрат
Таким образом, различают субстратную специфичность и
специфичность действия.
По степени проявления субстратная специфичность разделяется на абсолютную и относительную.
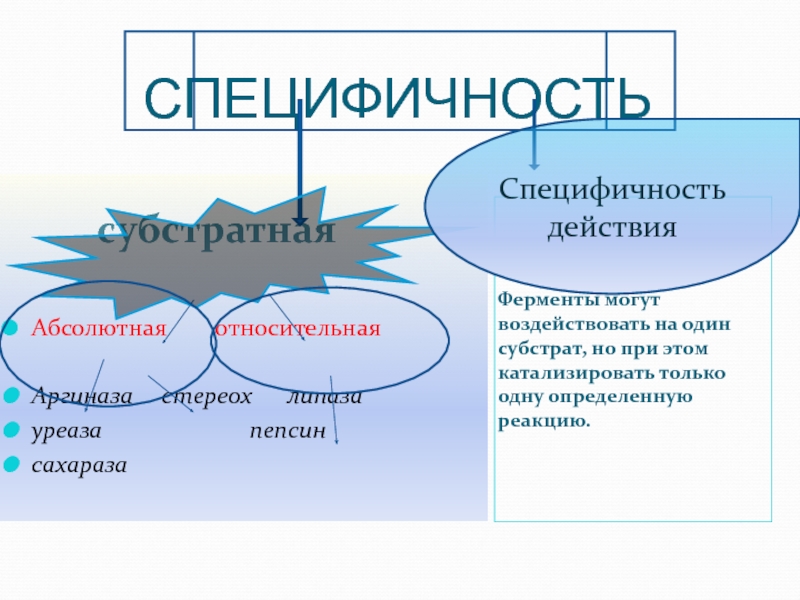
Слайд 39СПЕЦИФИЧНОСТЬ
субстратная
Ферменты могут воздействовать на один субстрат, но при этом катализировать только
Абсолютная относительная
Аргиназа стереох липаза
уреаза пепсин
сахараза
Специфичность действия
Слайд 40 При абсолютной (индивидуальной) специфичности фермент воздействует на один-единственный субстрат. Примером
уреазы, катализирующей превращения только мочевины;
сахаразы, гидролизующей только сахарозу.
Слайд 42Стереохимическая субстратная специфичность —
— высшее проявление абсолютной субстратной специфичности.
Фумараза действует только на фумаровую кислоту (транс-изомер) и не оказывает действия на малеиновую кислоту (цис-форма
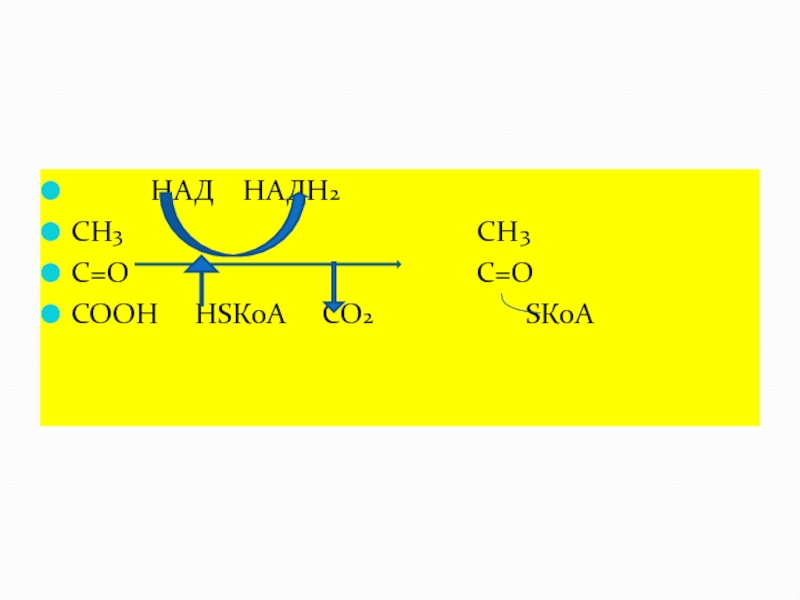
Слайд 43 Специфичность действия - это способность ферментов производить с субстратом лишь
Примером может служить мультиферментный пируватдегидрогеназный комплекс, субстратом этого комплекса является пировиноградная кислота.
Ферменты, входящие в этот комплекс, выполняют каждый свою функцию — декарбоксилаза отщепляет СО2, дегидрогеназы дегидрируют субстрат и т. д.
Слайд 45Относительная (групповая) специфичность.
Фермент, обладающий таким видом субстратной специфичности, может
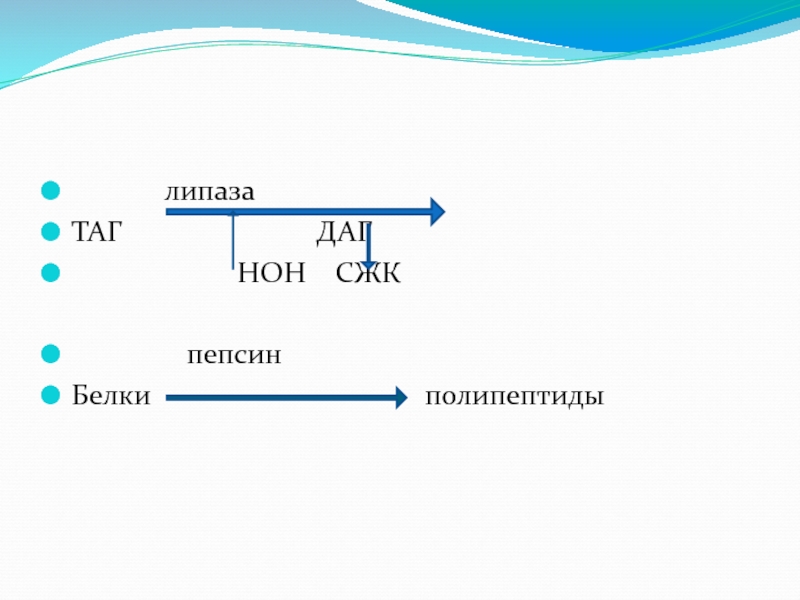
Например, липаза расщепляет сложноэфирные связи в липидах;
пепсин и трипсин расщепляют пептидные связи в белках.
Слайд 474. Ферменты обладают большой мощностью действия.
Большинство реакций,
Слайд 48Для характеристики мощности действия ферментов введено понятие катал — число молекул
в течение 1 минуты.
Слайд 49Мощность большинства ферментов равна 1000 каталов,
мощность действия каталазы —
амилазы — 240 000, а ацетилхолинэстеразы - более 1.000.000.
Высокая мощность действия ферментов обусловливает высокую скорость химических процессов в организме.
Слайд 505. Ферменты не входят в состав конечных продуктов, катализируемых ими реакций
6.Ферменты
Слайд 581 класс - Оксидоредуктазы
2 класс - Трансферазы
3 класс -
4 класс - Лиазы.
5 класс - Изомеразы –
6 класс - Лигазы или синтетазы – ускоряют процесс синтеза с использованием энергии АТФ
Слайд 60Номенклатура и классификация ферментов
класс
подкласс,
подкласс
подподкласс,
в каждом подподклассе обозначен порядковый
Слайд 61Поэтому для каждого фермента существует шифр, состоящий из 4 цифр –
вторая – номер подкласса,
третья – номер подподкласса,
четвертая – место фермента в подподклассе.
Слайд 62Шифр для липазы поджелудочной железы
– 3.1.1.3.,
это означает, что липаза п/ж
к первому подклассу – эстеразам (т.е. ускоряет гидролиз сложно-эфирных связей),
к первому подподклассу (т.е. ускоряет гидролиз сложно-эфирных связей, образованных карбоновыми кислотами), место в подподклассе – третье.
Слайд 65дегидрогеназы
Дегидрогеназы анаэробные
К ДГ относятся ферменты осуществляющие окисление вещества путем дегидрирования
(Пиридинферменты)
Аэробные
флавинферменты
Слайд 68оксигеназы
Гидроксилазы и оксигеназы
Способствуют окислению субстрата, включая в его молекулу кислород
Гидроксилазы включают
Оксигеназы способствуют включению молекулы О2 , вызывая окислительное расщепление двойной связи С=С
Слайд 69трансферазы
2 класс - Трансферазы – катализируют перенос атомов или группы атомов
Слайд 70гидролазы
3 класс - Гидролазы – катализируют распад сложных веществ на более
Слайд 73Лигазы или синтетазы
6 класс - Лигазы или синтетазы – ускоряют процесс
Слайд 74Применение ферментов в медицине
Ферментные препараты широко используются в медицине:
Энзимодиагностика
Энзимотерапия
В качестве специфических
В качестве лекарственных средств
Слайд 75Применение ферментов в медицине
Ферментные препараты широко используют в медицине
Ферменты в медицинской
Слайд 76Клиническое значение определения отдельных ферментов
Большинство ферментов находятся в клетках и их
Слайд 77В этой связи наиболее значимыми для клиники являются представители класса гидролаз,
Уровень активности альфа-амилазы в норме: в сыворотке 25-220МЕ/л; в моче 10-490МЕ/л. Увеличение активности данного фермента чаще связана с поражением поджелудочной железы (острый панкреатит), в меньшей мере слюнных желез (паротит).
Слайд 78Уровень активности сывороточной альдолазы составляет 1-7,5ЕД/л (0,0038-0,020мкМ/мин•мл).
Сывороточная альдолаза (фруктозо-1,6-дифосфатаза) увеличивается
Слайд 79ЩФ (щелочная фосфатаза) широко распространена в тканях человека, особенно в слизистой
Она катализирует отщепление фосфатов от их органических соединений, название получила в связи с тем, что оптимум рН лежит в щелочной среде (рН 8,6-10,1).
Слайд 80Активность ЩФ повышается при холестазе (застое желчи), или механической желтухе, а
Слайд 81Кислая фосфатаза
Уровень активности КФ (кислая фосфатаза) в норме 0-6,5МЕ/л. Этот фермент
Слайд 82КФ (кислая фосфатаза) увеличивается в основном
при прогрессирующей болезни Педжета (заболевание
раке предстательной железы
Слайд 83Аланинаминотрансфераза (АЛТ)
Аспартатаминотрансфераза (АСТ)
АЛТ и АСТ находятся во многих тканях, но больше
Слайд 84
Активность данных ферментов повышается значительно при остром гепатите, некрозе печени, травматическом
Слайд 85ГГТ находится в больших количествах в печени, почках, поджелудочной железе.
Этот
рака поджелудочной железы,
застоя желчи
и поражения почек
Слайд 86Для клинической диагностики важно понятие «изоферменты»
Изоферменты – это множественные формы одного
Слайд 87Изоферменты имеют одинаковое строение кофермента (небелковой части) и разное строение апофермента
Слайд 88Креатинфосфотрансфераза, или креатинфосфокиназа (КФК) имеет 3 изофермента –
КФК1 – в
КФК2 - в сердце,
КФК3 – в мышцах.
Если нет признаков повреждения мышц и нервной ткани, то повышение КФК характерно для инфаркта миокарда.
Слайд 89ЛДГ1 находится в сердце и эритроцитах;
ЛДГ2 – в основном в
ЛДГ3 – в основном в легких;
ЛДГ4 – в основном в печени,
ЛДГ5 – в скелетных мышцах и печени.
Соответственно повышение той или иной фракции ЛДГ говорит о локализации повреждения
Слайд 90Клиническое значение определения отдельных ферментов
Большинство ферментов находятся в клетках и их
Слайд 91В этой связи наиболее значимыми для клиники являются представители класса гидролаз,
Уровень активности альфа-амилазы в норме: в сыворотке 25-220МЕ/л; в моче 10-490МЕ/л. Увеличение активности данного фермента чаще связана с поражением поджелудочной железы (острый панкреатит), в меньшей мере слюнных желез (паротит).
Слайд 92Уровень активности сывороточной альдолазы составляет 1-7,5ЕД/л (0,0038-0,020мкМ/мин•мл). Сывороточная альдолаза (фруктозо-1,6-дифосфатаза) увеличивается
Слайд 93ЩФ широко распространена в тканях человека, особенно в слизистой оболочке кишечника,
Слайд 94Активность ЩФ повышается при холестазе (застое желчи), или механической желтухе, а
Уровень активности КФ в норме 0-6,5МЕ/л. Этот фермент содержится почти во всех органах и тканях человека, особенно в печени, костях, почках, предстательной железе, клетках крови.
Слайд 95КФ увеличивается в основном при прогрессирующей болезни Педжета (заболевание костной системы)
Слайд 96АЛТ и АСТ находятся во многих тканях, но больше всего их
Активность данных ферментов повышается значительно при остром гепатите, некрозе печени, травматическом повреждении мышц и инфаркте миокарда.
Слайд 97ГГТ находится в больших количествах в печени, почках, поджелудочной железе. Этот
Слайд 98Для клинической диагностики важно понятие «изоферменты»
Изоферменты – это множественные формы одного
Слайд 99Креатинфосфотрансфераза, или креатинфосфокиназа (КФК) имеет 3 изофермента - КФК1 – в
Слайд 100ЛДГ1 находится в сердце и эритроцитах;
ЛДГ2 – в основном в
ЛДГ3 – в основном в легких;
ЛДГ4 – в основном в печени,
ЛДГ5 – в скелетных мышцах и печени.
Соответственно повышение той или иной фракции ЛДГ говорит о локализации повреждения
Слайд 101Изоферменты имеют одинаковое строение кофермента (небелковой части) и разное строение апофермента
Слайд 102Применение гидролаз в медицине
гидролазы используются
Слайд 103 для растворения тромба при тромбофлебитах, инфаркте миокарда.
Стрептокиназа предложена
Слайд 104 для рассасывания гематом при операциях на лице,
для рассасывания воспалительных экссудатов при воспалении легких, абсцессах легкого, плевритах, пиелонефритах.
в стоматологии при обработке десневых карманов при парадонтозе.
для лечения старости.
Слайд 105Литература основная
Т.Ш.Шарманов, С.М.Плешкова «Метаболические основы питания с курсом общей биохимии»,
Е.С. Северин «Биохимия», 2009 г.
С.Тапбергенов «Медицинская биохимия», Астана, 2001 г.
С.Сеитов «Биохимия», Алматы, 2001 г.
В.Дж.Маршал «Клиническая биохимия», 2000 г.
Слайд 106дополнительная
Б.Гринстейн, А.Гринстейн «Наглядная биохимия», 2000 г.
Т.Т.Березов, Б.Ф.Коровкин «Биологическая химия», 2002 г.
Д.Г.Кнорре,
Р.Марри, Д.Греннер «Биохимия человека», I-II том, 1993 г.
А.Ш.Зайчик, Л.Г.Чурилов «Основы патохимии», Москва, 2001 г.
Полосухина Т.Я., Аблаев Н.Р. «Материалы к курсу биологической химии», 1977 – С. 3, 30-33, 47-49, 59-62.
Бышевский А.Ш., Терсенов О.А. «Биохимия для врача», 1994 – С. 34-54, 75, 95, 108, 214-216, 224, 249.
Н.Р. Аблаев Биохимия в схемах и рисунках, Алматы 2005 г.
Биохимия. Краткий курс с упражнениями и задачами. Под ред. проф. Е.С. Северина, А.Я. Николаева, М., 2002 г.
Слайд 107
КОНТРОЛЬНЫЕ ВОПРОСЫ:
Что такое ферменты?
Назовите общие свойства ферментов.
Перечислите с соблюдением порядка
В каких случаях в крови повышается активность АСТ и АЛТ?
Что бы вы хотели узнать по этой теме больше?