- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ферментативный микроанализ. Использование в микроанализе ферментных электродов. (Лекция 6) презентация
Содержание
- 1. Ферментативный микроанализ. Использование в микроанализе ферментных электродов. (Лекция 6)
- 2. Ферментативный микроанализ Ферменты используются для обнаружения и
- 3. Почему используют Е в ферментативном микроанализе Специфичность
- 4. Ферментативный микроанализ Пример: Щелочной фосфатазы используется
- 5. Кинетическая основа ферментативного микроанализа А→P Начальная скорость
- 6. Кинетическая основа ферментативного микроанализа Ферментативную реакцию останавливают
- 7. Кинетическая основа ферментативного микроанализа при определении концентрации
- 8. Кинетическая основа ферментативного микроанализа при определении концентрации
- 9. Зависимость скорости ферментативной реакции от концентрации субстрата
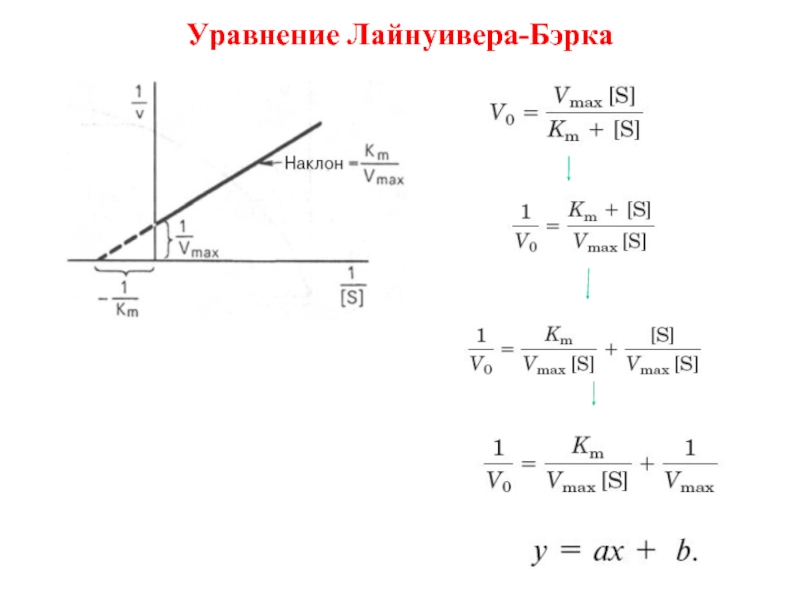
- 10. Уравнение Лайнуивера-Бэрка
- 11. Константа Михаэлиса Константа Михаэлиса хар-т сродство фермента
- 12. Кинетическая основа ферментативного микроанализа при определении эффекторов.
- 13. Конкурентное ингибирование
- 14. Конкурентное ингибирование
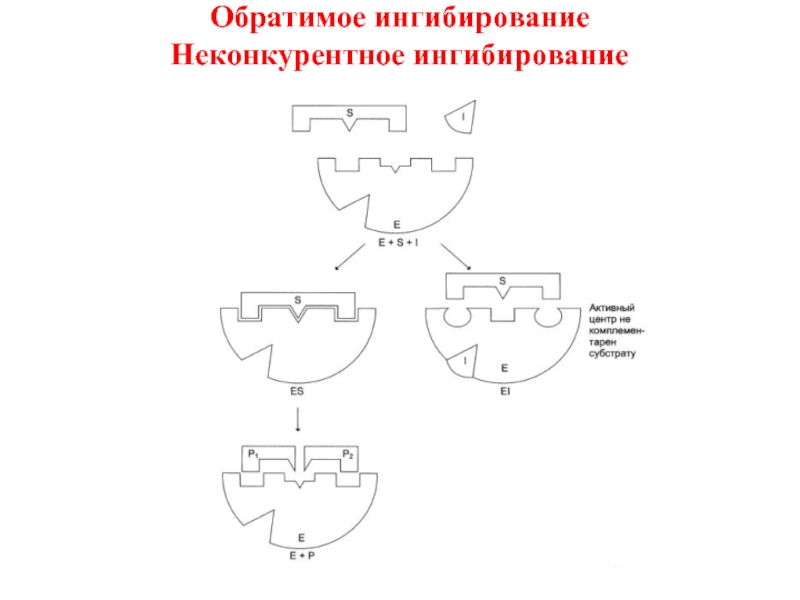
- 15. Обратимое ингибирование Неконкурентное ингибирование
- 16. Обратимое ингибирование Неконкурентное ингибирование
- 17. Кинетическая основа ферментативного микроанализа при определении эффекторов.
- 18. Необратимое ингибирование Наблюдается в случае
- 19. Для необратимых ингибиторов: E +
- 20. Использование в микроанализе сопряженных ферментативных систем: Использование
- 21. Использование в микроанализе сопряженных ферментативных систем: Надо
Слайд 2Ферментативный микроанализ
Ферменты используются для обнаружения и количественного определения различных веществ:
Металлов (Ag,
Cu, Hg, Zn и т. д)
Органических и неорганических соединений
Мутагенов
Канцерогенов
Метаболитов
Детекция количеств, недоступных определению с помощью большинства физико-химических методов.
Методы детекции: электрохимический, спектрофотометрический,флуоресцентный, биолюминесцентный.
Органических и неорганических соединений
Мутагенов
Канцерогенов
Метаболитов
Детекция количеств, недоступных определению с помощью большинства физико-химических методов.
Методы детекции: электрохимический, спектрофотометрический,флуоресцентный, биолюминесцентный.
Слайд 3Почему используют Е в ферментативном микроанализе
Специфичность по отношению к S (определение
S в многокомпонентной смеси, без ее предварительного разделения на составляющие)
Высокая каталитическая активность
(катализируют реакции химического превращения субстрата даже при его низких концентрациях, можно определять микроколичества вещества).
Ферментативный микроанализ простой и быстрый (не надо разделять смеси или концентрировать анализируемый образец, высокая скорость биокатализа)
Многообразие веществ, которые определяются (либо субстраты, либо его эффекторы)
Высокая каталитическая активность
(катализируют реакции химического превращения субстрата даже при его низких концентрациях, можно определять микроколичества вещества).
Ферментативный микроанализ простой и быстрый (не надо разделять смеси или концентрировать анализируемый образец, высокая скорость биокатализа)
Многообразие веществ, которые определяются (либо субстраты, либо его эффекторы)
Слайд 4Ферментативный микроанализ
Пример:
Щелочной фосфатазы используется для детекции нг количеств бериллия.
Алкогольдегидрогеназа - ионы
серебра (10пг/мл).
Пероксидаза и уреаза - ртуть.
Холинэстераза или карбоксилэстераза - фосфорсодержащие пестициды определяют п
Бактериальная люцифераза -инсектициды (ДДТ, пентахлорфенол).
Пероксидаза и уреаза - ртуть.
Холинэстераза или карбоксилэстераза - фосфорсодержащие пестициды определяют п
Бактериальная люцифераза -инсектициды (ДДТ, пентахлорфенол).
Слайд 5Кинетическая основа ферментативного микроанализа
А→P
Начальная скорость этой реакции ϑ0 пропорциональна концентрации исходного
вещества [А].
ϑ0=κ[А],
где κ–константа скорости реакции.
Чем выше концентрация вещества [А], тем больше ϑ0
Концентрацию вещества А определяют с помощью предварительно построенного калибровочного графика, отражающего зависимость ϑ0 от [А]).
ϑ0=κ[А],
где κ–константа скорости реакции.
Чем выше концентрация вещества [А], тем больше ϑ0
Концентрацию вещества А определяют с помощью предварительно построенного калибровочного графика, отражающего зависимость ϑ0 от [А]).
Слайд 6Кинетическая основа ферментативного микроанализа
Ферментативную реакцию останавливают через определенное время. Зная концентрацию
А и измерив концентрацию образовавшегося Р, можно построить калибровочный график, описывающий зависимость [Р] от [А].
Пределы обнаружения анализируемых соединений определяются не только каталитической активностью фермента, но и другими кинетическими параметрами индикаторной реакции.
Пределы обнаружения анализируемых соединений определяются не только каталитической активностью фермента, но и другими кинетическими параметрами индикаторной реакции.
Слайд 7Кинетическая основа ферментативного микроанализа при определении концентрации S
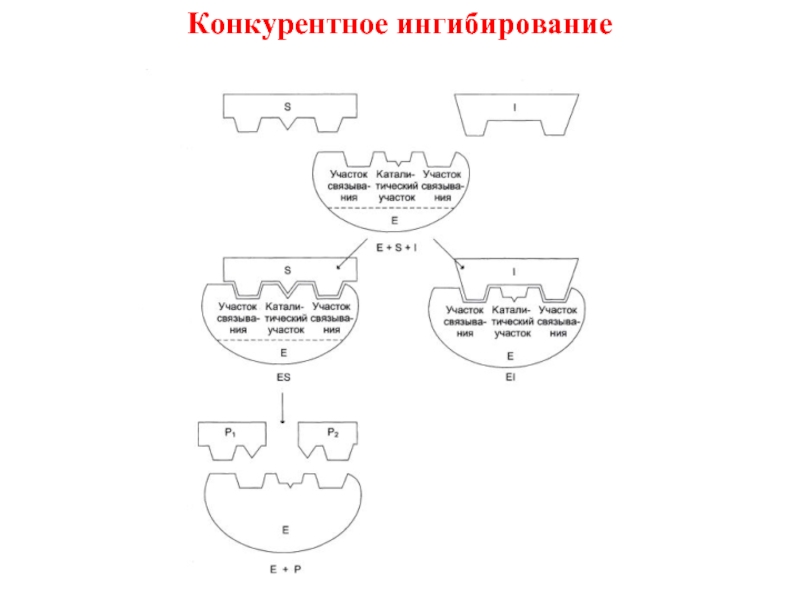
E + S
↔ES →P + E
где Е – фермент, S – субстрат, ES – фермент-субстратный комплекс, Р –продукт.
При [E] << [S]0 начальная стационарная скорость такого рода реакции описывается уравнением Михаэлиса–Ментен
где Е – фермент, S – субстрат, ES – фермент-субстратный комплекс, Р –продукт.
При [E] << [S]0 начальная стационарная скорость такого рода реакции описывается уравнением Михаэлиса–Ментен
k1
k-1
k2
Слайд 8Кинетическая основа ферментативного микроанализа при определении концентрации S
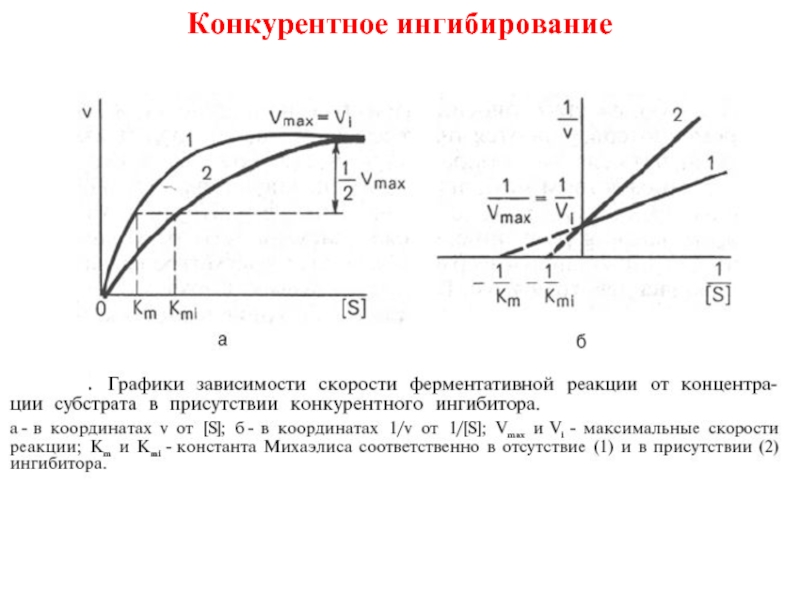
Согласно уравнению Михаэлиса–Ментен,
концентрация субстрата [S]0 будет пропорциональна v0 только при условии, когда [S]0 << Km.
Верхняя граница определения [S] ограничена величиной Km.
Нижняя граница зависит от чувствительности метода регистрации.
Верхняя граница определения [S] ограничена величиной Km.
Нижняя граница зависит от чувствительности метода регистрации.
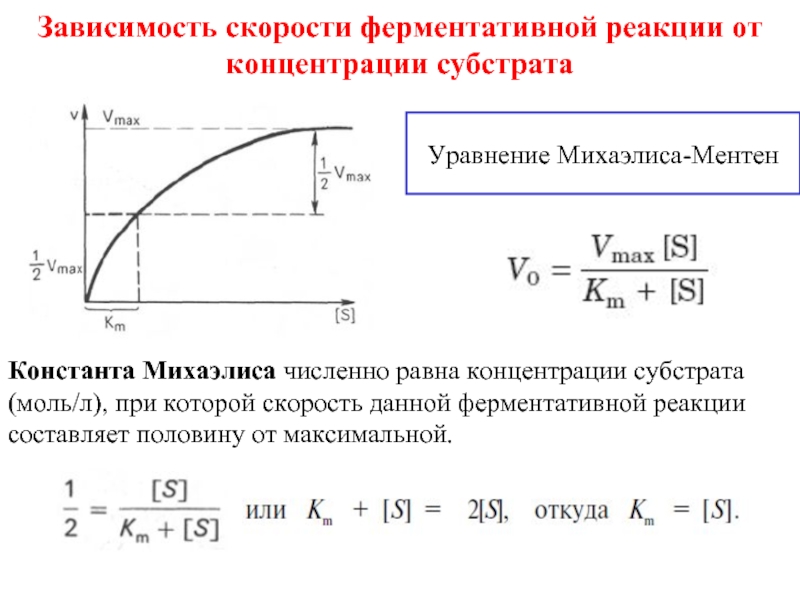
Слайд 9Зависимость скорости ферментативной реакции от концентрации субстрата
Уравнение Михаэлиса-Ментен
Константа Михаэлиса численно равна
концентрации субстрата (моль/л), при которой скорость данной ферментативной реакции
составляет половину от максимальной.
составляет половину от максимальной.
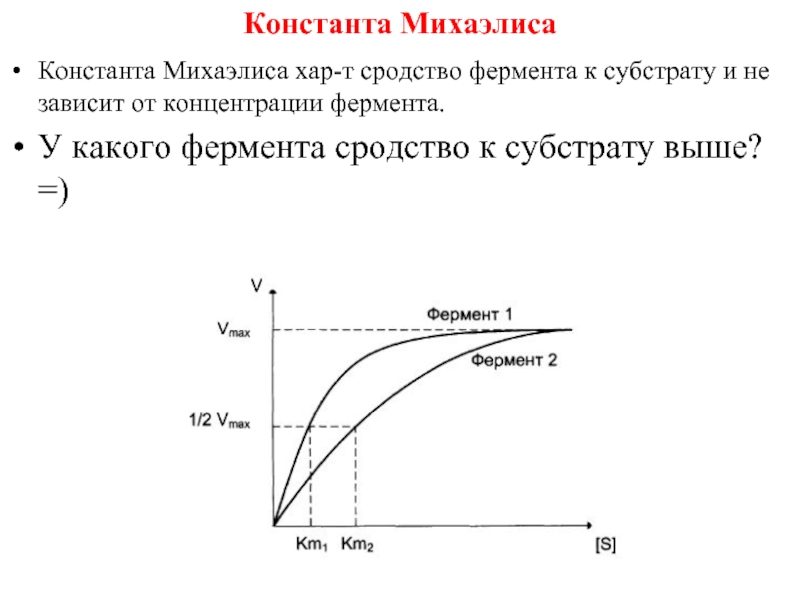
Слайд 11Константа Михаэлиса
Константа Михаэлиса хар-т сродство фермента к субстрату и не зависит
от концентрации фермента.
У какого фермента сродство к субстрату выше? =)
У какого фермента сродство к субстрату выше? =)
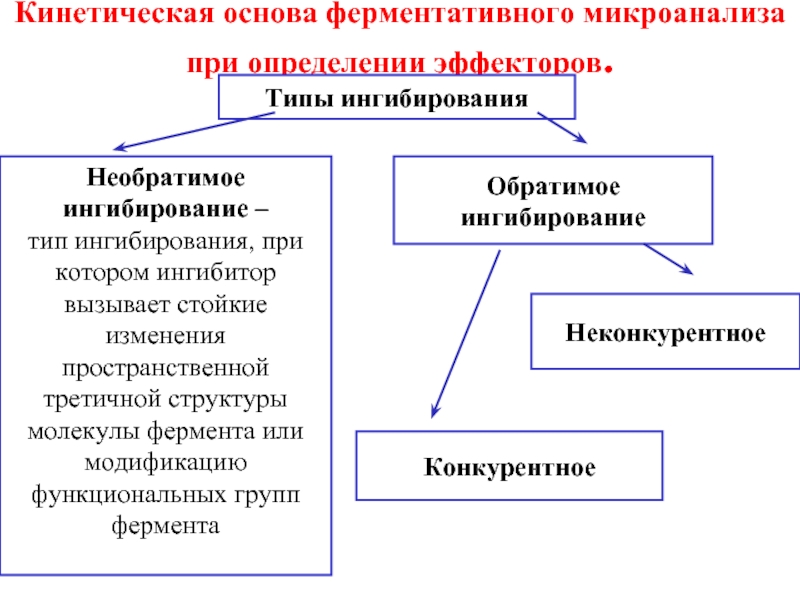
Слайд 12Кинетическая основа ферментативного микроанализа при определении эффекторов.
Типы ингибирования
Необратимое ингибирование –
тип
ингибирования, при котором ингибитор вызывает стойкие изменения пространственной
третичной структуры молекулы фермента или модификацию функциональных групп фермента
третичной структуры молекулы фермента или модификацию функциональных групп фермента
Обратимое ингибирование
Конкурентное
Неконкурентное
Слайд 17Кинетическая основа ферментативного микроанализа при определении эффекторов.
Верхняя граница детектируемых концентраций обратимых
ингибиторов определяется величиной ki.
Взаимодействие с ферментом обратимых неконкурентных ингибиторов можно описать в
виде следующей схемы:
E + I →EI
где I – ингибитор, ki = [EI]/([E][I]).
Взаимодействие с ферментом обратимых неконкурентных ингибиторов можно описать в
виде следующей схемы:
E + I →EI
где I – ингибитор, ki = [EI]/([E][I]).
ki
Слайд 18Необратимое ингибирование
Наблюдается в случае образования ковалентных стабильных связей между
молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр.
Пример:
Ионы тяжелых металлов (ртути, серебра, мышьяка), которые в малых концентрациях блокируют сульфгидрильные группы активного центра.
Аспирин (противовоспалительный нестероидный препарат) –ингибирует фермент циклооксигеназу, катализирующий реакцию образования простагландинов.
Пример:
Ионы тяжелых металлов (ртути, серебра, мышьяка), которые в малых концентрациях блокируют сульфгидрильные группы активного центра.
Аспирин (противовоспалительный нестероидный препарат) –ингибирует фермент циклооксигеназу, катализирующий реакцию образования простагландинов.
Слайд 19
Для необратимых ингибиторов:
E + nI → Ei
Уменьшение активности фермента Δ[E] будет
пропорционально концентрации ингибитора:
Δ[E] = n[I], где n – число молекул ингибитора, взаимодействующих с одной молекулой фермента.
Δ[E] = n[I], где n – число молекул ингибитора, взаимодействующих с одной молекулой фермента.
ki
Слайд 20Использование в микроанализе сопряженных ферментативных систем:
Использование сопряженных ферментативных систем увеличивает чувствительность
микроанализа.
В живой клетке многие ферментативные процессы тесно взаимосвязаны между собой, т. е. P одной реакции является S другой.
В живой клетке многие ферментативные процессы тесно взаимосвязаны между собой, т. е. P одной реакции является S другой.
Слайд 21Использование в микроанализе сопряженных ферментативных систем:
Надо измерить содержание сахарозы в опытном
образце.
1. сахароза → глюкоза + фруктоза (Е-сахараза)
2. глюкоза + О2+Н2О → глюконовая кислота + Н2О2
(Е- глюкозооксидаза)
Для определения содержания пероксида можно использовать полярографический метод
Или
3. Н2О2 + о-дианизидин → окрашенный продукт
(Е-перосидаза)
Чувствительность анализа повышается в 100–1000 раз
1. сахароза → глюкоза + фруктоза (Е-сахараза)
2. глюкоза + О2+Н2О → глюконовая кислота + Н2О2
(Е- глюкозооксидаза)
Для определения содержания пероксида можно использовать полярографический метод
Или
3. Н2О2 + о-дианизидин → окрашенный продукт
(Е-перосидаза)
Чувствительность анализа повышается в 100–1000 раз




![Кинетическая основа ферментативного микроанализаА→PНачальная скорость этой реакции ϑ0 пропорциональна концентрации исходного вещества [А].ϑ0=κ[А],где κ–константа скорости](/img/tmb/2/175376/0364ef33b50769f99a434a781c545b95-800x.jpg)


![Кинетическая основа ферментативного микроанализа при определении концентрации S Согласно уравнению Михаэлиса–Ментен, концентрация субстрата [S]0 будет](/img/tmb/2/175376/8c391ff97d3d2243c0d4fd7280d5a952-800x.jpg)



![Для необратимых ингибиторов:E + nI → EiУменьшение активности фермента Δ[E] будет пропорционально концентрации ингибитора: Δ[E]](/img/tmb/2/175376/a248d11dfddb5286ffd68f8721057dcf-800x.jpg)