- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электрофорез. Типы электрофореза презентация
Содержание
- 1. Электрофорез. Типы электрофореза
- 2. Принцип разделения молекул: по заряду; по размеру (Mr); по форме (пространственной конфигурации)
- 3. Электрофорез проводят в однородном электрическом поле, то
- 4. По способу проведения различают 2 типа электрофореза:
- 5. Электрофорез с подвижной границей
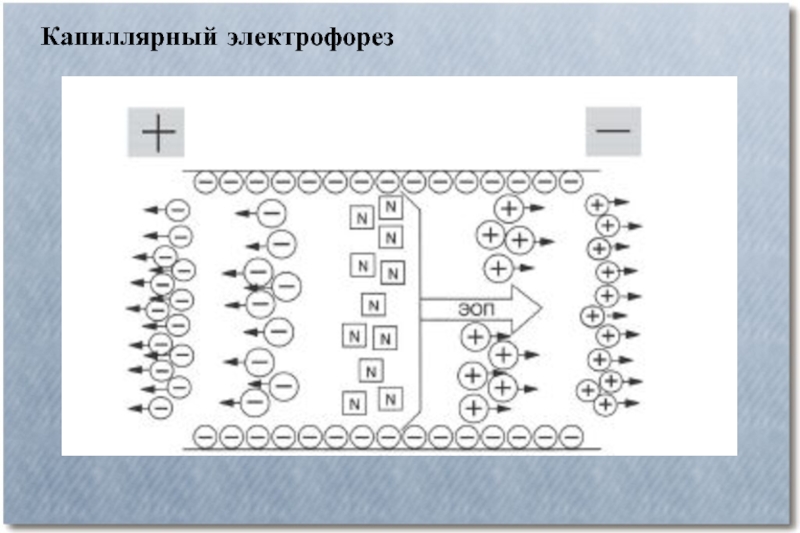
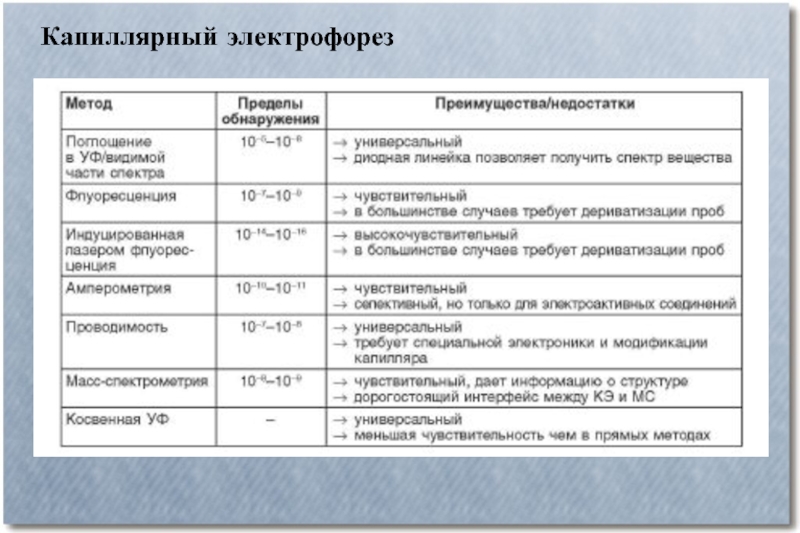
- 6. Капиллярный электрофорез Капиллярный электрофорез – метод разделения
- 7. Капиллярный электрофорез
- 8. Капиллярный электрофорез
- 9. Капиллярный электрофорез
- 10. Капиллярный электрофорез Электроосмотический поток
- 11. Капиллярный электрофорез
- 12. Капиллярный электрофорез
- 13. Капиллярный электрофорез
- 14. Капиллярный электрофорез
- 15. Зональный электрофорез Зональный электрофорез проводится при постоянном
- 16. Зональный электрофорез бумага фильтровальная бумага, небольшие молекулы,
- 17. Типы зональных электрофорезов: Препаративный и
- 18. Электрофорез на бумаге
- 19. Электрофорез на бумаге
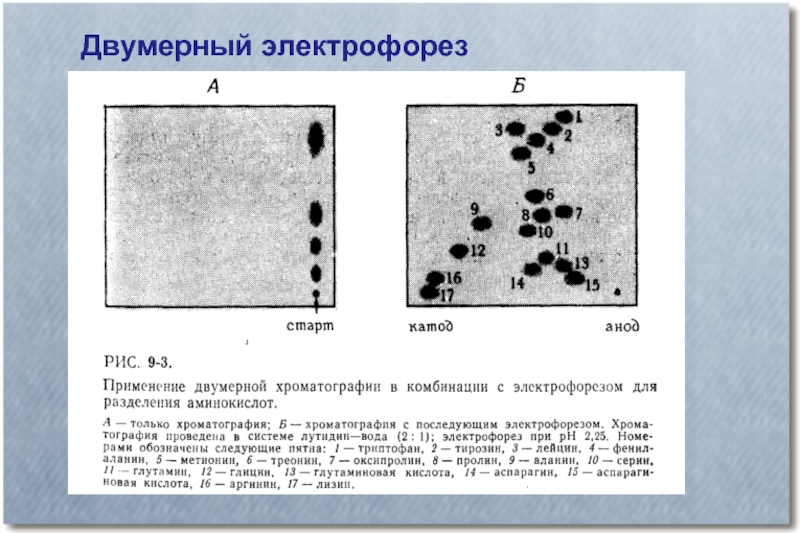
- 20. Двумерный электрофорез
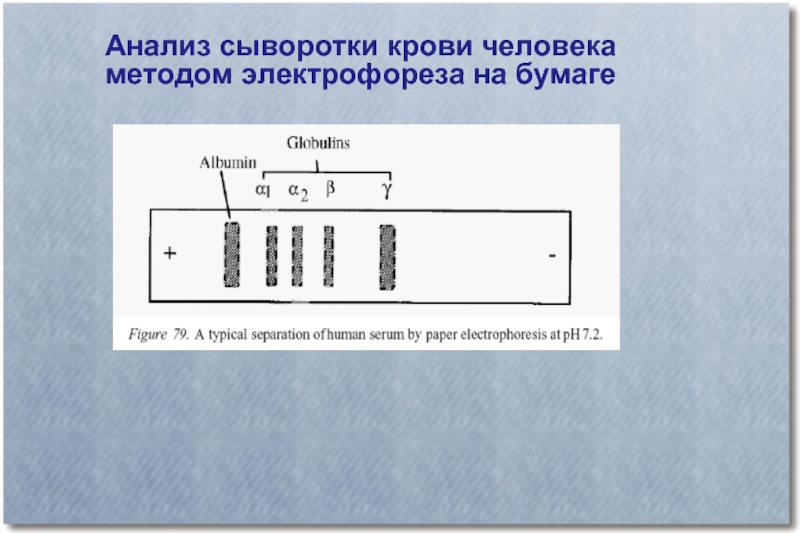
- 21. Анализ сыворотки крови человека методом электрофореза на бумаге
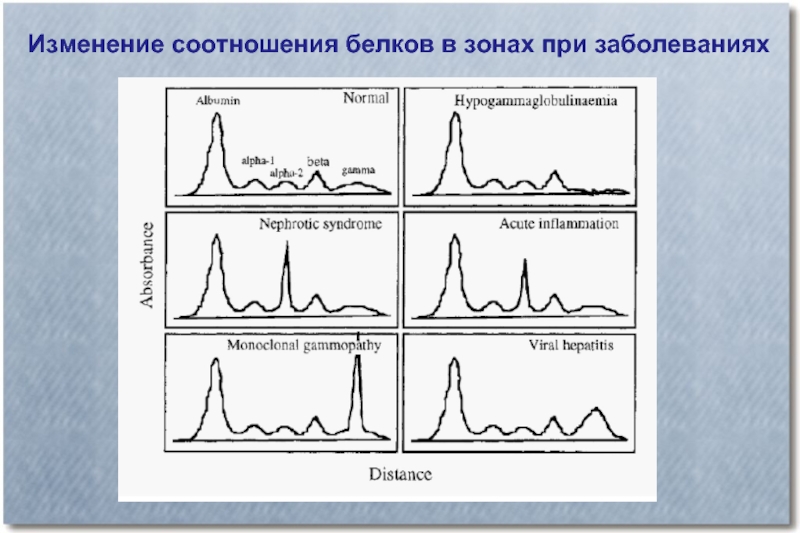
- 22. Изменение соотношения белков в зонах при заболеваниях
- 23. Электрофорез в геле (крахмальный гель, агар, агароза) Препараты: нативная ДНК нативные белки
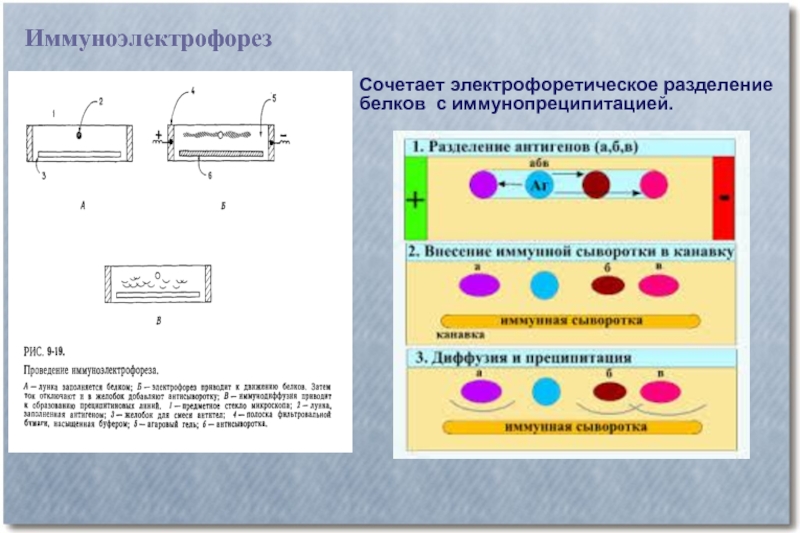
- 24. Иммуноэлектрофорез Сочетает электрофоретическое разделение белков с иммунопреципитацией.
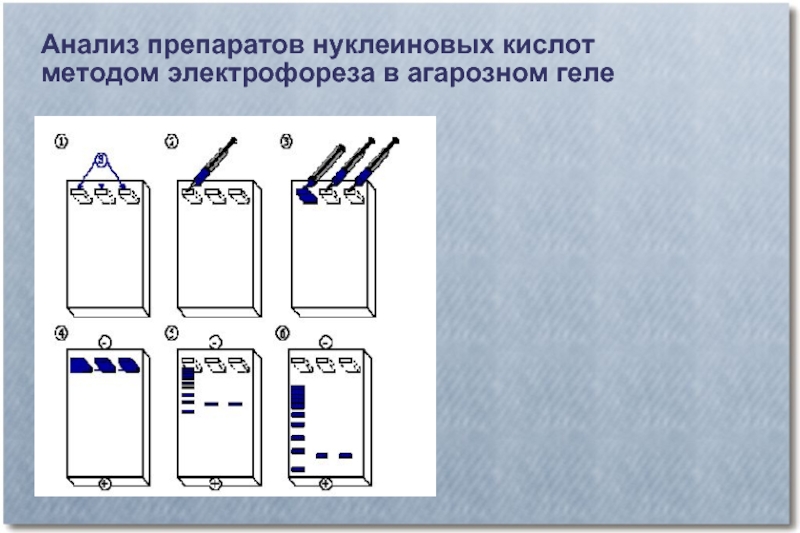
- 25. Анализ препаратов нуклеиновых кислот методом электрофореза в
- 26. Анализ препаратов нуклеиновых кислот методом электрофореза в агарозном геле
- 27. Анализ препаратов нуклеиновых кислот методом электрофореза в агарозном геле
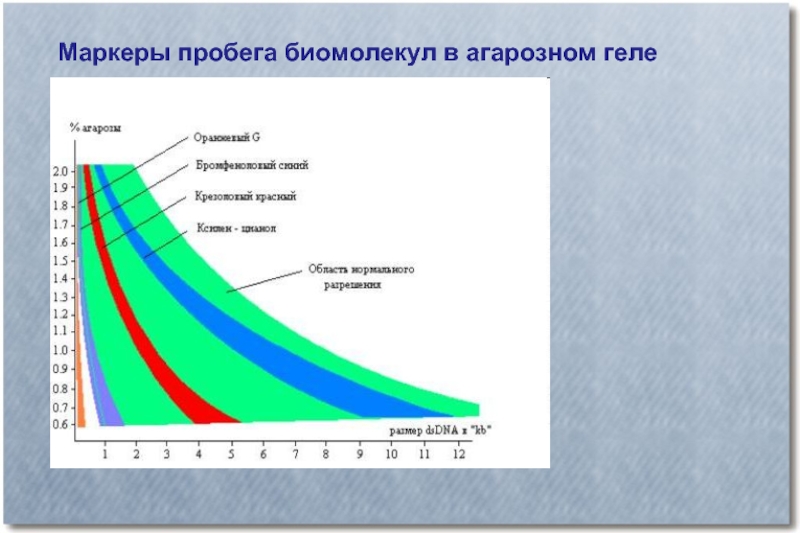
- 28. Маркеры пробега биомолекул в агарозном геле
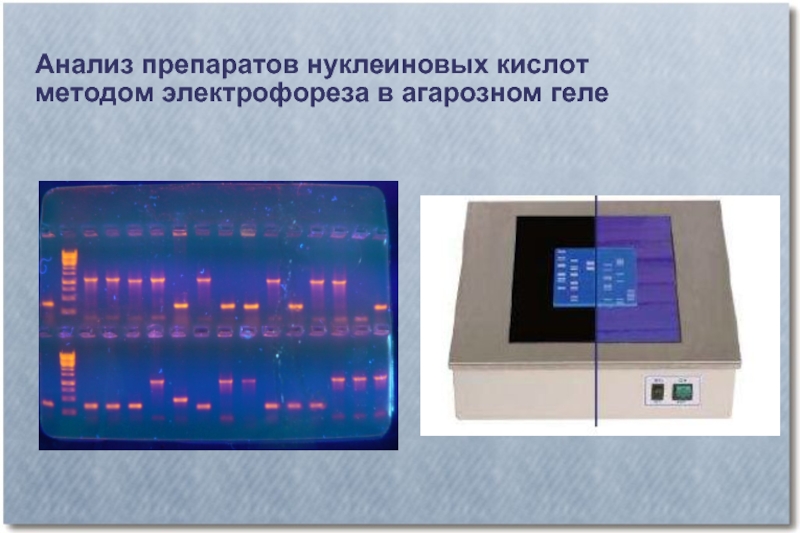
- 29. Визуализация ДНК в агарозном геле
- 30. Анализ препаратов нуклеиновых кислот методом электрофореза в агарозном геле
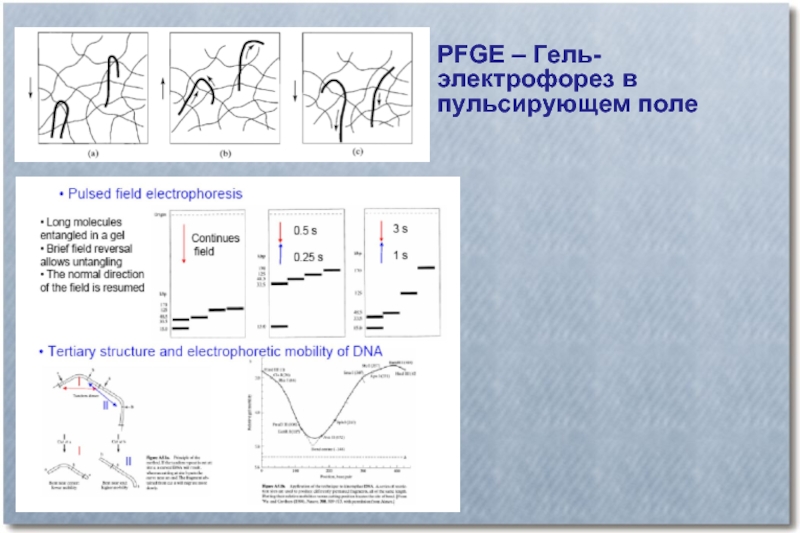
- 31. PFGE – Гель-электрофорез в пульсирующем поле
- 32. Электрофорез в полиакриламидном геле (ПААГ) Препараты: денатурир. РНК одноцепочечн. ДНК денатурир. белки
- 33. Полиакриламид (ПААГ) Для полимеризации необходимы инициатор (персульфат аммония) и катализатор ТЕМЕД
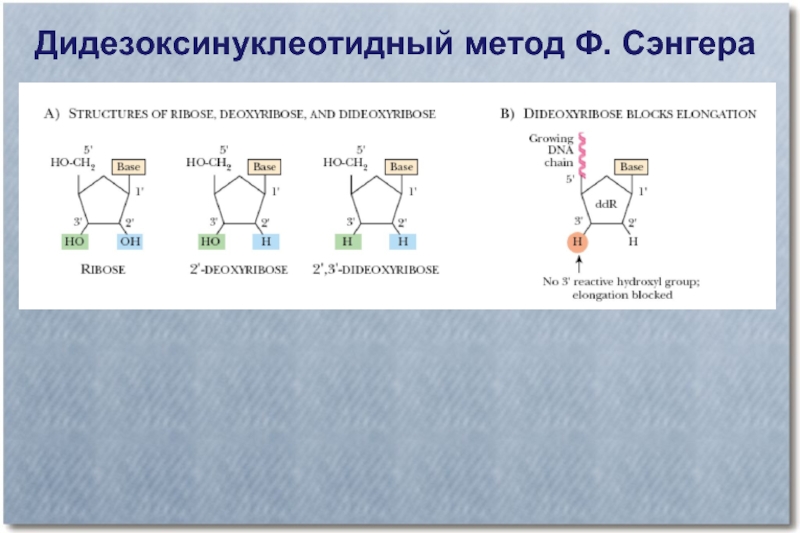
- 34. Секвенирование (определение последовательности нуклеотидов в цепи ДНК)
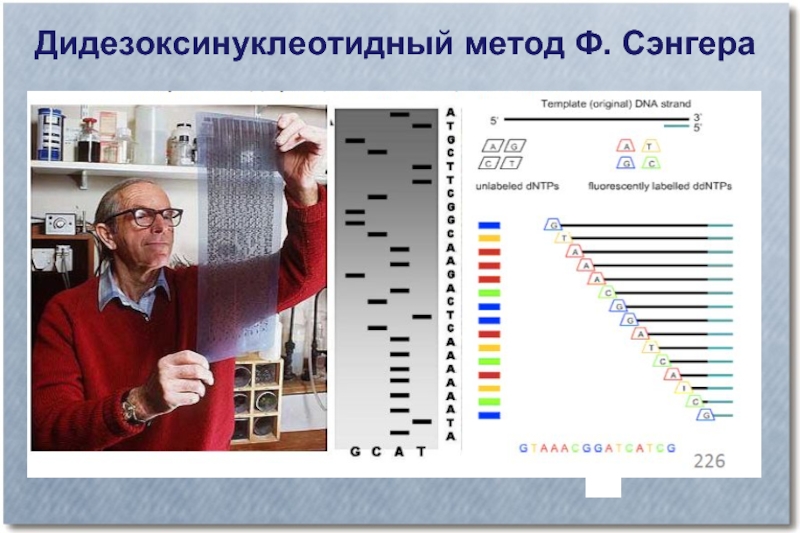
- 35. Дидезоксинуклеотидный метод Ф. Сэнгера
- 36. Дидезоксинуклеотидный метод Ф. Сэнгера
- 37. Дидезоксинуклеотидный метод Ф. Сэнгера
- 38. Секвенирование
- 39. Анализ препаратов белков методом электрофореза в ПААГ
- 40. Анализ препаратов белков методом электрофореза в ПААГ в присутствии SDS (ДСН-Na) (денатурирующие условия)
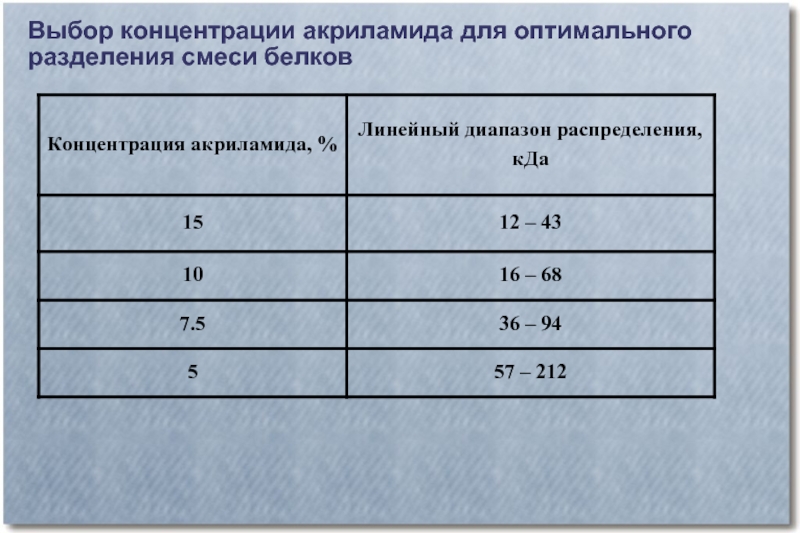
- 41. Выбор концентрации акриламида для оптимального разделения смеси белков
- 42. Анализ препаратов белков методом электрофореза в ПААГ в присутствии SDS (ДСН-Na) (денатурирующие условия)
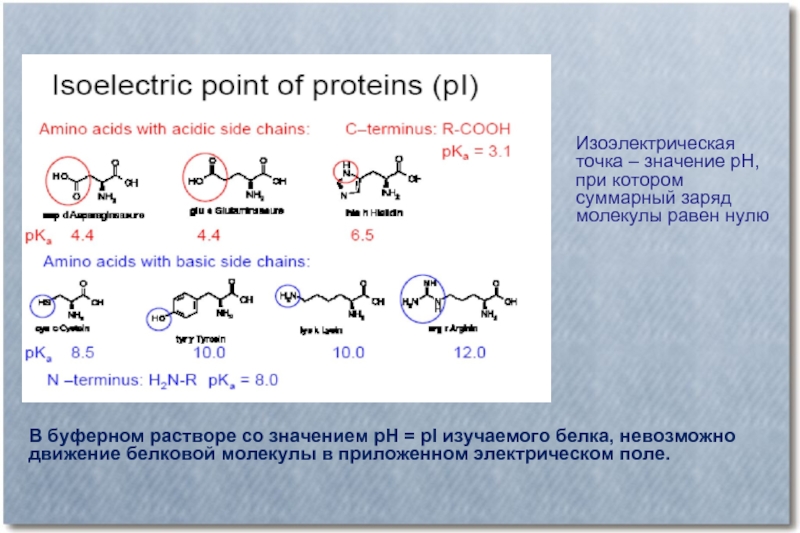
- 43. Ионогенные группы в составе аминокислот рК – характеризует способность групп отдавать ион водорода (Н+)
- 44. Изоэлектрическая точка – значение рН, при котором
- 46. Изоэлектрофокусирование При изоэлектрическом фокусировании в среде для
- 47. Изоэлектрофокусирование
- 48. Изотахофорез В случае изотахофореза заряженные ионы сначала
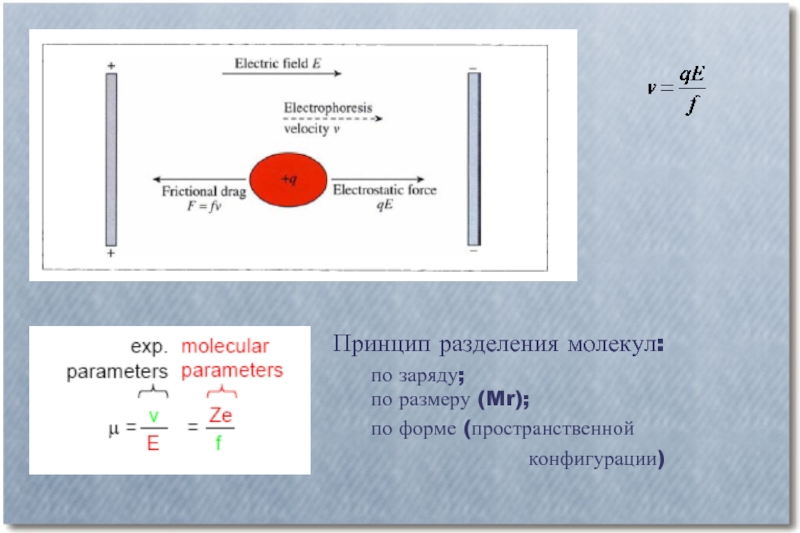
Слайд 2Принцип разделения молекул:
по заряду;
по размеру (Mr);
по форме (пространственной
конфигурации)
Слайд 3Электрофорез проводят в однородном электрическом поле, то есть в поле, напряженность
E которого во всех точках одинакова. Электрический ток пропускают через проводник – буферный раствор, налитый в канал из изолирующего материала (например, стекла) или пропитывающий какую-либо поддерживающую среду – носитель (например, бумагу или гель). Сопротивление R буферного раствора задается двумя факторами: концентрацией в нем свободных ионов и их электрофоретической подвижностью.
Электрофоретической подвижностью (µ) данной молекулы называют скорость движения заряженной молекулы (выражаемой в см/ч) в электрическом поле с напряженностью 1 В/см. Именно различия в электрофоретической подвижности молекул, содержащихся в анализируемой смеси, делают возможным разделить эти молекулы в пространстве (в разных зонах электрофореграммы).
Скорость V движения молекул к тому или иному электроду снижается из-за их трения в окружающей среде. Сила трения прямо пропорциональна скорости движения молекул. Коэффициент трения молекулы, обозначенный как f, зависит как от размера, формы и степени гидратированности этой молекулы, так и от свойств самой среды.
Электрофоретическая подвижность молекул зависит:
- от самой молекулы: ее размера (молекулярной массы), формы, электрического заряда, степени диссоциации и гидратации,
- от концентрации молекул,
- от среды: ее вязкости, рН, температуры и ионной силы,
- от характеристик используемого электрического поля (для крупных макромолекул применяется электрофорез в пульсирующем электрическом поле).
Электрофоретической подвижностью (µ) данной молекулы называют скорость движения заряженной молекулы (выражаемой в см/ч) в электрическом поле с напряженностью 1 В/см. Именно различия в электрофоретической подвижности молекул, содержащихся в анализируемой смеси, делают возможным разделить эти молекулы в пространстве (в разных зонах электрофореграммы).
Скорость V движения молекул к тому или иному электроду снижается из-за их трения в окружающей среде. Сила трения прямо пропорциональна скорости движения молекул. Коэффициент трения молекулы, обозначенный как f, зависит как от размера, формы и степени гидратированности этой молекулы, так и от свойств самой среды.
Электрофоретическая подвижность молекул зависит:
- от самой молекулы: ее размера (молекулярной массы), формы, электрического заряда, степени диссоциации и гидратации,
- от концентрации молекул,
- от среды: ее вязкости, рН, температуры и ионной силы,
- от характеристик используемого электрического поля (для крупных макромолекул применяется электрофорез в пульсирующем электрическом поле).
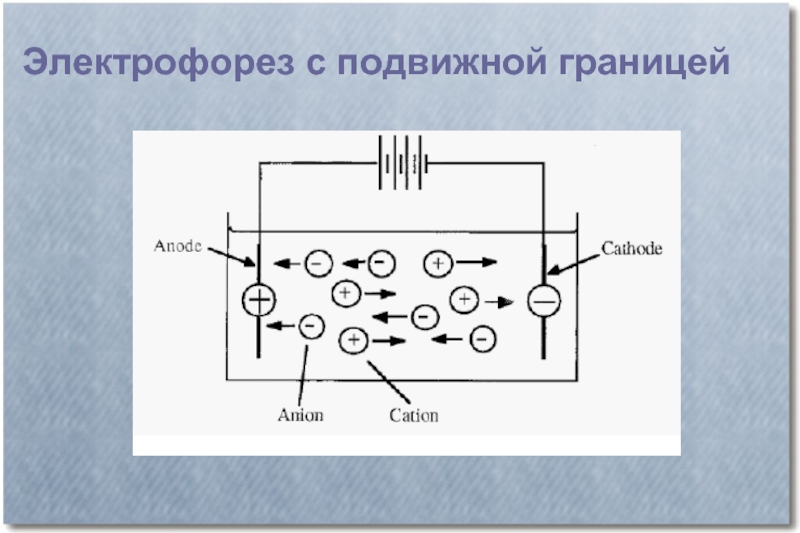
Слайд 4По способу проведения различают 2 типа электрофореза:
электрофорез с подвижной границей;
зональный электрофорез
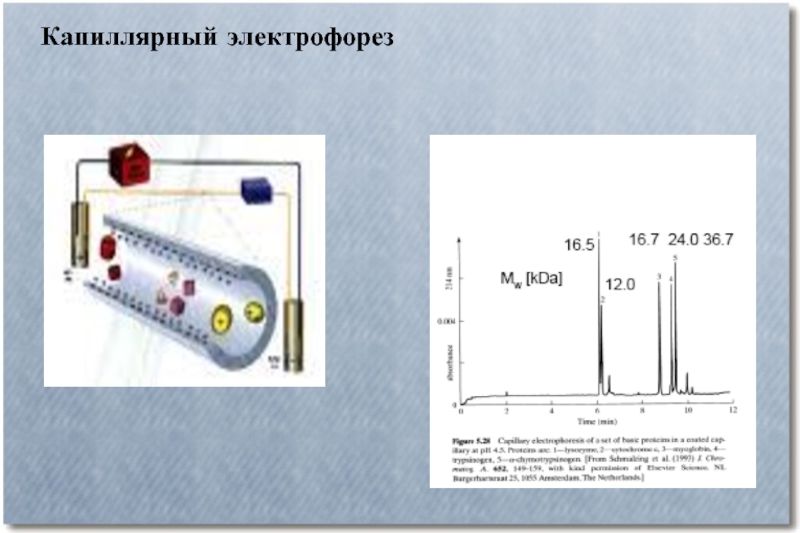
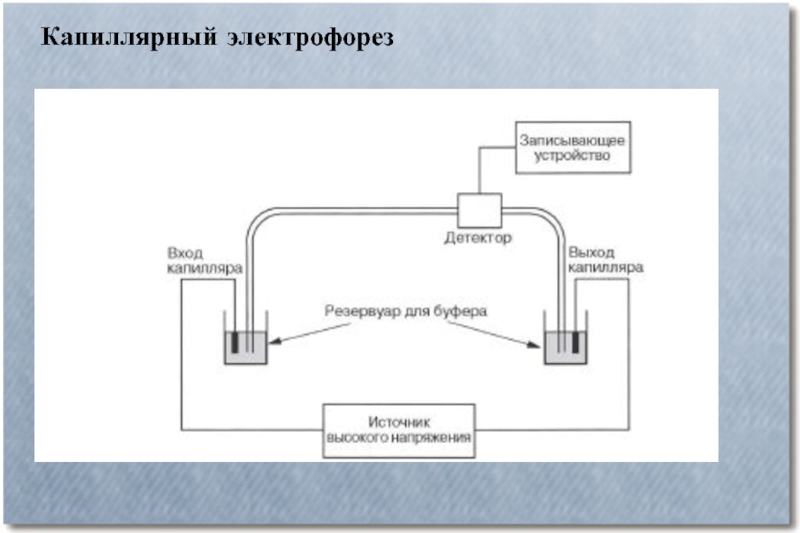
Слайд 6Капиллярный электрофорез
Капиллярный электрофорез – метод разделения молекул по заряду и размеру
в тонком капилляре, заполненном электролитом. Для проведения капиллярного электрофореза требуется относительно простое оборудование. Основные компоненты системы — флакон для нанесения образца, стартовый флакон, конечный флакон, капилляр, электроды, мощный источник питания, детектор и устройство обработки данных. Флакон для нанесения образца, стартовый и конечный флаконы заполнены электролитом, например, водным буферным раствором. Для нанесения образца конец капилляра опускают во флакон с образцом и затем перемещают в стартовый флакон. Миграция молекул анализируемых веществ осуществляется под действием электрического поля, которое прилагается между стартовым и конечным флаконами. Ионы передвигаются по капилляру в одном направлении под действием электроосмотического тока. Анализируемые вещества разделяются по электрофоретической мобильности и детектируются около конца капилляра.
Слайд 15Зональный электрофорез
Зональный электрофорез проводится при постоянном (не изменяющемся) значении рН буферного
раствора, заполняющего данный носитель (бумагу, гель, др.). Исследуемый образец наносится пятном или тонким слоем на носитель, по которому и перемещается в электрическом поле. Усложненным вариантом зонального электрофореза является диск-электрофорез (многофазный зональный электрофорез), при котором рН и другие характеристики, постоянные внутри одной “фазы”, при переходе к другой “фазе” скачкообразно изменяются.
Слайд 16Зональный электрофорез
бумага фильтровальная бумага, небольшие молекулы,
увлажненная буферным раствором аминокислоты, нуклеотиды
гель
агароза поперечно
не сшита, большие молекулы,
полимеризуется в горизонтальных двухцепочечные ДНК,
ячейках нативные белки
ПААГ поперечно сшит, белки (нативные и
полимеризуется в вертикальных денатурированные),
пластинах и трубках короткие фрагменты ДНК,
одноцепочечные НК
полимеризуется в горизонтальных двухцепочечные ДНК,
ячейках нативные белки
ПААГ поперечно сшит, белки (нативные и
полимеризуется в вертикальных денатурированные),
пластинах и трубках короткие фрагменты ДНК,
одноцепочечные НК
Слайд 17Типы зональных электрофорезов:
Препаративный и аналитический
Вертикальный и горизонтальный
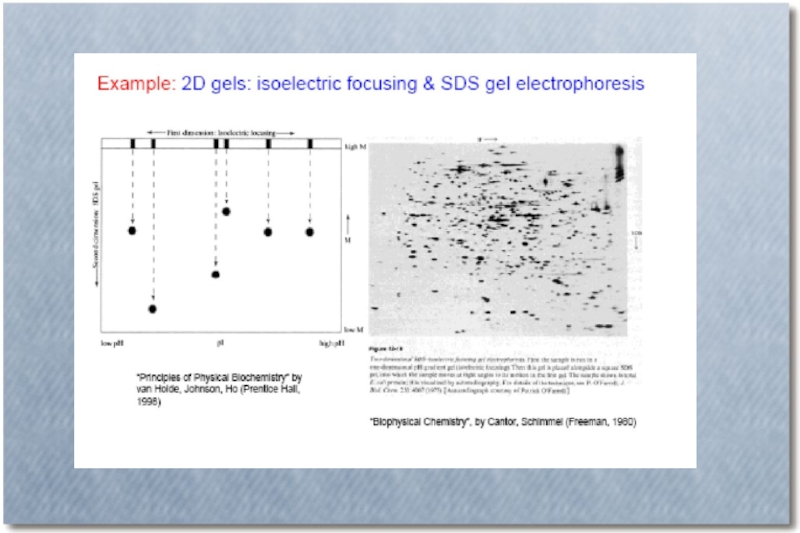
Одномерный, двумерный, в объеме
Нативный и
в присутствии денатурирующих агентов
Изоэлектрическое фокусирование
Изоэлектрическое фокусирование
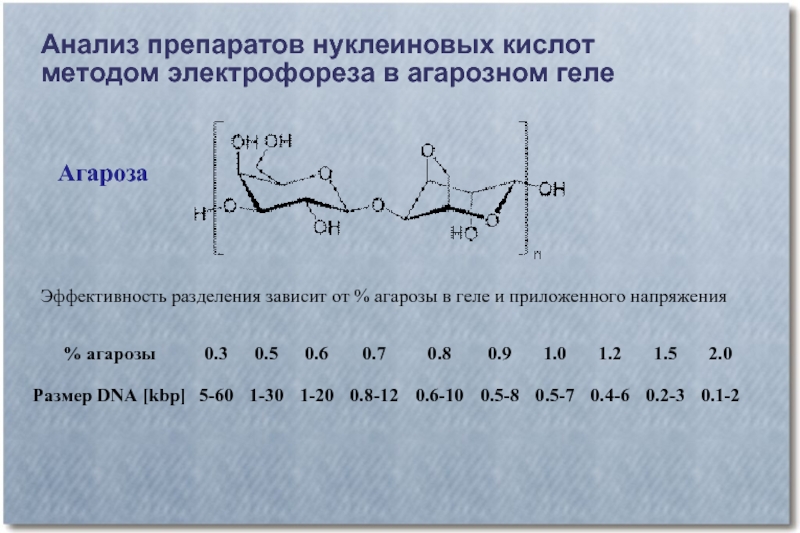
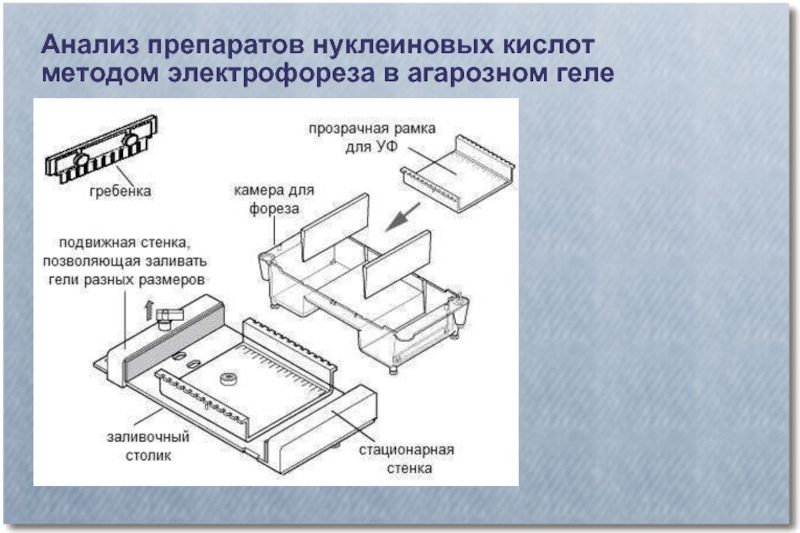
Слайд 25Анализ препаратов нуклеиновых кислот
методом электрофореза в агарозном геле
Агароза
Эффективность разделения зависит от
% агарозы в геле и приложенного напряжения
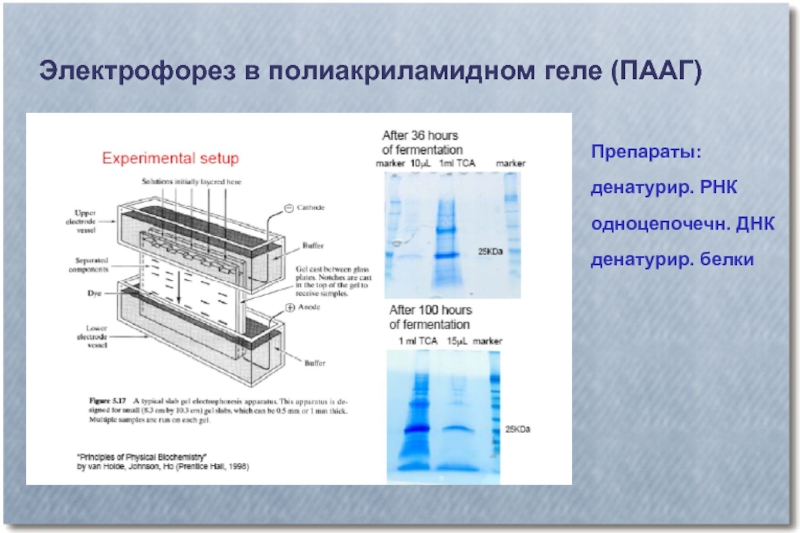
Слайд 32Электрофорез в полиакриламидном геле (ПААГ)
Препараты:
денатурир. РНК
одноцепочечн. ДНК
денатурир. белки
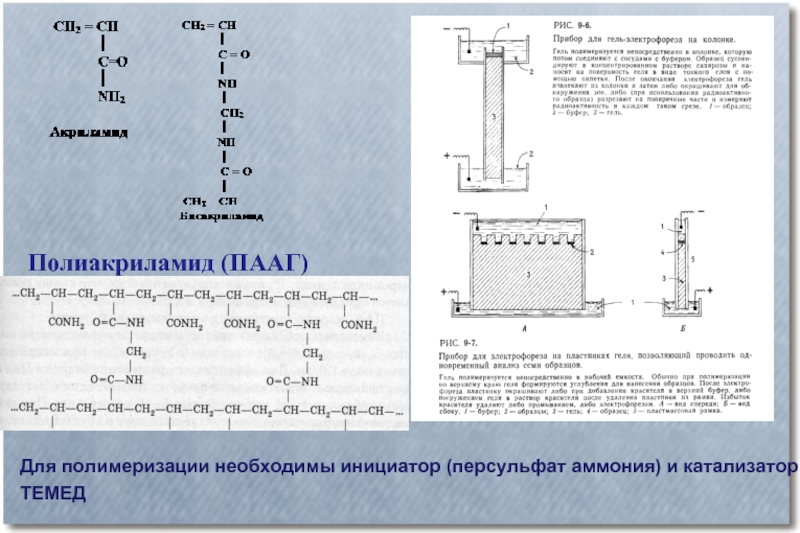
Слайд 33Полиакриламид (ПААГ)
Для полимеризации необходимы инициатор (персульфат аммония) и катализатор
ТЕМЕД
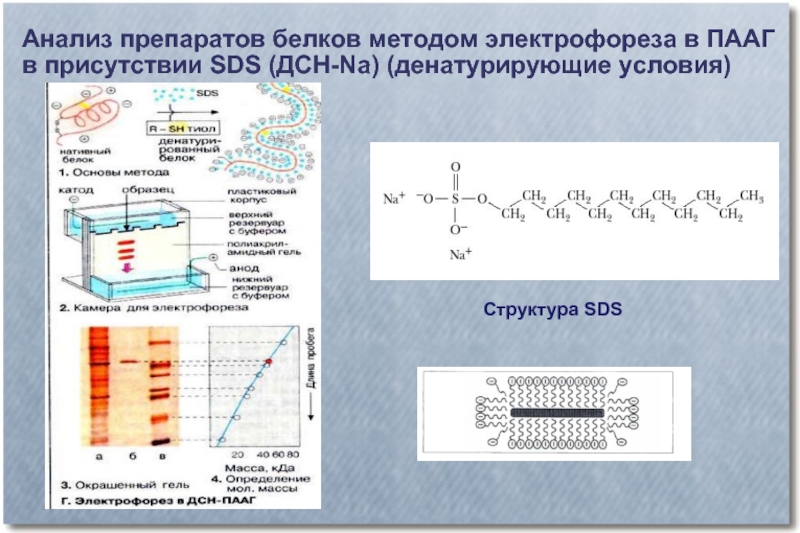
Слайд 39Анализ препаратов белков методом электрофореза в ПААГ
в присутствии SDS (ДСН-Na)
(денатурирующие условия)
Структура SDS
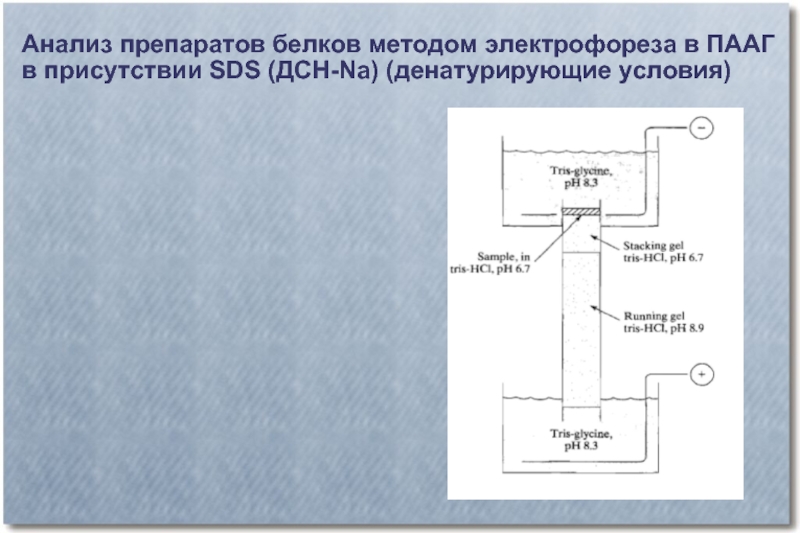
Слайд 40Анализ препаратов белков методом электрофореза в ПААГ
в присутствии SDS (ДСН-Na)
(денатурирующие условия)
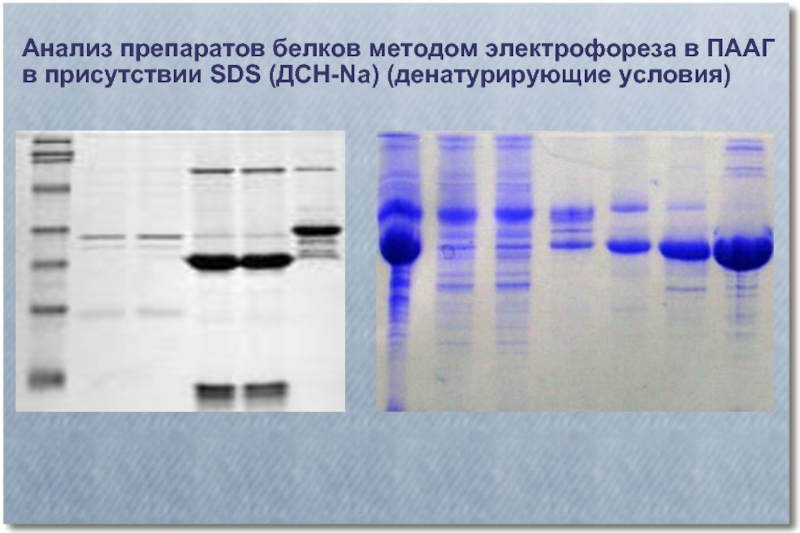
Слайд 42Анализ препаратов белков методом электрофореза в ПААГ
в присутствии SDS (ДСН-Na)
(денатурирующие условия)
Слайд 43Ионогенные группы в составе аминокислот
рК – характеризует способность групп отдавать ион
водорода (Н+)
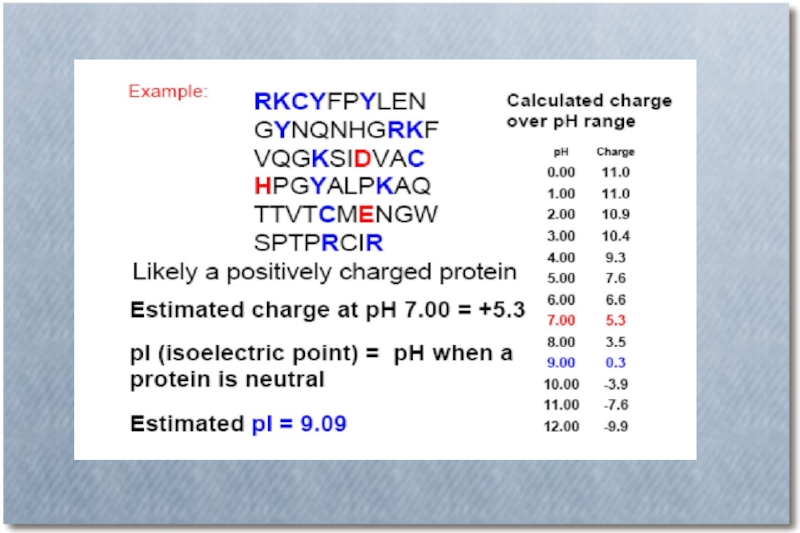
Слайд 44Изоэлектрическая точка – значение рН, при котором суммарный заряд молекулы равен
нулю
В буферном растворе со значением рН = рI изучаемого белка, невозможно движение белковой молекулы в приложенном электрическом поле.
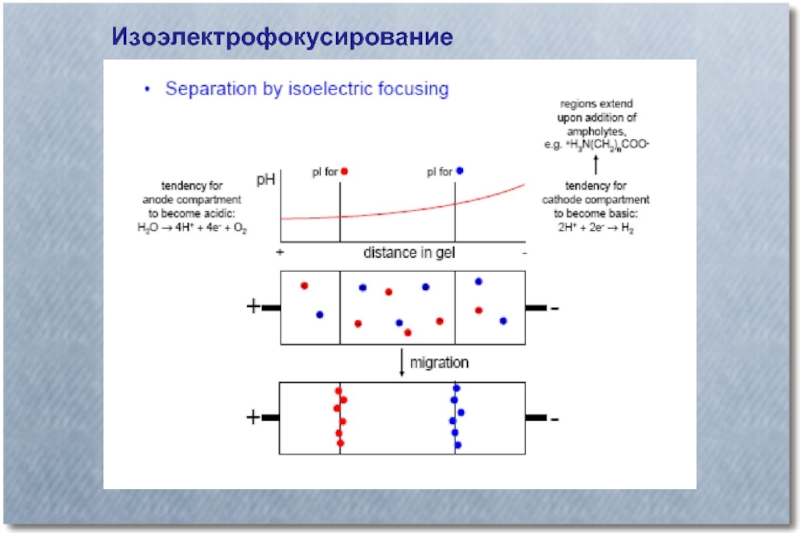
Слайд 46Изоэлектрофокусирование
При изоэлектрическом фокусировании в среде для электрофореза создается плавный градиент рН.
Белок останавливается в зоне, где значение рН равно его изоэлектрической точке (pI). Для создания градиента рН обычно используют амфолиты - раствор полиамино-поликарбоновых кислот, которыми насыщают носитель. В отсутствии электрического поля эта смесь обычно имеет значение рН равное 6.5. При наложении электрического поля указанные кислоты обеспечивают линейный градиент рН от 3 до 10.
Слайд 48Изотахофорез
В случае изотахофореза заряженные ионы сначала разделяются в соответствии с величинами
их заряда и подвижности, а затем перемещаются в электрическом поле с одинаковыми и постоянными скоростями.