- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биосинтез белка презентация
Содержание
- 1. Биосинтез белка
- 2. Создана молекулярная машина для сборки пептидов
- 4. Интересно, что Синтез одной молекулы белка длится
- 5. Белки – конечный продукт большинства информационных
- 6. Синтез тысяч различных белков в клетке
- 7. Генетический код Синтез белка отличается от других
- 8. Генетический код Генетический код — это способ
- 9. ГЕОРГИЙ АНТОНОВИЧ ГАМОВ В 1954 году опубликовал
- 10. Роберт Уильям Холли (США) Хар Гобинд
- 11. ГЕНЕТИЧЕСКИЙ КОД 1 2 3
- 12. Трансляция- процесс синтеза белка из аминокислот
- 13. Клетка E. coli имеет 15 000
- 14. Между ними образуется щель, через которую
- 15. Бактериальные тРНК содержат от 73 до
- 16. для выполнения адаптерной функции тРНК имеет:
- 17. Плечо D, содержит дигидроуридин, взаимодействие при
- 19. Этапы трансляции Активация аминокислот Инициация Элонгация Терминация и высвобождение Укладка и посттрансляционный процессинг
- 20. Активация аминокислот Mg+2 зависимые аминоацил-тРНК-синтетазы (АРС-аза или
- 22. Активация аминокислот
- 23. Аминоацилирование тРНК приводит к двум результатам:
- 24. Взаимодействие между аминоацил-тРНК –синтетазами и тРНК называют «вторым генетическим кодом».
- 25. Синтез белка начинается с N-конца и
- 26. Для метионина существует один кодон -
- 27. Поэтому у бактерий есть два типа
- 28. Инициаторная ак у бактерий – формилметионин. Инициаторная ак у эукариот – метионин.
- 29. Активация аминокислот
- 30. Для инициации синтеза полипептида у бактерий
- 31. Инициация Инициирующие комплексы: 30S рибосома соединяется с
- 32. Инициаторный кодон 5ꞌAUG попадает в правильную
- 33. Эта последовательность комплементарно связывается с пиримидин-обогащенной
- 34. Бактериальные рибосомы имеют три сайта связывания аминоацил-тРНК: Аминоацильный (А) Пептидильный (Р) Сайт выхода (Е)
- 35. Сайты А и Р образованы обеими
- 36. К комплексу: 30S субъединица рибосомы, IF-3,
- 37. Далее этот крупный комплекс объединяется с
- 38. Инициация В результате образуется функционально-активная 70S- рибосома, называемая инициаторным комплексом.
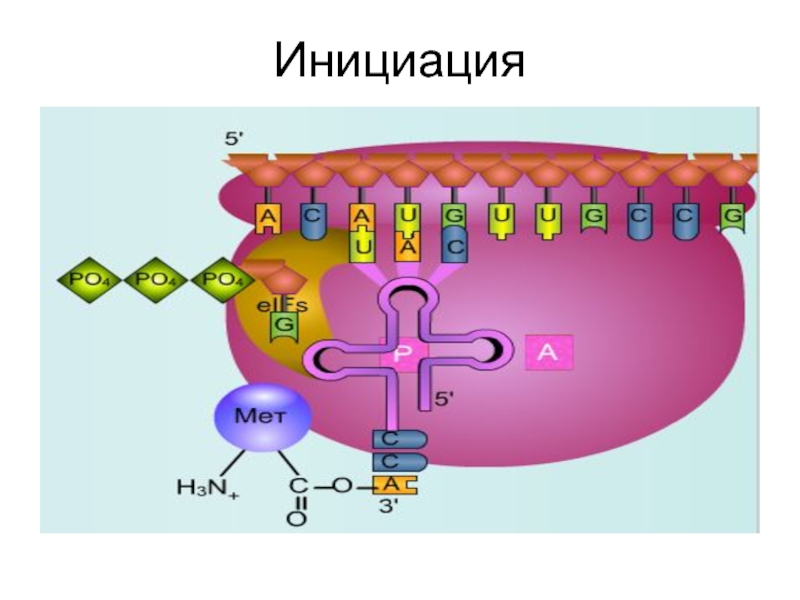
- 39. Инициация
- 40. Инициация
- 41. элонгация Необходимо: Инициаторный комплекс Аминоацил-тРНК Три растворимых
- 42. В клетке присоединение каждой ак происходит
- 43. На первой стадии элонгации соответствующая аминоацил-тРНК
- 44. ГТФ гидролизуется, комплекс EF-Tu – ГДФ
- 45. Формирование пептидных связей: Пептидная связь формируется
- 46. α-аминогруппа ак в сайте А выступает
- 47. Транслокация – рибосома передвигается на один
- 48. Деацилированная тРНК смещается из Р сайта
- 50. После транслокации дипептидил-тРНК готова к следующему
- 51. Терминация и высвобождение О терминации сигнализирует один
- 52. Стоп-кодон в А сайте рибосомы, подключаются
- 53. RF-3 участвует в высвобождении субъединицы рибосомы.
- 54. Гидролиз ГТФ под действием EG- G
- 56. Из бактериальных и эукариотических клеток можно
- 58. У бактерий процессы транскрипции и трансляции
- 59. Укладка и посттрансляционный процессинг Образованная полипептидная цепь
- 60. Модификации N-конца и C-конца. В
- 61. N-концевая последовательность – для доставки белка
- 62. Модификации некоторых аминокислот: Гидроксильные группы сер,
- 63. Образование дисульфидных мостиков между остатками цистеина.
- 64. К остаткам глу присоединяются карбоксигруппы. При
- 65. Частичный протеолиз – удаление части пептидной
- 66. Присоединение простетических групп: Гем – при
- 67. Присоединение углеводных остатков к остаткам асн
- 68. Трансформирующая активность онкогена ras исчезает при дефекте изопренилирования белка Ras. Применяется в противоопухолевой терапии.
- 69. Лекарственная регуляция синтеза белка Инактивация факторов
- 70. Лекарственная регуляция Нарушение элонгации: тетрациклины блокируют
- 71. Фолдинг белков Фолдинг – это процесс сворачивания
- 72. Фолдинг белков При нарушении функции шаперонов и
- 73. Регуляция синтеза белка Синтез белка регулируется внешними
- 74. Концентрация белка в клетке определяется сложным
- 75. Транскрипция –первая стадия в сложном и
- 76. Гены тех продуктов, которые необходимы клетке
- 77. Инициацию транскрипции РНК-полимеразой регулируют три типа
- 78. Репрессоры блокируют присоединение РНК-полимеразы к промотору. Активаторы усиливают взаимодействие РНК – полимеразы с промотором.
- 79. Белки-репрессоры связываются с определенными участками ДНК
- 80. Регуляция с участием репрессора, подавляющего транскрипцию,
- 81. Эффектор – это небольшая молекула или
- 82. Положительная регуляция - активаторы связываются с
- 83. Многие бактериальные мРНК полицистронные – содержат
- 84. Кластер генов и промотор, регуляторные последовательности
- 85. Регуляция синтеза белка Принципы экспрессии бактериальных генов
- 86. Регуляция синтеза белка Лактозный оперон (lac) содержит
- 87. Ген галактозидпермеазы (Y)–переносит лактозу внутрь клетки.
- 88. В отсутствии лактозы транскрипция lac-оперона подавлена
- 89. Когда в клетке появляется лактоза происходит
- 90. Регуляция синтеза белка Это типичный пример отрицательной
- 92. В присутствии глюкозы экспрессия генов, необходимых
- 93. В отсутствии глюкозы комплекс СRР-сАМР связывается
- 94. Lac- репрессор – отрицательный регуляторный элемент, реагирующий на лактозу. Оба элемента действуют согласованно.
- 95. Когда Lac- репрессор блокирует транскрипцию, комплекс
- 96. В отсутствии комплекса СRР-сАМР открытый комплекс
- 97. Действие глюкозы на СRР опосредовано сАМР.
- 98. По мере снижения концентрации сАМР (при
- 99. Для сильной индукции lac- оперона необходимо
- 101. Так как большинство генов прокариот находятся
- 102. Молекулярные болезни Серповидно-клеточная анемия Замена в 6-ом
- 103. Серповидно-клеточная анемия
- 104. Молекулярные болезни Талассемии – нарушения синтеза цепей Нв. Нарушен процессинг РНК.
- 105. Спасибо за внимание
Слайд 2Создана молекулярная машина для сборки пептидов
Исследователи из Манчестера и Эдинбурга
Слайд 4Интересно, что
Синтез одной молекулы белка длится 3-4 минуты.
За одну минуту образуется
Половина белков нашего тела
обновляется за 80 дней.
За свою жизнь человек обновляет все свои белки около 200 раз.
Слайд 5
Белки – конечный продукт большинства информационных метаболических путей.
На синтез белка может
Полипептид из 100 амк остатков синтезируется в клетке E. coli при 37º С ~5 секунд.
Слайд 6
Синтез тысяч различных белков в клетке регулируется таким образом, что их
Слайд 7Генетический код
Синтез белка отличается от других матричных биосинтезов тем, что между
Слайд 8Генетический код
Генетический код — это способ записи информации об аминокислотной последовательности
Слайд 9ГЕОРГИЙ АНТОНОВИЧ ГАМОВ
В 1954 году опубликовал статью,
где первым поднял вопрос
доказывая, что "при сочетании
4 нуклеотидов тройками
получаются 64 различные
комбинации, чего вполне
достаточно для "записи наследственной
информации"
Слайд 10Роберт Уильям Холли (США)
Хар Гобинд
Корана (США)
Маршалл Уоррен Ниренберг
За расшифровку генетического кода и его функции в синтезе белков.
Слайд 11
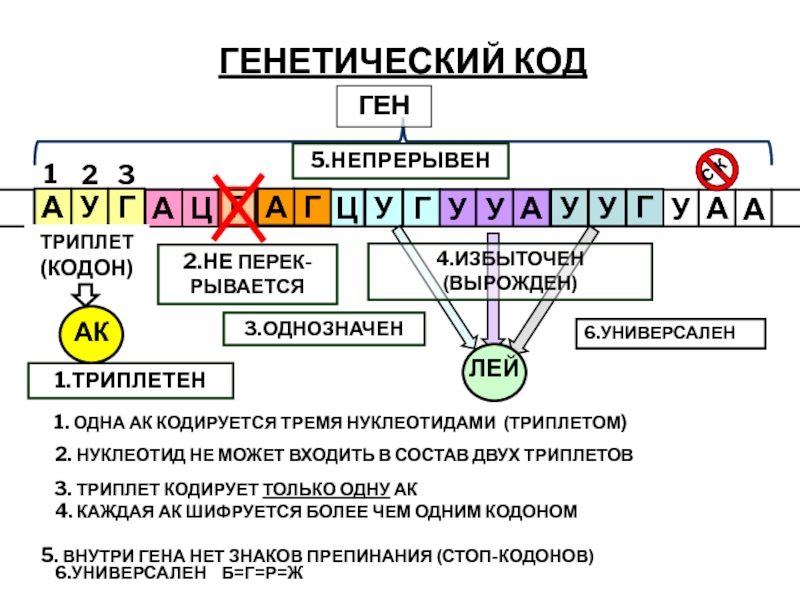
ГЕНЕТИЧЕСКИЙ КОД
1
2
3
ТРИПЛЕТ (КОДОН)
1.ТРИПЛЕТЕН
2.НЕ ПЕРЕК-РЫВАЕТСЯ
АК
ЛЕЙ
3.ОДНОЗНАЧЕН
ГЕН
5.НЕПРЕРЫВЕН
6.УНИВЕРСАЛЕН Б=Г=Р=Ж
1. ОДНА АК КОДИРУЕТСЯ ТРЕМЯ НУКЛЕОТИДАМИ
2. НУКЛЕОТИД НЕ МОЖЕТ ВХОДИТЬ В СОСТАВ ДВУХ ТРИПЛЕТОВ
3. ТРИПЛЕТ КОДИРУЕТ ТОЛЬКО ОДНУ АК
4. КАЖДАЯ АК ШИФРУЕТСЯ БОЛЕЕ ЧЕМ ОДНИМ КОДОНОМ
5. ВНУТРИ ГЕНА НЕТ ЗНАКОВ ПРЕПИНАНИЯ (СТОП-КОДОНОВ)
6.УНИВЕРСАЛЕН
c к
4.ИЗБЫТОЧЕН (ВЫРОЖДЕН)
Слайд 12
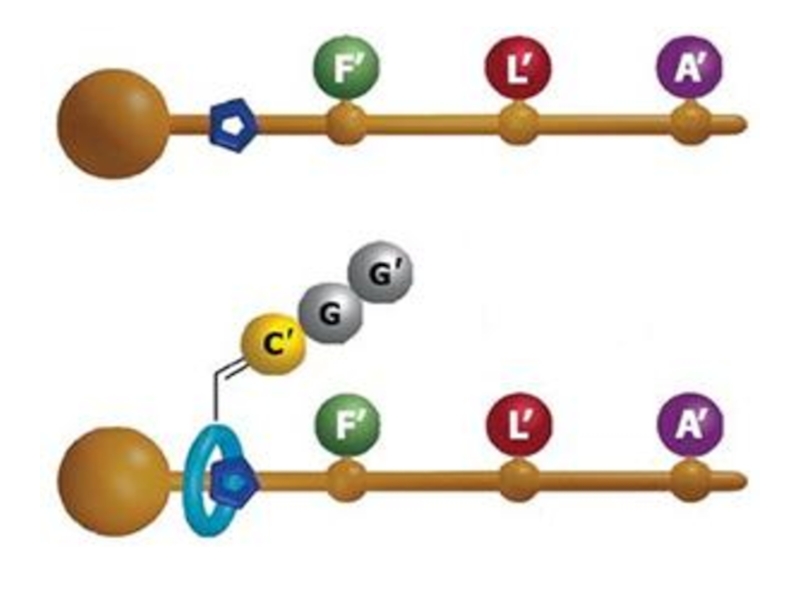
Трансляция- процесс синтеза белка из аминокислот на матрице РНК, осуществляемый рибосомальным
Слайд 13
Клетка E. coli имеет 15 000 и более рибосом, состоящие из
Рибосомы состоят из двух неравных субъединиц: 30S и 50S, содержат очень большие молекулы РНК.
50S состоит из 5S- и 23S-рРНК + 36 белков.
30S состоит из 16S-рРНК + 21 белок.
белки вторичны, покрывают поверхность РНК.
Слайд 14
Между ними образуется щель, через которую при трансляции проходит молекула РНК.
Образование
Слайд 15
Бактериальные тРНК содержат от 73 до 93 ак.
Каждой амк своя тРНК.
Для
Слайд 16
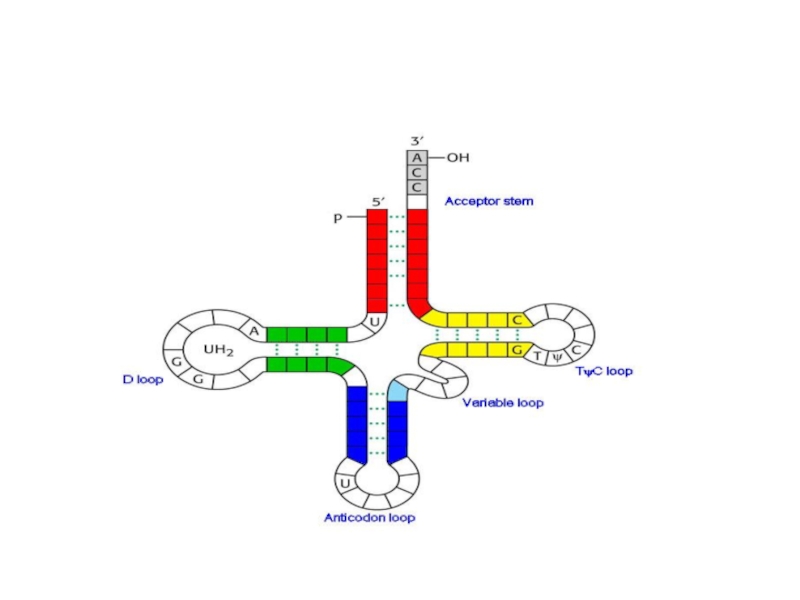
для выполнения адаптерной функции тРНК имеет:
аминокислотное плечо на 3‘конце тРНК.
Антикодоновое плечо
Кодон-триплет нуклеотидов, кодирующих определенную ак.
Слайд 17
Плечо D, содержит дигидроуридин, взаимодействие при укладке молекул тРНК.
плечо ТΨС, содержащего
Слайд 19Этапы трансляции
Активация аминокислот
Инициация
Элонгация
Терминация и высвобождение
Укладка и посттрансляционный процессинг
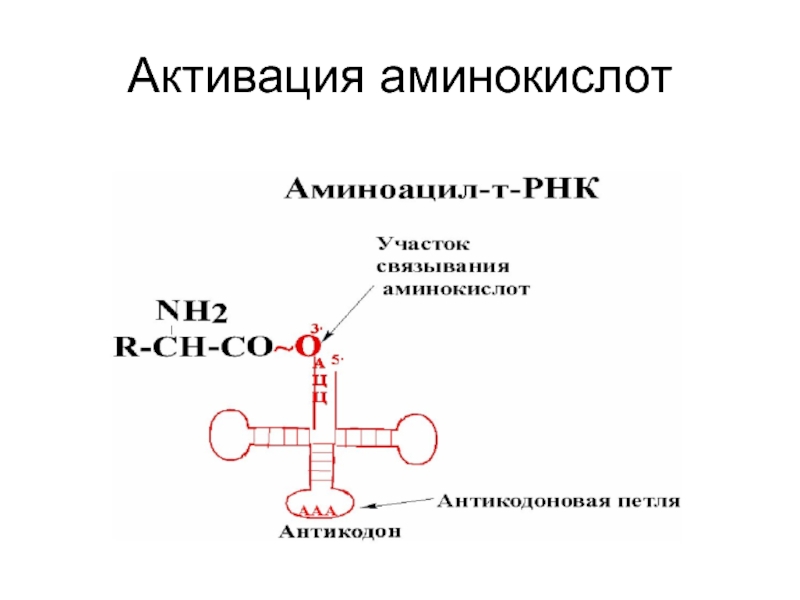
Слайд 20Активация аминокислот
Mg+2 зависимые аминоацил-тРНК-синтетазы (АРС-аза или кодаза)
α-Карбоксил ак атакует
Аминоацильная группа переносится на тРНК.
Слайд 23
Аминоацилирование тРНК приводит к двум результатам:
Активация ак для формирования пептидной связи.
Ак
Слайд 24
Взаимодействие между аминоацил-тРНК –синтетазами и тРНК называют «вторым генетическим кодом».
Слайд 25
Синтез белка начинается с N-конца и происходит путем последовательного присоединения ак
Инициаторный кодон AUG соответствует N –концевому остатку метионина.
Слайд 26
Для метионина существует один кодон - 5ꞌAUG, все организмы имеют для
Одна тРНК только для инициаторного кодона, другая – для встраивания остатка метионина во внутреннее положение полипептидной цепи.
Слайд 30
Для инициации синтеза полипептида у бактерий требуется 30S и 50S –рибосомальные
мРНК
Инициаторная fMet - тРНКfMet
ГТФ, ионы Mg+2
Три белковых фактора инициации:
IF-1,IF-2, IF-3
Слайд 31Инициация
Инициирующие комплексы:
30S рибосома соединяется с IF-1, IF-3.
IF-3 предупреждает преждевременное соединение субъединиц
С 30S -субъединицей связывается мРНК.
Слайд 32
Инициаторный кодон 5ꞌAUG попадает в правильную позицию благодаря последовательности Шайна-Дальгарно в
Эта консенсусная последовательность из 4-9 пуриновых оснований расположена на расстоянии 8-13 п.н. в сторону 5ꞌ-конца от инициаторного кодона.
Слайд 33
Эта последовательность комплементарно связывается с пиримидин-обогащенной последовательностью, находящейся вблизи 3ꞌконца 16S
Слайд 34
Бактериальные рибосомы имеют три сайта связывания аминоацил-тРНК:
Аминоацильный (А)
Пептидильный (Р)
Сайт выхода (Е)
Слайд 35
Сайты А и Р образованы обеими субъединицами рибосомы 30S и 50S,
Инициаторный 5ꞌ-кодон располагается в пептидильном сайте – здесь связывается fMet - тРНКfMet
Слайд 36
К комплексу: 30S субъединица рибосомы, IF-3, IF-1присоединяется ГТФ и инициаторная fMet
Антикодон этой тРНК связывается с инициаторным кодоном мРНК.
Слайд 37
Далее этот крупный комплекс объединяется с 50S субъединицей рибосомы.
В это же
В этот момент все три фактора инициации отделяются от рибосомального комплекса.
Слайд 38Инициация
В результате образуется функционально-активная 70S- рибосома, называемая инициаторным комплексом.
Слайд 41элонгация
Необходимо:
Инициаторный комплекс
Аминоацил-тРНК
Три растворимых цитоплазматических фактора – факторы элонгации (EF-Tu, EF-Ts, EF-G)
ГТФ
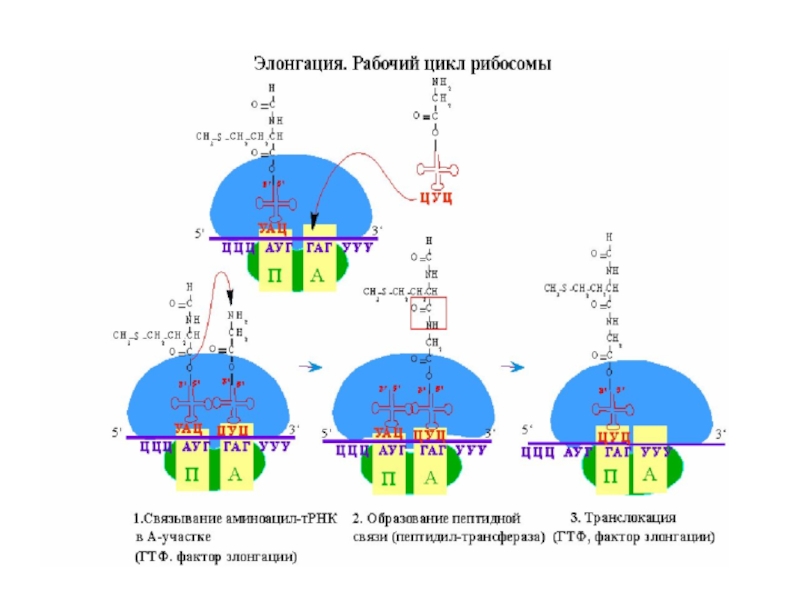
Слайд 42
В клетке присоединение каждой ак происходит в три стадии и эти
Элонгация начинается с присоединения второй аминоацил-тРНК.
Слайд 43
На первой стадии элонгации соответствующая аминоацил-тРНК взаимодействует с фактором EF-Tu, связанным
Комплекс аминоацил-тРНК - EF-Tu – ГТФ связывается на сайте А 70S инициаторного комплекса.
Слайд 44
ГТФ гидролизуется, комплекс EF-Tu – ГДФ высвобождается из 70S рибосомы.
Далее при
Слайд 45
Формирование пептидных связей:
Пептидная связь формируется между двумя ак, связанными через соответствующие
Инициаторная N-формилметионильная группа переносится от своей тРНК на аминогруппу второй аминокислоты, находящейся в сайте А.
Слайд 46
α-аминогруппа ак в сайте А выступает в роли нуклеофила, вытесняя тРНК
Катализирует реакцию 23S рРНК –пептидилтрансфераза.
В сайте А образуется дипептидил –тРНК , а разгруженная тРНКfMet остается связанной с Р сайтом.
Слайд 47
Транслокация – рибосома передвигается на один кодон по направлению к 3ꞌ
Слайд 48
Деацилированная тРНК смещается из Р сайта в Е сайт и высвобождается
Для транслокации рибосомы вдоль мРНК необходим фактор EF-G и энергия гидролиза ГТФ.
Теперь в А сайте расположен третий кодон мРНК, в Р сайте – второй кодон.
Слайд 50
После транслокации дипептидил-тРНК готова к следующему циклу элонгации и связыванию третьего
Таким образом, присоединение одного ак остатка сопровождается гидролизом двух молекул ГТФ до ГДФ и Фн.
Слайд 51Терминация и высвобождение
О терминации сигнализирует один из трех стоп-кодонов (UAA,UAG,UGA).
Мутации в
Слайд 52
Стоп-кодон в А сайте рибосомы, подключаются три фактора терминации (высвобождения) –
RF-1 распознает стоп-кодоны UAA,UAG.
RF-2 распознает стоп-кодоны UGA, UAA.
Под действием пептидилтрансферазы растущий полипептид связывается с Н2О.
Слайд 53
RF-3 участвует в высвобождении субъединицы рибосомы.
Высвобождение и распад рибосом на субъединицы
Факторы терминации заменяются на фактор EG-G и фактор рециклизации рибосом (RRF).
Слайд 54
Гидролиз ГТФ под действием EG- G приводит к уходу 50S-субъединицы из
ФакторыEG-G, RRF заменяются на IF-3, который способствует высвобождению тРНК, затем отделяется мРНК.
Затем комплекс 30S субъединица- IF-3 готов инициировать новый раунд синтеза белка.
Слайд 56
Из бактериальных и эукариотических клеток можно выделить крупные кластеры из 10-100
Высокая эффективность процесса.
Слайд 58
У бактерий процессы транскрипции и трансляции тесно связаны между собой.
Рибосомы начинают
Слайд 59Укладка и посттрансляционный процессинг
Образованная полипептидная цепь сворачивается в биологически активную форму.
То
Но до этого подвергается посттрансляционным модификациям.
У эукариот в ЭР, аппарат Гольджи.
Слайд 60
Модификации N-конца и C-конца.
В процессе образования функционального белка формильная группа
У эукариот аминогруппа N-конца подвергается ацилированию.
Слайд 61
N-концевая последовательность – для доставки белка к месту его назначения в
Удаление сигнальной последовательности специфическими пептидазами.
Слайд 62
Модификации некоторых аминокислот:
Гидроксильные группы сер, тре, тир – фосфорилируются под действием
Используется при регуляции активности ферментов, регуляторных белков или для связывания ионов Са2+
Слайд 63
Образование дисульфидных мостиков между остатками цистеина.
Дисульфидные мостики защищают нативную конформацию белка
Метилирование аргинина и лизина в составе гистонов используется для регуляции активности генома
Слайд 64
К остаткам глу присоединяются карбоксигруппы.
При участии витамина К происходит γ‑карбоксилирование глутамата
Позволяет связывать ионы кальция при инициации свертывания крови.
Слайд 65
Частичный протеолиз – удаление части пептидной цепи протеолитическими ферментами
Инсулином из проинсулина
Трипсин
Слайд 66
Присоединение простетических групп:
Гем – при синтезе гемоглобина, миоглобина, цитохромов, каталазы
Витаминных коферментов
Слайд 67
Присоединение углеводных остатков к остаткам асн или сер, тре – гликирование
Присоединение изопренильных групп к остатку цис. Помогает заякоривать белок на мембране.
Ras-белки –продукты онкогенов и протонкогенов ras.
Слайд 68
Трансформирующая активность онкогена ras исчезает при дефекте изопренилирования белка Ras.
Применяется в
Слайд 69Лекарственная регуляция синтеза белка
Инактивация факторов инициации:
интерферон активирует внутриклеточные протеинкиназы, которые,
Нарушение кодон-антикодонового взаимодействия:
стрептомицин присоединяется к малой субъединице и вызывает ошибку считывания первого основания кодона.
Слайд 70Лекарственная регуляция
Нарушение элонгации:
тетрациклины блокируют А‑сайт рибосомы и лишают ее способности
Хлорамфеникол ингибирует пептидилтрансферазу у бактерий; на уэкариот не влияет.
Циклогексимид ингибирует пептидилтрансферазу эукариотических рибосом.
Слайд 71Фолдинг белков
Фолдинг – это процесс сворачивания полипептидной цепи в правильную пространственную
Слайд 72Фолдинг белков
При нарушении функции шаперонов и отсутствии фолдинга в клетке формируются
Слайд 73Регуляция синтеза белка
Синтез белка регулируется внешними и внутренними факторами, которые диктуют
Слайд 74
Концентрация белка в клетке определяется сложным равновесием семи процессов:
Транскрипция
Посттранскрипционная модификация мРНК
Расщепление
Трансляция
Посттрансляционная модификация белка
Компартментализация и транспорт белка
Расщепление белка
Слайд 75
Транскрипция –первая стадия в сложном и энергозатратном процессе синтеза белка, поэтому
Слайд 76
Гены тех продуктов, которые необходимы клетке постоянно (ферменты основных метаболических путей)
Регулируемая экспрессия гена – концентрация продуктов этих генов изменяется в ответ на молекулярные сигналы.
Слайд 77
Инициацию транскрипции РНК-полимеразой регулируют три типа белков:
Факторы специфичности изменяют специфичность РНК-полимеразы
Слайд 78
Репрессоры блокируют присоединение РНК-полимеразы к промотору.
Активаторы усиливают взаимодействие РНК – полимеразы
Слайд 79
Белки-репрессоры связываются с определенными участками ДНК – операторами.
Оператор часто находится
Репрессор блокирует связывание РНК-полимеразы или ее продвижение вдоль РНК.
Слайд 80
Регуляция с участием репрессора, подавляющего транскрипцию, называется отрицательной регуляцией.
Связывание репрессора с
Слайд 81
Эффектор – это небольшая молекула или белок, который присоединяется к репрессору
Взаимодействие репрессора с эффектором либо усиливает, либо ослабляет транскрипцию.
Слайд 82
Положительная регуляция - активаторы связываются с ДНК и увеличивают активность РНК-полимеразы
Участки связывания активатора часто примыкают к тем промоторам, с которыми сама (без активаторов) РНК-полимераза не связывается совсем, либо очень слабо.
Слайд 83
Многие бактериальные мРНК полицистронные – содержат в одном транскрипте несколько генов,
Слайд 84
Кластер генов и промотор, регуляторные последовательности называются опероном.
Оперон может содержать от
Слайд 85Регуляция синтеза белка
Принципы экспрессии бактериальных генов впервые были выявлены при изучении
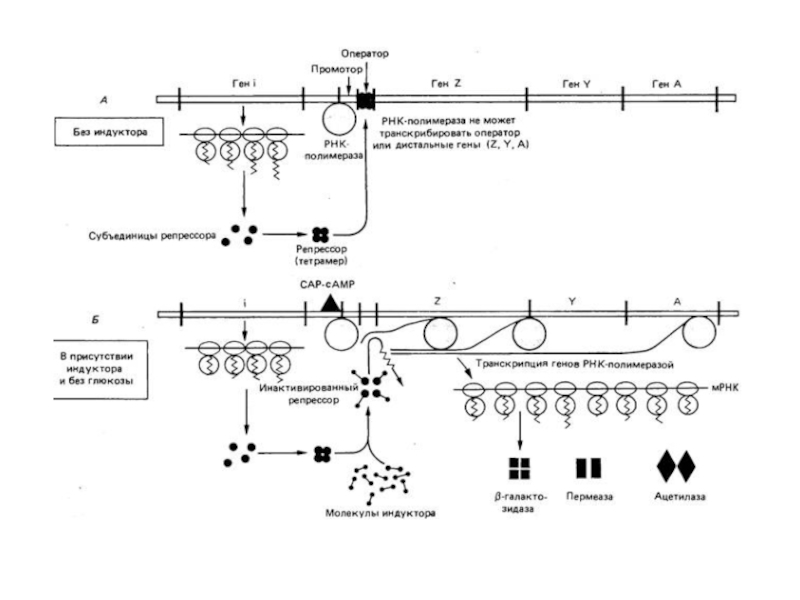
В 1960 г. французские ученые Ф. Жакоб и Ж. Моно лауреаты Нобелевской премии опубликовали статью, где описали регуляцию экспрессии генов, участвующих в метаболизме лактозы у E.coli.
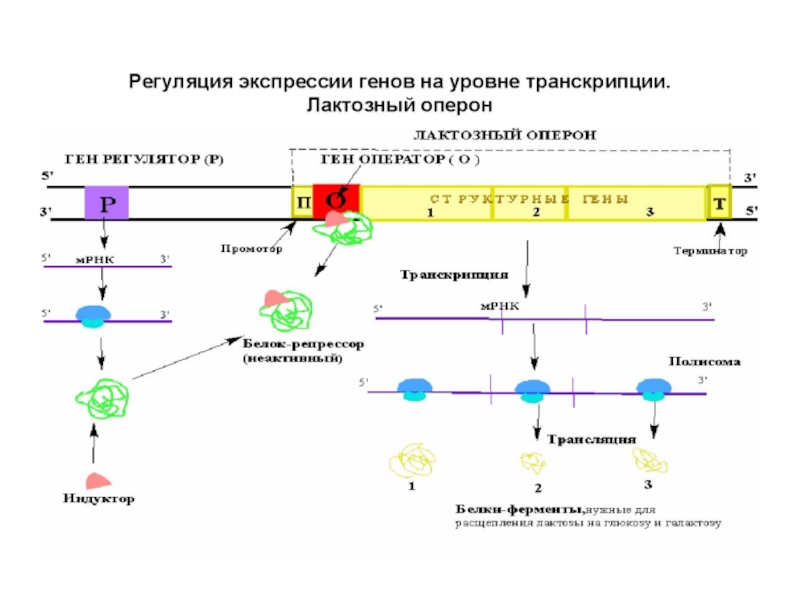
Слайд 86Регуляция синтеза белка
Лактозный оперон (lac) содержит структурные гены, определяющие первичную структуру
Ген β-галактозидазы (Z)- расщепляет лактозу на галактозу и глюкозу.
Слайд 87
Ген галактозидпермеазы (Y)–переносит лактозу внутрь клетки.
Ген тиогалактозидтрансацетилазы (A) – модифицирует
Каждому из этих трех генов предшествует участок связывания рибосомы, который направляет трансляцию этого гена независимо от остальных.
Слайд 88
В отсутствии лактозы транскрипция lac-оперона подавлена путем связывания Lac-репрессора.
Lac-репрессор –
Lac-репрессор транскрибируется со своего собственного промотора.
Слайд 89
Когда в клетке появляется лактоза происходит индукция lac-оперона.
Молекула индуктора связывается с
Это приводит к отделению репрессора от оператора.
Транскрипция генов lac-оперона.
Слайд 90Регуляция синтеза белка
Это типичный пример отрицательной формы регуляции, когда белок-репрессор связывается
Слайд 92
В присутствии глюкозы экспрессия генов, необходимых для катаболизма лактозы, арабинозы ограничивает
Влияние глюкозы опосредует сАМР, выступающий как коактиватор.
сАМР-рецепторный белок (СRР) содержит участки связывания ДНК и сАМР.
Слайд 93
В отсутствии глюкозы комплекс СRР-сАМР связывается с ДНК вблизи lac-промотора и
Комплекс СRР-сАМР - положительный регуляторный элемент, реагирующий на концентрацию глюкозы.
Слайд 94
Lac- репрессор – отрицательный регуляторный элемент, реагирующий на лактозу.
Оба элемента
Слайд 95
Когда Lac- репрессор блокирует транскрипцию, комплекс СRР-сАМР оказывает незначительное влияние на
Комплекс СRР-сАМР значительно облегчает транскрипцию Lac-оперона при диссоциации репрессора от Lac-оператора.
Слайд 96
В отсутствии комплекса СRР-сАМР открытый комплекс РНК-полимеразы и промотора образуется с
Белок СRР взаимодействует непосредственно с α – субъединицей РНК-полимеразы.
Слайд 97
Действие глюкозы на СRР опосредовано сАМР.
Наиболее активно СRР связывается с ДНК
При высокой концентрации глюкозы синтез сАМР подавляется и стимулируется выход его из клетки.
Слайд 98
По мере снижения концентрации сАМР (при высокой концентрации глюкозы) ослабевает связывание
Слайд 99
Для сильной индукции lac- оперона необходимо присутствие и лактозы (для инактивации
Слайд 101
Так как большинство генов прокариот находятся во «включенном» состоянии, то регуляторные
Для каждого набора генов имеется свой специфический репрессор.