- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биологические мембраны презентация
Содержание
- 1. Биологические мембраны
- 4. Биологические мембраны В покое мембраны являются электрически
- 5. Биологические мембраны Новые методологические подходы 1970-х г.г.
- 9. Биологические мембраны Мембрана нейронов состоит из различных
- 10. Фосфолипиды клеточной мембраны Основные компоненты бислоя мембраны
- 11. Фосфолипиды клеточной мембраны Фосфолипид фосфатидилхолин представляет собой
- 12. Фосфолипиды клеточной мембраны Полярная группа обращена во
- 13. Фосфолипиды клеточной мембраны Фосфолипид фосфатидилэтаноламин представляет собой
- 14. Фосфолипиды клеточной мембраны Фосфолипид фосфатидилсерин представляет собой
- 15. Фосфолипиды клеточной мембраны фосфатидилхолин
- 16. Фосфолипиды клеточной мембраны
- 17. Фосфолипиды клеточной мембраны (распределение в листках бислоя)
- 18. Фосфолипиды клеточной мембраны (распределение в листках бислоя) Легенда для фосфолипидов
- 19. Фосфолипиды в мембране выполняют три главные функции:
- 20. Электрические свойства мембраны Фосфолипидный бислой вместе с
- 21. каналы тока утечки
- 22. Фосфолипиды клеточной мембраны Крайне тонкий и текучий
- 23. Фосфолипиды клеточной мембраны Мембраны содержат много холестерола,
- 24. Фосфолипиды клеточной мембраны Мембраны содержат много холестерола,
- 26. Гликолипиды и ганглиозиды клеточной мембраны Гликолипиды
- 27. Белки клеточной мембраны Белки подразделяют в соответствии
- 28. Белки клеточной мембраны Интегральные белки типов I
- 29. Белки клеточной мембраны Белки III типа, включающие
- 30. Белки клеточной мембраны Гидрофобные участки интегральных белков
- 31. Белки клеточной мембраны Гидрофобные участки интегральных белков
- 32. Интегральные белки в мембране выполняют следующие функции
- 33. Белки клеточной мембраны Гликопротеины (V) вовлечены в
- 34. Периферические белки в мембране выполняют следующие функции:
- 35. Основные биологические процессы, происходящие с использованием ионных
- 36. 1839-1917
- 38. Bernstein J (1868) Über den zeitlichen Verlauf der negative Schwankung des Nervenstroms. Pflügers Arch 1:173–207
- 39. Julius Bernstein’s Rheotome: The pin p went
- 40. First recording of action potential from the
- 41. Потенциал покоя – это разность потенциалов между цитоплазмой клетки и окружающей средой.
- 42. Теория Ю. Бернштейна В конце
- 44. Потенциал покоя – это разность потенциалов между
- 45. Представления о возбуждении мышцы Теория Ю. Бернштейна
- 46. Гигантский аксон кальмара (A) Diagram of a
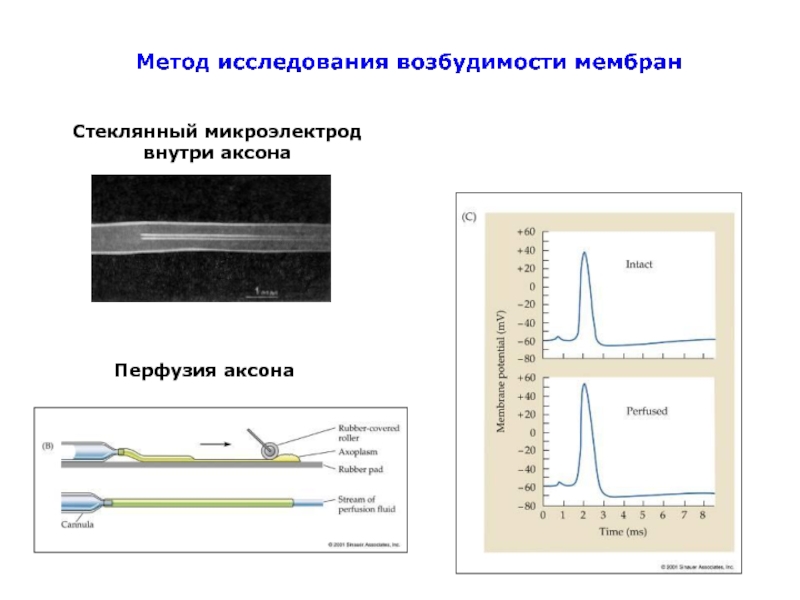
- 47. Стеклянный микроэлектрод внутри аксона Перфузия аксона
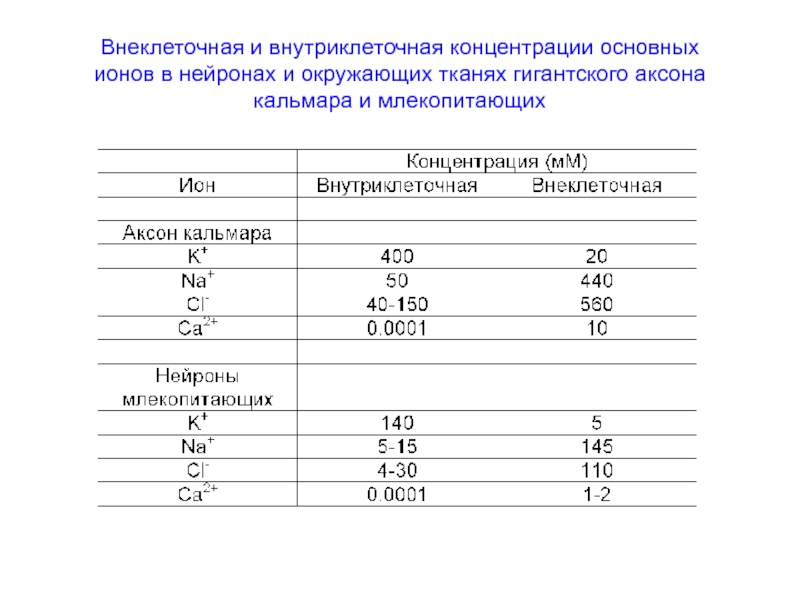
- 52. Внеклеточная и внутриклеточная концентрации основных ионов в
- 54. Распределение ионов по обе стороны мембраны
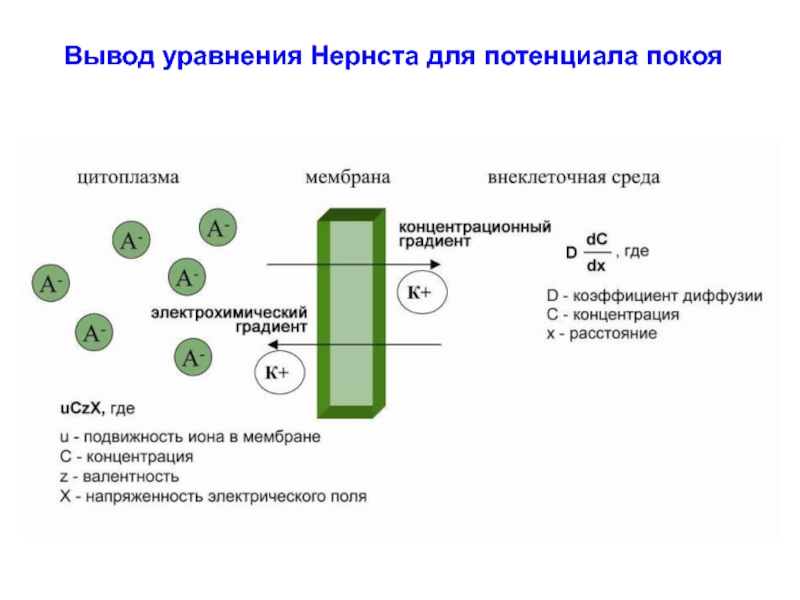
- 55. Вывод уравнения Нернста для потенциала покоя
- 58. Зависимость величины потенциала покоя от логарифма наружной
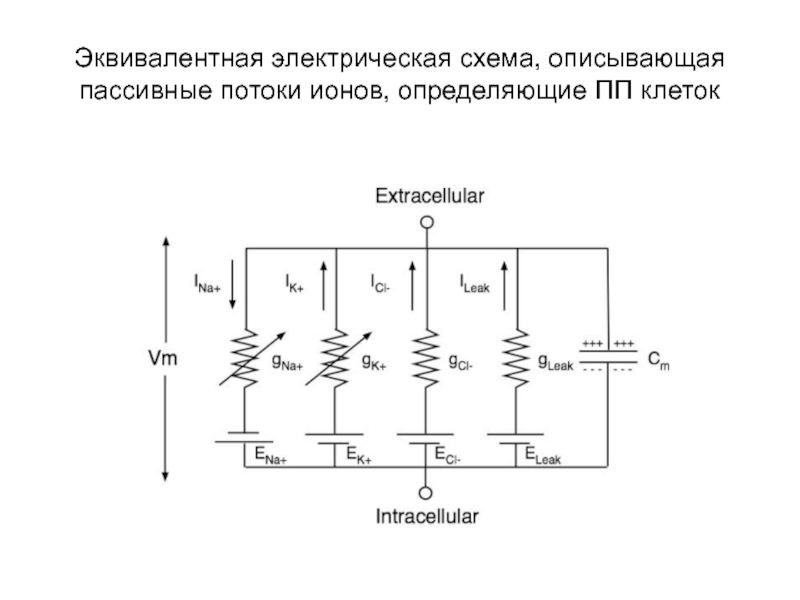
- 60. Эквивалентная электрическая схема, описывающая пассивные потоки ионов, определяющие ПП клеток
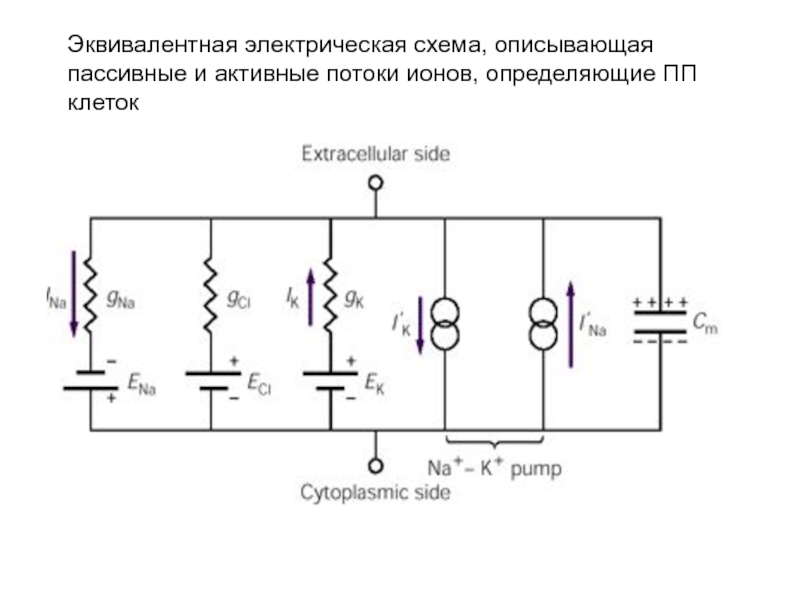
- 61. Эквивалентная электрическая схема, описывающая пассивные и активные потоки ионов, определяющие ПП клеток
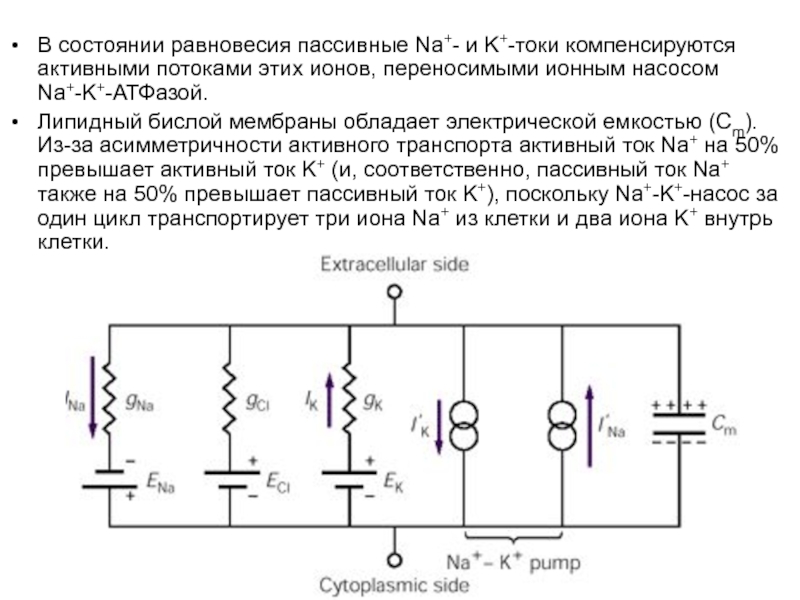
- 62. В состоянии равновесия пассивные Na+- и K+-токи
Слайд 1Биологические мембраны
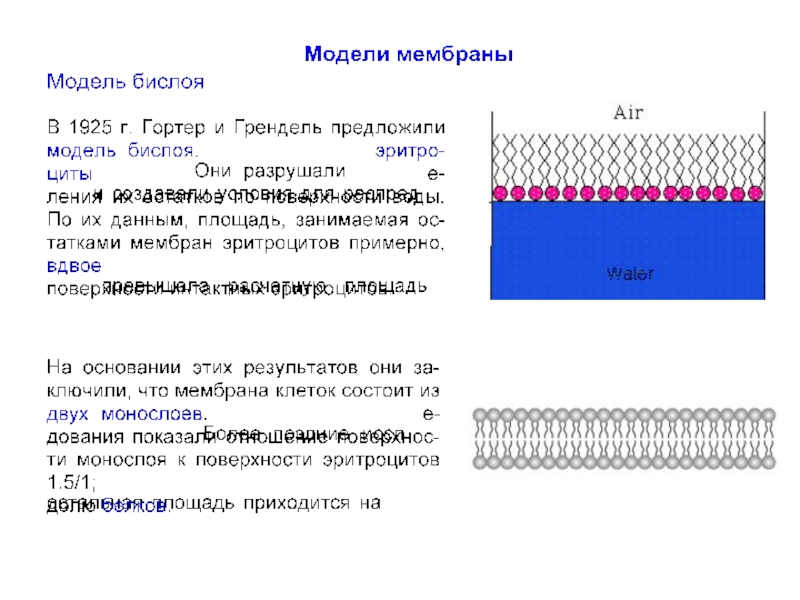
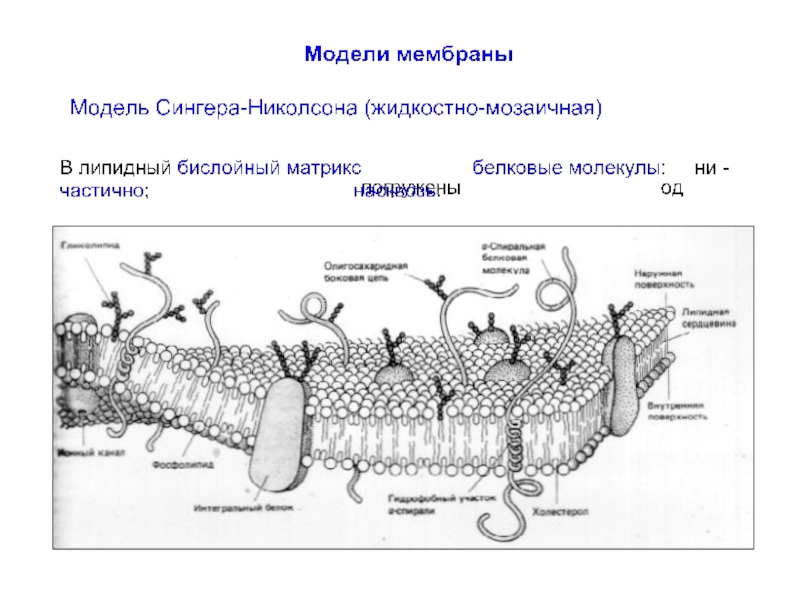
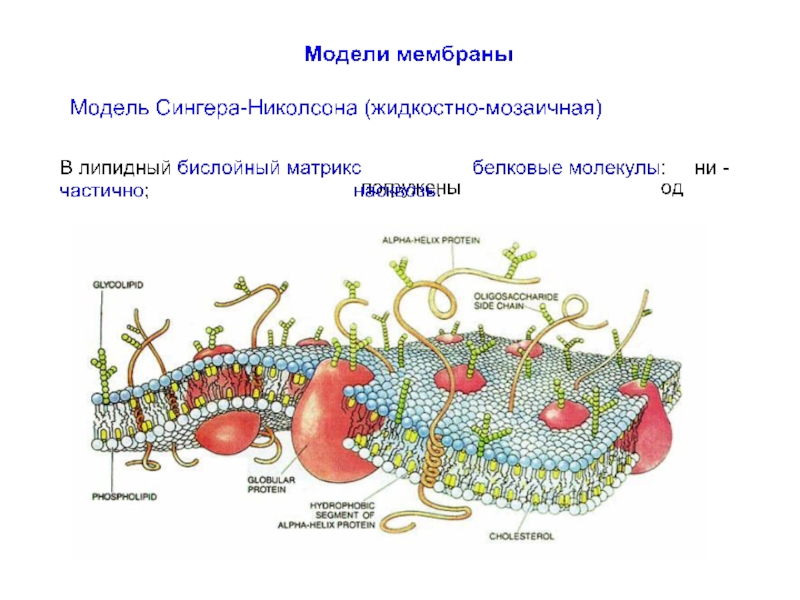
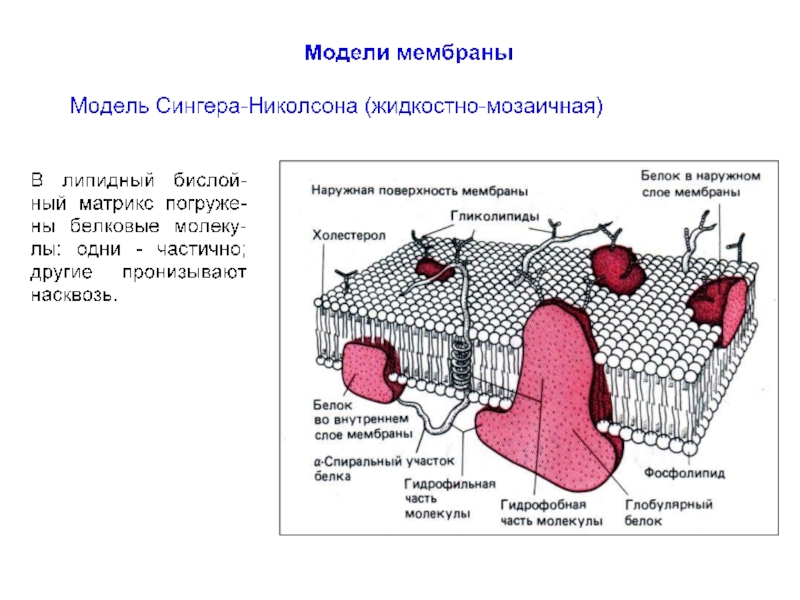
До середины XX в. мембрану рассматривали как относительно простое образование,
До 1960-х г.г. сведения о мембранах были сравнительно ограничены. Было известно, что мембраны несомненно очень тонкие (порядка 10 нм), состоят из липидного бислоя с интегрированными белковыми молекулами.
Слайд 4Биологические мембраны
В покое мембраны являются электрически заряженными (поляризованными). Они имеют в
Такие изменения заряда представляют собой различные потенциалы, обеспечивающие межклеточную коммуникацию.
Транспорт (ток) ионов контролируется различными мембранными электрическими сенсорами и линганд-активируемыми рецепторами.
Ионные токи вызывают генерацию нервных импульсов, градуальных потенциалов и иногда выделение медиаторов.
Мембраны также способствуют росту и развитию дендритов и аксонов, необходимых для локального и дистантного межклеточного взаимодействия.
Слайд 5Биологические мембраны
Новые методологические подходы 1970-х г.г.
благодаря разработке новых методов
рентгеноструктурного анализа,
электронной
кристаллографии,
компьютерного анализа и моделирования,
а также успехам в молекулярной биологии
привели к новому пониманию значения клеточных мембран и открытию неизвестных прежде присущих им механизмов синаптического контроля и нейропластичности.
Слайд 9Биологические мембраны
Мембрана нейронов состоит из различных типов фосфолипидов, белков и углеводов.
Молекулы,
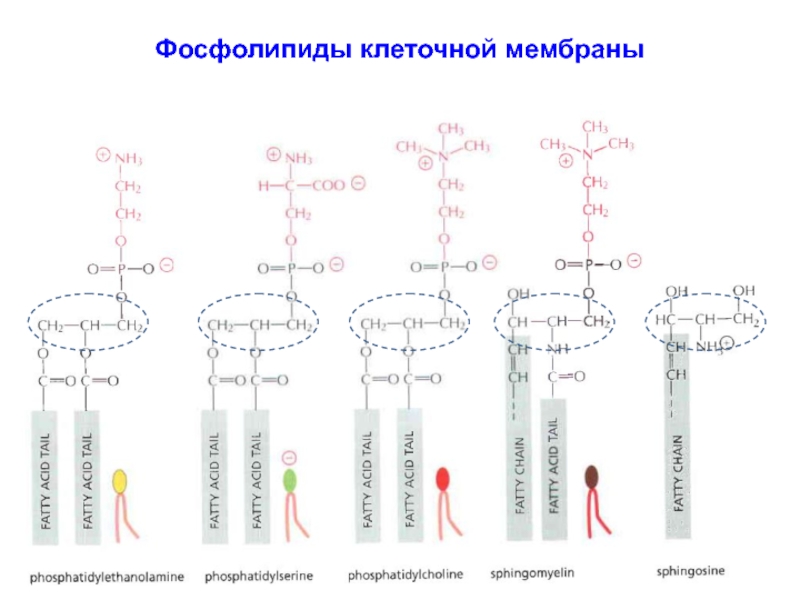
Слайд 10Фосфолипиды клеточной мембраны
Основные компоненты бислоя мембраны представляют:
фосфатидил-холин,
сфинго-миелин,
фосфатидил-этаноламин
и фосфатидил-серин.
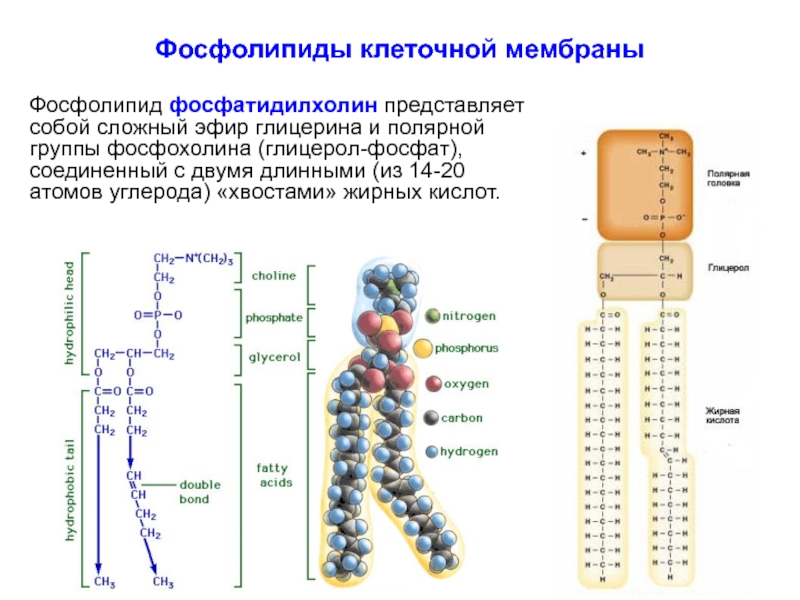
Слайд 11Фосфолипиды клеточной мембраны
Фосфолипид фосфатидилхолин представляет собой сложный эфир глицерина и полярной
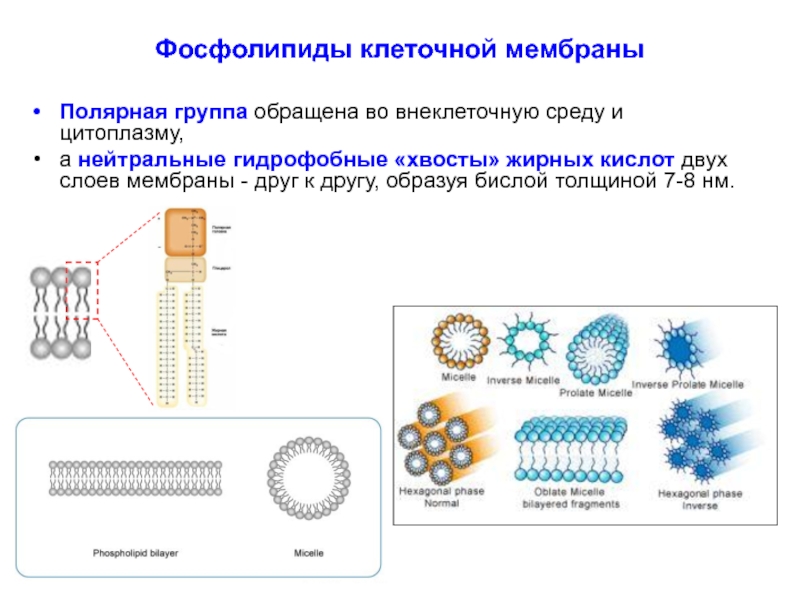
Слайд 12Фосфолипиды клеточной мембраны
Полярная группа обращена во внеклеточную среду и цитоплазму,
а нейтральные
Слайд 13Фосфолипиды клеточной мембраны
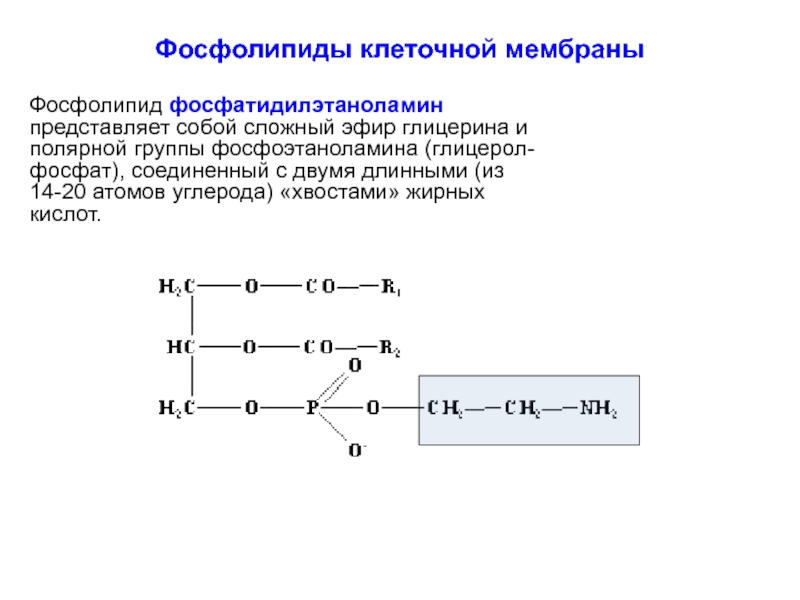
Фосфолипид фосфатидилэтаноламин представляет собой сложный эфир глицерина и полярной
Слайд 14Фосфолипиды клеточной мембраны
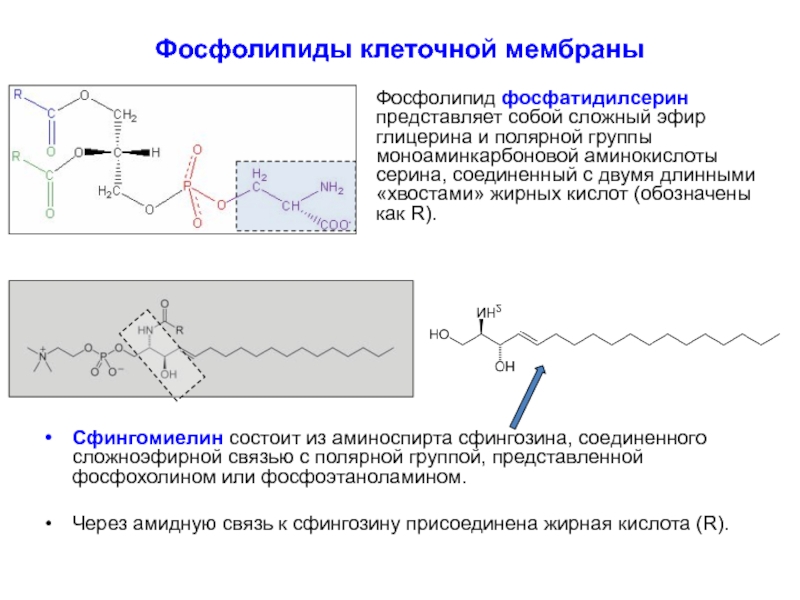
Фосфолипид фосфатидилсерин представляет собой сложный эфир глицерина и полярной
Сфингомиелин состоит из аминоспирта сфингозина, соединенного сложноэфирной связью с полярной группой, представленной фосфохолином или фосфоэтаноламином.
Через амидную связь к сфингозину присоединена жирная кислота (R).
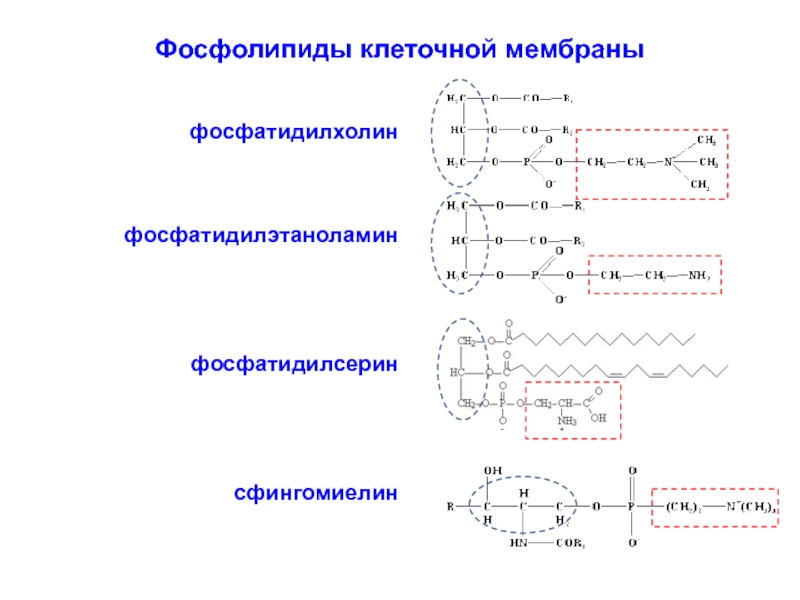
Слайд 15Фосфолипиды клеточной мембраны
фосфатидилхолин
фосфатидилэтаноламин
фосфатидилсерин
сфингомиелин
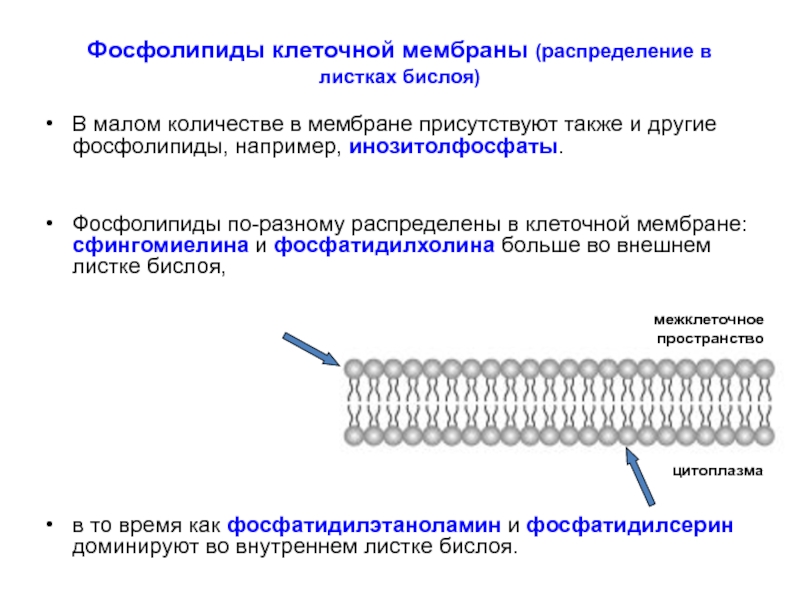
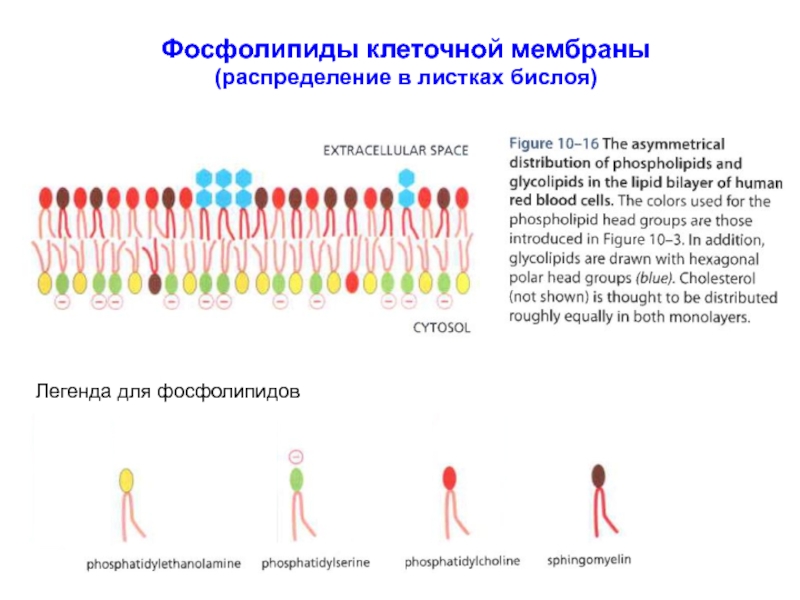
Слайд 17Фосфолипиды клеточной мембраны (распределение в листках бислоя)
В малом количестве в мембране
Фосфолипиды по-разному распределены в клеточной мембране: сфингомиелина и фосфатидилхолина больше во внешнем листке бислоя,
в то время как фосфатидилэтаноламин и фосфатидилсерин доминируют во внутреннем листке бислоя.
цитоплазма
межклеточное пространство
Слайд 19Фосфолипиды в мембране выполняют
три главные функции:
Функции изолятора и барьера. Фосфолипидный бислой
Внутриклеточная сигнализация. Производные мембранных фосфолипидов инозитол-1,2.3-трифосфат и диацилглицерол выполняют роль вторичных посредников .
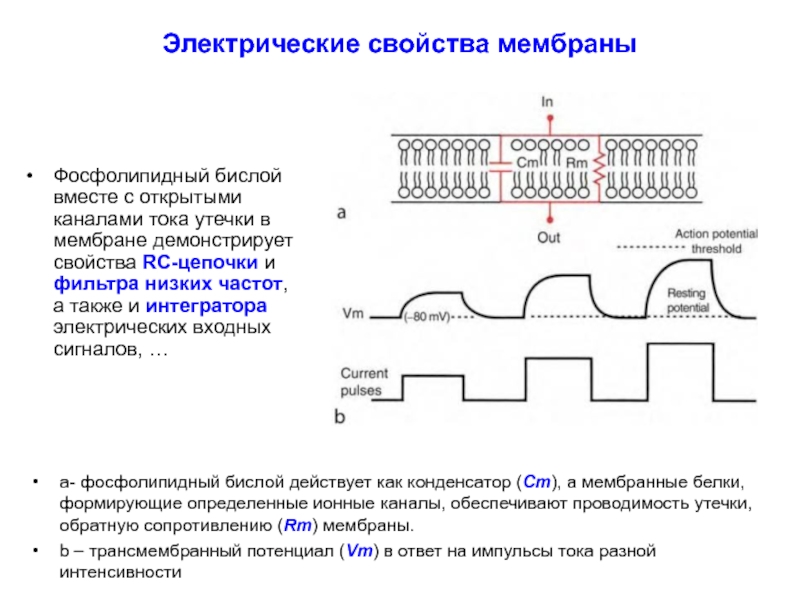
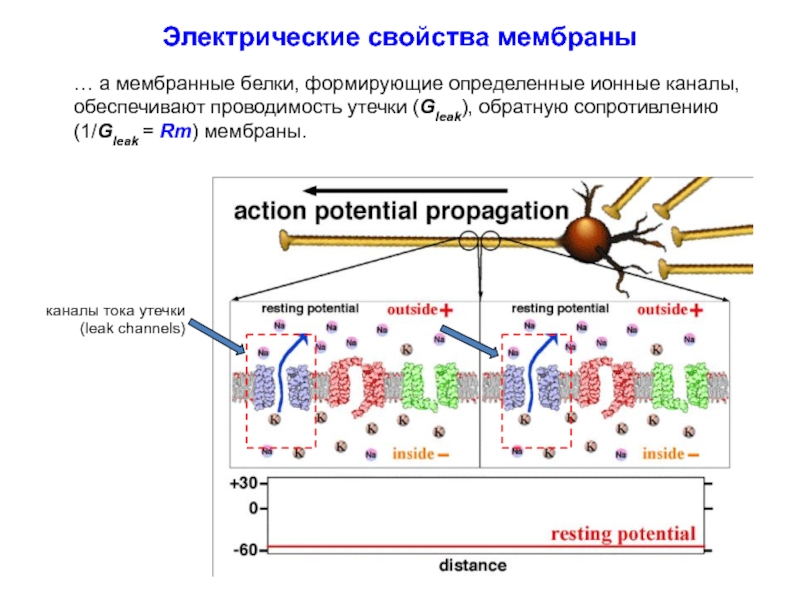
Электрические свойства. Фосфолипидный бислой вместе с открытыми каналами тока утечки в мембране демонстрирует свойства RC-цепочки и, соответственно, фильтра низких частот, а также и интегратора электрических входных сигналов.
Слайд 20Электрические свойства мембраны
Фосфолипидный бислой вместе с открытыми каналами тока утечки в
a- фосфолипидный бислой действует как конденсатор (Cm), а мембранные белки, формирующие определенные ионные каналы, обеспечивают проводимость утечки, обратную сопротивлению (Rm) мембраны.
b – трансмембранный потенциал (Vm) в ответ на импульсы тока разной интенсивности
Слайд 21
каналы тока утечки
(leak channels)
Электрические свойства мембраны
… а мембранные белки, формирующие определенные
Слайд 22Фосфолипиды клеточной мембраны
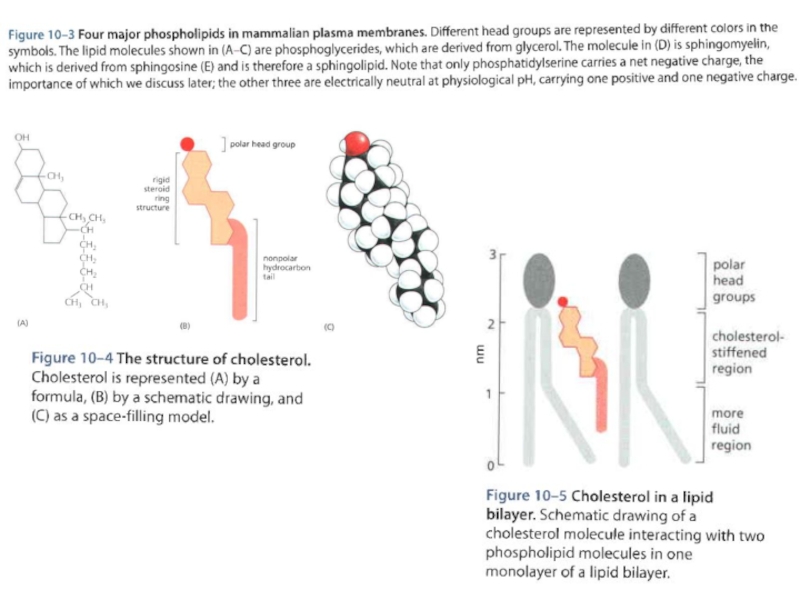
Крайне тонкий и текучий липидный бислой клеточной мембраны характеризуется
Даже в покое в мембране открыты каналы для ионов K+ и Na+, поэтому мембрана демонстрирует проводимость утечки. Как отражение свойства проводимости мембрана обладает сопротивлением около 1000 Ом●см2.
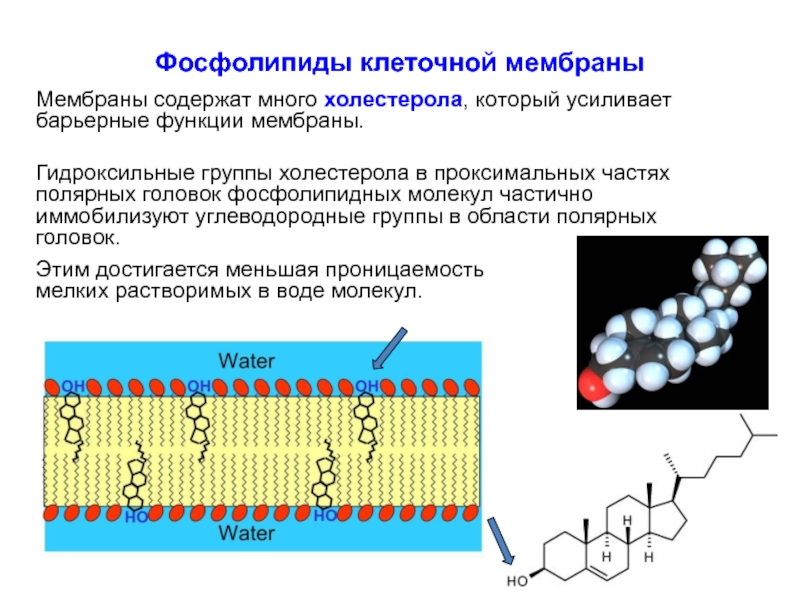
Слайд 23Фосфолипиды клеточной мембраны
Мембраны содержат много холестерола, который усиливает барьерные функции мембраны.
Гидроксильные группы холестерола в проксимальных частях полярных головок фосфолипидных молекул частично иммобилизуют углеводородные группы в области полярных головок.
Этим достигается меньшая проницаемость мелких растворимых в воде молекул.
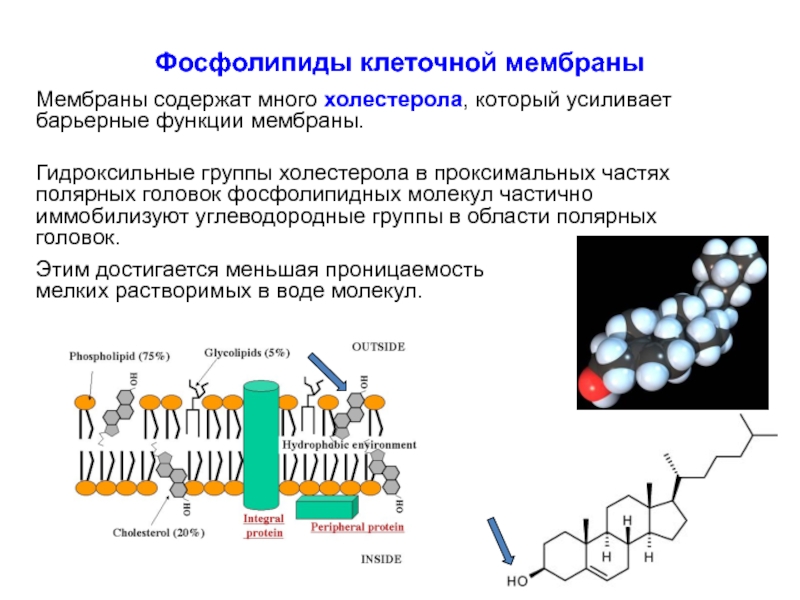
Слайд 24Фосфолипиды клеточной мембраны
Мембраны содержат много холестерола, который усиливает барьерные функции мембраны.
Гидроксильные группы холестерола в проксимальных частях полярных головок фосфолипидных молекул частично иммобилизуют углеводородные группы в области полярных головок.
Этим достигается меньшая проницаемость мелких растворимых в воде молекул.
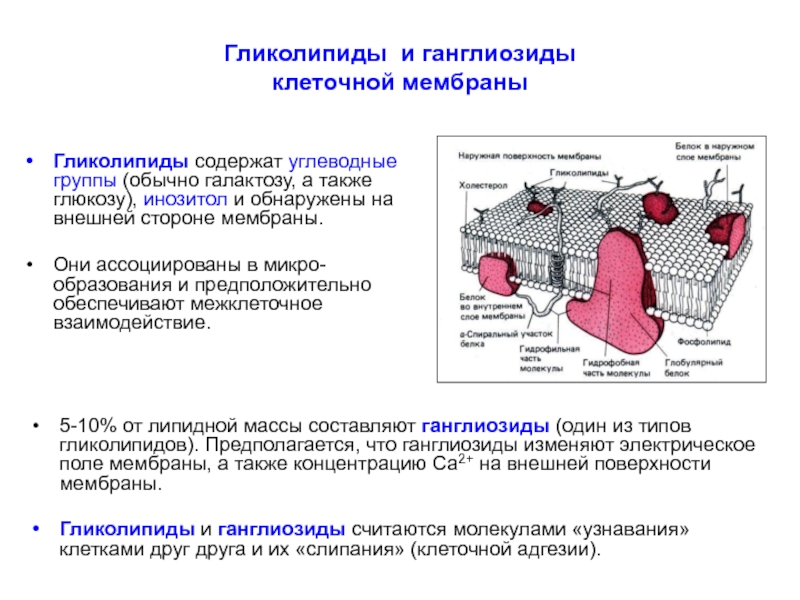
Слайд 26Гликолипиды и ганглиозиды
клеточной мембраны
Гликолипиды содержат углеводные группы (обычно галактозу, а
Они ассоциированы в микро-образования и предположительно обеспечивают межклеточное взаимодействие.
5-10% от липидной массы составляют ганглиозиды (один из типов гликолипидов). Предполагается, что ганглиозиды изменяют электрическое поле мембраны, а также концентрацию Са2+ на внешней поверхности мембраны.
Гликолипиды и ганглиозиды считаются молекулами «узнавания» клетками друг друга и их «слипания» (клеточной адгезии).
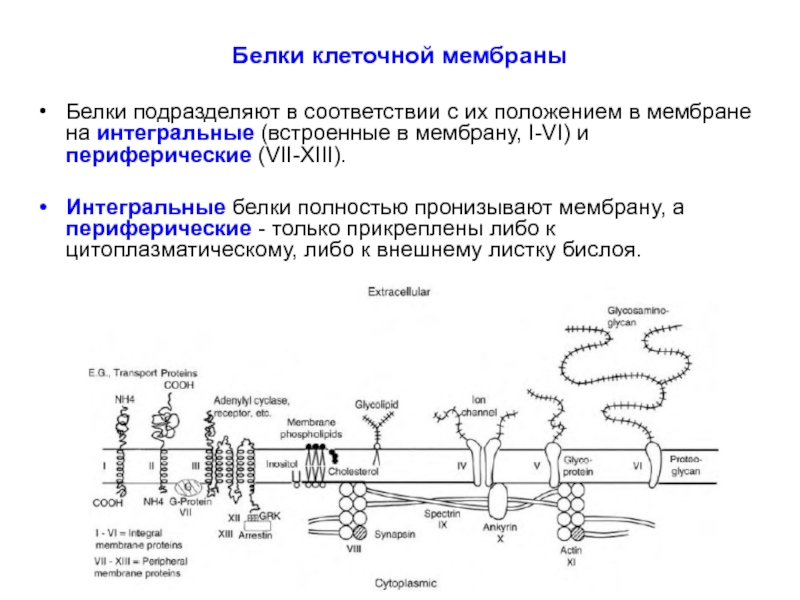
Слайд 27Белки клеточной мембраны
Белки подразделяют в соответствии с их положением в мембране
Интегральные белки полностью пронизывают мембрану, а периферические - только прикреплены либо к цитоплазматическому, либо к внешнему листку бислоя.
Слайд 28Белки клеточной мембраны
Интегральные белки типов I и II имеют только один
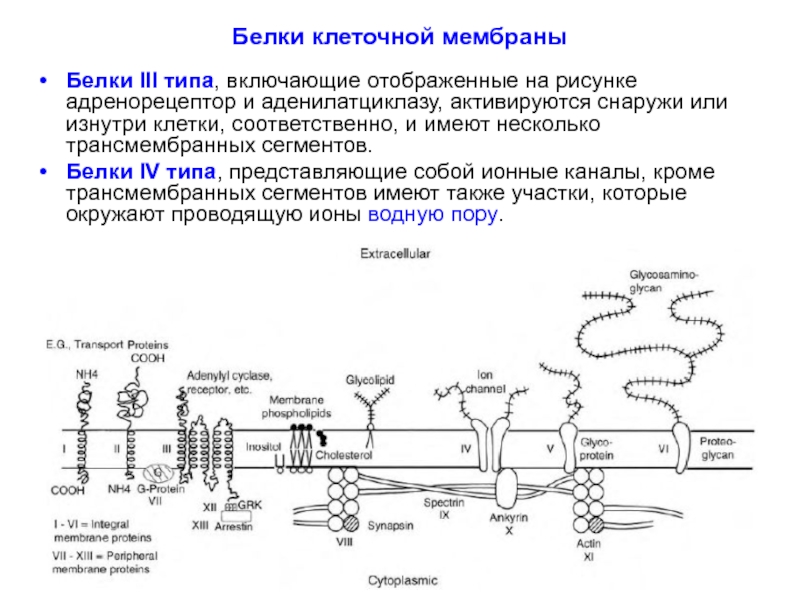
Слайд 29Белки клеточной мембраны
Белки III типа, включающие отображенные на рисунке адренорецептор и
Белки IV типа, представляющие собой ионные каналы, кроме трансмембранных сегментов имеют также участки, которые окружают проводящую ионы водную пору.
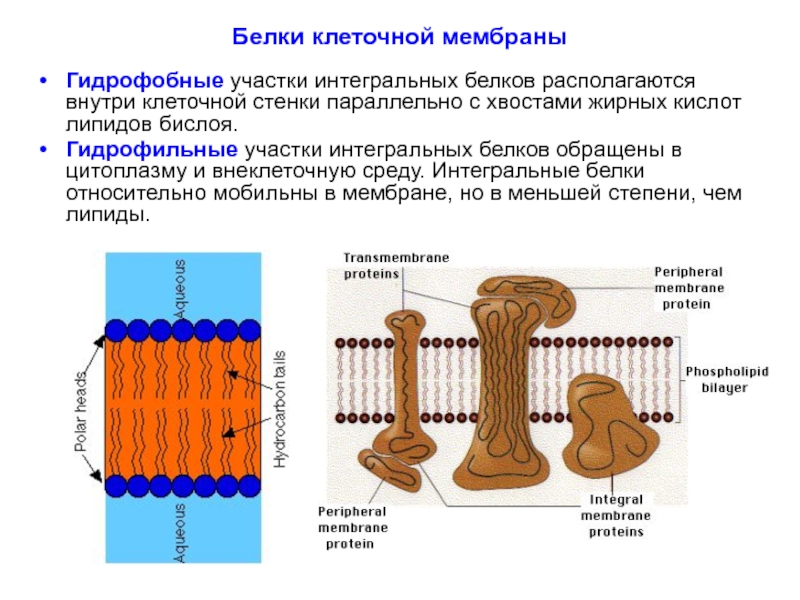
Слайд 30Белки клеточной мембраны
Гидрофобные участки интегральных белков располагаются внутри клеточной стенки параллельно
Гидрофильные участки интегральных белков обращены в цитоплазму и внеклеточную среду. Интегральные белки относительно мобильны в мембране, но в меньшей степени, чем липиды.
Слайд 31Белки клеточной мембраны
Гидрофобные участки интегральных белков располагаются внутри клеточной стенки параллельно
Гидрофильные участки интегральных белков обращены в цитоплазму и внеклеточную среду. Интегральные белки относительно мобильны в мембране, но в меньшей степени, чем липиды.
Слайд 32Интегральные белки в мембране выполняют следующие функции
Транспортная функция. Ионные помпы (системы
Ионные каналы обеспечивают проводимость растворенных в воде некоторых ионов по их электрохимическим градиентам.
Транспортируют сахара и аминокислоты.
Обеспечивают распознавание клеток друг друга при образовании клеточных агрегатов.
Рецепторы нейромедиаторов, нейромодуляторов, гормонов и других химических передатчиков управляют проницаемостью ионов.
Роль ферментов, катализирующих внутриклеточные каскады.
Иммунореактивные элементы.
Слайд 33Белки клеточной мембраны
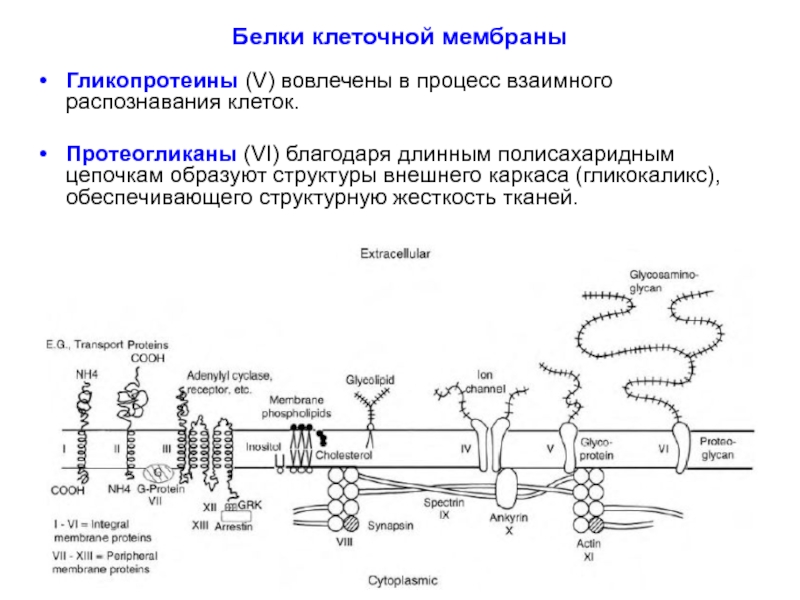
Гликопротеины (V) вовлечены в процесс взаимного распознавания клеток.
Протеогликаны (VI)
Слайд 34Периферические белки в мембране выполняют следующие функции:
Роль ферментов, катализирующих внутриклеточные каскады
Поддержание мембранной структуры (белки актин - XI, анкирин - X, фодрин, спектрин -IX).
Связывают везикулы с элементами цитоскелета (например, синапсин - VIII).
Посредники роста и развития дендритов и аксонов.
Обеспечивают процесс мембранного обмена – рециклирование лиганд-активируемых рецепторов и синаптических везикул (например, аррестин, клатрин - XIII).
Обеспечивают процесс отщепления G-белка от рецептора (G-protein receptor kinase, GRK - XII).
Слайд 35Основные биологические процессы, происходящие с использованием ионных градиентов
Генерация электрического сигнала за
Хемоосмотическое преобразование энергии - протонный градиент в митохондриях (теория Митчела). Существует специальный транспорт протонов (Н+), они выводятся из митохондрий в цитоплазму. Протонный градиент (градиент РН), как источник запасенной энергии, используется для окислительного фосфорилирования (АДФ -> АТФ).
Транспорт веществ против градиента концентрации. Осуществляется за счет перемещения другого вещества по концентрационному градиенту. Например, за счет градиента Na+ через клеточную мембрану транспортируются сахара и аминокислоты.
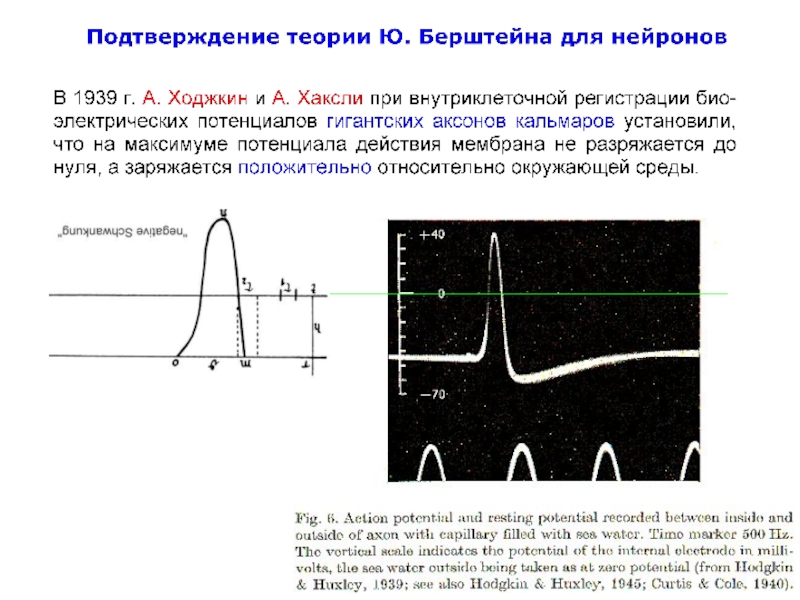
Слайд 38Bernstein J (1868) Über den zeitlichen Verlauf der negative Schwankung des
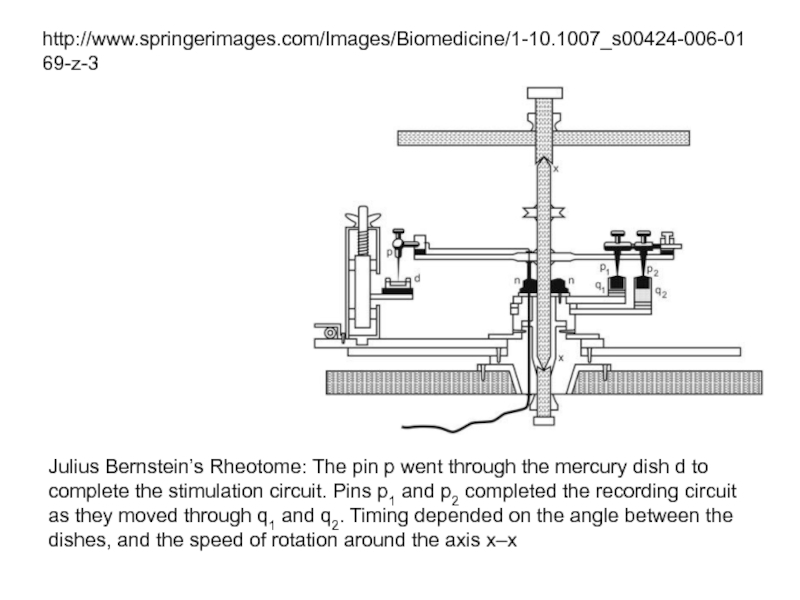
Слайд 39Julius Bernstein’s Rheotome: The pin p went through the mercury dish
http://www.springerimages.com/Images/Biomedicine/1-10.1007_s00424-006-0169-z-3
Слайд 40First recording of action potential from the nerve made by Julius
a The Bernstein rheotome;
b the recording of an action potential. The τ1 and τ2 indicate “sampling” intervals of the rheotome; the duration m–o is the duration of action potential [“negative Schwankung”, and n is the “sign reversal” (overshoot)]
Bernstein J (1868)
Über den zeitlichen Verlauf der negativen
Schwankung des Nervenstroms.
Pflügers Arch 1:173–207
Слайд 42
Теория Ю. Бернштейна
В конце XIX в. Ю. Бернштейн выдвинул гипотезу, согласно
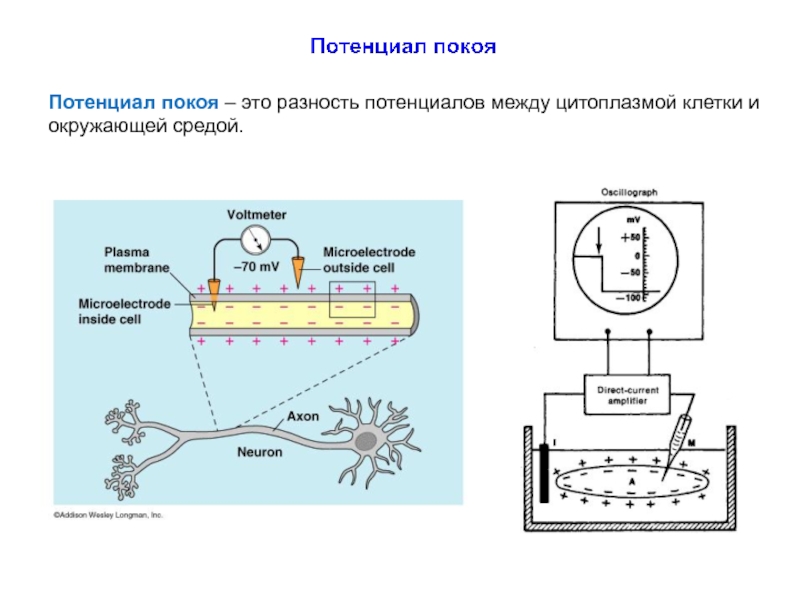
Слайд 44Потенциал покоя – это разность потенциалов между цитоплазмой клетки и окружающей
Теория Ю. Бернштейна
В конце XIX в. Ю. Бернштейн выдвинул гипотезу, согласно которой клеточная мембрана пропускает внутрь клетки ионы К+, и они накапливаются в цитоплазме.
В 1896 г. его ученик Василий Чаговец (1873-1941) подтвердил эту гипотезу и применил электролитическую теорию В. Нернста к биологическим системам и установил калиевую природу потенциала покоя.
Расчет величины потенциала покоя по уравнению Нернста для калиевого электрода удовлетворительно совпал с измеренным потенциалом между саркоплазмой мышцы и окружающей средой, который составлял около – 70 мВ.
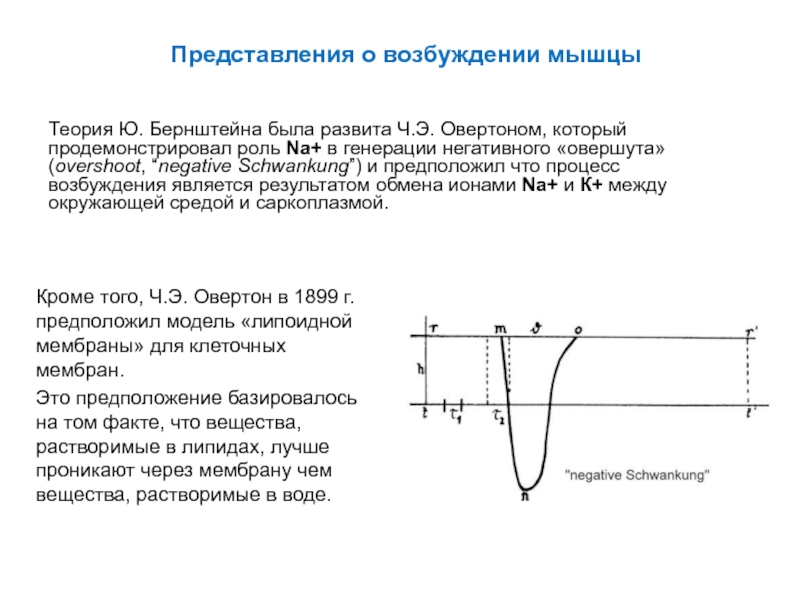
Слайд 45Представления о возбуждении мышцы
Теория Ю. Бернштейна была развита Ч.Э. Овертоном, который
Кроме того, Ч.Э. Овертон в 1899 г. предположил модель «липоидной мембраны» для клеточных мембран.
Это предположение базировалось на том факте, что вещества, растворимые в липидах, лучше проникают через мембрану чем вещества, растворимые в воде.
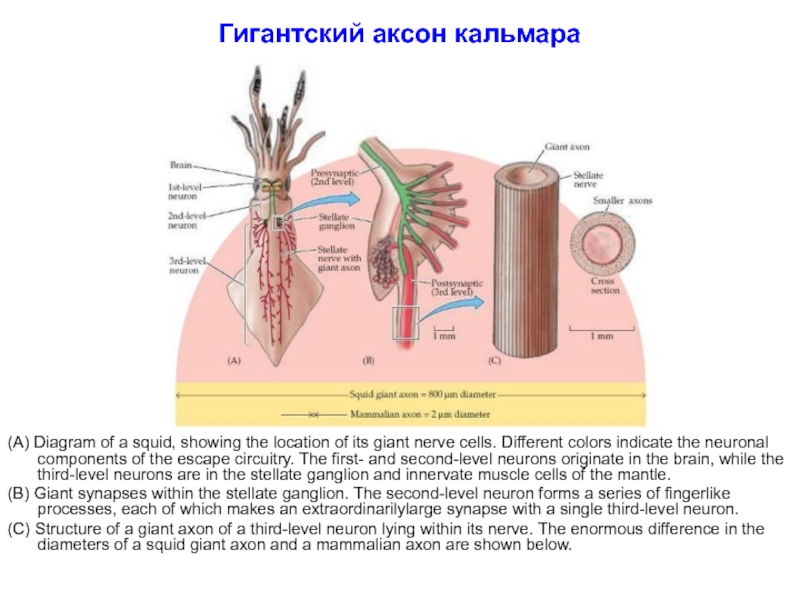
Слайд 46Гигантский аксон кальмара
(A) Diagram of a squid, showing the location of
(B) Giant synapses within the stellate ganglion. The second-level neuron forms a series of fingerlike processes, each of which makes an extraordinarilylarge synapse with a single third-level neuron.
(C) Structure of a giant axon of a third-level neuron lying within its nerve. The enormous difference in the diameters of a squid giant axon and a mammalian axon are shown below.
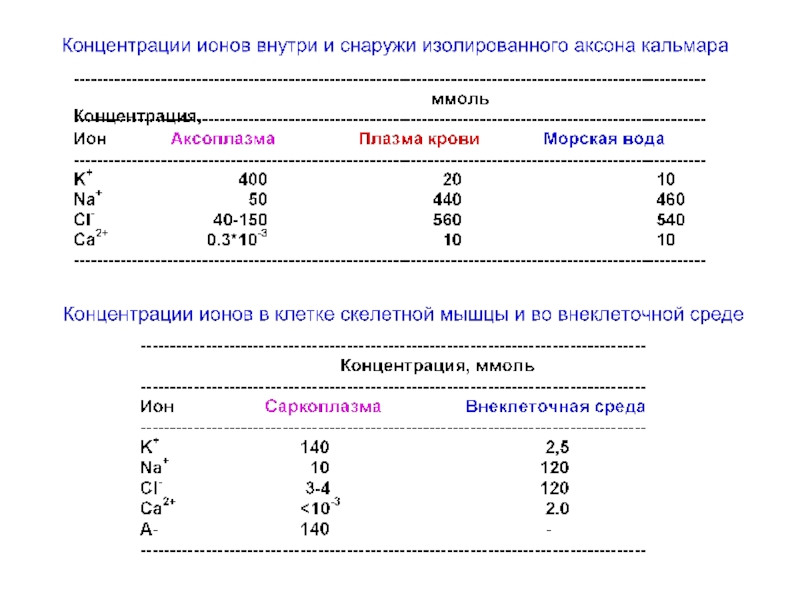
Слайд 52Внеклеточная и внутриклеточная концентрации основных ионов в нейронах и окружающих тканях
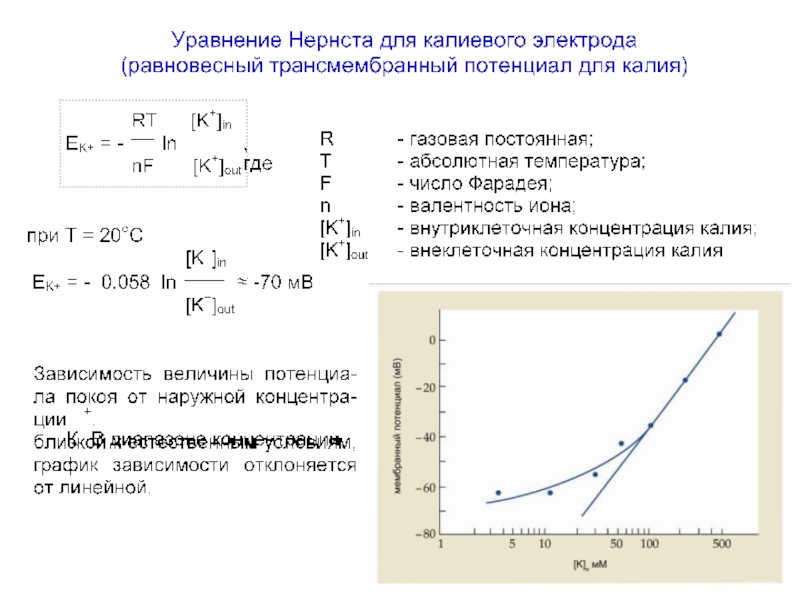
Слайд 58Зависимость величины потенциала покоя от логарифма наружной концентрации ионов К+ ([K]out)
В
Прямая линия на рисунке отражает эту теоретическую зависимость.
В действительности в диапазоне концентраций ионов К+, близких к естест-венным условиям (менее 50 мМ), график зависимости отклоняется от линейной функции из-за вклада в ПП ионов Na+ и Cl-.
Слайд 60Эквивалентная электрическая схема, описывающая пассивные потоки ионов, определяющие ПП клеток
Слайд 61Эквивалентная электрическая схема, описывающая пассивные и активные потоки ионов, определяющие ПП
Слайд 62В состоянии равновесия пассивные Na+- и K+-токи компенсируются активными потоками этих
Липидный бислой мембраны обладает электрической емкостью (Cm). Из-за асимметричности активного транспорта активный ток Na+ на 50% превышает активный ток K+ (и, соответственно, пассивный ток Na+ также на 50% превышает пассивный ток K+), поскольку Na+-K+-насос за один цикл транспортирует три иона Na+ из клетки и два иона K+ внутрь клетки.

























![Зависимость величины потенциала покоя от логарифма наружной концентрации ионов К+ ([K]out)В соответствии с уравнени-ем Нернста](/img/tmb/4/392284/b66e208d11646aabd368b61bc6f3dffc-800x.jpg)