- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биогенные элементы. Критерии биогенности презентация
Содержание
- 1. Биогенные элементы. Критерии биогенности
- 2. Биогенные элементы – элементы, необходимые для построения и функционирования различных клеток и организмов.
- 3. Критерии биогенности
- 4. 1. Распространенность элемента в природе. Биосфера
- 5. Живые организмы активно участвуют в перераспределении элементов
- 6. Распространенность элементов в земной коре различна.
- 7. Исследования показали, что в живых организмах присутствуют
- 8. Чем выше содержание элемента в природе, тем больше его в организме.
- 9. Однако, данная закономерность соблюдается не всегда.
- 10. Наблюдается и обратная картина:
- 11. В результате естественного отбора основой живых
- 12. Таблица 1
- 13. 2. Растворимость соединений элемента в
- 14. Таблица 2
- 15. 3. Размеры атомов Чем меньше порядковый
- 16. Таблица 3 99% массы организма составляют элементы с порядковым номером
- 17. 4.Способность приобретать устойчивую электронную конфигурацию Эта способность
- 18. Элементы 1-3-й групп ПСЭ отдают 1-3 электрона:
- 19. Элементы 4-7-й групп ПСЭ принимают 4-1
- 20. 5. Способность к образованию прочных полярных ковалентных
- 21. У их аналогов из
- 22. 6. Склонность к комплексообразованию максимальна для d-элементов,
- 23. Катионы “металлов жизни”- Fe, Zn, Cu,
- 24. Классификация биогенных элементов 1. По положению в
- 25. 2. По биороли (классификация Ковальского): -жизненно
- 26. -примесные, присутствуют в организме, но
- 27. 3. По среднему содержанию в организме:
- 28. -микроэлементы, их ω
- 29. Функции макроэлементов: Построение тканей. Поддержание постоянных:
- 30. Функции микроэлементов. Микроэлементы входят в состав
- 31. Топография биогенных элементов Распределение
- 32. Элементы могут проявлять специфическое
- 33. Таблица 4
- 34. Макроэлементы О и Н входят
- 35. Таблица 5
- 36. Макроэлементы O, C, H, N,
- 37. При заболеваниях происходит изменение
- 38. В организме с участием гормонов
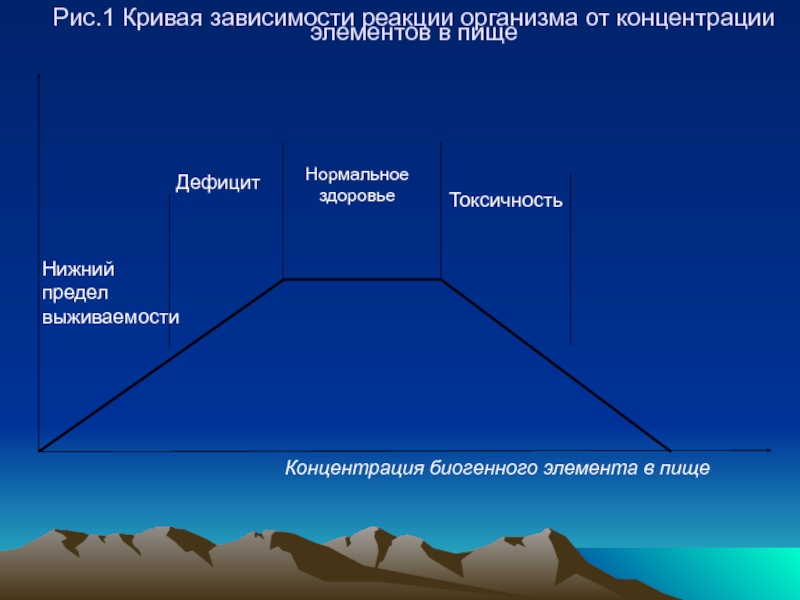
- 39. Рис.1 Кривая зависимости реакции организма от концентрации элементов в пище
- 40. Чем больше горизонтальный участок кривой,
- 41. Узкое плато свидетельствует о
- 42. Значительное увеличение концентраций таких микроэлементов может
- 43. Синергизм и антагонизм действия элементов Сходство
- 44. Синергизм – усиление биологической активности замещаемого элемента Антагонизм – угнетение активности.
- 45. Примеры: 1. Вe 2+ и Mg
- 46. 2. Са 2+ и
- 47. 3. Mg 2+ и Mn
- 48. 4. d-Элементы IV периода: Mn
- 49. Эндемические заболевания (микроэлементозы) Биогеохимические
- 50. Поскольку содержание элемента в
- 51. Таблица 6
- 52. Спасибо за внимание!
Слайд 2
Биогенные элементы – элементы, необходимые для построения и функционирования различных клеток
Слайд 41. Распространенность элемента в природе.
Биосфера – часть земной оболочки, занятая растительными
Слайд 5 Живые организмы активно участвуют в перераспределении элементов в земной коре,
например,
Слайд 6
Распространенность элементов в земной коре различна.
На долю 18 элементов приходится
O C H N P S Cl Mg Ca K Na
Макроэлементы
Zn Cu Fe Mn Mo Co
Микроэлементы
Слайд 7Исследования показали, что в живых организмах присутствуют все те же элементы,
Слайд 9
Однако, данная закономерность соблюдается не всегда.
Так, в земной коре содержится
27,6% Si, а в организмах его – 10-5%.
Слайд 10 Наблюдается и обратная картина:
Биологическое концентрирование –
Слайд 11
В результате естественного отбора основой живых систем стали
6 элементов-органогенов: углерод,
Их суммарная массовая доля в
организме – 97,4%.
Слайд 13 2. Растворимость соединений элемента в воде
Чем лучше растворимость
Слайд 153. Размеры атомов
Чем меньше порядковый номер элемента, тем больше его
Слайд 174.Способность приобретать устойчивую электронную конфигурацию
Эта способность является причиной прочности связей элемента
Слайд 18Элементы 1-3-й групп ПСЭ отдают 1-3 электрона:
Na 1s22s22p63s1-1e→Na+ 1s22s22p6 –
Слайд 19Элементы 4-7-й групп ПСЭ принимают
4-1 электрона:
Cl 1s22s22p63s23p5 +1e→Cl- 1s22s22p63s23p6
–
Так образуются ионы электролитов организма: Na+, Ca2+, Mg2+, Cl-.
Слайд 205. Способность к образованию прочных полярных ковалентных связей, кратных связей, созданию
В то же время эти связи лабильны – способны легко разрываться в условиях протекания биохимических превращений.
Эта способность максимальна у элементов 2-го периода – C, N, O.
Слайд 21
У их аналогов из 3-го периода – Si, P,
Слайд 226. Склонность к комплексообразованию
максимальна для d-элементов, имеющих большой заряд ядра и
Слайд 23
Катионы “металлов жизни”- Fe, Zn, Cu, Co, Mn, Mo – in
Слайд 24Классификация биогенных элементов
1. По положению в ПСЭ:
s-элементы: K, Na, Ca, Mg;
p-элементы:
d-элементы: Fe, Zn, Mn, Mo, Cu, Co.
Слайд 252. По биороли (классификация Ковальского):
-жизненно необходимые, дефицит которых приводит к нарушению
Слайд 26
-примесные, присутствуют в организме, но их биороль мало выяснена или
Слайд 273. По среднему содержанию в организме:
-макроэлементы, их ω>10-2%:
Слайд 29Функции макроэлементов:
Построение тканей.
Поддержание постоянных:
-осмотического давления ( осмотического гомеостаза);
-электролитного состава;
-рН (кислотно-основного гомеостаза).
Слайд 30 Функции микроэлементов. Микроэлементы входят в состав витаминов, гормонов, ферментов в качестве комплексообразователей
1. В обмене веществ.
2. В процессах размножения.
3. В тканевом дыхании.
4. В обезвреживании токсинов.
5. В кроветворении.
6. Влияют на проницаемость сосудов и тканей.
7. В окислительно-восстановительных процессах.
Слайд 31Топография биогенных элементов
Распределение элементов в органах и тканях различно.
Слайд 32
Элементы могут проявлять специфическое сродство к некоторым органам и
Zn накапливается в поджелудочной железе,
I - в щитовидной,
F - в эмали зубов,
As - в волосах и ногтях.
Слайд 34 Макроэлементы О и Н входят в состав воды:ω(Н2О)=65%,
Слайд 36 Макроэлементы O, C, H, N, P, S входят в
Максимальна ω белков в селезенке – 84%, минимальна в зубах – 24%.
Слайд 37
При заболеваниях происходит изменение содержания элементов. Например, при рахите
P-Ca обмен и уменьшается
содержание Са
Слайд 38 В организме с участием гормонов поддерживается оптимальный баланс концентраций
Слайд 40 Чем больше горизонтальный участок кривой, тем больше область концентраций,
Организм способен адаптироваться к большим изменения концентраций этого элемента.
Слайд 41
Узкое плато свидетельствует о высокой токсичности элемента и резком
Слайд 42
Значительное увеличение концентраций таких микроэлементов может привести к летальному исходу (Hg
Слайд 43Синергизм и антагонизм действия элементов
Сходство и различие биологического действия элементов связано
Слайд 44Синергизм – усиление биологической активности замещаемого элемента
Антагонизм – угнетение активности.
Слайд 45Примеры:
1. Вe 2+ и Mg 2+ сходны по химическим характеристикам: ⇒Ве
Mg 2+ ⇒ ингибирует Mg-содержащие ферменты, антагонизм действия.
Слайд 46
2. Са 2+ и Sr 2+ сходны по строению,
Са 2+ в костной ткани, прочность костей уменьшается, развивается стронциевый рахит ⇒ антагонисты.