- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биоэнергетика. Биологическое окисление. Биологические виды энергии презентация
Содержание
- 1. Биоэнергетика. Биологическое окисление. Биологические виды энергии
- 2. ∆Go первой реакции: +14 кДж/моль указывает на
- 4. Биологическое окисление Перенос электронов от
- 5. Способы передачи - прямой перенос:
- 6. В качестве эквивалента для оплаты энергетических
- 7. БИОЛОГИЧЕСКИЕ ВИДЫ ЭНЕРГИИ Энергия разности потенциалов на
- 8. Катализирующие окислительно-восстановительные реакции биологического окисления ОКСИДОРЕДУКТАЗЫ двухкомпонентные
- 9. По типу конечного акцептора все окислительно-восстановительные
- 10. Самая многочисленная группа оксидоредуктаз - никотинамид
- 12. НАД+ и НАДФ - дегидрогеназы катализируют
- 13. Активная часть молекулы ФАД и ФМН -
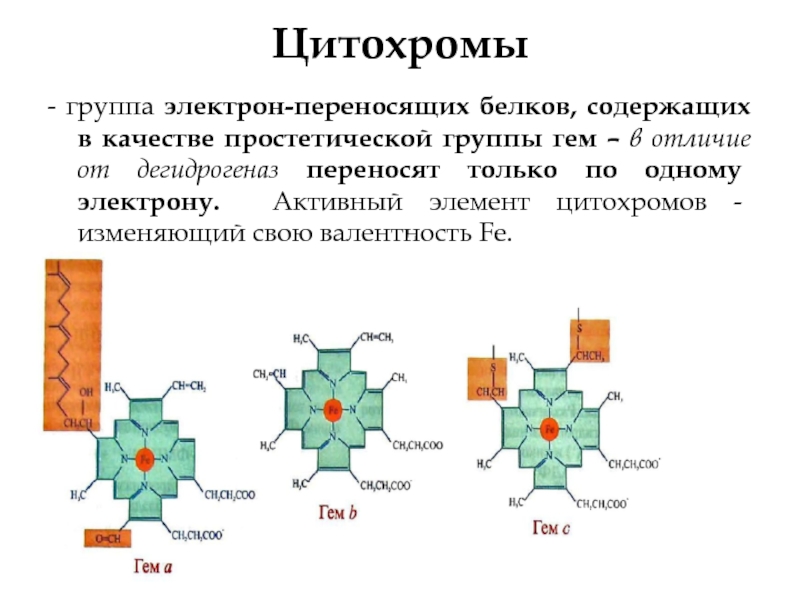
- 14. Цитохромы - группа электрон-переносящих белков, содержащих в
- 15. - группа белков, участников окислительно-восстановительных реакций.
- 16. Все перечисленные выше белки и ферменты
- 17. Транспортирующая H+-АТФ-синтаза использует для синтеза АТФ
- 18. Катаболизм белков, жиров и углеводов на трёх стадиях клеточного дыхания
- 19. ОСНОВНЫЕ РЕАКЦИИ ГЛИКОЛИЗА
- 21. ГЛИКОЛИЗ Т.о. при расщеплении 1М глюкозы образуется
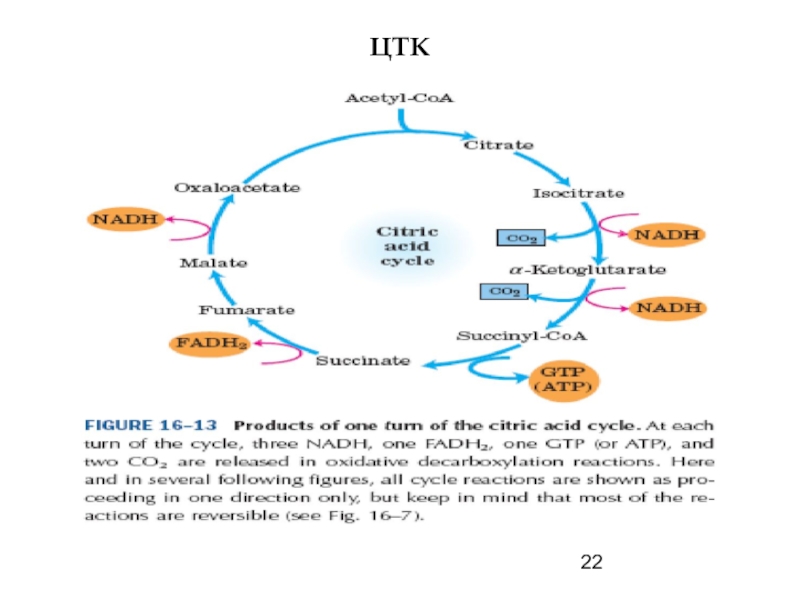
- 22. ЦТК
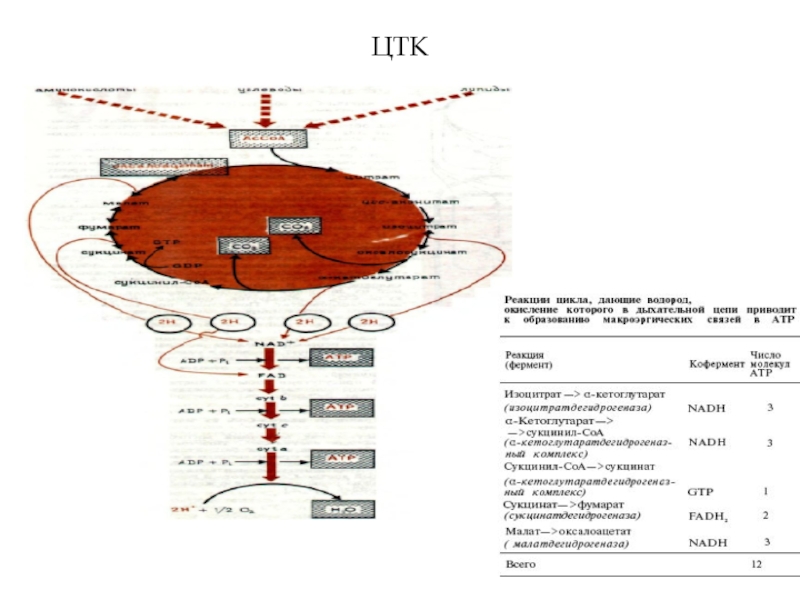
- 23. ЦТК
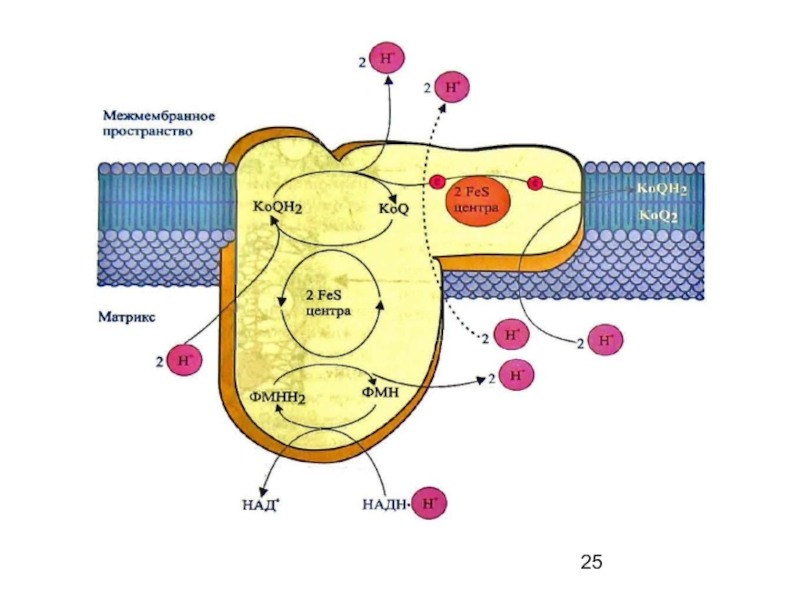
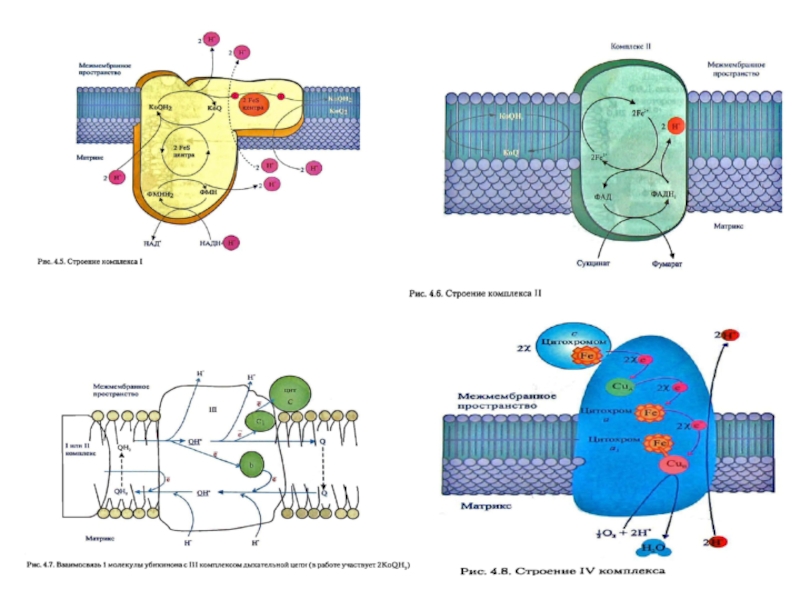
- 24. I комплекс цепи тканевого дыхания –
- 26. II комплекс цепи тканевого дыхания –
- 27. Комплекс II называют флавопротеином II (ФП2)
- 29. 2 компонента внутренней мембраны не связаны
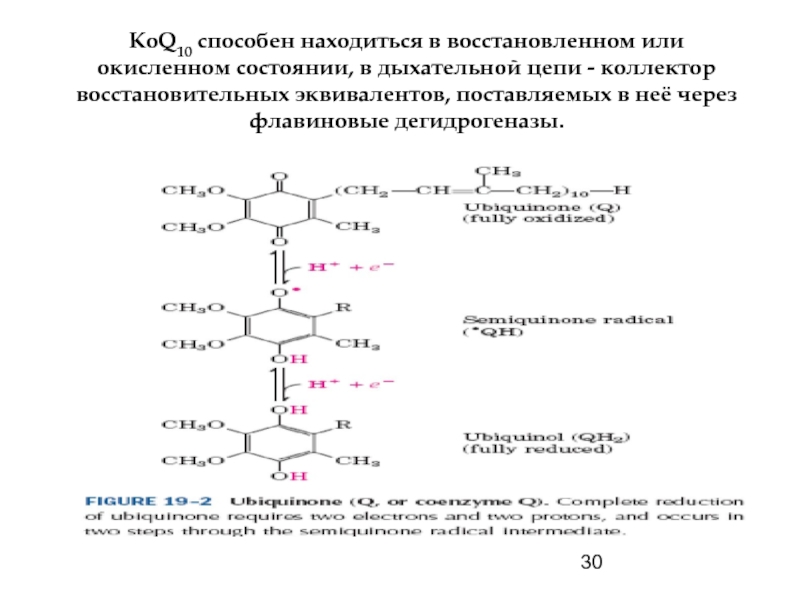
- 30. КоQ10 способен находиться в восстановленном или окисленном
- 31. Цитохром с по величине редокс-потенциала располагается
- 32. III комплекс цепи тканевого дыхания – убихинол:
- 33. ЦИТОХРОМЫ выстроенные в дыхательную цепь в порядке
- 34. IV комплекс дыхательной цепи - цитохром с-оксидаза
- 35. Цитохром с-оксидаза катализирует одноэлектронное окисление четырех
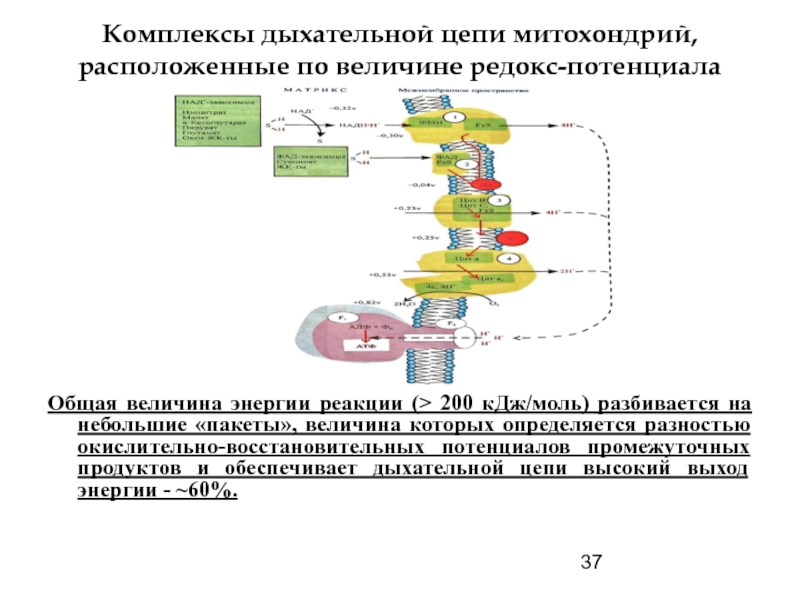
- 37. Комплексы дыхательной цепи митохондрий, расположенные по величине
- 38. Образование молекулы Н2О сопровождается переносом 10 или
- 39. Комплексы дыхательной цепи содержат различные простетические
- 42. Электроны поступают в дыхательную цепь различными
- 43. Окисление НАДН комплексом I происходит на
- 44. ХЕМИОСМОТИЧЕСКАЯ КОНЦЕПЦИЯ - превращения энергии в живых
- 45. ДЫХАТЕЛЬНЫЙ КОНТРОЛЬ - механизм регуляции образования и
- 46. РАЗОБЩАЮЩИЕ АГЕНТЫ функционально разделяют окисление и фосфорилирование,
- 48. Организация и функционирование дыхательной цепи Компоненты
- 50. ДЫХАТЕЛЬНЫЙ КОНТРОЛЬ Известно, что при недостатке АДФ
- 52. Система для исследования дыхания митохондрий in
- 53. В покоящейся клетке митохондрии находятся в
- 54. Реакции дыхательной цепи сопряжены с реакциями
- 55. ИНГИБИТОРЫ ДЫХАНИЯ И ИСКУССТВЕННЫЕ АКЦЕПТОРЫ ЭЛЕКТРОНОВ
- 56. Ротенон - растительный яд, применяемый индейцами
- 57. При добавлении разобщителей окислительного фосфорилирования между
- 58. ФАКТОРЫ И МЕСТО ДЕЙСТВИЯ ФАКТОРОВ НА РАБОТУ ДЫХАТЕЛЬНОЙ ЦЕПИ
- 59. Места действия искусственных акцепторов электронов и ингибиторов на цепь переносчиков электронов внутренне мембраны митохондрий
- 60. V комплекс внутренней мембраны обеспечивает возвращение
- 62. Каждая из трех β-субъединиц может находиться
- 63. У человека и других млекопитающих существует
- 64. Этот процесс регулируется жирными кислотами, а
- 65. РЕГУЛЯТОРНОЕ ТЕПЛООБРАЗОВАНИЕ И СВОБОДНОЕ ОКИСЛЕНИЕ В
- 66. ЭНЕРГЕТИКА МЫШЦ И ДРУГИХ СОКРАТИТЕЛЬНЫХ СТРУКТУР В
- 67. Хотя непосредственным источником энергии работающей мышцы
- 68. Актин содержится практически во всех
- 69. Содержание АТФ в мышцах относительно постоянно
- 70. В скелетных мышцах человека 3 вида
- 71. ИСТОЧНИКИ ЭНЕРГИИ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ 1. Ресинтез АТФ
- 72. 2. Ресинтез АТФ в миокиназной (аденилаткиназной) реакции
- 74. Мышцы - главные энергетические субстраты для
- 75. В активно действующей скелетной мышце скорость
- 76. В покое в мышцах ситуация другая:
- 77. Между интенсивно протекающими в мышечной и
- 78. МЕТАБОЛИЧЕСКАЯ РЕГУЛЯЦИЯ МЫШЕЧНОГО СОКРАЩЕНИЯ I. Цикл
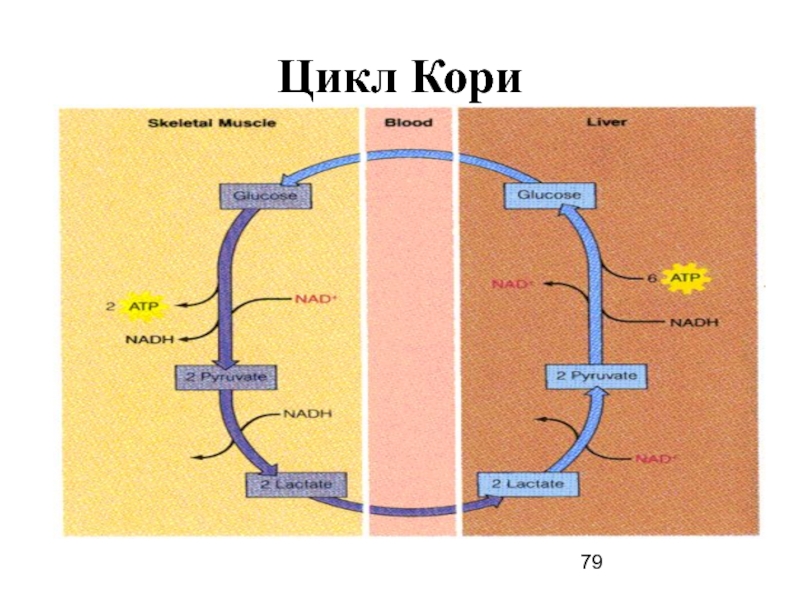
- 79. Цикл Кори
- 80. II.ГЛЮКОЗО-АЛАНИНОВЫЙ ЦИКЛ Обратная связь, подобная циклу Кори,
- 81. Глюкозо-аланиновый цикл
- 83. БИОЭНЕРГЕТИКА МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ Энергия для сокращения и
- 84. Аэробный путь ресинтеза АТФ приобретает значение
- 85. Для миокарда основным путем образования богатых
- 86. Характерной особенностью обмена веществ в миокарде
- 87. Главным же субстратом дыхания в сердечной
Слайд 1БИОЭНЕРГЕТИКА
Л.И.Нефёдов
д.м.н., профессор, D.h.c.,
профессор кафедры биохимии,
УО “ГрГУ им. Янки Купалы”
www.nil.grsu.by
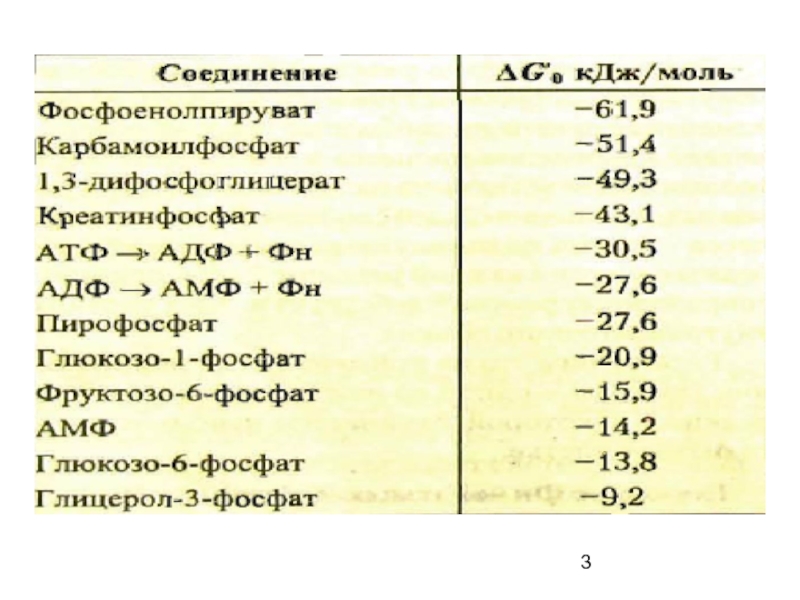
Слайд 2∆Go первой реакции:
+14 кДж/моль указывает на невозможность ее самопроизвольного протекания (эндергоническая),
-31 кДж/моль (экзергоническая): ∑∆Go -17.
Для обеспечения протекания в благоприятном с позиции термодинамики направлении реакций в клетке необходимы молекулы, реакции гидролиза которых характеризуется
(-)G – это макроэрги типа АТФ.
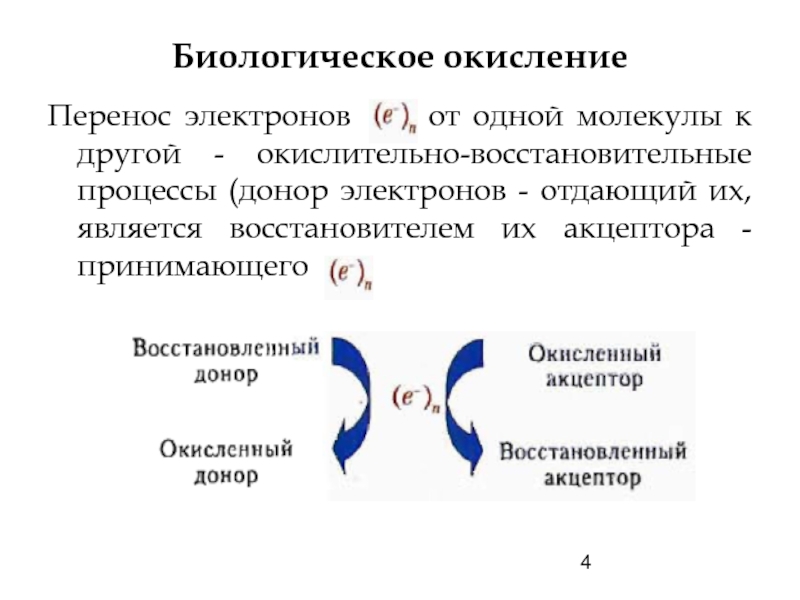
Слайд 4Биологическое окисление
Перенос электронов от одной молекулы к другой -
Слайд 5Способы передачи
- прямой перенос:
- в составе состоящих из протона
в составе состоящего из двух электронов и одного протона гидрид - иона (:H-);
от окисляемого вещества на кислород, связывающийся ковалентно с окисляемым веществом.
Чаще всего переносятся два электрона - рассматриваются как «единица» биологического окисления.
Слайд 6
В качестве эквивалента для оплаты энергетических затрат в:
- мембране -
- цитоплазме – АТФ, креатинфосфат и другие макроэрги.
Источник АТФ – фосфорилирование:
1. субстратное (гликолиз, реакция сукцинил-КоА
—> сукцинат в ЦТК);
2. окислительное (генерация ΔμН+ и ΔμNa+, используемых для окислительного фосфорилирования при транспорте электронов в дыхательной цепи энергосопрягающих мембран митохондрий).
Слайд 7БИОЛОГИЧЕСКИЕ ВИДЫ ЭНЕРГИИ
Энергия разности потенциалов на сопрягающих мембранах может:
- обратимо
- Na+-АТФ-синтазой (Na+-АТФазой) в “натриевых” мембранах, поддерживающих потенциал ΔμNa+.
Энергия субстратов дыхания утилизируется ферментами дыхательной редокс-цепи.
Генерируемый потенциал используется для совершения полезной работы - образования АТФ.
Слайд 8Катализирующие окислительно-восстановительные реакции биологического окисления ОКСИДОРЕДУКТАЗЫ
двухкомпонентные ферменты, коферментами которых м.б. моно-
Оксидоредуктаза с восстановленным коферментом не участвует в катализе до тех пор, пока электроны её кофермента не будут переданы на конечный акцептор.
Отношение восстановленный кофермент/окисленный кофермент – важнейший регуляторный фактор окислительно-восстановительных реакций.
Слайд 9
По типу конечного акцептора все окислительно-восстановительные реакции разделяют на аэробные (конечный
а по способу передачи электронов, которым пользуются оксидоредуктазы, различают дегидрогеназы, оксидазы, оксигеназы и гидропероксидазы.
Слайд 10
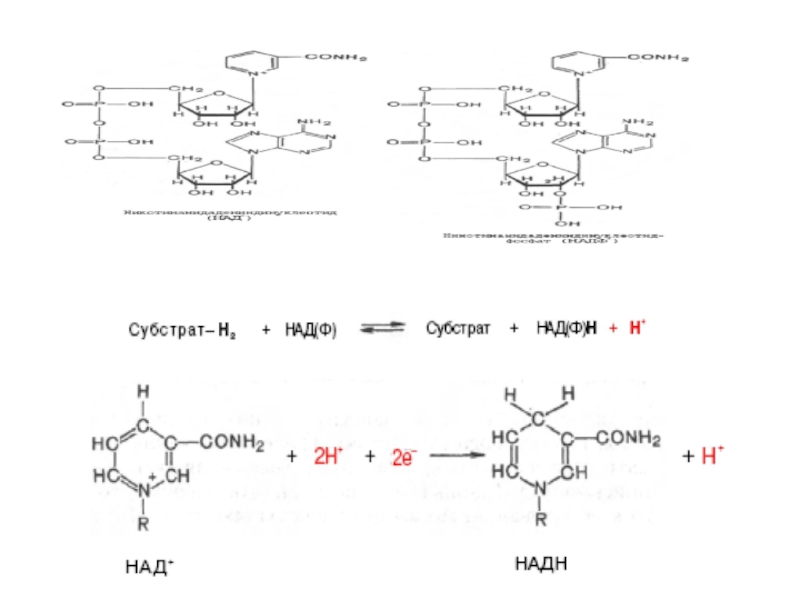
Самая многочисленная группа оксидоредуктаз - никотинамид (пиридин)-зависимые и флавин-зависимые дегидрогеназы.
Коферменты никотинамидзависимых
Различают два типа коферментов данных дегидрогеназ: никотинамидадениндинуклеотид (НАД+) и никотинамидадениндинуклеотидфосфат (НАДФ+).
Слайд 12
НАД+ и НАДФ - дегидрогеназы катализируют перенос гидрид-иона (акцептором в реакции
Различия в структуре НАД+ и НАДФ+ не отражаются на механизме их участия в реакциях переноса электронов, но придают им разные функции в клетке:
НАДН∙Н+ поставляет электроны в реакции, обеспечивающие образование макроэргов, а
НАДФН∙Н+ - для анаболических процессов (восстановительные синтезы) и реакций обезвреживания ксенобиотиков и активных форм О2.
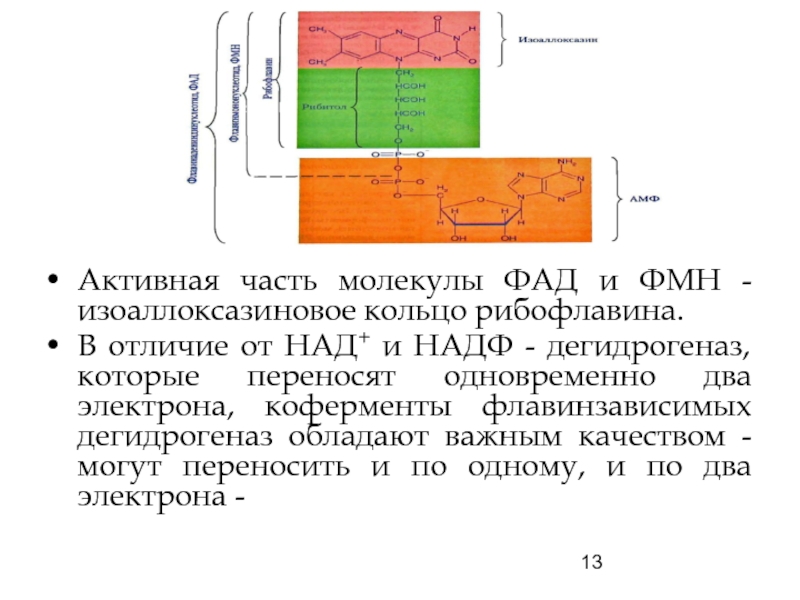
Слайд 13Активная часть молекулы ФАД и ФМН - изоаллоксазиновое кольцо рибофлавина.
В
Слайд 14Цитохромы
- группа электрон-переносящих белков, содержащих в качестве простетической группы гем –
Слайд 15- группа белков, участников окислительно-восстановительных реакций.
Fe в этих комплексах –
Железосерные комплексы
Слайд 16
Все перечисленные выше белки и ферменты используют 3 из 4-х механизмов
1. перенос электронов (цитохромы и FeS-белки),
2. перенос электронов в составе:
2.1. гидрид-ионов (НАД-зависимые дегидрогеназы)
2.2. атомов водорода (ФАД-зависимые дегидрогеназы).
Слайд 17
Транспортирующая H+-АТФ-синтаза использует для синтеза АТФ энергию градиента потенциала.
У эукариот
Второй способ синтеза АТФ осуществляется в анаэробных условиях и основан на переносе фосфатных остатков на АДФ через метаболит с высоким потенциалом переноса фосфатных групп - образование АТФ из креатинфосфата.
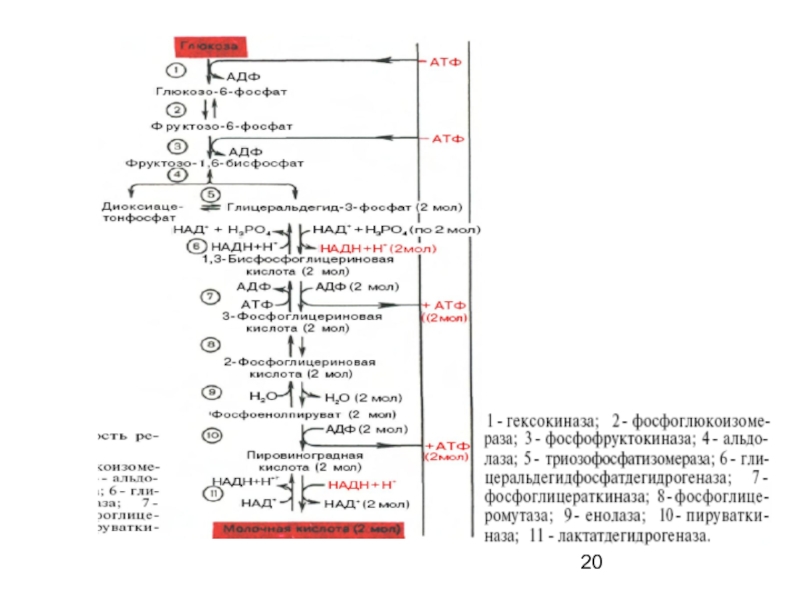
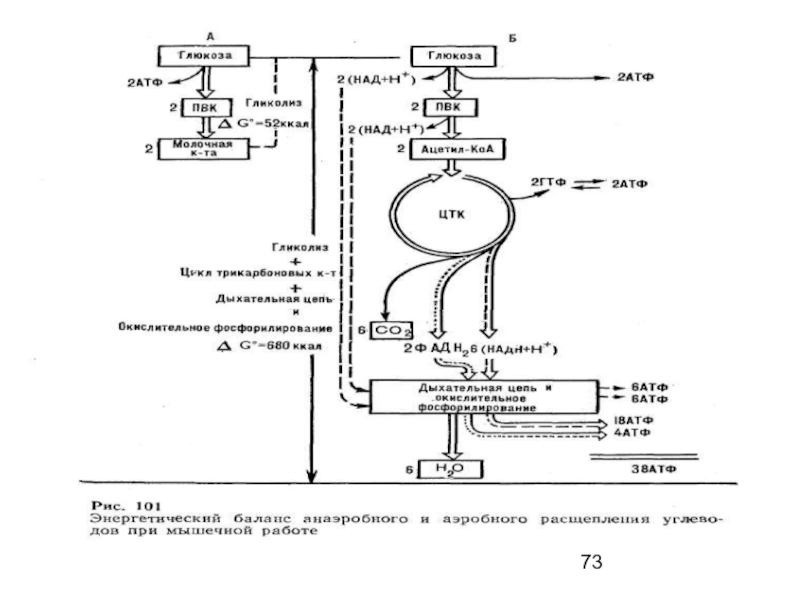
Слайд 21ГЛИКОЛИЗ
Т.о. при расщеплении 1М глюкозы образуется 2М пирувата, при окислении которых
К этому количеству добавляется 2М АТФ, образующиеся при анаэробном гликолизе, и 6М АТФ, синтезирующихся при окислении 2М цитоплазматического НАДН, образующихся при окислении 2М глицеральдегид-3-фосфата в дегидрогеназной реакции гликолиза, -
при расщеплении в тканях 1 молекулы глюкозы по уравнению
С6Н12О6 + 6О2 —> 6СО2 + 6Н2О
синтезируется 38 молекул АТФ
Слайд 24
I комплекс цепи тканевого дыхания –
НАДН ∙ Н+: KoQ- оксидоредуктаза
более
При работе комплекса используется свойство ФМН переносить по одному электрону. Основной путь переноса электронов:
Одновременно с переносом электронов комплекс транспортирует протоны из матрикса в межмембранное пространство (ММП). На каждые 2 электрона переносятся 4 протона.
Слайд 26II комплекс цепи тканевого дыхания –
сукцинат : убихиноноксидоредуктаза
(сукцинатедгидрогеназа)
состоит из
Первичным акцептором водорода является ФАД, ковалентно связанный с комплексом. Путь, по которому проходят электроны в комплексе:
Слайд 27
Комплекс II называют флавопротеином II (ФП2) т.к. на этом участке дыхательной
В состав перечисленных ФП входят ковалентно связанный ФАД и FeS - белки. ФП1 - это комплекс I, также передающий электроны KoQ, который становится, т.о., своеобразным коллектором всех электронов, поступающих в митохондрию из разных субстратов, и передает их комплексу III.
Слайд 29
2 компонента внутренней мембраны не связаны с комплексами структурно, но обеспечивают
Убихинон - хинон с длинной полиизопреновой цепью, состоящей из 10 изопреновых единиц (Q10!), обеспечивающей его растворимость в липидах.
Свободное перемещение по мембране и самая высокая молярная концентрация среди других переносчиков делают КоQ10 функционально значимым в механизмах транспорта электронов в митохондриях.
Подобно ФАД и ФМН, КоQ10 может принимать 1 (семихинон) и 2 (убихинол) электрона, что позволяет ему обеспечивать связь между переносчиками двух и одного электронов.
Слайд 30КоQ10 способен находиться в восстановленном или окисленном состоянии, в дыхательной цепи
Слайд 31
Цитохром с по величине редокс-потенциала располагается между III и IV комплексами
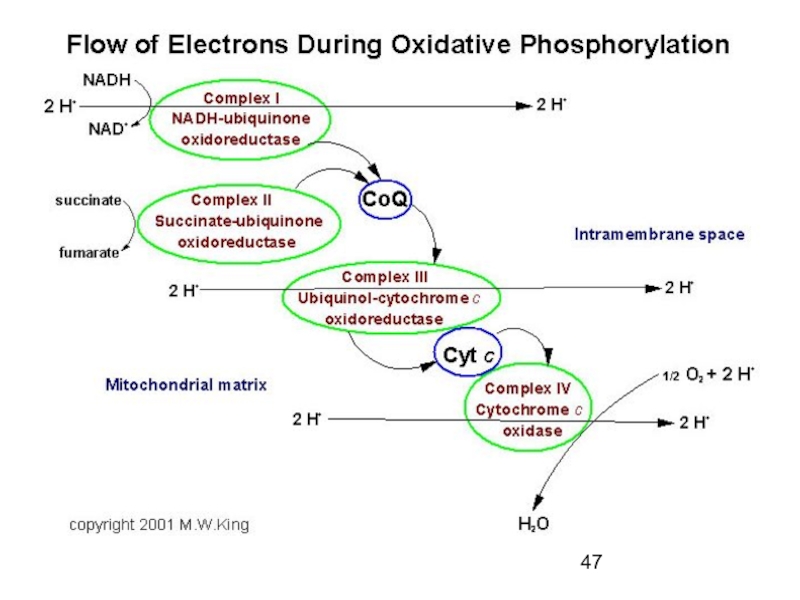
Т.о., по величине редокс - потенциала удается «выстроить» комплексы митохондрий в цепь переноса электронов от НАДН∙Н+ до О2, с которым взаимодействует IV комплекс.
Эта цепь ферментов получила название цепи ферментов митохондриального (тканевого) дыхания
Слайд 32III комплекс цепи тканевого дыхания – убихинол: цитохром с оксидоредуктаза (цитохром
в его состав входят два цитохрома b (bL и bH), цитохром с1, и FeS-белок. Суммарная реакция процессов, протекающих при участии комплекса III:
комплекс забирает электроны у KoQH2 и передает их цитохрому с. Т.к. цитохромы неспособны связывать протоны, 4 протона переносятся комплексом в межмембранное пространство.
Слайд 33ЦИТОХРОМЫ
выстроенные в дыхательную цепь в порядке возрастания окислительно-восстановительного потенциала гемопротеины, в
Ионы Fe+2(+3) в геме обратимо изменяют валентность получая или отдавая электроны.
Цитохромы b, с1, с, а и а3 играют наиболее важную роль процессах тканевого дыхания.
а3 - терминальный участок дыхательной цепи – цитохромоксидаза, окисляющая цитохром с и образование Н2О путём двухэлектронного восстановления одного атома кислорода - каждая молекула O2 одновременно взаимодействует с двумя электрон-транспортными цепями и при транспорте каждой пары электронов в матриксе митохондрий накапливается до 6 протонов.
Слайд 34IV комплекс дыхательной цепи - цитохром с-оксидаза
Получив электрон, цитохром с
У млекопитающих - это крупный (~200 кДа) трансмембранный белок из 6 – 13 субъединиц, некоторые из них кодируются митохондриальной ДНК. В его состав входят два хромопротеина - цитохром а и цитохром а3, два атома меди - СuA и СuB, связанные с белковыми частями цитохромов таким образом, что пространственно сближены с Fe порфиринов, с которыми они способны обмениваться электронами.
Слайд 35
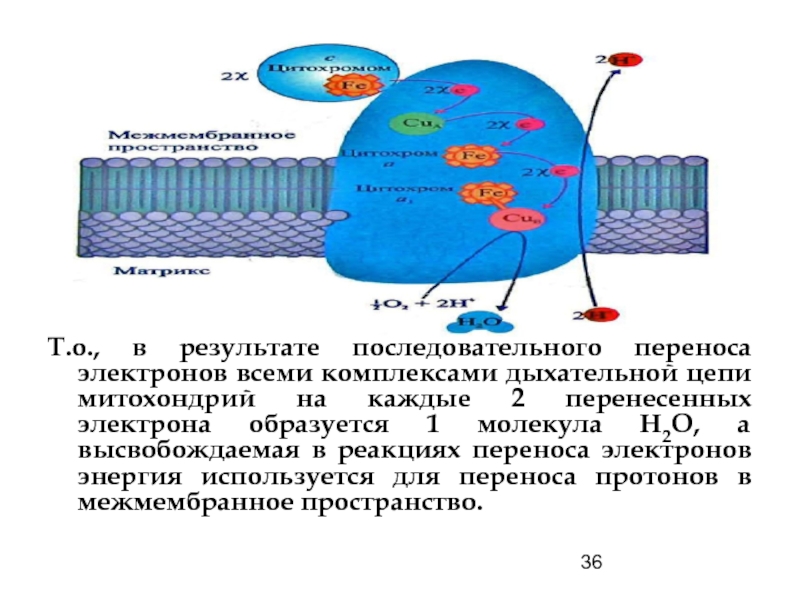
Цитохром с-оксидаза катализирует одноэлектронное окисление четырех восстановленных молекул цитохрома с, одновременно
Протоны для образования молекул Н2О поступают из матрикса. Цитохром с, переносящий по 1 электрону, вначале передает его СuA, а затем электрон переходит на цитохром а. Кислород взаимодействует с Fe цитохрома а3 после восстановления последнего. Комплекс IV переносит также в межмембранное пространство 2 протона на каждые 2 переносимых электрона.
Слайд 36
Т.о., в результате последовательного переноса электронов всеми комплексами дыхательной цепи митохондрий
Слайд 37Комплексы дыхательной цепи митохондрий, расположенные по величине редокс-потенциала
Общая величина энергии реакции
Слайд 38Образование молекулы Н2О сопровождается переносом 10 или 6 протонов в ММП
Место
Примечательна судьба водородов НАД+-зависимых дегидрогеназ, катализирующих окислительные реакции вне митохондрий. Так, большинство НАД+-зависимых дегидрогеназ, поставляющих водород I комплексу дыхательной цели, находятся в матриксе митохондрий - они катализируют реакции окисления в ЦТК (3 дегидрогеназы), окислительное декарбоксилирование ПК, окислительное дезаминирование Глу, окисление гидроксиацил-КоА и др.
Слайд 39
Комплексы дыхательной цепи содержат различные простетические группы - связанные с белками
флавин (ФМН или ФАД), в комплексах I и II;
железо-серные центры (в I, II и III) - содержат 2-6 ионов Fe, образующих комплексы с неорганическим сульфидом и SH-группами остатков Цис);
группы гема (в II, III и IV).
Слайд 42
Электроны поступают в дыхательную цепь различными путями:
при окислении НАДН+Н+ комплекс I
при окислении сукцината, ацил-КоА и др. субстратов они переносятся на КоQ комплексом II или митохондриальной сукцинатдегидрогеназой через связанный с ней ФАДН2 или флавопротеин - окисленный Ко Q восстанавливается, -
и переносит их в комплекс III, поставляющий их через 2 гема b1 Fe/S-центр и гем с1 на гемсодержащий белок цитохром с,-
переносящий их к комплексу IV - цитохром с-оксидазе, содержащей 2 Cu2+- cодержащих центра (A и B) и гемы а и а3, от которых электроны,-
поступают к О2 – при его восстановлении образуется основной анион О2-, связывающий 2 протона и переходящий в Н2О.
Слайд 43
Окисление НАДН комплексом I происходит на внутренней стороне мембраны и в
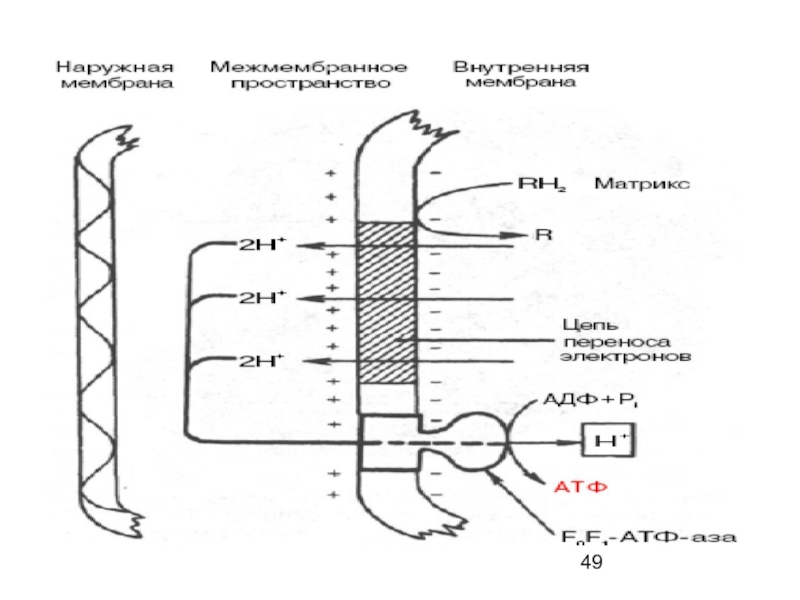
Перенос протонов комплексами I, III и IV реализуется векторно - из матрикса в межмембранное пространство.
Только АТФ-синтаза митохондрий реализует обратное движение протонов в матрикс.
Слайд 44ХЕМИОСМОТИЧЕСКАЯ КОНЦЕПЦИЯ
- превращения энергии в живых клетках выдвинута П. Митчеллом в
Движение электронов по дыхательной цепи - источник энергии для транслокации протонов через митохондриальную мембрану, а возникающая в результате этого разность электрохимических потенциалов (ΔμH+) приводит в действие АТФ-синтазу, катализирующую образование АТФ из АДФ и Рi:
АДФ + Рi = АТФ
Слайд 45ДЫХАТЕЛЬНЫЙ КОНТРОЛЬ
- механизм регуляции образования и потребления АТФ, основанный на сопряжении
В отсутствие АДФ АТФ-синтаза не в состоянии использовать протонный градиент на внутренней митохондриальной мембране, что ингибирует электронный перенос в дыхательной цепи и НАДН не может быть вновь окислен в НАД+.
Возникающее высокое соотношение НАДН/НАД+ ингибирует ЦТК и замедляет потребление субстратов, и, наоборот, активация потребления АТФ стимулирует усвоение пищи и дыхательную цепь.
Если создание протонного градиента подавлено, процессы окисления субстратов и переноса электронов протекают быстрее обычного, а вместо ресинтеза АТФ выделяется тепло.
Слайд 46РАЗОБЩАЮЩИЕ АГЕНТЫ
функционально разделяют окисление и фосфорилирование, без участия АТФ-синтазы, содействуя переносу
Разобщение возникает в результате повреждения внутренней мембраны, действия 2,4-динитрофенола - переносчика протонов через мембрану или природного соединения термогенина, разобщающего протонный канал в митохондриях бурых жировых клеток (источник теплообразования бурый жир обнаружен у новорожденных и животных, впадающих в зимнюю спячку, а при охлаждении организма норадреналин активирует гормонзависимую липазу. Благодаря интенсивному липолизу образуется большое количество свободных жирных кислот, которые распадаются в при β-окислении и в дыхательной цепи. Т.к. жирные кислоты при этом открывают протонный канал термогенина, их распад не зависит от наличия АДФ, т. е. протекает с максимальной скоростью и генерирует энергию в форме тепла)
Слайд 48Организация и функционирование
дыхательной цепи
Компоненты дыхательной цепи митохондрий в порядке убывания
Слайд 50ДЫХАТЕЛЬНЫЙ КОНТРОЛЬ
Известно, что при недостатке АДФ скорость аэробного дыхания тормозится (дыхательный
Д. Е. Аткинсон (1968) предложил характеризовать энергетическое состояние клетки количественно, вычисляя «заполнение» системы АТФ-АДФ-АМФ высокоэнергетическими фосфатными связями.
Если все содержащиеся в клетке аденозинфосфаты находятся в форме АТФ, то система энергетически заполнена до предела, т. е. ее энергетический заряд равен 1,0.
Если аденозинфосфаты находятся в форме АМФ, то система не содержит высокоэнергетических связей, она энергетически «пуста», ее заряд равен 0. Энергетический заряд системы ‘АТФ-АДФ-АМФ вычисляется по уравнению:
Слайд 51
От величины энергетического заряда зависят скорости реакций ЦТК и скорости
Например, у дрожжей уменьшение отношения АТФ/АМФ вызывает активацию ЦТК за счет активирования цитрат-синтазы и изоцитратдегидрогеназы. В тканях животных важную регуляторную роль выполняет отношение АТФ/АДФ.
Слайд 52
Система для исследования дыхания митохондрий in vitro - изменения количества О2
По Д.Чансу существует 5 состояний митохондрий, при которых скорость их дыхания ограничивается определенными факторами состояния дыхательного контроля:
Слайд 53
В покоящейся клетке митохондрии находятся в состоянии 4, при котором скорость
Во время работы митохондрии могут пребывать в состояниях 3 (исчерпываются возможности дыхательной цепи) или 5 (недостаток О2). Cкорость потребления О2 митохондриями контролируется концентрацией АДФ. Т.о. окисление и фосфорилирование – сопряженные процессы.
Слайд 54
Реакции дыхательной цепи сопряжены с реакциями аэробного фосфорилирования, которое in vitro
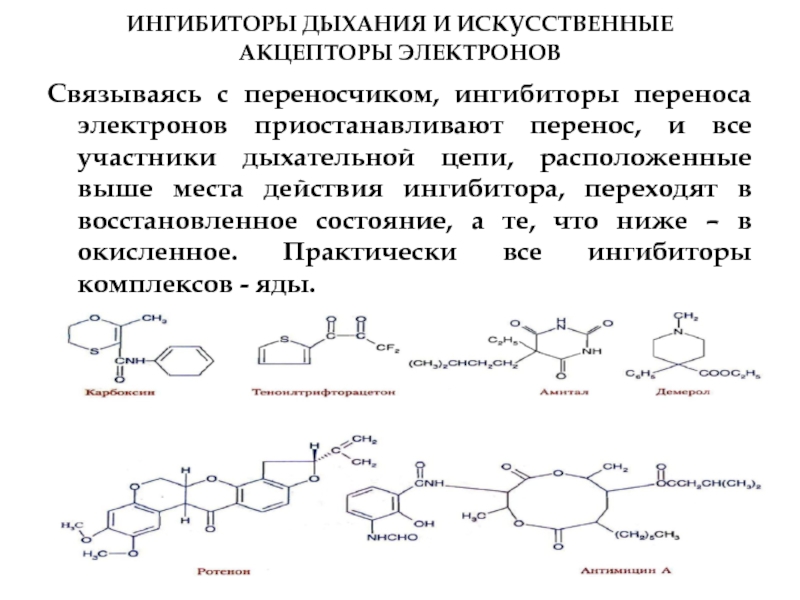
Слайд 55ИНГИБИТОРЫ ДЫХАНИЯ И ИСКУССТВЕННЫЕ АКЦЕПТОРЫ ЭЛЕКТРОНОВ
Связываясь с переносчиком, ингибиторы переноса
Слайд 56
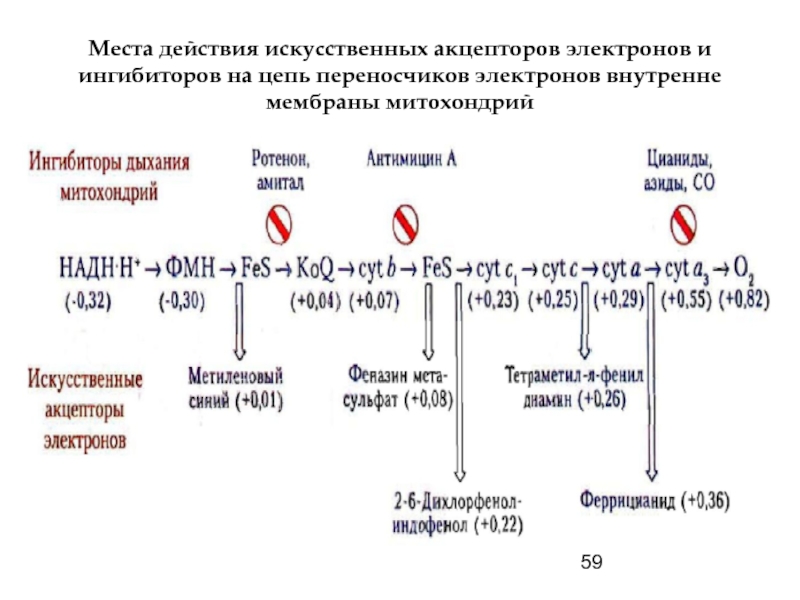
Ротенон - растительный яд, применяемый индейцами при ловле рыбы и используемый
Амитал - производное барбитуровой кислоты, антибиотик антимицин А, цианиды.
(ротенон н амитал тормозят перенос водорода от ФМН к убихинону; антимицин А - транспорт электронов от цитохрома b к цитохрому с1 (III комплекс); CN-, CO, H2S, HN3 - ингибиторы цитохромоксидазы, а карбоксин и теноилтрифторацетон - ингибиторы II комплекса).
Ингибитор синтеза АТФ - антибиотик олигомицин: он не влияет на окисление, но тормозит фосфорилирование и в его присутствии добавление АДФ не оказывает стимулирующего влияния на дыхание.
Слайд 57
При добавлении разобщителей окислительного фосфорилирования между последним и окислением нарушается сопряжение,
Разобщители имеют гидрофобный характер, хорошо растворимы в липидах и способны связывать протоны.
Используя искусственные акцепторы электронов, удается запустить перенос электронов выше действия ингибитора, а т.к. большинство таких акцепторов - окрашенные соединения, по изменению их цвета количественно оценивают скорость работы комплексов дыхательной цепи.
Слайд 59Места действия искусственных акцепторов электронов и ингибиторов на цепь переносчиков электронов
Слайд 60
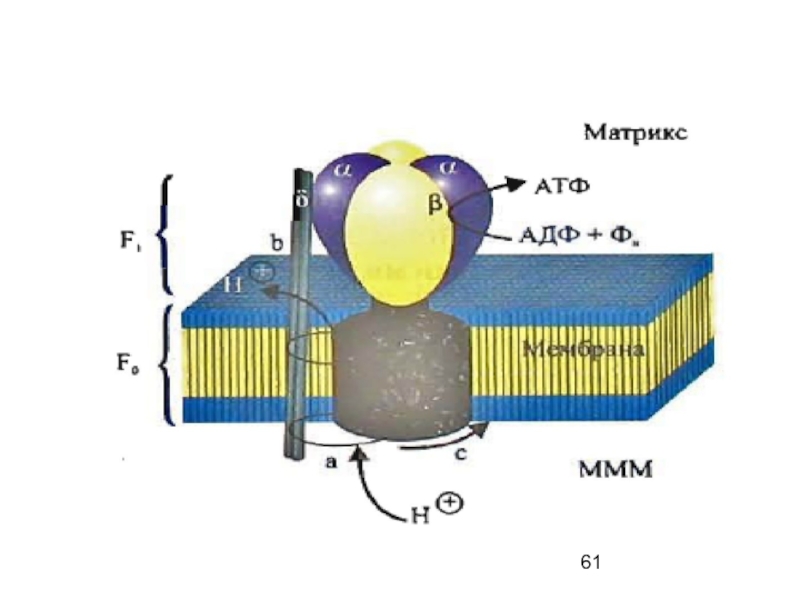
V комплекс внутренней мембраны обеспечивает возвращение протонов в матрикс и энергия
Нарушение целостности мембраны, затрудняющее создание градиента рН, препятствует и синтезу АТФ, а V комплекс, не поддерживаемый ∆рН, начинает выполнять функцию протонного насоса, перекачивающего протоны в ММП, используя энергию гидролиза АТФ и стремясь создать ∆рН, который снижается из-за нарушения целостности мембраны.
Слайд 62
Каждая из трех β-субъединиц может находиться в одном из трех конформационных
L - происходит связывание АДФ и Фн с активным центром;
Т - образуется АТФ;
О - ослабление связи с АТФ и ее высвобождение.
Основная движущая сила смены конформации каталитических субъединиц - перемещение по α-субъединице фрагмента Fo протонов из ММП в матрикс.
Слайд 63
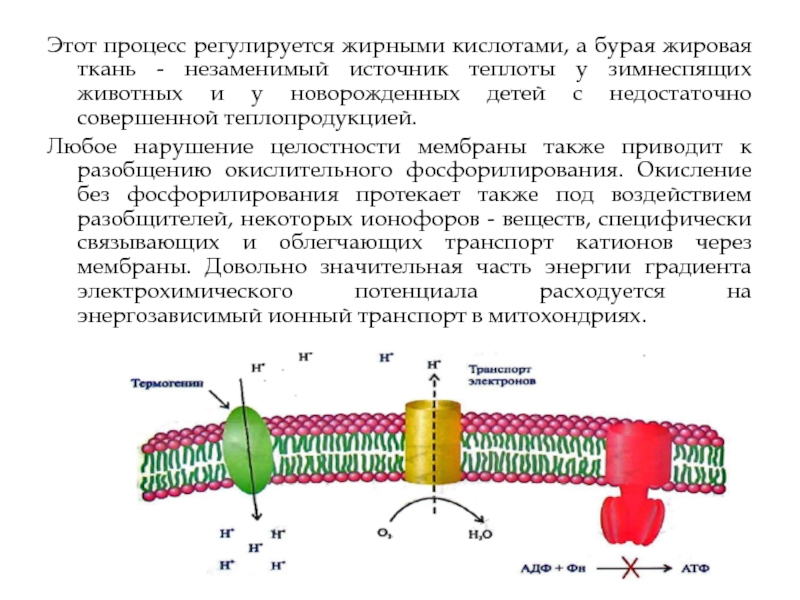
У человека и других млекопитающих существует специальная бурая жировая ткань, цвет
Особенность дыхания таких митохондрий, в структуре внутренней мембраны которых находится белок термогенин, выполняющий функцию протонного канала и снижающий генерируемый митохондриями градиент электрохимического потенциала, - несопряженное дыхание и вся продуцируемая ими энергия выделяется в виде теплоты.
Слайд 64
Этот процесс регулируется жирными кислотами, а бурая жировая ткань - незаменимый
Любое нарушение целостности мембраны также приводит к разобщению окислительного фосфорилирования. Окисление без фосфорилирования протекает также под воздействием разобщителей, некоторых ионофоров - веществ, специфически связывающих и облегчающих транспорт катионов через мембраны. Довольно значительная часть энергии градиента электрохимического потенциала расходуется на энергозависимый ионный транспорт в митохондриях.
Слайд 65РЕГУЛЯТОРНОЕ ТЕПЛООБРАЗОВАНИЕ
И СВОБОДНОЕ ОКИСЛЕНИЕ
В организме среднего взрослого человека в сутки
За это время не изменяются существенно ни масса тела, ни его структура и состав. Поэтому вся эта энергия, за исключением количества, которое потребовалось для выполнения физической работы, выделяется в виде тепла и необратимо рассеивается в окружающей среде, обеспечивая организм теплом, необходимым для поддержания температуры тела 37°С.
При помещении теплокровных животных усиливается теплообразование в мышцах, которое включает в себя несколько механизмов:
Сократительный термогенез - актомиозин гидролизует АТФ, скелетные мышцы сокращаются - начинается мышечная дрожь: скелетные мышцы наряду с сократительной функцией служат «отопительной системой».
Слайд 66ЭНЕРГЕТИКА МЫШЦ И ДРУГИХ СОКРАТИТЕЛЬНЫХ СТРУКТУР
В 1939г. В.Энгельгардт и М.Любимова обнаружили,
Слайд 67
Хотя непосредственным источником энергии работающей мышцы служит АТФ, ее содержание в
Запасными макроэргическими соединениями в мышцах млекопитающих является креатинфосфат, а у беспозвоночных - аргининфосфат. За счет высокоэнергетических связей этих соединений из АДФ в мышцах может образовываться АТФ.
Кроме процесса сокращения мышц актин как главный компонент микрофиламентов участвует в стабилизации и изменении формы клеток, в митозе, движении клеток (в частности, амебоидном), токах цитоплазмы, движении органелл, фагоцитозе, секреторной, активности, распределении белков в мембране и др.
Слайд 68
Актин содержится практически во всех эукариотических клетках, но особенно много
У большинства немышечных клеток, как и в мышечных волокнах, преобразователем энергии, обладающим АТФ-азной активностью, является миозин, близкий по структуре к мышечному.
Слайд 69
Содержание АТФ в мышцах относительно постоянно ~5 мМ на 1 кг
Мышцы не накапливают значимых количеств АТФ, но её концентрация не может быть ниже 2 мМ на 1 кг сырого веса ткани, т.к. при этом в саркоплазматическом ретикулуме перестанет действовать «Са2+-насос» и мышца будет сокращаться вплоть до полного исчерпания всех запасов АТФ и развития ритора (состояния стойкого непреходящего сокращения).
Слайд 70
В скелетных мышцах человека 3 вида анаробных процессов, в ходе которых
креатинфосфокиназная реакция (фосфогенный, алактатный анаэробный процесс) - ресинтез АТФ за счет трансфосфорилирования между креатинфосфатом и АДФ;
миокиназная реакция - ресинтез АТФ за счет дефосфорилирования части АДФ;
гликолиз (лактацидный анаэробный процесс) - ресинтез АТФ при ферментативном анаэробном расщеплении углеводов, заканчивающегося образованием молочной кислоты.
Слайд 71ИСТОЧНИКИ ЭНЕРГИИ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ
1. Ресинтез АТФ путём трансфосфорилирования АДФ с креатинфосфатом,
Это чрезвычайно быстрый и максимально эффективный путь ресинтеза АТФ (за счет каждой молекулы креатинфосфата образуется 1 молекула АТФ).
Слайд 722. Ресинтез АТФ в миокиназной (аденилаткиназной) реакции
- реализуется в мышцах при
Слайд 74
Мышцы - главные энергетические субстраты для них – глюкоза, жирные кислоты
В отличие от мозга, в мышцах запасается значимое количество гликогена (эквивалент – 5 000 kJ -1200 ккал) - аккумулируется ~75% всего гликогена человека, а его количество после потребления пищи может достигать в мышцах 1% от их массы.
Гликоген легко превращается в Гл-6-Ф. В мышцах, как и в мозге, нет Гл-6-Ф-азы, и поэтому они не могут экспортировать глюкозу, а накапливают её преимущественно для срочного получения энергии.
Слайд 75
В активно действующей скелетной мышце скорость гликолиза значимо превышает скорость ЦТК.
И т.о., по циклу Кори, метаболическая нагрузка мышц переносится в печень, пируват трансаминируется до глюконеогенного Ала, превращаемого в печени в глюкозу.
Слайд 76
В покое в мышцах ситуация другая: главными энергетическими субстратами становятся жирные
Для миокарда основными энергетическими субстратами могут стать кетоновые тела – сердце чаще использует ацетоацетат, чем глюкозу.
Слайд 77
Между интенсивно протекающими в мышечной и печеночной тканях гликолизом и глюконеогенезом
при высокой активности мышц и активации гликолиза образующийся в них избыток лактата диффундирует в кровь и в печень, где значимая его часть превращается в глюкозу (глюконеогенез) - пируват используется как энергетический субстрат для деятельности мышечной ткани.
Слайд 78МЕТАБОЛИЧЕСКАЯ РЕГУЛЯЦИЯ МЫШЕЧНОГО СОКРАЩЕНИЯ
I. Цикл Кори
В клетках, не содержащих митохондрий (в
Лактат переносится кровью в печень, где в процессе глюконеогенеза с затратой АТФ вновь конвертируется в глюкозу (цикл Кори).
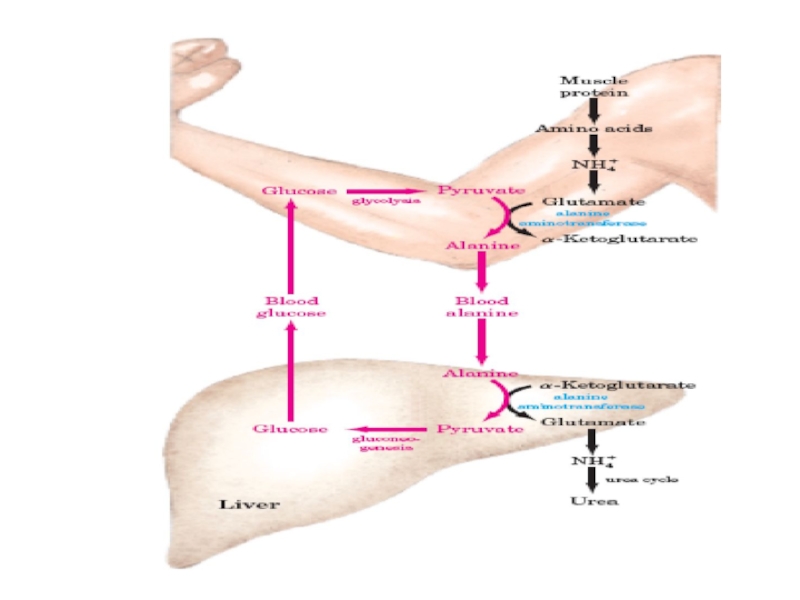
Слайд 80II.ГЛЮКОЗО-АЛАНИНОВЫЙ ЦИКЛ
Обратная связь, подобная циклу Кори, существует в цикле аланина, в
Образующиеся аминокислоты в результате трансаминирования превращаются в α-кетокислоты, которые в основном включаются в ЦТК.
Слайд 83БИОЭНЕРГЕТИКА МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ
Энергия для сокращения и расслабления мышц обеспечивается поступлением АТФ:
Небольшой
Анаэробное гликолитическое расщепление гликогена (гликолиз) достигает своего максимума через 40-50 с после начала мышечной работы.
Через 60-70 с включаются аэробные процессы образования (фосфорилирования) АТФ в митохондриях, расположенных вблизи саркомеров.
Лимитирующим фактором этого процесса является количество поставляемого О2.
Слайд 84
Аэробный путь ресинтеза АТФ приобретает значение при длительной и менее интенсивной
Содержание АТФ и креатинфосфата в сердечной мышце ниже, чем в скелетной мускулатуре, а расход АТФ велик.
Поэтому ресинтез АТФ в миокарде происходит намного интенсивнее, чем в скелетной мускулатуре.
Слайд 85
Для миокарда основным путем образования богатых энергией фосфорных соединений является путь
Регенерация АТФ в процессе анаэробного расщепления углеводов (гликолиз) в сердце человека практического значения не имеет и поэтому миокард очень чувствителен к недостатку О2.
Слайд 86
Характерной особенностью обмена веществ в миокарде по сравнению со скелетной мышцей
Только 30–35% поглощаемого сердцем О2, расходуется на окисление углеводов и продуктов их превращения.