- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Белок. Ферменты презентация
Содержание
- 1. Белок. Ферменты
- 2. СТРУКТУРА БЕЛКА Пептидные цепи содержат а/к
- 4. Первичная структура белка линейная последовательность а/к в
- 5. Вторичная структура белка Линейные цепи а\к приобретают
- 6. Вторичная структура белка регулярные структуры двух типов: α-спираль и β-структура.
- 7. α-Спираль пептид закручивается в виде спирали
- 8. β-Структура формируется за счёт образования водородных связей
- 10. Третичная структура белков трёхмерная пространственная структура образуетсяза
- 11. Гидрофобные взаимодействия гидрофобные радикалы аминокислот стремятся
- 12. Ионные связи могут возникать между отрицательно заряженными
- 13. Ковалентные связи Третичную структуру некоторых белков
- 14. Денатурация белков Гидрофобные взаимодействия, а также
- 15. Доменная структура белков Если полипептидная цепь
- 16. Четвертичная структура белков существуют белки, состоящие
- 18. Физико-химические свойства белков Индивидуальные белки различаются
- 19. Различия белков по форме молекул форме
- 20. Различия белков по молекулярной массе Белки
- 21. Суммарный заряд белков Белки имеют в
- 22. Соотношение полярных и неполярных групп на
- 23. Растворимость белков Растворимость белков в воде
- 24. Методы выделения и очистки белков Получение
- 25. Методы разрушения тканей и экстракции белков
- 26. Экстракция белков, связанных с мембранами, и
- 27. Удаление из раствора небелковых веществ Нуклеиновые
- 28. Гель-фильтрация, или метод молекулярных сит Для
- 29. Неподвижная фаза - жидкость внутри гранул,
- 30. Ультрацентрифугирование Метод разделения также основан на
- 31. Электрофорез белков Метод основан на
- 32. Каталитическая функция Ферменты (энзимы) – белки -
- 33. Фермент-субстратные реакции В участке связывания субстрат связывается
- 34. Катализ Схематично процесс катализа можно представить следующим
- 38. Специфичность наиболее важное свойство ферментов. субстратная
- 39. Специфичность Выделяют абсолютную субстратную специфичность (катализ 1
- 40. Каталитическая специфичность Фермент превращает субстрат по одному
- 42. Номенклатура и классификация ферментов В настоящее
- 43. Вещество, имеющее это окончание, принимают за
- 44. ферменты, катализирующие процессы гидролиза называют гидролазами,
- 45. Классы ферментов Оксидоредуктазы, катализирующие окисление или
- 47. Оксидазы. Акцептором электрона служит молекулярный кислород. Пример реакции, катализируемой цитохромоксидазой
- 48. Оксигеназы (гидроксилазы) - атом кислорода из молекулы кислорода присоединяется к субстрату. Пример реакции:
- 50. 2.Трансферазы, катализирующие перенос химических групп с одной
- 51. 3. Гидролазы катализирующие гидролиз химических связей. Пример: пепсин, трипсин, амилаза
- 52. Классы ферментов Лиазы, катализирующие разрыв химических связей
- 53. КОФАКТОРЫ И КОФЕРМЕНТЫ Большинство ферментов для
- 54. Регуляция работы ферментов Активность ферментов зависит от
- 55. Среди множества ферментов практически каждого метаболического
- 56. Основные способы регуляции активности ферментов Аллостерическая
- 57. Регуляция активности ферментов путем фосфорилирования—дефосфорилирования . Фермент изменяет активность в результате ковалентной модификации.
- 59. Активация ферментов путем частичного протеолиза. Некоторые ферменты
- 60. Ингибиторы ферментов Действие ферментов можно полностью
- 61. Взаимодействие аспирина с ферментом простагландинсинтетазой
- 62. Терапевтическое действие аспирина как жаропонижающего и противовоспалительного
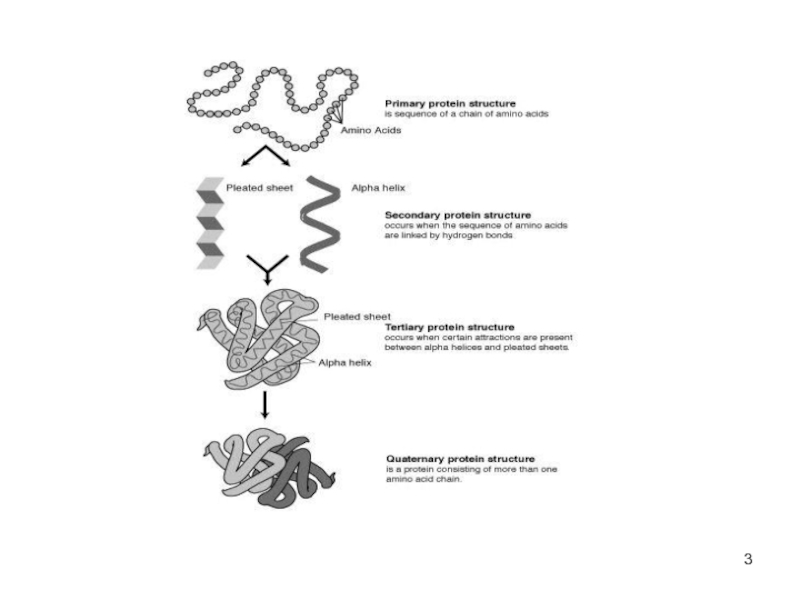
Слайд 2СТРУКТУРА БЕЛКА
Пептидные цепи содержат а/к остатки, соединены пептидными связями. (прочные,
разрыв - фермент)
Белок имеет определённую пространственную структуру, она определяет функции белка.
Различают 4 уровня структурной организации белков
Белок имеет определённую пространственную структуру, она определяет функции белка.
Различают 4 уровня структурной организации белков
Слайд 4Первичная структура белка
линейная последовательность а/к в полипептидной цепи
первичная структура каждого белка
закодирована в одном гене
Слайд 5Вторичная структура белка
Линейные цепи а\к приобретают пространственную трёхмерную структуру -"конформацию".
образуется
за счёт взаимодействия функциональных групп аминокислот
обусловлена первичной структурой белка.
обусловлена первичной структурой белка.
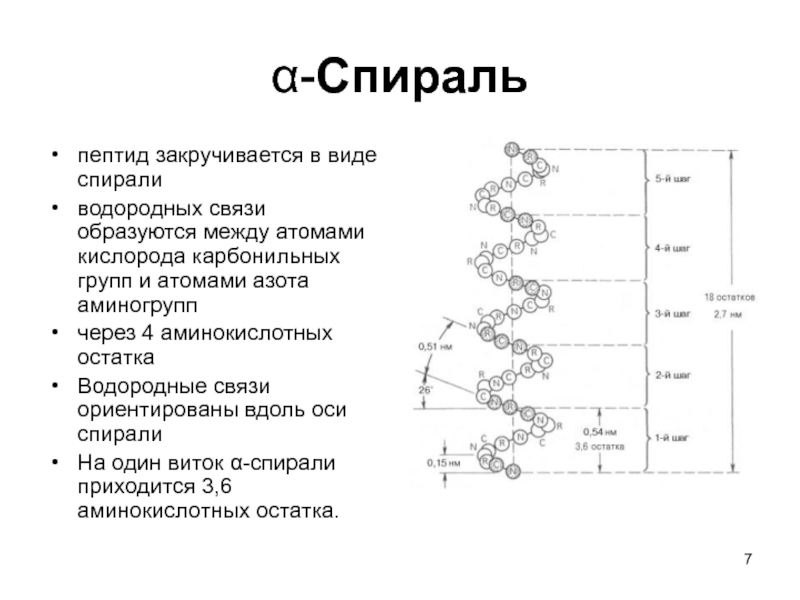
Слайд 7α-Спираль
пептид закручивается в виде спирали
водородных связи образуются между атомами
кислорода карбонильных групп и атомами азота аминогрупп
через 4 аминокислотных остатка
Водородные связи ориентированы вдоль оси спирали
На один виток α-спирали приходится 3,6 аминокислотных остатка.
через 4 аминокислотных остатка
Водородные связи ориентированы вдоль оси спирали
На один виток α-спирали приходится 3,6 аминокислотных остатка.
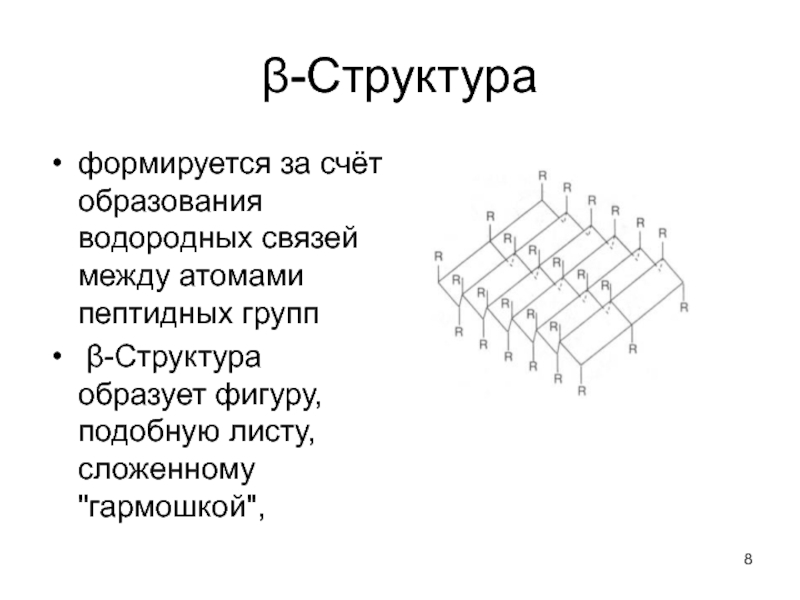
Слайд 8β-Структура
формируется за счёт образования водородных связей между атомами пептидных групп
β-Структура образует фигуру, подобную листу, сложенному "гармошкой",
Слайд 10Третичная структура белков
трёхмерная пространственная структура
образуетсяза счёт взаимодействий между радикалами аминокислот, стоящих
на значительном расстоянии друг от друга в цепи
функционально активная конформация - "нативная структура".
функционально активная конформация - "нативная структура".
Слайд 11Гидрофобные взаимодействия
гидрофобные радикалы аминокислот стремятся к объединению
внутри белковой глобулы
формируется гидрофобное ядро
гидрофильные радикалы а/к стремятся образовать водородные связи с водой и поэтому в основном располагаются на поверхности белковой молекулы.
гидрофильные радикалы а/к стремятся образовать водородные связи с водой и поэтому в основном располагаются на поверхности белковой молекулы.
Слайд 12Ионные связи
могут возникать между отрицательно заряженными (анионными) карбоксильными группами радикалов асп
и глу кислот и положительно заряженными (катионными) группами радикалов лизина, аргинина или гистидина
Слайд 13Ковалентные связи
Третичную структуру некоторых белков стабилизируют дисульфидные связи, образующиеся за
счёт взаимодействия SH-групп двух остатков цистеина.
могут находиться далеко друг от друга в линейной молекуле, но сближаются и образуют ковалентную связь
могут находиться далеко друг от друга в линейной молекуле, но сближаются и образуют ковалентную связь
Слайд 14Денатурация белков
Гидрофобные взаимодействия, а также ионные и водородные связи относят
к числу слабых
Разрыв большого количества слабых связей (t, хим. реакции и т.п.) к разрушению нативной конформации белка
утрата специфической функции белков
Разрыв большого количества слабых связей (t, хим. реакции и т.п.) к разрушению нативной конформации белка
утрата специфической функции белков
Слайд 15Доменная структура белков
Если полипептидная цепь белка содержит более 200 аминокислот,
как правило, её пространственная структура сформирована в виде двух или более доменов.
Домен - участок полипептидной цепи, который в процессе формирования пространственной структуры приобрёл независимо от других участков той же цепи конформацию глобулярного белка.
Домен - участок полипептидной цепи, который в процессе формирования пространственной структуры приобрёл независимо от других участков той же цепи конформацию глобулярного белка.
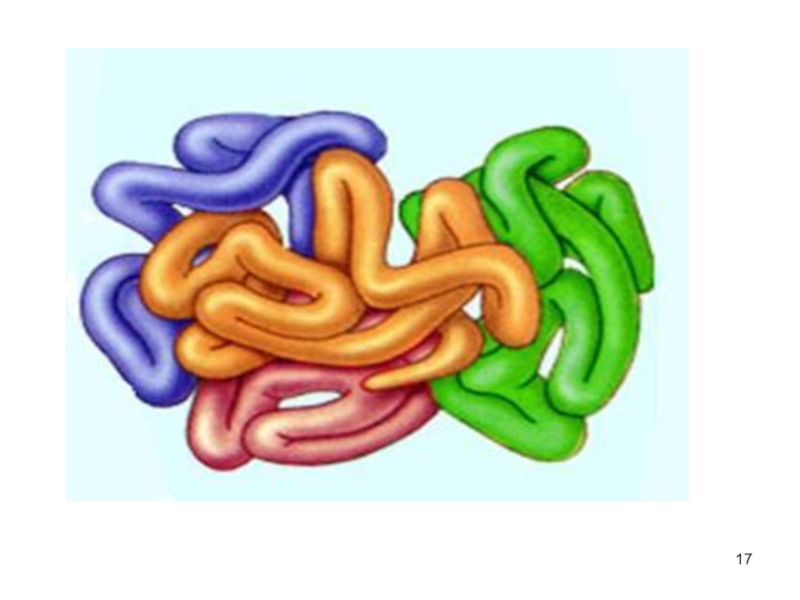
Слайд 16Четвертичная структура белков
существуют белки, состоящие из двух и более полипептидных
цепей
после формирования трёхмерной структуры каждой полипептидной цепи они объединяются
связи, соединяющие полипептидные цепи: гидрофобные, ионные, водородные
отдельные полипептидные цепи - субъединицы
после формирования трёхмерной структуры каждой полипептидной цепи они объединяются
связи, соединяющие полипептидные цепи: гидрофобные, ионные, водородные
отдельные полипептидные цепи - субъединицы
Слайд 18Физико-химические свойства белков
Индивидуальные белки различаются по своим физико-химическим свойствам: форме
молекул, молекулярной массе, суммарному заряду молекулы, соотношению полярных и неполярных групп на поверхности нативной молекулы белка, растворимости белков, а также степени устойчивости к воздействию денатурирующих агентов
Слайд 19Различия белков по форме молекул
форме молекул белки делят на глобулярные
и фибриллярные.
Глобулярные белки имеют более компактную структуру, их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма, чем фибриллярные белки (исключение составляют мембранные белки).
Глобулярные белки имеют более компактную структуру, их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма, чем фибриллярные белки (исключение составляют мембранные белки).
Слайд 20Различия белков по молекулярной массе
Белки - высокомолекулярные соединения, но могут
сильно отличаться по молекулярной массе, которая колеблется от 6000 до 1 000 000 Д и выше.
Молекулярная масса белка зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков - и от количества входящих в него протомеров (или субъединиц).
Молекулярная масса белка зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков - и от количества входящих в него протомеров (или субъединиц).
Слайд 21Суммарный заряд белков
Белки имеют в своём составе радикалы лизина, аргинина,
гистидина, глутаминовой и аспарагиновой кислот, содержащие функциональные группы, способные к ионизации (ионогенные группы). Кроме того, на N- и С-концах полипептидных цепей имеются α-амино- и α-карбоксильная группы, также способные к ионизации. Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов Глу и Асп и катионных радикалов Лиз, Apr и Гис.
Слайд 22
Соотношение полярных и неполярных
групп на поверхности нативных молекул
белков
На поверхности большинства внутриклеточных
белков преобладают полярные радикалы, однако соотношение полярных и неполярных групп отлично для разных индивидуальных белков. Так, протомеры олигомерных белков в области контактов друг с другом часто содержат гидрофобные радикалы. Поверхности белков, функционирующих в составе мембран или прикрепляющиеся к ним в процессе функционирования, также обогащены гидрофобными радикалами. Такие белки лучше растворимы в липидах, чем в воде.
Слайд 23Растворимость белков
Растворимость белков в воде зависит от всех перечисленных выше
свойств белков: формы, молекулярной массы, величины заряда, соотношения полярных и неполярных функциональных групп на поверхности белка. Кроме этого, растворимость белка определяется составом растворителя, т.е. наличием в растворе других растворённых веществ.
Например, некоторые белки легче растворяются в слабом солевом растворе, чем в дистиллированной воде. С другой стороны, увеличение концентрации нейтральных солей может способствовать вьшадению определённых белков в осадок. Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков.
Например, некоторые белки легче растворяются в слабом солевом растворе, чем в дистиллированной воде. С другой стороны, увеличение концентрации нейтральных солей может способствовать вьшадению определённых белков в осадок. Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков.
Слайд 24Методы выделения и очистки белков
Получение индивидуальных белков из биологического материала
(тканей, органов, клеточных культур) требует проведения последовательных операций, включающих:
дробление биологического материала и разрушение клеточных мембран;
фракционирование органелл, содержащих те или иные белки;
экстракцию белков (перевод их в растворённое состояние);
разделение смеси белков на индивидуальные белки.
дробление биологического материала и разрушение клеточных мембран;
фракционирование органелл, содержащих те или иные белки;
экстракцию белков (перевод их в растворённое состояние);
разделение смеси белков на индивидуальные белки.
Слайд 25Методы разрушения тканей
и экстракции белков
Для разрушения биологического материала используют методы:
гомогенизации ткани, метод попеременного замораживания и оттаивания, а также обработку клеток ультразвуком.
Слайд 26
Экстракция белков, связанных с мембранами, и разрушение олигомерных белков на протомеры
Если искомый белок прочно связан с какими-либо структурами клетки, его необходимо перевести в раствор. Так, для разрушения гидрофобных взаимодействий между белками и липидами мембран в раствор добавляют детергенты; чаще всего используют тритон Х-100 или додецилсульфат натрия.
При действии детергентов обычно разрушаются и гидрофобные взаимодействия между протомерами в олигомерных белках.
Слайд 27Удаление из раствора небелковых веществ
Нуклеиновые кислоты, липиды и другие небелковые вещества
можно удалить из раствора, используя их Особенные физико-химические свойства. Так, липиды легко удаляются из раствора добавлением органических растворителей, например ацетона. Однако воздействие должно быть кратковременным, так как ацетон вызывает денатурацию некоторых белков. Нуклеиновые кислоты осаждают добавлением в раствор стрептомицина.
Слайд 28Гель-фильтрация, или метод молекулярных сит
Для разделения белков часто используют хроматографические методы,
основанные на распределении веществ между двумя фазами, одна из которых подвижная, а другая неподвижная. В основу хроматографических методов положены разные принципы: гель-фильтрации, ионного обмена, адсорбции, биологического сродства.
Метод разделения белков с помощью гель-фильтрационной хроматографии основан на том, что вещества, отличающиеся молекулярной массой, по-разному распределяются между неподвижной и подвижной фазами. Хроматографическая колонка заполняется гранулами пористого вещества (сефадекс, агароза и др.). В структуре полисахарида образуются поперечные связи и формируются гранулы с "порами", через которые легко проходят вода и низкомолекулярные вещества. В зависимости от условий можно формировать гранулы с разной величиной "пор".
Метод разделения белков с помощью гель-фильтрационной хроматографии основан на том, что вещества, отличающиеся молекулярной массой, по-разному распределяются между неподвижной и подвижной фазами. Хроматографическая колонка заполняется гранулами пористого вещества (сефадекс, агароза и др.). В структуре полисахарида образуются поперечные связи и формируются гранулы с "порами", через которые легко проходят вода и низкомолекулярные вещества. В зависимости от условий можно формировать гранулы с разной величиной "пор".
Слайд 29
Неподвижная фаза - жидкость внутри гранул, в которую способны проникать низкомолекулярные
вещества и белки с небольшой молекулярной массой. Смесь белков, нанесённую на хроматографическую колонку, вымывают (элюируют), пропуская через колонку растворитель. Вместе с фронтом растворителя движутся и самые крупные молекулы.
Более мелкие молекулы диффундируют внутрь гранул сефадекса и на некоторое время попадают в неподвижную фазу, в результате чего их движение задерживается. Величина пор определяет размер молекул, способных проникать внутрь гранул
Так как гелевая структура сефадекса легко деформируется под давлением, гели стали заменять более жёсткими матрицами (сефактил, той-оперл), представляющими сферические гранулы с разными размерами пор. Выбор размеров пор в гранулах зависит от целей хроматографии
Более мелкие молекулы диффундируют внутрь гранул сефадекса и на некоторое время попадают в неподвижную фазу, в результате чего их движение задерживается. Величина пор определяет размер молекул, способных проникать внутрь гранул
Так как гелевая структура сефадекса легко деформируется под давлением, гели стали заменять более жёсткими матрицами (сефактил, той-оперл), представляющими сферические гранулы с разными размерами пор. Выбор размеров пор в гранулах зависит от целей хроматографии
Слайд 30Ультрацентрифугирование
Метод разделения также основан на различии в молекулярных массах белков. Скорость
седиментации веществ в процессе вращения в ультрацентрифуге, где центробежное ускорение достигает 100 000-500 000 g, пропорционально их молекулярной массе.
На поверхность буферного раствора, помещённого в кювету, наносят тонкий слой смеси белков. Кювету помещают в ротор ультрацентрифуги. При вращении ротора в течение 10-12 ч более крупные молекулы (с большей молекулярной массой) оседают в буферном растворе с большей скоростью.
В результате в кювете происходит расслоение смеси белков на отдельные фракции с разной молекулярной массой (рис. 1-56). После расслоения белковых фракций дно кюветы прокаливают иглой и по каплям собирают содержимое небольшими порциями в пробирки.
На поверхность буферного раствора, помещённого в кювету, наносят тонкий слой смеси белков. Кювету помещают в ротор ультрацентрифуги. При вращении ротора в течение 10-12 ч более крупные молекулы (с большей молекулярной массой) оседают в буферном растворе с большей скоростью.
В результате в кювете происходит расслоение смеси белков на отдельные фракции с разной молекулярной массой (рис. 1-56). После расслоения белковых фракций дно кюветы прокаливают иглой и по каплям собирают содержимое небольшими порциями в пробирки.
Слайд 31Электрофорез белков
Метод основан на том, что при определённом значении рН
и ионной силы раствора белки двигаются в электрическом поле со скоростью, пропорциональной их суммарному заряду. Белки, имеющие суммарный отрицательный заряд, двигаются к аноду (+), а положительно заряженные белки - к катоду (-).
Электрофорез проводят на различных носителях: бумаге, крахмальном геле, полиакриламидном геле и др. В отличие от электрофореза на бумаге, где скорость движения белков пропорциональна только их суммарному заряду, в полиакриламидном геле скорость движения белков пропорциональна их молекулярным массам.
Разрешающая способность электрофореза в полиакриламидном геле выше, чем на бумаге.
Электрофорез проводят на различных носителях: бумаге, крахмальном геле, полиакриламидном геле и др. В отличие от электрофореза на бумаге, где скорость движения белков пропорциональна только их суммарному заряду, в полиакриламидном геле скорость движения белков пропорциональна их молекулярным массам.
Разрешающая способность электрофореза в полиакриламидном геле выше, чем на бумаге.
Слайд 32Каталитическая функция
Ферменты (энзимы) – белки - увеличивают скорость протекания химической реакции,
при этом не расходуются
биологическая функция фермента обусловлена наличием в его структуре активного центра (АЦ)
в АЦ фермента есть участки связывания субстрата, и участки химического превращения субстрата (каталитический участок).
биологическая функция фермента обусловлена наличием в его структуре активного центра (АЦ)
в АЦ фермента есть участки связывания субстрата, и участки химического превращения субстрата (каталитический участок).
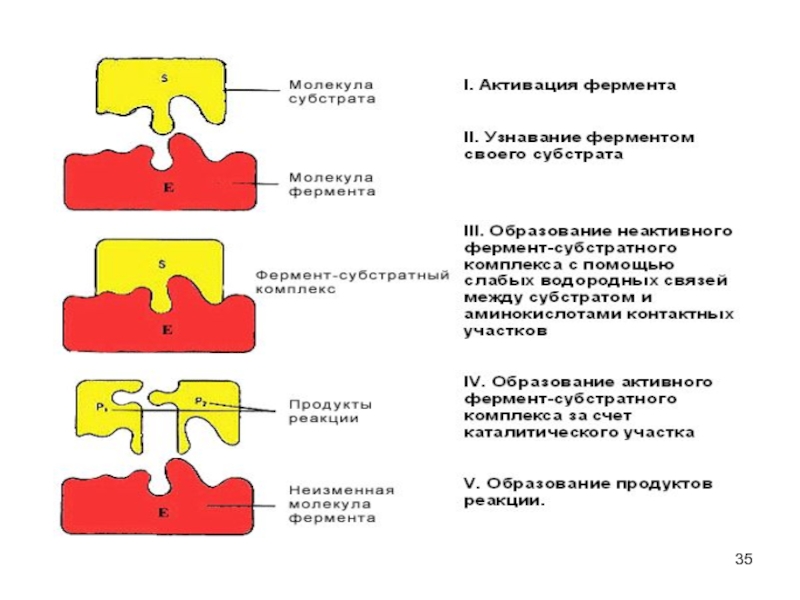
Слайд 33Фермент-субстратные реакции
В участке связывания субстрат связывается с ферментом - фермент-субстратный комплекс.
В каталитическом участке субстрат превращается в продукт
продукт отщепляется от активного центра фермента.
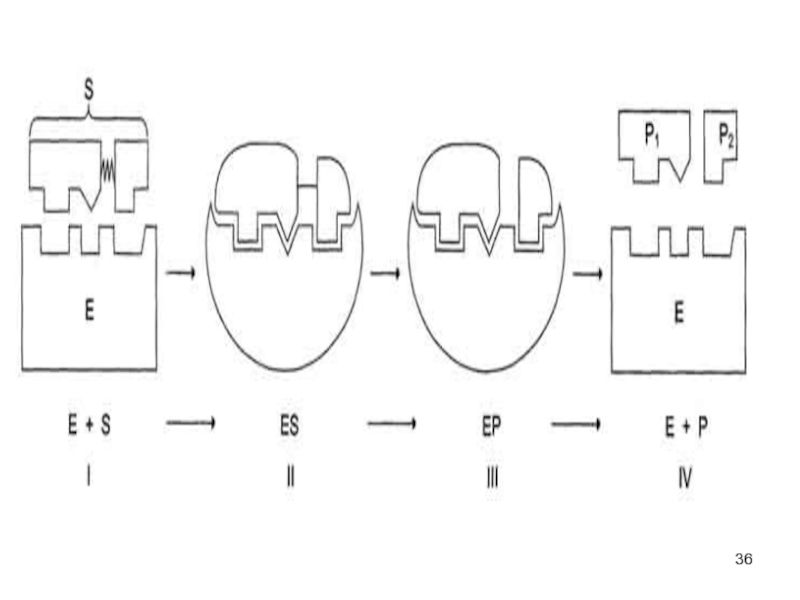
Слайд 34Катализ
Схематично процесс катализа можно представить следующим уравнением:
Е + S ↔
ES ↔ ЕР ↔ Е + Р,
где Е - фермент (энзим), S - субстрат, Р - продукт.
где Е - фермент (энзим), S - субстрат, Р - продукт.
Слайд 38Специфичность
наиболее важное свойство ферментов.
субстратная сп.- способность фермента взаимодействовать лишь с
одним или несколькими определёнными субстратами.
Слайд 39Специфичность
Выделяют
абсолютную субстратную специфичность (катализ 1 субстрата) - аргиназа;
групповую субстратную специфичность
однотипные реакции с группой структурно похожих субстратов - панкреатическая липаза ;
стереоспецифичность специфичность ферментов к стереоизомерам (L-аминокислотам )
стереоспецифичность специфичность ферментов к стереоизомерам (L-аминокислотам )
Слайд 40Каталитическая специфичность
Фермент превращает субстрат по одному из возможных путей его превращения
Зависит
от строения каталитического участка активного центра фермента
глюкозо-6-фосфат в клетках печени человека - субстрат 4 различных ферментов; фосфоглюкомутазы, глюкозо-6-фосфатфосфатазы, фосфоглюкоизомеразы и глюкозо-6-фосфатдегидрогеназы
глюкозо-6-фосфат в клетках печени человека - субстрат 4 различных ферментов; фосфоглюкомутазы, глюкозо-6-фосфатфосфатазы, фосфоглюкоизомеразы и глюкозо-6-фосфатдегидрогеназы
Слайд 42Номенклатура и классификация ферментов
В настоящее время известно более 2400 ферментов. Каждый
фермент, как правило, имеет две номенклатуры; одна из них рабочая (тривиальная), а другая - систематическая.
Рабочее наименоваие фермента составляют путем прибавления к корню слова латинского , греческого или химического названия субстрата, на который действует фермент, или к названию процесса, катализируемого данным ферментом окончания “-аза”.
Рабочее наименоваие фермента составляют путем прибавления к корню слова латинского , греческого или химического названия субстрата, на который действует фермент, или к названию процесса, катализируемого данным ферментом окончания “-аза”.
Слайд 43
Вещество, имеющее это окончание, принимают за фермент. Ферменты, действующие на крахмал
(amylum), сахарозу, мочевину (urea), пептиды получили соответственно названия : амилаза, сахараза, уреаза, пептидаза;
В названии ряда ферментов указывают как характер субстрата, так и тип катализируемой реакции. Фермент, катализирующий отнятие водорода от спирта, называют алкогольдегирогеназа.
Рабочим названием ферментов пользуются в повседневной практике.
В названии ряда ферментов указывают как характер субстрата, так и тип катализируемой реакции. Фермент, катализирующий отнятие водорода от спирта, называют алкогольдегирогеназа.
Рабочим названием ферментов пользуются в повседневной практике.
Слайд 44
ферменты, катализирующие процессы гидролиза называют гидролазами, процессы окисления - оксидазами, перенос
групп - трнсферазами и т.д. Для некоторых ферментов сохранены названия, неподчиняющиеся этому правилу: пепсин, трипсин, химотрипсин папин и др.
Слайд 45Классы ферментов
Оксидоредуктазы, катализирующие окисление или восстановление - алкогольдегидрогеназа
Дегидрогеназы. В этот подкласс
входят ферменты, катализирующие реакции дегидрирования (отщепления водорода). В качестве акцепторов электронов используются коферменты NAD+, NADP+, FAD, FMN . Все ферменты этой группы обладают высокой субстратной специфичностью.
Слайд 47
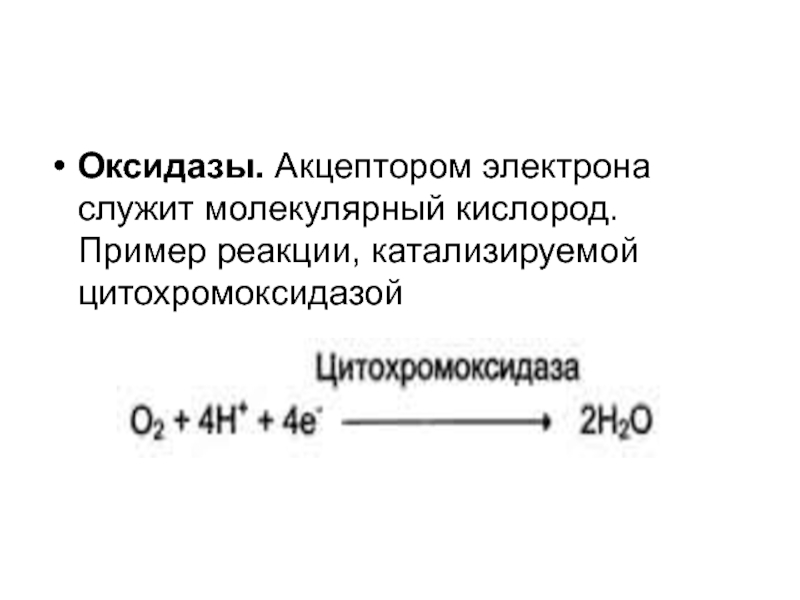
Оксидазы. Акцептором электрона служит молекулярный кислород. Пример реакции, катализируемой цитохромоксидазой
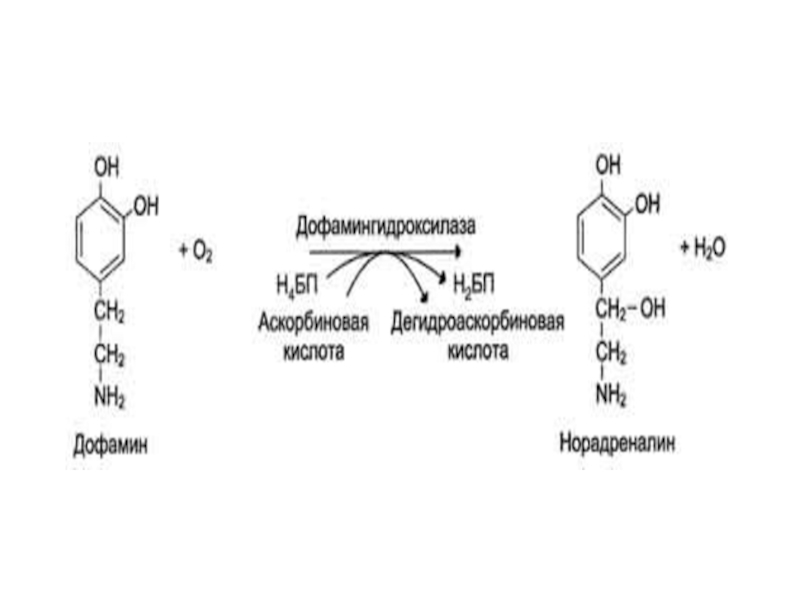
Слайд 48Оксигеназы (гидроксилазы)
- атом кислорода из молекулы кислорода присоединяется к субстрату. Пример
реакции:
Слайд 502.Трансферазы,
катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз выделяют киназы,
переносящие фосфатную группу с молекулы АТФ.
Слайд 52Классы ферментов
Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в
одном из продуктов.
Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата.
Лигазы, катализирующие образование химических связей между субстратами за счет гидролиза АТФ. - ДНК-полимераза
Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата.
Лигазы, катализирующие образование химических связей между субстратами за счет гидролиза АТФ. - ДНК-полимераза
Слайд 53КОФАКТОРЫ И КОФЕРМЕНТЫ
Большинство ферментов для активности нуждается в:
низкомолекулярных органических
соединениях небелковой природы (коферментах)
и/или в ионах металлов (кофакторах) Zn2+, Mg2+, Mn2+, Fe2+, Cu2+, K+, Na+ .
и/или в ионах металлов (кофакторах) Zn2+, Mg2+, Mn2+, Fe2+, Cu2+, K+, Na+ .
Слайд 54Регуляция работы ферментов
Активность ферментов зависит от количества:
молекул субстрата
продукта
наличия кофакторов и коферментов.
Каскад : продукт одной ферментативной реакции является субстратом другой, образуя таким образом "метаболические пути".
Слайд 55
Среди множества ферментов практически каждого метаболического пути различают ключевые, или регуляторные,
ферменты, активность которых может изменяться в зависимости от потребности клетки в конечном продукте метаболического пути.
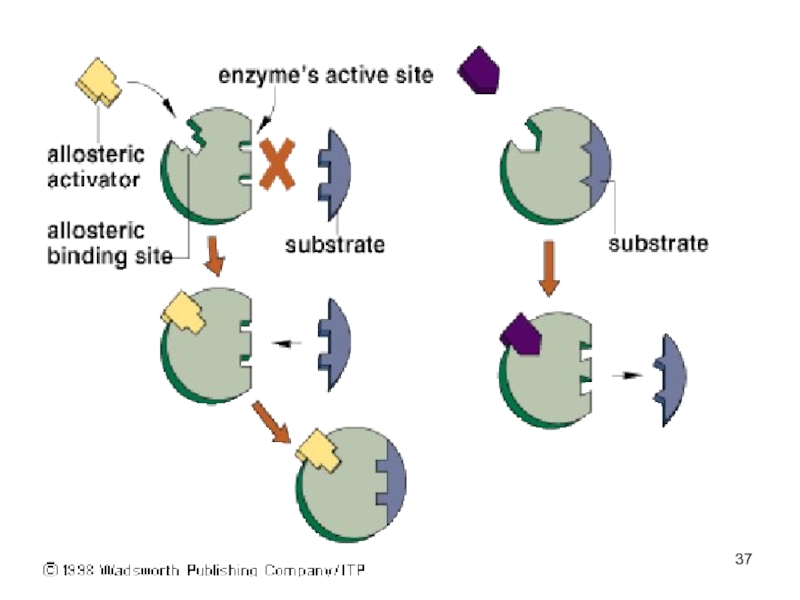
Слайд 56Основные способы регуляции активности ферментов
Аллостерическая регуляция.
Фермент изменяет активность с
помощью нековалентно связанного с ним эффектора.
Связывание происходит в участке, пространственно удаленном от активного (каталитического) центра
Это связывание вызывает конформационные изменения в молекуле белка, приводящие к изменению определенной геометрии каталитического центра.
Активность может увеличиться — это активация фермента, или уменьшиться — это ингибирование.
Связывание происходит в участке, пространственно удаленном от активного (каталитического) центра
Это связывание вызывает конформационные изменения в молекуле белка, приводящие к изменению определенной геометрии каталитического центра.
Активность может увеличиться — это активация фермента, или уменьшиться — это ингибирование.
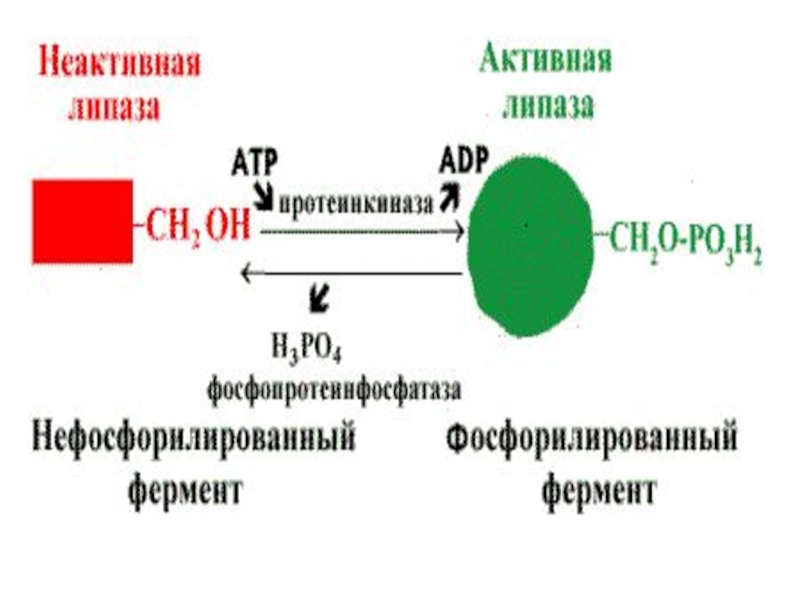
Слайд 57Регуляция активности ферментов путем фосфорилирования—дефосфорилирования .
Фермент изменяет активность в результате ковалентной
модификации.
Слайд 59Активация ферментов путем частичного протеолиза.
Некоторые ферменты синтезируются первоначально неактивными и лишь
после секреции из клетки переходят в активную форму.
Неактивный предшественник называется проферментом.
Активация профермента включает модификацию первичной структуры с одновременным изменением конформации.
Например, трипсиноген, синтезированный в поджелудочной железе, затем в кишечнике превращается в трипсин путем удаления фрагмента с N—конца
Неактивный предшественник называется проферментом.
Активация профермента включает модификацию первичной структуры с одновременным изменением конформации.
Например, трипсиноген, синтезированный в поджелудочной железе, затем в кишечнике превращается в трипсин путем удаления фрагмента с N—конца
Слайд 60Ингибиторы ферментов
Действие ферментов можно полностью или частично подавить (ингибировать) химическими
веществами (ингибиторами).
По характеру действия ингибиторы могут быть обратимыми и необратимыми. - прочность соединения ингибитора с ферментом.
По характеру действия ингибиторы могут быть обратимыми и необратимыми. - прочность соединения ингибитора с ферментом.
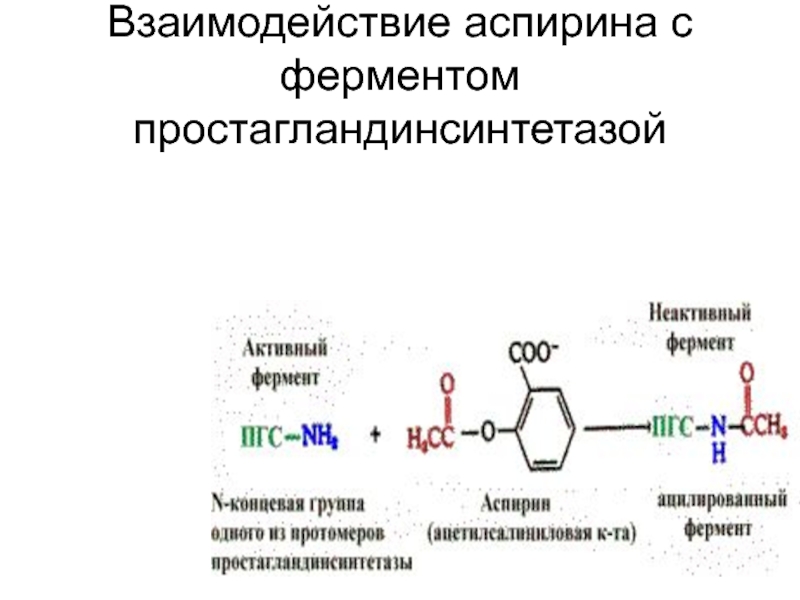
Слайд 62Терапевтическое действие аспирина
как жаропонижающего и противовоспалительного средства
аспирин ингибирует один
из ферментов, катализирующий синтез простагландинов (ПГ). Простагландины — вещества, участвующие в развитии воспаления.
Ингибирование обусловлено ковалентной модификацией одной из аминогрупп фермента — простагландинсинтетазы.
Ингибирование обусловлено ковалентной модификацией одной из аминогрупп фермента — простагландинсинтетазы.