- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Белковый обмен презентация
Содержание
- 1. Белковый обмен
- 2. Функции белков - ферментативная - структурообразовательная - защитная (иммунная) - опорная - сократительная
- 3. Функции белков - регуляторная (гормоны,
- 4. Нормы белка в питании Для взрослых
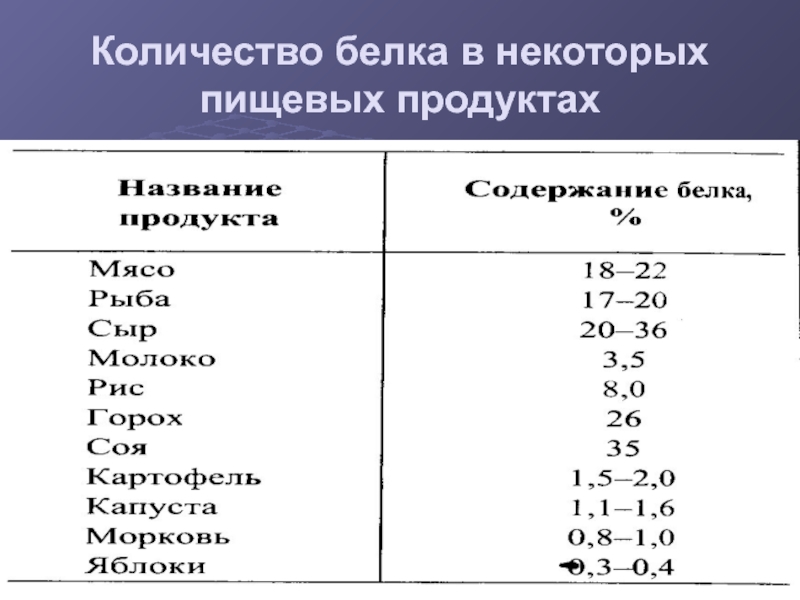
- 5. Количество белка в некоторых пищевых продуктах
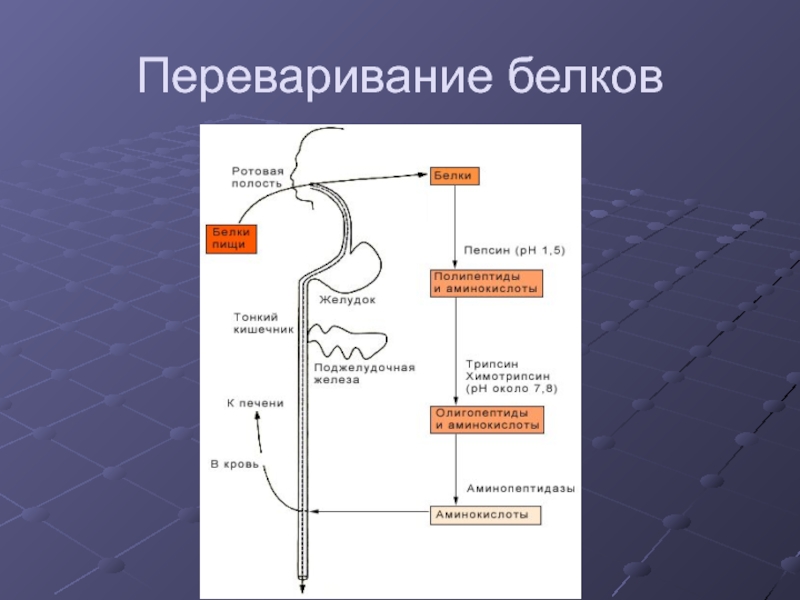
- 6. Переваривание белков
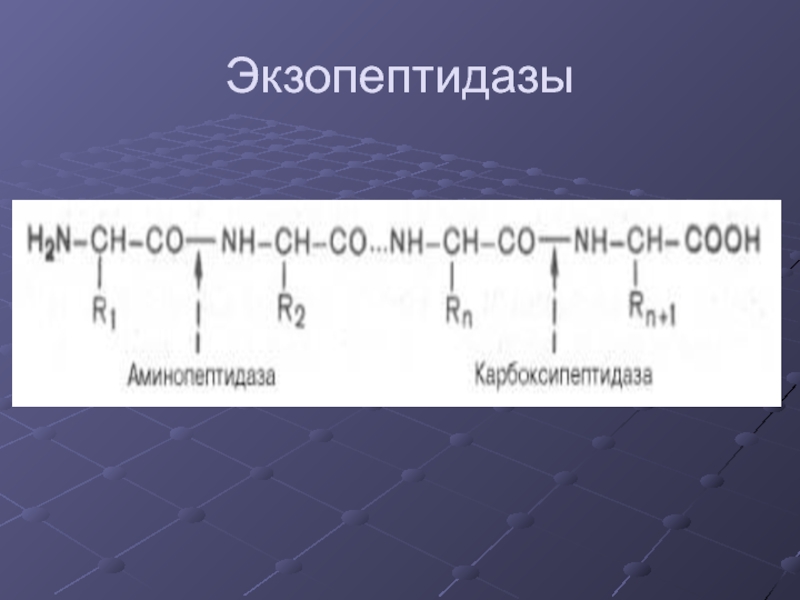
- 7. Экзопептидазы
- 8. Характеристика пептидаз желудка Пепсин: -
- 9. Характеристика пептидаз поджелудочной железы Трипсин: -
- 10. Характеристика пептидаз кишечного сока Аминопептидаза: -
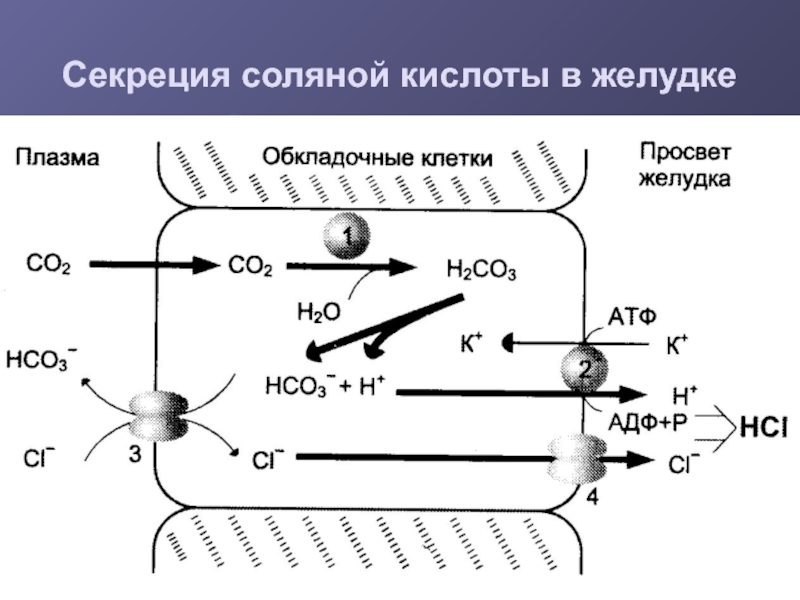
- 11. Секреция соляной кислоты в желудке
- 12. Роль НСl Превращение препепсина в
- 13. Источники аминокислот Переваривание пищевых белков в ЖКТ
- 14. Пути использования аминокислот Синтез белков
- 15. Пути использования аминокислот
- 16. Декарбоксилирование аминокислот R CH NH2 COOH
- 17. Декарбоксилирование гистидина
- 18. Функции гистамина - через Н2-рецепторы стимулирует
- 19. Функции гистамина - сокращает гладкую мускулатуру легких,
- 20. Декарбоксилирование орнитина и лизина При декарбоксилировании
- 21. Декарбоксилирование глутамата B6 Декарбоксилаза COOH
- 22. Декарбоксилирование глутамата γ- аминомасляная кислота (ГАМК):
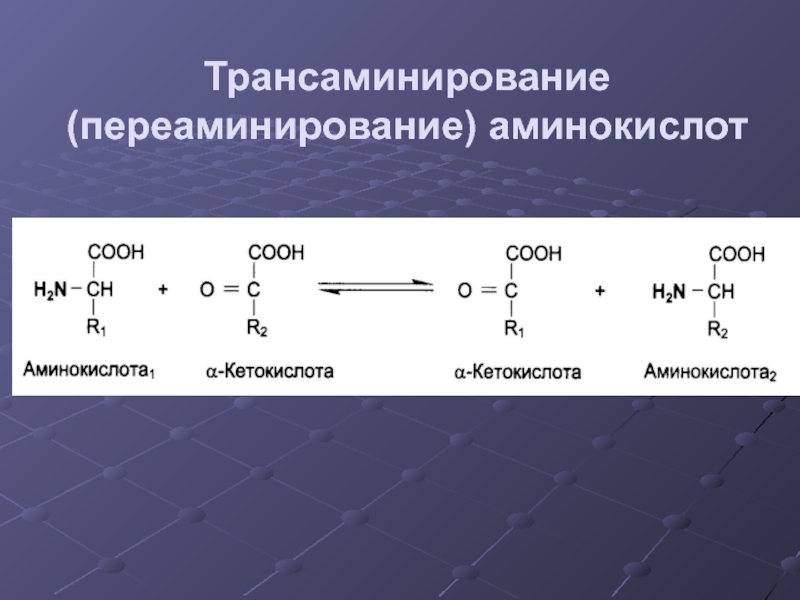
- 23. Трансаминирование (переаминирование) аминокислот
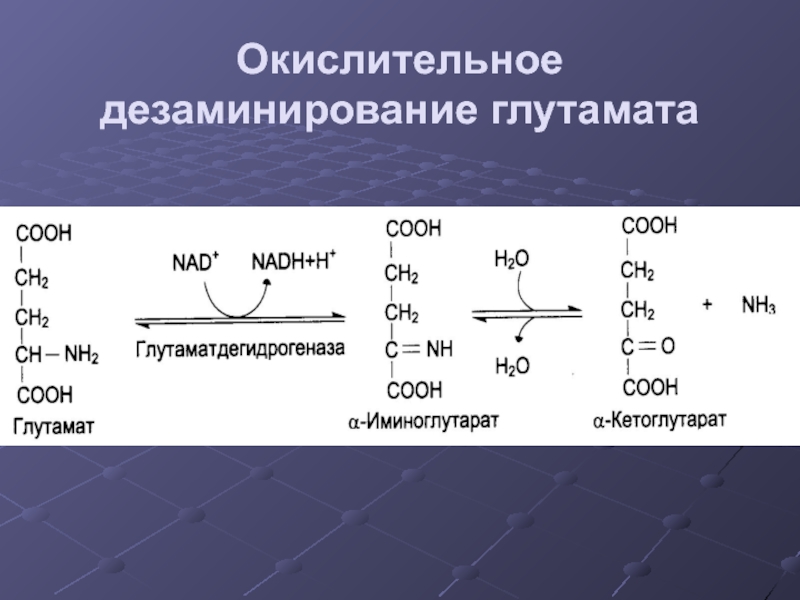
- 24. Окислительное дезаминирование глутамата .
- 25. Регуляция ГДГ
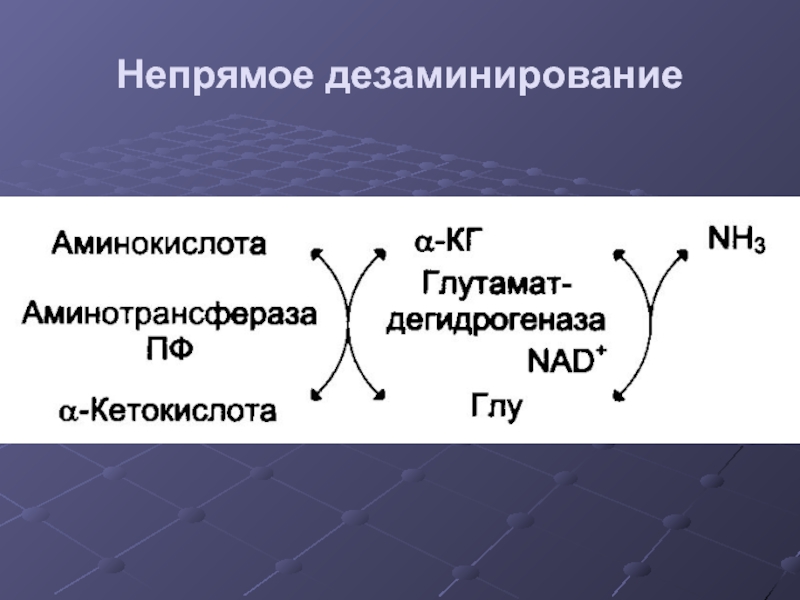
- 26. Непрямое дезаминирование
- 27. Непрямое дезаминирование Продукты
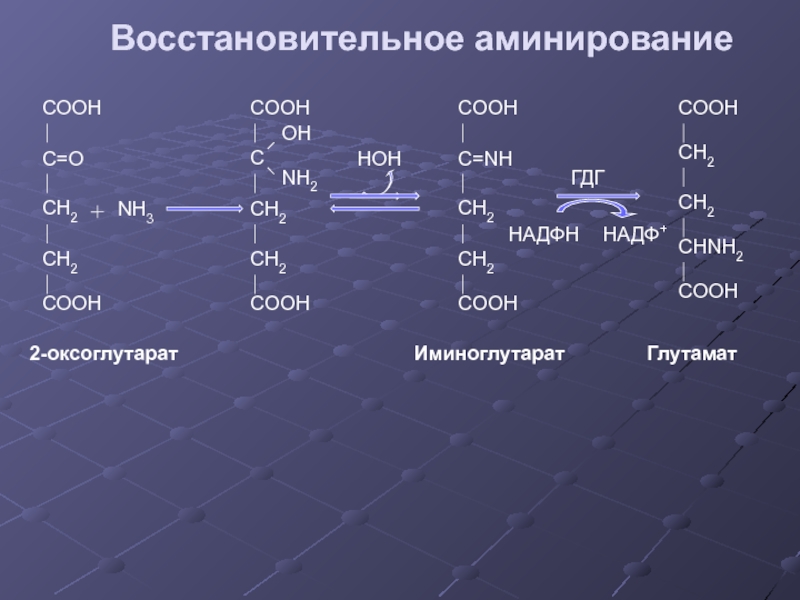
- 28. Восстановительное аминирование COOH C=O CH2 CH2
- 29. Значение восстановительного аминирования: глутамат является источником
- 30. Источники аммиака : Реакции дезаминирования
- 31. Причины токсичности аммиака 1) Легко проникает
- 32. Причины токсичности аммиака
- 33. Обезвреживание аммиака COOH CH2 CH2 CHNH2
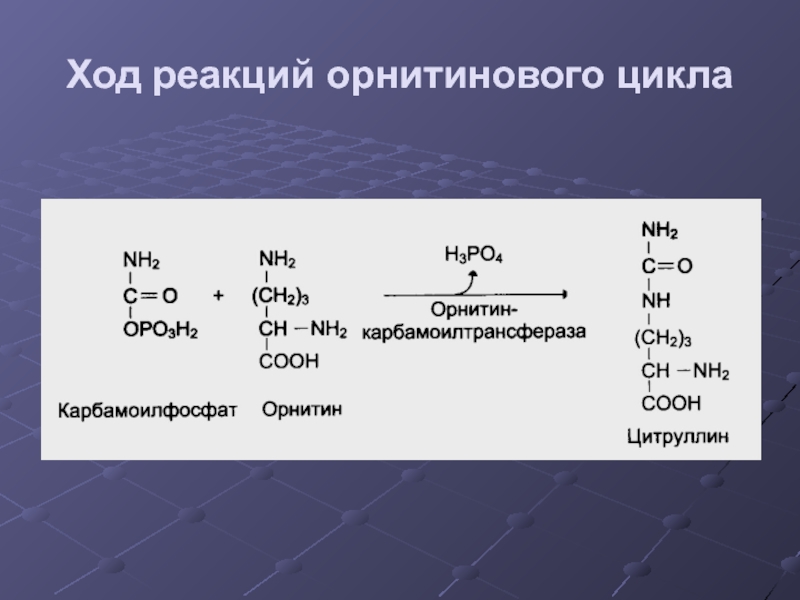
- 34. Ход реакций орнитинового цикла
- 35. Ход реакций орнитинового цикла
- 36. Ход реакций орнитинового цикла
- 37. Ход реакций орнитинового цикла
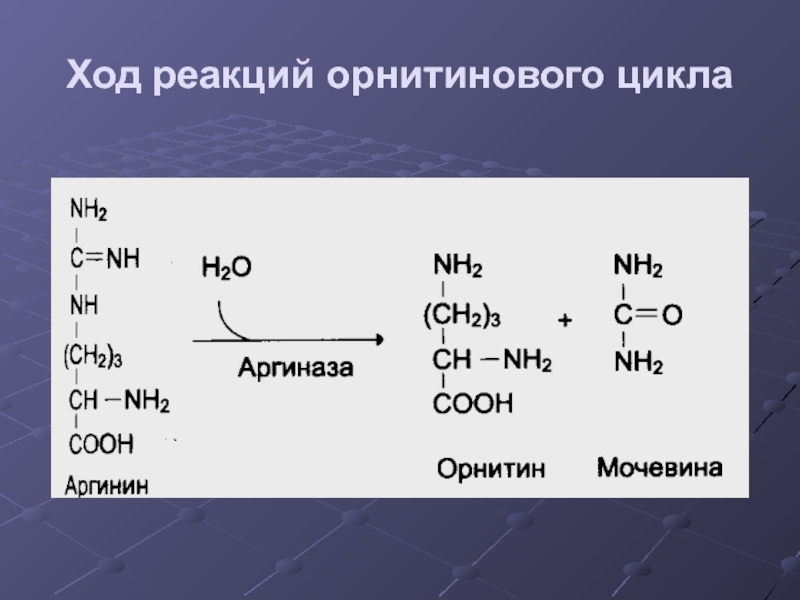
- 38. Ход реакций орнитинового цикла
- 39. Суммарное уравнение синтеза мочевины: CO2 +
- 40. Классификация аминокислот по судьбе безазотистого остатка
- 41. Обмен ароматических аминокислот
- 42. Синтез креатина В почках:
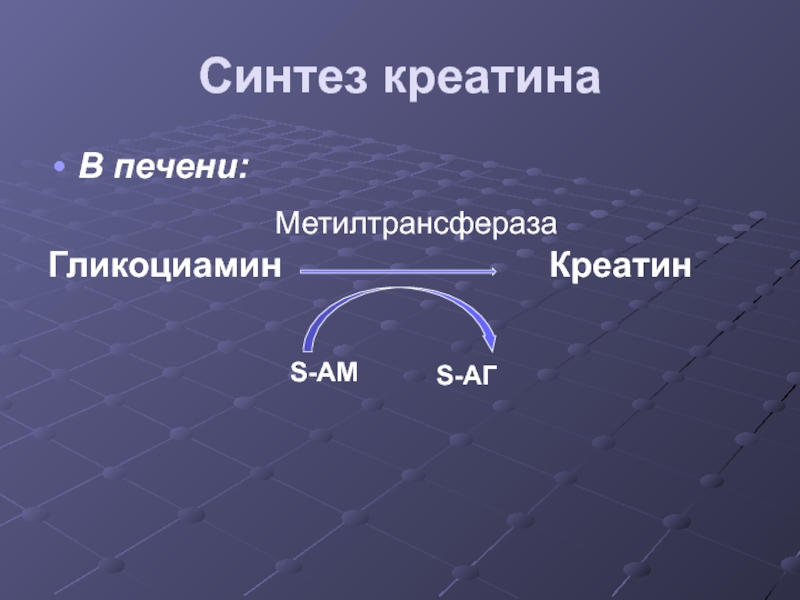
- 43. Синтез креатина В печени: Гликоциамин
- 44. Синтез креатина В мышцах:
- 45. Метаболизм креатинфосфата Креатинфосфат
- 46. Диагностическое значение: 1. Определение содержания креатина и
- 47. Диагностическое значение: 2. Определение активности
Слайд 2Функции белков
- ферментативная
- структурообразовательная
- защитная (иммунная)
- опорная
- сократительная
Слайд 3Функции белков
- регуляторная (гормоны, рецепторы)
- энергетическая
- транспортная (белки плазмы
крови, белки мембран, белки плазматических мембран, белки каналов)
- специфические функции
- специфические функции
Слайд 4Нормы белка в питании
Для взрослых при средней физической нагрузке –
100 -120 г белков в сутки.
При тяжелой мышечной работе – 130 – 150 г в сутки.
Детям до 12 лет – 50 – 70 г в сутки.
При тяжелой мышечной работе – 130 – 150 г в сутки.
Детям до 12 лет – 50 – 70 г в сутки.
Слайд 8Характеристика пептидаз желудка
Пепсин:
- расщепляет связи, образованные карбоксильными группами ароматических
аминокислот (фен, тир и трп);
- действует в сильно кислой среде при рН 1,5 - 2,5.
Гастриксин:
- расщепляет связи, образованные карбоксильными группами дикарбоновых аминокислот (глу и асп);
- действует при рН 3,5.
Реннин:
- створаживает белки молока.
- действует в сильно кислой среде при рН 1,5 - 2,5.
Гастриксин:
- расщепляет связи, образованные карбоксильными группами дикарбоновых аминокислот (глу и асп);
- действует при рН 3,5.
Реннин:
- створаживает белки молока.
Слайд 9Характеристика пептидаз поджелудочной железы
Трипсин:
- расщепляет связи, образованные СООН группами арг
или лиз;
- активирует другие пептидазы поджелудочной железы.
Химотрипсин:
- расщепляет связи, образованные СООН группами ароматических аминокислот.
Эластаза:
- расщепляет связи образованные про.
Карбоксипептидаза:
- отщепляет аминокислоты с С-конца.
- активирует другие пептидазы поджелудочной железы.
Химотрипсин:
- расщепляет связи, образованные СООН группами ароматических аминокислот.
Эластаза:
- расщепляет связи образованные про.
Карбоксипептидаза:
- отщепляет аминокислоты с С-конца.
Слайд 10Характеристика пептидаз кишечного сока
Аминопептидаза:
- отщепляет аминокислоты с N-конца.
Дипептидазы и трипептидазы:
-
расщепляют дипептиды или трипептиды соответственно.
Слайд 12Роль НСl
Превращение препепсина в пепсин
Оптимум рН для работы
пепсина
Денатурация и набухание пищевых белков
Бактерицидное действие
Денатурация и набухание пищевых белков
Бактерицидное действие
Слайд 13Источники аминокислот
Переваривание пищевых белков в ЖКТ
Расщепление клеточных белков лизосомальными пептидазами (катепсинами)
Синтез
из других аминокислот
Образование из безазотистых соединений (прежде всего из кетокислот)
Образование из безазотистых соединений (прежде всего из кетокислот)
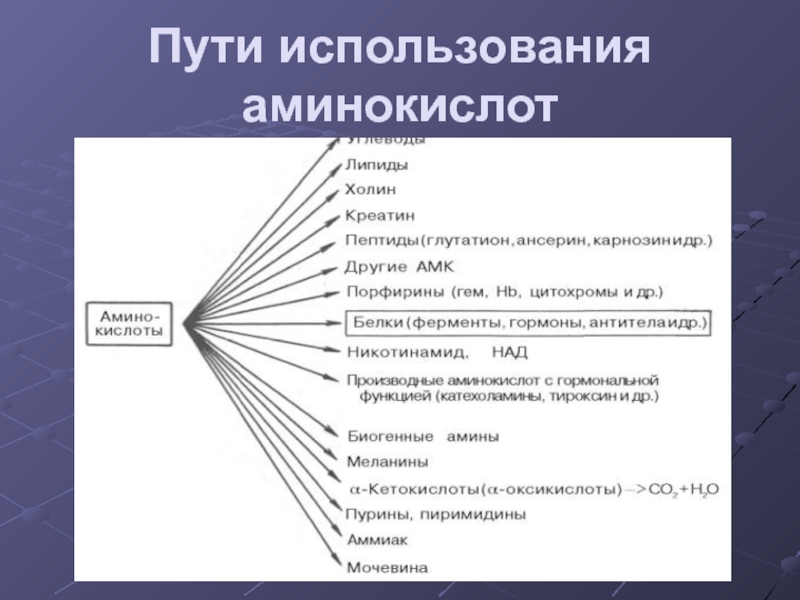
Слайд 14Пути использования аминокислот
Синтез белков
Синтез биологически важных соединений (пуринов, пиримидинов,
гормонов, порфиринов и др.)
Дезаминирование аминокислот с образованием кетокислот которые идут:
1) в цикл Кребса
2) в ГНГ на синтез глюкозы
3) на синтез кетоновых тел
Дезаминирование аминокислот с образованием кетокислот которые идут:
1) в цикл Кребса
2) в ГНГ на синтез глюкозы
3) на синтез кетоновых тел
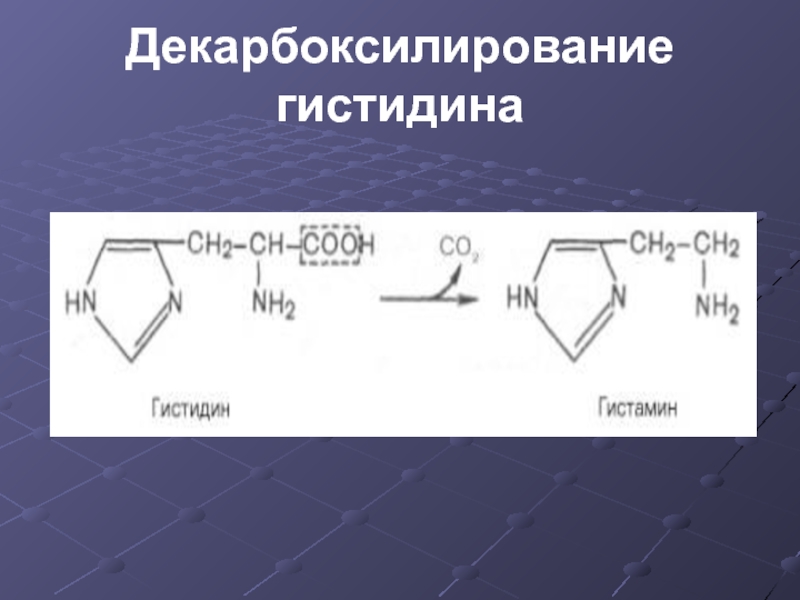
Слайд 18Функции гистамина
- через Н2-рецепторы стимулирует секрецию желудочного сока, слюны
- через
Н1-рецепторы повышает проницаемость капилляров, вызывает отеки, снижает АД
Слайд 19Функции гистамина
- сокращает гладкую мускулатуру легких, вызывает удушье
- участвует в формировании
воспалительной реакции
- вызывает аллергическую реакцию
- исполняет роль нейромедиатора
- является медиатором боли
- вызывает аллергическую реакцию
- исполняет роль нейромедиатора
- является медиатором боли
Слайд 20Декарбоксилирование орнитина и лизина
При декарбоксилировании орнитина образуется путресцин,
лизина - кадаверин, которые относятся к диаминам.
Из путресцина образуются спермин и спермидин, которые обнаружены в ядрах клеток всех органов человека.
Из путресцина образуются спермин и спермидин, которые обнаружены в ядрах клеток всех органов человека.
Слайд 21Декарбоксилирование глутамата
B6
Декарбоксилаза
COOH
CH2
CH2
CHNH2
COOH
Глутамат
COOH
CH2
CH2
CH2
NH2
γ- аминомасляная кислота
CO2
Слайд 22Декарбоксилирование глутамата
γ- аминомасляная кислота (ГАМК):
служит основным тормозным модулятором высших отделов
мозга
повышает дыхательную активность нервной ткани
улучшает кровоснабжение головного мозга
повышает дыхательную активность нервной ткани
улучшает кровоснабжение головного мозга
Слайд 28Восстановительное аминирование
COOH
C=O
CH2
CH2
COOH
NH3
COOH
C
OH
NH2
CH2
CH2
COOH
COOH
C=NH
CH2
CH2
COOH
COOH
CH2
CH2
CHNH2
COOH
Глутамат
ГДГ
НАДФH
НАДФ+
2-оксоглутарат
Иминоглутарат
HOH
Слайд 29Значение восстановительного аминирования:
глутамат является источником аминогрупп для синтеза заменимых аминокислот
служит одним из способов связывания аммиака в клетке
Слайд 30Источники аммиака :
Реакции дезаминирования
Образование в кишечнике в результате деятельности микрофлоры (гниение
белков)
Содержание аммиака в крови в норме 25-40 мкмоль/л.
Содержание аммиака в крови в норме 25-40 мкмоль/л.
Слайд 31Причины токсичности аммиака
1) Легко проникает через клеточные мембраны
2) Связывается с 2-оксоглутаратом, что вызывает угнетение обмена аминокислот и гипоэнергетическое состояние (угнетение цикла Кребса)
3) Усиливает синтез глн из глу в нервной ткани, что снижает синтез ГАМК. Это нарушает проведение нервного импульса и вызывает судороги
3) Усиливает синтез глн из глу в нервной ткани, что снижает синтез ГАМК. Это нарушает проведение нервного импульса и вызывает судороги
Слайд 32Причины токсичности аммиака
4) образует ион NH4+, накопление
которого нарушает проведение нервного импульса
5) сдвигает рН в щелочную сторону, вызывая метаболический алкалоз
5) сдвигает рН в щелочную сторону, вызывая метаболический алкалоз
Слайд 33Обезвреживание аммиака
COOH
CH2
CH2
CHNH2
COOH
Глутамат
CO NH2
CH2
CH2
CHNH2
COOH
NH3
АТФ
АДФ+Pн
глутаминсинтетаза
1. Восстановительное аминирование (имеет небольшое значение)
2.
Образование амидов (глн и асн).
3. Образование аланина в мышцах
3. Образование аланина в мышцах
глутамин
Слайд 39 Суммарное уравнение синтеза мочевины:
CO2 + NH3 + Аспартат + 3
АТФ + 2H2O =
Мочевина + Фумарат + 2(АДФ + H3PO4) + АМФ + H4P2O7
Мочевина + Фумарат + 2(АДФ + H3PO4) + АМФ + H4P2O7
Слайд 41Обмен ароматических аминокислот
Йодтиронины
гидроксилаза
фенилаланин тирозин ДОФА меланин
фенилпируват гидроксифенил- катехоламины
пируват (А, НА, ДА)
фениллактат гомогентизиновая
кислота
фумарат ацетоацетат
фенилаланин тирозин ДОФА меланин
фенилпируват гидроксифенил- катехоламины
пируват (А, НА, ДА)
фениллактат гомогентизиновая
кислота
фумарат ацетоацетат
Слайд 44Синтез креатина
В мышцах:
в покое
Креатин + АТФ креатинкиназа
при сокращении
Креатинфосфат + АДФ
Креатин + АТФ креатинкиназа
при сокращении
Креатинфосфат + АДФ
Слайд 46Диагностическое значение:
1. Определение содержания креатина и креатинина в крови и моче
используется для характеристики:
а) интенсивности работы мышц в спортивной медицине
б) для диагностики заболеваний почек:
Креатинин мочи
Клиренс = ------------------------- х диурез (мин)
Креатинин крови
а) интенсивности работы мышц в спортивной медицине
б) для диагностики заболеваний почек:
Креатинин мочи
Клиренс = ------------------------- х диурез (мин)
Креатинин крови
Слайд 47Диагностическое значение:
2. Определение активности креатинкиназы и ее изоферментов в крови
используется для диагностики инфаркта миокарда, миопатий, мышечных дистрофий и др.