- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Белки в действии презентация
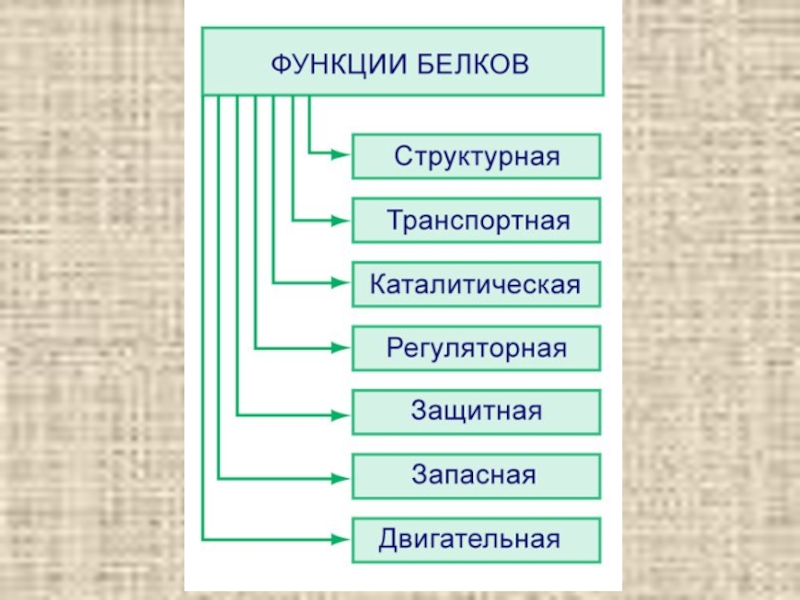
Содержание
- 1. Белки в действии
- 3. Структурная (строительная) Белки входят в состав всех
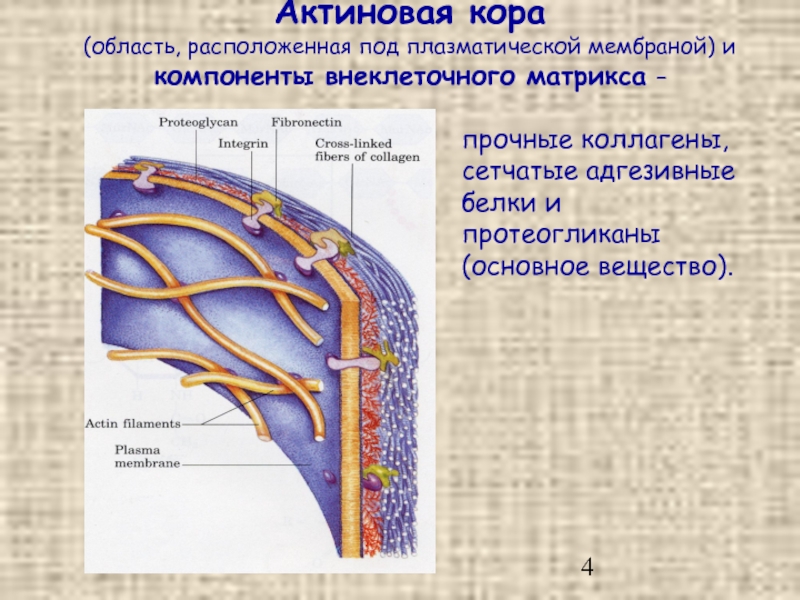
- 4. Актиновая кора (область, расположенная под плазматической
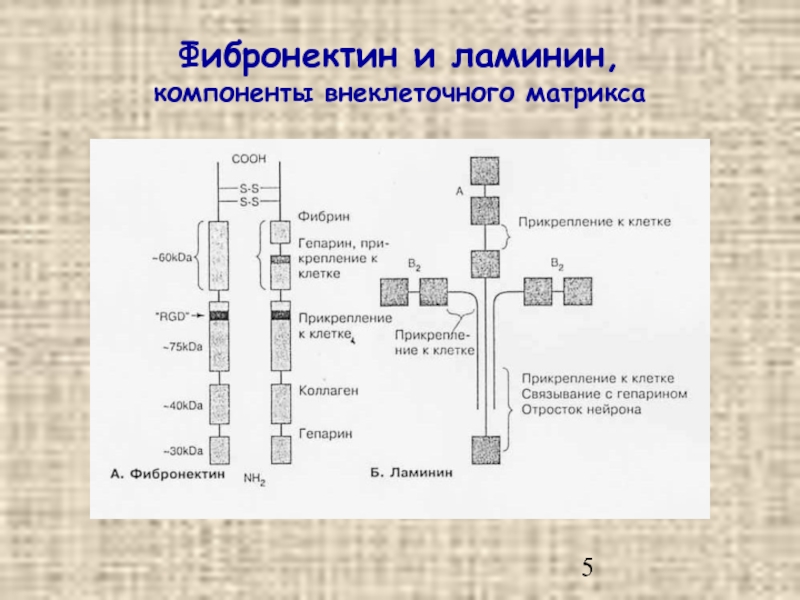
- 5. Фибронектин и ламинин, компоненты внеклеточного матрикса
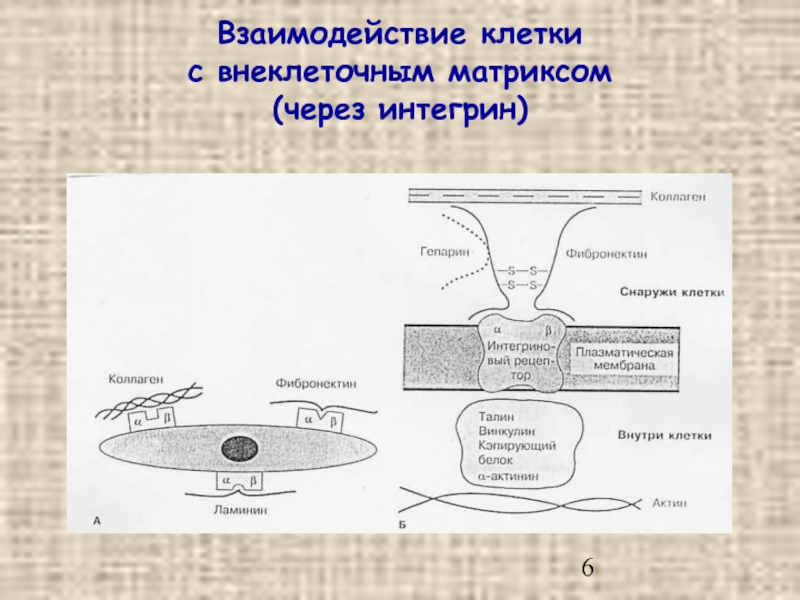
- 6. Взаимодействие клетки с внеклеточным матриксом (через интегрин)
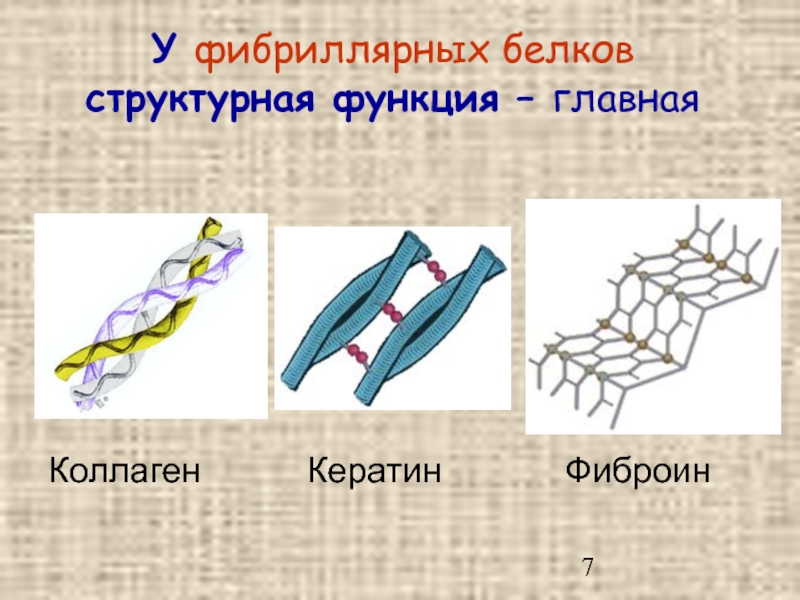
- 7. У фибриллярных белков структурная функция – главная Коллаген Кератин Фиброин
- 8. Внутри клетки: цитоскелет NB!!! Компоненты
- 9. Вне клетки: кератин
- 10. Фиброин – белок шелка и паутины
- 11. Коллаген – структурный белок кожи и хрящей
- 12. Волокна коллагена и эластина в межклеточном веществе
- 13. Энергия химических связей механическая энергия Актин Миозин Кинезин Шагающий белок Работа мышц Внутриклеточный транспорт
- 14. Двигательные белки Актино-миозиновая система подвижности (мышечное
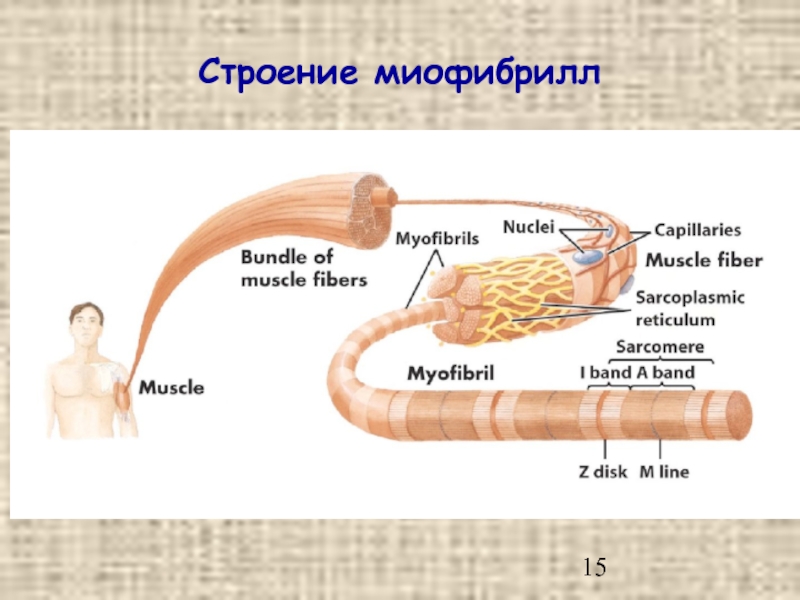
- 15. Строение миофибрилл
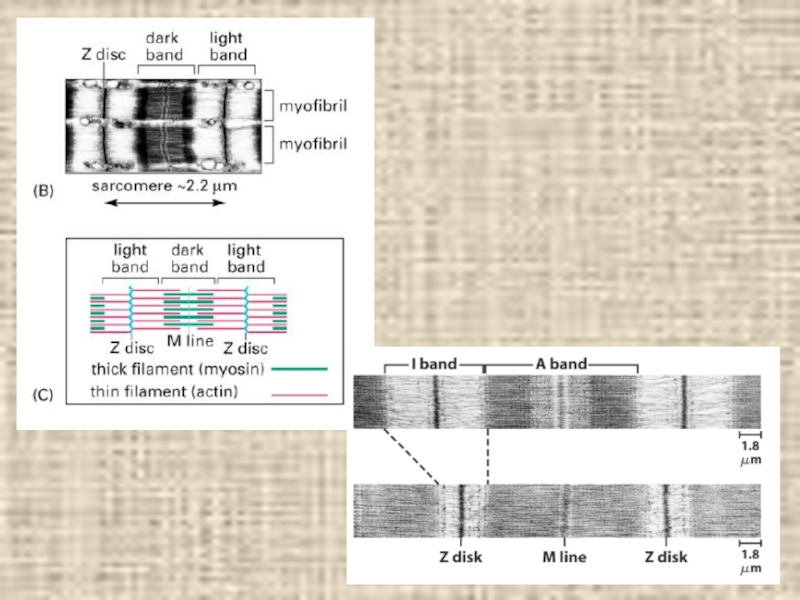
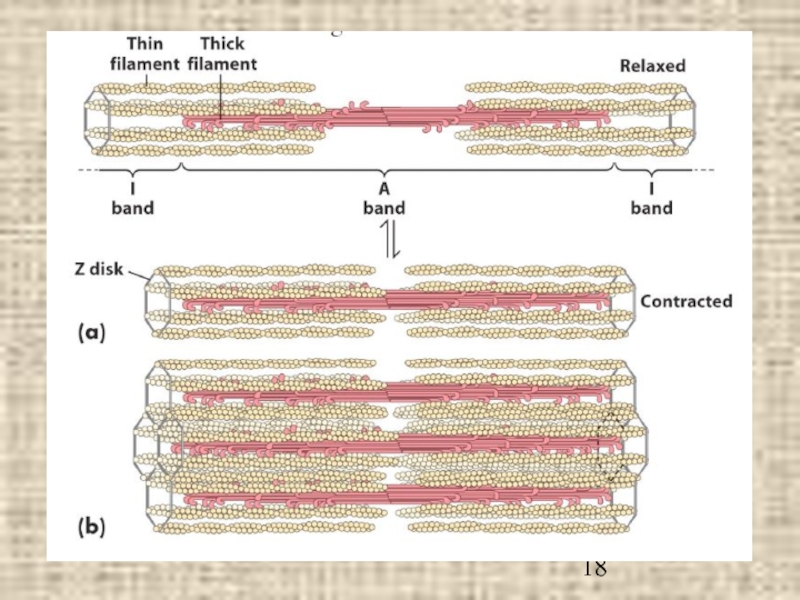
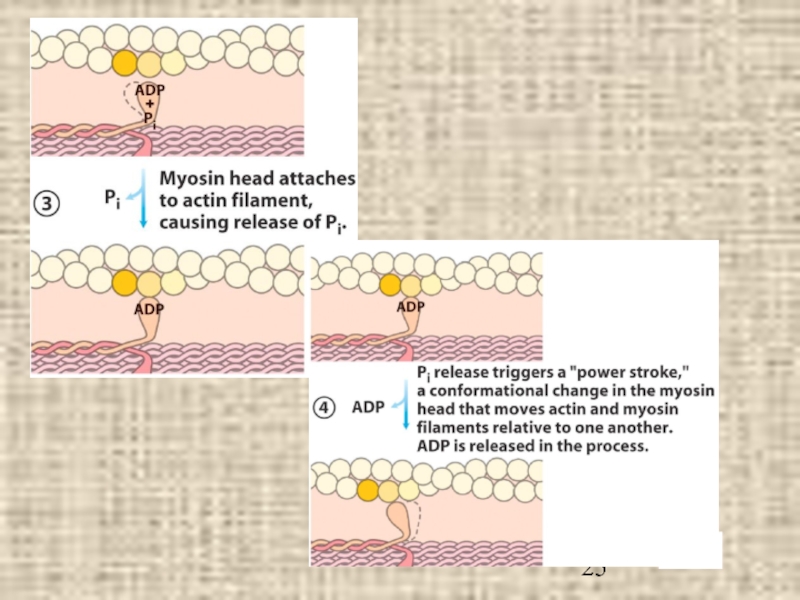
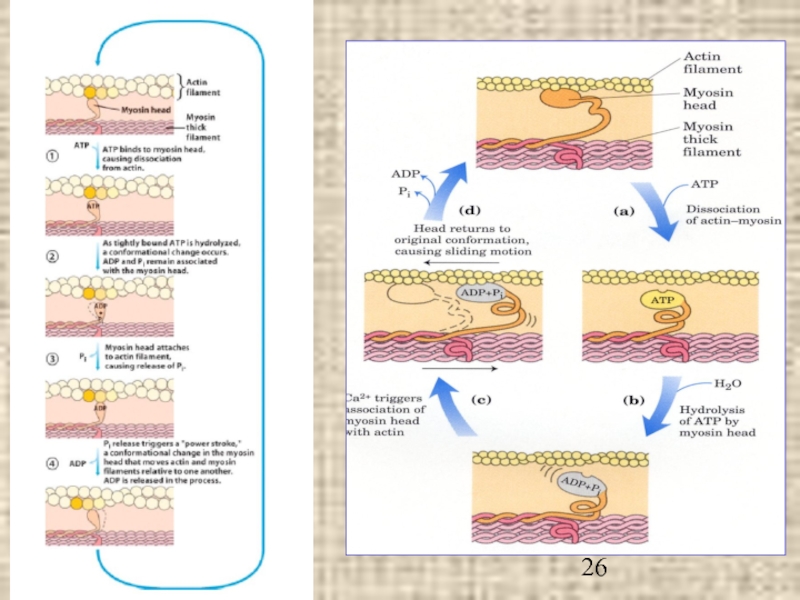
- 17. Уровни организации скелетной мышцы А B. Миофибрилла С. Строение саркомера А. Мышечное волокно
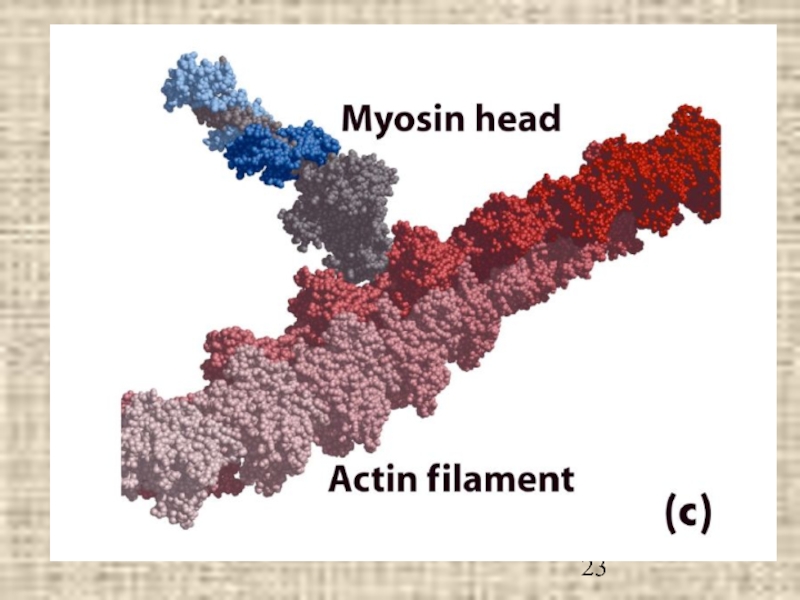
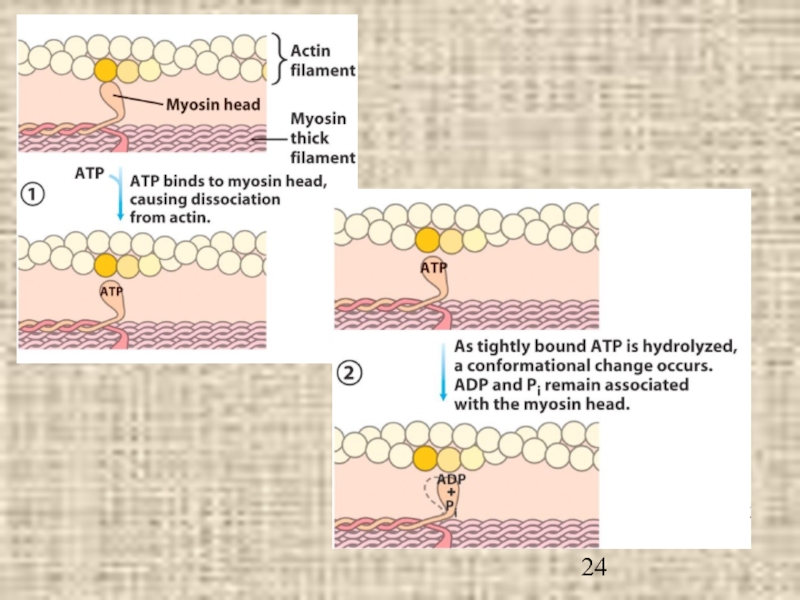
- 19. Модель «скользящих нитей» Глобулярные головки миозина (хвосты, спирально закручивающиеся друг отн-но друга, не показаны)
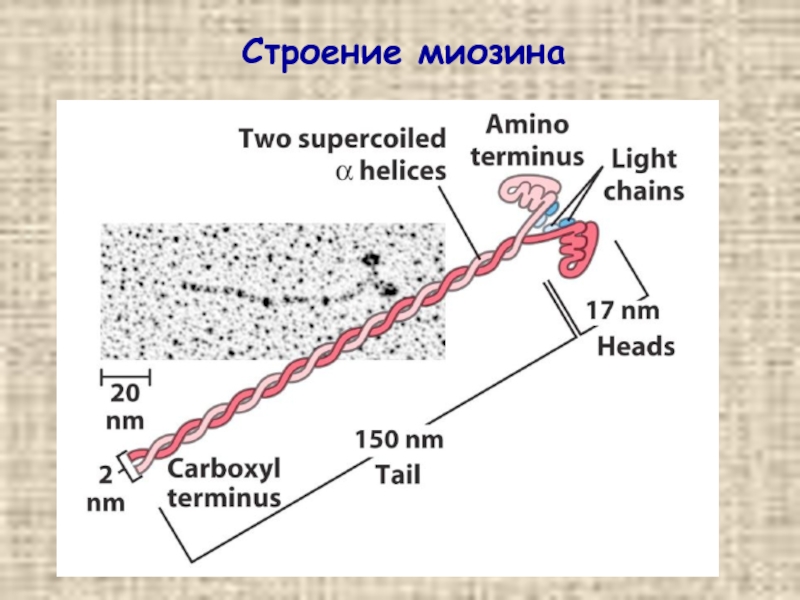
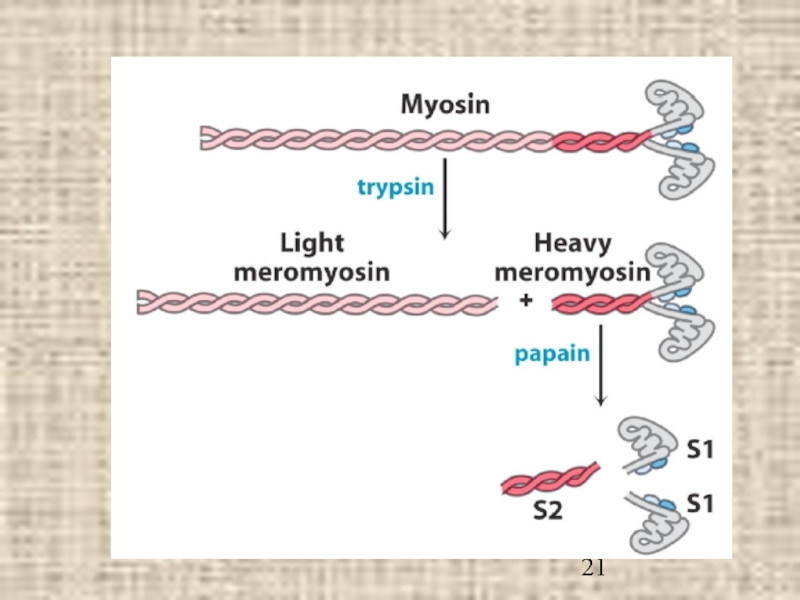
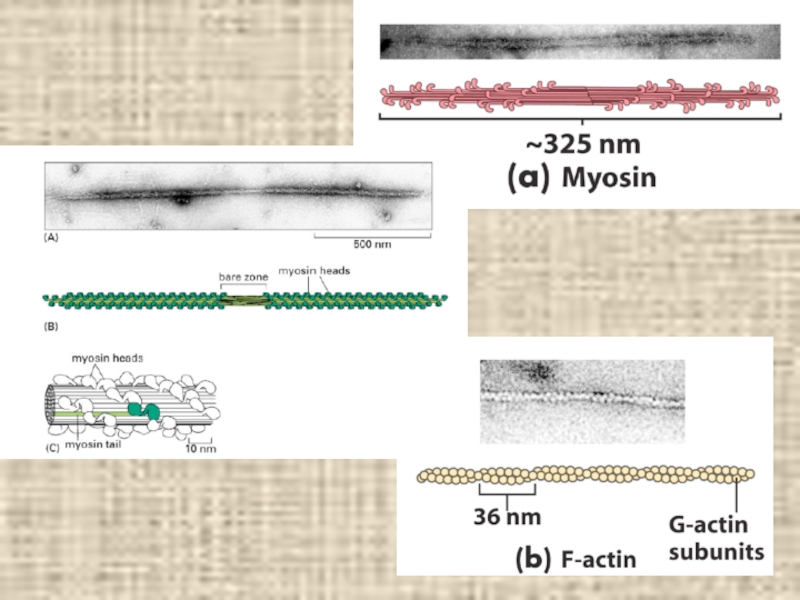
- 20. Строение миозина
- 27. Белки цитоскелета
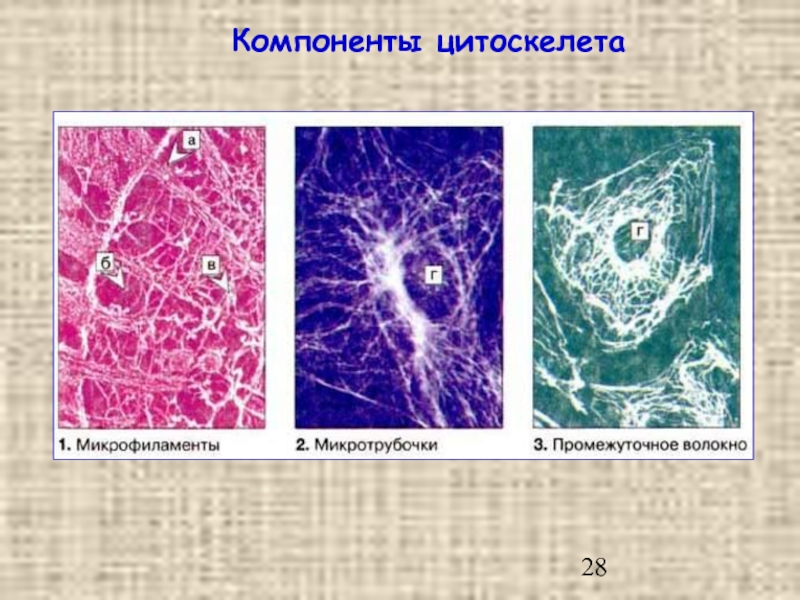
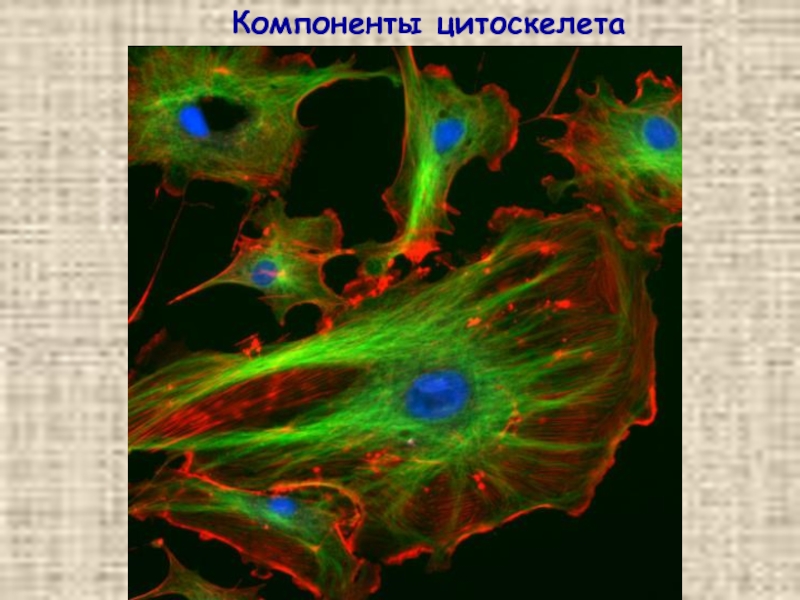
- 28. Компоненты цитоскелета
- 29. Компоненты цитоскелета
- 30. Белки микротрубочек (МТ) тубулин белки, ассоциированные с
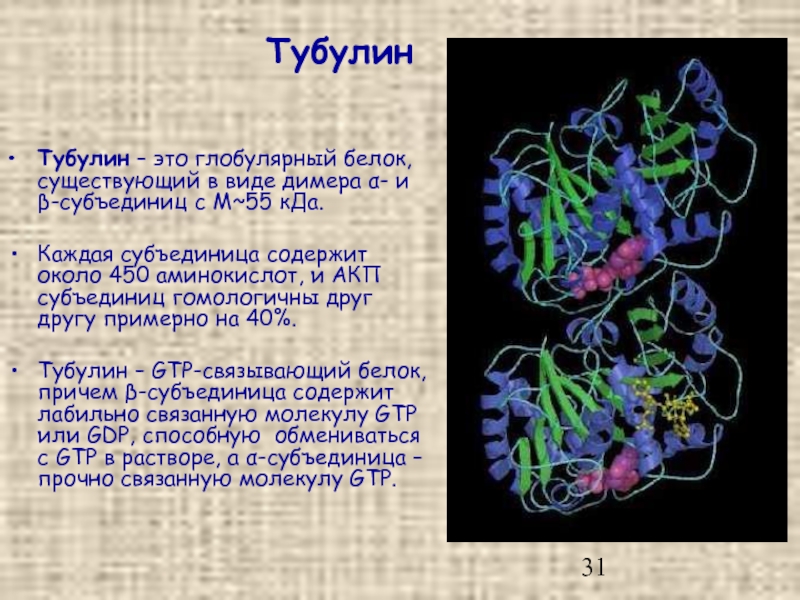
- 31. Тубулин Тубулин – это глобулярный белок, существующий
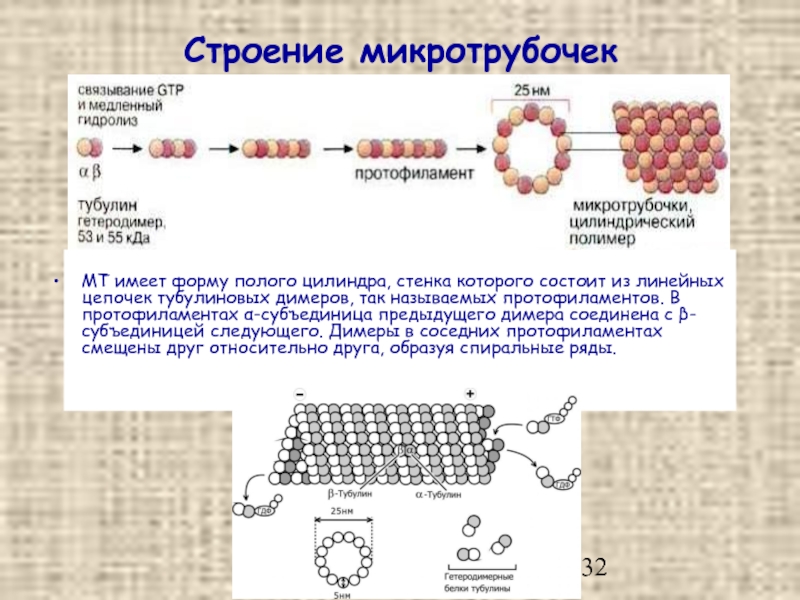
- 32. Строение микротрубочек МТ имеет форму полого цилиндра,
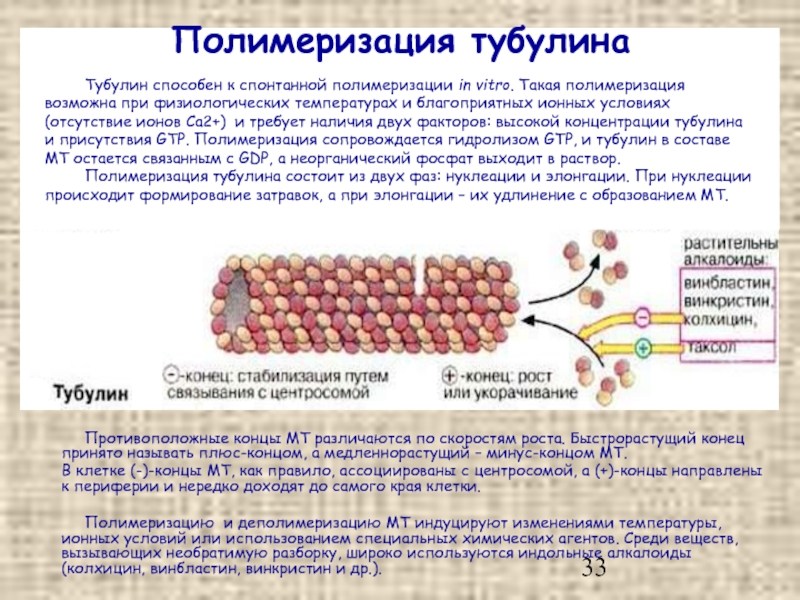
- 33. Полимеризация тубулина Тубулин способен к спонтанной полимеризации
- 34. Динамическая нестабильность МТ При постоянном количестве полимера
- 35. БЕЛКИ, АССОЦИИРОВАННЫЕ С МИКРОТРУБОЧКАМИ (МАР) Структурные МАР.
- 36. Молекулярные двигатели Миозин Кинезины – движутся
- 37. Белки-транслокаторы
- 38. Белки-транслокаторы
- 39. Модель образования кинезинового поперечного мостика между органеллами
- 40. Перемещение кинезина по микротрубочке
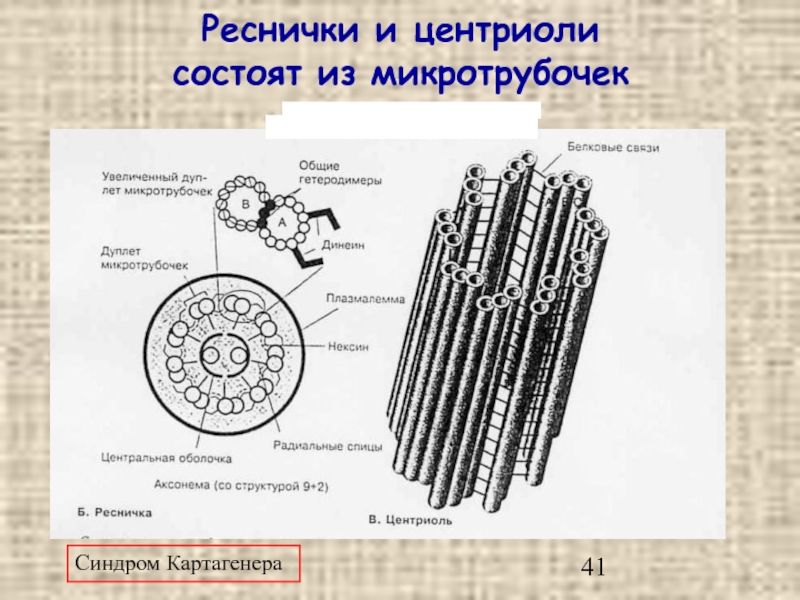
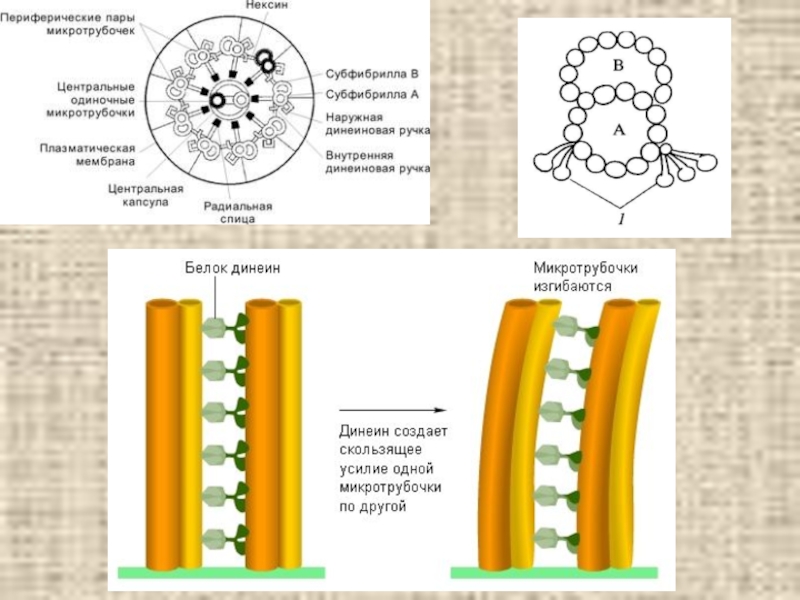
- 41. Реснички и центриоли состоят из микротрубочек Кинезин
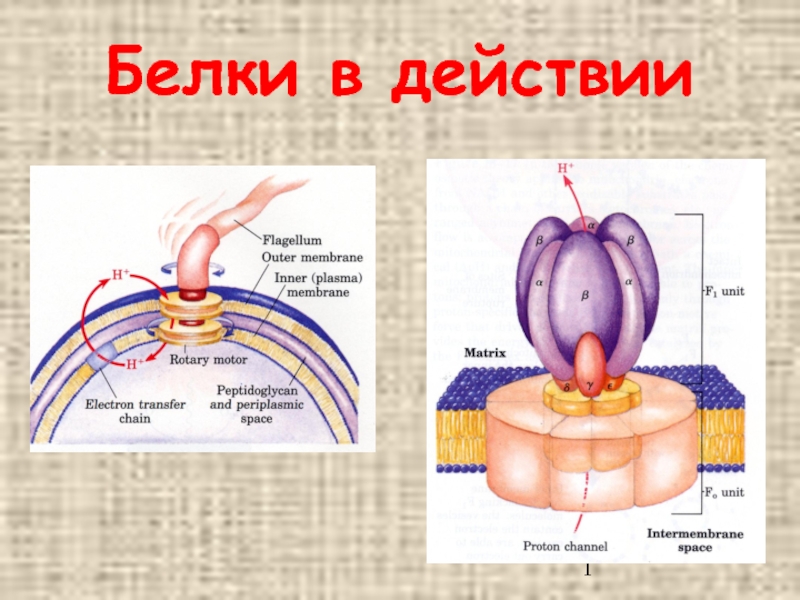
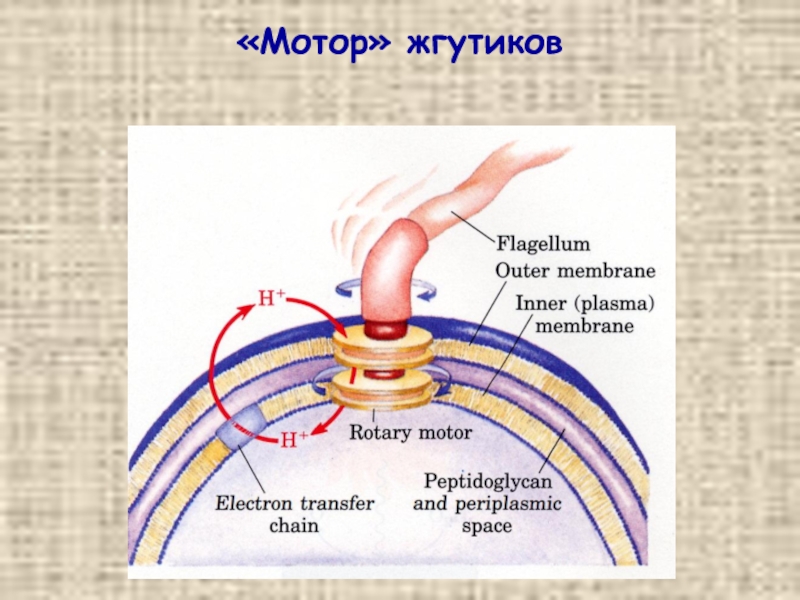
- 43. «Мотор» жгутиков
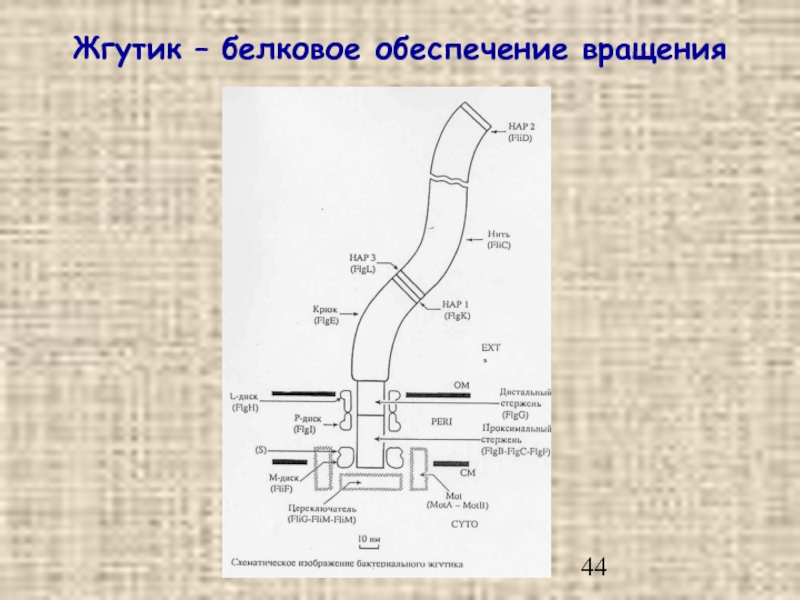
- 44. Жгутик – белковое обеспечение вращения
Слайд 3Структурная (строительная)
Белки входят в состав всех клеточных органелл, цитоплазмы, мембран
коллаген,
белки
и межклеточного вещества:
Слайд 4Актиновая кора (область, расположенная под плазматической мембраной) и компоненты внеклеточного матрикса –
прочные коллагены,
сетчатые адгезивные белки и протеогликаны (основное вещество).
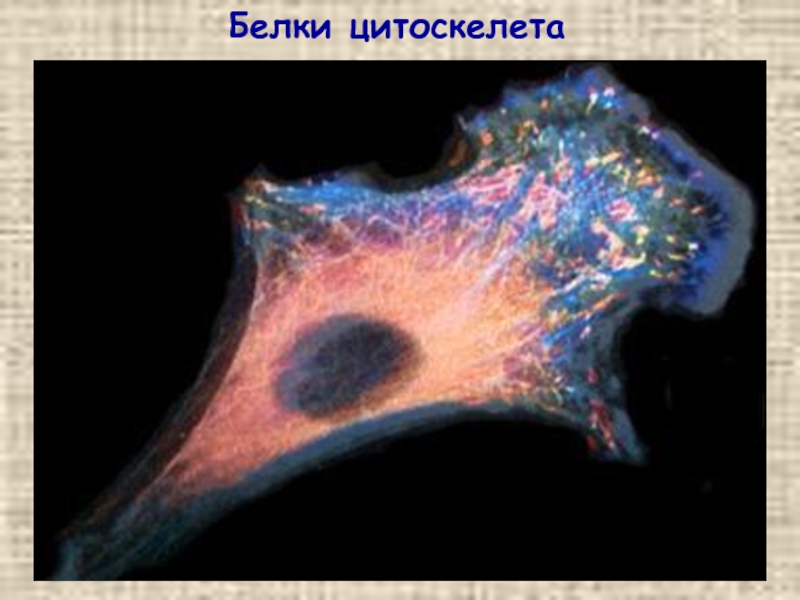
Слайд 8Внутри клетки: цитоскелет
NB!!!
Компоненты
цитоскелета –
не фибриллярные
белки!
(но об этом позже)
Слайд 12Волокна коллагена и эластина в межклеточном веществе подкожной соединительной ткани
Фибробласты
Коллагеновое волокно
Эластиновое
Макрофаг
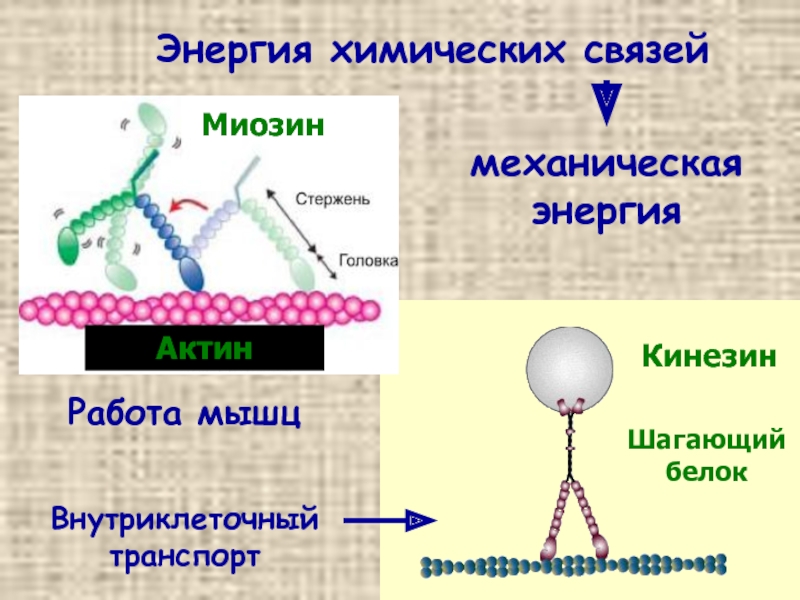
Слайд 13Энергия химических связей
механическая энергия
Актин
Миозин
Кинезин
Шагающий белок
Работа мышц
Внутриклеточный транспорт
Слайд 14Двигательные белки
Актино-миозиновая система подвижности
(мышечное сокращение и др.)
Динеино-тубулиновая система подвижности
(в микротрубочках)
Белковое
(жгутики)
Двигательная система бактериофагов
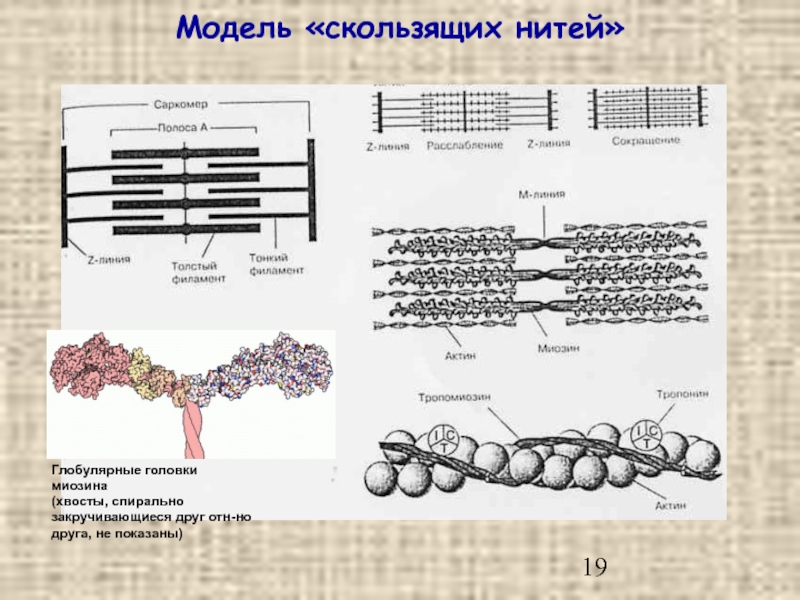
Слайд 19Модель «скользящих нитей»
Глобулярные головки
миозина
(хвосты, спирально
закручивающиеся друг отн-но
друга, не показаны)
Слайд 30Белки микротрубочек (МТ)
тубулин
белки, ассоциированные с МТ
(МАР 1, МАР 2, МАР
белки-транслокаторы (динеин, кинезин, динамин).
МТ образуют:
веретено деления (ахроматиновую фигуру) в митозе и в мейозе,
аксонему (центральную структуру) подвижных ресничек и жгутиков,
стенку центриолей и базальных телец.
МТ отводится важная, если не ключевая, роль в клеточном морфогенезе и в некоторых видах клеточной подвижности.
МТ – диаметр около 25 нм,
длина до нескольких
десятков микрометров;
толщина их стенок –
около 6 нм.
Слайд 31Тубулин
Тубулин – это глобулярный белок, существующий в виде димера α- и
Каждая субъединица содержит около 450 аминокислот, и АКП субъединиц гомологичны друг другу примерно на 40%.
Тубулин – GTP-связывающий белок, причем β-субъединица содержит лабильно связанную молекулу GTP или GDP, способную обмениваться с GTP в растворе, а α-субъединица – прочно связанную молекулу GTP.
Слайд 32Строение микротрубочек
МТ имеет форму полого цилиндра, стенка которого состоит из линейных
Слайд 33Полимеризация тубулина
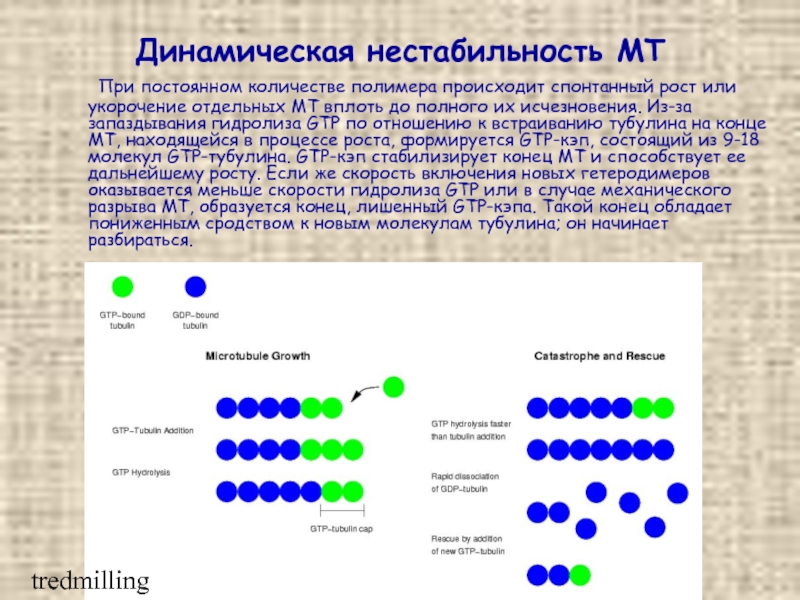
Тубулин способен к спонтанной полимеризации in vitro. Такая полимеризация возможна
Полимеризация тубулина состоит из двух фаз: нуклеации и элонгации. При нуклеации происходит формирование затравок, а при элонгации – их удлинение с образованием МТ.
Противоположные концы МТ различаются по скоростям роста. Быстрорастущий конец принято называть плюс-концом, а медленнорастущий – минус-концом МТ.
В клетке (-)-концы МТ, как правило, ассоциированы с центросомой, а (+)-концы направлены к периферии и нередко доходят до самого края клетки.
Полимеризацию и деполимеризацию МТ индуцируют изменениями температуры, ионных условий или использованием специальных химических агентов. Среди веществ, вызывающих необратимую разборку, широко используются индольные алкалоиды (колхицин, винбластин, винкристин и др.).
Слайд 34Динамическая нестабильность МТ
При постоянном количестве полимера происходит спонтанный рост или укорочение
tredmilling
Слайд 35БЕЛКИ, АССОЦИИРОВАННЫЕ С МИКРОТРУБОЧКАМИ (МАР)
Структурные МАР. Общее свойство – перманентная ассоциация
МАР способны стимулировать инициацию и элонгацию и стабилизировать готовые МТ; сшивать МТ в пучки.
Три основные функции структурных МАР: регуляция динамики МТ, клеточный морфогенез и участие во взаимодействии МТ с другими внутриклеточными структурами.
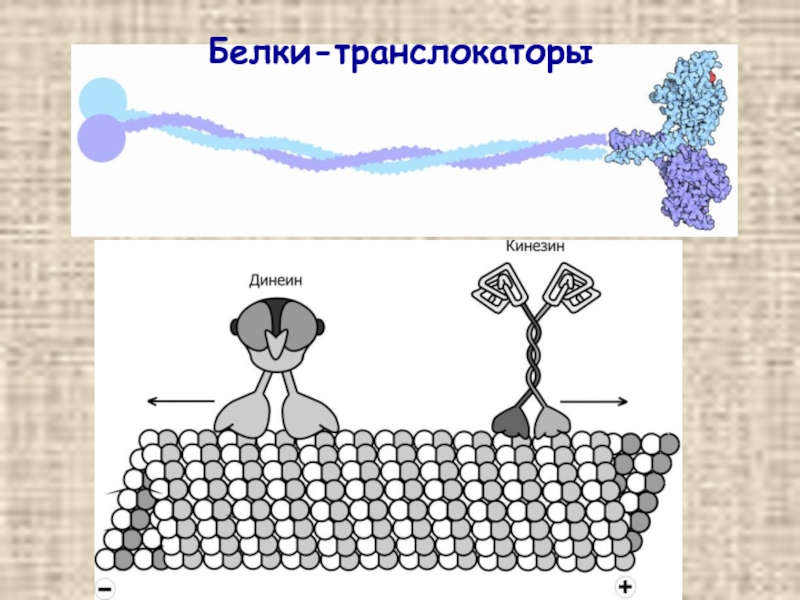
Белки-транслокаторы. Отличительная особенность – свойство преобразовывать энергию АТР в механическое усилие, способное перемещать частицы вдоль МТ или МТ вдоль субстрата. Соответственно транслокаторы являются механохимическими АТР-азами и их АТР-азная активность стимулируется МТ. В отличие от структурных МАР, транслокаторы ассоциированы в МТ только в момент АТР-зависимого перемещения.
Слайд 36Молекулярные двигатели
Миозин
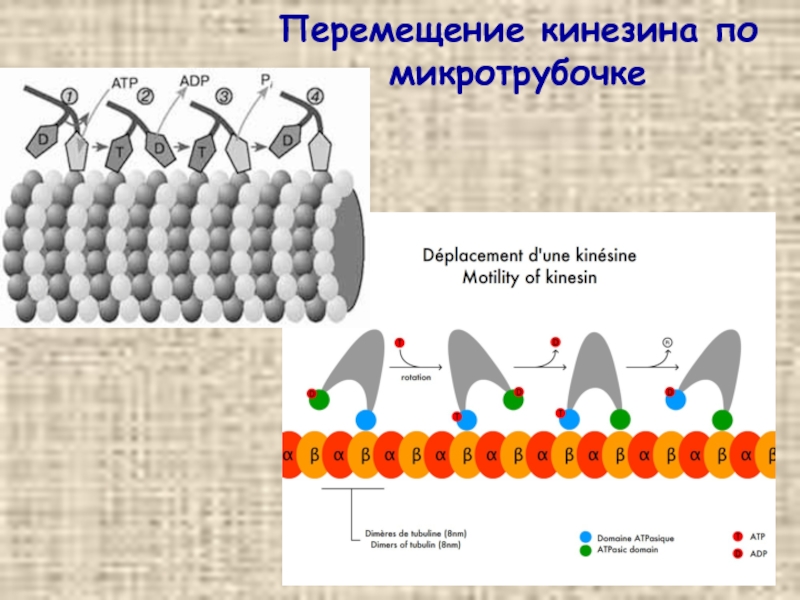
Кинезины – движутся по микротрубочкам в направлении (+)-конца (т.е от
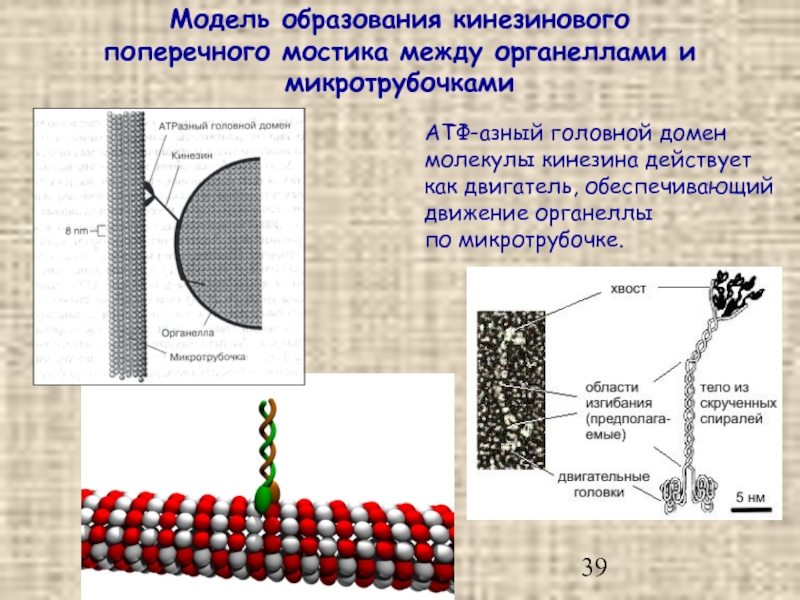
Слайд 39Модель образования кинезинового
поперечного мостика между органеллами и микротрубочками
АТФ-азный головной домен молекулы
по микротрубочке.
Слайд 41Реснички и центриоли
состоят из микротрубочек
Кинезин из мозга крупного рогатого скота имеет
Динеин – высокомолекулярный белок, состоящий из различных комбинаций α-, β- и γ-тяжелых цепей с молекулярной массой более 400 кДа и набора промежуточных и легких цепей с М от 10 до 80 кДа. В зависимости от количества тяжелых цепей на молекулу динеина различают одно-, двух- и трехголовые динеины.
Динамин – М 100 кДа, обладает GTP-азной активность, которая стимулируется при добавлении МТ. При добавлении динамина к МТ происходит образование гексагонально упакованных пучков.
Синдром Картагенера