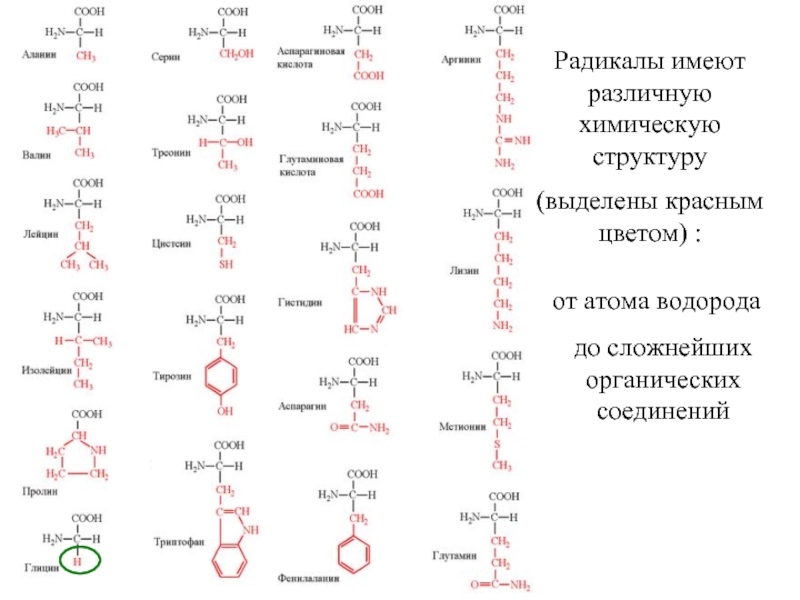
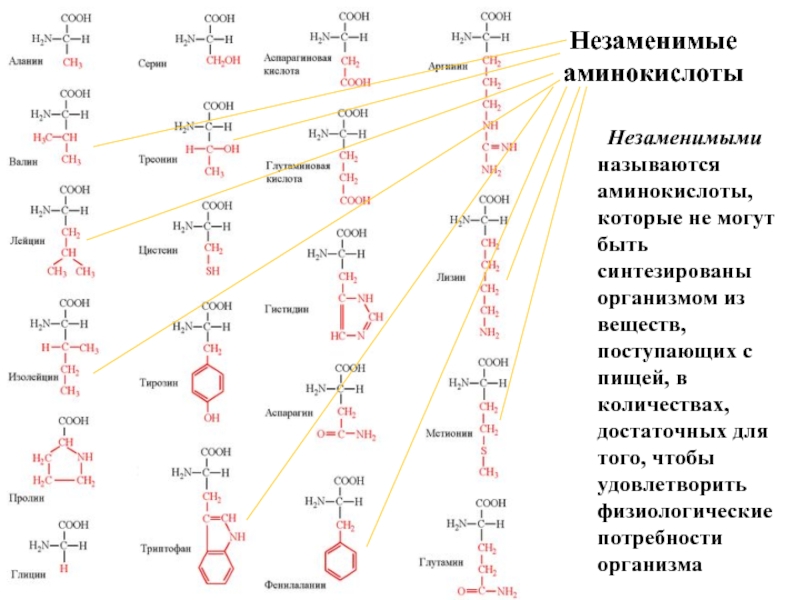
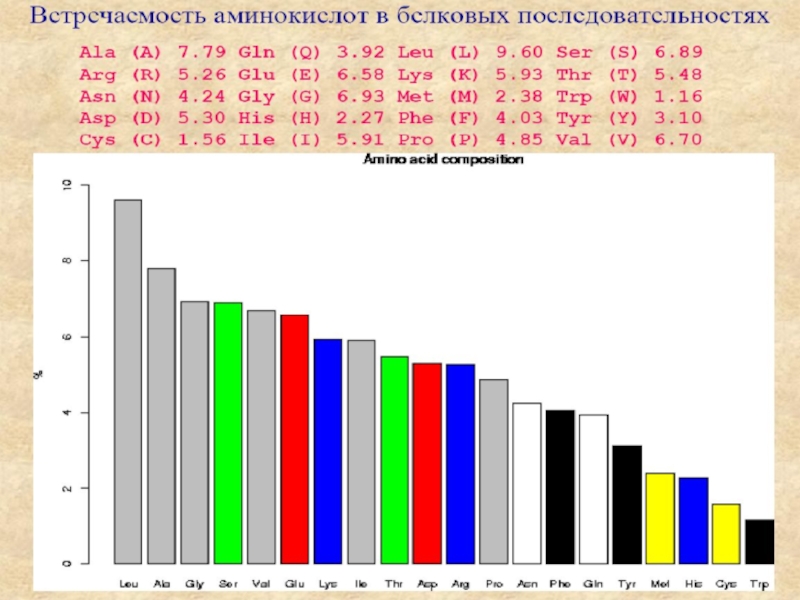
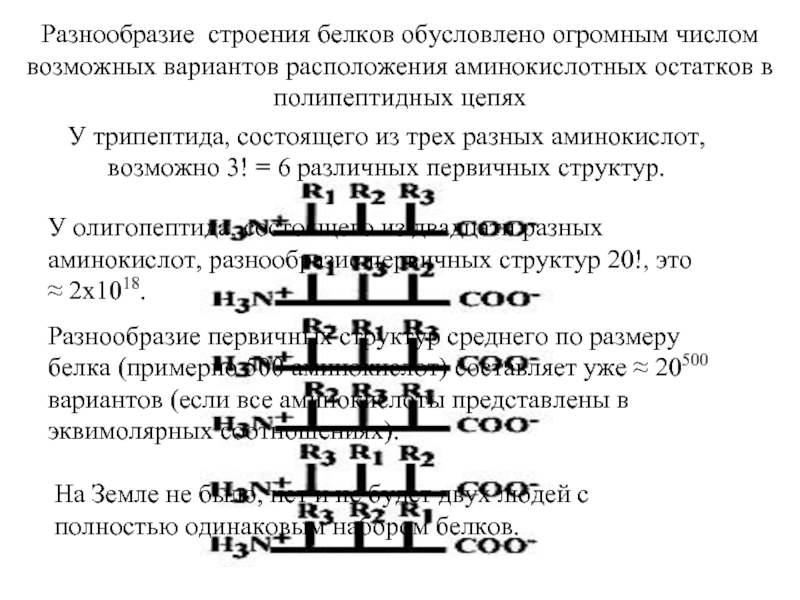
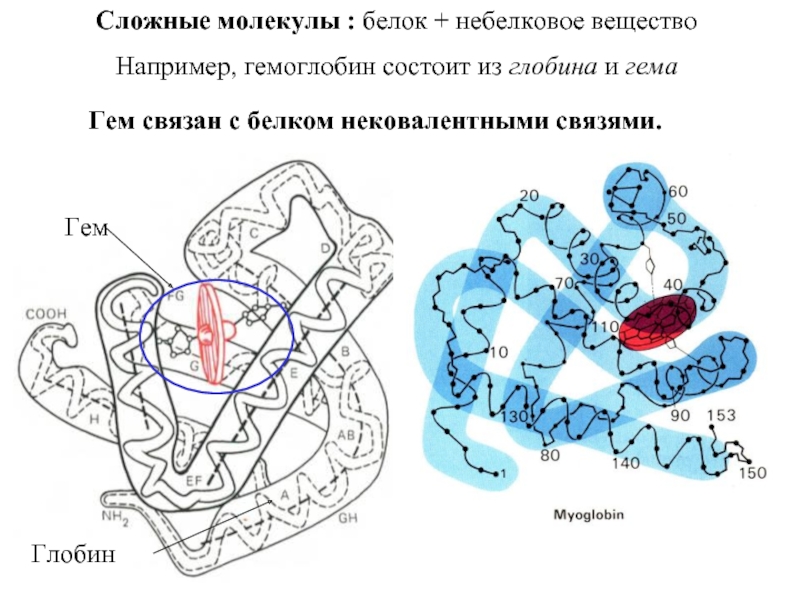
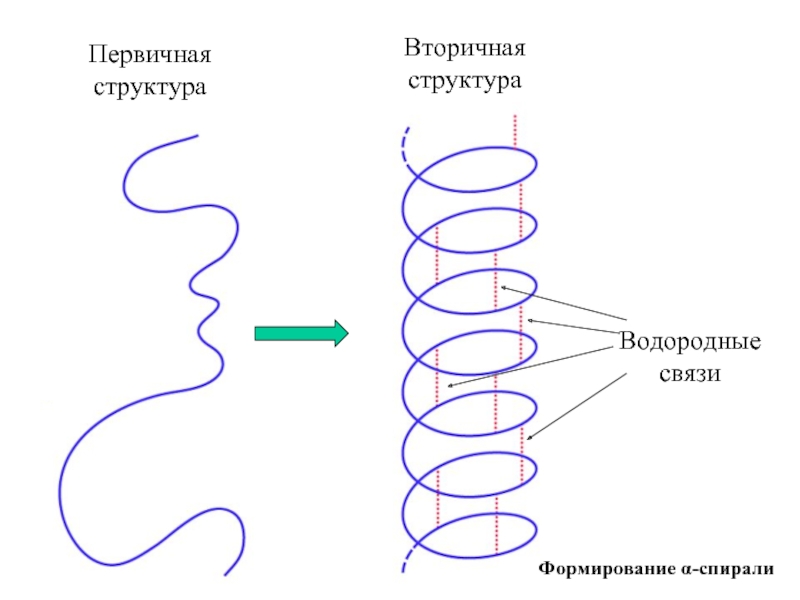
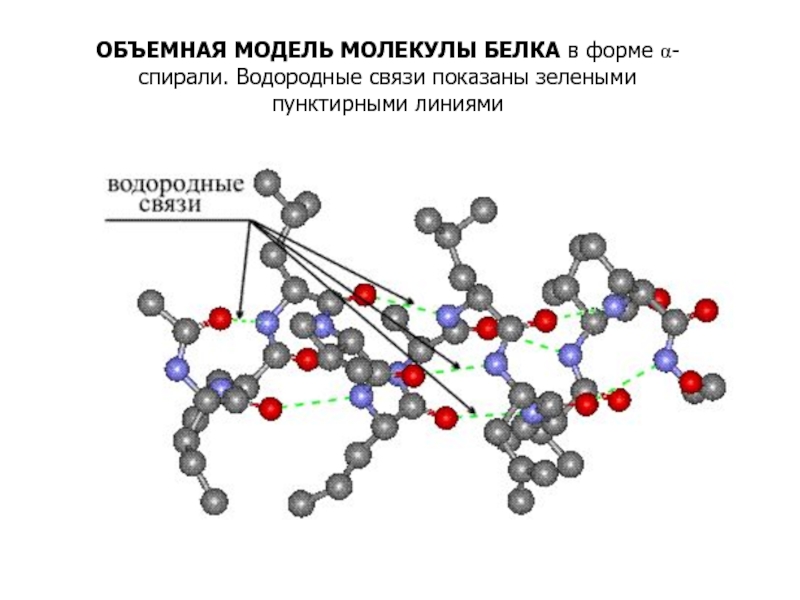
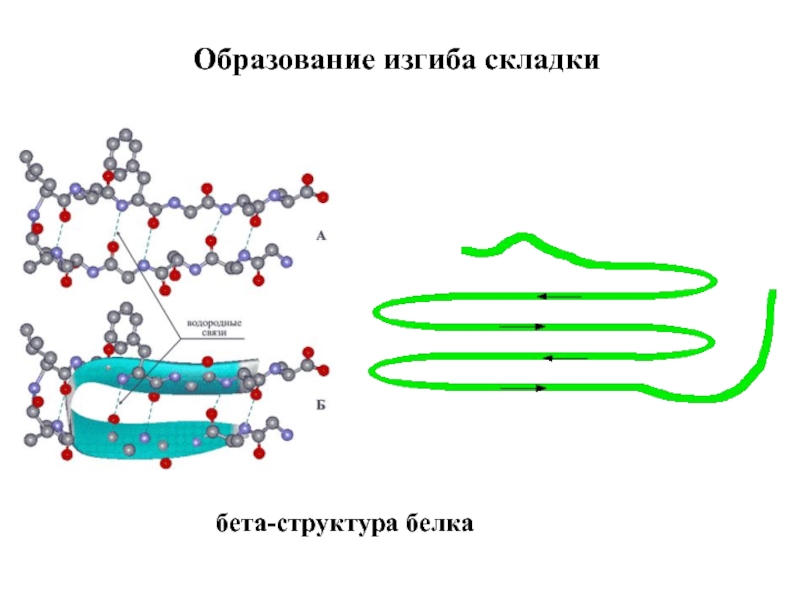
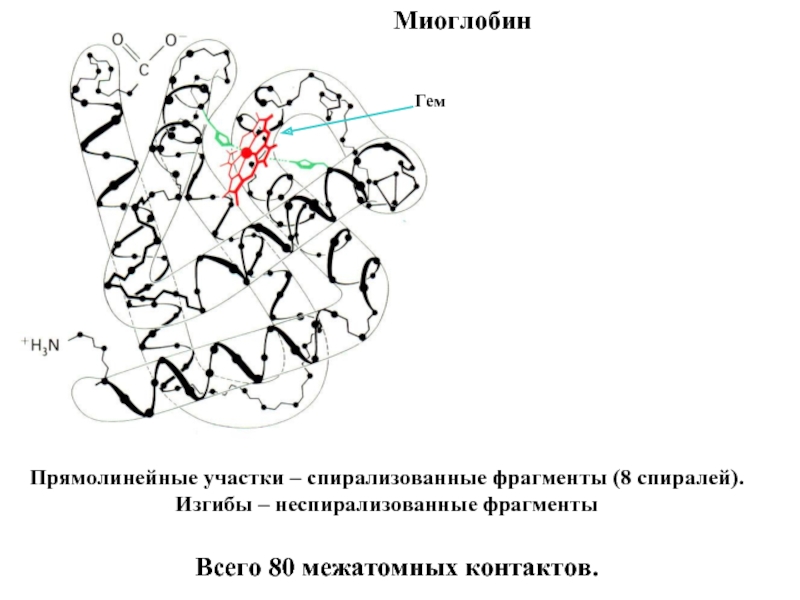
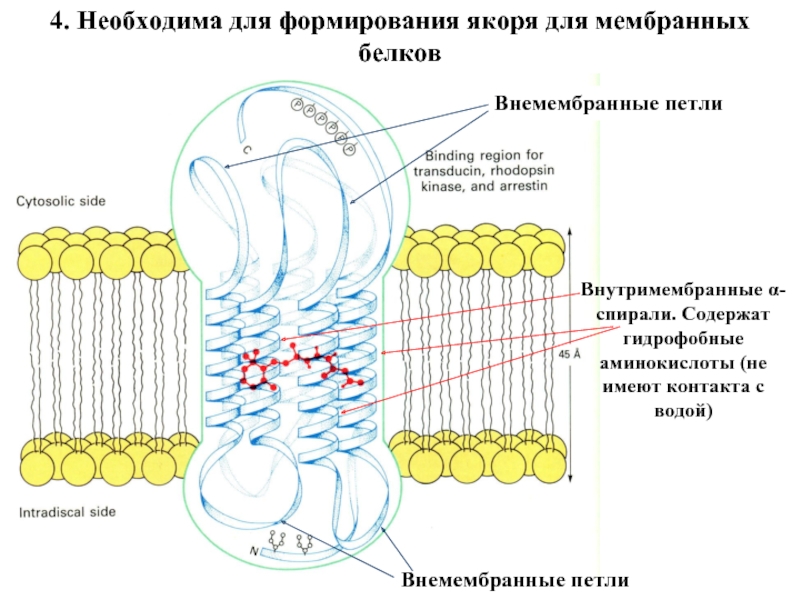
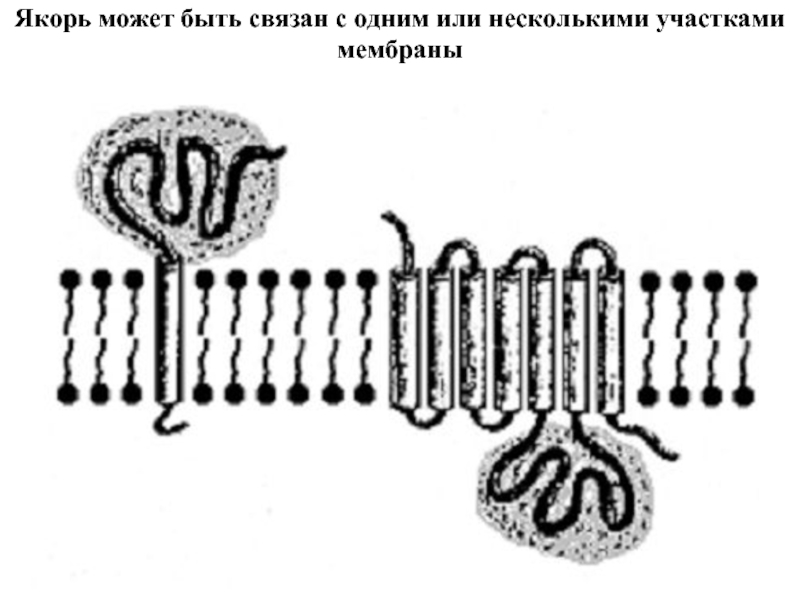
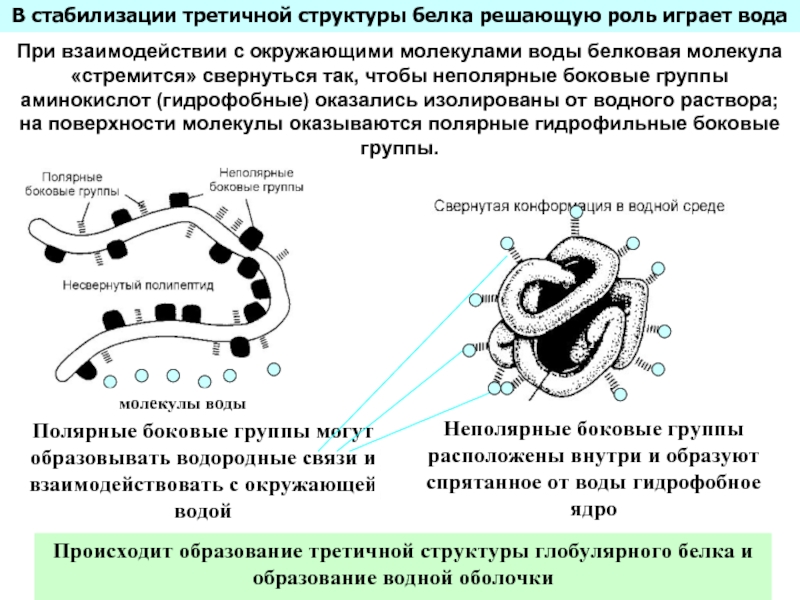
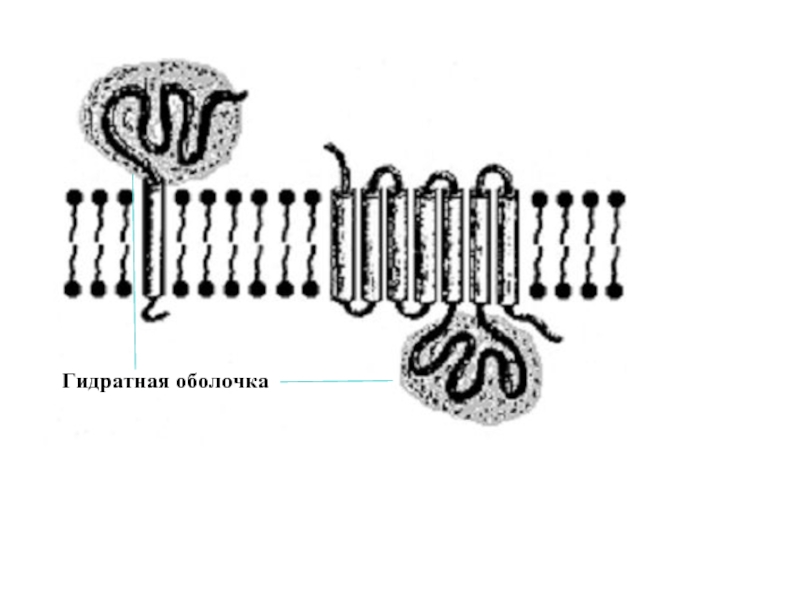
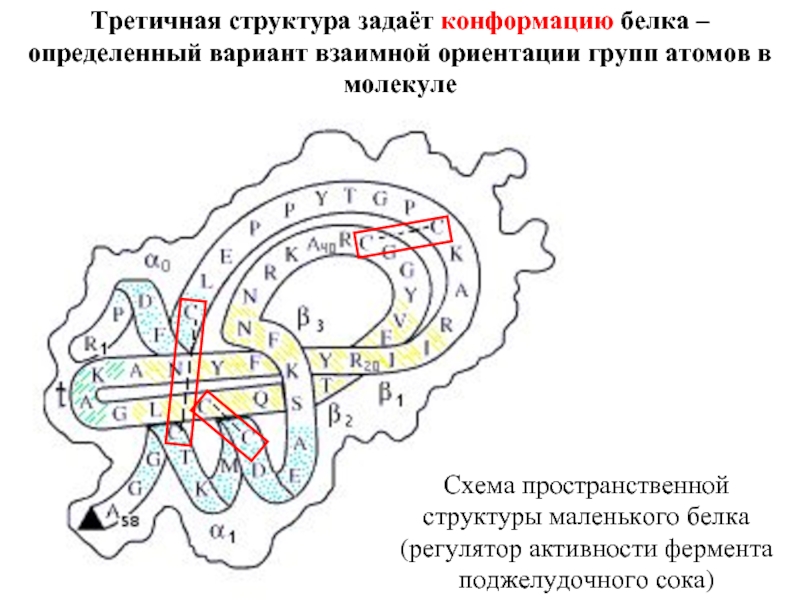
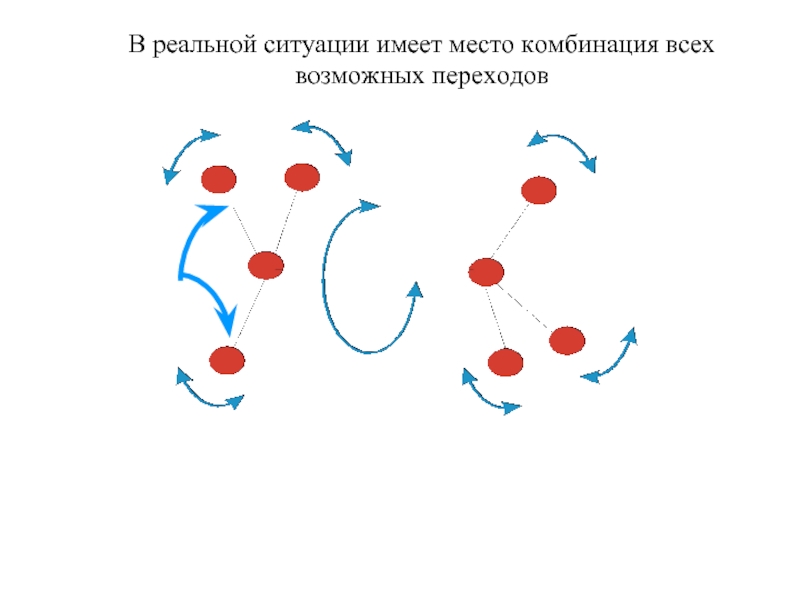
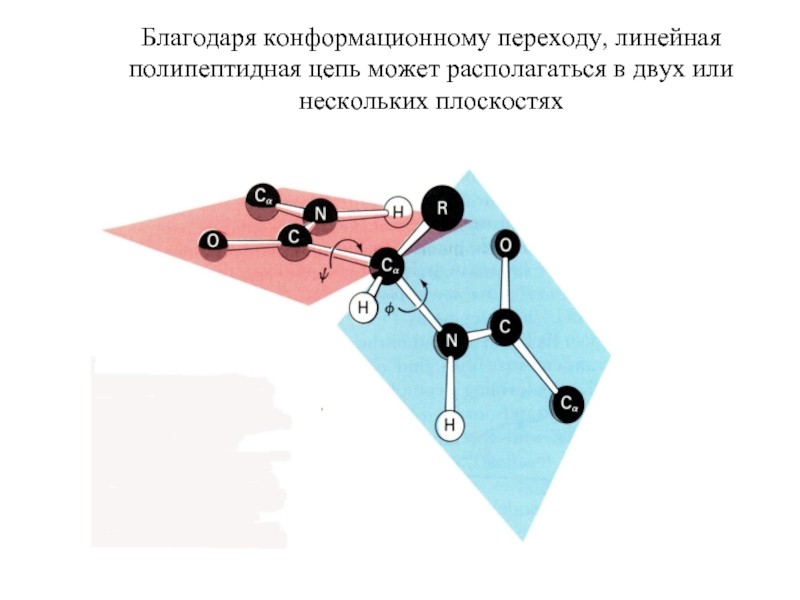
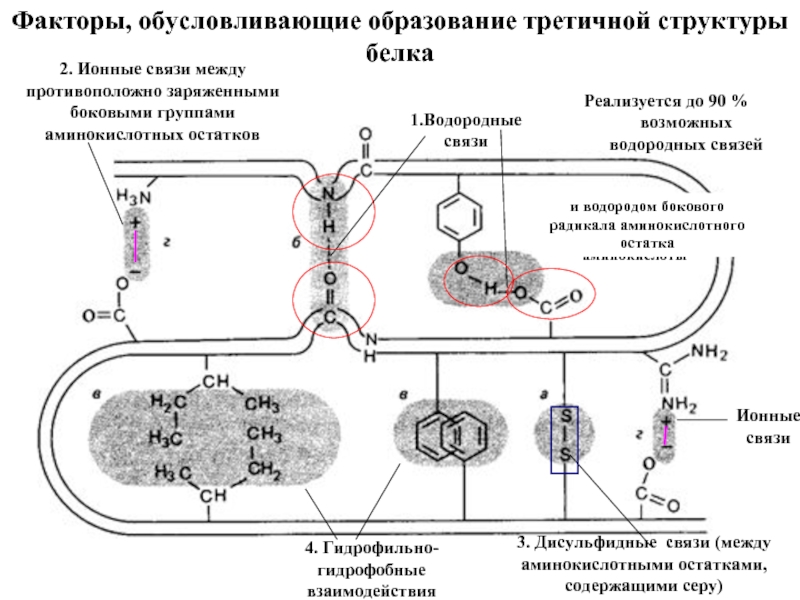
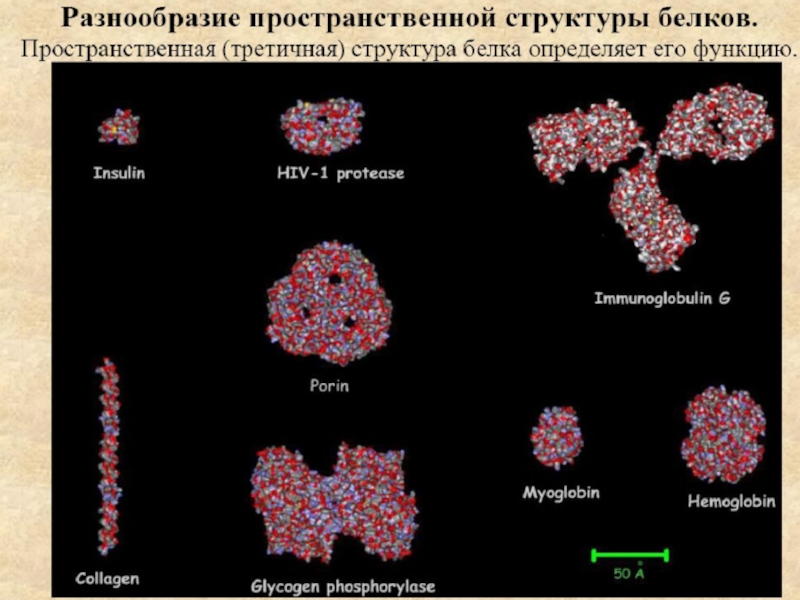
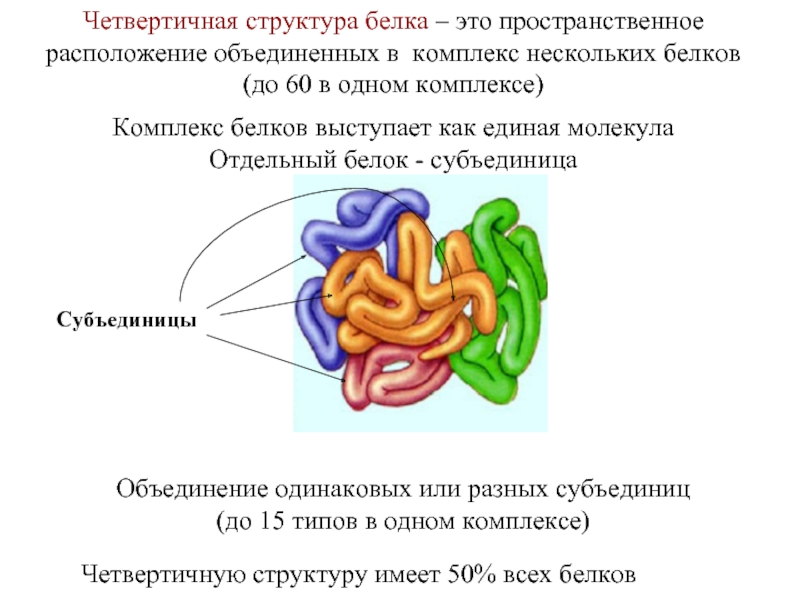
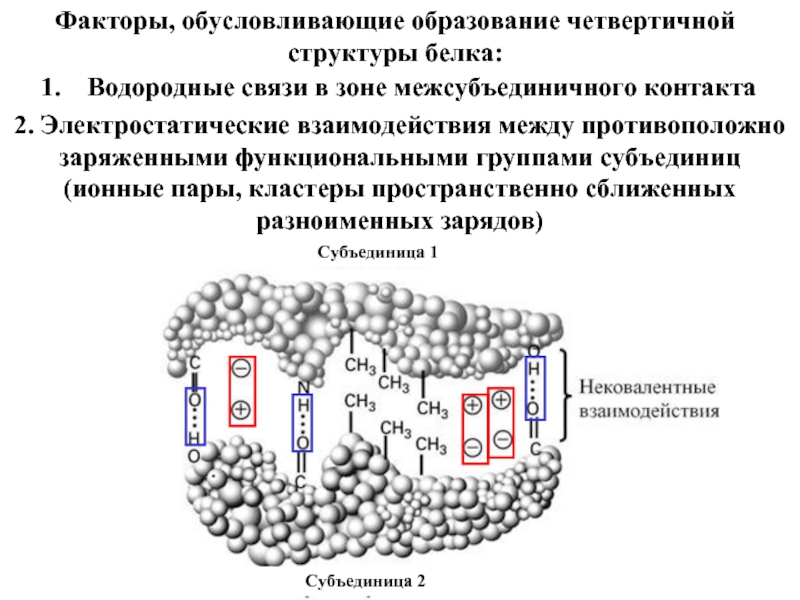
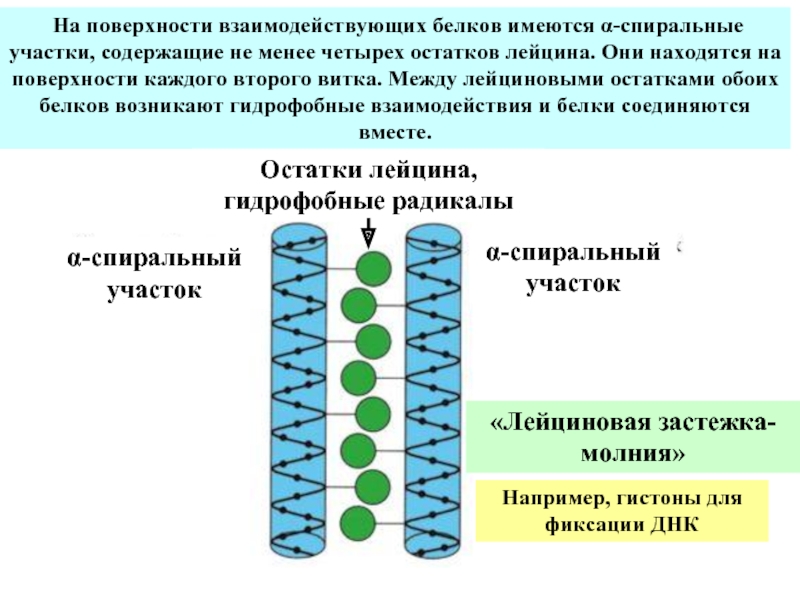
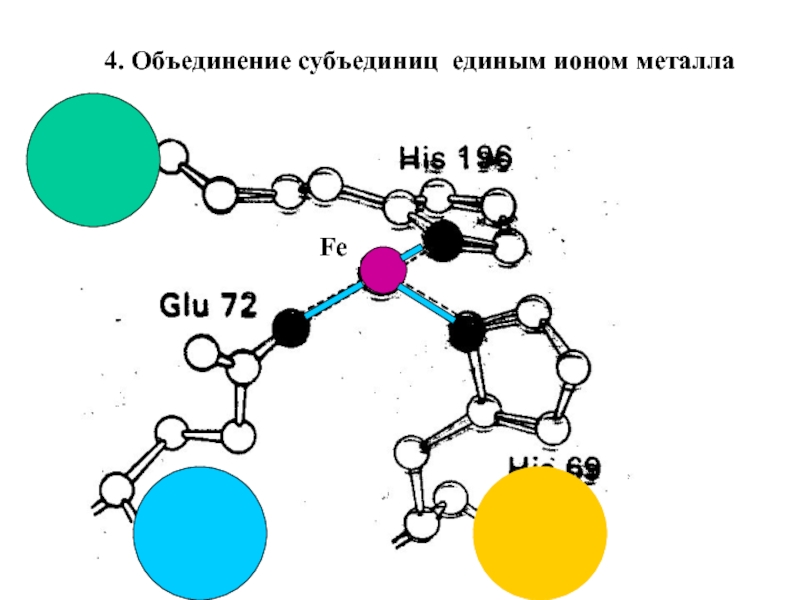
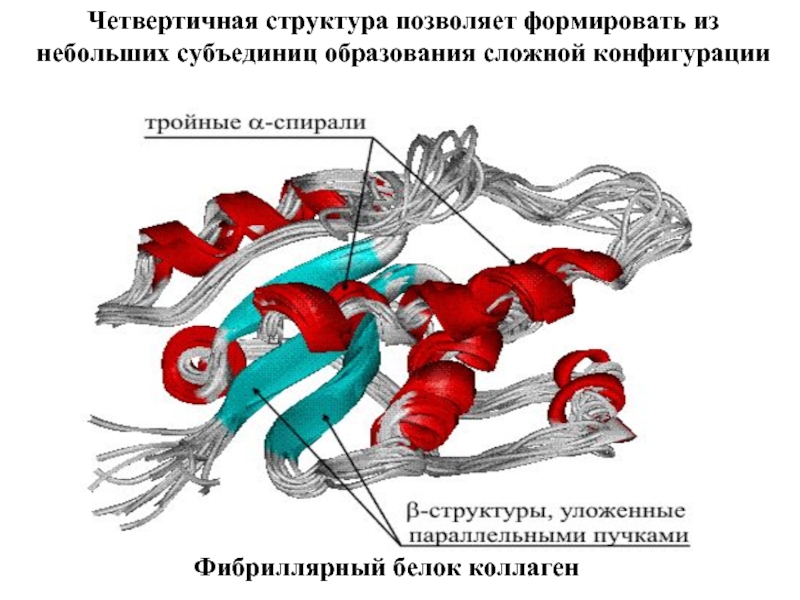
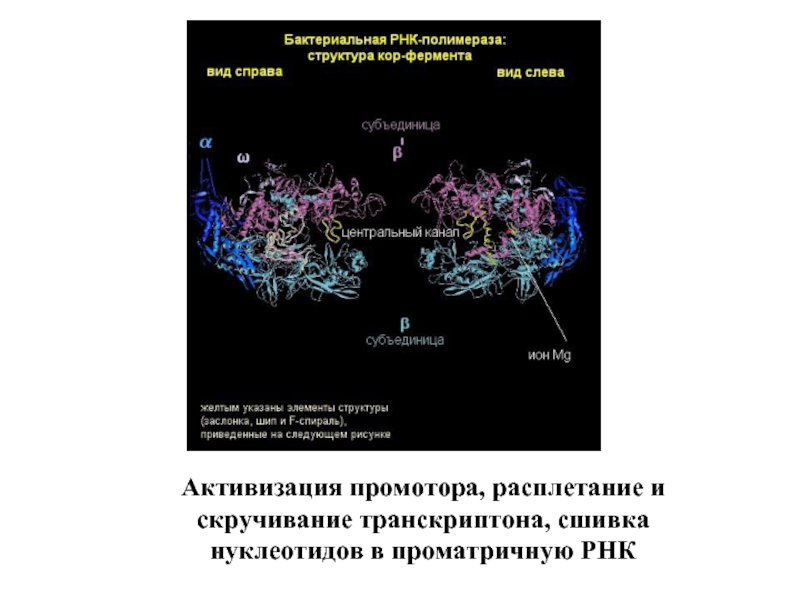
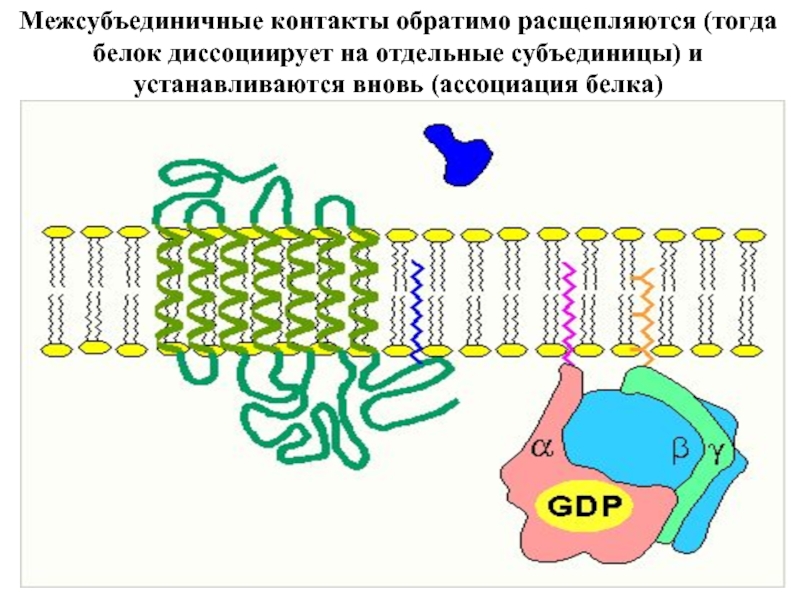
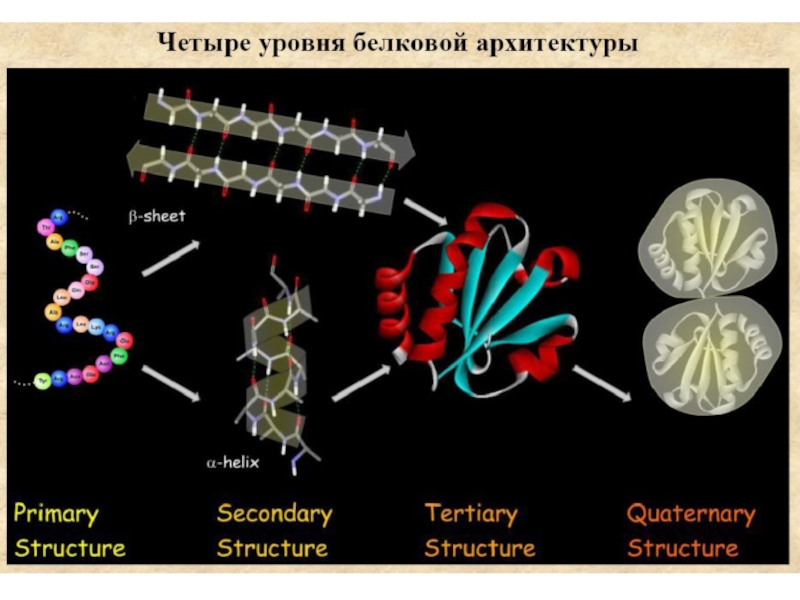
Входят в состав соединительных тканей и обеспечивают "архитектурный остов" всех органов, сосудов и организма в целом.
Входят в состав скелета (кости, хрящи, связки).
2. Сократительные белки. Обеспечивают сокращение мышц сосудов и внутренних органов (гладкая мускулатура), сердца и скелетных мышц (поперечно-полосатая мускулатура).
3. Энергетические белки. Состоят из аминокислот, которые "сгорают" с выделением энергии и которые могут быть синтезированы в клетке из продуктов расщепления углеводов и липидов. Запасной источник энергии.
Типы белков